目錄
第一部分財務信息
第 1 項。財務報表和補充數據

ESSA 製藥公司
簡明合併中期財務報表
(未經審計)
(以美元表示)
截至2023年12月31日的三個月
8
目錄
美國
證券交易委員會
華盛頓特區 20549
表單
(Mark One)
在截至的季度期間
要麼
在過渡期內到
委員會文件編號:
(註冊人的確切姓名如其章程所示)
(州或其他司法管轄區 | (美國國税局僱主 |
公司或組織) | 識別碼) |
(主要行政辦公室地址,包括郵政編碼) | |
註冊人的電話號碼,包括區號:( | |
根據該法第12(b)條註冊的證券: | |
每個班級的標題 | 交易品種 | 註冊的每個交易所的名稱 | ||
用勾號指明註冊人是否:(1)在過去的12個月中(或在要求註冊人提交此類報告的較短時間內)提交了1934年《證券交易法》第13條或第15(d)條要求提交的所有報告,以及(2)在過去的90天內是否受到此類申報要求的約束。
用複選標記表明註冊人是否在過去 12 個月內(或者在要求註冊人提交此類文件的較短時間內)以電子方式提交了根據第 S-T 法規(本章第 232.405 節)第 405 條要求提交的所有交互式數據文件。
用複選標記指明註冊人是大型加速申報人、加速申報人、非加速申報人、小型申報公司還是新興成長型公司。參見《交易法》第12b-2條中 “大型加速申報人”、“加速申報公司”、“小型申報公司” 和 “新興成長型公司” 的定義。
大型加速過濾器 | ☐ | 加速過濾器 | ☐ | |
☒ | 規模較小的申報公司 | |||
新興成長型公司 |
如果是新興成長型公司,請用複選標記表明註冊人是否選擇不使用延長的過渡期來遵守根據《交易法》第13(a)條規定的任何新的或修訂後的財務會計準則。 ☐
用複選標記表明註冊人是否為空殼公司(定義見1934年《證券交易法》第12b-2條)。是的
截至2024年2月12日,註冊人的已發行普通股數量(無每股面值)為
目錄
ESSA 製藥公司
10-Q 表季度報告
截至2023年12月31日的季度
目錄
第一部分財務信息 | 8 | |
第 1 項。 | 財務報表和補充數據 | 8 |
截至2023年12月31日和2022年9月30日的簡明合併中期資產負債表3 | 9 | |
截至2023年12月31日和2022年12月31日止三個月的簡明合併中期運營報表和綜合虧損報表 | 10 | |
截至2023年12月31日和2022年12月31日的三個月的簡明合併中期現金流量表 | 11 | |
截至2023年12月31日及2022年12月31日止三個月的簡明合併中期股東權益變動表 | 12 | |
簡明合併中期財務報表附註 | 13 | |
第 2 項。 | 管理層對財務狀況和經營結果的討論與分析s | 22 |
第 3 項。 | 關於市場風險的定量和定性披露 | 47 |
第 4 項。 | 控制和程序 | 47 |
第二部分。其他信息 | 48 | |
第 1 項。 | 法律訴訟 | 48 |
第 1A 項。 | 風險因素 | 48 |
第 2 項。 | 未註冊的股權證券銷售和所得款項的使用 | 48 |
第 3 項。 | 優先證券違約 | 48 |
第 4 項。 | 礦山安全披露 | 48 |
第 5 項。 | 其他信息 | 48 |
第 6 項。 | 附件、財務報表附表 | 49 |
簽名 | 50 |
2
目錄
關於前瞻性陳述的警示説明
本10-Q表季度報告包括1995年《美國私人證券訴訟改革法》所指的 “前瞻性陳述” 和加拿大證券法所指的 “前瞻性信息”,或統稱為前瞻性陳述。前瞻性陳述包括可能與我們的計劃、目標、目標、戰略、未來事件、未來收入或業績、資本支出、融資需求以及其他非歷史信息的信息相關的陳述。其中許多陳述特別出現在 “業務”、“風險因素” 和 “管理層對財務狀況和經營業績的討論和分析” 的標題下。前瞻性陳述通常使用諸如 “服從”、“相信”、“預測”、“計劃”、“預期”、“打算”、“估計”、“項目”、“可能”、“可能”、“將”、“應該”、“可以”、“希望”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“可以”、“此類前瞻性陳述涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致公司的實際業績、業績或成就與此類前瞻性陳述可能明示或暗示的任何未來業績、業績或成就存在重大差異。此類前瞻性陳述的示例包括但不限於與以下內容相關的陳述:
| ● | 我們有能力通過臨牀試驗推進我們的候選產品和潛在的未來候選產品,併成功完成臨牀試驗; |
| ● | 我們為未來的臨牀試驗招募足夠數量的患者的能力以及由此帶來的預期收益; |
| ● | 我們與具有可接受的開發、監管和商業化專業知識的合作者建立和維持關係的能力,以及此類合作努力將帶來的好處; |
| ● | 我們獲得運營資金(包括研究資金)的能力以及此類資金的時間和潛在來源; |
| ● | 與我們的研發計劃(包括與下一代候選藥物和化合物有關的研究計劃和相關里程碑)、臨牀前研究和臨牀試驗的啟動、時間、成本、地點、進展和成功與否; |
| ● | 我們的候選產品和潛在的未來候選產品(如果有)的治療益處、特性、有效性、藥代動力學特徵和安全性,包括我們的下一代Aniten化合物的預期益處、特性、有效性、藥代動力學特徵和安全性; |
| ● | 我們在不侵犯他人知識產權的情況下保護我們的知識產權和經營業務的能力; |
| ● | 與我們的競爭對手和我們的行業相關的發展,包括已經或可能上市的競爭療法的成功; |
| ● | 我們實現盈利的能力; |
| ● | 德克薩斯州癌症預防與研究所(“CPRIT”)下的補助金(“CPRIT Grant”)及其下的付款,包括任何剩餘債務; |
| ● | 根據公司與傑富瑞集團之間的公開市場銷售協議(“自動櫃員機銷售協議”),出售我們的普通股,無面值(“普通股”),該協議自2023年11月3日起生效; |
| ● | 我們對過去和未來證券發行所得收益的預期用途; |
| ● | 我們的商業模式和戰略計劃的實施,包括與專利申請以及戰略合作和夥伴關係有關的戰略計劃; |
| ● | 我們識別、開發和商業化候選產品的能力; |
| ● | 我們的商業化、營銷和製造能力和戰略; |
| ● | 我們對聯邦、州、省和外國監管要求的期望,包括我們對預期監管申報的計劃; |
| ● | 我們是否會在美國、加拿大和其他司法管轄區獲得監管部門批准,以及獲得監管批准的時間和成本; |
| ● | 我們對我們的候選產品和潛在的未來候選產品(如果有)可能涉及的市場規模和特徵的估計的準確性; |
3
目錄
| ● | 由於全球宏觀經濟因素,包括通貨膨脹、供應鏈問題以及與廣泛健康問題、流行病或流行病以及其他疾病疫情相關的任何當前或未來影響,我們維持運營、開發計劃、臨牀前研究、臨牀試驗和籌集資金的能力; |
| ● | 我們潛在的未來候選產品的市場接受程度和臨牀效用(如果有); |
| ● | 為我們的候選產品和潛在的未來候選產品(如果有)獲得和維持監管部門批准的時機,以及我們的能力和合作者的能力(如果有); |
| ● | 我們對市場風險的預期,包括通貨膨脹、利率變動和外幣波動; |
| ● | 我們聘用和留住發展業務所需的員工的能力; |
| ● | 預計向我們的員工支付的薪酬; |
| ● | 我們未來的財務業績和預計支出;以及 |
| ● | 對我們的財務狀況、支出、未來收入、資本需求以及我們對額外融資和潛在資本和資金來源的需求的估計。 |
此類陳述反映了我們目前對未來事件的看法,受風險和不確定性的影響,必然基於許多估計和假設,這些估計和假設本質上受重大的醫學、科學、商業、經濟、競爭、政治和社會不確定性和突發事件的影響。許多因素可能導致我們的實際業績、業績或成就與此類前瞻性陳述可能表達或暗示的任何未來業績、業績或成就存在重大差異,包括我們在10-K表年度報告中在 “風險因素” 下描述的那些業績、業績或成就。本10-Q季度報告中包含的所有前瞻性陳述均基於我們當前的預期和各種假設。在準備前瞻性陳述時做出的某些假設包括但不限於:
| ● | 我們進行涉及我們的候選產品的臨牀研究和確定任何未來候選產品的能力; |
| ● | 我們獲得監管和其他批准以啟動涉及任何未來候選產品的臨牀試驗的能力; |
| ● | 我們從研發活動(包括臨牀試驗)中獲得積極成果的能力; |
| ● | 以合理條件提供充足的融資; |
| ● | 我們獲得所需監管批准的能力; |
| ● | 我們保護專利和專有權利的能力; |
| ● | 我們成功向外許可或銷售未來產品(如果有)以及獲得許可和開發新產品的能力; |
| ● | 我們的行業或全球經濟沒有重大不利變化; |
| ● | 我們吸引和留住關鍵人員的能力; |
| ● | 我們繼續遵守第三方許可條款,不侵犯第三方知識產權; |
| ● | 我們與戰略合作伙伴保持良好業務關係的能力;以及 |
| ● | 我們理解和預測市場競爭的能力。 |
我們認為,我們當前的預期、觀點和假設有合理的依據,但它們本質上是不確定的。我們可能無法實現我們的期望,我們的觀點和假設可能不正確。實際結果可能與此類前瞻性陳述所描述或暗示的結果存在重大差異。在評估前瞻性陳述時,投資者應特別考慮以下不確定性和因素,其中包括 “” 標題下列出的不確定性和因素風險因素” 在我們的年度報告(表10-K)中,這可能會影響未來的業績,並導致實際業績與前瞻性陳述中表達或暗示的事項存在重大差異
風險因素摘要
以下是使我們的普通股投資具有投機性或風險性的重要因素摘要。重要的是,本摘要並未涉及我們面臨的所有風險和不確定性。關於本風險因素摘要中總結的風險和不確定性以及我們面臨的其他風險和不確定性的更多討論,可在 “關於前瞻性陳述的警示説明” 和第一部分第1A項下找到。我們的10-K表年度報告中的 “風險因素”。以下摘要完全由對此類風險和不確定性的更全面的討論所限定。您應仔細考慮第一部分第 1A 項中描述的風險和不確定性。“風險因素”
4
目錄
在我們的10-K表年度報告中,這是您評估我們普通股投資的一部分。除其他外,可能導致這種差異的重要因素包括:
| ● | 與臨牀試驗開發、我們對候選產品進行臨牀試驗的能力以及我們當前或計劃中的臨牀試驗的預測價值相關的風險; |
| ● | 與我們未來成功相關的風險主要取決於通過臨牀前研究、臨牀研究、監管部門批准單一候選產品的商業化來進行識別; |
| ● | 與我們與第三方簽訂的許可協議相關的風險; |
| ● | 與我們為擬議產品獲得所需監管批准的能力相關的不確定性; |
| ● | 與公司進行臨牀試驗或提交未來的NDA/NDS或IND/CTA(均定義見此處)的能力相關的風險; |
| ● | 與我們成功將未來候選產品商業化的能力相關的風險; |
| ● | 與我們的候選產品和潛在的未來候選產品(如果有)在單獨使用或與其他藥物聯合使用時可能產生不良副作用相關的風險; |
| ● | 與我們招募受試者參與臨牀試驗的能力相關的風險; |
| ● | 美國食品和藥物管理局可能不接受在美國以外地點進行的試驗數據的風險; |
| ● | 與我們的持續義務和持續的監管審查相關的風險; |
| ● | 與潛在的行政或司法制裁相關的風險; |
| ● | 與延期、延遲或終止臨牀試驗相關的成本增加的風險; |
| ● | 與第三方根據合作和臨牀供應協議進行的臨牀試驗相關的風險,包括組合研究、使用公司的候選產品、公司可能無法控制的研究,以及隨之而來的與臨牀試驗結果相關的聲譽風險; |
| ● | 第三方可能無法履行其合同義務或終止關係的風險; |
| ● | 與我們缺乏大規模臨牀或商業規模生產候選產品的經驗以及缺乏製造設施相關的風險; |
| ● | 國外業務固有的風險,包括與國外採購的原材料、製造或臨牀試驗相關的風險; |
| ● | 與公司生產和運輸原材料和臨牀試驗材料所依賴的國內外供應鏈中斷相關的風險; |
| ● | 與我們未能在國際司法管轄區獲得監管批准相關的風險; |
| ● | 與美國和國際上最近頒佈的和未來的立法相關的風險,這些風險可能會增加我們獲得候選產品和潛在未來產品(如果有)的上市批准和商業化的難度和成本,並影響我們可能獲得的價格; |
| ● | 與新立法、新監管要求以及政府和第三方付款人為控制或降低醫療成本所做的持續努力相關的風險; |
| ● | 我們籌集額外資金的能力的不確定性; |
| ● | 與我們以優惠條件籌集額外資本的能力以及增量融資稀釋的影響相關的風險; |
| ● | 如果CPRIT未免除CPRIT補助金協議中規定的任何剩餘義務,則該協議中的任何剩餘義務被視為違約,並且必須償還所有CPRIT補助金的風險; |
| ● | 與我們自成立以來每個季度都遭受重大損失以及我們對未來將繼續蒙受重大損失的預期相關的風險; |
| ● | 與我們有限的運營歷史相關的風險; |
| ● | 與我們依賴專有技術相關的風險; |
| ● | 與我們在全球範圍內保護知識產權的能力相關的風險; |
| ● | 與第三方聲稱我們或我們的員工、承包商或顧問盜用了他們的知識產權或聲稱擁有我們認為的知識產權的所有權的索賠相關的風險; |
| ● | 與我們為維持專利保護而遵守政府專利機構要求的能力相關的風險; |
| ● | 與計算機系統故障或安全漏洞以及日益增加的網絡威脅相關的風險; |
| ● | 與業務中斷相關的風險,這些風險可能會嚴重損害我們未來的收入和財務狀況並增加我們的成本和支出; |
5
目錄
| ● | 與我們吸引和留住高素質人員的能力相關的風險; |
| ● | 與第三方承保和報銷以及醫療保健成本控制計劃和治療指南可能限制我們未來收入相關的風險; |
| ● | 與我們與我們的董事和高級管理人員之間的潛在利益衝突相關的風險; |
| ● | 與來自其他生物技術和製藥公司的競爭相關的風險; |
| ● | 與外幣匯率、利率和通貨膨脹率變動有關的風險; |
| ● | 與我們説服公共支付者和醫院將我們的候選產品和潛在的未來產品(如果有)列入其批准的處方清單的能力相關的風險; |
| ● | 與我們建立有效的銷售隊伍和營銷基礎設施,或簽訂可接受的第三方銷售和營銷或許可安排的能力相關的風險; |
| ● | 與我們管理增長的能力相關的風險; |
| ● | 與我們實現或維持產品預期市場接受水平的能力相關的風險; |
| ● | 與我們從收購的業務或產品中獲益或在未來建立戰略聯盟的能力相關的風險; |
| ● | 與第三方合作相關的風險; |
| ● | 員工可能從事不當行為或其他不當行為的風險,包括不遵守監管標準和要求,這可能會給我們帶來重大責任並損害我們的聲譽; |
| ● | 與產品責任訴訟相關的風險; |
| ● | 與強制許可和/或仿製藥競爭相關的風險; |
| ● | 與上市公司運營的成本和管理時間相關的風險; |
| ● | 與規模較小的申報公司相關的風險; |
| ● | 與管理國際業務的法律法規可能使我們無法在美國和加拿大以外開發、製造和銷售某些候選產品並要求我們制定和實施昂貴的合規計劃相關的風險; |
| ● | 與管理欺詐和濫用行為的法律以及患者權利相關的風險; |
| ● | 與我們遵守環境、健康和安全法律法規的能力相關的風險; |
| ● | 與我們成為一個人相關的風險 “被動外國投資公司”; |
| ● | 與美國投資者向我們提供訴訟或執行訴訟的能力相關的風險; |
| ● | 與市場價格和交易量波動相關的風險; |
| ● | 與我們的股息政策相關的風險; |
| ● | 與未來出售我們的證券相關的風險; |
| ● | 與我們維持公司普通股活躍交易市場的能力相關的風險; |
| ● | 與廣泛的健康問題、流行病或流行病和其他疾病爆發相關的風險; |
| ● | 與我們實施和維持有效內部控制的能力相關的風險; |
| ● | 與我們的章程文件和加拿大法律中影響公司治理的條款相關的風險;以及 |
| ● | 與分析師保險相關的風險。 |
如果這些風險或不確定性中的一項或多項或一項我們目前尚不瞭解的風險得以實現,或者如果我們的基本假設被證明不正確,則實際結果可能與前瞻性陳述所表達或暗示的結果存在重大差異。前瞻性陳述代表我們截至本文件發佈之日的預期、計劃、估計和觀點。除非法律要求,否則我們不承諾並明確拒絕承擔任何更新、重新發布或修改前瞻性陳述以反映未來事件或情況或反映意外事件發生的義務。提醒投資者,我們無法保證未來的業績、事件、活動水平、業績或成就,而且前瞻性陳述本質上是不確定的。因此,提醒投資者不要過分依賴前瞻性陳述。我們建議您,這些警示性言論在其完全歸因於我們或代表我們行事的人的所有前瞻性陳述中均明確符合這些警示性言論。
6
目錄
除非另有説明,否則本10-Q表季度報告中的所有金額均以美元表示。提及的 “$” 和 “美元” 是指美元,“C$” 是指加元。除非另有説明,否則本10-Q表季度報告中提及的 “ESSA”、“公司”、“我們” 和 “我們的” 是指ESSA Pharma Inc.及其子公司。
7
目錄
第一部分財務信息
第 1 項。財務報表和補充數據

ESSA 製藥公司
簡明合併中期財務報表
(未經審計)
(以美元表示)
截至2023年12月31日的三個月
8
目錄
ESSA 製藥公司
簡明合併中期資產負債表
(未經審計)
(以美元表示)
截至
十二月三十一日 | 9月30日 | |||||
| 2023 |
| 2023 | |||
資產 |
|
|
|
| ||
當前 |
|
|
|
| ||
現金和現金等價物 | $ | |
| $ | | |
短期投資(注4) | | | ||||
應收款 |
| |
| | ||
預付款(註釋5) |
| |
| | ||
| |
| | |||
存款 | |
| | |||
經營租賃使用權資產(注7) |
| |
| | ||
總資產 | $ | |
| $ | | |
負債和股東權益 |
|
|
|
| ||
當前 |
|
|
|
| ||
應付賬款和應計負債(附註6) | $ | |
| $ | | |
經營租賃負債的流動部分(附註7) |
| |
| | ||
| |
| | |||
經營租賃負債(附註7) |
| |
| | ||
負債總額 |
| |
| | ||
股東權益 |
|
|
|
| ||
已授權 |
|
|
|
| ||
無限量普通股,無面值 |
|
|
|
| ||
無限量優先股,無面值 | ||||||
普通股 |
| |
| | ||
額外實收資本(注8) |
| |
| | ||
累計其他綜合虧損 |
| ( |
| ( | ||
累計赤字 |
| ( |
| ( | ||
| |
| | |||
負債和股東權益總額 | $ | |
| $ | | |
業務性質(注1)
所附附附註是這些簡明合併中期財務報表不可分割的一部分。
9
目錄
ESSA 製藥公司
簡明合併中期運營報表和綜合虧損
(未經審計)
(以美元表示)
在截至12月31日的三個月中
在截至的三個月中 | ||||||
十二月三十一日 | ||||||
| 2023 |
| 2022 | |||
運營費用 |
|
|
|
| ||
研究和開發 | $ | |
| $ | | |
融資成本 |
| — |
| | ||
總務和行政 |
| |
| | ||
運營費用總額 |
| ( |
| ( | ||
外匯 |
| ( |
| | ||
投資和其他收入 |
| |
| | ||
該期間的淨虧損 | ( | ( | ||||
其他綜合收入 | ||||||
短期投資的未實現收益(注4) |
| |
| | ||
該期間的虧損和綜合虧損 | $ | ( |
| $ | ( | |
普通股每股基本虧損和攤薄後虧損 | $ | ( |
| $ | ( | |
已發行普通股的加權平均數 |
| |
| | ||
所附附附註是這些簡明合併中期財務報表不可分割的一部分。
10
目錄
ESSA 製藥公司
簡明的合併中期現金流量報表
(未經審計)
(以美元表示)
在截至12月31日的三個月中
| 2023 |
| 2022 | |||
來自經營活動的現金流 |
|
|
|
| ||
該期間的淨虧損 | $ | ( |
| $ | ( | |
不影響現金和現金等價物的物品: |
|
|
|
| ||
使用權資產的攤銷 |
| |
| | ||
短期投資保費/折扣的增加,淨額 | ( |
| ( | |||
租賃負債的增加 |
| |
| | ||
應計投資收益 | ( | ( | ||||
未實現的外匯 |
| ( |
| ( | ||
短期投資的未實現虧損 | ||||||
基於股份的支付 |
| |
| | ||
非現金營運資金項目的變化: |
|
|
|
| ||
應收款 |
| ( |
| ( | ||
預付款 |
| ( |
| | ||
應付賬款和應計負債 |
| |
| | ||
經營租賃負債 | ( | | ||||
用於經營活動的淨現金 |
| ( |
| ( | ||
來自投資活動的現金流 |
|
|
|
| ||
購買短期投資 | ( | ( | ||||
出售短期投資的收益 | | | ||||
由(用於)投資活動提供的淨現金 |
| |
| ( | ||
來自融資活動的現金流量 |
|
|
|
| ||
行使的期權 | | | ||||
通過員工股票購買計劃購買的股票 | | | ||||
租賃付款 |
| |
| ( | ||
融資活動提供的淨現金 |
| |
| | ||
外匯對現金和現金等價物的影響 |
| |
| ( | ||
該期間現金及現金等價物的變動 |
| |
| ( | ||
現金及現金等價物,期初 |
| |
| | ||
現金及現金等價物,期末 | $ | |
| $ | | |
非現金投資和財務項目的補充披露: | ||||||
為換取經營租賃負債而獲得的租賃資產 | $ | | $ | | ||
所附附附註是這些簡明合併中期財務報表不可分割的一部分。
11
目錄
ESSA 製藥公司
簡明合併中期股東權益變動表
(未經審計)
(以美元表示)
截至2023年12月31日和2022年12月31日的三個月
累積的 | |||||||||||||||||
額外 | 其他 | ||||||||||||||||
數字 | 常見 | 付費 | 綜合的 |
| |||||||||||||
| 的股份 |
| 股份 |
| 首都 |
| 損失 |
| 赤字 |
| 總計 | ||||||
餘額,2022 年 9 月 30 日 |
| | $ | | $ | | $ | ( | $ | ( |
| $ | | ||||
通過員工股票購買計劃發行的股票 | | | ( | — | — |
| | ||||||||||
基於股份的支付 |
| — | — | | — | — |
| | |||||||||
該期間的虧損和綜合虧損 |
| — | — | — | | ( |
| ( | |||||||||
餘額,2022 年 12 月 31 日 |
| | $ | | $ | | $ | ( | $ | ( |
| $ | | ||||
累積的 | |||||||||||||||||
額外 | 其他 | ||||||||||||||||
數字 | 常見 | 付費 | 綜合的 |
| |||||||||||||
的股份 |
| 股份 |
| 首都 |
| 損失 |
| 赤字 |
| 總計 | |||||||
餘額,2023 年 9 月 30 日 |
| | $ | | $ | | $ | ( | $ | ( |
| $ | | ||||
行使的期權 | | | ( | — | — |
| | ||||||||||
通過員工股票購買計劃發行的股票 | | | ( | — | — |
| | ||||||||||
基於股份的支付 |
| — | — | | — | — |
| | |||||||||
該期間的虧損和綜合虧損 |
| — | — | — | | ( |
| ( | |||||||||
餘額,2023 年 12 月 31 日 |
| | $ | | $ | | $ | ( | $ | ( |
| $ | | ||||
所附附附註是這些簡明合併中期財務報表不可分割的一部分。
12
目錄
ESSA 製藥公司
簡明合併中期財務報表附註
(未經審計)
(以美元表示)
截至2023年12月31日的三個月
1。操作的性質
操作性質
該公司於2009年1月6日根據不列顛哥倫比亞省法律註冊成立。該公司的總部地址是不列顛哥倫比亞省温哥華市西百老匯720 — 999號套房,V5Z 1K5。註冊和記錄辦公地址是位於不列顛哥倫比亞省温哥華梅爾維爾街1133號The Stack的3500套房,V6E 4E5。該公司在納斯達克資本市場(“納斯達克”)上市,股票代碼為 “EPIX”。
這個 公司專注於開發用於治療前列腺癌的小分子藥物。該公司已獲得某些專利(“NTD”)的許可,這些專利是不列顛哥倫比亞省癌症管理局和不列顛哥倫比亞大學的共同財產。截至2023年12月31日,沒有任何產品處於商業生產或使用狀態。
2。演示基礎
演示基礎
隨附的未經審計的簡明合併中期財務報表,包括比較報表,是根據美國公認會計原則(“U.S. GAAP”)和美國證券交易委員會(“SEC”)的中期財務信息規則和條例編制的。因此,這些簡明合併中期財務報表不包括完整合並財務報表所需的所有信息和腳註,應與截至2023年9月30日止年度的經審計的合併財務報表和附註一起閲讀,幷包含在公司於2023年12月12日向美國證券交易委員會以及不列顛哥倫比亞省、艾伯塔省和安大略省證券委員會提交的2023年10-K表年度報告中。
這些未經審計的簡明合併中期財務報表反映了所有調整,包括正常的經常性調整,管理層認為,這些調整是公允列報中期業績所必需的。截至2023年12月31日和2022年12月31日的三個月的經營業績不一定表示全年業績的預期。這些未經審計的簡明合併中期財務報表遵循與公司截至2023年9月30日止年度的2023年10-K表年度報告中包含的公司經審計的合併財務報表附註中描述的重要會計政策,附註3中描述的任何政策除外。未經審計的簡明合併中期現金流量報表中的某些前期金額已重新分類,以符合本期的列報方式。
隨附的未經審計的簡明合併中期財務報表包括公司及其全資子公司的賬目。公司間交易、餘額和未實現的交易損益在合併時予以消除。
隨附的簡明合併中期財務報表是按歷史成本編制的,但某些按公允價值計量的金融資產除外。
除每股數據和另有説明外,隨附的簡明合併中期財務報表和附註中列報的所有金額均以美元表示。提及 “$” 是指美元,提及 “C$” 是指加元。
13
目錄
估算值的使用
根據美國公認會計原則編制隨附的簡明合併中期財務報表要求管理層對影響截至報告期末或報告期內報告的資產、負債、支出、或有資產和或有負債金額的未來事件做出估算和假設。實際結果可能與這些估計有很大差異。需要管理層進行估算的重要領域包括為服務而發行的股票工具的估值。有關這些假設和條件性質的更多細節可以在這些簡明合併中期財務報表的相關附註中找到。
如果變動僅影響變更期間,則將會計估算變動的影響納入變更期間的綜合收益,或者如果變更同時影響變更期間和未來時期,則將其納入變更期間和未來時期。每季度對估計值和假設進行審查。
3.最近的會計聲明
最近的會計公告尚未通過
管理層認為,任何最近發佈但尚未生效的會計準則,如果目前獲得通過,都不會對公司的簡明合併中期財務報表產生重大影響。
管理層認為,FASB最近發佈的會計聲明,包括其新興問題工作組、美國註冊會計師協會和證券交易委員會,沒有或沒有對公司當前或未來的合併財務報表列報或披露產生重大影響。
14
目錄
4。短期投資
短期投資包括根據公司財政政策購買的金融機構持有的擔保投資證書(“GIC”)。這些擔保投資證和定期存款的利息為
短期投資還包括美國國庫證券、公司債務證券和商業票據。該公司已將這些投資歸類為可供出售的投資,因為可能需要在到期前出售此類投資才能實施管理策略,因此將所有投資證券歸類為流動資產。購買之日到期日為三個月或更短的投資在隨附的資產負債表中以現金等價物列報。短期投資按公允價值入賬,未實現的損益作為股東權益(赤字)的一部分,計入累計的其他綜合虧損,直至變現。購買時產生的任何溢價或折扣將在工具的整個生命週期內使用直線法攤銷或累積到投資收益中,作為收益率的調整。當未實現虧損是由信貸相關因素引起時,公司會記錄信貸損失備抵金。已實現收益和虧損使用特定的識別方法計算,並記錄為投資收益。
截至 2023 年 12 月 31 日 | |||||||||||||||
攤銷 | 未實現 | 估計的 | |||||||||||||
| 成本 |
| 收益 |
| 損失 |
| 投資收益 |
| 公允價值 | ||||||
美國國債 | $ | |
| $ | — |
| $ | ( |
| $ | |
| $ | | |
擔保投資證和定期存款 | | — | — | | | ||||||||||
公司債務證券 | — | — | — | — | — | ||||||||||
期末餘額 | $ | |
| $ | — |
| $ | ( |
| $ | |
| $ | | |
截至2023年12月31日,短期投資的總公允市值為 $
5。預付款
十二月三十一日 | 9月30日 | |||||
| 2023 |
| 2023 | |||
預付保險 | $ | |
| $ | | |
預付 CMC 和臨牀費用和存款 |
| |
| | ||
其他存款和預付費用 |
| |
| | ||
期末餘額 | $ | |
| $ | | |
15
目錄
6。應付賬款和應計負債
十二月三十一日 | 9月30日 | |||||
| 2023 |
| 2023 | |||
應付賬款 | $ | |
| $ | | |
應計費用 |
| |
| | ||
應計假期 |
| |
| | ||
期末餘額 | $ | |
| $ | | |
7。經營租賃
經營租賃使用權資產 |
|
| |
餘額,2023 年 9 月 30 日 | $ | | |
加法 |
| | |
攤銷 | ( | ||
餘額,2023 年 12 月 31 日 | $ | | |
經營租賃負債 |
|
| |
餘額,2023 年 9 月 30 日 | $ | | |
加法 | | ||
經營租賃成本 | ( | ||
餘額,2023 年 12 月 31 日 | $ | | |
預期壽命小於一年的經營租賃負債 |
| $ | |
預期壽命超過一年的經營租賃負債 |
| $ | |
公司承認在租賃期內使用標的資產的使用權的使用權資產和租賃負債,後者代表公司在租賃期內付款的義務的現值。租賃付款的現值是使用增量借款利率計算的,因為公司的租賃不提供隱性利率。在 2023年12月31日,該公司的增量借款利率為
截至2023年12月31日,公司經營租賃負債的到期日如下:
| 經營租賃 | ||
1 年以內 | $ | | |
1 到 2 年 |
| | |
2 到 3 年 | | ||
3 到 4 年 | | ||
| |||
減去: | |||
估算利息 | ( | ||
經營租賃責任 | $ | | |
16
目錄
8。股東權益
已授權
無限量的普通股,沒有面值。
無限量優先股,無面值。
綜合激勵計劃
2021年2月25日,公司通過了一項符合納斯達克政策和規則的綜合激勵計劃(“綜合計劃”)。根據綜合計劃,公司可以發行股票期權、股票增值權、限制性股票、限制性股票單位和其他基於股份的獎勵。截至2023年9月30日,公司尚未根據綜合計劃發行股票期權以外的任何工具。
在綜合計劃通過之前,公司根據公司修訂和重述的股票期權計劃(“傳統期權計劃”)、經修訂和重述的限制性股票單位計劃(“RSU計劃”)和員工股票購買計劃發行了股權補償。自綜合計劃通過以來,儘管傳統期權計劃下的現有補助金將繼續按照其條款有效,但沒有根據傳統期權計劃或RSU計劃提供進一步的補助金。
截至 2023年12月31日,綜合計劃的最大值為
員工股票購買計劃
公司採用了員工股票購買計劃(“ESPP”),根據該計劃,符合條件的員工可以獲得不少於以下價格的公司普通股的購買權(“購買權”)
符合條件的員工最多可以繳款
在截至2023年12月31日的三個月中,公司發行了
在截至的三個月中 | ||||||
十二月三十一日 | ||||||
| 2023 |
| 2022 | |||
研發費用 | $ | |
| $ | | |
一般和行政 |
| |
| | ||
$ | | $ | | |||
17
目錄
公司使用Black-Scholes期權定價模型和預計可購買的股票數量,根據其預計的授予日期公允價值來衡量購買權。購買權的估值使用了以下加權平均假設:
在截至的三個月中 | |||||
十二月三十一日 | |||||
2023 |
| 2022 |
| ||
無風險利率 |
| | % | | % |
股票購買權的預期壽命 |
|
|
| ||
預期的年化波動率 |
| | % | | % |
分紅 |
| |
| |
|
股票期權
根據傳統期權計劃和綜合計劃,先前已授予或可能分別授予期權,到期期限最長為
股票期權交易彙總如下:
|
| 加權 | |||
數字 | 平均值 | ||||
的期權 | 運動價格* | ||||
| |||||
餘額,2023 年 9 月 30 日 |
| | $ | | |
授予的期權 |
| |
| | |
行使的期權 |
| ( |
| ( | |
期權已過期/被沒收 |
| ( |
| ( | |
未償餘額,2023 年 12 月 31 日 |
| | $ | | |
餘額可行使,2023 年 12 月 31 日 |
| | $ | | |
| * | 截至目前可以加元行使的期權 2023年12月31日按當前匯率折算,以反映所有未平倉期權的當前加權平均行使價(美元)。 |
18
目錄
截至2023年12月31日,未償還期權使持有人能夠按以下方式收購普通股:
| 剩餘加權平均值 | |||||
行使價格 | 期權數量 | 合同壽命(年) | ||||
$ | | |||||
$ | | |||||
$ | | |||||
$ | |
| ||||
$ | |
| ||||
$ | |
| * | |||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
$ | |
| ||||
C$ | |
| ||||
C$ | |
| ||||
|
|
*
基於股份的薪酬
在結束的三個月中 2023年12月31日,該公司共授予了
在截至2023年12月31日和2022年12月31日期間,公司確認了授予和歸屬期權的股份支付支出,扣除取消未歸屬期權後的回收額,其職能支出分配如下:
在截至的三個月中 | ||||||
十二月三十一日 | ||||||
2023 |
| 2022 | ||||
研究和開發費用 | $ | |
| $ | | |
一般和行政 |
| |
| | ||
$ | |
| $ | | ||
19
目錄
Black-Scholes期權定價模型對授予的股票期權進行估值時使用了以下加權平均假設:
2023 |
| 2022 | |||
無風險利率 |
| | % | | % |
期權的預期壽命 |
| 年份 | 年份 | ||
預期的年化波動率 |
| | % | | % |
分紅 |
| |
| |
認股證
認股權證交易彙總如下:
|
| 加權 | |||
數字 | 平均值 | ||||
的認股權證 | 行使價格 | ||||
| |||||
餘額,2023 年 9 月 30 日 |
| | $ | | |
認股證到期 |
| ( |
| ( | |
未清餘額和可行使餘額,2023 年 12 月 31 日 |
| | $ | | |
截至2023年12月31日,認股權證已到期,使持有人能夠按以下方式收購普通股:
數字 |
|
| ||||
的認股權證 | 行使價格 | 到期日期 | ||||
$ | |
| ||||
|
|
|
| |||
9。關聯方交易
包含在應付賬款和應計負債中 2023年12月31日 是 $
10。分段信息
該公司工作於
11。金融工具和風險
公司的金融工具包括現金和現金等價物、短期投資、應收賬款和應付賬款以及應計負債。短期投資、應收賬款和應計負債中包含的現金和現金等價物、擔保投資證和定期存款的公允價值近似於其短期至到期日的賬面價值。短期投資中包含的美國國庫證券、公司債務證券和商業票據的公允價值以及現金等價物中包含的貨幣市場基金的公允價值是使用基於標準可觀察輸入(包括報告的交易、經紀商/交易商報價以及出價和/或報價)的二級輸入來衡量的(注4)。
20
目錄
金融工具的公允價值估算是根據有關金融市場和特定金融工具的相關信息,在特定時間點進行的。由於這些估計本質上是主觀的,涉及不確定性和判斷問題,因此無法精確確定。假設的變化會對估計的公允價值產生重大影響。
財務風險因素
公司的風險敞口和對公司金融工具的影響彙總如下:
信用風險
可能使公司受到信用風險高度集中的金融工具主要包括現金和現金等價物、短期投資和應收賬款。公司通過儘可能將現金存入主要金融機構的隔離基金來限制其信貸損失風險。公司將購買時到期日長達十二個月的高流動性投資視為短期投資。短期投資包括自購買之日到期日可能超過一年的投資;但是,公司可能會在到期前清算投資頭寸以實施管理策略。該公司維持的投資政策要求其投資工具具有一定的最低投資等級。
截至 2023年12月31日,現金和現金等價物包括加拿大和美國的現金、美國的貨幣市場基金以及對購買之日到期日不到三個月的某些工具的投資。現金賬户餘額超過加拿大存款保險公司的保險金額,最高可達C$
流動性風險
公司管理流動性風險的方法是確保其有足夠的流動性來償還到期的負債。截至 2023年12月31日,該公司的營運資金為 $
市場風險
市場風險是指利率和外匯匯率等市場因素的變化可能產生的損失風險。
截至 2023年12月31日,公司有現金和現金等價物餘額以及帶息的短期投資。利息收入不是公司資本管理戰略的核心,對公司的預計運營預算也不重要。利率波動對公司的風險評估並不重要。
公司的外幣風險敞口與以加元和歐元計價的淨貨幣資產有關。該公司以美元維持其現金和現金等價物,並根據需要進行兑換以償還以加拿大計價的支出。加元和美元相對於加元的匯率變動了10%,維持在 2023年12月31日 會導致波動 $
21
目錄
第 2 項。管理層對財務狀況和經營業績的討論和分析
以下討論應與本10-Q表季度報告第一部分第1項所附財務報表及其附註,以及我們於2023年12月12日向美國證券交易委員會(“SEC”)提交的10-K表年度報告中包含的經審計的財務報表及其相關附註以及管理層對截至2023年9月30日的財年財務狀況和經營業績的討論和分析一起閲讀。本10-Q表季度報告,包括以下章節,包含1995年《美國私人證券訴訟改革法》所指的前瞻性陳述和加拿大證券法所指的 “前瞻性信息”,或統稱為前瞻性陳述。這些陳述存在風險和不確定性,可能導致實際結果和事件與此類前瞻性陳述所表達或暗示的結果和事件存在重大差異。有關這些風險和不確定性的詳細討論,請參閲我們的10-K表年度報告中的 “風險因素”。我們提醒讀者不要過分依賴這些前瞻性陳述,這些陳述僅反映了管理層截至本10-Q表季度報告發布之日的分析。我們沒有義務更新前瞻性陳述以反映本10-Q表季度報告發布之日之後發生的事件或情況。
概述
ESSA是一家臨牀階段的製藥公司,專注於開發治療前列腺癌的新療法,主要關注疾病仍主要由雄激素軸驅動的患者。ESSA開發的雄激素受體(“AR”)N末端結構域(“NTD”)的專有小分子抑制劑的重點是與阿比特龍、恩扎魯胺、阿帕魯胺和達魯他胺等第二代抗雄激素藥物聯合治療這些患者。該公司認為,其最新的一系列研究化合物,包括其候選產品masofaniten(前身為 EPI-7386),有可能顯著延長早期前列腺癌患者受益於抗激素類療法的時間間隔。具體而言,這些化合物旨在破壞雄激素受體AR信號通路,這是推動前列腺癌生長的主要途徑,通過選擇性結合AR的NTD來防止AR激活。在這方面,該公司的化合物在機制上不同於傳統的非類固醇抗雄激素。這些經典的抗雄激素要麼幹擾雄激素合成(即阿比特龍),要麼幹擾雄激素與配體結合域(“LBD”)的結合,配體結合結構域(“LBD”)位於NTD(即 “lutamides”)受體的另一端。功能性 NTD 對於 AR 的功能至關重要;阻斷 NTD 會抑制 AR 驅動的轉錄,從而抑制雄激素驅動的生物學。
該公司認為,其臨牀前化合物的轉錄抑制機制是獨一無二的,其潛在優勢是繞過了目前用於治療去勢抗性前列腺癌(“CRPC”)的幾種已確定的抗雄激素耐藥機制。該公司已獲得美國採用的名稱(“USAN”)委員會授予一個獨特的USAN詞幹 “-Aniten”,以表彰這一全新的首創機械級別。該公司將這一系列專有研究化合物稱為 “Aniten” 系列。在臨牀前研究中,阻斷新傳染病已證明有能力阻止 AR 驅動的基因表達。先前完成的ESSA第一代藥物醋酸拉尼汀(“EPI-506”)的1期臨牀試驗顯示,前列腺特異性抗原(“PSA”)對當前標準護理療法難治的轉移性CRPC(“mcRPC”)患者施用,顯示前列腺特異性抗原(“PSA”)下降,這是增強現實驅動生物學抑制的標誌。但是,這種抑制既不夠深入,也不夠持久,不足以帶來臨牀益處,該公司決定開發一種更有效的下一代藥物,這種藥物的半衰期也將更長。該公司已經這樣做了,目前正在對下一代Aniten masofaniten(EPI-7386)進行臨牀試驗,重點是結合當前最新一代的一種經典抗雄激素,治療早期階段、更均勻的雄激素驅動的腫瘤。
根據美國癌症協會的數據,在美國,前列腺癌是男性中第二常被診斷的癌症,僅次於皮膚癌。在出於治療目的接受局部疾病治療的所有前列腺癌患者中,大約三分之一的血清PSA水平隨後會升高,這表明疾病復發,有或沒有發生遠處轉移。以PSA升高或淋巴結或骨轉移為表現的複發性疾病的患者通常使用促黃體激素釋放激素的類似物或手術去勢進行初始雄激素消融治療;這種方法被稱為 “雄激素剝奪療法”(“ADT”)。這些患者中的大多數最初對ADT有反應;但是,儘管腫瘤的生長減少了,但許多患者還是會復發
22
目錄
****激素到去勢水平,此時被認為有CRPC。診斷為CRPC後,患者通常接受抗雄激素治療,這些抗雄激素會阻斷雄激素(恩扎魯胺)與AR的結合,或抑制雄激素的合成(阿比特龍)。最近,通過將這種最新一代的抗雄激素與疾病自然史早期的ADT(即轉移性激素敏感性前列腺癌(“mHSPC”)和非轉移性去勢抗性前列腺癌(“nmCRPC”))聯合使用,無進展存活率和總存活率得到了顯著改善。
自20世紀中葉以來,人們已經認識到,前列腺腫瘤的生長在很大程度上是由激活的AR介導的。通常,有三種激活 AR 的方法。首先,雄激素,例如二氫睾酮,可以通過與其LBD結合來激活AR。其次,CRPC 可以由沒有 LBD、本構激活的 AR 變體驅動,因此不需要雄激素來激活。第三種機制的臨牀意義不太確定,可能涉及某些與雄激素活性無關的激活增強現實的信號通路。通常,當前用於治療前列腺癌的藥物通過以下方式對抗第一種機制:(i)幹擾雄激素的產生,或(ii)防止雄激素與LBD結合。隨着時間的推移,這些方法最終會由於涉及受體LBD端的耐藥機制而失敗,無論是在DNA(AR擴增或LBD突變)還是在RNA水平(AR剪接變體的出現)。在開發AR激活的替代途徑機制方面,腫瘤也可能對抗雄激素活性不敏感。最後,對於已經接受各種抗雄激素療法多年治療的患者,基因組變化可能會導致其他與AR無關的致癌驅動因素,也對增強現實生物學的抑制不敏感。
該公司認為,Aniten系列化合物有可能通過使用涉及NTD的獨特機制來阻斷雄激素驅動的基因轉錄,從而繞過這些已知的對當前抗雄激素的耐藥機制,因此有可能在其他AR驅動的疾病中基於LBD的第二代抗雄激素耐藥機制發揮作用的情況下有效。廣泛的臨牀前研究結果和初步臨牀經驗都支持了公司的信念。在臨牀前研究中,已觀察到Aniten系列化合物可以縮小AR依賴性前列腺癌的異種移植,包括對恩扎魯胺等第二代抗雄激素敏感和耐藥的腫瘤。在參與masofaniten(EPI-7386)1期研究的患者中,觀察到血漿PSA水平下降和PSA倍增時間的增加,循環腫瘤DNA的下降和放射照相腫瘤測量值的降低,如下所述。重要的是,關於NTD抑制劑在疾病自然史上的潛在臨牀應用,該公司及其合作者最近的研究還表明,與僅從受體兩端的AR抑制相比,該公司的Aniten化合物與目前批准的抗雄激素組合能夠更完全地抑制AR驅動的生物學,具有潛在優勢。這一假設得到了近年來臨牀試驗結果的支持,即在激素敏感性前列腺癌(“HSPC”)環境中通過在發病早期結合ADT和最新一代抗雄激素,與按順序使用這兩種療法相比,在激素敏感性前列腺癌(“HSPC”)環境中獲得了優異的總體存活率。
儘管二十多年來人們一直意識到NTD作為藥物靶標的潛在重要性,但由於技術原因,它一直是治療藥物開發的困難目標。AR 的 NTD 具有靈活性,具有高度的內在失調,因此很難用於基於晶體結構的經典藥物設計。該公司目前沒有發現其他藥物開發公司正在開發任何臨牀階段的NTD AR抑制劑。科學研究界定了Aniten化合物與新傳染病的高度特異性結合的性質以及這種結合的生物學後果。綁定的選擇性,基於 在活體中成像以及 體外研究與第一代 EPI-506 臨牀前研究中觀察到的良好毒理學結果以及隨後在 EPI-506 的1期試驗中觀察到的安全性結果一致。在這項試驗之後,在決定將masofaniten(EPI-7386)作為公司的主要候選產品之後,該公司完成了一系列生物物理和生物學研究,揭示了masofaniten(EPI-7386)與AR的NTD的相互作用和結合,並在2021年的多個醫學會議上介紹了這些發現。參見”已完成 EPI-506 的 1 期臨牀研究” 和”下一代 Aniten 分子” 下面。
23
目錄
轉移性和非轉移性 CRPC 的發病率持續上升。使用動態進展模型,Scher 等人。1預計2020年的發病率為546,955例,患病率為3,072,480。該公司認為,Aniten系列化合物最終可能為其中許多患者帶來潛在益處。在早期的臨牀開發中,該公司重點關注因以下原因而失敗的第二代抗雄激素療法(即阿比特龍和/或盧他胺)的患者:
| ● | CRPC治療仍然是一個前列腺癌細分市場,有明顯而重要的治療需求未得到滿足,並且是一個潛在的巨大市場; |
| ● | 該公司認為,其Aniten化合物的獨特作用機制非常適合治療那些以AR LBD為重點的療法失敗且其生物學特徵表明其腫瘤在很大程度上仍由增強現實生物學驅動的患者;以及 |
| ● | 該公司預計,該領域治療需求明顯未得到滿足的患者數量相對較多,這將促進其臨牀試驗的及時入組。 |
該公司認為,最初的Aniten 1期臨牀試驗表現出良好的安全性和耐受性,加上令人信服的臨牀前理由,推動並強調了masofaniten(EPI-7386)與第二代抗雄激素聯合研究的重要性。此外,該公司認為,兩種獨立的、互補的AR轉錄抑制機制的應用可能會進一步抑制雄激素活性,延緩或預防藥物。抵抗。前列腺癌臨牀治療的最新進展源於較早地將抗雄激素與經典的ADT聯合使用,這與更有效的雄激素抑制可能產生臨牀益處的前提一致。因此,該公司認為,引入NTD抑制劑,例如masofaniten(EPI-7386),有可能改善雄激素抑制,延緩耐藥性的出現,並改善臨牀益處。
已完成 EPI-506 的 1 期臨牀研究
該公司在2015年至2017年期間使用第一代Aniten化合物 EPI-506 進行了初步的概念驗證1期臨牀研究。EPI-506 1 期臨牀試驗的目標是探索 EPI-506 的安全性、耐受性、最大耐受劑量和藥代動力學,以及對無症狀或症狀微小、對阿比特龍或恩扎魯胺治療或兩者均無反應的 mcRPC 患者的抗腫瘤活性。評估了降低PSA等療效終點和其他疾病進展標準。與 EPI-506 1/2 期臨牀試驗設計相關的詳細信息可在美國國立衞生研究院臨牀試驗網站上查閲(參見標識符 NCT02606123 下的 https://clinicaltrials.gov)。
研究性新藥(“IND”)向美國食品藥品管理局申請 EPI-506 以開始 1 期臨牀試驗,於 2015 年 9 月獲準,第一位臨牀患者於 2015 年 11 月入組。該公司向加拿大衞生部提交的臨牀試驗申請(“CTA”)隨後也獲得批准。根據異速比例,EPI-506 的初始劑量水平確定為 80 mg。但是,在最初的隊列入組之後,很明顯,人體的 EPI-506 暴露量遠低於預期。為了讓臨牀研究中的患者有更多機會接觸該藥物,EPI-506 的劑量被積極增加。患者最終接受的最高劑量為 3600 mg EPI-506,以單劑量給藥或每天分成兩劑給藥。1期臨牀試驗的初步數據已在2017年9月的歐洲腫瘤內科學會會議上公佈。
這項開放標籤、單臂、劑量遞增研究在美國和加拿大的五個地點進行,評估了在先前接受恩扎魯胺和/或阿比特龍治療後進展的終末期 mcRPC 男性中 EPI-506 的安全性、藥代動力學、最大耐受劑量和抗腫瘤活性。有28名患者可供分析,每位患者在研究進入時接受過四種或更多前列腺癌治療。患者自行口服的 EPI-506 劑量從 80 毫克到 3600 毫克不等,平均藥物暴露量為 85 天(介於 8 到 535 天之間)。在患者內給藥後,四名患者接受了長期治療(中位數為318天;在數據截止時為219至535天)
1Scher HI、Solo K、Valant J、Todd MB、Mehra M(2015)前列腺癌患病率臨牀狀態和死亡率
在美國:使用動態進展模型進行估計。PLoS ONE 10 (10):e0139440。
doi: 10.1371/journal.pone.013944
24
目錄
升級。在五名患者中觀察到PSA下降幅度從4%到37%不等,這是衡量潛在療效的指標,主要發生在較高劑量的隊列中(≥1280 mg)。
EPI-506 的耐受性總體良好,在不超過 2400 mg 的所有劑量下均觀察到良好的安全結果。劑量為3600 mg時,在兩名患者中觀察到胃腸道不良事件(噁心、嘔吐和腹痛):在每日一次(“QD”)給藥隊列中有一名患者,在1800 mg每日兩次給藥隊列中有一名患者,這導致研究中止和劑量限制毒性(“DLT”),原因是28天安全報告期內錯過了超過25%的劑量。在3600 mg QD隊列中,另一名患者出現了短暫的3級肝酶(AST/ALT)升高,這也構成了DLT,因此該隊列的入組得出結論。
儘管該公司認為,在較高劑量水平下觀察到的安全性結果和可能的抗腫瘤活性跡象支持抑制AR-NTD可能為mcRPC患者帶來臨牀益處的概念,但藥代動力學和代謝研究揭示了第一代藥物 EPI-506 的侷限性。通過其發現研究,該公司得出結論,開發下一代NTD抑制劑應該是可行的,這種抑制劑將顯示出更大的效力、更低的新陳代謝和其他更好的藥物特性。因此,該公司於2017年9月11日宣佈決定終止 EPI-506 的進一步臨牀開發,並實施一項公司重組計劃,將研發資源集中在針對AR-NTD的下一代Anitens上。這種下一代Aniten化合物包括效力要強得多的藥物,旨在表現出更強的新陳代謝抵抗力,因此預計的循環半衰期更長。該公司的主要候選產品masofaniten(EPI-7386)已在廣泛的臨牀前表徵和臨牀研究中展示了這些和其他有利特徵,該公司在科學會議上的一系列海報演示中介紹了這些特徵。
下一代 Aniten 分子
該公司的下一代研究用Aniten化合物系列對第一代藥物進行了多種化學支架改動,這些藥物在臨牀前研究中保留了對AR的NTD抑制作用。此外,在臨牀前研究中,與第一代化合物 EPI-506 相比,它們在一系列屬性上有所改善。在 體外通過測量 AR 轉錄活性抑制的試驗,這些候選產品的效力是 EPI-506 或其活性代謝物 EPI-002 的 20 倍。此外,這些化合物在臨牀前研究中顯示出更高的代謝穩定性,這表明人類的半衰期有可能延長。最後,與 EPI-506 相比,這些化合物表現出更有利的藥物特性。該公司認為,這些候選產品如果成功開發和批准,可能會在大規模生產的便利性和成本、藥品穩定性以及全球商業化的適用性方面取得進步。在這些下一代抗菌素中,masofaniten(EPI-7386)被選為IND申請和1期臨牀試驗。
我們的戰略
在開發可能的與新傳染病結合的療法時,公司的戰略方針包括:
| ● | 在早期的治療方案中將Aniten化合物與第二代抗雄激素結合使用。該公司一直在與行業合作伙伴一起對早期治療中的nmcRPC、mcRPC、mHSPC和新輔助前列腺癌手術療法患者進行masofaniten(EPI-7386)和第二代抗雄激素組合的臨牀試驗; |
| ● | 完成masofaniten(EPI-7386)作為單一療法治療對當前護理標準有耐藥性的mcRPC患者的第一階段臨牀開發,以儘可能完整地證明該藥物作為單一藥物在安全性、耐受性和有效性方面的特性,並進行詳細的藥理和生物學研究。該公司對這些臨牀數據的評估將決定其作為單一藥物療法和聯合療法的masofaniten(EPI-7386)的臨牀開發,同時考慮此類治療對儘管對最新一代抗雄激素進行了大量預處理但腫瘤進展並主要由AR途徑驅動的患者羣體規模的影響;以及 |
25
目錄
| ● | 持續的臨牀前研究,包括研究其他 Aniten 分子和 AR NTD 抑制劑的其他潛在應用。 |
masofaniten (EPI-7386) 的鑑定和特徵
下一代項目的目的是確定與ESSA的第一代化合物相比效力更高、代謝敏感性更低且藥物特性更高的候選藥物。在ESSA第一代化合物的化學支架上進行的結構-活性關係研究產生了一系列新的化合物,這些化合物顯示出更高的效力並預測了更長的半衰期。為了改善該化學類別的ADME(吸收、分佈、新陳代謝和排泄)和藥物特性,還對化學支架進行了多次更改。
幾種下一代Aniten分子在效力、穩定性、選擇性和藥物特性方面實現了預先規定的臨牀前靶產品概況目標。2019年3月26日,該公司宣佈提名masofaniten(EPI-7386)作為其通過抑制雄激素受體的NTD來治療mcRPC的主要臨牀候選藥物。在臨牀前研究中,masofaniten(EPI-7386)已顯示出活性 體外在許多 AR 依賴性前列腺癌模型中,包括第二代抗雄激素無活性的模型。此外,與ESSA的第一代化合物 EPI-506 相比,masofaniten(EPI-7386)的效力、代謝穩定性明顯更高,在臨牀前研究中也更有效。最後,在迄今為止對該化合物進行的所有動物研究中,masofaniten(EPI-7386)都顯示出良好的耐受性。
從這一系列下一代化合物中,馬索芬汀(EPI-7386)被選為mcRPC初始臨牀開發的主要候選藥物。IND 於 2020 年 3 月 30 日提交給 FDA,並於 2020 年 4 月 30 日獲得 FDA 的批准。2020年4月向加拿大衞生部提交了CTA,隨後獲得了許可。masofaniten(EPI-7386)的臨牀測試於2020年7月開始,由於 COVID-19 對臨牀試驗場所的影響,可以按計劃的時間表進行調整(見”風險因素-廣泛的健康問題、流行病或流行病以及其他疾病疫情可能會對公司維持運營和執行業務計劃的能力產生負面影響” 在我們的 10-K 表年度報告中)。
26
目錄
通過臨牀開發推進 masofaniten (EPI-7386)
該公司正在通過兩項臨牀試驗:EPI-7386-CS-001 和 EPI-7386-CS-010 來推進馬索法尼特(EPI-7386)的發展。EPI-7386-CS-001 的臨牀試驗有兩個分支,分別代表研究方案的單一療法和組合部分,概述如下:

注意:“mcRPC” 是指轉移性去勢抵抗性前列腺癌;“AAP” 是指醋酸阿比特龍/潑尼鬆;“mHSPC” 是指轉移性激素敏感性前列腺;“nmcRPC” 是指非轉移性去勢抵抗性前列腺癌
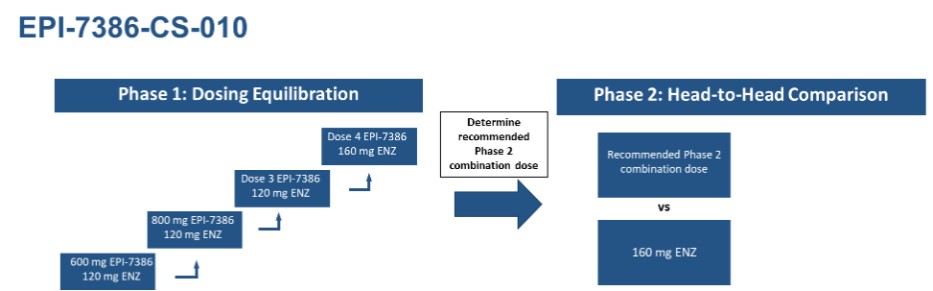
EPI-7386-CS-010 的臨牀試驗是恩雜魯胺的聯合試驗,含有 1 期劑量平衡成分和 2 期正面對比組分,如下研究架構所述:
備註:“ENZ” 是指恩扎魯胺
1 期臨牀試驗-EPI-7386-CS-001-單一療法治療
masofaniten(EPI-7386)“針對去勢耐藥性前列腺癌患者的口服 EPI-7386(EPI-7386)” 的1期臨牀試驗目前正在積極招募對第二代抗雄激素天真的nmcRPC患者以及對美國和加拿大臨牀場所標準護理治療難以接受的mcRPC患者(www.clinicaltrials.gov,標識符為NCT04421222)。2021年9月,該公司修訂了協議,允許在1a階段對800毫克/天和1200毫克的劑量進行測試,分別以400毫克或600毫克的劑量給藥,每日兩次(“BID”)。此外,該協議修正案將進一步的單一療法開發重點放在預先治療程度較低的mcRPC患者,即先前最多接受過三種批准的mcRPC全身療法的患者,包括至少一種第二代抗雄激素且排除內臟轉移患者的患者。
27
目錄
A部分單一療法 - 第 1a 階段 — 劑量遞增
這項開放標籤、劑量遞增的1a期臨牀試驗旨在確定安全性、耐受性、藥代動力學、最大耐受劑量和/或推薦的2期劑量範圍,並評估該藥物的初步抗腫瘤活性。
1期臨牀試驗的設計包括1a部分劑量遞增階段的標準每劑量3+3設計,受試者每天接受一次口服馬索凡尼特(EPI-7386),直到有客觀證據表明臨牀疾病進展和/或出現不可接受的毒性為止。
劑量遞增該研究的第 1a 部分已完成入組。參與該研究第1a部分的患者是臨牀選擇的,其基礎是mcRPC進展情況,儘管有最新一代的抗雄激素治療,但PSA值上升和/或放射學疾病進展就是例證。但是,還對所有患者進行了回顧性生物學特徵的生物學特徵,以獲得增強現實途徑激活和非增強現實致癌途徑的證據,以及在試驗進行期間,對與劑量相關的生物、藥理和藥效學效應進行了回顧性生物學特徵。
2021年9月和2022年7月向美國食品藥品管理局提交的協議修正案允許在預治療程度較低的患者(如上所述)中開發單一療法,在這些患者中,雄激素受體途徑更有可能成為腫瘤生長的主要驅動力。該公司的目標是根據包括藥代動力學和生物學觀察在內的多種輸入以及臨牀經驗,確定一種或多種劑量/時間表供擴展的1b期研究進行測試,以符合FDA項目Optimus指導方針。已將兩個劑量水平提高到1b階段劑量擴展測試:600 mg QD 和 600 mg BID。
A部分單一療法 - 第 1b 階段 — 劑量擴大
1b期的主要目標是進一步評估masofaniten(EPI-7386)在600 mg BID和600 mg QD條件下的安全性、耐受性、藥代動力學和初步抗腫瘤活性(通過影像學測量的腫瘤負擔的變化以及PSA水平隨時間推移的變化來衡量),在符合資格標準與1a期採用的資格標準相似,重點是未成化療的mcRPC患者經過兩條治療線,包括至少一條第二代抗雄激素的治療後,他們的病情有所進展。由12名患者組成的600 mg BID隊列已全部入組,由12名患者組成的600 mg QD隊列正在完成入組。
為了能夠研究前列腺癌晚期和治療程度較低的前列腺癌患者羣體,有必要證明masofaniten(EPI-7386)在1a期具有良好的安全性和耐受性,以及其作用機制和療效的臨牀證據。最初的1a期試驗的經驗為抗雄激素的生物學效應和一些臨牀相關的抗腫瘤活性提供了證據。這些患者的生物學特徵也顯示出良好的安全性。
該公司的臨牀前數據和其他證據表明,早期患者羣體的增強現實驅動力更加均勻,1a期劑量遞增試驗顯示的良好安全性證明瞭masofaniten(EPI-7386)與經典抗雄激素聯合用藥的研究是合理的。因此,該公司及其合作者正在在這方面進行一系列臨牀試驗。第一項1/2期研究涉及馬索非尼特(EPI-7386)與恩雜魯胺聯合評估對mcRPC天真至第二代抗雄激素患者的評估。其他涉及馬索非尼特(EPI-7386)與阿帕魯他胺、醋酸阿比特龍或達洛他胺聯合使用的臨牀試驗正處於不同的實施階段。
組合研究 — 為前列腺癌的治療制定新的護理標準
大多數前列腺癌的生長和存活都需要活化的 AR。與目前只能抑制全長AR的抗雄激素療法不同,NTD對AR定向生物學的抑制既發生在全長AR中,也發生在剪接變體AR中。因此,該公司認為AR-NTD是下一代抗雄激素療法的理想靶標。如果 ESSA 的 masofaniten (EPI-7386) 成功治療了 CRPC 患者,那麼可以合理地期待
28
目錄
這種臨牀候選藥物可能有效治療早期患者。臨牀前研究表明,將Anitens與目前廣泛使用的第二代抗雄激素聯合使用具有特殊價值。該公司正在根據這一戰略進行臨牀試驗。
臨牀試驗-EPI-7386-CS-010 — 恩雜魯胺聯合治療
該公司一直在對mcRPC患者進行馬索非尼特(EPI-7386)與恩扎魯胺聯合使用與單獨使用恩扎魯胺的1/2期研究。該研究的第一階段是對馬索非尼特(EPI-7386)與固定劑量的恩扎魯胺聯合進行的單臂劑量遞增研究。
2021年2月24日宣佈了與安斯泰來製藥公司(“安斯泰來”)的合作和供應協議,以評估馬索非尼特(EPI-7386)與安斯泰來和輝瑞公司(“輝瑞”)的AR抑制劑恩扎魯胺聯合治療mcRPC患者。ESSA正在為這項試驗付費,並正在實際開展這項試驗,首先進行1期劑量平衡,隨後進行一項涉及計劃中的120名患者的隨機2期試驗。用於該試驗的恩扎魯胺由安斯泰來提供。這項1/2期研究的第一位患者於2022年1月給藥,其安全性、耐受性、藥代動力學和初始PSA反應最初是在2022年10月前列腺癌基金會務虛會和2023年2月美國臨牀腫瘤學會泌尿生殖系癌研討會的海報展示中於2022年6月的臨牀更新中報告的。該臨牀試驗是一項由兩部分組成的研究:第一階段劑量平衡階段,然後是第二期開放標籤隨機研究。Masofaniten(EPI-7386)正在逐步增加的劑量水平進行評估,包括600毫克QD、800 mg QD和600 mg BID與120毫克和160毫克恩扎魯胺聯合治療mcRPC患者,用於治療未受過第二代抗雄激素的mcRPC患者。該研究的第一階段已完成入學。第二階段隨機階段的推薦2期組合劑量為600 mg BID masofaniten(EPI-7386)和160毫克恩雜魯胺(測試的最高劑量水平)。2期研究目前正在招收患者。
臨牀試驗-EPI-7386-CS-001 — 阿比特龍和阿帕魯他胺聯合治療
2021年1月13日宣佈了與詹森研究與開發有限責任公司(“楊森”)的首次合作,目的是在臨牀試驗中研究馬索法尼特(EPI-7386)與醋酸阿比特龍和潑尼鬆聯合使用以及將馬索芬汀(EPI-7386)與阿帕魯胺聯合用於mcRPC患者的安全性和潛在益處。根據與詹森的合作協議,詹森將支付馬索法尼特(EPI-7386)的臨牀試驗費用並進行臨牀試驗,並將他們的每種抗雄激素阿帕魯胺和醋酸阿比特龍分成不同的隊列進行臨牀試驗。該組合試驗於2022年3月啟動。由於業務招聘方面的挑戰,詹森於2022年10月暫停了招生。2023年4月12日,ESSA宣佈已與楊森簽訂臨牀試驗支持協議,由ESSA在較早的患者羣體中支付並對這些組合進行研究,而詹森則提供阿帕魯他胺和醋酸阿比特龍。
該公司於2023年6月發佈的最新方案修正案修改了該研究的方案設計,增加了第二代抗雄激素的聯合治療。具體而言,修訂後的方案由兩部分組成:A部分單一療法研究和B部分組合研究。A部分分為兩個階段:1a期劑量遞增和1b期劑量擴大,如上所述,B部分分兩組進行,隊列1評估馬索法尼特(EPI-7386)與醋酸阿比特龍/潑尼鬆聯合使用阿比特龍/潑尼鬆的治療標準的mhspc或mcRPC患者,以及隊列2,以前是 “機會之窗隊列”,在添加阿帕魯他胺之前,對nmcRPC患者進行為期12周的單一藥物馬索法尼特(EPI-7386)評估。
B 部分組合-隊列 1 — 與醋酸阿比特龍/潑尼鬆聯合使用
該公司將評估masofaniten(EPI-7386)與醋酸阿比特龍/潑尼鬆(AAP)在mHSPC或mcRPC患者中的組合。AAP將由詹森根據上述臨牀試驗支持協議提供。這項研究目前正在招收患者。
29
目錄
B部分組合-隊列2 — 機會之窗,先有臨牀終點,然後與阿帕魯他胺聯合使用
隊列2的主要目標是評估疾病不受先前第二代抗雄激素療法或化療幹擾的nmcRPC患者在有限的時間內(最多在患者開始標準護理治療之前的12周)內以600 mg BID給藥的masofaniten(EPI-7386)的抗腫瘤活性(以PSA隨時間推移的變化來衡量)。在12周的窗口期結束後,根據馬索法尼特(EPI-7386)作為單一藥物的劑量,公司將評估馬索法尼特(EPI-7386)與阿帕魯他胺的組合。阿帕魯胺將由詹森根據相同的臨牀試驗支持協議提供。
除了與輝瑞和詹森宣佈的協議外,還宣佈了與拜耳的第三次合作。拜耳將支付馬索法尼特(EPI-7386)的1/2期臨牀試驗,以評估馬索法尼特(EPI-7386)與達洛他胺聯合用於早期的mcRPC患者。ESSA將為組合試驗提供馬索法尼特(EPI-7386)。該臨牀試驗尚未啟動。該公司繼續評估潛在的合作,這些合作可能會提高其前列腺癌項目的價值,並使其能夠利用詹森、安斯泰來和拜耳等戰略合作伙伴的專業知識。
Anitens 和其他適應症的臨牀前開發
該公司繼續對新興的NTD抑制劑的其他新興潛在臨牀應用進行臨牀前研究。作為Aniten化合物臨牀前工作的一部分,該公司還研究了新傳染性降解劑,並在2022年4月10日的AACR年會上在一張題為 “雄激素受體(AR)N末端結構域降解劑可以降解CRPC臨牀前模型中的AR全長和AR剪接變體” 的海報中提供了其第一代AR ANITAC NTD降解劑的數據。
最近 事態發展
該公司在科學會議和其他論壇的許多演講中提供了與masofaniten(EPI-7386)相關的臨牀前和臨牀科學數據。
2024
2024年1月25日至27日,該公司在2024年ASCO泌尿生殖系統癌症研討會上公佈了其評估馬索非尼特(EPI-7386)與恩雜魯胺聯合使用的第1/2期研究的最新劑量遞增數據。
在可進行安全性評估的患者(n=18)中,在某些患者通過25個給藥週期測試的劑量水平上,masofaniten與恩雜魯胺聯合使用仍然具有良好的耐受性。最常見的不良事件為 1 級和 2 級,與 AR 抑制或胃腸道刺激有關。在隊列4中,一名患者出現了3級皮疹,該皮疹是在給藥masofaniten與恩雜魯胺聯合使用後立即觀察到的,被認為可能有關,導致隊列從四名患者增加到七名。未觀察到額外的劑量限制毒性,因此未達到最大耐受劑量。推薦的 2 期組合劑量被確定為馬索非尼特 600 mg BID 與恩扎魯胺 160 QD 聯合使用。
在可評估療效的患者(n=16)中,無論以往的化療狀態如何,包括接受低於全劑量恩扎魯胺(120 mg)的患者,均觀察到PSA的快速、深度和持久降低。在所有劑量羣組中,88% 的患者(16 箇中的 14 個)獲得了 PSA50,81% 的患者(16 箇中的 13 個)獲得了 PSA90,69% 的患者(16 箇中的 11 個)在不到 90 天內獲得了 PSA90,63% 的患者(16 箇中的 10 個)獲得了 PSA
該研究的隨機、開放標籤、雙組的2期劑量擴展部分正在進行中,旨在評估mcRPC天真至第二代抗雄激素患者中masofaniten和恩雜魯胺與單劑恩扎魯胺的組合。該研究目前正在美國、加拿大和澳大利亞的大約25個地點註冊。向歐洲基地的擴張正在進行中。
30
目錄
2023
2023年10月26日至28日,該公司在第30屆前列腺癌基金會年度科學務虛會上介紹了此前在歐洲腫瘤內科學會(ESMO)2023年大會上發佈的評估馬索法尼特(EPI-7386)聯合恩扎魯胺的1/2期研究的海報的更新。
提供的數據來自該研究第一階段劑量遞增部分的四組患者。數據表明,masofaniten(EPI-7386)對恩雜魯胺暴露沒有影響,因此允許按標籤全劑量(160mg)聯合使用恩扎魯胺。研究還表明,恩扎魯胺可減少馬索法尼特(EPI-7386)的暴露量,但每天服用兩次馬索法尼特(EPI-7386)似乎可以減輕降低,並維持與臨牀相關的藥物暴露量。
在可評估安全性(n=18)的患者中,通過對某些患者的21個給藥週期進行測試的劑量,馬索法尼汀(EPI-7386)與恩雜魯胺聯合使用的耐受性良好。最常見的不良事件為 1 級和 2 級,與 AR 抑制或胃腸道刺激有關。在隊列4中,一名患者出現了3級皮疹,該皮疹是在與恩扎魯胺聯合使用馬索非尼特(EPI-7386)後立即觀察到的,被認為可能有關聯。
在可評估療效的患者(n=16)中,無論以往的化療狀態如何,包括接受低於全劑量恩扎魯胺(120 mg)的患者,均觀察到PSA的快速、深度和持久降低。在前三組中,90% 的患者(10 箇中的 9 個)在 90 天內獲得了 PSA50 和 PSA90,80% 的患者(10 箇中的 8 個)在不到 90 天的時間內獲得了 PSA90,70% 的患者(10 箇中的 7 個)獲得了 PSA
2023年10月20日至24日,該公司在歐洲腫瘤內科學會(ESMO)2023年大會上公佈了其評估馬索非尼特(EPI-7386)與恩扎魯胺聯合使用的第1/2期研究的最新劑量遞增數據。
在可進行安全性評估的患者(n=18)中,在某些患者通過21個給藥週期進行測試的劑量下,masofaniten與恩雜魯胺聯合使用仍然具有良好的耐受性。最常見的不良事件為 1 級和 2 級,與 AR 抑制或胃腸道刺激有關。在隊列4中,一名患者出現了3級皮疹,該皮疹是在給藥馬索非尼特與恩雜魯胺聯合使用後立即觀察到的,被認為可能有關。
在可評估療效的患者(n=16)中,無論以往的化療狀態如何,包括接受低於全劑量恩扎魯胺(120 mg)的患者,均觀察到PSA的快速、深度和持久降低。在前三組中,90% 的患者(10 箇中的 9 個)在 90 天內獲得了 PSA50 和 PSA90,80% 的患者(10 箇中的 8 個)在不到 90 天的時間內獲得了 PSA90,70% 的患者(10 箇中的 7 個)獲得了 PSA
2023年10月3日,公司向美國證券交易委員會提交了S-3表格註冊聲明的招股説明書補充文件,包括基本招股説明書。除此之外,該公司於2023年11月6日宣佈已與傑富瑞集團簽訂自動櫃員機銷售協議,該協議自2023年11月3日起生效。根據自動櫃員機銷售協議,ESSA可以在自動櫃員機銷售協議生效期間不時出售其普通股,總銷售收益最高為5,000萬美元。加拿大不會向Jefferies LLC認定為加拿大居民的任何人提供或通過加拿大任何證券交易所或交易市場的設施提供或出售普通股。
2023年9月18日,該公司宣佈啟動其第1/2期研究的第二階段部分,評估其主要候選藥物馬索法尼汀(EPI-7386)與安斯泰來和輝瑞的恩扎魯胺聯合治療mcRPC天真至第二代抗雄激素患者。
31
目錄
2023年8月31日,公司宣佈為其總裁兼首席執行官戴維·帕金森及其執行副總裁兼首席運營官彼得·維爾西剋制定自動證券處置計劃。
2023年6月6日,公司任命勞倫·梅倫迪諾為董事會(“董事會”)成員。
2023年4月12日,該公司宣佈已與詹森簽訂了臨牀試驗支持協議。ESSA將贊助並開展一項1期臨牀試驗,評估masofaniten(EPI-7386)與阿帕魯他胺或醋酸阿比特龍加潑尼鬆聯合使用時的安全性、藥代動力學、藥物相互作用和初步抗腫瘤活性。詹森將供應阿帕魯他胺和醋酸阿比特龍。
2023年2月16日至19日,該公司在美國臨牀腫瘤學會泌尿生殖系統癌研討會上介紹了對mcRPC患者進行兩項馬索非尼特(EPI-7386)1期研究的初步臨牀數據分析。該公司介紹了1期單一療法研究的最新情況,該研究表明,masofaniten(EPI-7386)單一藥物表現出良好的安全性,耐受性良好,每日劑量為1200 mg(600 mg BID),達到了臨牀暴露目標,並且在經過大量預處理的mcRPC患者中顯示出抗腫瘤活性的初步信號。第二張海報介紹了馬索法尼特(EPI-7386)與安斯泰來和輝瑞的AR抑制劑恩雜魯胺聯合使用的1/2期試驗的初步結果。前三個隊列中有十名患者:隊列1中有三名患者(600 mg QD masofaniten(EPI-7386)和120 mg QD enzalutamide),隊列2中有四名患者(800 mg QD masofaniten(EPI-7386)和120 mg QD 恩扎魯胺),隊列3中的三名(600 mg BID masofaniten(EPI-7386)和120 mg QD 恩扎魯胺)。當時,隊列3的DLT期限尚未結束。在前兩個清除 DLT 期的隊列中,未觀察到 DLT,其安全性特徵與第二代抗雄激素(例如,疲勞和潮熱的 1 級或 2 級 AE)一致。來自隊列1和2的藥代動力學結果表明,恩雜魯胺暴露受馬索非尼特(EPI-7386)的影響微乎其微,而正如預期的那樣,恩雜魯胺(一種成熟的 CYP3A4 誘導劑)使馬索法尼特(EPI-7386)的暴露量減少了約60%。觀察到的masofaniten(EPI-7386)暴露量仍處於臨牀前異形圖研究所建議的臨牀相關範圍內。無論患者以前的化療狀態如何,在前兩組中註冊的六名可評估患者中,有五名顯示PSA降低了90%以上,六分之四的可評估患者PSA水平達到了90%
2022
2022年10月31日,公司宣佈,由於手術招募方面的挑戰,詹森研發部暫停了對mcRPC患者中使用阿帕魯他胺和馬索法尼特(EPI-7386)和醋酸阿比特龍加潑尼鬆的馬索非尼特()和潑尼鬆的1期臨牀研究的註冊。EPI-7386在一些患者中觀察到初步臨牀活性,三名患者中有兩名在12周內實現了90%的PSA降低(“PSA90”)。該公司正在與詹森討論為ESSA贊助的聯合研究提供醋酸阿比特龍和阿帕魯他胺。
2022年10月26日,該公司在第34屆EORTC-NCI-AACR分子靶標和癌症治療年度研討會上的海報發佈會上宣佈了其領先的第一代基於AR AniTen的Chimera(“ANITAC”™)NTD降解劑的臨牀前數據。
2022年10月26日,公司宣佈在2022年前列腺癌基金會科學務虛會上公佈了ESSA主要候選人馬索法尼汀(EPI-7386)聯合恩扎魯胺的1/2期研究的前兩組的最新臨牀數據。在這項多中心、開放標籤的1/2期劑量遞增研究中,七名對第二代抗雄激素不熟悉的mcRPC患者被納入前兩組,馬索法尼汀(EPI-7386)的劑量不斷增加,恩扎魯胺的固定劑量為120 mg,每天一次QD劑量的恩扎魯胺。該研究允許先進行一線化療。前兩個隊列的藥代動力學結果表明,恩扎魯胺暴露受masofaniten(EPI-7386)的影響微乎其微,而與恩雜魯胺共同給藥可減少masofaniten(EPI-7386)的暴露,但正如臨牀前異種移植研究所表明的那樣,仍處於臨牀相關範圍內。該組合的安全性良好,其安全性與第二代抗雄激素一致,未觀察到劑量限制毒性。第一組患者中的一名患者在給藥一個週期後停藥,原因是強效的 CYP3A 誘導劑伴隨藥物降低了對馬索法尼特(EPI-7386)和
32
目錄
恩扎魯胺,因此無法評估療效。其餘六名入組患者的抗腫瘤活性表明,其中六名患者中有四名在給藥 12 周後獲得了 PSA90,迄今為止,六名患者中有五名獲得了 PSA90。
2022年9月13日,公司任命菲利普·坎托夫為董事會成員。
2022年6月30日,公司宣佈為其總裁兼首席執行官戴維·帕金森及其執行副總裁兼首席運營官彼得·維爾西剋制定自動證券處置計劃。
2022年6月27日,公司通過電話會議和網絡直播介紹了masofaniten(EPI-7386)單一療法和聯合療法臨牀開發的最新臨牀情況。1a期劑量遞增研究的最新數據顯示,來自36名患者的初步數據表明,masofaniten(EPI-7386)耐受性良好,表現出良好的藥代動力學特徵,並在經過大量預處理的患者中顯示出初步的抗腫瘤活性。該公司認為,良好的安全性和耐受性、良好的藥物特性以及抗雄激素的生物學和抗腫瘤活性支持公司決定轉向早期療法,研究masofaniten(EPI-7386)與第二代抗雄激素的聯合療法。最新消息還指出,在經過大量預處理的人羣中進行ctDNA分子分析提供了遺傳變化的詳細概況,這揭示了晚期mcRPC患者的生物學複雜性,也允許繼續完善腫瘤仍主要由雄激素受體驅動,因此最有可能對雄激素受體抑制劑產生反應的前列腺癌患者羣體。
該更新詳細介紹説,在多中心、開放標籤的1a期劑量遞增研究中,31名患者以200毫克的增量從200毫克到1000毫克的隊列每天接受一次口服masofaniten(EPI-7386)作為口服片劑。該QD組的患者接受了大量的預治療,前列腺癌的先前治療中位數為七行,mcRPC的治療中位數為四行。將近60%的患者以前曾接受過化療。患者進入試驗時患有快速進展的疾病,PSA加倍時間中位數僅為2.1個月,ctDNA的中位數為29%即為明證。近三分之一的患者出現肺部、肝臟或腦部轉移,重疊的三分之一的患者出現明顯的神經內分泌分化。ctDNA分析顯示,這些患者的腫瘤具有廣泛的非增強現實相關基因組變化,這意味着存在多種與晚期前列腺癌相關的非增強現實致癌驅動因素。在修訂方案之後,還介紹了最初參加每日兩次劑量方案的 400 mg 和 600 mg BID 隊列的五名患者的經驗。該修正案排除了先前接受過三種以上療法治療的患者,排除了內臟轉移的患者,並且只允許先前接受過一線化療。
截至2022年6月1日,QD和BID患者的關鍵安全性結果顯示,masofaniten(EPI-7386)在測試的所有劑量水平和時間表中均安全且耐受性良好,沒有劑量限制毒性,與治療相關的不良事件僅限於1級或2級,一次3級貧血的發生最終被認為不太可能與治療有關,並且任何副作用都沒有明顯的劑量依賴性。
抗雄激素反應是通過循環PSA水平的變化、ctDNA水平的變化和疾病負擔的射線照相變化來評估的,這些變化是通過傳統的RECIST標準以及使用AIQ Solutions平臺進行總病變體積量化來衡量的。
截至2022年6月1日,QD和BID患者的主要反應發現表明,在患有可測量疾病且接受治療超過12周的10名患者中,有5名患者的腫瘤體積減少了。在沒有內臟疾病、非 AR 致癌途徑中 DNA 基因組畸變較少、治療線路少於 3 種的臨牀患者中觀察到 PSA 下降或 PSA 穩定。這為完善單一療法開發計劃的患者羣體提供了更多信息。在基線時具有可測ctDNA水平的17名患者中,觀察到攜帶AR點突變、AR增益/擴增和AR截斷的患者ctDNA下降,這表明masofaniten(EPI-7386)對這些腫瘤的潛在活性。
該更新還描述了計劃中的1b期研究、計劃中的機會之窗隊列以及馬索非尼特(EPI-7386)與恩雜魯胺聯合研究的現狀。1b期研究將評估患者羣體
33
目錄
的mcRPC與在1a期BID隊列下治療的mcRPC相似,但另外排除了先前的化療。每劑量/時間表(600 mg QD 和 400 mg 或 600 mg BID)將對多達 12 名患者進行評估,以獲得有關預治療程度較低的患者羣體中馬索法尼汀(EPI-7386)的安全性、耐受性、暴露和抗腫瘤活性的更多信息。
該更新還描述了計劃中的機會之窗隊列,這是1b期擴張的一部分,在該階段中,將單獨一組非轉移性CRPC納入一項為期12周的研究,其臨牀終點(即PSA變化),以評估masofaniten(EPI-7386)在該疾病主要由增強現實驅動且腫瘤生物學未受第二代抗雄激素療法影響的患者羣體中的抗腫瘤活性。
臨牀更新還提供了評估馬索非尼特(EPI-7386)與經批准的第二代抗雄激素的1/2期試驗中早期療法中馬索非尼特(EPI-7386)的組合研究的現狀。在瑪索非尼特公司(EPI-7386)與安斯泰來製藥公司和輝瑞公司的增強現實抑制劑恩扎魯胺聯合對未接受第二代抗雄激素治療的mcRPC患者進行的1/2期研究中,第一組已經清除了28天的DLT期,沒有出現安全問題,當報告時,該試驗目前正在招收第二批患者。恩雜魯胺的1/2期聯合試驗中第一個隊列的初步數據表明,根據預計具有活性的臨牀和臨牀前數據,這些藥物可以安全地聯合使用。除臨牀前研究外,早期數據還支持masofaniten(EPI-7386)與第二代抗雄激素聯合應用的潛力,可抑制雄激素受體生物學並誘發有效的抗腫瘤反應。
該公司還描述了預計將於2022年晚些時候啟動一項由研究人員贊助的2期新輔助研究,該研究將評估在接受前列腺切除術的高危侷限性前列腺癌患者中達洛他胺與馬索法尼特(EPI-7386)+達洛妥胺的對比。
在2022年4月10日的AACR年會上,該公司在一張題為 “雄激素受體(AR)N末端結構域降解劑可以降解CRPC臨牀前模型中的AR全長和AR剪接變體” 的海報中,公佈了其第一代基於雄激素受體(AR)AniTen的Chimera(ANITAC™)N末端結構域(NTD)降解劑的臨牀前數據。臨牀前數據表明,ESSA的ANITAC降解劑有可能成為抑制增強現實途徑的新方法。AR 的 NTD 區域本質上是無序的,這意味着人們普遍認為它是不可藥物的。臨牀前研究表明,AniTACs通過其與AR的NTD結合的獨特能力,能夠抑制NTD介導的AR轉錄,同時還能降解AR蛋白,包括通常與CRPC相關的耐藥性AR。臨牀前結果表明,ANITAC 降解劑利用泛素蛋白酶體系統,可以降解多種形式的 AR,包括通常在 CRPC 患者中表達的全長、突變體和剪接變體。具體而言,ANITAC 降解劑在抑制 AR-FL、AR-V7 或 AR-v567E 驅動的 AR 轉錄活性方面表現出強大的效力。此外,口服生物利用的ANITAC降解劑在抑制AR依賴性轉錄和降低AR依賴性前列腺癌細胞活力方面表現出高效力。該公司繼續設計和測試ANITAC降解劑,重點是提高選擇性。
2022年1月19日,公司宣佈在公司贊助的1/2期研究中首次給藥患者,該研究旨在評估ESSA的主要候選產品masofaniten(EPI-7386)(一種同類首創的N末端雄激素受體抑制劑)與安斯泰來和輝瑞公司的配體結合域雄激素受體抑制劑恩扎魯胺聯合對mzalutamide患者的安全性、耐受性和初步療效 CRPC。該聯合試驗研究了在治療尚未接受第二代抗雄激素藥物治療的mcRPC患者時,通過兩種獨立途徑抑制雄激素受體的潛在臨牀益處。在臨牀前模型中,masofaniten(EPI-7386)與lutamides通過同時靶向AR的兩端進行組合,可對雄激素生物學產生更深、更廣泛的抑制。
1/2期臨牀試驗(NCT05075577)是一項由兩部分組成的研究。第一階段評估藥物組合的安全性和耐受性,以確定馬索法尼特(EPI-7386)和恩雜魯胺聯合給藥時的推薦劑量範圍。該研究的這一階段預計將招收多達30名尚未接受第二代抗雄激素療法治療的mcRPC患者。如下文所述,2022年6月27日公佈了第一個隊列的初步經驗結果,證明瞭該組合在第一組隊列中的安全性和耐受性,以及隨之而來的藥代動力學和PSA還原信息。在第二階段,單劑恩雜魯胺是
34
目錄
相比之下,在同一患者羣體中聯合使用恩扎魯胺和馬索法尼特(EPI-7386)。第二階段的目標是評估masofaniten(EPI-7386)與固定劑量的恩雜魯胺聯合使用與作為單一藥物的恩雜魯胺相比的安全性、耐受性和抗腫瘤活性。該研究的這一部分預計將招收120名尚未接受第二代抗雄激素療法治療的mcRPC患者。
未來臨牀開發計劃
治療CRPC患者的2/3期臨牀試驗設計
聯合療法開發
該公司開發的大量臨牀前數據,以及持續出現的證據表明,儘管前列腺癌的早期階段由增強現實途徑驅動更為均勻,但該疾病的後期階段在生物學上要複雜得多。該公司正在將masofaniten(EPI-7386)與目前的抗雄激素聯合用於早期患者,這反映在與領先製藥公司建立的多項臨牀試驗合作中。在證明瞭將masofaniten(EPI-7386)與每種抗雄激素結合的實際能力之後,進一步的臨牀開發將需要在早期的患者羣體(可能包括從新診斷到非轉移性和轉移性激素敏感或最新一代之前的抗雄激素CRPC人羣)中進行隨機臨牀試驗。
單一代理開發
根據1期研究的結果,可能會進行一項2期單臂臨牀試驗,評估masofaniten(EPI-7386)作為單一藥物在更多生物學特徵的mcRPC患者中的活性。儘管尚未正式作出是否進行此類審判的決定,但開始進行這樣的審判將取決於幾個因素。與決定進行此類試驗相關的考慮因素與公司識別那些在使用一種或另一種晚期抗雄激素後仍患有以增強現實為主的腫瘤的患者的能力以及該患者羣體的規模有關。我們在進行1期劑量遞增試驗期間的經驗表明,許多此類患者的腫瘤將主要由其他致癌因素驅動。那些腫瘤仍然主要由增強現實驅動的患者是最有可能在臨牀上從Aniten療法中受益的人羣,而這一人羣的規模將影響是否採取單一藥物註冊策略的決定。
為了最終獲得全面的單一藥物監管批准,該公司預計至少需要進行一項3期臨牀試驗,最有可能的患者與計劃中的1/2期臨牀試驗的mcRPC患者羣體相似。但是,1/2期臨牀試驗的結果也可能表明,根據抗腫瘤反應和生物標誌物評估,對初始患者羣體進行了修改。在一項3期臨牀試驗中,與接受標準護理的患者相比,關鍵終點預計是無進展存活率或總存活率。預計這樣的3期臨牀試驗將在全球多個地點進行。
競爭
前列腺癌市場的競爭非常激烈,我們與之競爭或將來可能與之競爭的許多公司在研發、製造、臨牀前測試、進行臨牀試驗、獲得監管部門批准和銷售批准產品方面的財務資源和專業知識要比我們多得多。製藥和生物技術行業的合併和收購可能導致更多的資源集中在少數競爭對手身上。幾種藥物療法已經獲得批准,許多新分子正在測試其對該患者羣體的作用。此外,Zytiga(醋酸阿比特龍)的仿製藥現已獲得批准並在美國上市。
35
目錄
目前批准的療法包括:
通用/程序 | 品牌名稱 | 公司名 | 舞臺 | |||
恩扎魯胺 | Xtandi | 安斯泰來和輝瑞 | 已上市 | |||
醋酸阿比特龍 | Zytiga | 強生公司 | 已上市 | |||
醋酸阿比特龍 | Yonsa | 太陽製藥 | 已上市 | |||
Sipuleucel-T | Provenge | Valeant | 已上市 | |||
多西他賽 | 不適用 | 賽諾菲和各種 | 已上市 | |||
Cabazitaxel | 傑夫塔納 | 賽諾菲 | 已上市 | |||
鐳-233 | Xofigo | 拜爾 | 已上市 | |||
阿帕魯胺 (ARN-509) | Erleada | 強生公司 | 已上市 | |||
達魯他胺 | 努貝卡 | 拜爾 | 已上市 | |||
Pembrolizumab | 凱特魯達 | 默沙東 | 已上市 | |||
奧拉帕里布 | Lynparza | 阿斯利康 | 已上市 | |||
魯卡帕裏 | Rubraca | 克洛維斯腫瘤學 | 已上市 | |||
Vipivotide tetraxetan | Pluvicto | 諾華 | 已上市 | |||
Niraparib/醋酸阿比特龍 | Akeega | 強生公司 | 已上市 | |||
塔拉扎帕尼(含恩雜魯胺) | Talzenna | 輝瑞公司 | 已上市 |
ESSA認為,在這個市場中,其競爭地位很強,因為其候選產品如果成功,將涉及一種機制獨特、差異化的前列腺癌治療方法,該方法涉及的治療模式已被證明對復發前列腺癌患者的存活率產生最大的影響:阻斷增強現實激活。由於Anitens已被證明可以直接與AR-NTD結合並阻止AR介導的轉錄,因此它們有可能繞過當前針對AR LBD的激素相關療法進行治療後可能出現的AR依賴性耐藥途徑(如上所述)。ESSA認為,如果成功,這可能是前列腺癌治療向前邁出的重要一步。據ESSA所知,目前沒有其他AR-NTD拮抗劑正在進行前列腺癌或任何其他適應症的臨牀試驗。幹擾增強現實信號的其他方法包括降低增強現實的潛在補充策略,例如Arvinas, Inc.正在採用的策略。
專利和專有權利
與 UBC 和 BCCA 簽訂的許可協議
ESSA擁有許可的知識產權,具體體現在已頒發的專利、待處理的專利申請以及與調節增強現實活性的化合物相關的專有技術中。ESSA將這些知識產權稱為 “許可知識產權”。
公司是2010年12月22日與不列顛哥倫比亞省癌症管理局和不列顛哥倫比亞大學(“許可方”)簽訂的許可協議的當事方,該協議於2011年2月10日、2014年5月27日和2021年5月25日修訂,該協議為公司提供了基於許可知識產權開發和商業化產品的全球獨家權利。
ESSA在2017年、2018年和2019年支付的最低年度特許權使用費為8.5萬加元,此後必須繼續每年支付最低8.5萬加元的特許權使用費。對於進入臨牀開發的第一種化合物,在患者參與2期臨牀試驗時支付了50,000加元。此外,在患者參與3期臨牀試驗時,必須支付900,000加元。
許可方可以在ESSA破產時終止許可協議,或者任何一方都可能因另一方的某些重大違規行為而終止許可協議。ESSA必須為許可知識產權的開發和商業化分配合理的時間,並做出合理的努力來推廣、營銷和銷售許可知識產權所涵蓋的產品。許可協議的條款要求ESSA向許可方簽發,
36
目錄
1,000,034股合併前的普通股,以代替支付初始許可費。如果ESSA將來開發受許可知識產權保護的產品,則需要為根據許可開發的第一種藥物產品支付一定的開發和監管里程碑付款,總額為240萬加元,為後續每種產品支付最高51萬加元的款項。ESSA還必須根據許可知識產權所涵蓋產品的全球淨銷售總額和低年級再許可收入的百分比,向許可方支付較低的個位數特許權使用費。許可協議將在許可協議簽訂之日或許可知識產權中包含的最後一次頒發的專利到期後的20年內到期,以較晚者為準。
ESSA的知識產權戰略
該公司目前保留其Aniten系列藥物組合的所有商業權利,並認為其已經為Aniten結構類別建立了強大的防禦性知識產權地位。ESSA已向許可方許可了其某些調節增強現實活性的化合物的某些專利權。ESSA有權在向許可人支付特定款項後獲得許可專利和專利申請的所有權,前提是繼續支付許可協議所要求的款項。
截至2023年12月,ESSA擁有一項專利組合的權利,其中包括71項已頒發的專利,包括19項已頒發的美國專利,這些專利已生效,涵蓋具有不同結構圖案/類似物的多種EPI和Aniten結構類別。美國和Aniten下一代NTD抑制劑專利合作條約的締約國也在等待專利申請,預計到期日期為2036年至2043年之間。
專利組合包括已頒發的有效專利和待處理的專利申請,這些專利涵蓋了馬索非尼特(EPI-7386)化合物、包含馬索非尼特(EPI-7386)化合物的藥物組合物或其使用方法,預計將在到期日(2036年至2043年)之前提供保護。
ESSA和更廣泛的製藥行業都非常重視專利,以保護新技術、產品和工藝。因此,ESSA的成功在一定程度上取決於其獲得專利或相關權利、保護商業祕密和在不侵犯第三方權利的情況下開展活動的能力。可能會出現有關公司或許可人專利的發明權和/或所有權權益的爭議,包括例如,公司的前任或現任員工,或尋求公司擁有或許可的專利的所有權的許可人。公司影響許可方與其僱員或前僱員之間的任何內部糾紛的能力可能有限。參見”風險因素” 在我們的10-K表年度報告中。在適當的情況下,在符合管理層目標的情況下,ESSA將繼續就其認為重要的技術組件或概念尋求專利。
監管環境
ESSA候選產品和潛在的未來候選產品的生產和製造及其研發活動受全球各政府機構對安全性、有效性、質量和道德的監管。在美國,藥品和生物製品受美國食品和藥物管理局的監管。在加拿大,這些活動受《食品和藥品法》及其相關規則和條例的監管,這些規則和條例由TPD執行。藥品批准法要求在批准銷售藥品之前,對生產設施進行註冊,嚴格控制候選產品的研究和測試,政府審查和批准實驗結果。監管機構還要求在任何藥品的製造、測試和臨牀開發中分別遵循嚴格的具體標準,例如cGMP、良好實驗室規範(“GLP”)和當前的良好臨牀規範(“GCP”)。參見”風險因素” 在我們的10-K表年度報告中。
獲得監管部門批准和相應遵守適當的聯邦、州、地方和外國法規和條例的過程需要花費大量的時間和財政資源。在產品開發過程、批准過程或批准後的任何時候未能遵守適用的美國要求可能會使申請人或贊助人受到各種行政或司法制裁,包括食品和藥物管理局拒絕批准待處理的申請、撤回批准、實施臨牀擱置、發出警告信和其他類型的執法信函、產品召回、產品沒收、全部或部分暫停生產或
37
目錄
分配、禁令、罰款、拒絕政府合同、歸還、挪用利潤,或由食品和藥物管理局和司法部或其他政府實體提出的民事或刑事調查和處罰。
藥品開發流程
尋求批准在美國銷售和分銷新藥產品的申請人通常必須採取以下措施:
| ● | 根據實驗動物人道使用和配方研究(包括GLP)的適用要求,完成廣泛的非臨牀(有時稱為臨牀前實驗室測試)和臨牀前動物試驗; |
| ● | 向美國食品和藥物管理局提交IND,該IND必須在人體臨牀試驗開始之前生效; |
| ● | 在啟動每項臨牀試驗之前,由代表每個臨牀場所的機構審查委員會(“IRB”)批准; |
| ● | 根據美國食品和藥物管理局的法規(通常稱為GCP法規)以及保護人類研究對象及其健康信息的任何其他要求,進行充分且控制良好的人體臨牀試驗,以確定擬議藥物產品在其預期用途上的安全性和有效性; |
| ● | 準備並向美國食品和藥物管理局提交新藥申請(“NDA”); |
| ● | 在適當或適用的情況下,由美國食品和藥物管理局諮詢委員會對產品進行審查; |
| ● | 令人滿意地完成美國食品和藥物管理局對生產該產品或其組件的製造設施進行的一次或多次檢查,以評估是否符合cGMP要求,並確保設施、方法和控制措施足以保持產品的特性、強度、質量和純度; |
| ● | 支付用户費用並確保保密協議獲得美國食品和藥物管理局的批准;以及 |
| ● | 遵守任何批准後的要求,包括FDA要求的風險評估和緩解策略(“REMS”)和批准後研究。 |
臨牀前研究
進行了臨牀前研究 體外並在動物體內評估藥代動力學、新陳代謝和可能的毒性作用,以便在臨牀研究和整個開發過程中將候選產品應用於人體之前,為候選產品的安全性提供證據。臨牀前研究的進行受聯邦法規和要求的約束,包括GLP法規。臨牀前測試結果,以及製造信息、分析數據、任何可用的臨牀數據或文獻以及臨牀研究計劃等,作為臨牀研究的一部分提交給美國食品和藥物管理局。一些長期的臨牀前試驗,例如生殖不良事件和致癌性的動物試驗,可能會在提交IND後繼續進行。
開始人體測試
臨牀試驗涉及根據GCP要求在合格研究人員的監督下向人類受試者提供研究產品,其中包括要求所有研究對象在參與任何臨牀試驗之前以書面形式提供知情同意。臨牀試驗是根據書面試驗協議進行的,其中詳細説明瞭試驗的目標、用於監測安全性的參數以及待評估的有效性標準等。每項臨牀試驗的協議和任何後續方案修正案都必須作為 IND 的一部分提交給 FDA。IND 在獲得 FDA 後 30 天自動生效,除非在此之前 FDA 提出與擬議臨牀試驗相關的擔憂或疑問,並將該試驗置於臨牀暫停狀態。在這種情況下,IND發起人和FDA必須解決任何懸而未決的問題,然後才能開始臨牀試驗。在加拿大,此應用程序稱為CTA。在人體臨牀試驗開始之前,必須提交IND/CTA申請並獲得美國食品藥品管理局或TPD的接受(如適用)。此外,代表參與臨牀試驗的每個機構的IRB必須在任何臨牀試驗的計劃開始之前對其進行審查和批准,並且IRB必須至少每年進行一次持續審查並重新批准該試驗。IRB 必須審查
38
目錄
除其他外, 批准向試驗對象提供試驗協議和知情同意信息.IRB 的運作必須符合 FDA 的規定。
影響臨牀試驗進展速度的兩個關鍵因素是患者參與研究計劃的速度,以及該藥物旨在治療的疾病目前是否有有效的治療方法。患者入組在很大程度上取決於疾病的發病率和嚴重程度、可用的治療方法、待測藥物的潛在副作用以及監管機構可能對入組施加的任何限制。
1 期臨牀試驗
癌症療法的1期臨牀試驗通常對少數患者進行,以評估安全性、劑量限制毒性、耐受性、藥代動力學,並確定人體2期臨牀試驗的劑量。
2 期臨牀試驗
與1期臨牀試驗相比,2期臨牀試驗通常涉及更多的患者羣體,旨在確定可能的不良反應和安全風險,初步評估候選產品對特定靶向疾病的療效,並確定劑量耐受性、最佳劑量和給藥時間表。
三期臨牀試驗
第三階段臨牀試驗通常涉及在更多患有靶向疾病或疾病的患者身上測試實驗藥物,以ESSA為例,CRPC。這些研究涉及在地理位置分散的試驗場所(多中心試驗)在擴大的患者羣體中測試實驗藥物,以確定臨牀安全性和有效性。這些試驗還產生信息,據此可以確定與藥物相關的總體風險收益關係。
在大多數情況下,FDA要求進行兩項充分且控制良好的3期臨牀試驗,以證明該藥物的療效。在極少數情況下,一項帶有其他確認性證據的單一3期試驗可能就足夠了,因為該試驗是一項大型的多中心試驗,顯示出內部一致性,而且在統計學上非常有説服力的發現,對死亡率、不可逆的發病率或預防具有臨牀意義的影響,而在第二項試驗中確認結果實際上或倫理上是不可能的。
新藥申請
假設成功完成所需的臨牀測試和其他要求,臨牀前和臨牀研究的結果以及與產品化學、製造、控制和擬議標籤等相關的詳細信息將作為保密協議的一部分提交給美國食品和藥物管理局,或作為新藥申報(“NDS”)的一部分提交給TPD,申請批准該藥物用於一種或多種適應症的銷售。然後,相關監管機構對NDS或NDA進行審查,以批准該藥物上市。
食品和藥物管理局在收到保密協議後的60天內對其進行初步審查,並在FDA收到申請後的第74天之前通知發起人,以確定該申請是否足夠完整,可以進行實質性審查。美國食品和藥物管理局可能會要求提供更多信息,而不是接受保密協議進行申報。在這種情況下,必須重新提交申請並提供其他信息。在FDA接受提交申請之前,重新提交的申請也需要接受審查。一旦申請獲準提交,美國食品和藥物管理局就會開始深入的實質性審查。美國食品和藥物管理局已同意在保密協議審查過程中明確的績效目標。大多數此類申請應在提交之日起十個月內進行審查,而大多數 “優先審查” 產品的申請應在提交後的九個月內進行審查。美國食品和藥物管理局可能會將審查程序再延長三個月,以考慮申請人提供的新信息或澄清,以解決FDA在最初提交後發現的突出缺陷。
39
目錄
在批准保密協議之前,美國食品和藥物管理局通常會檢查正在或將要生產該產品的設施。這些批准前檢查涵蓋與提交保密協議有關的所有設施,包括藥物成分製造(例如活性藥物成分)、成品製造和控制測試實驗室。除非美國食品和藥物管理局確定製造過程和設施符合cGMP要求,並且足以確保產品在規定的規格內持續生產,否則不會批准申請。此外,在批准保密協議之前,FDA通常會檢查一個或多個臨牀場所,以確保符合GCP。
準備和提交保密協議的成本是巨大的。大多數保密協議的提交還需要支付鉅額的申請使用費,目前超過250萬美元,批准的新藥申請下的製造商或贊助商還需要繳納鉅額的年度計劃和機構使用費。這些費用通常每年增加。
根據美國食品和藥物管理局對保密協議的評估和相關信息,包括對製造設施的檢查結果,食品和藥物管理局可能會簽發批准信或完整的回覆信。批准書授權該產品的商業營銷,其中包含針對特定適應症的具體處方信息。完整的回覆信通常會概述提交的缺陷,並且可能需要大量的額外測試或信息,以便FDA重新考慮申請。如果這些缺陷在重新提交的保密協議中得到了令FDA滿意的解決,FDA將簽發批准書。美國食品和藥物管理局已承諾在兩到九個月內審查此類重新提交的信息,具體取決於所含信息的類型。即使提交了這些額外信息,美國食品和藥物管理局最終仍可能決定該申請不符合批准的監管標準。
如果美國食品和藥物管理局批准某一產品,它可能會限制該產品的批准使用適應症,要求在產品標籤中包含禁忌症、警告或預防措施,要求進行批准後的研究,包括4期臨牀試驗,以進一步評估該藥物在批准後的安全性,要求測試和監督計劃在產品商業化後對產品進行監測,或施加其他條件,包括分銷限制或其他可能對潛在市場產生重大影響的風險管理機制,以及產品的盈利能力。美國食品和藥物管理局可能會根據上市後研究或監督計劃的結果阻止或限制產品的進一步銷售。批准後,對批准產品的許多類型的更改,例如添加新適應症、生產變更和其他標籤聲明,都需要接受進一步的測試要求和FDA的審查和批准。
批准後要求
根據美國食品和藥物管理局批准生產或分銷的藥物受美國食品和藥物管理局的全面和持續監管,包括與記錄保存、定期報告、產品抽樣和分銷、廣告和促銷以及報告產品不良體驗有關的要求等。批准後,對批准的產品進行重大更改,例如增加新的適應症或其他標籤聲明,需要事先經過FDA的審查和批准。此外,對於任何上市產品和生產此類產品的機構,還有持續的年度用户費要求,對於附有臨牀數據的補充申請,也需要繳納新的申請費。
此外,參與制造和分銷批准藥物的藥品製造商和其他實體必須向美國食品和藥物管理局和州機構註冊其機構,並定期接受美國食品藥品管理局和這些州機構的突擊檢查,以確保其遵守cGMP要求。製造過程的變更受到嚴格監管,通常需要事先獲得美國食品和藥物管理局的批准才能實施。美國食品和藥物管理局的法規還要求調查和糾正任何偏離cGMP的情況,並對贊助商和發起人可能決定使用的任何第三方製造商施加報告和文件要求。因此,製造商必須繼續在生產和質量控制領域花費時間、金錢和精力,以保持cGMP合規性。
一旦獲得批准,如果不遵守監管要求和標準,或者產品上市後出現問題,FDA可以撤回批准。稍後發現產品存在以前未知的問題,包括嚴重程度或頻率出乎意料的不良事件,或製造過程中的不良事件,或不符合監管要求,可能會導致對批准的標籤進行修改,以增加新的標籤
40
目錄
安全信息;實施上市後研究或臨牀試驗以評估新的安全風險;或根據REMS計劃實施分發或其他限制。其他潛在後果包括:
| ● | 限制產品的營銷或製造、產品完全退出市場或產品召回; |
| ● | 對批准後的臨牀試驗處以罰款、警告信或擱置; |
| ● | 美國食品和藥物管理局拒絕批准待批准的保密協議或對已批准的保密協議的補充,或暫停或撤銷產品許可證的批准; |
| ● | 產品扣押或扣押,或拒絕允許產品的進出口;或 |
| ● | 禁令或施加民事或刑事處罰。 |
美國食品和藥物管理局嚴格監管市場上產品的營銷、標籤、廣告和促銷。只能根據批准的適應症並根據批准的標籤的規定推廣藥物。美國食品和藥物管理局和其他機構積極執行禁止推廣標籤外用途的法律法規,被發現不當推廣標籤外用途的公司可能會承擔重大責任。
此外,處方藥產品的分銷受《處方藥銷售法》(PDMA)的約束,該法規範了聯邦一級藥品和藥物樣本的分配,併為各州藥品分銷商的註冊和監管設定了最低標準。PDMA和州法律都限制處方藥產品樣本的分發,並規定了確保分銷問責制的要求。
孤兒稱號和排他性
ESSA將來可能會為其候選產品尋求孤兒藥認定。根據《孤兒藥法》,如果一種藥品旨在治療一種罕見的疾病或病症,則美國食品和藥物管理局可以將其指定為 “孤兒藥”(通常是指在美國影響的人數少於20萬人,如果沒有合理的預期在美國開發和提供用於治療該疾病或病症的藥物產品的成本將從該產品的銷售中收回),則該藥品會被指定為 “孤兒藥”。在提交保密協議之前,公司必須申請孤兒產品認定。如果該請求獲得批准,美國食品和藥物管理局將披露該治療藥物的身份及其潛在用途。孤兒產品的指定不會在監管審查和批准程序中帶來任何好處,也不會縮短監管審查和批准過程的持續時間。
如果具有孤兒身份的產品首次獲得美國食品藥品管理局對其具有此類稱號的疾病或病症的批准,則該產品通常將獲得孤兒產品獨家經營權。孤兒產品排他性意味着,除非在某些有限的情況下,否則美國食品和藥物管理局在七年內不得批准同一產品的任何其他相同適應症的申請。競爭對手可能會因孤兒產品具有獨家經營權的適應症獲得不同產品的批准,並且可能獲得相同產品但適應症不同的批准。如果被指定為孤兒產品的藥物或藥品最終獲得的上市批准範圍大於其孤兒產品申請中指定的適應症,則可能無權獲得獨家經營權。
41
目錄
精選季度財務信息
下表列出了ESSA根據美國公認會計原則編制的過去八個季度中每個季度的未經審計的合併財務數據。截至目前,公司尚未獲得任何收入或宣佈分紅 2023年12月31日:
對於已結束的季度 | ||||||||||||
十二月三十一日 | 9月30日 | 6月30日 | 3月31日 | |||||||||
| 2023 |
| 2023 |
| 2023 |
| 2023 | |||||
研發費用 |
| $ | 5,376,764 |
| $ | 5,226,231 |
| $ | 6,271,186 |
| $ | 4,480,863 |
一般和行政 |
| 2,217,868 |
| 1,922,382 |
| 2,639,381 |
| 3,730,692 | ||||
綜合損失 |
| (5,944,198) |
| (5,479,603) |
| (7,256,184) |
| (7,119,354) | ||||
每股基本虧損和攤薄後虧損 |
| (0.14) |
| (0.12) |
| (0.17) |
| (0.16) | ||||
現金和現金等價物 | 35,344,517 | 33,701,912 | 38,466,991 | 44,300,677 | ||||||||
短期投資 | 106,775,273 | 114,374,489 | 114,001,923 | 112,743,037 | ||||||||
總資產 |
| 144,489,279 |
| 149,122,131 |
| 153,650,198 |
| 158,504,040 | ||||
長期負債 |
| 275,445 |
| - |
| - |
| 19,777 | ||||
營運資金 |
| 140,337,994 |
| 145,301,807 |
| 149,882,729 |
| 155,967,246 | ||||
對於已結束的季度 | ||||||||||||
十二月三十一日 | 9月30日 | 6月30日 | 3月31日 | |||||||||
| 2022 |
| 2022 |
| 2022 |
| 2022 | |||||
研發費用 |
| $ | 5,344,250 |
| $ | 4,351,494 |
| $ | 6,394,534 |
| $ | 7,649,459 |
一般和行政 |
| 2,519,119 |
| 2,769,678 |
| 2,895,542 |
| 3,817,370 | ||||
綜合損失 |
| (6,712,455) |
| (6,330,969) |
| (8,829,694) |
| (10,903,335) | ||||
每股基本虧損和攤薄後虧損 |
| (0.15) |
| (0.14) |
| (0.20) |
| (0.25) | ||||
現金和現金等價物 | 51,220,602 | 57,076,475 | 67,868,096 | 86,235,830 | ||||||||
短期投資 | 111,850,895 | 110,161,029 | 106,727,807 | 94,782,609 | ||||||||
總資產 |
| 165,003,340 |
| 169,505,295 |
| 175,660,846 |
| 182,609,005 | ||||
長期負債 |
| 48,274 |
| 76,418 |
| 111,273 |
| 145,268 | ||||
營運資金 |
| 161,652,689 |
| 166,748,942 |
| 171,150,678 |
| 178,353,354 | ||||
ESSA從未盈利,自成立以來一直出現淨虧損。截至三個月,ESSA的綜合虧損為5,944,198美元,虧損為6,712,455美元 2023年12月31日,分別是2022年。ESSA預計在可預見的將來將蒙受損失,並預計,隨着其候選產品的開發和尋求監管部門的批准,這些損失將增加。由於與產品開發相關的眾多風險和不確定性,ESSA無法預測支出增加的時間或金額,也無法預測何時或是否能夠實現或維持盈利能力。
42
目錄
截至2023年12月31日和2022年12月31日止三個月的經營業績
截至報告的任何期間均無收入。截至2023年12月31日的三個月,該公司的綜合虧損為5,944,198美元,而截至2023年12月31日的三個月的綜合虧損為6,712,455美元 2022年12月31日。ESSA各期支出和淨虧損的變化主要是由以下因素造成的:
研發支出
按性質劃分,研發費用包括以下主要支出:
三個月已結束 | ||||||
| 2023年12月31日 |
| 2022年12月31日 | |||
臨牀 |
| $ | 1,827,247 |
| $ | 1,379,393 |
臨牀前和數據分析 | 1,248,687 | 1,492,268 | ||||
工資和福利 |
| 649,702 |
| 576,912 | ||
基於股份的支付 |
| 526,241 |
| 791,192 | ||
製造業 |
| 423,116 |
| 843,151 | ||
合法專利和許可費 |
| 365,118 |
| 105,061 | ||
其他 |
| 124,715 |
| 28,628 | ||
諮詢 |
| 103,755 |
| 89,573 | ||
旅行及其他 |
| 71,717 |
| 38,072 | ||
特許權使用費 |
| 36,466 |
| - | ||
總計 |
| $ | 5,376,764 |
| $ | 5,344,250 |
截至三個月的總研發費用 2023年12月31日 為5,376,764美元,而截至三個月為5,344,250美元 2022年12月31日。截至三個月期間的研發費用 2023年12月31日 而2022年則反映了正在進行的馬索法尼坦(EPI-7386)臨牀試驗,該試驗於2020年7月開始。
產生了1,827,247美元(2022年至1,379,393美元)的臨牀成本,與公司臨牀研究機構開展馬索凡尼特(EPI-7386)1期臨牀試驗相關的支出。
產生了1,248,687美元(2022年至1,492,268美元)的臨牀前和數據分析成本,涉及對與1期研究相關的臨牀試驗數據進行藥代動力學數據分析的支出,以及臨牀前管道和Anitac化合物的研究。
由於臨牀前和臨牀工作人員數量的增加,工資和福利已增加到649,702美元(2022年-576,912美元)。
基於股份的支付費用為526,241美元(2022年至791,192美元),屬於非現金支出,與授予公司主要管理層和顧問的股票期權和員工股票購買權的價值有關。費用在扣除到期和沒收後確認與這些股票工具的授予和歸屬有關,並分配給與標的期權持有者活動相關的研發、一般和行政及融資支出。
423,116美元(2022年至843,151美元)的製造成本包括用於支持正在進行的臨牀試驗的masofaniten(EPI-7386)藥物供應的cGMP製造金額,以及圍繞公司masofaniten(EPI-7386)藥物特性的配方和化學工作所產生的成本。
該期間的合法專利和許可費總額為365,118美元(2022年至105,061美元)。該公司採取了分層專利戰略來保護其知識產權,因為製藥行業非常重視專利以保護新技術、產品和工藝。成本反映了持續的投資和相關維護費用的時間。該公司預計,將繼續對專利申請進行投資。
43
目錄
截至三個月的諮詢費用為103,755美元 2023年12月31日 (2022年-89,573美元)與合同項目管理服務有關。
一般和行政開支
一般和管理費用按性質包括以下主要開支:
三個月已結束 | ||||||
| 2023年12月31日 |
| 2022年12月31日 | |||
工資和福利 | $ | 765,455 | $ | 699,782 | ||
專業費用 |
| 396,236 |
| 175,612 | ||
保險 |
| 348,323 |
| 456,486 | ||
基於股份的支付 |
| 277,177 |
| 772,419 | ||
投資者關係 |
| 203,428 |
| 118,032 | ||
辦公、保險、IT 和通信 |
| 113,943 |
| 134,549 | ||
董事費 |
| 104,000 |
| 95,250 | ||
旅行及其他 |
| 101,065 |
| 63,740 | ||
監管費用和過户代理 |
| 50,007 |
| 63,664 | ||
諮詢和分包商費用 |
| 35,042 |
| - | ||
經營租賃負債和租金 |
| 30,296 |
| 3,366 | ||
增加短期投資 |
| (207,104) | (63,781) | |||
總計 |
| $ | 2,217,868 | $ | 2,519,119 | |
截至止三個月,一般和管理費用總額為2,217,868美元 2023年12月31日 相比之下,截至三個月為2519,119美元 2022年12月31日 幷包括與277,177美元(2022年至772,419美元)的股份支付相關的非現金支出。這筆非現金支出與分配給公司主要管理層和顧問的股票期權和員工股票購買權的價值有關。費用在扣除到期和沒收後確認與這些股票工具的授予和歸屬有關,並分配給與標的期權持有者活動相關的研發、一般和行政及融資支出。
由於公司員工人數的增加以及工資調整,工資和福利已增加到765,455美元(2022年至699,782美元)。
與正在進行的公司活動相關的法律和會計服務產生的專業費用為396,236美元(2022年至175,612美元)。
348,323美元(2022年至456,486美元)的保險費用與公司董事和高級管理人員的保險費用有關。
根據年費結構,向董事支付董事會成員的薪酬為104,000美元(2022年至95,250美元)的董事費。
44
目錄
流動性和資本資源
ESSA是一家臨牀階段的公司,目前不產生收入。
截至 2023年12月31日,該公司的營運資金為140,337,994美元(2023年9月30日——145,301,807美元)。終了三個月期間的業務活動 2023年12月31日 資金主要來自於2020年7月和2021年2月完成的融資的收益。在 2023年12月31日,該公司的可用現金儲備和短期投資為142,119,790美元(2023年9月30日——148,076,401美元),用於結算3530,895美元(2023年9月30日——3,495,071美元)的流動負債。在 2023年12月31日,該公司認為,它有足夠的資本來償還到期的債務,並執行超過十二個月的計劃支出。
由於多種因素,包括與未來臨牀前工作相關的成本以及利用合作合作或併購活動等戰略機會,ESSA的未來現金需求可能與現在的預期存在重大差異。將來,可能需要籌集更多資金。這些資金可能來自簽訂戰略合作安排、從國庫發行股票或替代融資來源等來源。但是,無法保證ESSA會成功籌集資金以繼續其業務活動。參見”風險因素” 在我們的10-K表年度報告中。
關鍵會計政策與估計
公司對未來做出估計和假設,這些估計和假設會影響報告的資產和負債金額。不斷根據歷史經驗和其他因素對估計和判斷進行評估,包括對未來事件的預期,這些預期在當時情況下被認為是合理的。將來,實際經驗可能不同於這些估計和假設。
如果變動僅影響變更期間,則將會計估算變動的影響納入變更期間的綜合收益;如果變更同時影響變更期間和未來時期,則將其納入變更期間和未來時期。
關鍵會計政策是那些在編制簡明合併中期財務報表時需要做出最重要的判斷和估計的政策。關鍵會計政策摘要載於2023年12月12日向美國證券交易委員會以及不列顛哥倫比亞省、艾伯塔省和安大略省證券委員會提交的截至2023年9月30日的年度合併財務報表附註3。
趨勢信息
ESSA是一家處於臨牀開發階段的公司,目前不產生收入。該公司專注於開發用於治療前列腺癌的小分子藥物。公司已獲得某些許可知識產權的許可。截至本10-Q表季度報告發布之日,沒有任何產品處於商業生產或使用狀態。該公司的財務成功將取決於其在臨牀前和臨牀階段到商業化階段繼續開發其化合物的能力。
資產負債表外安排
ESSA沒有未公開的重大資產負債表外安排,這些安排對其經營業績、財務狀況、收入或支出、流動性、資本支出或對投資者至關重要的資本資源具有或合理可能產生當前或未來影響。
出色的股票數據
截至2024年2月12日,我們的法定股本包括無限數量的普通股,每股沒有面值,其中44,238,147股已發行和流通,以及無限數量的優先股,每股沒有面值,沒有已發行和流通。截至2024年2月12日,根據全額現金行使,我們有292萬股普通股購買權證可發行292萬股普通股,6,705,629股普通股可發行
45
目錄
根據6,705,629股可行使的已行使股票期權,根據當時尚未行使的1,488,312份已發行期權可發行的1,488,312股普通股,沒有已發行的限制性股票單位。
安全港
參見”關於前瞻性陳述的警示説明” 在本季度報告的導言中。
46
目錄
第 3 項。關於市場風險的定量和定性披露
根據經修訂的1934年《證券交易法》(“交易法”)第12b-2條的定義,我們是一家規模較小的申報公司,無需提供本項目所要求的信息。
第 4 項。控制和程序
評估披露控制和程序
截至本10Q表季度報告所涉期末,我們的管理層在首席執行官兼首席財務官的參與下,評估了《交易法》第13a-15(e)條和第15d-15(e)條所定義的披露控制和程序的設計和運營有效性。我們的披露控制和程序旨在確保在 SEC 規則和表格規定的時間內記錄、處理、彙總和報告公司根據《交易法》提交或提交的報告中要求披露的信息。任何此類信息都將收集並酌情傳達給公司的管理層,包括其主要執行官和首席財務官,以便及時就所需的披露做出決定。
管理層認識到,任何控制和程序,無論設計和運作多麼完善,都只能為實現其目標提供合理的保證,管理層在評估可能的控制和程序的成本效益關係時必須作出判斷。根據我們對截至本報告所涉期末的披露控制和程序的評估,我們的首席執行官兼首席財務官得出結論,截至該日,我們的披露控制和程序在設計和運作中均在合理的保證水平上有效。
管理層關於財務報告內部控制的年度報告
我們的管理層在首席執行官和首席財務官的參與下,負責根據《交易法》第13a-15(f)條和第15d-15(f)條的規定,對我們的財務報告建立和維持適當的內部控制。
任何財務報告內部控制系統,包括我們的系統,其有效性都受到固有的限制,包括在設計、實施、運作和評估控制和程序時行使判斷力,以及無法完全消除不當行為。因此,任何財務報告內部控制體系,包括我們的系統,無論設計和運作多麼良好,都只能提供合理而非絕對的保證。此外,對未來時期任何有效性評估的預測都可能面臨這樣的風險:由於條件的變化,控制措施可能變得不充分,或者對政策或程序的遵守程度可能下降。截至目前,管理層已經評估了我們對財務報告的內部控制的有效性 2023年12月31日。在進行評估時,管理層使用了特雷德韋委員會贊助組織委員會發布的內部控制——綜合框架(2013年COSO框架)中規定的標準來評估我們對財務報告的內部控制的有效性。根據這項評估,管理層得出結論,我們對財務報告的內部控制自那時起是有效的 2023年12月31日.
財務報告內部控制的變化
在截至本季度,我們對財務報告的內部控制沒有變化 2023年12月31日 對我們對財務報告的內部控制產生了重大影響或有合理可能產生重大影響的內容。
47
目錄
第二部分。其他信息
第 1 項。法律訴訟
我們可能會不時參與法律訴訟或受到普通情況下產生的索賠 我們的業務方向。截至 2023年12月31日,我們不是任何法律訴訟的當事方,我們的管理層認為,如果對我們作出不利的決定,這些訴訟將對我們的業務、財務狀況、經營業績或現金流產生重大不利影響。無論結果如何,由於辯護和和解成本、管理資源的轉移和其他因素,訴訟都可能對我們產生不利影響。
第 1A 項。風險因素
與截至2023年9月30日止年度的10-K表年度報告中披露的風險因素相比,我們的風險因素沒有重大變化。
第 2 項。未註冊的股權證券銷售和所得款項的使用
沒有。
第 3 項。優先證券違約
沒有。
第 4 項。礦山安全披露
不適用。
第 5 項。其他信息
在截至2023年12月31日的三個月中,公司沒有董事或高級管理人員採用或終止S-K法規第408(a)項中每個術語定義的 “第10b5-1條交易安排” 或 “非規則10b5-1交易安排”。
48
目錄
第 6 項。展品
展品編號
3.1 | 已修正 ESSA Pharma Inc. 的公司章程(參照公司附錄 1 納入)20-F 表格上的註冊聲明 (文件編號 377-00939),最初於 2015 年 2 月 24 日向美國證券交易委員會提交) |
4.1 | 普通股證書樣本(參照註冊人於2018年5月18日向委員會提交的S-8表格註冊聲明附錄4.1納入(文件編號 333-225056)) |
31.1 | 根據經修訂的1934年《證券交易法》第13a-14(a)條對首席執行官進行認證 |
31.2 | 根據經修訂的1934年《證券交易法》第13a-14(a)條對首席財務官進行認證 |
32.1 | 首席執行官兼首席財務官根據《美國法典》第 18 章第 1350 條以及 2002 年《薩班斯-奧克斯利法案》第 906 條補充的認證 |
101.INS | 行內 XBRL 實例文檔 — 該實例文檔不出現在交互式數據文件中,因為其 XBRL 標籤嵌入在內聯 XBRL 文檔中。* |
101.SCH | 內聯 XBRL 分類擴展架構文檔 * |
101.CAL | 內聯 XBRL 分類擴展計算 Linkbase 文檔* |
101.LAB | Inline XBRL 分類擴展標籤 Linkbase 文檔* |
101.PRE | Inline XBRL 分類學擴展演示文稿 Linkbase 文檔* |
101.DEF | Inline XBRL 分類擴展定義 Linkbase 文檔* |
104 | 公司截至2023年9月30日止年度的10-K表年度報告的封面頁,格式為行內XBRL(包含在附錄101中)。 |
* 隨函提交。
49
目錄
簽名
根據1934年《證券交易法》第13條或第15(d)條的要求,註冊人已正式促使經正式授權的下列簽署人代表其簽署本報告。
日期:2024 年 2 月 13 日
ESSA P哈爾瑪INC。 | ||
(註冊人) | ||
來自: | /S/ D狂熱的帕金森 | |
姓名: | 大衞帕金森 | |
標題: | 首席執行官 | |
來自: | /S/ D狂熱的木頭 | |
姓名: | 大衞伍德 | |
標題: | 首席財務官 | |
50