
附錄 99.1

2024年2月納斯達克:NRSN

前瞻性陳述本演講和就本演示主題所作的口頭陳述包含聯合國所指的 “前瞻性陳述”。S。1995 年的《私人證券訴訟改革法》,涉及重大風險和不確定性。除歷史事實陳述外,本演示文稿中包含的所有陳述,包括我們的業務戰略以及未來運營的計劃和目標,包括我們的財務業績,均為前瞻性陳述。“預期”、“相信”、“繼續”、“估計”、“期望”、“打算”、“可能”、“將” 等詞語以及類似的表述旨在識別前瞻性陳述。我們的這些前瞻性陳述主要基於我們當前對未來事件和趨勢的預期和預測,我們認為這些事件和趨勢可能會影響我們的財務狀況、經營業績、業務戰略、短期和長期業務運營和目標以及財務需求。本演講中的前瞻性陳述包括關於報告ALS 2b期臨牀試驗的神經絲和生物標誌物結果的時間以及其他臨牀和監管里程碑的陳述,包括目標市場和候選產品的機會;我們對競爭優勢的期望;候選產品的計劃開發時間表;以及候選產品的臨牀前和臨牀試驗結果的特徵。前瞻性陳述受許多風險和不確定性的影響,僅代表我們截至演示之日的觀點。本演示文稿中討論的未來事件和趨勢可能不會發生,實際結果可能與前瞻性陳述中的預期或暗示存在重大不利差異,這是由於我們的ALS 2 b期臨牀試驗延遲報告神經絲和生物標誌物結果、其他臨牀和監管里程碑的延遲以及任何候選產品的開發和商業潛力等原因。有關影響公司的風險和不確定性的更多信息,載於2023年3月22日向美國證券交易委員會提交的20-F表年度報告以及公司隨後向美國證券交易委員會提交的文件中的 “風險因素” 標題下。無論是由於新信息、未來事件還是其他原因,我們都沒有義務或義務更新這些前瞻性陳述中包含的信息。本演示文稿中的商標是其各自所有者的財產,僅用於信息和教育目的。2

NeuroSense 亮點為未得到滿足的高需求神經退行性疾病開發新療法 ALS 1的2b期研究的重大結果預計會有更多催化劑:神經絲成果(2024年第一季度)生物標誌物結果(2024年上半年)與大型製藥公司的現有合作伙伴關係,並於2024年第二季度前獲得全額資助 1 ALS——肌萎縮性側索硬化症,也稱為盧·格里格氏病 3

重點管道疾病,治療選擇有限,商業機會大 ALS • nFl 1(2024 年第 1 季度)• 生物標誌物數據(2024 年第 1 季度)發現臨牀前 1 期 2 期 3 期新藥上市適應症下一個里程碑帕金森氏症 • 探索潛在的共同開發阿爾茨海默氏症 • 完成第 2 期入組(2024 年第 2 季度)1 nFl:Neurofilament 4

到2040年,美國和歐盟的患者人數將增長約24% NeuroSense的計劃目標市場中有超過8萬名ALS患者 2 + 5,000例肌萎縮性側索硬化症每年新發病例(美國)1 3 年度市場機會約30億美元 1 約翰·霍普金斯醫學 2 預計從2015年到2040年肌萎縮性側索硬化症將增加,自然通訊,2016年 3 管理層估計 ALS 是一種無法治癒的神經退行性疾病,最終導致完全癱瘓診斷後 2-5 年內死亡 5

Celecoxib是一種獨特的協同配方,具有強效的非甾體抗炎藥,可降低:• 神經炎症 • 穀氨酸興奮毒性 • 氧化應激環丙沙星——一種可調節:• microRNA 合成 • 鐵積累 PrimeC 是一種新配方,由兩種經美國食品藥品管理局批准的藥物的特定劑量組成,旨在協同作用在 ALS PrimePrime中的多個靶標上 c 對導致 ALS 6 中神經元死亡的途徑的影響

協同效益:體外和體內這一發現歸因於塞來昔布阻斷了神經元中環丙沙星的退出 PrimeC 的組合(塞來昔布 + 環丙沙星)在齧齒類動物腦組織中保持較高的濃度更長時間,與單獨使用環丙沙星相比 *** 7 協同作用模式改善藥代動力學(PK)概況

* = p

健康的 ALS ALS + PrimeC PrimeC 在體內表現出統計學上的顯著療效 1。提高了電機性能健康控制 mSOD 1 ALS 模型 mSOD 1 ALS +PrimeC 2。恢復的神經元結構 ALS + PrimeC

兩種化合物的同步 PK 譜有可能最大限度地發揮它們之間的協同作用 PrimeC 獨特配方誘導同步的 PK 曲線 10 0 2 4 6 8 10 12 0 500 1000 1500 2500 2500 2500 時間 (h) c o n c e n t r a t i o n (n g/m l) primeC 環丙沙星 primeC celecoxib ref celecoxib Ref celecoxib PK 對人類的剖面研究同步峯值紅外最大值 T 最大值 ER T 最大值 ER Tmax 翻了一倍 IR Tmax

這些結果促使NeuroSense開始了一項2b期臨牀研究,使用了經過改進的PrimeC延期釋放配方,肌萎縮性側索硬化症相關生物標誌物的顯著變化耐受性良好,無藥物相關SAE減少功能和呼吸衰退 NST 002 15 名患者開放——PrimeC 的標籤中間配方 12 個月給藥每 3 個月就診一次 1.5 個月地點:特拉維夫蘇拉斯基醫療中心 PrimeC 符合主要終點第二階段的探索性終點(一項研究 11)
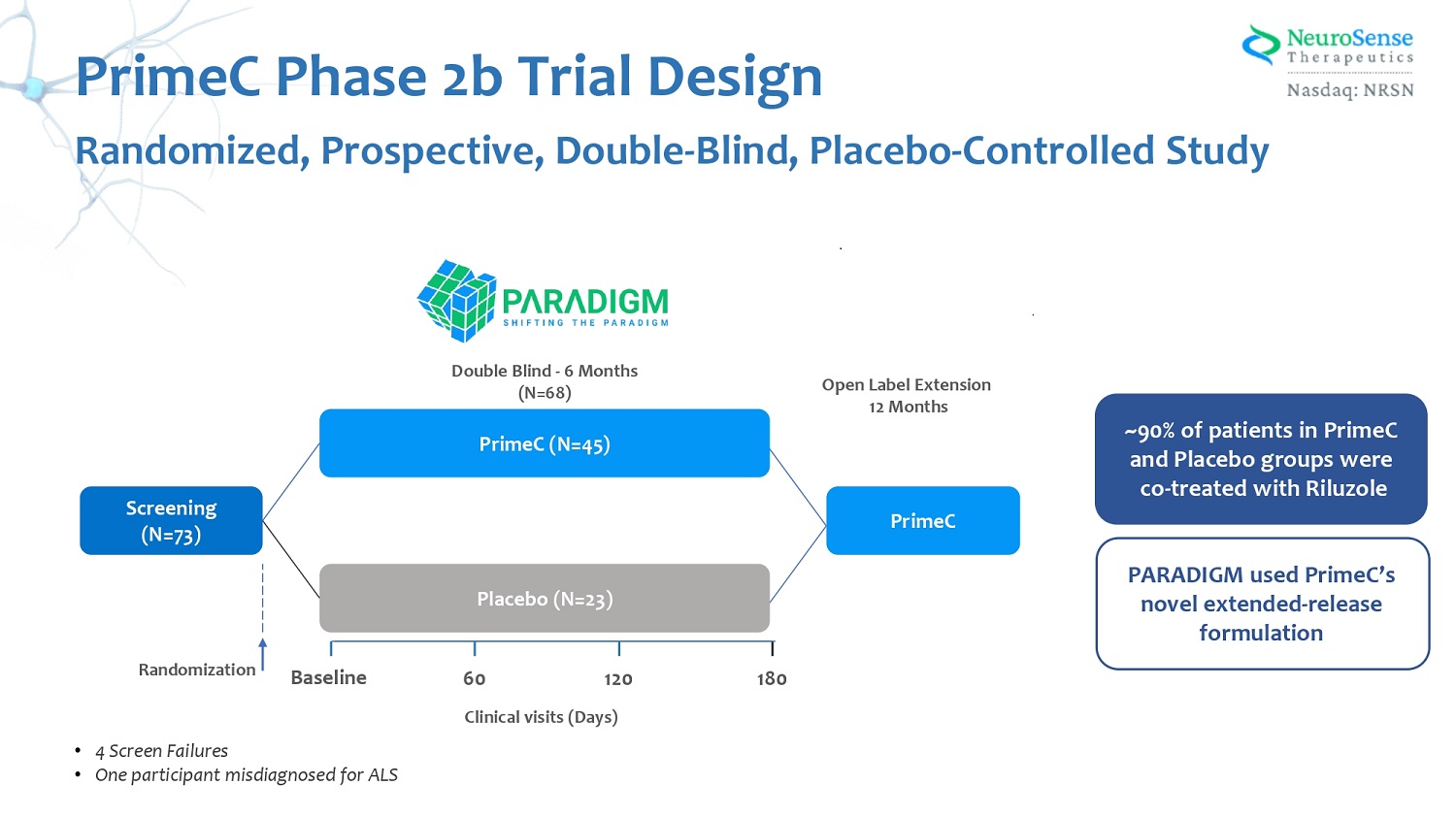
篩查(N= 73)PrimeC(N= 45)安慰劑(N= 23)基線 180 60 120 次臨牀就診(天)雙盲-6 個月(N= 68)PrimeC 開放標籤延期 12 個月 ~ 90% 的 PrimeC 和安慰劑組患者接受了 Riluzole PARADIGM 的聯合治療,使用 P rimeC 的新型延期釋放配方 PrimeC 2 b 期試驗設計隨機、前瞻性雙盲、安慰劑對照研究 • 4 次篩查失敗 • 一名參與者誤診為 ALS 隨機分組

主要終點 • 安全性和耐受性衡量標準 • ALS-TDP-43 和 ProstaglandinJ 2 的標誌性生物標誌物指標(預計結果 2024 年上半年)次要療效終點 • ALSFRS-R(ALS 功能評級量表)• SVC(慢生命容量)• PROMIS-10 生活質量問卷 • 無併發症生存探索終點 • King's/ Mitos • 神經絲(預計結果 2024 年第 1 季度)PRImast MEC 第 2 階段 b 試驗終點

PrimeC 第 2 階段 b 期研究納入/排除納入標準 • 18 至 75 歲的男性或女性 • 家族性或散發性肌萎縮性側索硬化症的診斷 • 篩查前疾病持續時間少於 30 個月 • 入組前 ALSFRS-R 從發病開始的斜率 ≥ 0. 3 個百分點 • ALSFRS-R 篩查 ≥ 25 時的 R • ALSFRS 第 3 項(吞嚥)-R ≥ 3 受試者可與利魯唑和/或依達拉豐和/或苯丁酸鈉/TUDCA 並行治療 • 直立慢肺活量 (SVC) ≥ 60% • 18

PrimeC 2b 期研究 ITT 和 PP 預先指定分析 PP (N= 62) ITT (N= 68) n=43 n=45 primeC n=19 n=23 安慰劑治療意向 (ITT) 和 Per Protocol (PP) 均為研究中的預先指定分析 ITT 評估治療對所有參與研究的患者的影響,而 PP 分析僅包括嚴格遵守研究方案的患者 1 兩者分析是有效的,但是 PP 最能回答的問題是,接受治療對一組患者有何影響,而將治療分配給一組患者會產生什麼影響患者 1 1 Tripepi G、北卡羅來納州 Chesnaye、Dekker FW、Zoccali C、Jager KJ。臨牀試驗中的治療意圖和按方案進行分析。Neph rol ogy。2020;25:513 — 517。15 分析預定義人羣

PrimeC 2b 期研究:入學人數均衡的男性女性年齡身高 (cm) 體重指數 (kg) BMI (kg/m 2) TRICALS 風險概況接受背景肌萎縮性側索硬化症治療的患者 PP 分析(PrimeC= 43;安慰劑 19)ALSFRS-R 基線時預測的 SVC 百分比安慰劑 n= 23 60.9% 39.1% 54.9 171.2 24.0-4.4% 37.9 87% 37.9 83.9 PrimeC n=45 60.0% 40.0% 59.1 170.8 70.6 24.1-4.2 91% 37.9 89.4 16

安慰劑(N=2 3)PrimeC(N=45)所有不良事件摘要 65.2% 68.9% 不良事件(AE)65.2% 68.9% 治療-緊急不良事件(TEAE)4.3% 20.0% 研究藥物相關治療-緊急不良事件(TEAE)8.6% 8.9% 嚴重治療——緊急不良事件(TEAE)4.3% 4.4% 受試者死亡 4.3% 6.7% TEAE 導致研究藥物停藥 0.0% 0.0% TEAE 導致研究藥物減少 8.6% 15.6% TEAE 導致研究藥物中斷 PrimeC 2b 期研究結果實現了主要終點,其安全性和耐受性與安慰劑相當 17 所有不良事件均為暫時性且預計不會因不良事件而中斷

PrimeC 2b 期研究結果以 D 類藥物 T 耐受性概況實現了主要終點耐受性定義為自隨機分組以來的雙盲期內停藥或完成指定研究藥物的時間 PrimeC 安慰劑 N=5 of 45 N = 24 中的 4

2 b 期研究結果 — ITT 分析 PrimeC 在 ALSFRS 中將疾病進展減弱了 29.2% 的差異-R *p-value= 0.12

20 (N= 43) (N=19) 2 b 期研究結果 — PP 分析 PrimeC 在 ALSFRS 中顯著減緩了疾病進展 37%-R (p= 0.03)

在ALSFRS-R上丟失或保持單點可能會產生重大影響。手部功能喪失評分下降1分可能表示從獨立餵食過渡到需要援助。吞嚥評估量表下降1分可以標誌着自給自足與補充管道餵養的必要性之間的臨界閾值。腿部有 1 點的絆腳可能是用枴杖行走和根本無法行走的區別。呼吸損失1點會導致從獨立呼吸過渡到需要使用機器呼吸機。Cedarbaum JM、Stambler N、Malta E 等ALSFRS-R:修訂後的ALS功能評級量表,納入了對呼吸功能的評估。BDNF ALS 研究組(第三階段)。J Neurol Sci. 1999;169 (1-2):13-21。doi:10.1016 /s 0022-510 x (99) 00210-5 21

第 2 階段 b 研究結果 — ITT 分析 PrimeC 與安慰劑相比身體機能減緩平均值 ALSFRS——與安慰劑相比,PrimeC在 6 個月時的總分高出 2.23 分。22 安慰劑 PrimeC-7.64-5.41 -9 -8 -7 -6 -5 -4 -2 -1 0 失分數 ALSFRS-R 總分差 2.23 分(P = 0.12)

第 2 階段 b 研究結果 — ITT 分析 PrimeC 與安慰劑相比,身體機能減緩衰竭 23 背景呼吸衰竭是肌萎縮性側索硬化症最常見的死因-1.25-0.84 -4 -3 -2 -1 0 失點數 bulbar 0. 41 點差 (P= 0.24)-1.55-0.74 -4 -2 -1 0 呼吸損失點數 0.81 點差 (P= 0.13)-2.41-2.01 4 -3 -2 -1 0 丟失點數精細馬達 0.40 點差 (P= 0.51)-2.61-2.11 -4 -3 -2 -1 0 丟失的點數總運動量 0.50 點差 (P= 0.34) 安慰劑 PrimeC Bulbar:言語流涎吞嚥呼吸道:呼吸困難直腸呼吸功能不全精細動作:手寫切割食物敷料和衞生大肌肉:在牀上轉身走路爬樓梯

第二階段b研究結果——PP分析PrimeC與安慰劑相比減緩了身體機能下降——8.61-5.39 -9 -8 -7 -6 -4 -4 -3 -2 -1 0 丟失的分數 ALSFRS-R 總分差 3.22 分(P = 0.03)與安慰劑相比,PrimeC在6個月時的平均ALSFRS-R總分高出3.22分。安慰劑 PrimeC 24

第 2 階段 b 研究結果 — PP 分析 PrimeC 與安慰劑相比,身體機能減緩衰退-2.51-1.99 -4 -2 -1 0 精細運動失點數 0.52 點差(P= 0.42)-1.36-0.83 -4 -4 -4 -4 -4 -4 -4 -4 -4 -4 -4 -1 0 運動總量損失點數 0.84 分差 (P= 0.14)-1.71-0.57 -4 -3 -2 -1 0 呼吸損失點數 1.14 分差 (P=0.04) 25 背景呼吸衰竭是 ALS Bulbar 最常見的死因:言語流涎吞嚥呼吸:呼吸困難直腸呼吸功能不全呼吸功能不全精細動作:手寫切割食物敷料和衞生大肌肉:上牀走路爬樓梯安慰劑 PrimeC
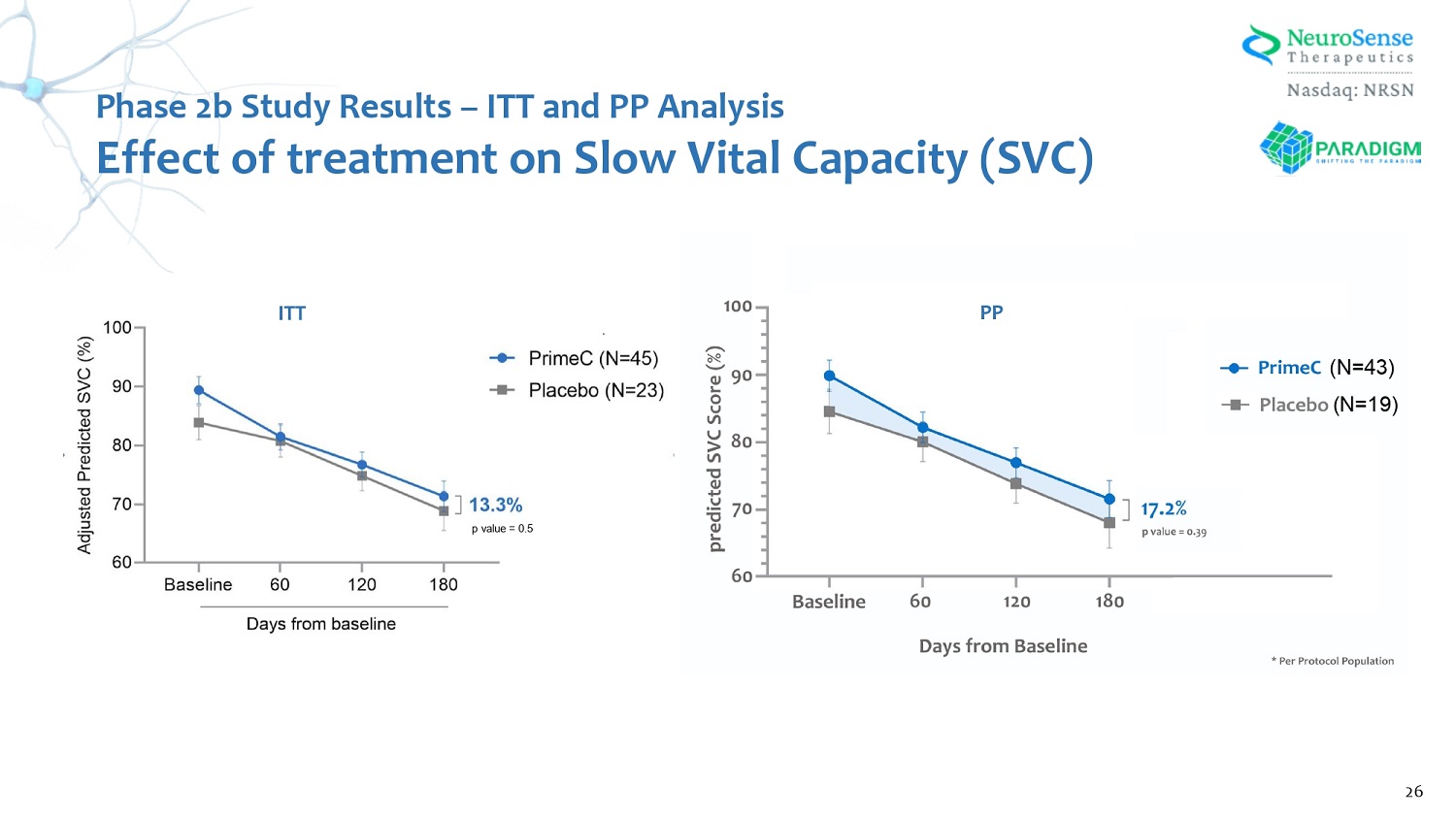
第 2 階段 b 研究結果 — ITT 和 PP 分析治療對慢肺活量 (SVC) 的影響 26 (N= 43) (N= 19) p 值 = 0.5 ITT PP

併發症-免費存活概率測量 ALS 併發症分析包括任何原因導致的死亡或呼吸功能不全或與 ALS 相關的併發症導致的住院 MitOS 系統分為六個階段,從 0 到 5,基於功能能力 (ALSFRS-R) 階段 0 = 正常功能第 5 階段 = 死亡根據疾病負擔(臨牀受累、進食或呼吸衰竭)第 1 階段 = 症狀發作階段 5 = 死亡

PrimeC 增加併發症發生概率-不同方法自由生存 (ITT) 危險比(平均值,95% 置信區間)King's Stage——免費生存 MitoS 階段——免費生存 ALS 併發症——免費生存 PrimeC 可降低死亡或併發症的風險 1 危險比為 1 表示兩個治療組的存活率沒有差異。危險比小於 1 表示 PrimeC 組的存活率更好 0.52 (P= 0.1) 0.65 (P=0.31) 0.7 (P= 0.69)

King's Stage-免費生存 MitOS 階段-免費生存 ALS 併發症-免費生存 PrimeC 可降低死亡或併發症的風險 1 危險比(平均值,95% 置信區間)危險比為 1 表示兩個治療組之間的存活率沒有差異。危險比小於 1 表示 PrimeC 組的存活率更好 0.47 (P= 0.07) 0.5 (P= 0.12) 0.34 (P= 0.29) PrimeC 增加併發症發生概率——使用不同方法自由生存 (PP)

-6.4-5.7 -7.0 -6.0 -5.0 -4.0 -3.0 -2.0 -1.0 0.0 安慰劑 (N=23) PrimeC (N=45) 丟失的積分數量 PrimeC 生活質量下降放緩 (ITT) 11.2% (P= 0.68)-5.5-4.6 -6.0 -4.0 -3.0 -2.0 -1.0 0.0 安慰劑 (N=23) PrimeC (N=45) 分數 11.2% (P= 0.68)-5.5-4.6 -6.0 -4.0 -2.0 -1.0 0.0 安慰劑 (N=23) PrimeC (N=45) 分數 Lost PROMIS-10 心理健康分數 PROMIS-10 身體健康分數 15.5%(P = 0.66)PROMIS(患者——報告結果測量信息系統)-10 是一套以人為本的衡量標準,用於評估和監測慢性病患者的身體、心理和社會健康

-5.8-4.8 -6.0 -5.0 -4.0 -3.0 -2.0 -1.0 0.0 安慰劑 (N=19) PrimeC (N=43) 丟失的分數-7.1-6.2 -7.0 -6.0 -5.0 -5.0 -4.0 -3.0 -2.0 -1.0 0.0 0.0 安慰劑 (N=19) PrimeC (N=43) 丟失的分數 PROMIS(患者——報告結果測量信息系統)-10 是一組以人為本的衡量標準,用於評估和監測慢性病患者的身體、心理和社會健康狀況 12.3%(P = 0.65)16.4%(P = 0.64)PROMIS-10 心理健康分數 PROMIS-10 身體健康分數 PrimeC 生活質量下降放緩(PP)

NeuroSense正在與領先的KOL和業界合作進行PARADIGM試驗,以通過新方法闡明PrimeC的MOA,生物標記物驅動的蛋白質組學在TDP-43和RNA監管的微RNA譜分析之間相互作用新生物標誌物的鑑定神經絲神經元衍生外泌體ALS生物標誌物研究的開創性方法以最大限度地提高臨牀工作量 32
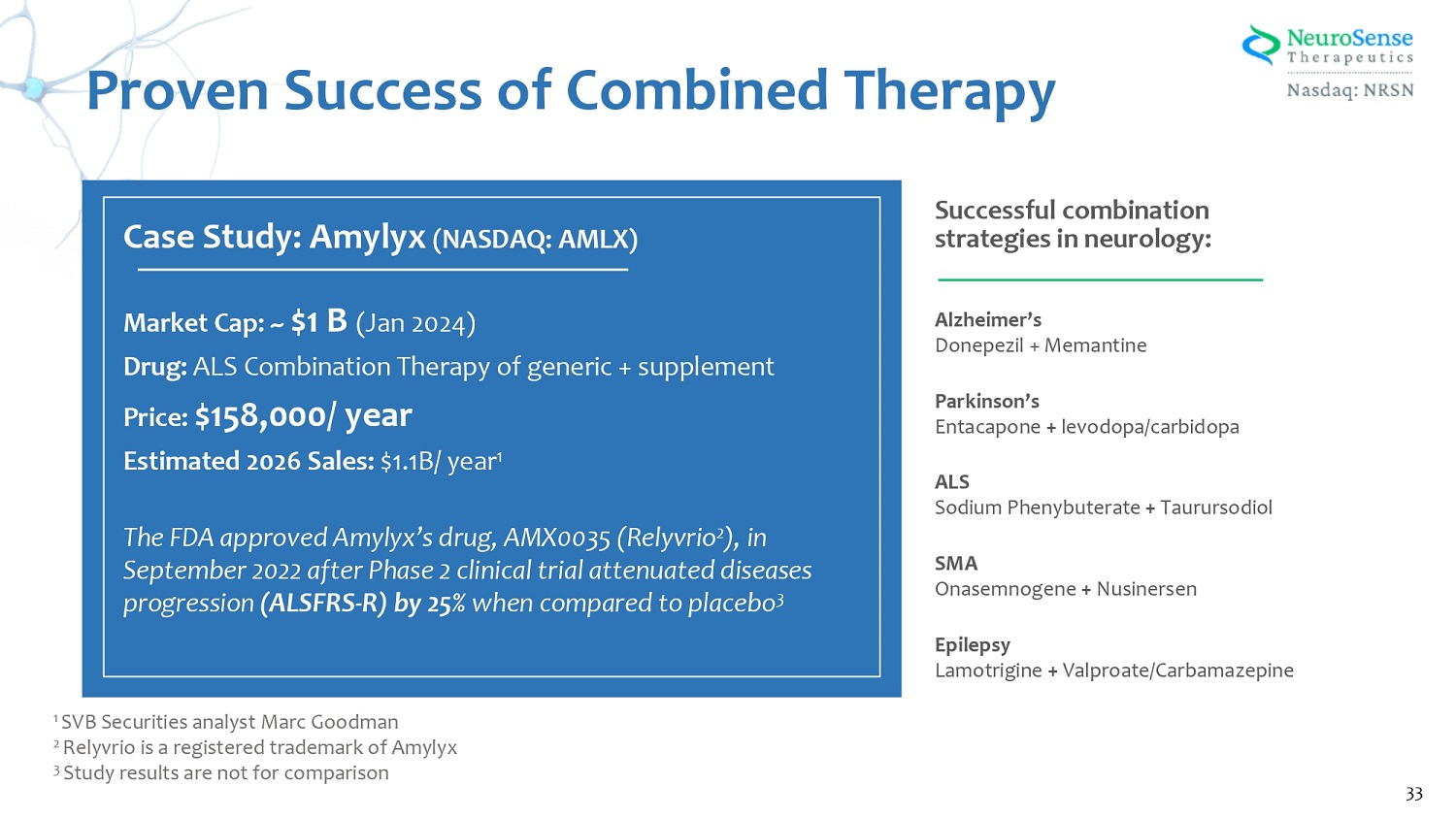
阿爾茨海默氏多奈哌齊 + 美金剛帕金森氏恩他卡彭 + 左旋多巴/卡比多巴 ALS 苯丁酸鈉 + Taurursodiol SMA Onasemnogene + Nusinersen 癲癇拉莫三嗪 + 丙戊酸/卡馬西平神經病學成功組合策略:案例研究:Amylyx(納斯達克股票代碼:AMLX)市值:~10億美元(2024年1月)藥物:ALS 仿製藥 + 補充劑聯合療法價格:15.8萬美元/年 2026年預計銷售額:11億美元/年 1 在第二階段臨牀試驗減弱了疾病進展之後,美國食品藥品管理局於2022年9月批准了Amylyx的藥物 AMX0035(Relyvrio 2)(ALSFRS-R)與安慰劑 3 1 相比,增長了 25% 1 SVB 證券分析師馬克·古德曼 2 Relyvrio 是 Amylyx 3 的註冊商標。研究結果不可比較。聯合療法的成功 33

經批准的新型組合療法候選藥物經過優化,具有協同作用,可解決肌萎縮性側索硬化症和潛在的其他疾病靶標,從ALS2期a和2b期臨牀研究中觀察到穩健的臨牀療效和出色的安全性 • 在2b期研究中ALSFRS-R(p= 0.03)降低 37% 新配方、方法和組合的專利覆蓋範圍(直至2038年)加快和降低風險的監管途徑(孤兒藥名稱/505(b)) 2 路徑) PrimeC:強大的臨牀和商業潛力 34
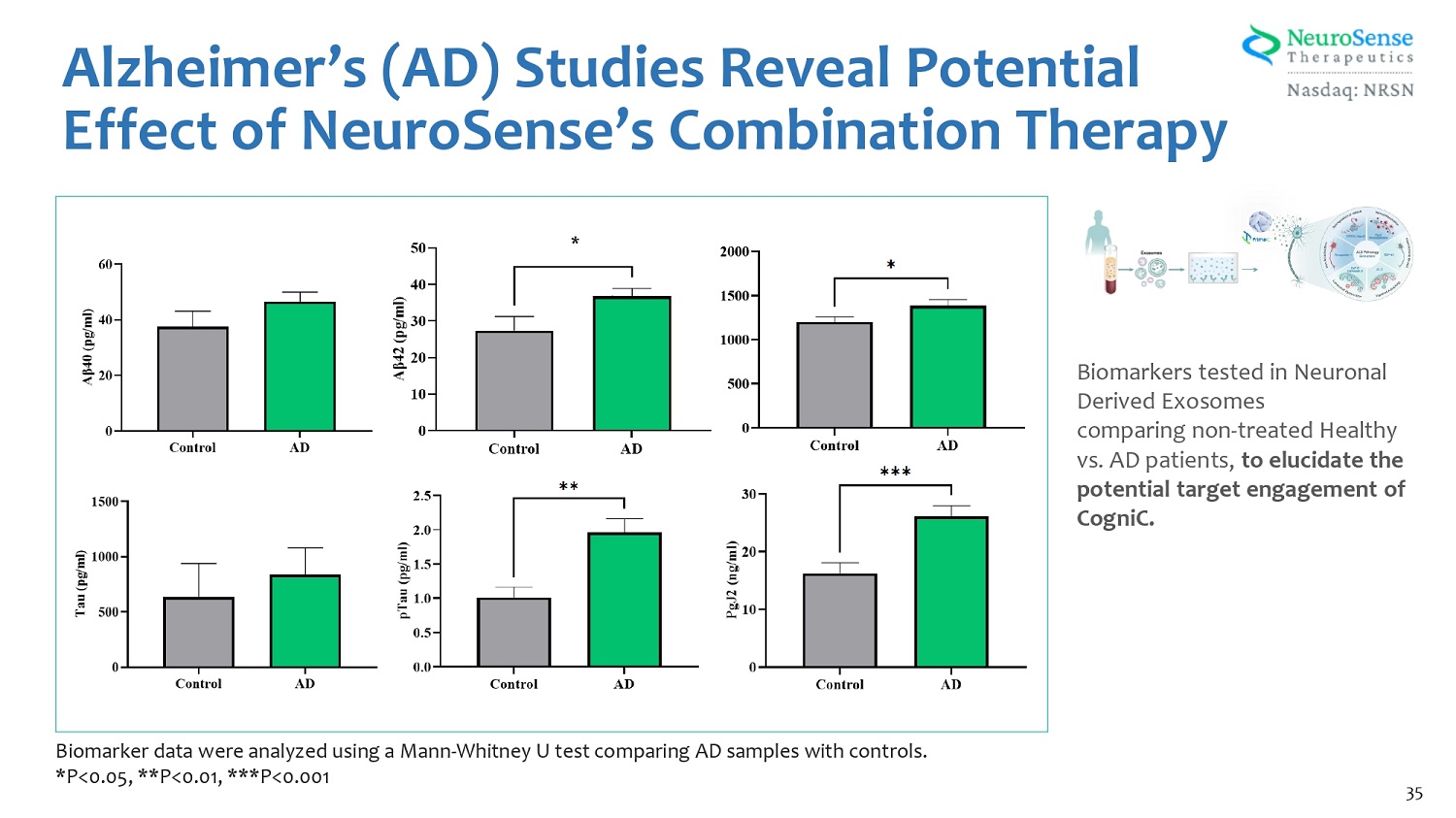
阿爾茨海默氏症(AD)研究揭示了在神經元衍生外泌體中測試的NeuroSense聯合療法生物標誌物的潛在作用,比較了未接受治療的健康患者與AD患者,以闡明Cognic的潛在靶點參與度。使用曼恩-惠特尼大學測試對生物標記物數據進行了分析,將AD樣本與對照組進行了比較。*P

20 名輕度至中度 AD 1:1 的患者 PrimeC to Placebo Cognic-中間製劑(= PrimeC-ER)12 個月給藥每 3 個月就診一次單中心靶點生物標誌物次要療效臨牀結果主要終點安全性和耐受性 3 1 PrimeC PrimeC 2 AD 2 期研究設計隨機、前瞻性、雙盲、安慰劑——對照研究 36

巴羅神經學研究所高級副院長神經病學系主任傑裏米·謝夫納教授(主席)金西·安德魯斯博士哥倫比亞大學神經肌肉醫學系神經病學副教授神經肌肉臨牀試驗主任 Merit Cudkowicz 教授麻省總裁兼哈佛醫學院神經病學系主任 Sean M. Healey 和 AMG ALS 神經病學中心主任 Jeffrey 教授羅森菲爾德洛馬琳達大學醫學院神經病學教授兼神經病學副主任洛馬琳達大學恢復性神經病學中心主任奧拉·哈迪曼教授都柏林三一學院神經病學學術部主任、博蒙特公司神經科顧問醫生——歐洲治療肌萎縮性側索硬化症聯盟主席兼ENCALS卓越科學顧問委員會科學委員會主席 37

主要合作 38

• 神經絲結果 • 生物標誌物結果 • ALS 第 2 階段結束與 FDA 和 EMA 的會議 • 根據需要啟動 ALS 3 期臨牀研究啟動了 ALS 2 期 b PARADIGM 研究獲得 PrimeC 的 FDA IND 許可已完成單劑量和多劑量 PK 研究成功完成生命中 90 天 GLP 毒理學研究 2022 2023 年 2024 年完成阿爾茨海默氏生物標誌物研究,取得積極結果完成帕金森氏生物標誌物研究陽性結果 D 型與 FDA 會面發佈 ALS 2 b 期臨牀研究頂級結果啟動阿爾茨海默氏症2期研究取得的里程碑和即將推出的潛在催化劑 39

納斯達克:NRSN 謝謝你提供更多信息:info @neurosense-tx.com 40