sgmo-202402050001001233假的00010012332024-02-052024-02-05 美國
證券交易委員會
華盛頓特區 20549
表單 8-K
當前報告
根據第 13 條或第 15 (d) 條
1934 年《證券交易法》
報告日期(最早報告事件的日期): 2024年2月5日
SANGAMO 治療公司
(註冊人的確切姓名如其章程所示)
| | | | | | | | | | | | | | |
| | | | |
| 特拉華 | | 000-30171 | | 68-0359556 |
(州或其他司法管轄區
公司) | | (委員會
文件號) | | (國税局僱主
證件號碼) |
運河大道 501 號。, 裏士滿, 加利福尼亞94084
(主要行政辦公室地址)(郵政編碼)
(510) 970-6000
(註冊人的電話號碼,包括區號)
不適用
(如果自上次報告以來發生了變化,則為以前的姓名或以前的地址)
如果提交8-K表格是為了同時履行註冊人根據以下任何條款承擔的申報義務,請勾選下面的相應方框:
| | | | | |
| ☐ | 根據《證券法》(17 CFR 230.425)第425條提交的書面通信 |
| | | | | |
| ☐ | 根據《交易法》(17 CFR 240.14a-12)第14a-12條徵集材料 |
| | | | | |
| ☐ | 根據《交易法》(17 CFR 240.14d-2 (b))第14d-2(b)條進行的啟動前通信 |
| | | | | |
| ☐ | 根據《交易法》(17 CFR 240.13e-4 (c))第13e-4(c)條進行的啟動前通信 |
根據該法第12(b)條註冊的證券: | | | | | | | | | | | | | | |
| | | | |
| 每個班級的標題 | | 交易品種 | | 註冊的每個交易所的名稱 |
| 普通股,每股面值0.01美元 | | SGMO | | 納斯達克全球精選市場 |
用複選標記表明註冊人是1933年《證券法》第405條(本章第230.405節)還是1934年《證券交易法》第12b-2條(本章第240.12b-2節)所定義的新興成長型公司。
新興成長型公司☐
如果是新興成長型公司,請用複選標記表明註冊人是否選擇不使用延長的過渡期來遵守根據《交易法》第13(a)條規定的任何新的或修訂後的財務會計準則。☐
項目 8.01 其他活動。
2024年2月5日,Sangamo Therapeutics, Inc.(“Sangamo” 或 “公司”)公佈了其評估用於治療法布里病的全資基因療法候選產品isaralgagene civaparvovec或 ST-920 的第1/2期STAAR研究的最新初步臨牀數據,然後在20日發佈了該研究第四年度世界座談會2024 年 2 月 7 日。數據摘要如下。該公告包括截至2023年9月19日數據截止日期接受isaralgagene civaparvovec治療的24名患者的數據。自數據截止日期以來,在第1/2期STAAR研究中又給了四名患者服藥,截至本最新報告發布之日,共有28名患者服藥。
第1/2期STAAR研究的篩查和入組已經完成,其餘入組患者的給藥預計將在2024年上半年進行。與美國食品藥品管理局和其他衞生當局繼續就註冊途徑進行富有成效的討論。該公司將推遲對規劃潛在註冊試驗的額外投資,直到獲得合作伙伴關係或試用融資為止。
Isaralgagene Civaparvovec 1/2 期 STAAR 研究的最新初步臨牀數據摘要已於 2024 年 2 月 5 日公佈,將在第 20 屆年度世界博覽會上發表之前座談會於 2024 年 2 月 7 日
•STAAR研究是一項正在進行的1/2期多中心、開放標籤、劑量範圍的臨牀研究,旨在評估年齡在18歲以上的法布里病患者中單次輸注isaralgagene civaparvovec的安全性和耐受性。患者靜脈注射單劑量,隨訪52周。另一項長期隨訪研究正在進行中,以監測該研究中接受治療的患者在治療後長達五年的時間。研究設計規定,每個劑量隊列中至少要給兩名患者服藥,每個隊列都有可能擴大。接受穩定酶替代療法(“ERT”)的患者可以在治療後以受控和監測的方式退出ERT,由患者和研究人員自行決定。
•劑量遞增階段包括患有典型法布里病的男性。隨後的研究擴展階段始於2022年下半年,用於治療女性以及患有更嚴重的法布里相關心臟或腎臟疾病的患者。該研究的主要終點是治療緊急不良事件(“AEs”)的發生率。其他安全性評估包括常規血液學、化學和肝臟檢查;生命體徵監測;心電圖;超聲心動圖;一系列α-胎蛋白檢測和肝臟磁共振成像(“MRI”),以監測任何肝腫塊的潛在形成。次要終點包括在一年研究期內特定時間點與基線相比的變化,血漿中α-半乳糖苷酶A(“α-Gal A”)活性、globotriaosylceramide(“Gb3”)和lyso‑GB3水平的變化;ERT輸注頻率;以及通過心臟磁共振成像和Raav2/6矢量清除率測得的腎功能和心臟功能(左心室腫塊)的變化。關鍵的探索終點包括生活質量、Fabry 症狀和神經病理性疼痛評分;以及對 AAV6 衣殼和 α-gal A 的免疫反應。
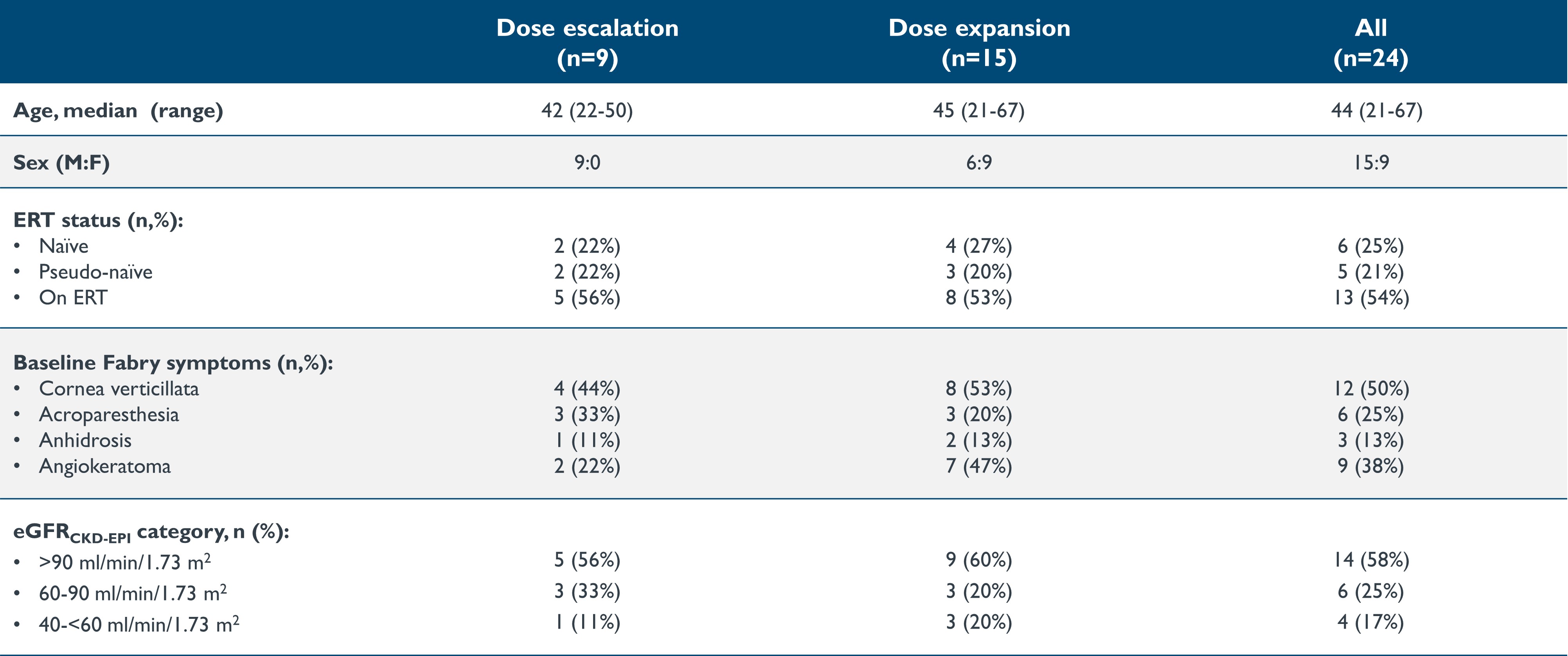
•截至2023年9月19日的數據截止日期,24名年齡在21至67歲的患者接受了isaralgagene civaparvovec的治療,9名處於劑量遞增階段,15名處於研究的擴展階段。這24名患者的基線特徵如下表1所示。在劑量遞增階段,隊列 1 中有兩名患者以 0.26x10 的劑量給藥13vg/kg,隊列 2 中有兩名患者以 0.53x10 的劑量給藥13vg/kg,隊列 3 中有三名患者以 1.58x10 的劑量給藥13vg/kg,隊列 4 中有兩名患者以 2.63x10 的劑量給藥13vg/kg。在擴張階段,15名患者以2.63x10的劑量給藥13vg/kg。截至2023年9月19日的數據截止日期,第一位接受治療的患者在給藥後已經進行了至少36.2個月的隨訪,最近接受治療的患者在給藥後進行了0.9周的隨訪。
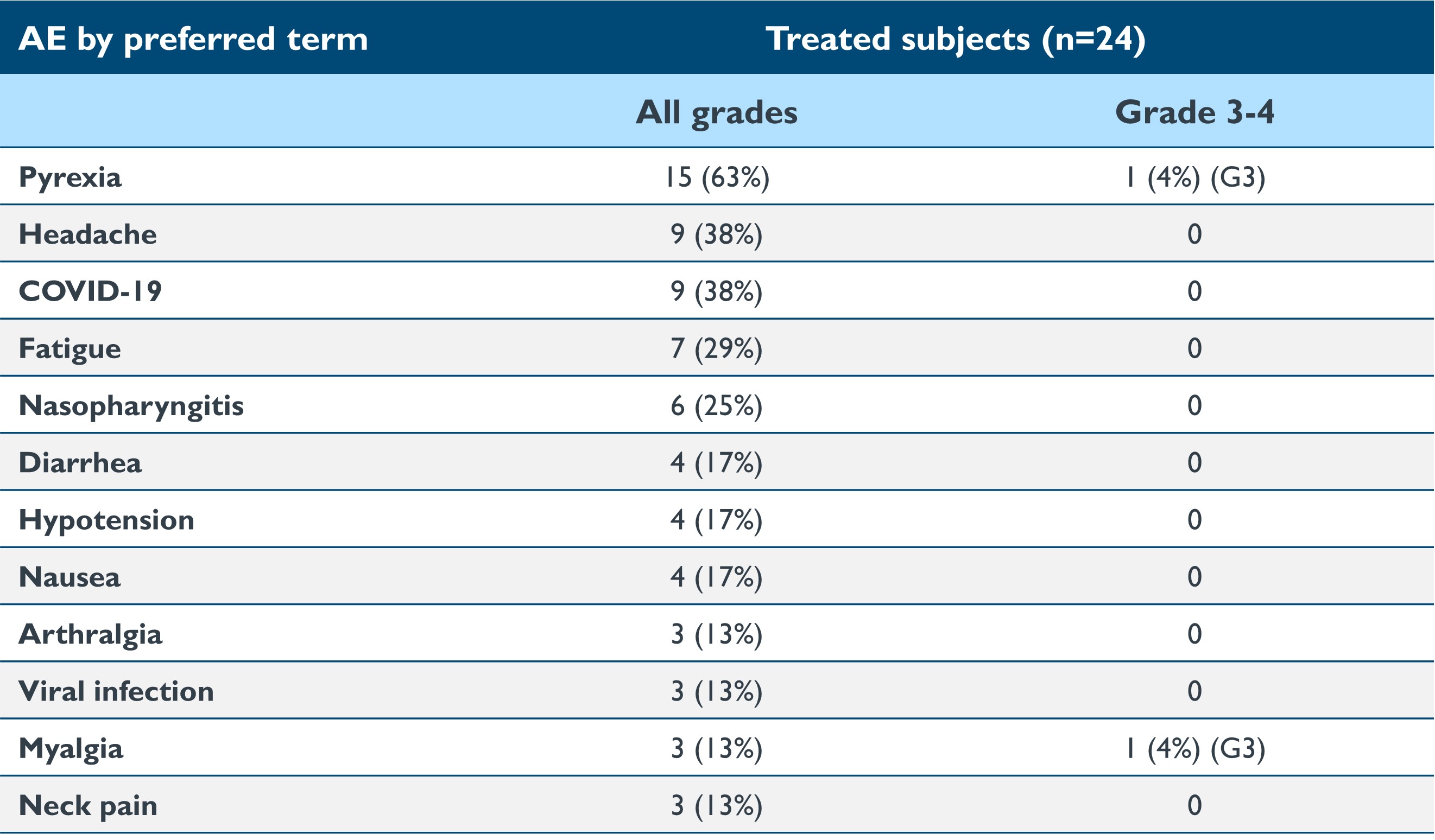
•截至2023年9月19日的數據截止日期,在24名接受治療的患者中,isaralgagene civaparvovec在所有劑量組中的耐受性總體上仍然良好,其中大多數不良反應在本質上被分為輕度(1級)或中度(2級)。一名患者出現了 3 級發熱不良事件。三名患者出現輸液後高血壓:2 級,使用類固醇(n=2),1 級,鹽水注射(n=1)。無需使用類固醇進行肝功能檢查升高。沒有使用過預防性皮質類固醇或其他免疫調節劑。截至2023年9月19日截止日期,報告的治療相關不良事件的摘要如下表2所示。四名患者報告了與治療相關的嚴重不良事件(“SAE”):左臂疼痛(0.53×10)13vg/kg);敗血癥(1.58×10)13vg/kg); 集中症、中風/缺血性中風 (2.63×10)13vg/kg)。沒有任何不良反應導致研究中止。
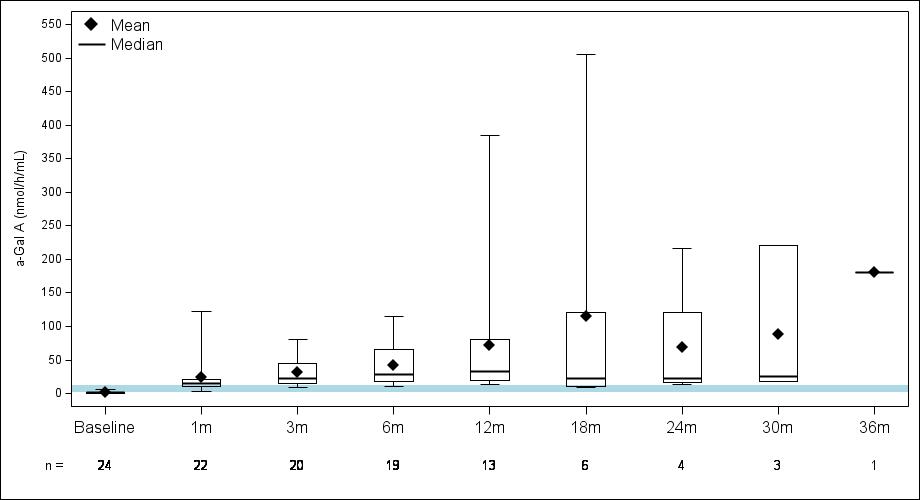
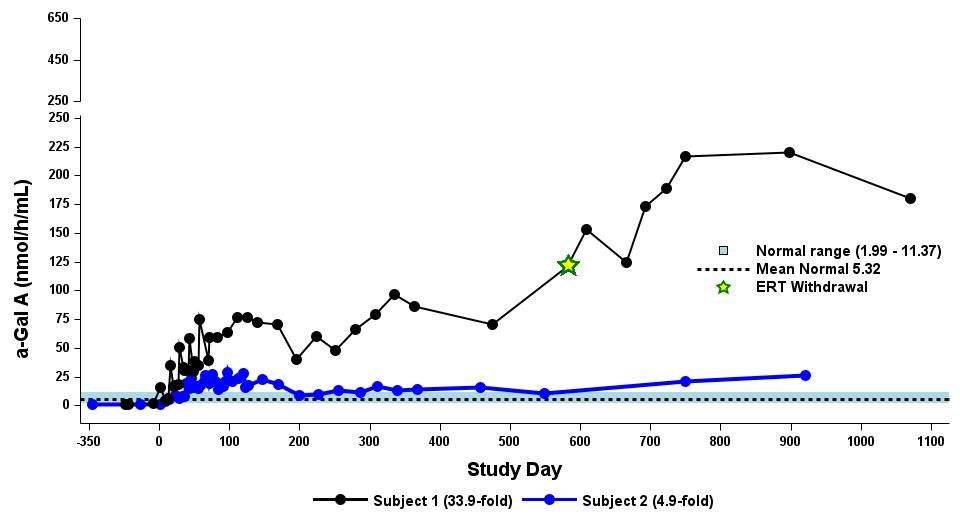
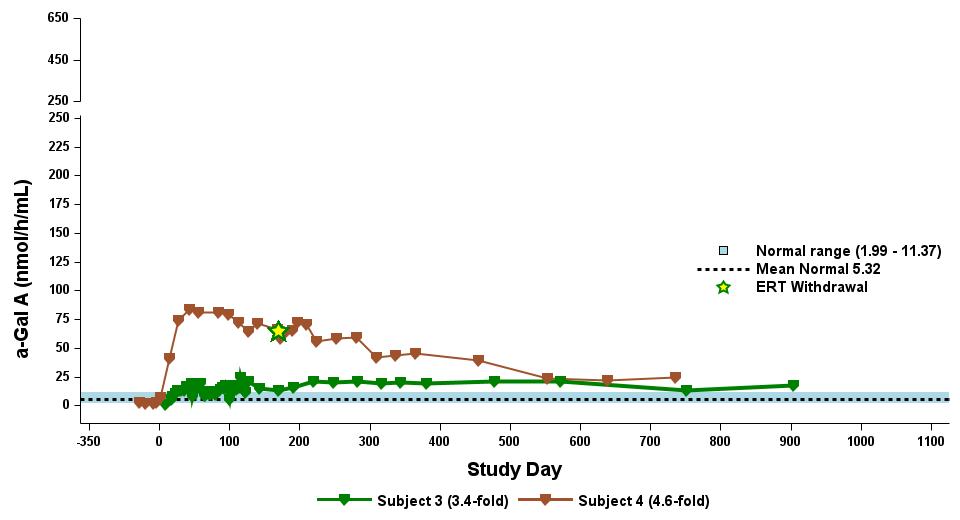
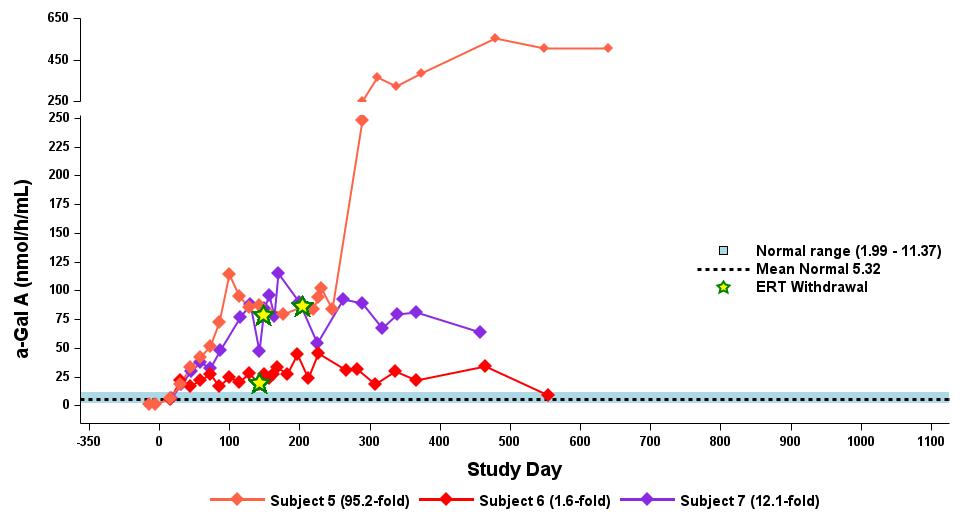
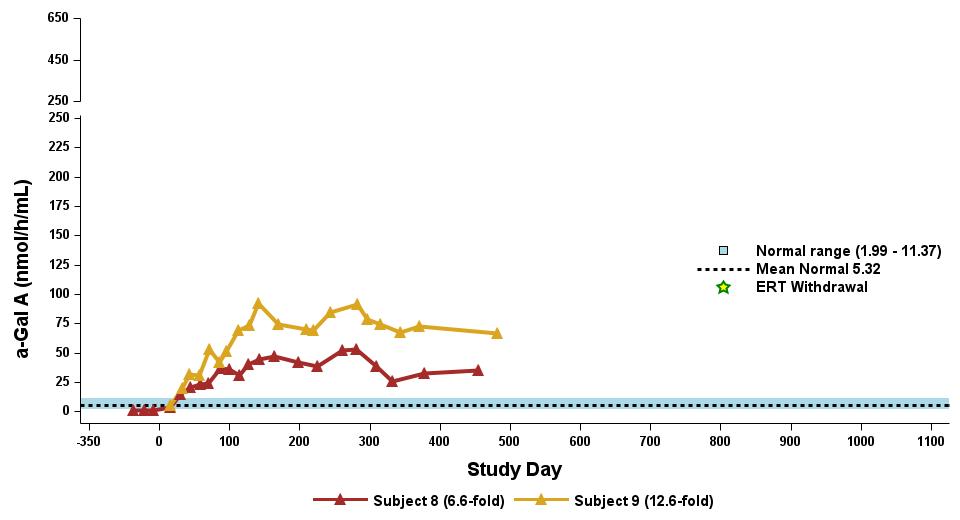
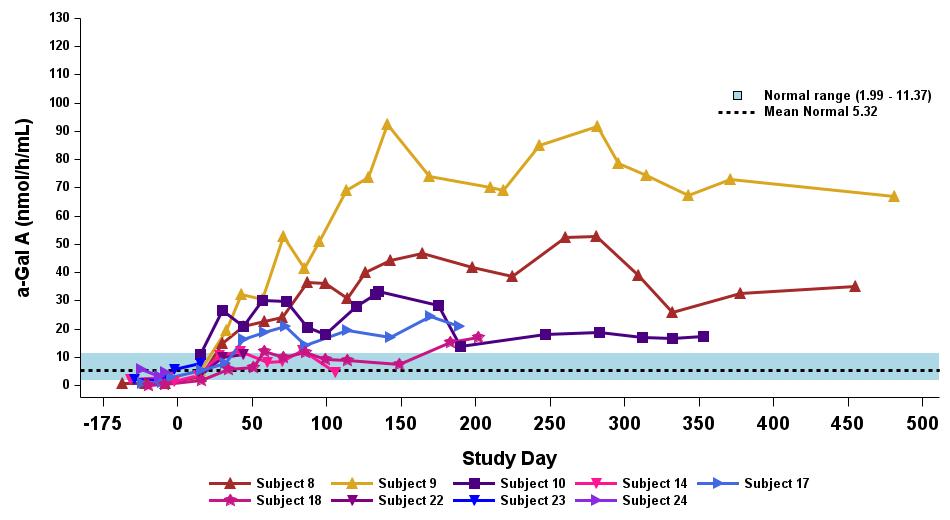
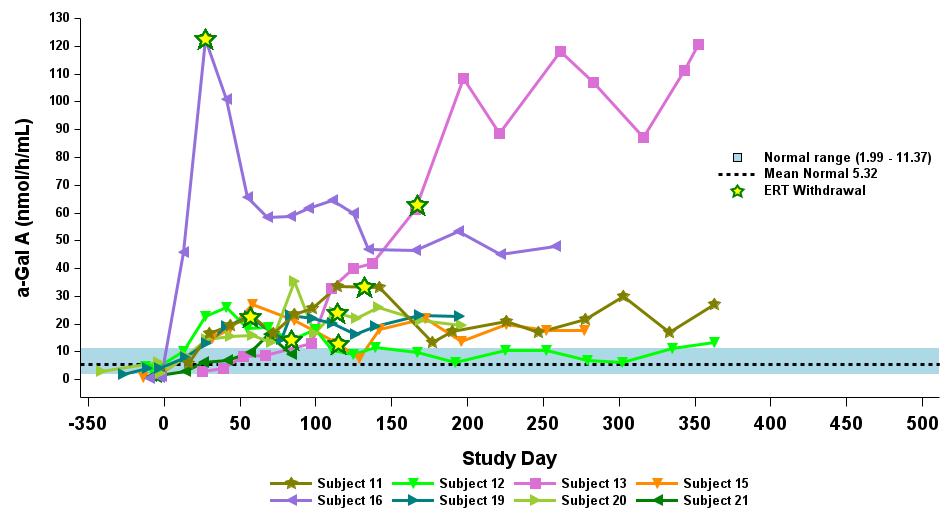
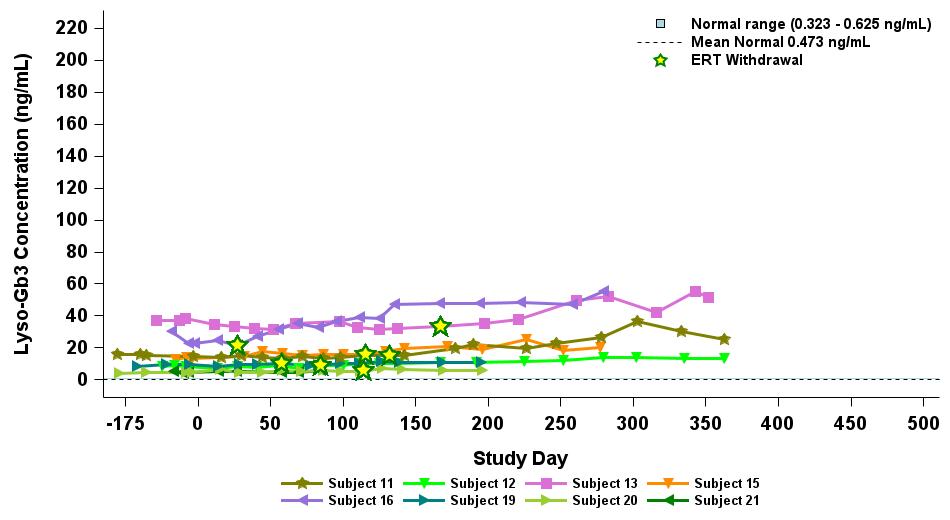
•截至2023年9月19日數據截止日期,所有24名處於劑量遞增和擴張階段的患者的血漿α-Gal A活性結果如表3所示,並在下文進行了進一步的詳細描述。對於九名處於劑量遞增階段的接受治療的患者,截至截止日期,所有九名患者均觀察到α-GAL A活性的表達持續升高,持續升高,這是截至截止日期治療時間最長的患者,如表4所示。對於這些患者,在給藥 ST-920 四到八週後,觀察到 α-GAL A 活性迅速增加。開始進行ERT研究的所有五名患者的ERT戒斷均已完成,在ERT戒斷後,α-Gal A活性水平持續升高。截至2024年2月5日,這些患者均未要求恢復ERT。對於處於劑量遞增階段的天真和假天真患者,最高劑量隊列 4 中的患者的表現明顯更高
與低劑量隊列的患者相比,α-Gal A活性水平。截至2023年9月19日數據截止日期,所有這些患者的α-GAL A活性水平持續升高。
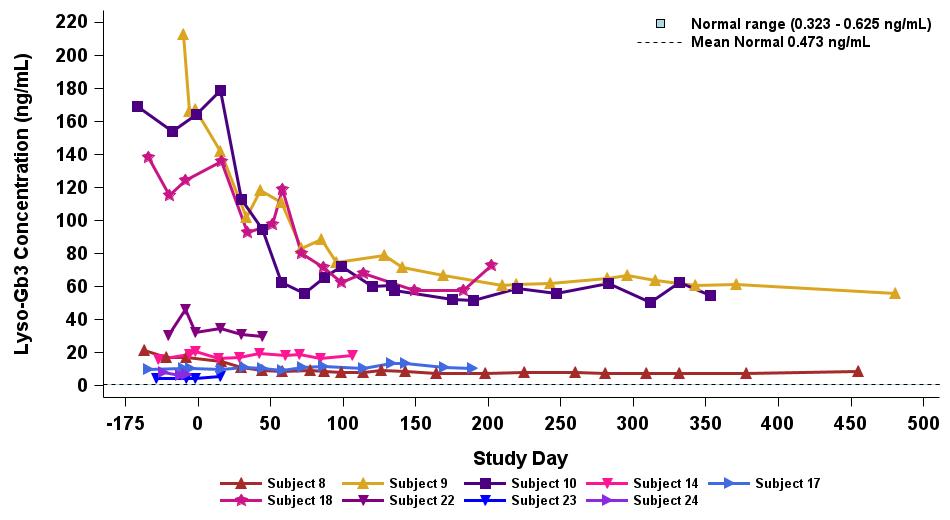
•截至2023年9月19日數據截止日期,ERT 天真或假天真患者接受的劑量水平最高(2.63 x 10)13vg/kg)顯示持續的超生理學α-Gal A活性長達近500天,如表5所示。α-GAL A活性表達持續升高伴隨着LYSO-GB3水平的降低和/或長期穩定,在基線水平最高的患者中,血漿lyso-GB3的下降幅度最大。
•截至2023年9月19日的截止日期,所有12名開始接受ERT研究並隨後退出ERT的患者均未接受ERT,如表6所示。ERT的停藥時間由調查人員自行決定,在給藥isaralgagene civaparvovec後八週內停藥。在12名接受ERT治療的患者中,有11名患者在長達19個月的時間內繼續表現出超生理學水平的α-Gal A活性,而一名患者維持生理水平。從輸液後的第四周到第19周,擴增劑量隊列中八名接受ERT治療的患者的戒斷情況各不相同。重要的是,在 ERT 戒斷後,血漿 lyso-GB3 水平在長達一年的時間內保持穩定。
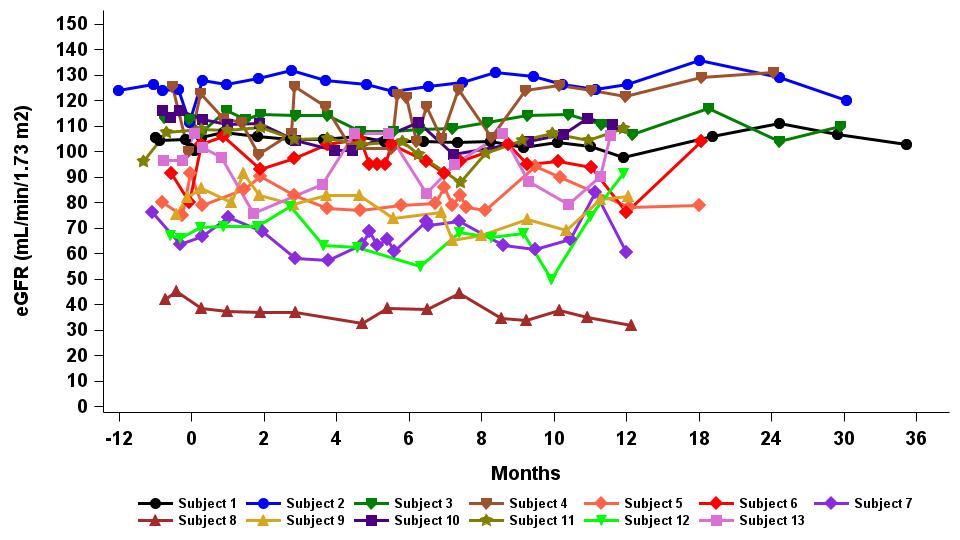
•截至2023年9月19日數據截止日期,所有13名接受12個月或更長隨訪的患者都將腎功能穩定作為次要終點,以估計的腎小球濾過率(“eGFR”)來衡量,如表7所示。患者的水平在12個月內保持不變,平均年化表皮生長因子斜率為-0.915 mL/min/1.73m2/年(95% 置信區間:-4.1,2.3)。
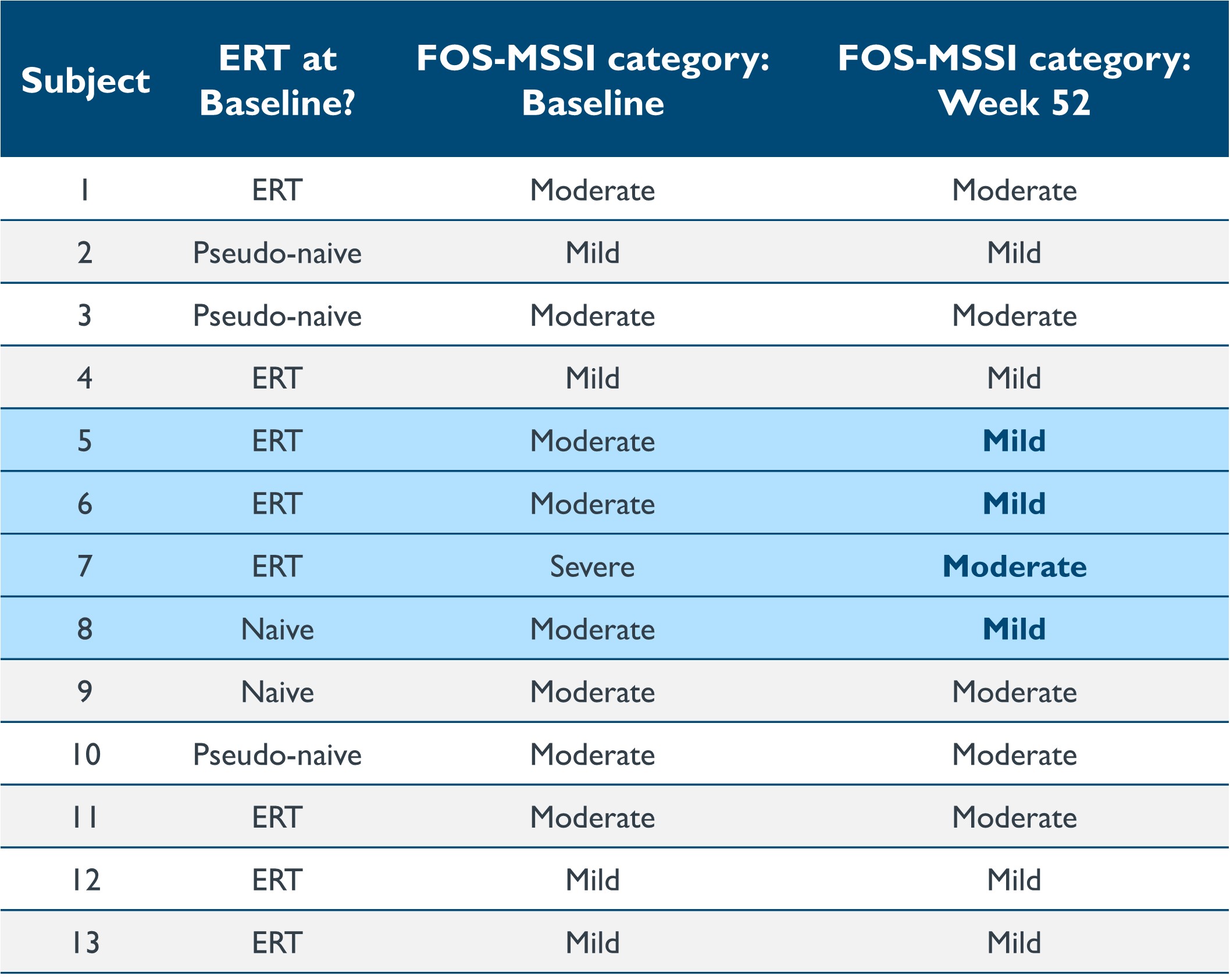
•對13名患者進行了為期12個月的隨訪,顯示疾病嚴重程度、生活質量(“QoL”)和胃腸道(“GI”)症狀有所改善。截至2023年9月19日的數據截止日期,改編自美因茨嚴重程度評分指數(“FOS-MSSI”)的Fabry結果調查顯示,4個MSSI分區均有統計學上的顯著改善,69%的患者在第12個月的總MSSI分數較基線有所提高。年齡調整分數與第 12 個月基線相比的平均變化為 -3.96(95% 置信區間: [-7.4.-0.5],p=0.0269)。重要的是,四名患者,包括一名未接受治療的患者,在第52周與基線相比,他們的FOS-MSSI疾病類別總體有所改善(例如,與基線類別相比,Fabry病的分類從 “中度” 改為 “輕度”),如表8所示。其中三人在基線時接受了急診治療,這表明與目前批准的護理標準相比,isaralgagene civaparvovec具有潛在的臨牀益處。在此後退出的八名接受ERT治療的患者中,有75%的患者將分數提高了-3.5至-14分,38%的患者的總體疾病類別有所改善。據報道,簡表36(“SF-36”)生活質量分數有統計學上的顯著改善,在第52周,一般健康和物理成分分的平均變化分別為10.5(p = 0.0158)和4.395(p = 0.0140)。就上下文而言,任何 SF-36 分數的變化 3 到 5 分是臨牀上最重要的區別。胃腸道症狀評級量表(“GSRS”)也顯示出顯著改善,與第12個月的基線相比平均變化為-0.26(95%置信區間: [-0.5, -0.0], p=0.0226).
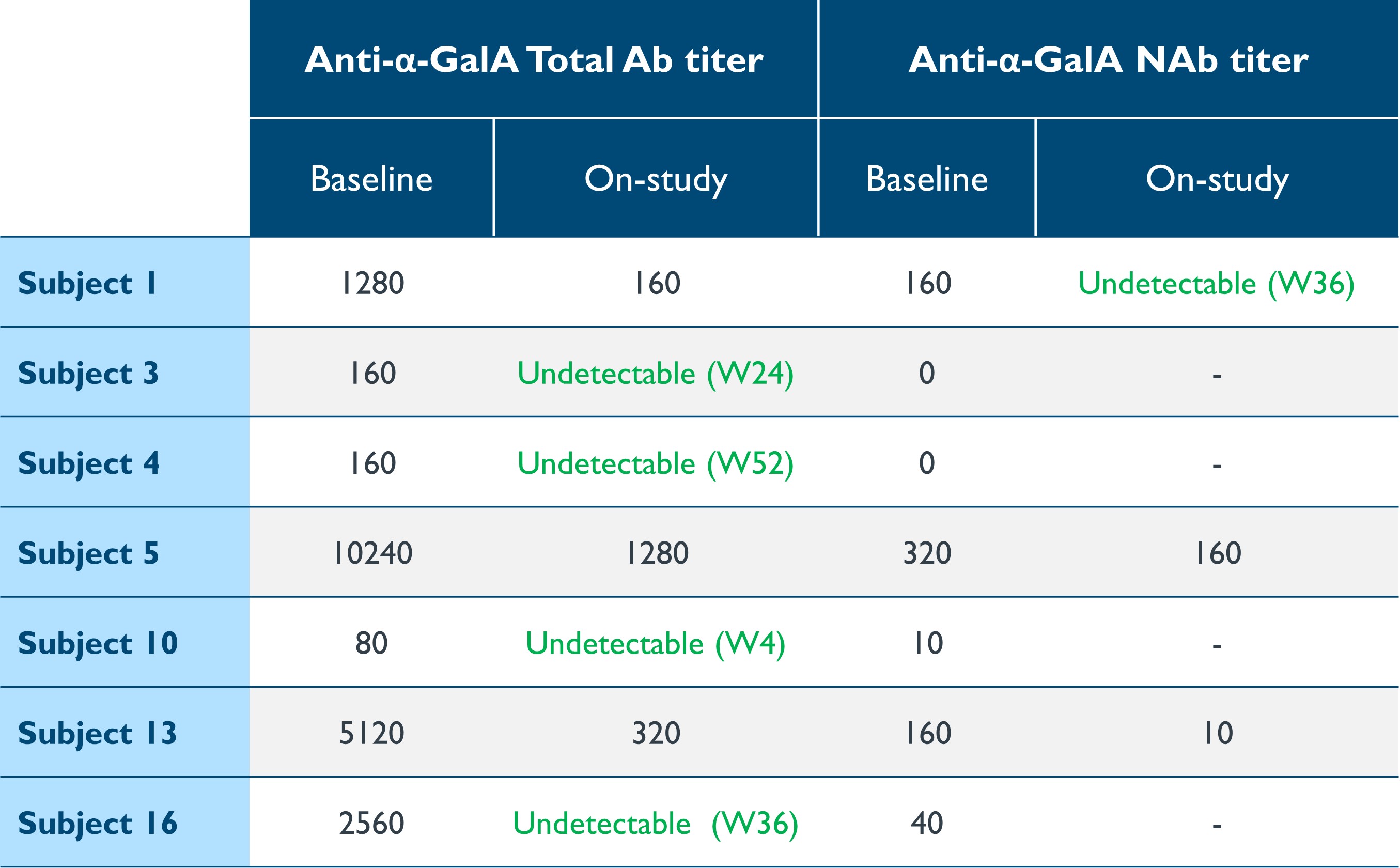
•與免疫原性相關的進行性器官損傷仍然是ERT的問題。在基線時,有七名患者對α-Gal A的總抗體(“Ab”)或中和抗體(“NaB”)的可測量滴度,與ERT有關。如表9所示,給藥後,所有七名患者的總Ab或NaB滴度明顯下降,五名患者(佔71%)的總滴度變得無法檢測到。治療未在血清陰性患者中誘導抗α-GAL A抗體。
表 1:基線特徵:劑量遞增和劑量擴展階段
數據截止日期:2023 年 9 月 19 日
eGFR,估計的腎小球濾過率(mL/min/1.73m2);ERT,酶替代療法
表 2:>2 名患者的治療急性不良反應摘要
數據截止日期:2023 年 9 月 19 日
在4名受試者中報告了治療中出現的急性SAE:左臂疼痛(0.53×10)13vg/kg);敗血癥(1.58×10)13vg/kg); 集中症、中風/缺血性中風 (2.63×10)13vg/kg)。
表 3:α-gal A 活性的表達
數據截止日期:2023 年 9 月 19 日
14號患者在第148天退出了研究。
表 4:劑量遞增階段九名接受治療患者的劑量依賴性對天真/假天真患者α-gal A活性的影響
2.63×1013vg/kg 被選為擴展階段
劑量等級 1:0.26×1013vg/kg (n=2)
劑量等級 2:0.53×1013vg/kg (n=2)
劑量等級 3:1.58×1013vg/kg (n=3)
劑量等級 4:2.63×1013vg/kg (n=2)
數據截止日期:2023 年 9 月 19 日
α-gal A 活性使用 3 小時的反應時間測量。正常範圍由健康的男性和女性決定。數據點 > 第 365 天學習來自長期隨訪研究。
α-gal A,α-半乳糖苷酶 A;vg/kg,每千克總體重的載體基因組(由 ddPCR 評估);ERT,基線時進行急性轉錄治療;N,ERT-naieve;P-N,假天真,篩查前 ≥ 6 個月內沒有 ERT
表 5:接受最高劑量水平 2.63×10 的 ERT 天真/假天真患者中 st-920 驅動的血漿 α-gal A 活性和 lyso-GB3 的降低13vg/kg (n=9)
血漿 α-gal A 活性
等離子 Lyso-Gb3
數據截止日期:2023 年 9 月 19 日
α-gal A 活性使用 3 小時的反應時間測量。正常範圍由健康的男性和女性決定。長期隨訪數據:數據點 > 學習日 365。
α-gal A,α-半乳糖苷酶 A;ERT,酶替代療法;lyso-GB3,globotriaosylsphingosylsphingosine;vg/kg,每千克總體重的載體基因組(由 ddPCR 評估)
表 6:接受最高劑量水平 2.63×10 的 ERT 治療患者的血漿 α-gal A 和 lyso-GB313vg/kg (n=8)
血漿 α-gal A 活性
等離子 Lyso-Gb3
數據截止日期:2023 年 9 月 19 日
α-gal A 活性使用 3 小時的反應時間測量。正常範圍由健康的男性和女性決定。
α-gal A,α-半乳糖苷酶 A;ERT,酶替代療法;lyso-GB3,globotriaosylsphingosylsphingosylsphingosine;vg/kg,每千克總體重的載體基因組(由 ddPCR 評估);W,周
表 7:隨訪時間≥12 m的患者腎功能保持穩定
數據截止日期:2023 年 9 月 19 日
表皮生長因子,根據 2009 年 CKD-EPI 肌酐方程估算的腎小球濾過率(mL/min/1.73m2);95% 置信區間,95% 置信區間界限
表 8:疾病嚴重程度、生活質量和胃腸道症狀的比較
數據截止日期:2023 年 9 月 19 日
對隨訪時間≥12 m(n = 13)的 ST-920 患者進行分析。“第 12 個月” 是第 52 周的學習時間點。所有 p 值均為未經調整的標稱 p 值。
ERT,酶替代療法;FOS-MSSI、Fabry 結果調查改編自美因茲嚴重程度評分指數;SF-36,簡表 36(任何 SF-36 分數的變化 3 到 5 分是臨牀上最重要的區別)
表 9:減少或消除針對 α-Gal A 的抗體
數據截止日期:2023 年 9 月 19 日
α-gal A,α-半乳糖苷酶 A;Ab,抗體;NaB,中和抗體;W,周;(-) 表示總抗體滴度為 0 時未進行 NaB 測試
前瞻性陳述
本表8-K最新報告包含有關Sangamo當前預期的前瞻性陳述。這些前瞻性陳述包括但不限於:isaralgagene civaparvovec的安全性和有效性以及治療和商業潛力,進行我們正在進行的和潛在的未來臨牀試驗以及提供臨牀試驗臨牀數據的預期計劃和時間表,對我們1/2期STAAR研究給藥結論的預期,isaralgagene civaparvovec進入後期開發的預期進展,包括桑加莫的計劃尋求潛在的合作伙伴或額外的資金以繼續進行isaralgagene civaparvovec 未來可能進行的第三階段試驗及其時機,以及其他非歷史事實的陳述。這些陳述不能保證未來的表現,並且存在某些難以預測的風險和不確定性。可能導致實際結果不同的因素包括但不限於與我們缺乏資本資源來全面開發、獲得監管部門批准和商業化候選產品相關的風險和不確定性,包括我們獲得及時或根本啟動isaralgagene civaparvovec可能的第三階段試驗所需的資金的能力;我們需要大量額外資金來執行運營計劃並繼續運營關注;宏觀經濟因素或金融挑戰的影響,包括持續的海外衝突、當前或未來可能的銀行倒閉、通貨膨脹和利率上升對全球商業環境、醫療保健系統以及Sangamo及其合作者的業務和運營,包括臨牀試驗的運營;研發過程,包括臨牀試驗的運作和結果以及臨牀數據的呈現;臨牀試驗延遲、暫停和暫停對臨牀試驗時間表和候選產品商業化的影響;這臨牀試驗結果的時間不確定和不可預測的性質,包括在1/2期STAAR研究的最新初步臨牀數據中觀察到的治療效果對患者來説不可持久,該研究的最終臨牀試驗數據無法驗證isaralgagene civaparvovec的安全性和有效性,以及退出ERT的患者將保持在ERT之外的風險;多個監管機構對候選產品的監管批准程序不可預測;依賴於早期臨牀試驗,哪些結果不一定能預測未來的臨牀試驗結果,包括我們候選產品的任何3期試驗的結果;排除Sangamo使用的技術的可能性;我們對合作者的依賴以及我們可能無法獲得更多合作;我們實現預期未來財務業績的能力;以及Sangamo向美國證券交易委員會提交的文件,包括其年度10-K表年度報告中描述的其他風險和不確定性已結束2022年12月31日,由桑加莫截至2023年9月30日的季度10-Q表季度報告補充。本表8-K最新報告中包含的信息截至2024年2月5日,除非適用法律要求,否則Sangamo沒有義務更新本8-K表最新報告中包含的前瞻性陳述。
簽名
根據1934年《證券交易法》的要求,註冊人已正式促使經正式授權的下列簽署人代表其簽署本報告。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | |
| | | | SANGAMO 治療公司 |
| | | |
| 日期:2024 年 2 月 6 日 | | | | 來自: | | /SCOTT B. WILLOUGHBY |
| | | | 姓名: | | 斯科特·B·威洛比 |
| | | | 標題: | | 高級副總裁、總法律顧問兼公司祕書 |