

Olema Oncology 摩根大通會議 2024

前瞻性陳述本演示文稿包含根據1995年《私人證券訴訟改革法》的安全港條款做出的前瞻性陳述。本演示文稿中非歷史事實陳述的陳述均為前瞻性陳述。此類前瞻性陳述包括但不限於有關我們的研究和臨牀開發計劃、開發我們的候選產品或任何其他未來候選產品的範圍、進展、結果和成本、戰略、監管事宜的陳述,包括獲得藥物批准的時機和成功可能性、帕拉西司朗(OP-1250)作為單一療法和聯合試驗(包括公司的關鍵三期單一療法 OPERA-01)的潛在臨牀研究結果和臨牀試驗的時間表臨牀試驗,以及OPERA-02,該公司潛在的關鍵性3期聯合臨牀試驗,palazestrant作為單一療法和聯合試驗中的潛在有益特徵、安全性、耐受性、療效和治療效果,片劑配方的潛在有益特性和耐受性,palazestrant有可能成為ER+/HER2-轉移性乳腺癌的同類最佳治療選擇和乳腺癌女性的主要療法,可組合性 palazestrant 與其他藥物一起使用,潛在藥物的時間表我們的KAT6抑制劑的臨牀前研究和臨牀工作、市場規模和機會、我們完成某些里程碑的能力、我們的財務狀況、現金狀況、資金來源和財務資源的充足性以及管理團隊的充足性。諸如 “相信”、“預測”、“計劃”、“期望”、“打算”、“將”、“可能”、“目標”、“項目”、“估計”、“潛力” 等詞語和類似表述旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都一定包含這些識別詞。這些前瞻性陳述基於公司管理層的信念以及公司做出的假設和目前可獲得的信息。此類陳述反映了公司當前對未來事件的看法,並受已知和未知風險的影響,包括業務、監管、經濟和競爭風險、不確定性、突發事件和對公司的假設,包括但不限於開發產品和技術所固有的風險、公司正在進行和計劃中的臨牀試驗的未來結果、公司獲得足夠資金以資助其計劃臨牀試驗和其他費用的能力、行業趨勢、法律和行業和未來支出的監管框架,以及影響公司的其他風險和不確定性,包括 “風險因素” 標題下以及公司10-Q表季度報告、10-K表年度報告以及公司未來向美國證券交易委員會提交的文件和報告中其他地方描述的風險和不確定性。鑑於這些風險和不確定性,前瞻性陳述中提及的事件或情況可能不會發生。實際結果可能與預期結果有所不同,並且差異可能是重大的。不應將這些前瞻性陳述視為預測或承諾,也不應將其視為暗示任何跡象、保證或保證,表明此類前瞻性陳述所依據的假設是正確或詳盡的,或者就假設而言,在本演示文稿中已得到充分陳述。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本演示文稿發表之日。本演示文稿討論了正在進行臨牀研究且尚未獲得美國食品藥品監督管理局批准上市的候選產品。沒有就這些候選產品的安全性或有效性作出任何陳述,以供研究此類候選產品的用途。本演示文稿包含我們尚未獨立驗證的公開第三方數據。進行跨審比較存在固有的風險,應謹慎解釋結果。此類第三方數據的呈現並不代表對palazestrant與任何其他第三方候選藥物或研究的表現進行正面比較。相反,此類第三方數據是我們從公開來源中提取的,僅用於補充信息的目的。我們提醒您,不應將此處列出的第三方數據的任何比較視為並排比較,並且您不應依賴我們在這些幻燈片中展示的任何第三方候選藥物結果的完整性或準確性,這是由於研究設計、其他公司量化或合格標準的方式、結果的記錄方式以及其他區別因素和不確定性的差異。由於我們可能沒有意識到或可能無法充分呈現各種區別因素和不確定性,因此此處提出的比較可能無法正確呈現此類第三方數據,這些數據可能與此處提供的數據存在重大差異。鼓勵投資者獨立審查第三方數據,不應將我們提供的此類數據(包括與palazestrant的業績進行比較的任何此類數據)作為評估我們業務的單一衡量標準。此處包含的商標是其所有者的財產,僅用於參考目的。此類使用不應被解釋為對此類產品的認可。
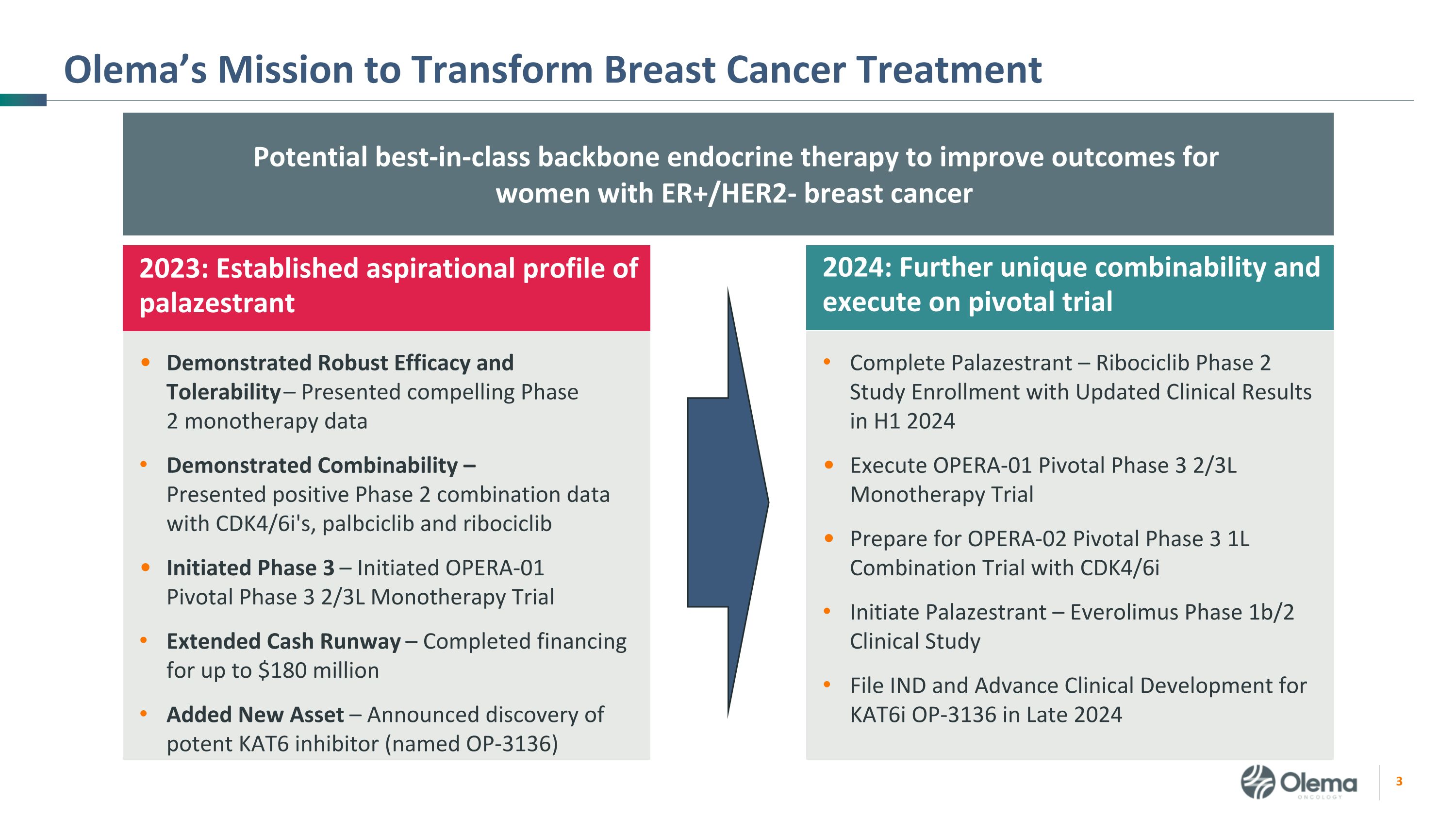
Olema 的使命是改變乳腺癌治療的潛在一流骨幹內分泌療法,以改善 2024 年 ER+/HER2-乳腺癌女性的預後:進一步獨特的組合性並執行關鍵試驗完成 Palazestrant — Ribociclib 2 期研究入組,更新臨牀結果 2024 年上半年執行 OPERA-01 關鍵期 2/3L 單一療法試驗,為使用 CDK4/6i 的 OPERA-02 關鍵期 1L 聯合試驗做準備 Everolimus 1b/2 期臨牀研究檔案 Kat6i OP 的臨牀研究和高級臨牀開發2024 年末的 -3136:已確立的 palazestrant 吸氣概況顯示出強勁的療效和耐受性 — 提供了令人信服的 2 期單一療法數據,顯示了可組合性 — 提供了積極的 2 期聯合數據,啟動了 OPERA-01 關鍵第 3 期 2/3L 單一療法試驗,延長了現金流 — 完成了高達 1.8 億美元的融資,新增了資產 — 宣佈發現強效的 KATC 6 抑制劑(命名為 OP-3136)

Palazestrant:一種差異化的下一代內分泌療法 Palazestrant,一種完整的雌激素受體 (ER) 拮抗劑 (CERAN),可有效完全滅活 ER,阻斷 ER 驅動的轉錄活性,抑制 ER 驅動的乳腺癌細胞生長,並強力誘導 ER 降解。完成 ER 拮抗劑關閉 AF2 並招募 N-cor 來滅活 AF1 Palazestrant Palazestrant Estrant (CERAN/SERD) Complete ER Antagonism CERAN 可完全阻斷急診室的生長和增殖信號,從而推動野生型和突變體 ER 中更深、更持久的反應極具吸引力的藥代動力學、口服生物利用度和 8 天半衰期良好的耐受性對大量預處理的患者具有良好的耐受性穩健的腫瘤收縮率臨牀前模型中野生型和突變體急診中有意義的抗腫瘤活性在臨牀環境中具有持久的益處組合性可與全劑量ribociclib或palbociclib聯合使用——不含DDI*,總體耐受性與CDK4/6i plus的預期特徵一致內分泌療法中樞神經系統滲透在非臨牀大腦中表現出活性轉移模型 *在 SABCS 2023 上對 Palbociclib 或 Ribociclib 聯合研究的臨時更新。縮略語:AF1,活化因子 1;AF2,活化因子 2;CDK4/6i,細胞週期蛋白依賴激酶 4/6 抑制劑;DDI,藥物相互作用參考文獻:Shang 和 Brown,《科學》,2002 年:第 295 卷,第 5564 期,第 2465-2468 頁;Webb、Nguyen 和 Kushner,JBC,2003 年:第 278 卷,第 6912—6920 頁

2/3L 和 1L MBC 治療的競爭項目和市場機會當前活性項目 2L/3L ER+/HER2-MBC 1L Combo ER+/HER2-MBC * *美納里尼的藥物 ORSERDU(elacestrant)於 2023 年 1 月 27 日獲得美國食品藥品管理局批准,用於治療初始荷爾蒙療法後的 ER+/HER2-ESR1 突變轉移性乳腺癌。/患者 ~15萬療程持續時間2~2-12個月以上的市場潛力3 50億美元以上的患者約11.5萬療程持續時間2 ~6-36個月以上的市場潛力3 100億美元以上的市場潛力根據ER+/HER2-1 12025年發病率預測估算的100億美元以上的市場機會。Olema內部數據,基於Informa ER+/HER2-BC患病率的市場預測。2Olema內部數據。總內分泌療法市場(美國和歐盟5國)的32025年機會估計。Olema 內部數據。w/palbociclib w/palbociclib w/palbociclib
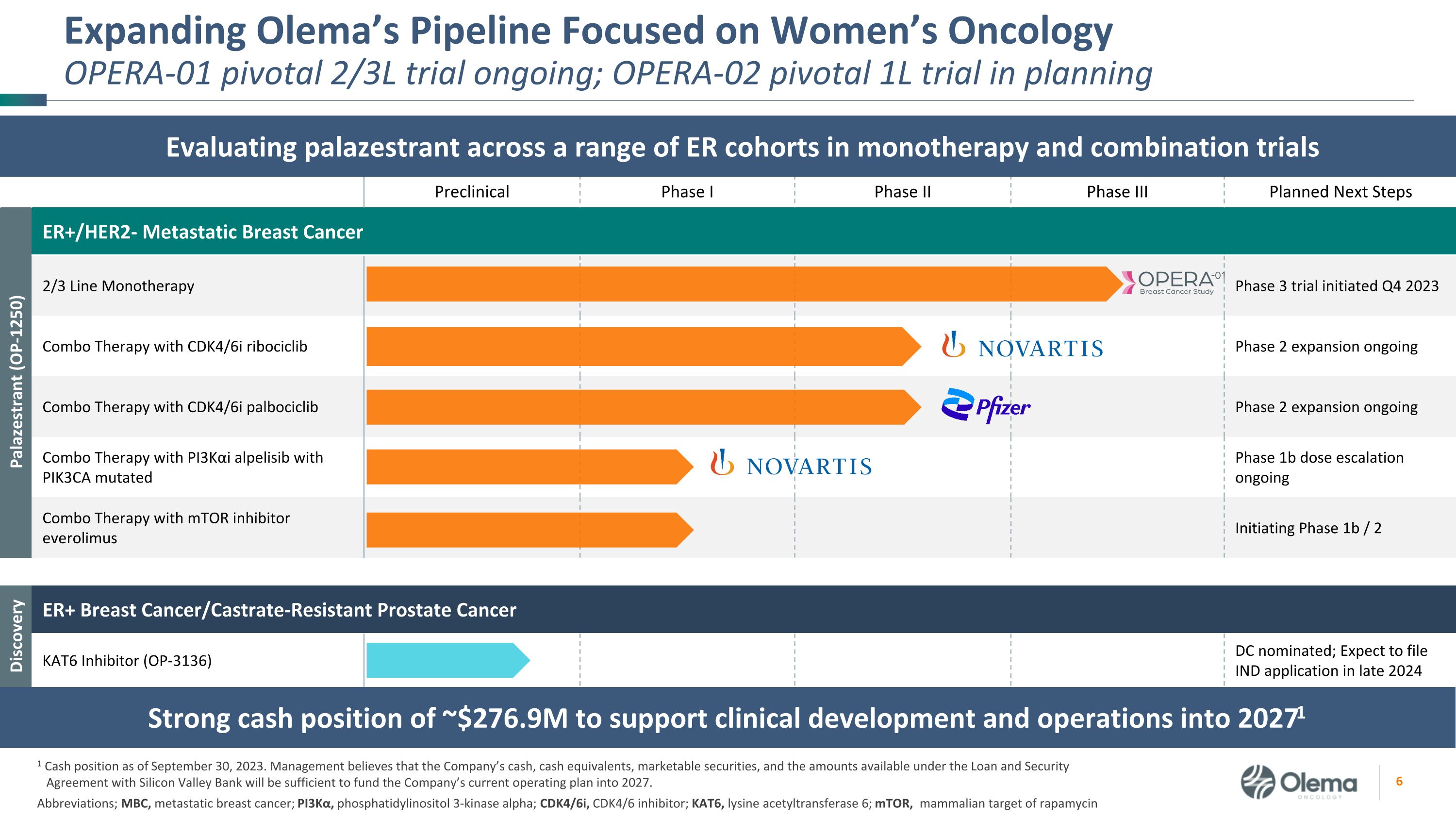
臨牀前 I 期 II 期 II 期 III II 期計劃進行後續步驟 Palazestrant (OP-1250) ER+/HER2-轉移性乳腺癌 2/3 系單一療法 3 期試驗於 2023 年第四季度啟動 CDK4/6i ribociclib 的組合療法 2 期擴展正在進行中 PI3KαI alpelisib 與 PIK3CA 突變 1b 期劑量遞增的組合療法正在進行的 mTOR 抑制劑 everolimus 聯合療法啟動 1b/2 階段 Discovery ER+ 乳腺癌/去勢抗性前列腺癌發現 KAT6 抑制劑 (OP-3136) DC 提名;預計將在2024年底提交IND申請,擴大Olema的產品線,專注於女性腫瘤學Opera-01的關鍵2/3L試驗正在進行中;OPERA-02 關鍵1L試驗正在規劃縮寫中;MBC,轉移性乳腺癌;PI3Kα,磷脂酰肌醇3-激酶 α;CDK4/6i,CDK4/6抑制劑;KAT6,賴氨酸乙酰轉移酶 6;mmTOR,雷帕黴素的目標在單一療法和聯合試驗中評估一系列急診室羣組中的帕拉西司坦的強勁現金狀況約為2.769億美元,用於支持20271年的臨牀開發和運營 1 截至20271年的現金狀況2023 年 9 月 30 日。管理層認為,公司的現金、現金等價物、有價證券以及與硅谷銀行簽訂的貸款和擔保協議下的可用金額將足以為公司當前的2027年運營計劃提供資金。

Palazestrant 2 期單一療法臨牀結果 (ESMO 2023)
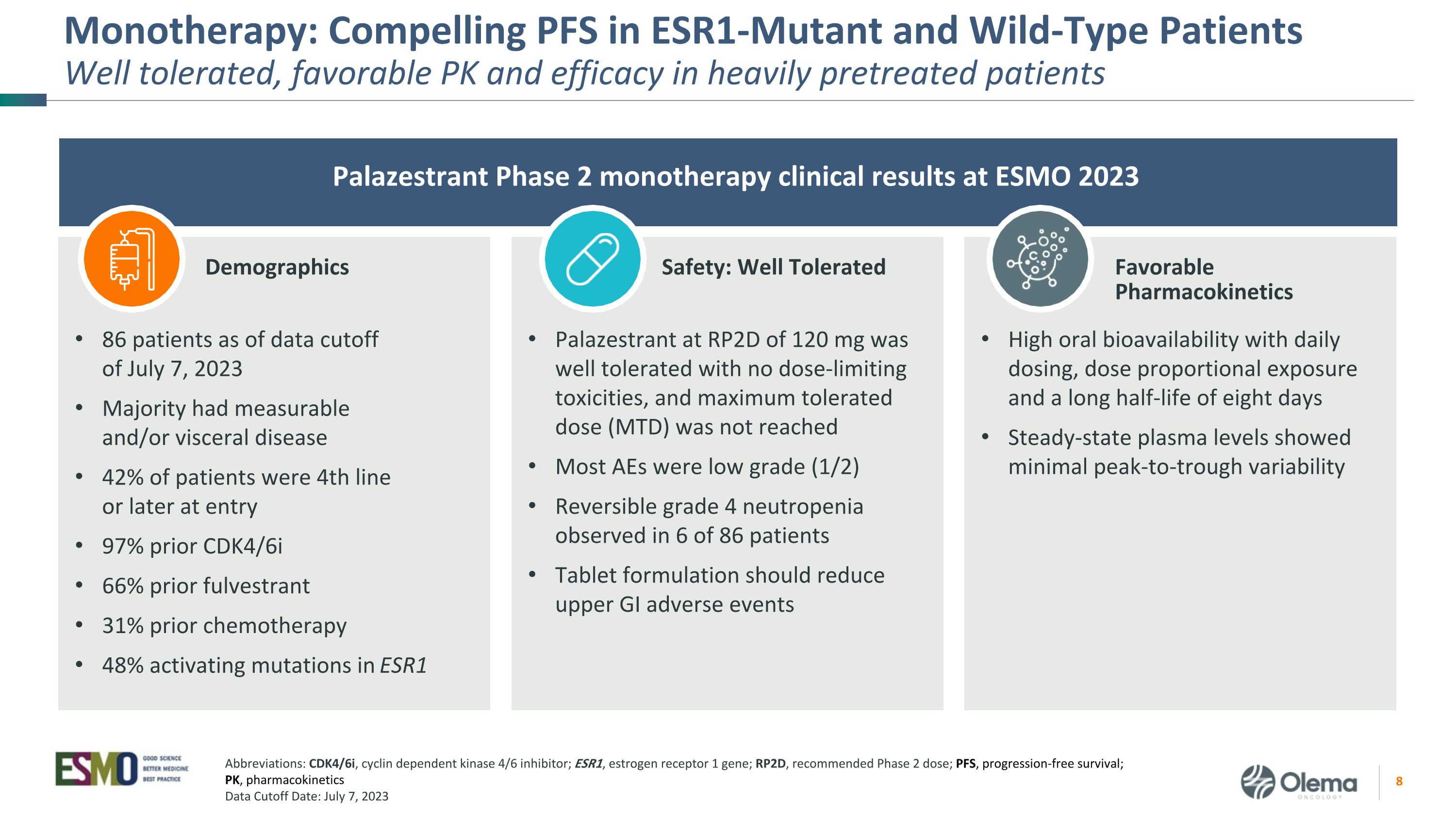
單一療法:ESR1突變體和野生型患者具有良好的耐受性、良好的PK值和療效 Palazestrant 2023 年 ESMO 2 期單一療法臨牀結果口服生物利用度高,每日劑量、劑量比例暴露和長達八天的半衰期,穩態血漿水平顯示出最小的峯谷變異性截至 2023 年 7 月 7 日數據截止日期 86 名患者進行了可測量和/或內臟疾病 42% 的患者在入院時處於第 4 線或晚期 97% 之前是 CDK4/6i 66% 之前是 fulvestrant 31%化療 RP2D 為 120 mg 的 ESR1 Palazestrant 中有 48% 的激活突變耐受性良好,沒有劑量限制毒性,未達到最大耐受劑量 (MTD)。大多數 AE 為低級 (1/2) 可逆的 4 級中性粒細胞減少在 86 名患者中觀察到 4 級中性粒細胞減少症片劑配方應減少上消化道不良事件人口統計學安全性:耐受性良好有利藥代動力學縮寫:CDK4/6i,細胞週期蛋白依賴性激酶 4/6 抑制劑;ESR1,雌激素受體 1 基因;RP2D,推薦的 2 期劑量;PFS,無進展存活率;PK,藥代動力學數據截止日期:2023 年 7 月 7 日
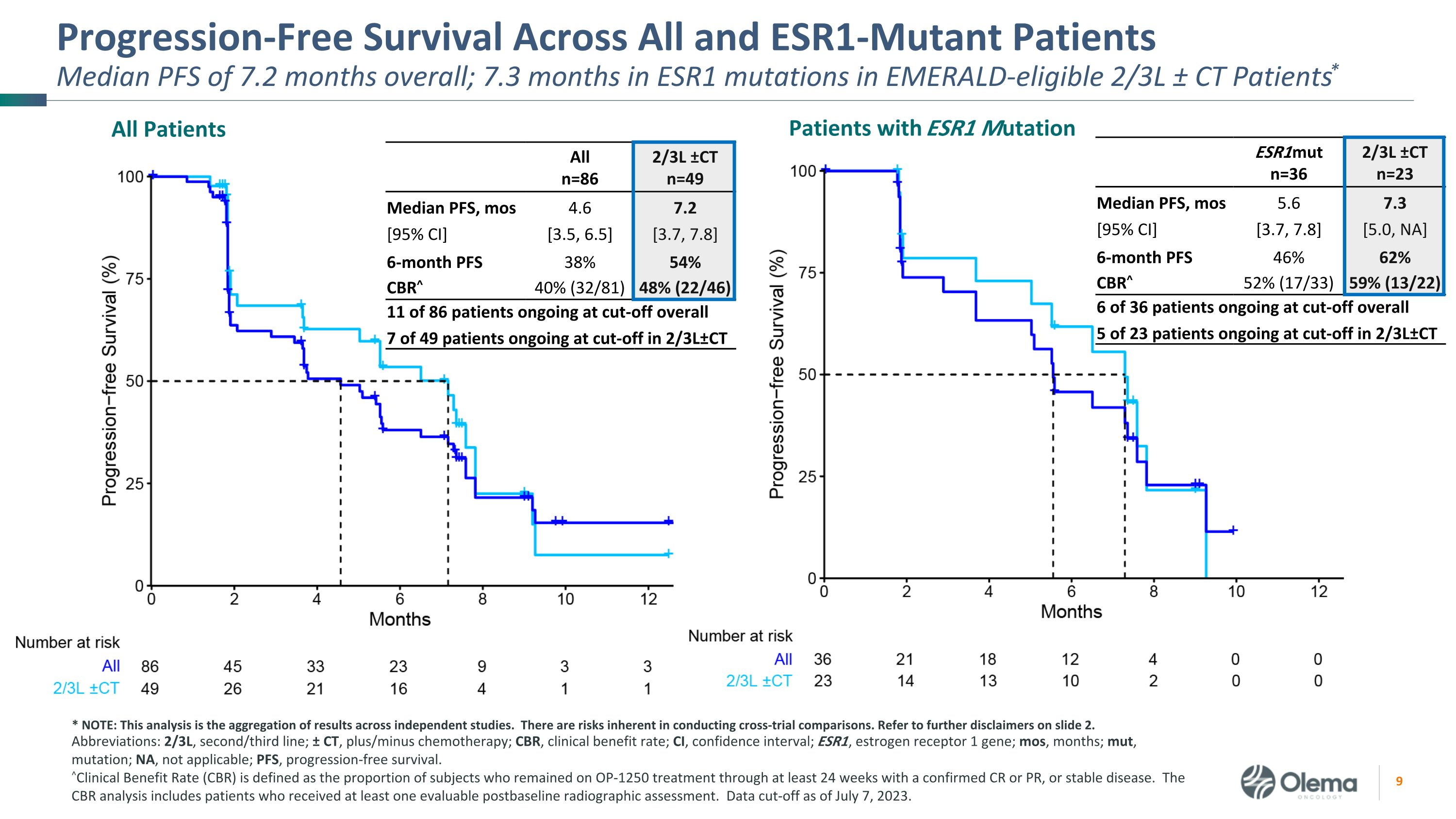
所有和 ESR1 突變患者的無進展存活率總計 7.2 個月;符合 Emerald 條件的 2/3L ± CT 患者的 ESR1 突變中位數 7.3 個月* 所有 ESR1 突變患者 Alln=86 2/3L ±ctn=49 中位數 PFS,mos [95% 置信區] 4.6 [3.5, 6.5] 7.2 [3.7, 7.8]6 個月 PFS 38% 54% CBR^ 40% (32/81) 48% (22/46) 86 名患者中 11 名患者中總共有 11 名患者在 2/3L±CT 處於截止期 ESR1mutn=36 2/3L ±ctn=23 中位數 PFS,mos [95% 置信區] 5.6 [3.7, 7.8] 7.3 [5.0,不是]6 個月 PFS 46% 62% CBR^ 52% (17/33) 59% (13/22) 36 名患者中有 6 名患者在 2/3L±CT 處於截止期 23 名患者中 5 名縮寫:2/3L,二線/三線;± CT,加/減化療;CBR,臨牀獲益率;CI,置信區間;ESR1,雌激素受體 1 基因;mos,月份;,突變;NA,不適用;PFS,無進展存活。^臨牀受益率 (CBR) 定義為在至少 24 周內仍在接受 OP-1250 治療且確診為 CR 或 PR 或病情穩定的受試者比例。CBR 分析包括接受過至少一次可評估的基線後射線照相評估的患者。截止日期為 2023 年 7 月 7 日。* 注:該分析是獨立研究結果的彙總。進行交叉試驗比較存在固有的風險。請參閲幻燈片 2 中的更多免責聲明。
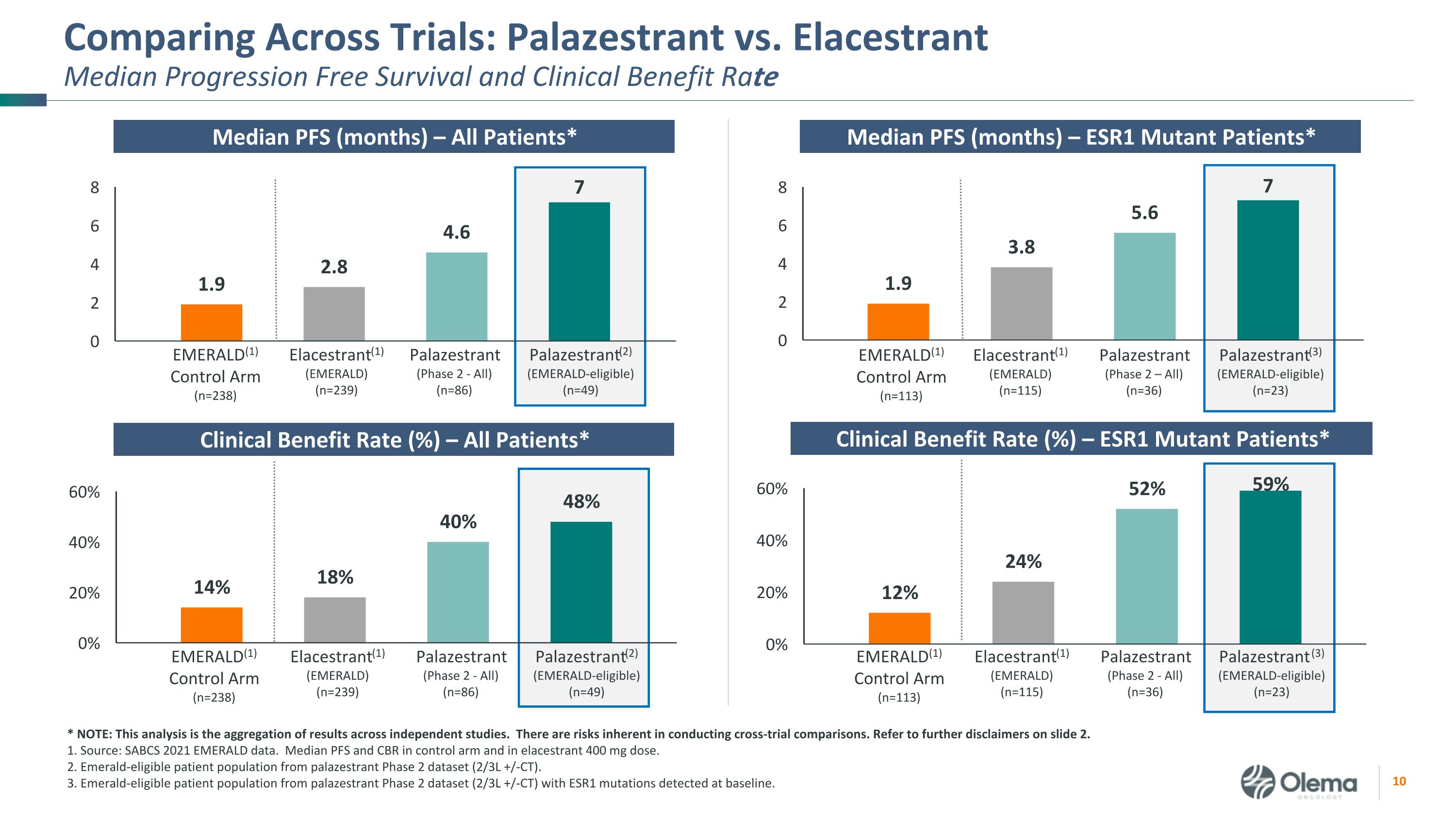
對比試驗:Palazestrant 與 Elastrant 中位數自由進展存活率和臨牀受益率 EMERALD (1) 對照組 (n=238) Elastrant (1) (EMERALD) (n=239) Palazestrant (2)(符合 Emerald 資格)(n=49)Palazestrant(2 期——全部)(n=86)EMERALD (1) 控制臂(n=113)Elastrant (1) (EMERALD) (n=115) Palazestrant (3)(符合 Emerald 資格)(n=23)Palazestrant(第 2 階段 — 全部)(n=36)中位數 PFS(月)— 所有患者* PFS 中位數(月)— ESR1 突變患者* 臨牀獲益率(%)— ESR1 突變患者* EMERALD (1)) 控制臂 (n=238) Elastrant (1) (EMERALD) (n=239) Palazestrant (2)(符合 Emerald 資格)(n=49)Palazestrant(第 2 階段-全部)(n=86) EMERALD (1) 控制臂 (n=113) Elacestrant (1) (EMERALD) (n=115) Palazestrant (3) Emerald (1) Emerald (1) (EMERALD) (1) (EMERALD) (n=115) Palazestrant (3) (Emerald) (3) Emerald (符合ALD資格)(n=23)Palazestrant(第二階段——全部)(n=36)*注:該分析彙總了獨立研究的結果。進行交叉試驗比較存在固有的風險。請參閲幻燈片 2.1 中的更多免責聲明。資料來源:SABCS 2021 年 EMERALD 數據。對照組和彈性劑量的 PFS 和 CBR 中位數 400 mg。2.來自 palazestrant 2 期數據集(2/3L +/-CT)的 Emerald 合格患者羣體。3.來自 palazestrant 2 期數據集(2/3L +/-CT)的 Emerald 合格患者羣體,基線時檢測到 ESR1 突變。
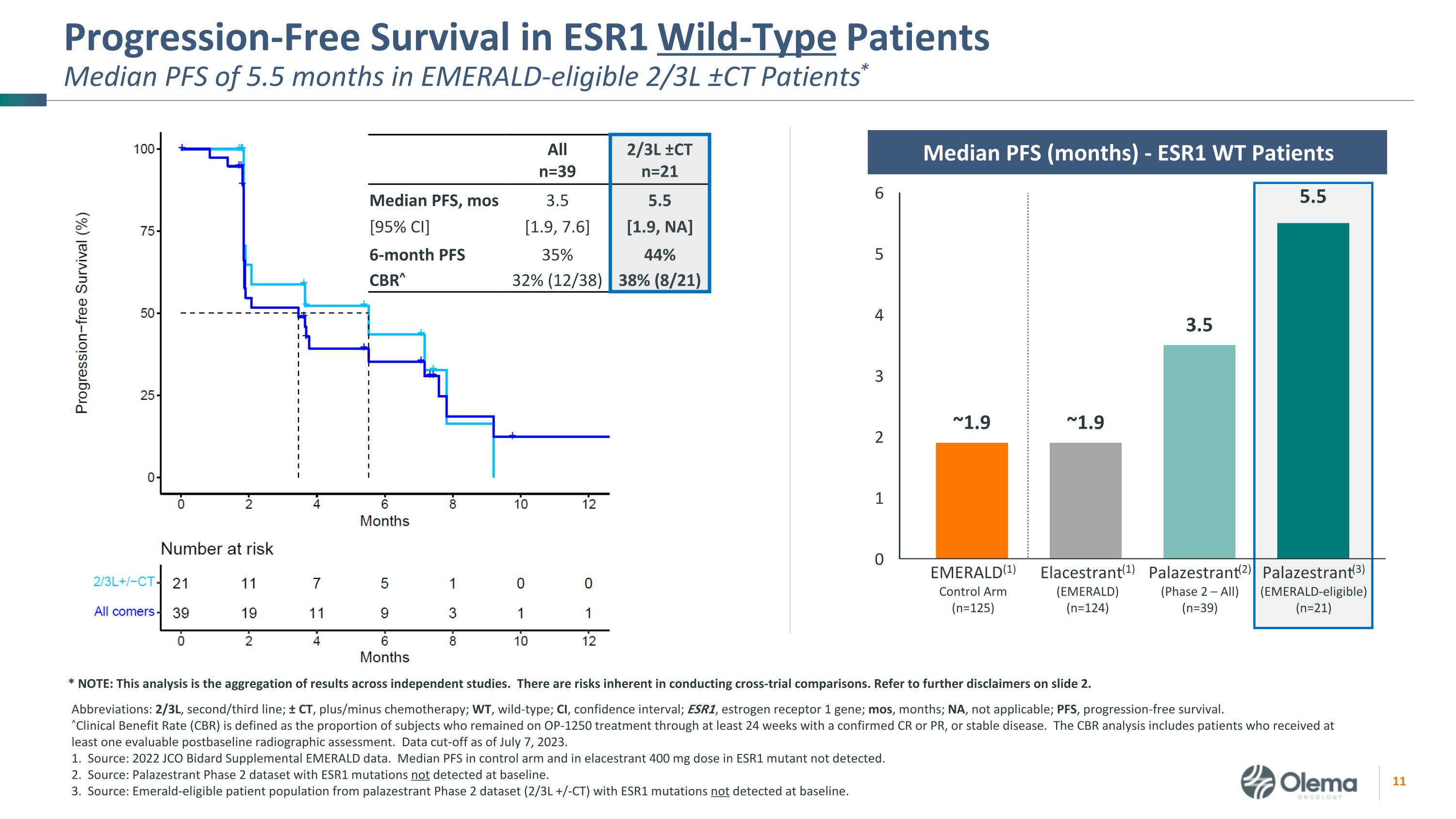
ESR1 野生型患者的無進展存活率符合Emerald條件的2/3L ±CT患者中位PFS為5.5個月*縮寫:2/3L,第二/三線;± CT,加/減化療;WT,野生型;CI,置信區間;ESR1,雌激素受體 1 基因;mos,月;NA,不適用;PFS,無進展生存。^臨牀受益率 (CBR) 定義為在至少 24 周內仍在接受 OP-1250 治療且確診為 CR 或 PR 或病情穩定的受試者比例。CBR 分析包括接受過至少一次可評估的基線後射線照相評估的患者。截止日期為 2023 年 7 月 7 日。1.資料來源:2022年JCO Bidard補充綠寶石數據。未檢測到 ESR1 突變體中對照組和彈性劑中 400 mg 劑量的 PFS 中位數。2.來源:Palazestrant 第 2 期數據集,基線時未檢測到 ESR1 突變。3.來源:palazestrant 2期數據集(2/3L +/-CT)中符合Emerald條件的患者羣體,其ESR1突變在基線時未檢測到。Alln=39 2/3L ±ctn=21 中位數 PFS,mos [95% 置信區] 3.5 [1.9, 7.6] 5.5 [1.9,不適用]6 個月 PFS 35% 44% CBR^ 32% (12/38) 38% (8/21) EMERALD (1) 控制臂 (n=125) Elastrant (1) (EMERALD) (n=124) Palazestrant (3)(符合綠寶石資格)(n=21)Palazestrant(2)(第 2 階段 — 全部)(n=39)Pfs 中位數(月)-ESR1 WT 患者 * 注意:該分析是獨立研究結果的彙總。進行交叉試驗比較存在固有的風險。請參閲幻燈片 2 中的更多免責聲明。
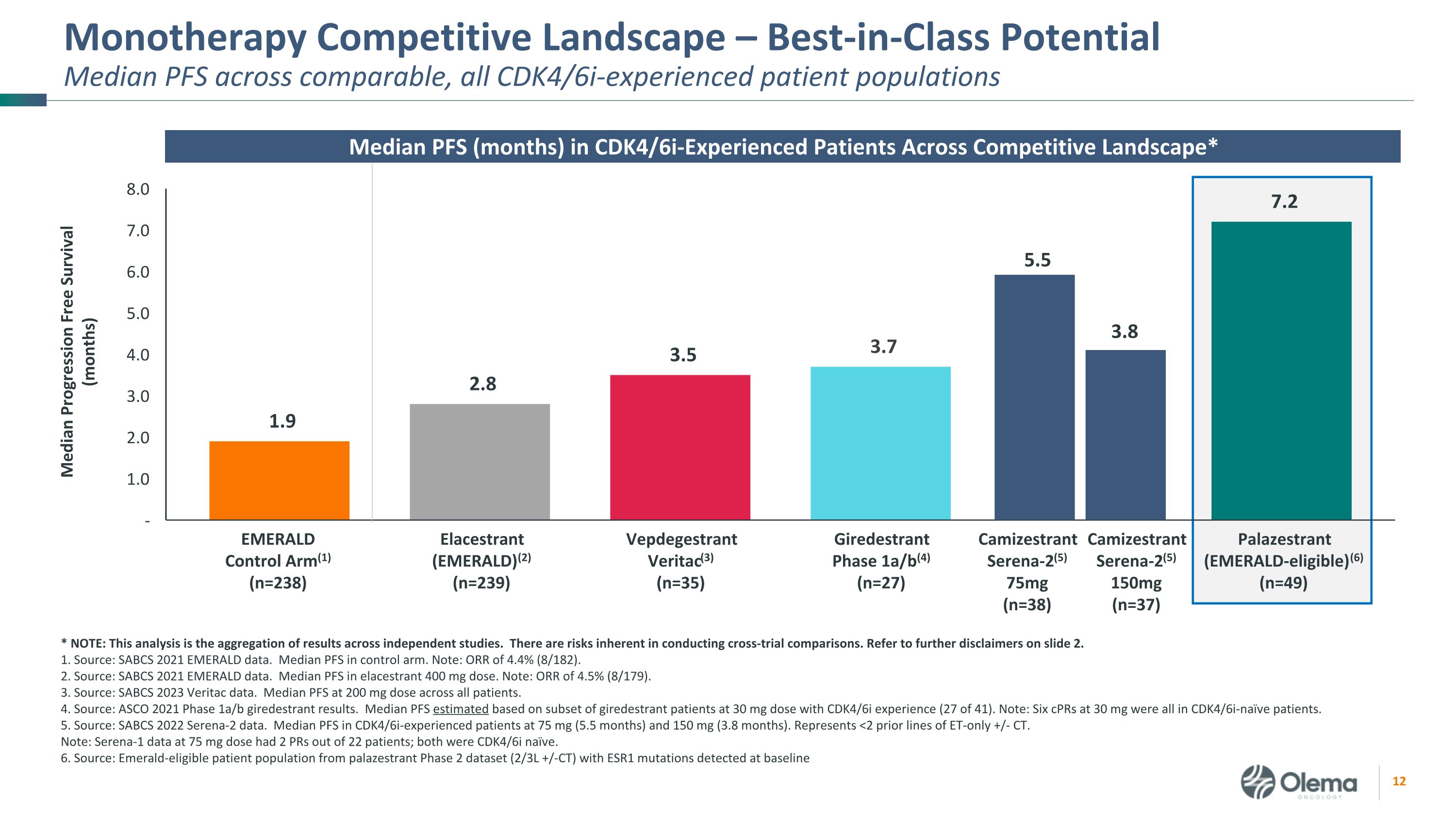
單一療法的競爭格局——在所有具有CDK4/6I經驗的同類患者羣體中,潛在的中位PFS處於同類中位數。*注:該分析彙總了獨立研究的結果。進行交叉試驗比較存在固有的風險。請參閲幻燈片 2.1 中的更多免責聲明。資料來源:SABCS 2021 年 EMERALD 數據。控制臂的 PFS 中位數。注意:ORR 為 4.4% (8/182)。2.資料來源:SABCS 2021 年 EMERALD 數據。400 mg 劑量的 PFS 中位數。注意:ORR 為 4.5% (8/179)。3.資料來源:SABCS 2023 Veritac 數據。所有患者的 PFS 中位數為 200 mg。資料來源:ASCO 2021 年第 1a/b 階段 giredestrant 結果。PFS中位數是根據劑量為30 mg且有CDK4/6i經歷的吉瑞司朗患者子集(41例中的27例)估算得出的。注意:六次 30 mg 的 CPR 均為 CDK4/6I-naive 患者。5.資料來源:SABCS 2022 Serena-2 數據。經歷過CDK4/6I的患者的PFS中位數為75毫克(5.5個月)和150毫克(3.8個月)。代表

1b/2 期聯合臨牀結果(SABCS 2023)
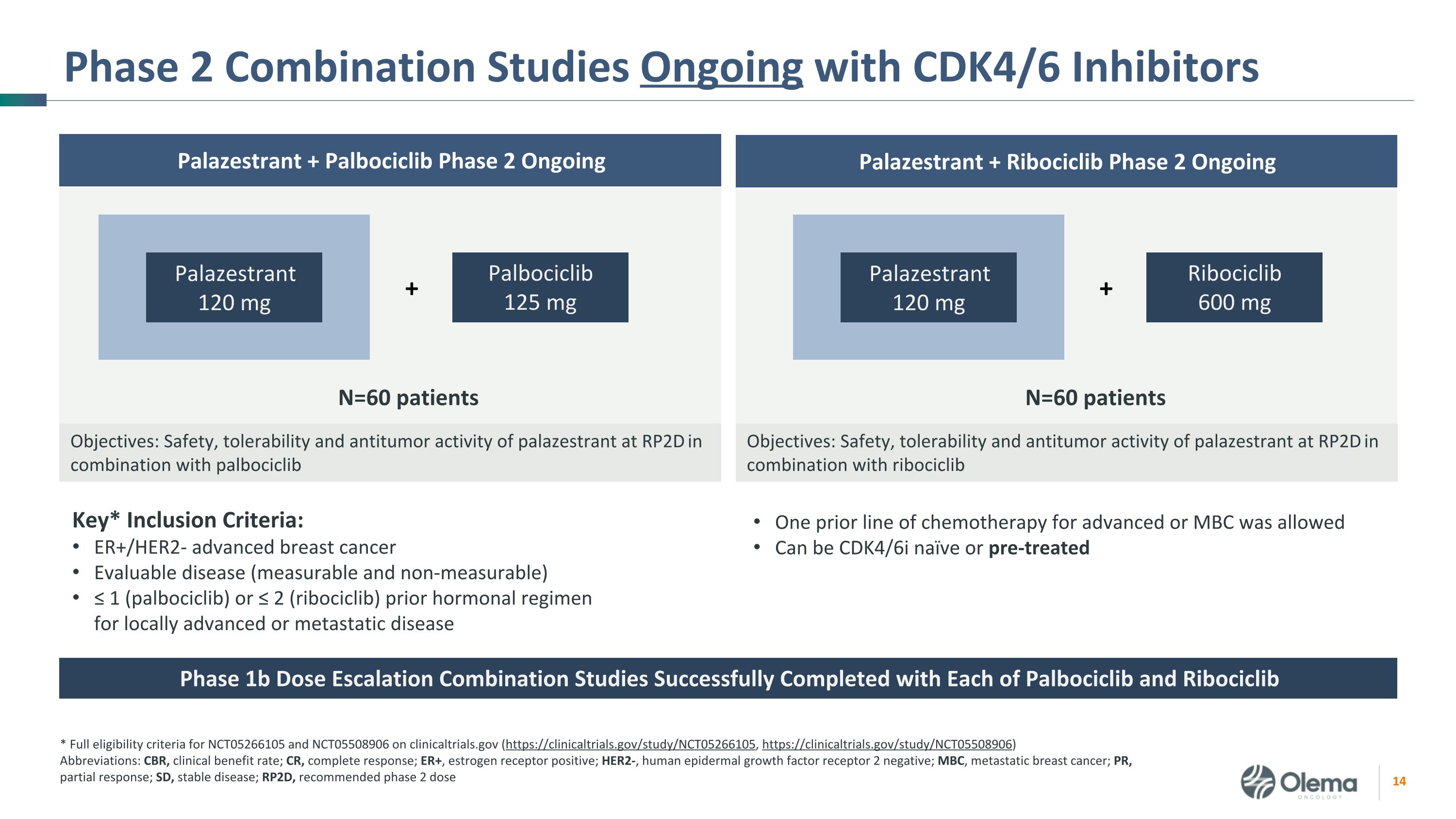
正在進行的使用 CDK4/6 抑制劑的 2 期聯合研究關鍵* 納入標準:ER+/HER2-晚期乳腺癌可評估疾病(可測量且不可測量)≤ 1(palbociclib)或 ≤ 2(ribociclib)先前針對局部晚期或轉移性疾病的激素方案 * clinicaltrials.gov 上的 NCT05266105 和 NCT05508906 的完整資格標準(https://clinicaltrials.gov/study/NCT05266105,https://clinicaltrials.gov/study/NCT05508906)縮寫:CBR,臨牀受益率;CR,完全反應;ER+,雌激素受體陽性;HER2-,人類表皮生長因子受體 2 陰性;MBC,轉移性乳腺癌;PR,部分反應;SD,穩定疾病;RP2D,推薦的 2 期劑量 Palazestrant + Ribociclib 第 2 期持續目標:palazestrant 與 palbociclib 聯合使用 120 mg Palbociclib 125 mg + N=60 患者的安全性、耐受性和抗腫瘤活性:Palazestrant 與 ribociclib Palazestrant + Palbociclib 2 期聯合使用 RP2D 時的安全性、耐受性和抗腫瘤活性 Palazestrant 120 mg Ribociclib 600 mg + 前一線允許對晚期或 MBC 進行化療可以是 CDK4/6i 天真或經過預治療的 1b 期劑量遞增聯合研究 Palbociclib 和 Ribociclib 均成功完成
Palbociclib 組合:野生型和 ESR1 突變體 Palbociclib 組合中均顯示出誘人的組合性,無 DDIS初步療效信號和抗腫瘤活性 SABCS 2023 年 1b/2 期臨牀結果,正在進行中 palbociclib 和 palazestrant 之間沒有藥物相互作用 (DDI) Palbociclib 125 mg 的暴露量,palbociclib 沒有影響任何劑量水平下的palazestrant暴露截至2023年9月15日數據截止日期,46名經過大量預治療的患者在研究進入時為2/3L+,44% 為內臟疾病;22% 不可測量的疾病 72% 之前曾接受過 CDK4/6i 治療 22% 之前接受過化療 43% 的 ESR1 激活突變,劑量遞增期間未觀察到劑量限制毒性 (DLT) 未觀察到與劑量相關的發病率或嚴重程度增加總體安全性和耐受性概況與 palbociclib + 芳香化酶抑制劑的既定概況一致縮寫:CDK4/6i,細胞週期蛋白依賴型酶 4/6 抑制劑;ESR1,雌激素受體 1 基因;TEAE,治療緊急不良事件;數據截止日期:2023 年 9 月 15 日人口統計學安全:耐受性良好良好的藥代動力學
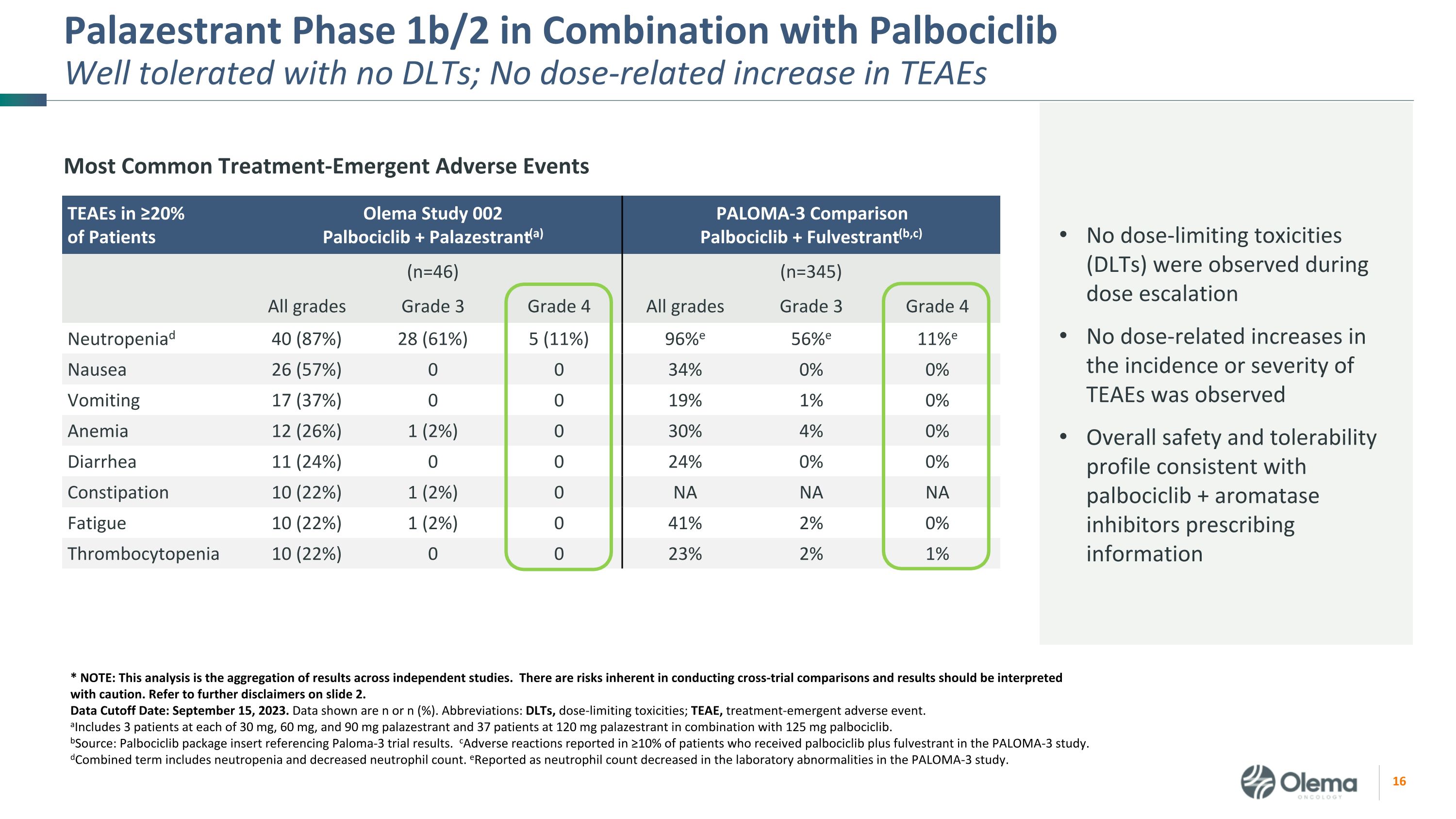
Palazestrant 1b/2 期與 Palbociclib 聯合使用耐受性良好,無 DLT;TEAE 沒有劑量相關增加 ≥ 20% 的患者中最常見的治療緊急不良事件 TEAE Olema 研究 002Palbociclib + Palazestrant (a) PALOMA-3 對比 Palbociclib + Fulvestrant (b, c) (n=46) (n=345) 全部三年級四年級所有年級 3 年級 4 級中性粒細胞減少症 40 (87%) 28 (61%) 5 (11%) 96% e 56% e 11% e 噁心 26 (57%) 0 0 34% 0% 0% 嘔吐 17 (37%) 0 0 19% 0% 貧血 12 (26%) 0 30% 腹瀉 11 (24%) 0 24% 0% 便祕 10 (22%) 0 24% 0% 0% 便祕 10 (22%)%) 1 (2%) 0NA NA NA 疲勞 10 (22%) 1 (2%) 0 41% 2% 0% 血小板減少症 10 (22%) 0 23% 2% 1% * 注:該分析是獨立研究結果的彙總。進行跨審比較存在固有的風險,應謹慎解釋結果。請參閲幻燈片 2 中的更多免責聲明。數據截止日期:2023 年 9 月 15 日。顯示的數據為 n 或 n (%)。縮寫:DLT,劑量限制毒性;TEAE,治療緊急不良事件。a包括 30 mg、60 mg 和 90 mg palazestrant 各有 3 名患者,37 名服用 120 mg palazestrant 和 125 mg palbociclib 的患者。bSource:參考了 Paloma-3 試驗結果的 Palbociclib 包裝説明書。在 ≥ 10% 的接受治療的患者中報告了不良反應 PALOMA-3 研究中的 palbociclib 加氟維司朗。d組合術語包括中性粒細胞減少和中性粒細胞計數減少。e報告為實驗室異常中性粒細胞計數下降所致PALOMA-3 研究。劑量遞增期間未觀察到劑量限制毒性(DLT)未觀察到TEAE的發生率或嚴重程度與劑量相關的增加。總體安全性和耐受性概況與palbociclib +芳香化酶抑制劑的處方信息一致
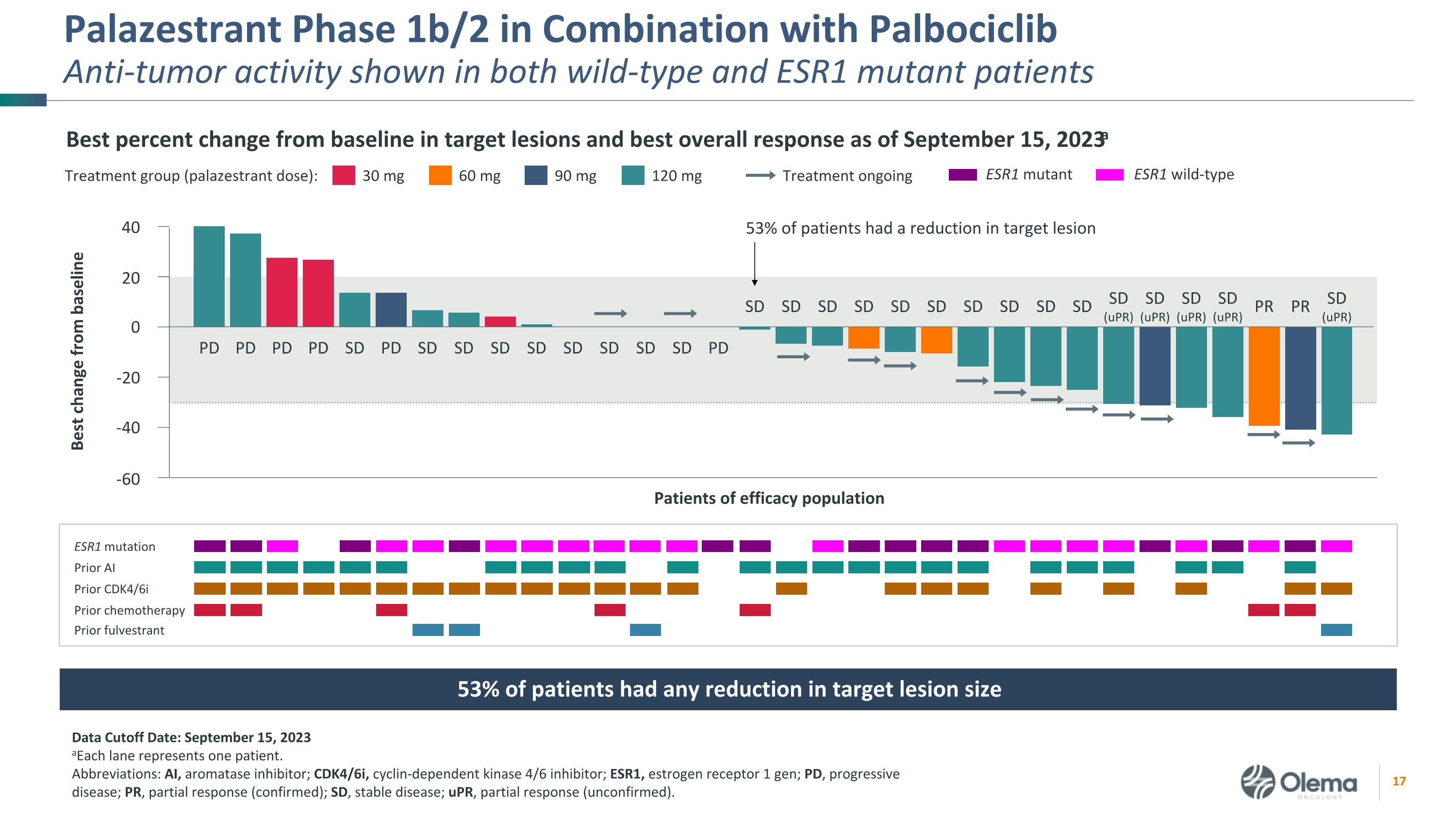
Palazestrant 1b/2 期聯合使用 palboCiclibanti-Tumor 活性在野生型和 ESR1 突變患者中均顯示出截至2023年9月15日的靶損與基線相比的最佳變化百分比和最佳總體反應a 數據截止日期:2023 年 9 月 15 日 a每個通道代表一名患者。縮寫:AI,芳香化酶抑制劑;CDK4/6i,週期蛋白依賴性激酶 4/6 抑制劑;ESR1,雌激素受體 1 代;PD,進行性疾病;PR,部分反應(確認);SD,穩定疾病;uPR,部分反應(未經證實)。30 mg 治療組(palazestrant 劑量):60 mg 90 mg 120 mg 正在進行的 ESR1 突變 Prior AI Prior k4/6i 之前的化療先前有療效的患者羣體 PD PD PD PD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD (uPR) SD (uPR) SD (uPR) 53% 的患者有目標病變減小 40 20 0 -20 -40 -60 與基線 ESR1 突變體 ESR1 野生型相比的最佳變化 53% 的患者目標病變大小減小
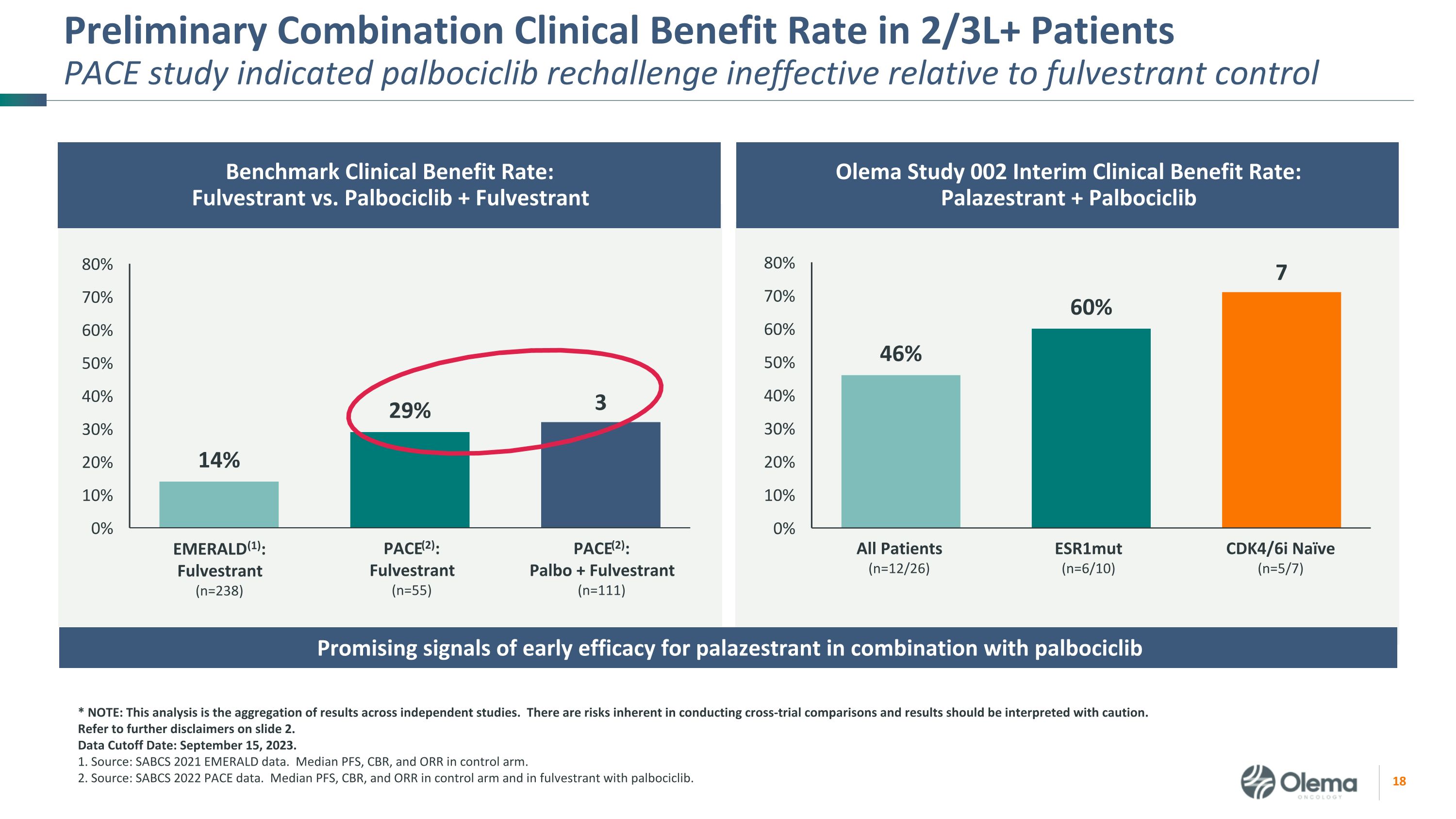
2/3L+ PatientSpace 研究的初步聯合臨牀受益率表明 palbociclib 再挑戰相對於氟維司羣控制無效所有患者 (n=12/26) esr1mut (n=6/10) cdk4/6i Naive (n=5/7) 基準臨牀受益率:Fulvestrant 與 palbociclib + Fulvestrant Olema 研究 002 中期臨牀受益率:Palazestrant + Palbociclib * 注:該分析是獨立研究結果的彙總。進行交叉試驗比較存在固有的風險,應謹慎解釋結果。請參閲幻燈片 2 中的更多免責聲明。數據截止日期:2023 年 9 月 15 日。1.來源:SABCS 2021 年翡翠數據。控制臂中位數 PFS、CBR 和 ORR。2.來源:SABCS 2022 PACE 數據。對照組中PFS、CBR和ORR的中位數,以及使用palbociclib的fulvestrant。PACE (2):Fulvestrant (n=55) PACE (2):Palbo + Fulvestrant (n=111) EMERALD (1):Fulvestrant (n=238) palazestrant 與 palbociclib 聯合使用可獲得早期療效的好信號
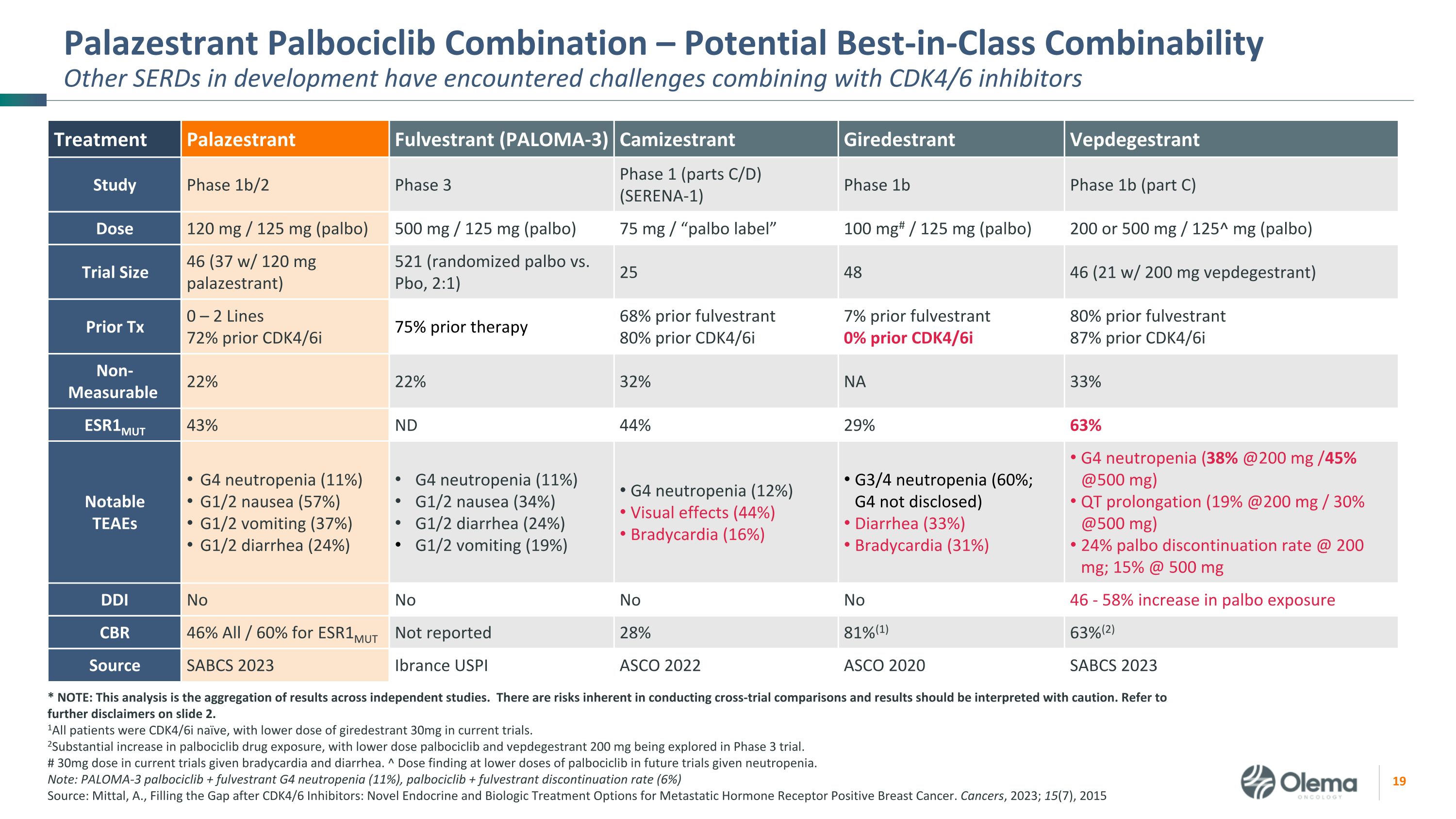
Palazestrant Palbociclib組合——潛在的同類最佳組合性其他正在開發的SERD在與CDK4/6抑制劑聯合使用時遇到了挑戰 * 注意:該分析彙總了獨立研究的結果。進行跨審比較存在固有的風險,應謹慎解釋結果。請參閲幻燈片2中的更多免責聲明。1所有患者均為CDK4/6i天真,目前的試驗中girestrant 30mg的劑量較低。2palbociclib藥物暴露量大幅增加,3期試驗中正在探索低劑量的palbociclib和vepdegestrant 200 mg。在當前試驗中,考慮到心動過緩和腹瀉,劑量為30mg。^ 在較低劑量的palbociclib下發現劑量在未來的試驗中,ciclib將用於中性粒細胞減少症。注意:PALOMA-3 palbociclib + fulvestrant G4 中性粒細胞減少症(11%),palbociclib + fulvestrant停藥率(6%)來源:A.米塔爾,填補CDK4/6抑制劑之後的空白:轉移激素受體陽性乳腺癌的新型內分泌和生物治療選擇。癌症,2023;15(7),2015 年治療 Palazestrant Fulvestrant(PALOMA-3)Camizestrant Giredestrant Vepdegestrant 研究 1b階段 3階段(C部分)1b 階段(C 部分)劑量 120 mg/125 mg(palbo)500 mg/125 mg(palbo)75 mg/“palbo 標籤” 100 mg#/125 mg(palbo)200 或 500 mg/125^ mg(palbo)試驗規模 46(37 w/ 120 mg palazestrant)521(隨機 palbo 與 Pbo,2:1)25 48 46(21 含 200 mg vepdegestrant)Prior Tx 0 — 2 系 72% 之前的 CDK4/6i 75% 之前的治療 68% 之前的氟維司朗 80% 之前的治療 6i 7% 之前的氟維司汀 0% 之前的 CDK SERENA-14/6i 80% 之前的氟維司坦 87% 之前的 CDK4/6i 不可測量 22% 22% 32% NA 33% ESR1MUT 43% ND 44% 29% 63% 值得注意的 TEAE G4 中性粒細胞減少症 (11%) G1/2 噁心 (57%) G1/2 嘔吐 (37%) G1/2 腹瀉 (24%) G4 中性粒細胞減少 (11%) G1/2 噁心 (34%) G1/2 腹瀉 (24%) G1/2 腹瀉 (24%) G1/2 腹瀉 (24%) G1/2 噁心 (24%) G1/2 腹瀉 (24%)) G1/2 嘔吐 (19%) G4 中性粒細胞減少 (12%) 視覺效果 (44%) 心動過緩 (16%) G3/4 中性粒細胞減少 (60%;G4 未披露) 腹瀉 (33%) 心動過緩 (31%) G4 中性粒細胞減少 (38% @200 mg /45% @500 mg) QT 延長 (19% @200 mg/30% @500 mg) 24% palbo 停藥比率 @ 200 mg;15% @ 500 mg DDI 不不不不 46-palbo 曝光量增加 58% CBR 46% 全部/60% 未報告 28% 81% (1) 63% (2) 來源 SABCS 2023 Ibrance USPI ASCO 2022 ASCO 2020 SABCS 2023 ESR1MUT

Ribociclib 組合:可與 CDK4/6i-of-Preference 組合無顯著的 DDI,沒有 DLT,總體安全性與來自 SABCS 23 的 ribociclib 和 ET Ribociclib 1b 期組合數據的預期一致,正在進行的入組 Palazestrant 不影響患者的 ribociclib 藥物暴露,利博西利布對帕拉西司朗藥物暴露沒有臨牀意義的影響 19 截至 2023 年 11 月 1 日數據截止日期,接受治療的患者在研究錄入時為 2/3L+ 37% 的內臟疾病 89% 之前接受過 CDK4/6i 治療 26% 之前接受過化療 29%,ESR1 中有激活突變的總體安全性和耐受性概況與 ribociclib + 內分泌療法一致,劑量遞增期間未觀察到 DLT 且未達到 MTD 未觀察到與劑量相關的發病率或嚴重程度增加 4 級 TEAE 未報告 qtCF 值在任何時間點均未觀察到 >500 msec 縮寫:CDK4/6i,週期蛋白依賴激酶 4/6 抑制劑或;ESR1,雌激素受體 1 基因;DLT,劑量限制毒性;MTD,最大耐受劑量;TEAE,治療緊急不良事件數據截止日期:2023 年 11 月 1 日人口統計學安全:耐受性良好,沒有 DLT 有利的藥代動力學
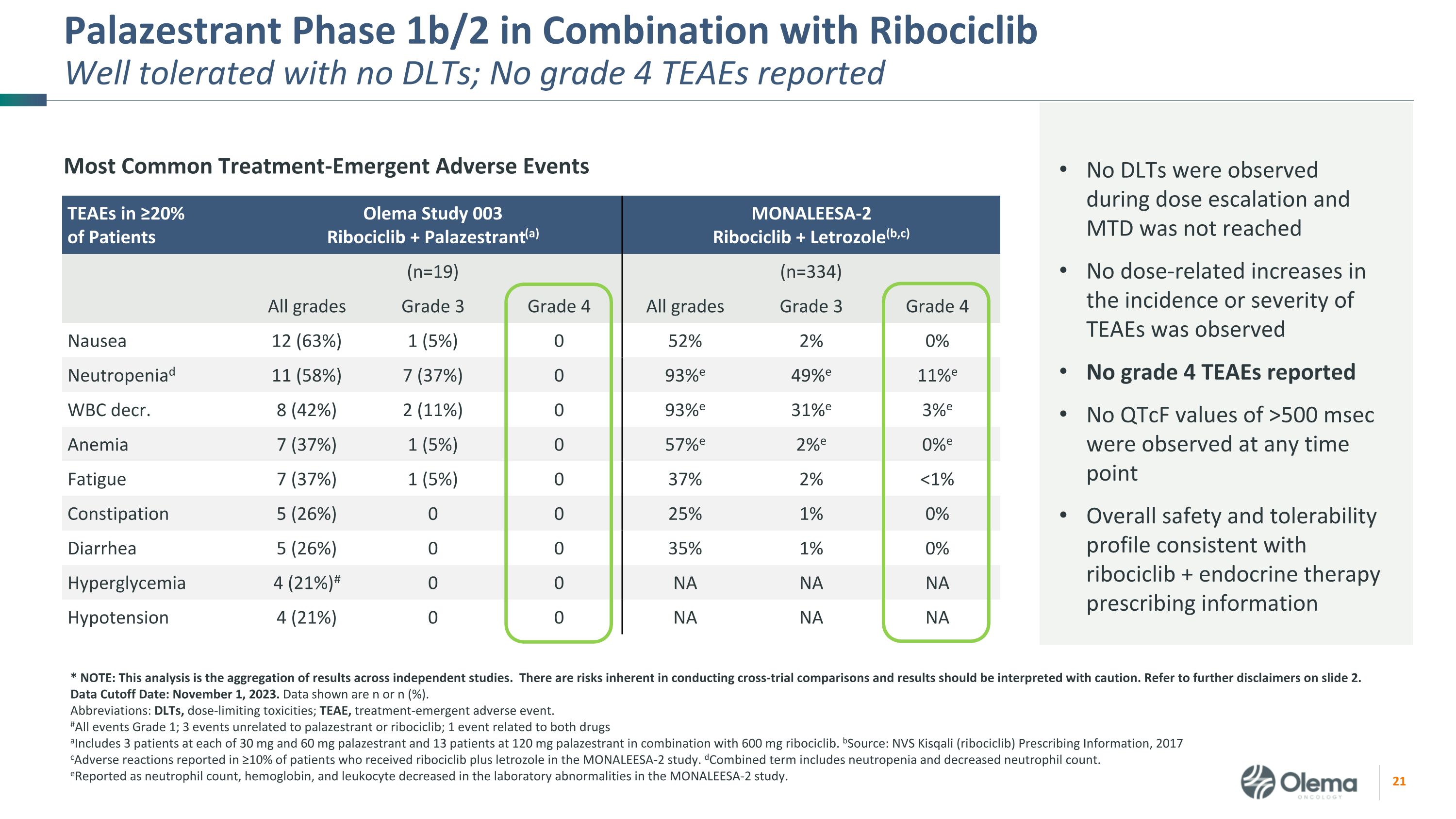
Palazestrant 1b/2 期與 Ribociclib 聯合使用耐受性良好,無 DLT;無 4 級 TEAE 報告 ≥ 20% 患者中最常見的治療緊急不良事件 TEAE Olema 研究 003Ribociclib + Palazestrant (a) monaleesa-2ribociclib + Letrozole (b, c) (n=19) (n=334) 所有等級三年級 4 級所有年級 3 級 4 級噁心 12 (63%) 1 (5%) 0 52% 2% 0% 中性粒細胞減少症 11 (58%) 7 (37%) 0 93% e 49% e 11% e 11% e WBC decr. 8 (42%) 2 (11%) 0 93% e 31% e 3% e 貧血 7 (37%) 1 (5%) 0 57% e 2% e 0% e 0% e 2% e 0% e 疲勞 7 (5%) 0 57% e 2% e 0% e 0% e 0% e 0% e 疲勞 7 (5%) 37%) 1 (5%) 0 37% 2% 500 毫秒在任何時間點觀測到總體安全性和耐受性概況與 ribociclib + 內分泌療法處方信息一致
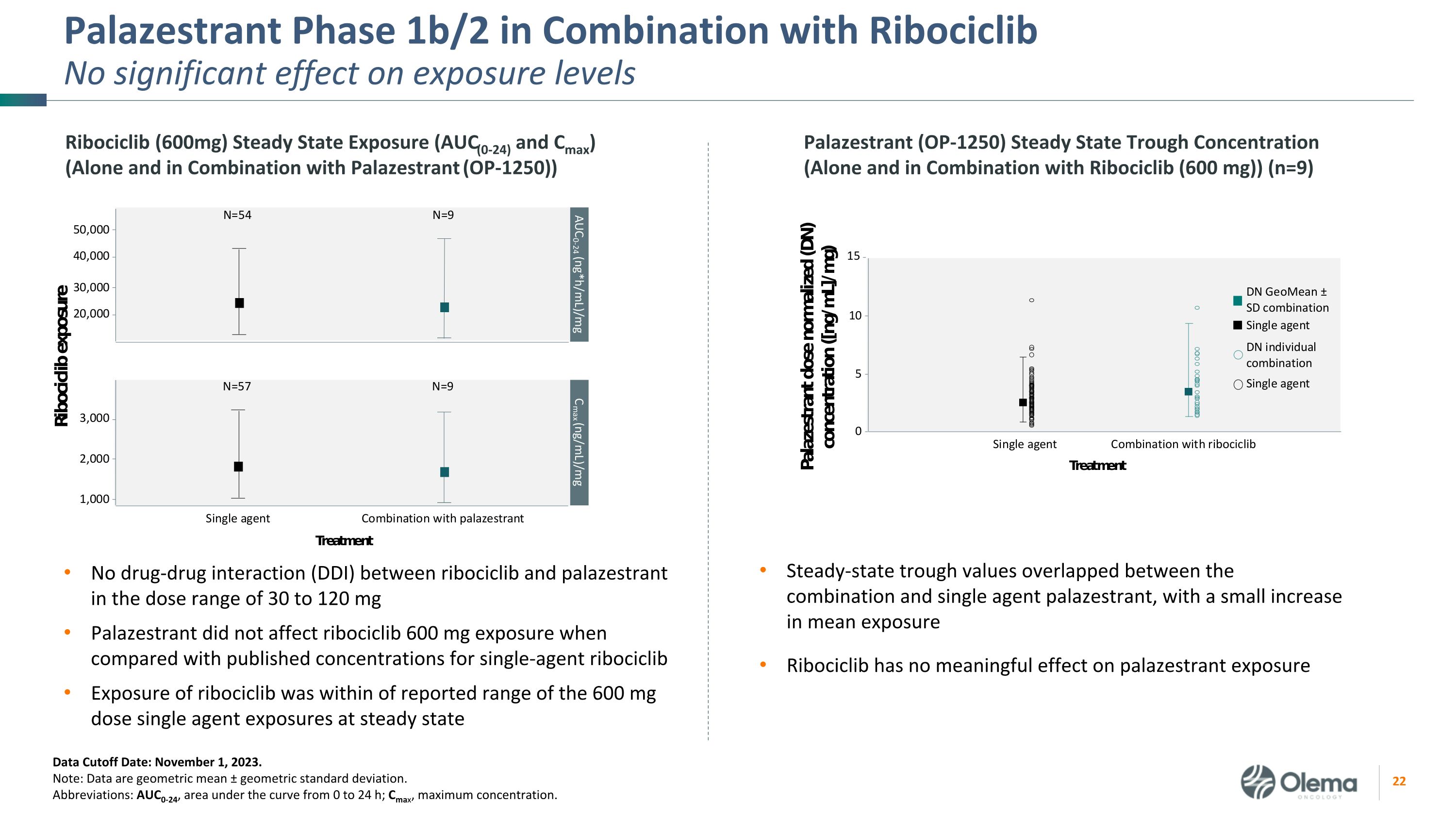
Palazestrant 1b/2 期與 Ribociclib 聯合使用對暴露水平沒有顯著影響在 30 至 120 mg 劑量範圍內 ribociclib 和 palazestrant 之間沒有藥物相互作用 (DDI) Palazestrant 與公佈的單劑瑞博西利布濃度相比,瑞博西利布的暴露量在報告的 600 mg 劑量範圍內穩定狀態下的曝光量數據截止日期:2023 年 11 月 1 日。注意:數據是幾何平均值 ± 幾何標準差。縮寫:AUC0-24,曲線下方面積從 0 到 24 h;Cmax,最大濃度。穩態低谷值在組合和單劑帕拉西斯特蘭特之間重疊,平均暴露量略有增加 Ribociclib 對緩解劑暴露沒有實質性影響 Ribociclib(600mg)穩態暴露(AUC(0-24)和 Cmax)(單獨使用和與 Palazestrant 聯合使用(OP-1250))Palazestrant(OP-1250)穩態槽濃度(單獨和組合)使用 Ribociclib (600 mg) (n=9)
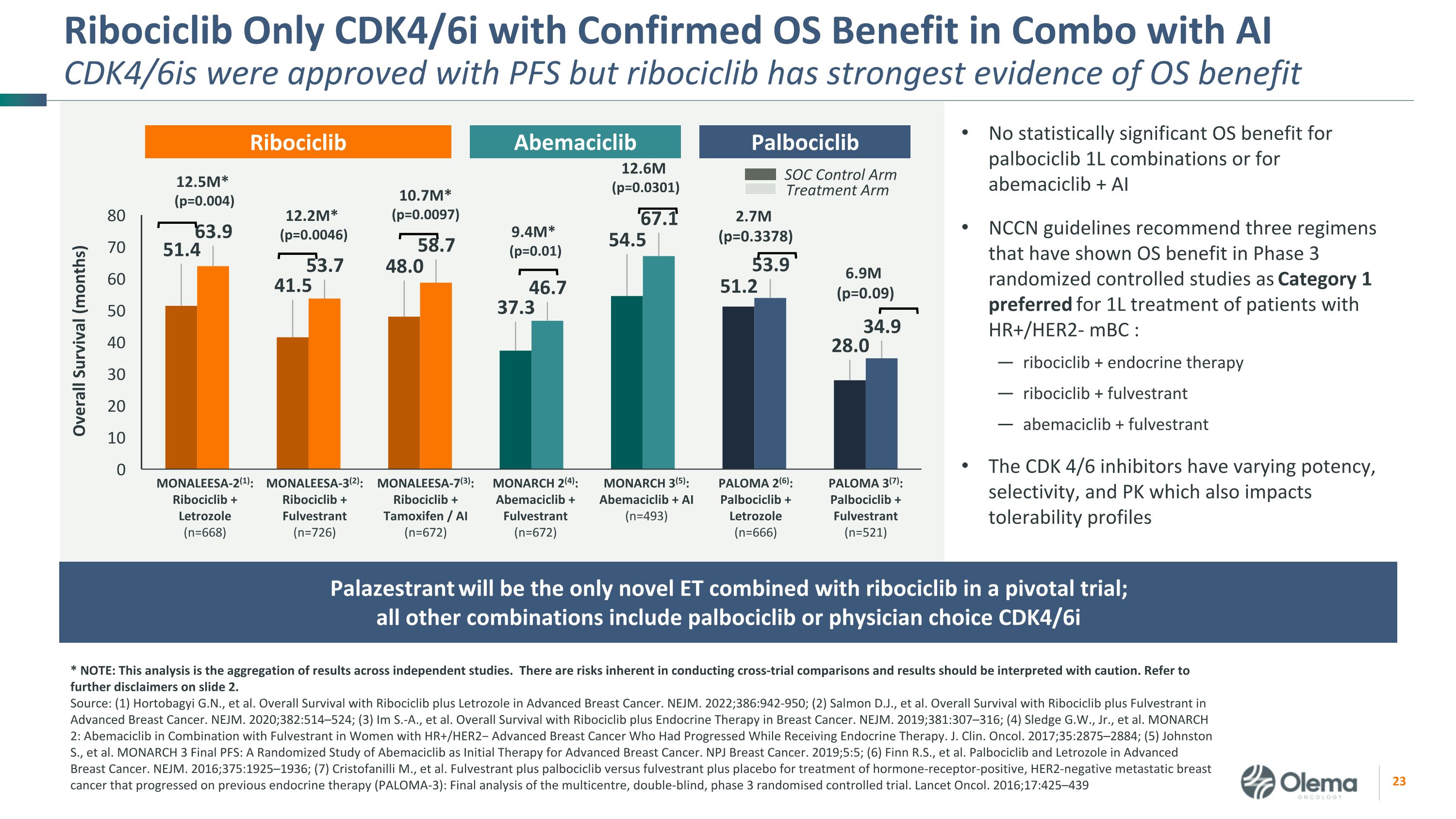
Ribociclib 只有經證實的操作系統益處的CDK4/6i與AICDK4/6I的組合才獲準與PFS一起使用,但ribociclib有最強的操作系統益處證據 * 注意:本分析是獨立研究結果的彙總。進行跨審比較存在固有的風險,應謹慎解釋結果。請參閲幻燈片 2 中的更多免責聲明。資料來源:(1) Hortobagyi G.N. 等人使用Ribociclib加來曲唑治療晚期乳腺癌的總體存活率。NEJM. 2022;386:942-950;(2) Salmon D.J.,等在晚期乳腺癌中使用 Ribociclib 和 Fulvestrant 的總體存活率。NEJM. 2020;382:514 —524;(3) 我是 S.A.,等使用Ribociclib加內分泌療法治療乳腺癌的總體存活率。NEJM. 2019;381:307 —316;(4) Sledge G.W.,Jr. 等MONARCH 2:對於在接受內分泌治療期間出現進展的HR+/HER2− 晚期乳腺癌女性,將阿貝馬西利布與氟維司蘭聯合使用。J. Clin。Oncol. 2017;35:2875 —2884;(5) Johnston S.,等人MONARCH 3 Final PFS:一項關於阿貝馬西利布作為晚期乳腺癌初始療法的隨機研究。NPJ 乳腺癌。2019;5:5;(6) Finn R.S. 等晚期乳腺癌中的帕博西利布和來曲唑。NEJM. 2016;375:1925 —1936;(7) Cristofanilli M.,等Fulvestrant加palbociclib對比氟維司朗加安慰劑治療激素受體陽性、HER2陰性的轉移性乳腺癌,這些乳腺癌在先前的內分泌療法(PALOMA-3)上取得了進展:多中心、雙盲、3期隨機對照試驗的最終分析。Lancet Oncol. 2016;17:425 —439 palbociclib 1L 組合或 abemaciclib + AI NCCN 指南推薦了三種在第 3 期隨機對照研究中顯示操作系統益處為 HR+/HER2-mBC 患者 1L 治療的首選方案:ribociclib + 內分泌療法 ribociclib + fulvestrant abemcc aciclib + fulvestrant CDK 4/6 抑制劑具有不同的效力、選擇性和 PK,這也會影響耐受性概況 Ribociclib MONARCH 2 (4):Abemaciclib + Fulvestrant (n=672) MONARCH 3 (5):Abemaciclib + AI (n=493) MONALEESA-2 (1):Ribociclib + Letrozole (n=668) MONALEESA-3 (2):Ribociclib + Fulvestrant (n=726) PALOMA 2 (6):Palbociclib + Letrozole (n=666) PALOMA 3 (7):Palbociclib + Fulvestrant (n=526) PALOMA 2 (6):Palbociclib + Letrozole (n=666) PALOMA 3 (7):Palbociclib + Fulvestrant (n=56) 21) MONALEESA-7 (3):Ribociclib + 他莫昔芬/AI (n=672) 9.4M* (p=0.01) SOC 控制臂治療臂 12.5M* (p=0.004) 12.2M* (p=0.0046) 10.7M* (p=0.0046) 10.7M* (p=0.0097) 12.6M (p=0.09) 2.7M (p=0.09) 6.9M (p=0.09)) Abemaciclib Palbociclib Palazestrant 將是關鍵試驗中唯一一款與 ribociclib 聯合使用的新型 ET;所有其他組合包括 palbociclib 或醫生選擇 cdk4/6i

關鍵三期試驗取得進展
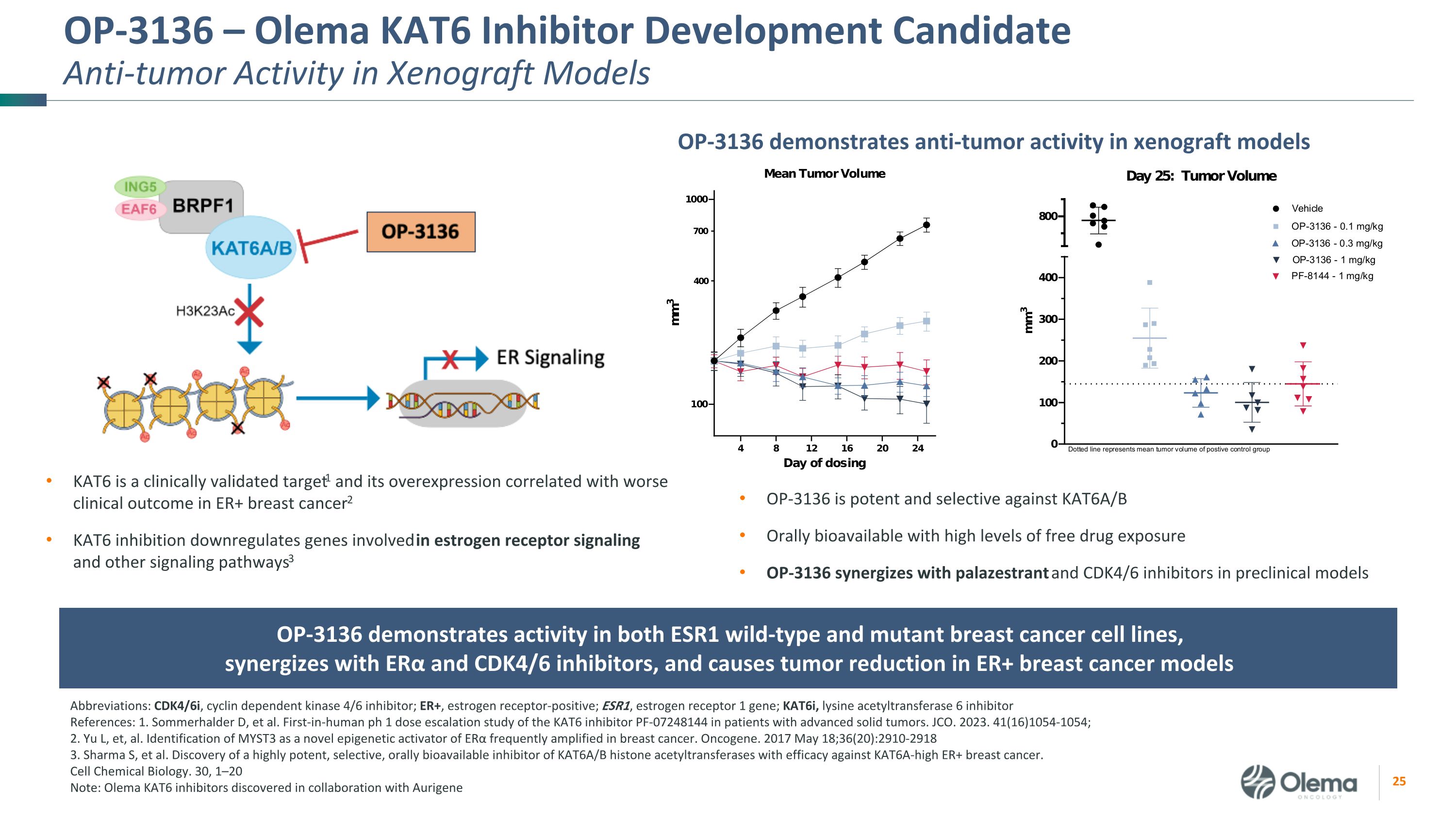
OP-3136 — Olema KAT6 抑制劑開發候選藥物異種移植模型中的抗腫瘤活性 OP-3136 在異種移植模型中表現出抗腫瘤活性 KAT6 是經過臨牀驗證的靶標1,其過度表達與 ER+ 乳腺癌的較差臨牀預後相關2 KAT6 抑制下調參與雌激素受體信號傳導和其他信號通路的基因3 縮寫:CDK4/6i,細胞週期蛋白依賴激酶 4/6 抑制劑;ER+,雌激素受體陽性;ESR1,雌激素受體 1 基因;kat6i,賴氨酸乙酰轉移酶 6 抑制劑參考文獻:1.Sommerhalder D 等人。首次對晚期實體瘤患者進行 KAT6 抑制劑 PF-07248144 的人類 ph 1 劑量遞增研究。JCO. 2023. 41 (16) 1054-1054;2.Yu L等。將 MYST3 鑑定為乳腺癌中經常擴增的 ERα 的新型表觀遺傳學激活劑。癌基因。2017 年 5 月 18 日;36 (20): 2910-2918 3.Sharma S 等人。發現了一種高效、選擇性、口服生物可利用的KAT6A/B組蛋白乙酰轉移酶抑制劑,可有效對抗KAT6A高ER+乳腺癌。細胞化學生物學。30、1—20 注:與 Aurigene OP-3136 合作發現的 Olema KAT6 抑制劑對 KAT6A/B 具有有效和選擇性,具有高遊離藥物暴露量的口服生物利用度 OP-3136 與 palazestrant 和 CDK4/6 抑制劑協同作用 OP-3136 在 ESR1 野生型和突變乳腺癌細胞系中均表現出活性,與 ERα 和 CDK4/6 抑制劑協同作用,並導致 ER+ 乳腺癌模型中的腫瘤減少
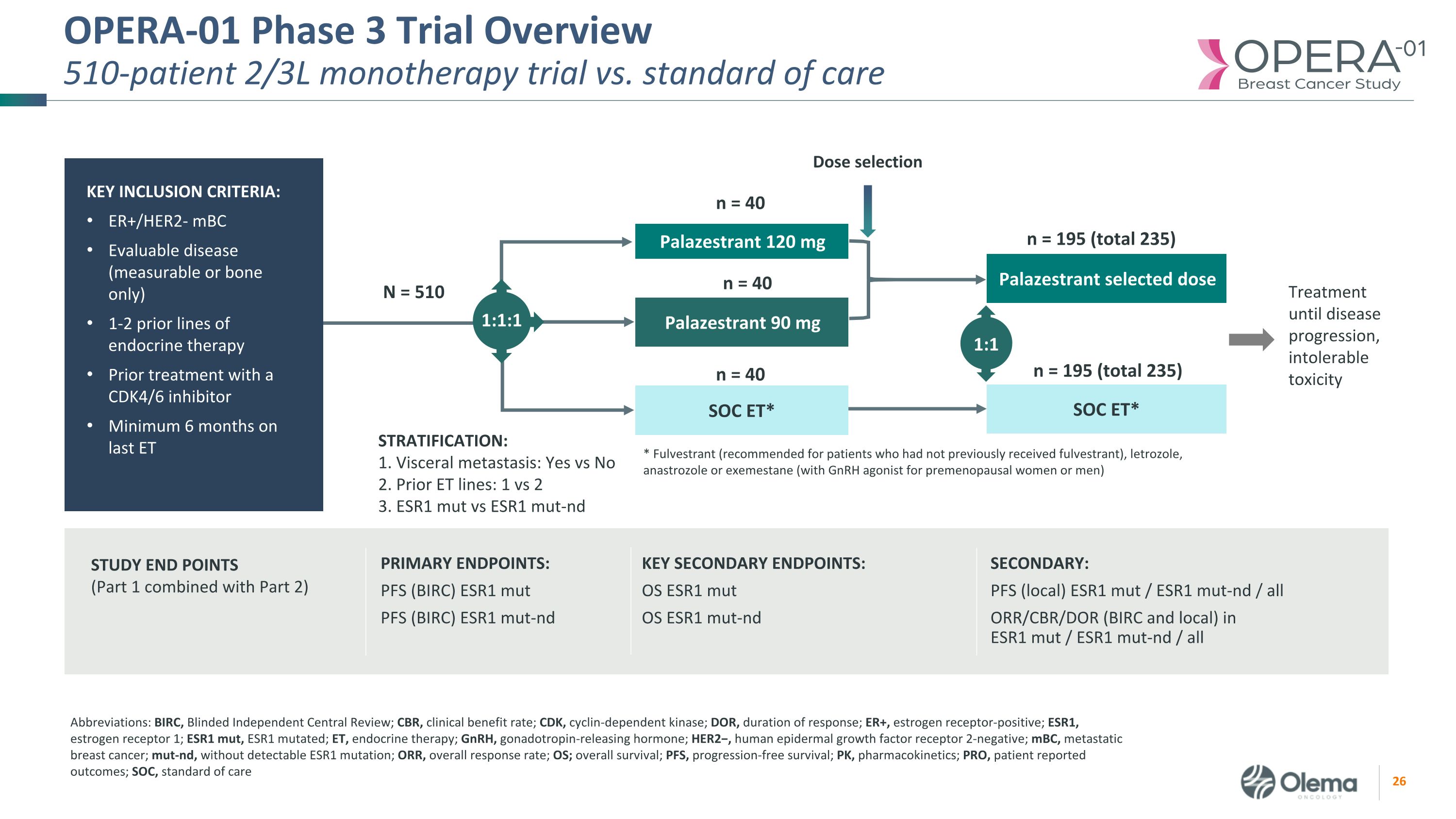
OPERA-01 三期試驗概述510位患者 2/3L 單一療法試驗與標準護理的主要終點:PFS(BIRC)ESR1 mut PFS(BIRC)ESR1 mut-nd ESR1 mut-nd:PFS(本地)ESR1 mut/ESR1 mut-nd/ESR1 mut-nd/ESR1 mut-nd /所有 ORR/CBR/DOR(BIRC 和本地)/所有研究終點(第 1 部分與第 2 部分合並)關鍵次要終點:OS ESR1 mut OS ESR1 mut OS ESR1 mut-nd Palazestrant 120 mg SOC ET* * Fulvestrant(推薦給以前未接受氟維司羣的患者)、來曲唑、阿那曲唑或依西美坦(與GnRH激動劑一起用於絕經前女性或男性)分層:1。內臟轉移:是 vs 否 2。之前的 ET 線路:1 對 2 3。ESR1 mut vs ESR1 mut-nd Palazestrant 90 mg N = 510 Palazestrant 選定劑量選擇 1:1 1:1 n = 40 治療直到疾病進展,不可耐受的毒性 SOC ET* n = 40 n = 195(總計 235)n = 195(總計 235)縮寫:BIRC,盲目獨立中心評論;CBR,臨牀獲益率;CDK,週期蛋白依賴激動蛋白酶;DOR,反應持續時間;ER+,雌激素受體陽性;ESR1,雌激素受體 1;ESR1 mut,ESR1 突變;ET,內分泌治療;GnRH,促性腺激素釋放激素;HER2−,人類表皮生長因子受體 2-陰性;mBC,轉移性乳腺癌;mut-nd,無可檢測到的 ESR1 突變;ORR,總緩解率;OS;總存活率;PFS,無進展存活率;PK,藥代動力學;PRO,患者報告的結局;SOC,護理標準關鍵納入標準:ER+/HER2-mBC 可評估疾病(僅可測量或僅限骨骼)先前使用 CDK4/6 的內分泌療法 1-2 系先前使用 CDK4/6 進行治療抑制劑最後一次 ET 至少服用 6 個月

Olema:女性腫瘤學領域一個引人注目的後期機遇截至2023年9月30日,Palazestrant擁有約2.769億美元的現金和現金等價物。截至2023年9月30日,Palazestrant與CDK4/6抑制劑的全劑量組合使其成為一線適應症Palazestrant在新一類內分泌療法中存在高度差異1的現金狀況。管理層認為,公司的現金、現金等價物、有價證券以及與硅谷銀行簽訂的貸款和擔保協議下的可用金額將足以為公司當前的2027年運營計劃提供資金。令人信服的 2 期單一療法數據使 OPERA-01 3 期試驗取得成功,管理層和董事會擁有豐富的經驗和成功歷史
