

© 2024 SAB BIOTHERAPEUTICS, INC.為延緩 1 型糖尿病的發作或進展而開發的全人源抗胸腺細胞生物製劑 NASDAQ:SABS SAB 生物療法簡介 2024 年 1 月附錄 99.1

前瞻性陳述 2 本演示文稿中的材料由SAB Biotherapeutics, Inc.(“SAB”)編寫,是截至本演講之日有關SAB活動的一般背景信息。此信息以摘要形式提供,並不完整。本演示文稿中的信息,包括財務預測,不應被視為就持有、購買或出售證券或其他金融產品或工具向投資者或潛在投資者提出的建議或推薦,並且不考慮任何特定的投資目標、財務狀況或需求。本演示文稿可能包含前瞻性陳述,包括有關我們對SAB業務和運營的意圖、信念或當前預期、市場狀況、經營業績和財務狀況、資本充足率、具體條款和風險管理實踐的陳述。提醒讀者不要過分依賴這些前瞻性陳述。除非法律要求,否則SAB不承擔任何義務出於任何原因更新此處的任何信息,也沒有義務公開發布對這些前瞻性陳述的任何修訂結果,以反映本文發佈之日之後的事件或情況,以反映意外事件的發生。儘管在編制預測信息時採取了應有的謹慎態度,但實際結果可能存在重大正面或負面的差異,並且陳述可能包含錯誤或遺漏。預測和假設示例受SAB無法控制的不確定性和突發事件的影響。過去的表現並不能可靠地表明未來的表現。本演示文稿中包含或暗示的前瞻性陳述受其他風險和不確定性的影響,包括SAB向美國證券交易委員會(“SEC”)發佈的最新10-K表年度報告以及SAB向美國證券交易委員會提交的其他文件中,在 “風險因素” 標題下討論的那些風險和不確定性。除非另有説明,否則信息是截至本文發佈之日的最新信息。本演示文稿中出現的SAB徽標和其他商標均為SAB的財產。本演示文稿中的所有其他商標、服務商標和商品名稱均為其各自所有者的財產。© 2024 SAB BIOTHERAPEUTICS, INC.

Investment Thesis 3 SAB Biotherapeutics是一家下一代抗體平臺公司,在三種適應症中擁有超過700名患者的人體數據,目前專注於預防1型糖尿病。T1D 中 SAB-142 的 MoA 是一種行之有效的治療方法,得到了臨牀醫生、意見領袖和青少年糖尿病研究基金會 (JDRF) 的支持和熱情。新發的 T1D 被視為孤兒病啟動的 SAB-142-101 FIM 研究;開發計劃是與 JDRF 1 期數據合作設計的,預計到 2024 年;旨在證明與 rAtG(零血清病和 NaDA)相比具有安全優勢,因為它是可以重做的人類抗體用於預防和改變疾病預防1型新藥的戰略驗證賽諾菲以29億美元的價格收購了另一家由JDRF贊助的公司Provention © 2024 SAB BIOTHERAPEUTICS, INC.,INC.,這證明瞭糖尿病。

經驗豐富的管理團隊 Christoph Bausch,博士,工商管理碩士執行副總裁兼首席運營官 20 多年的研究和發現、生物製造、業務開發和平臺技術商業化 MilliporeSigma(默沙東 KGaA)斯托爾斯醫學研究所博士後 Eddie J. Sullivan,博士總裁兼首席執行官/聯合創始人 20 年以上新技術開發 25 年以上生物技術前日本製藥生物執行委員會生殖生理學家 Michael G. King, Jr.執行副總裁兼首席財務官在豐澤生物科技(FBIO)擔任屢獲殊榮的生物技術行業分析師駐校企業家 Ziopharm Oncology (ZIOP) 高級副總裁兼企業發展總監塞繆爾·賴希執行董事長、董事長 20 年以上生物製藥高管兼生物企業家聯合創始人 Acuity Pharmicals、OPKO Health、Biscayne 神經療法分子生物學家亞歷山德拉·克羅波託娃,醫學博士,執行副總裁兼首席醫學官 20 多年的全球臨牀開發生物製藥研發負責人,輝瑞、惠氏、賽諾菲、梯瓦專業研發委員會成員,iBio為從一期到BLA和NDA批准的眾多專利和化合物領先組合做出了貢獻 © 2024 SAB BIOTHERAPEUTICS, INC.

唯一攜帶全人類免疫球蛋白 (Ig) 重鏈和輕鏈 (q) 位點的轉基因動物。HAC 與其他60 Tc Bovine染色體一起受到有絲分裂的影響。Tc Bovine 中存在的 HAC 可以最大限度地產生與人類最相似的人體免疫球蛋白庫。Tc Bovine Human Immunoglobulin G 在轉染體牛中產生 Tc Bovine 含有所有的人類免疫球蛋白基因人類人工染色體 (HAC) ~17Mb 包含整個未排列的 VDJ 人類免疫球蛋白位點 (iGH + IgΩ) © 2024 SAB BIOTHERAPEUTICS, INC.

SAB-142:人類抗胸腺細胞球蛋白(HaTG)——針對1型糖尿病的重點項目開發 © 2024 SAB BIOTHERAPEUTICS, INC.
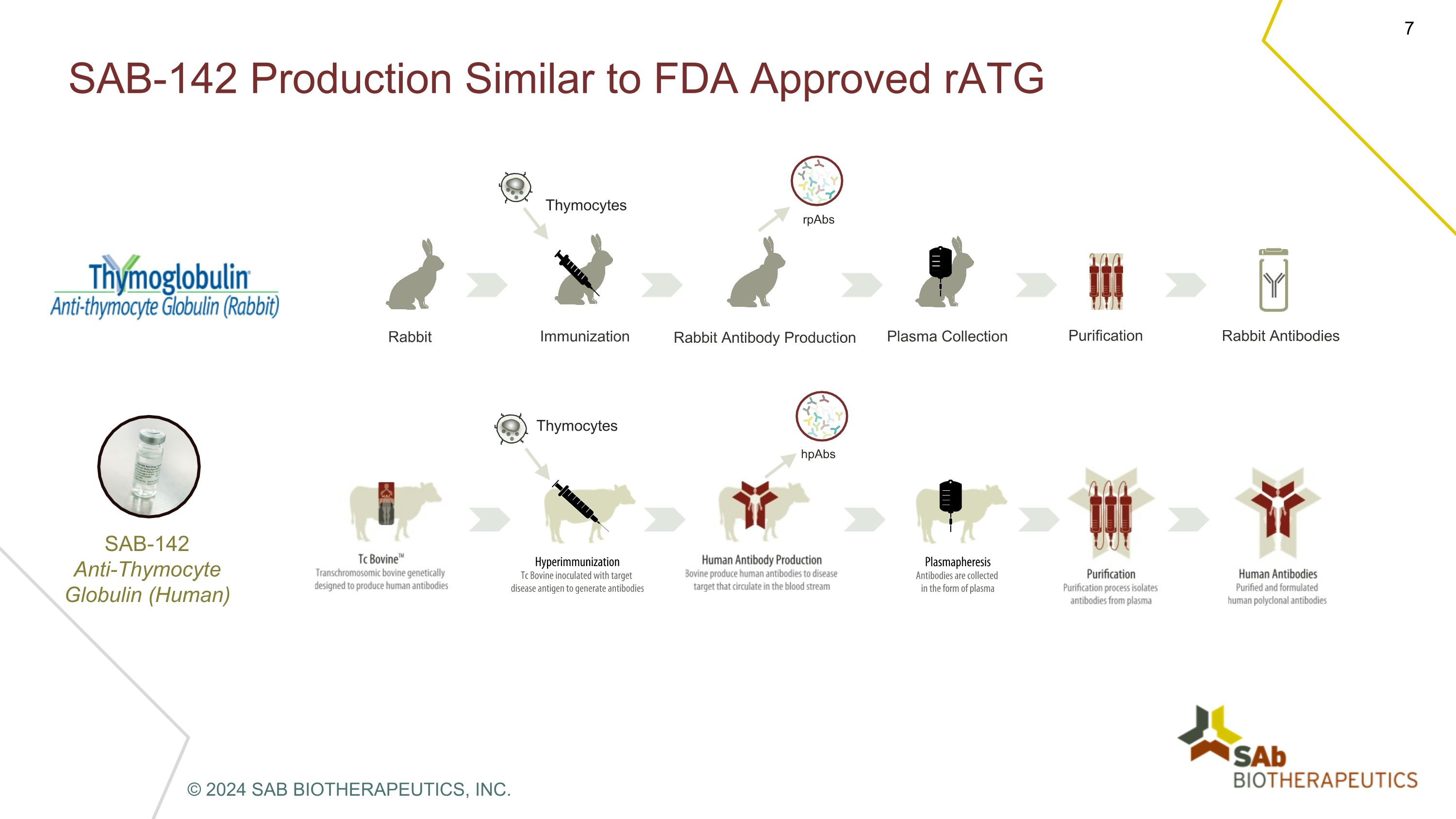
SAB-142 產量與美國食品藥品管理局批准的 rATG rPab hPabs 胸腺細胞胸腺細胞兔子免疫兔抗體生產血漿收集純化兔抗體 sab-142抗胸腺細胞球蛋白(人類)© 2024 SAB BIOTHERAPEUTICS, INC.
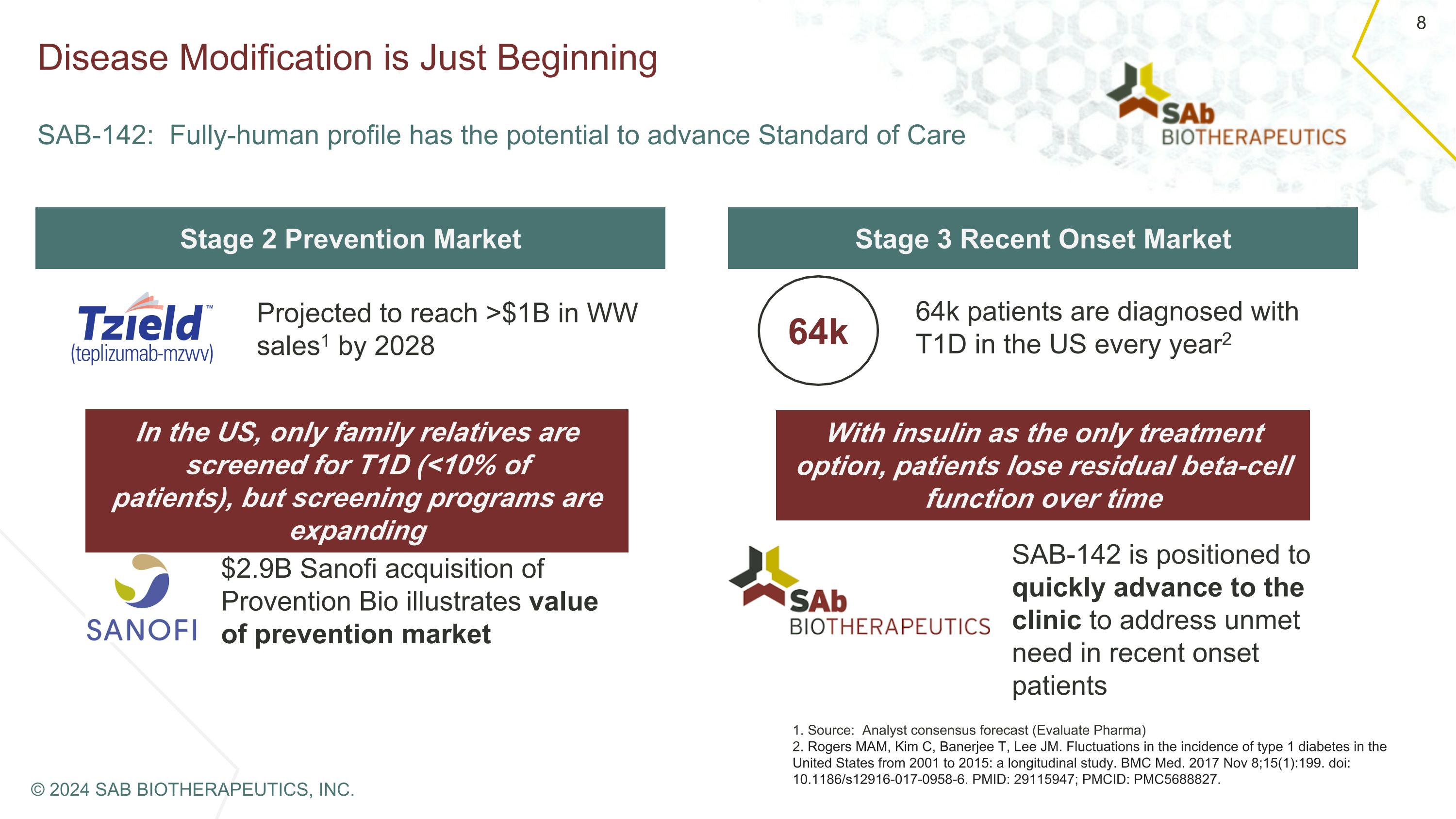
疾病改變才剛剛開始 SAB-142:全人概況有可能推進標準護理第二階段預防市場第三階段近期發病市場預計到2028年全球銷售額將達到超過10億美元1 在美國,只有家庭親屬接受T1D篩查 (
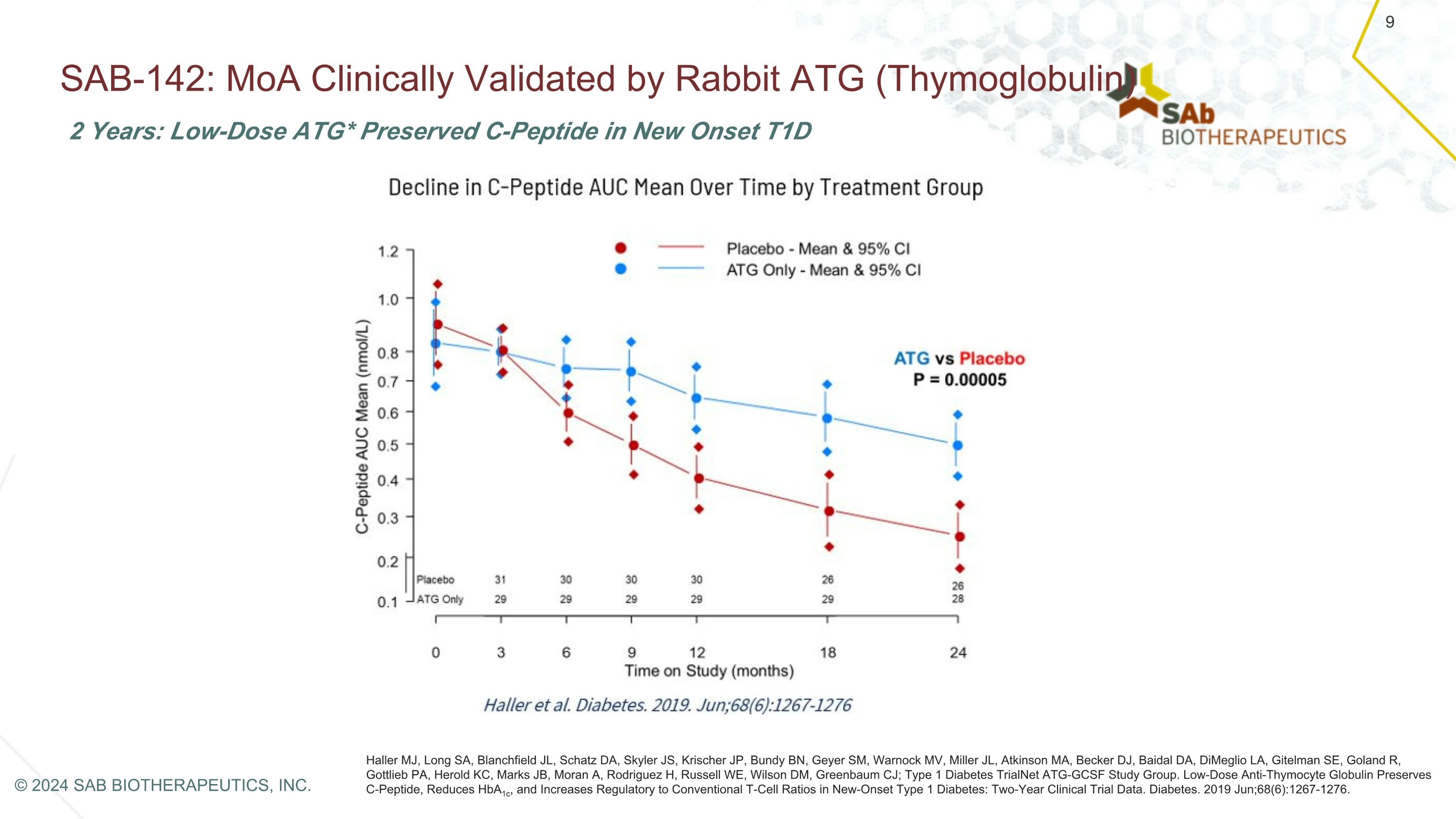
SAB-142:MoA 經過 Rabbit ATG(胸腺球蛋白)Haller MJ、Long SA、Blanchfield JL、Schatz DA、Skyler JS、Krischer JP、Bundy BN、Geyer SM、Warnock MV、Miller JL、Atkinson MA、Becker DJ、Baidal DA、Dimeglio LA、Gitelman SE、Goland R、PA Gottlieb 的臨牀驗證 Herold KC、Marks JB、Moran A、Rodriguez H、Russell WE、Wilson DM、Greenbaum CJ;1 型糖尿病 TrialNet ATG-GCSF 研究組。低劑量抗胸腺細胞球蛋白可保存 C 肽,降低 HbA1c,並增強對新發型 1 型糖尿病的傳統 T 細胞比率的監管:兩年臨牀試驗數據。糖尿病。2019 年 6 月;68 (6): 1267-1276。2 年:低劑量 ATG* 在新發的 T1D 9 中保留了 C 肽 © 2024 SAB BIOTHERAPEUTICS, INC.
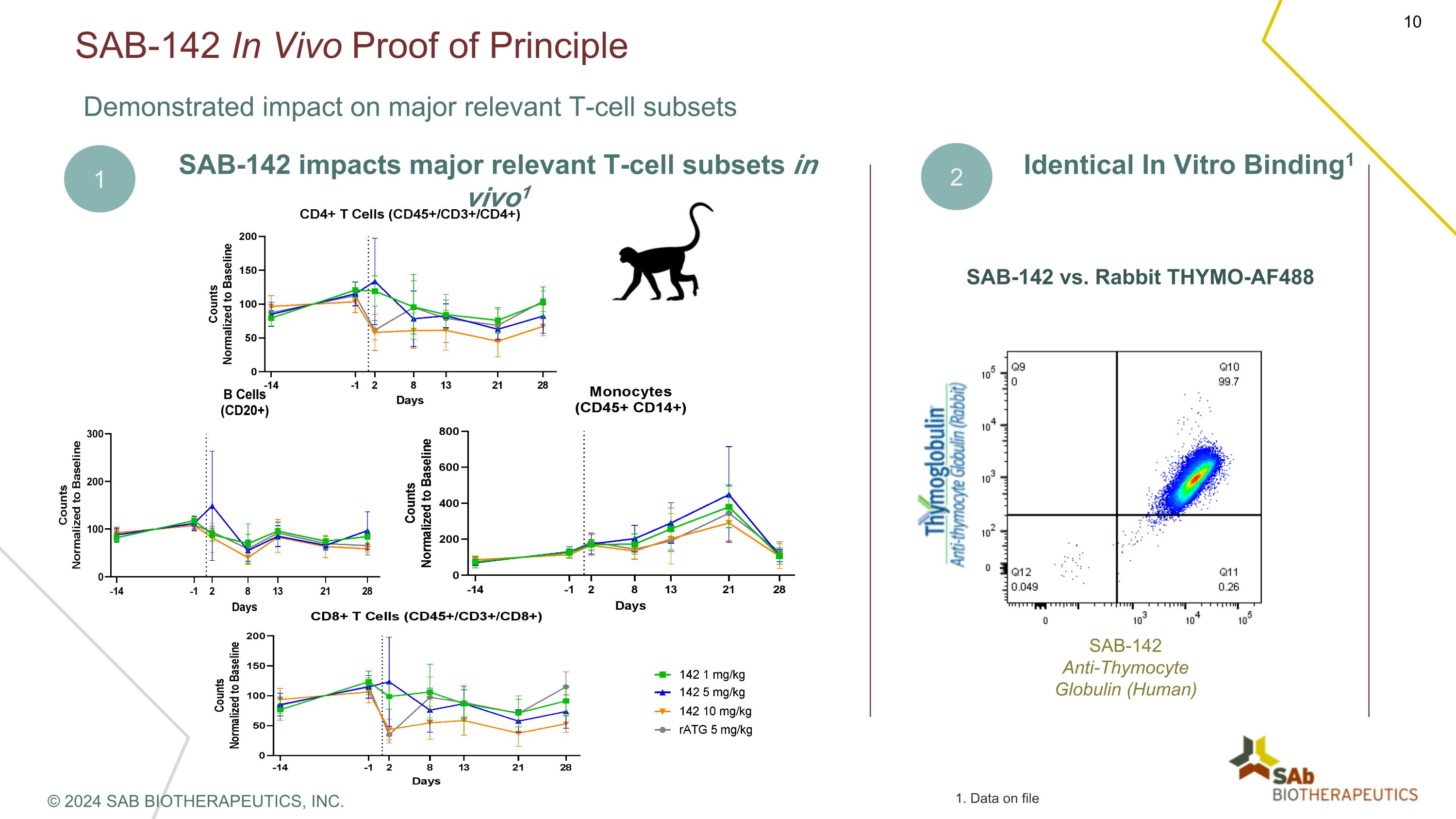
SAB-142 體內原理證明對主要相關 T 細胞亞羣產生影響 SAB-142 影響 vivo1 中主要相關 T 細胞亞羣 2 相同體外結合1 SAB-142 與兔子 THYMO-AF488 sab-142抗胸腺細胞球蛋白(人類)1 © 2024 SAB BIOTHERAPEUTICS, INC. 1.存檔數據

Teplizumab(Tzield)3期研究胸腺球蛋白2期數據外賣/附加值年齡8-17歲 12-45歲 rATG顯示適用於更廣泛的患者,即成人和兒科/青少年。使用TZIELD劑量顯著的市場規模將沒有資格使用TZIELD給藥兩個療程的每日靜脈注射,為期12天,在第1個月和第6個月進行單劑量的靜脈注射,在2天內給藥 ATG 更便於患者的給藥方案,有可能節省與藥物管理和患者監測主要時間點第 78 周(1.5 年)第 52 周相關的成本(1 年) 需要 2 個療程和更長的時間到達主要終點的樣本量 TZIELD 樣本量 200 個,ATG 的 PBO 29 上的 31 個,PBO ATG 上的 31 個樣本量更強,需要較小的樣本量才能顯示出顯著的統計結果功效 C肽 C肽水平的主要終點在第 78 周達到 AUC 的主要終點 ATG 顯示出 AUC 與 PBO 的功效相比 c 無統計重要數據:在第52周,ATG和ATG-GCSF ATG均有統計學意義的數據,顯示了HbA1v功效胰島素的顯著臨牀結果數字趨勢與 PBO 相比數值更好(ATG 組與 PBO 組中添加的胰島素較少)數據持平 SAB-142 在第 3 階段的潛在優勢:Teplizumab 與胸腺球蛋白 © 2024 SAB BIOTHERAPEUTICS, INC.
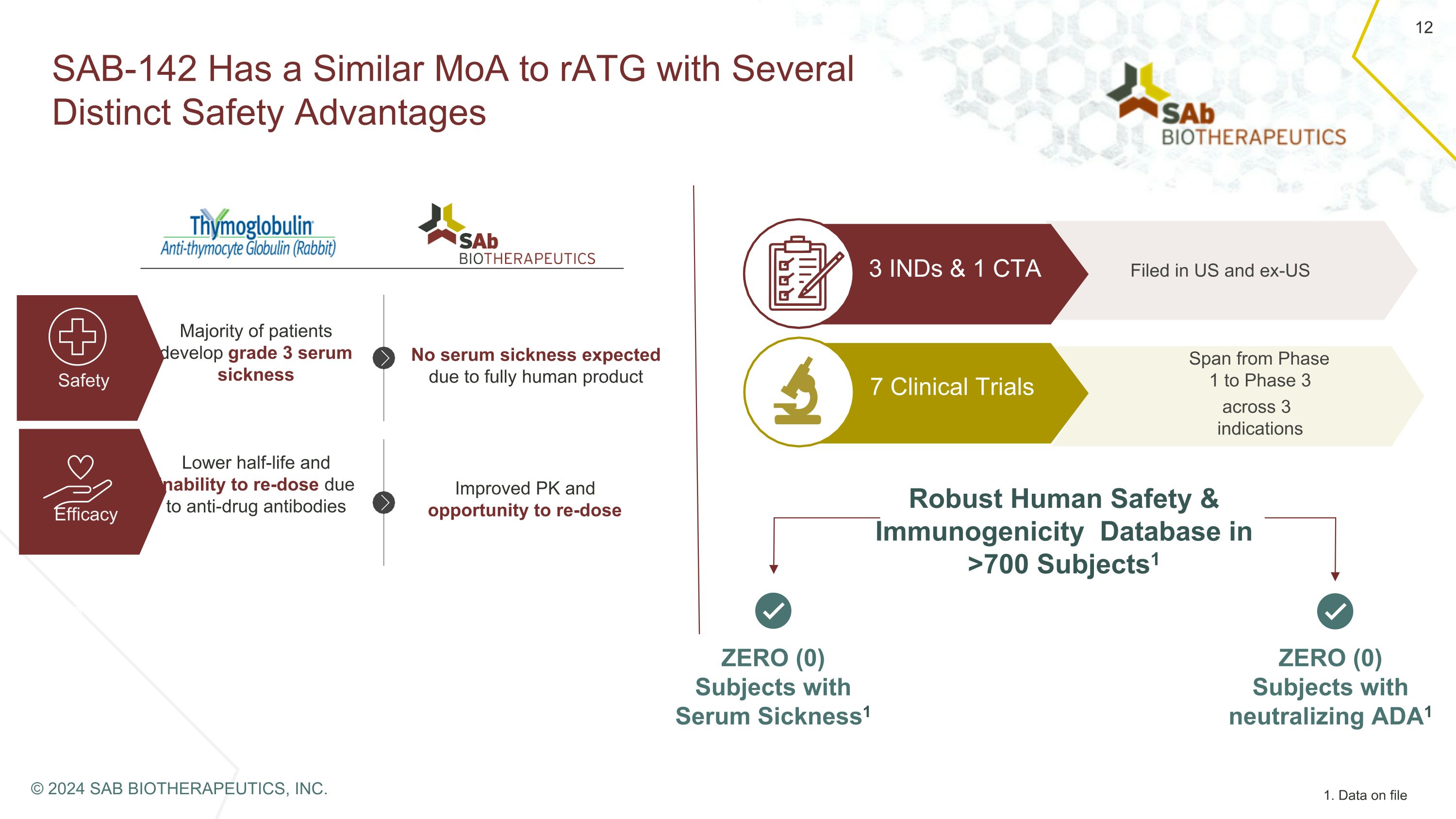
SAB-142 與 rAtG 相似,具有多種明顯的安全優勢。大多數患者會出現 3 級血清病安全功效由於完全人體產物而預計不會出現血清疾病;由於抗藥抗體,半衰期較短,無法再給藥。改善的 PK 和重劑機會在美國和美國以外的 7 個臨牀試驗涵蓋了 3 個適應症 3 個 IND 和 1 個 CTA > 700 個主題中的強大人類安全性和免疫原性數據庫 ts1 零 (0) 血清病受試者1 零 (0) 中和 ADA1 受試者 1 1.存檔數據 © 2024 SAB BIOTHERAPEUTICS, INC.

SAB-142:T1D 研究設計中的臨牀開發計劃 “首次人體臨牀研究(人體試驗)中採用全人類抗胸腺細胞生物製劑” 第 1 階段:首次進入人體、隨機、單次遞增劑量試驗 SAB-142 劑量範圍:0.03mg/kg 至 2.5mg/kg 終點主要終點:急性(血清病,CRS)和長期(感染率)安全性次要終點:藥代動力學、藥效學,免疫原性/ADA 主要結果:根據預期的 0% 的血清病和 NAB 驗證人體 SAB-142 的 MoA 證明生物活性(POBA):CD3、CD8、CD4、CD8/CD4比率、Tregs與rAtG相比與基線的變化(交叉研究)© 2024 SAB BIOTHERAPEUTICS, INC.**截至 2024 年 12 月底的收入數據
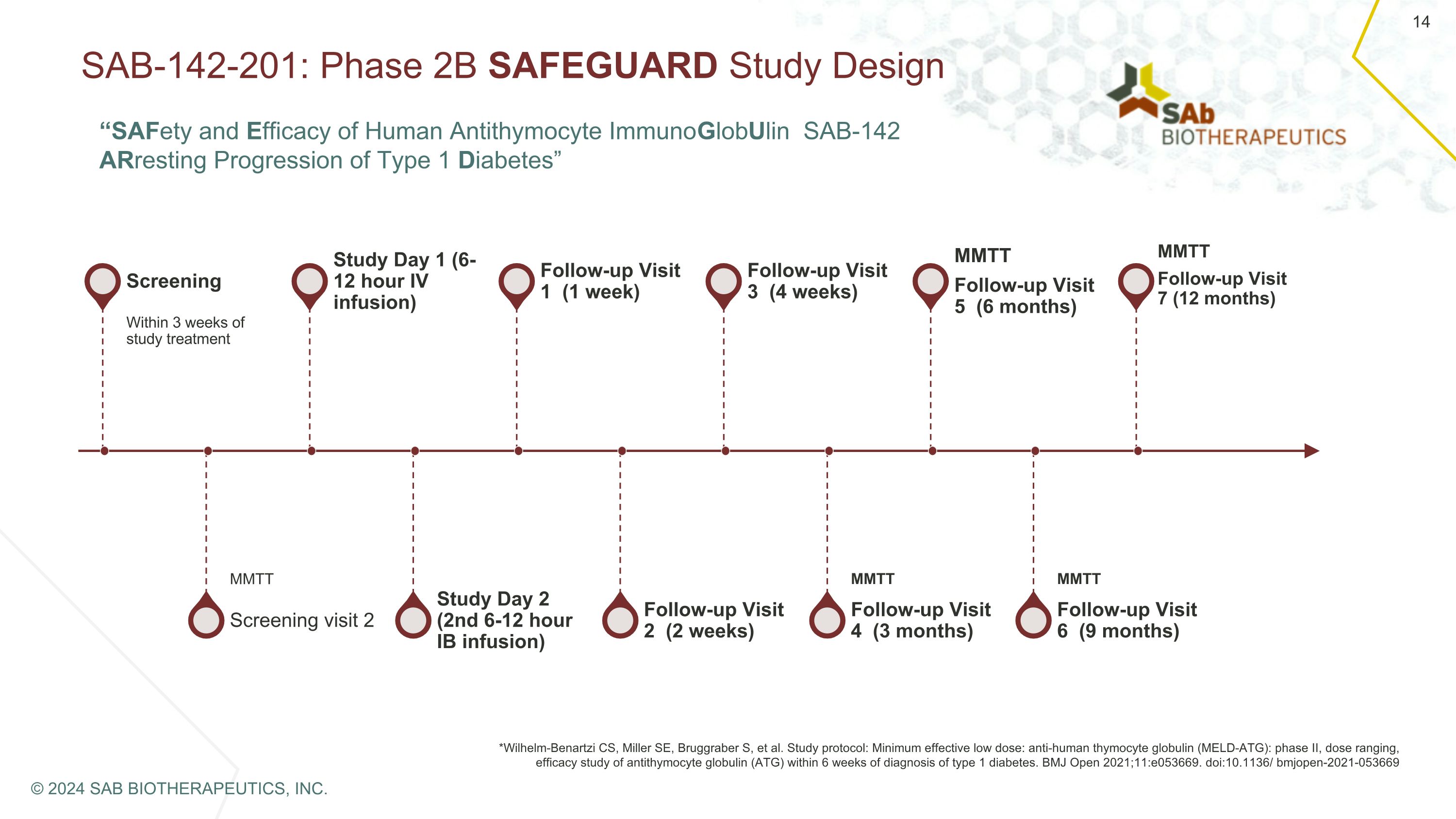
SAB-142-201:2B 期 SAFEGUARD 研究設計篩查在研究治療後 3 周內篩查 2 MMTT 研究第 1 天(6-12 小時靜脈輸注)研究第 2 天(第 2 次 6-12 小時 IB 輸液)隨訪 1(1 周)隨訪 2(2 周)隨訪 3(4 周)隨訪 4(3 個月)MMTT 隨訪 5(6 個月)後續就診 6(9 個月)MMTT *Wilhelm-BenArtMartt Zi CS、Miller SE、Bruggraber S 等研究方案:最低有效低劑量:抗人胸腺細胞球蛋白(MELD-ATG):第二階段,劑量範圍,在診斷為1型糖尿病後的6周內進行抗胸腺細胞球蛋白(ATG)的療效研究。BMJ Open 2021;11:e053669。doi: 10.1136/ bmjopen-2021-053669 MMTT 後續訪問 7(12 個月)© 2024 SAB BIOTHERAPEUTICS, INC.“人類抗胸腺細胞免疫球蛋白 SAB-142 的安全性和有效性阻止 1 型糖尿病的進展”
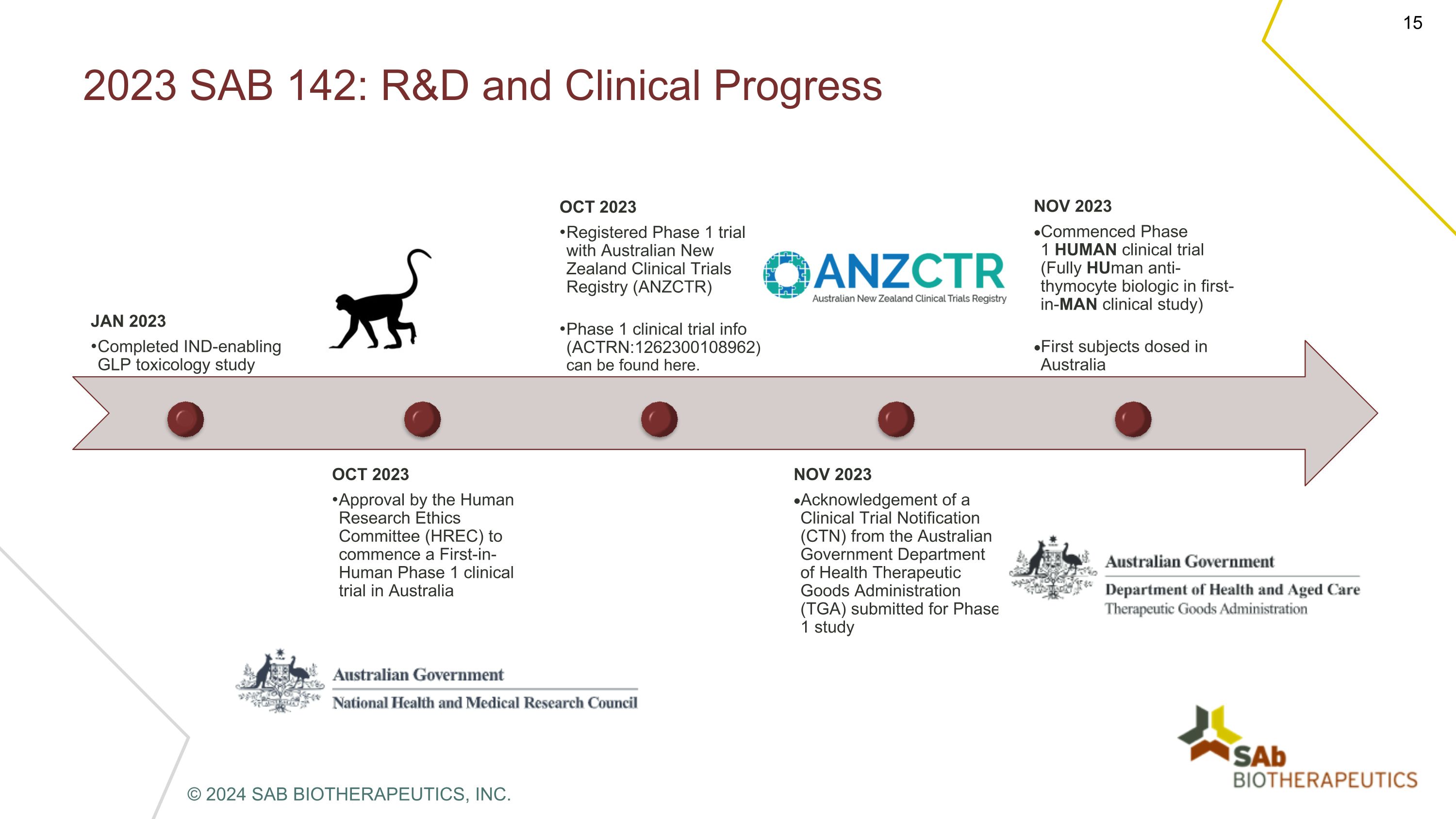
2023 SAB 142:研發和臨牀進展 2023 年 1 月完成支持臨牀試驗的 GLP 毒理學研究 2023 年 10 月經人類研究倫理委員會 (HREC) 批准在澳大利亞啟動首次人體 1 期臨牀試驗 2023 年 10 月澳大利亞新西蘭臨牀試驗註冊局 (ANZCTR) 的1期臨牀試驗信息 (ACTRN: 1262300108962) 可在此處找到。2023 年 11 月澳大利亞政府衞生部治療用品管理局 (TGA) 提交的臨牀試驗通知 (CTN) 確認函 2023 年 11 月開始了 1 期人體臨牀試驗(首次人體臨牀研究中為全人類抗胸腺細胞生物製劑)澳大利亞首批受試者給藥 © 2024 SAB BIOTHERAPEUTICS, INC.
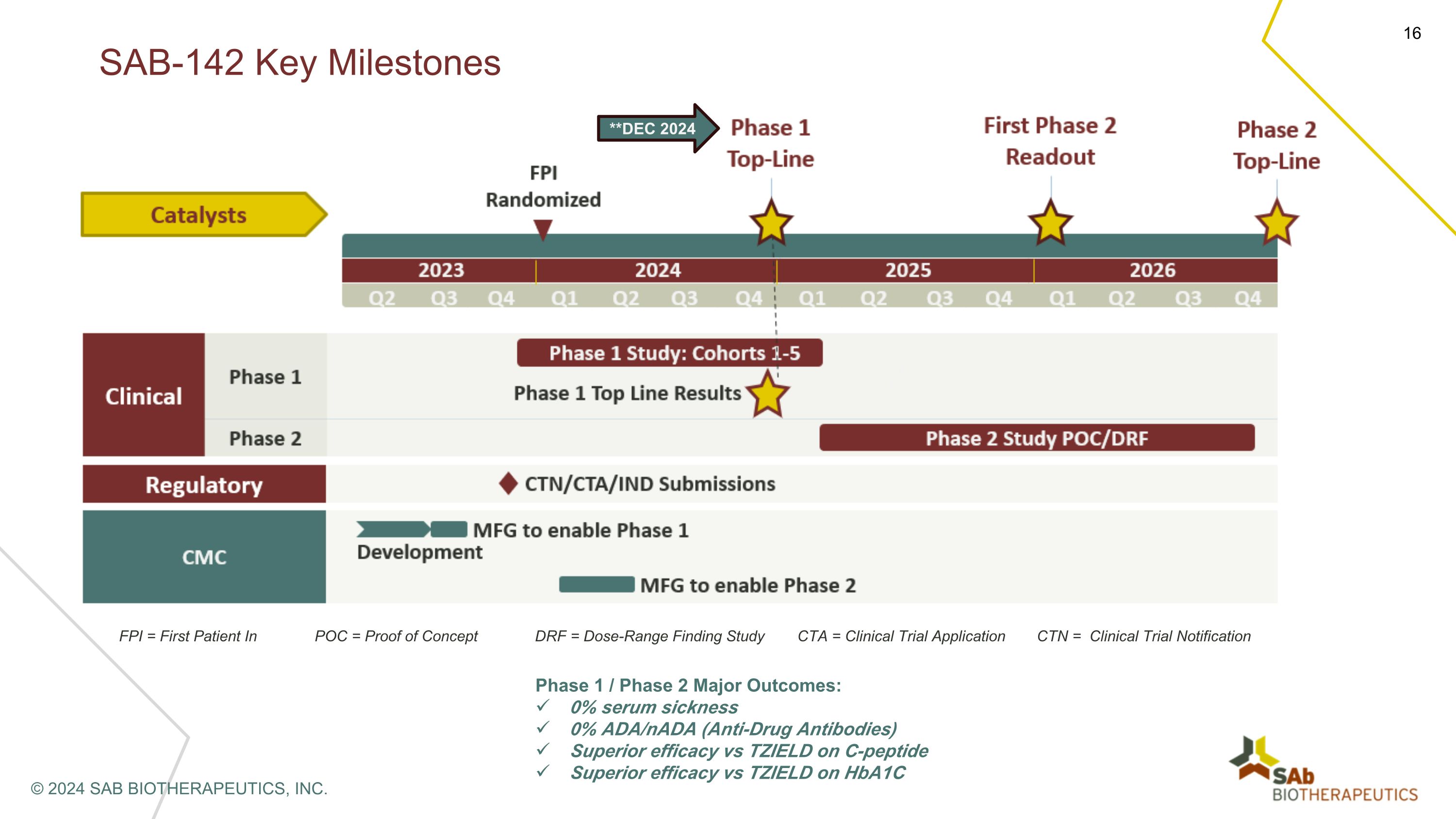
FPI = POC 中的第一位患者 = 概念驗證 DRF = 劑量範圍調查研究 CTA = 臨牀試驗申請 CTN = 臨牀試驗通知 1 期/第 2 期主要結果:0% 血清病 0% ADA/NADA(抗藥抗體)與 TZIELD 相比 TZIELD 對於 Hba1c SAB-142 的卓越療效關鍵里程碑 © 2024 SAB BIOTHERAPEUTICS, INC.**2024 年 12 月

承諾的 T1D 臨牀開發和投資者合作伙伴 17 個 T1D 承諾投資者合作伙伴:總收益高達 1.1 億美元的融資,專門用於在 2026 年之前推進 SAB-142 的臨牀進展以及 Topline 第 2 階段業績:Sessa Capital BVF Partners RTW Investments Marshall Wace ATW JDRF T1D 基金 T1D 臨牀開發合作伙伴:SAB-142 臨牀開發計劃與青少年發展研究基金會 (JDRF) 合作設計 © 2024 SAB 生物療法公司
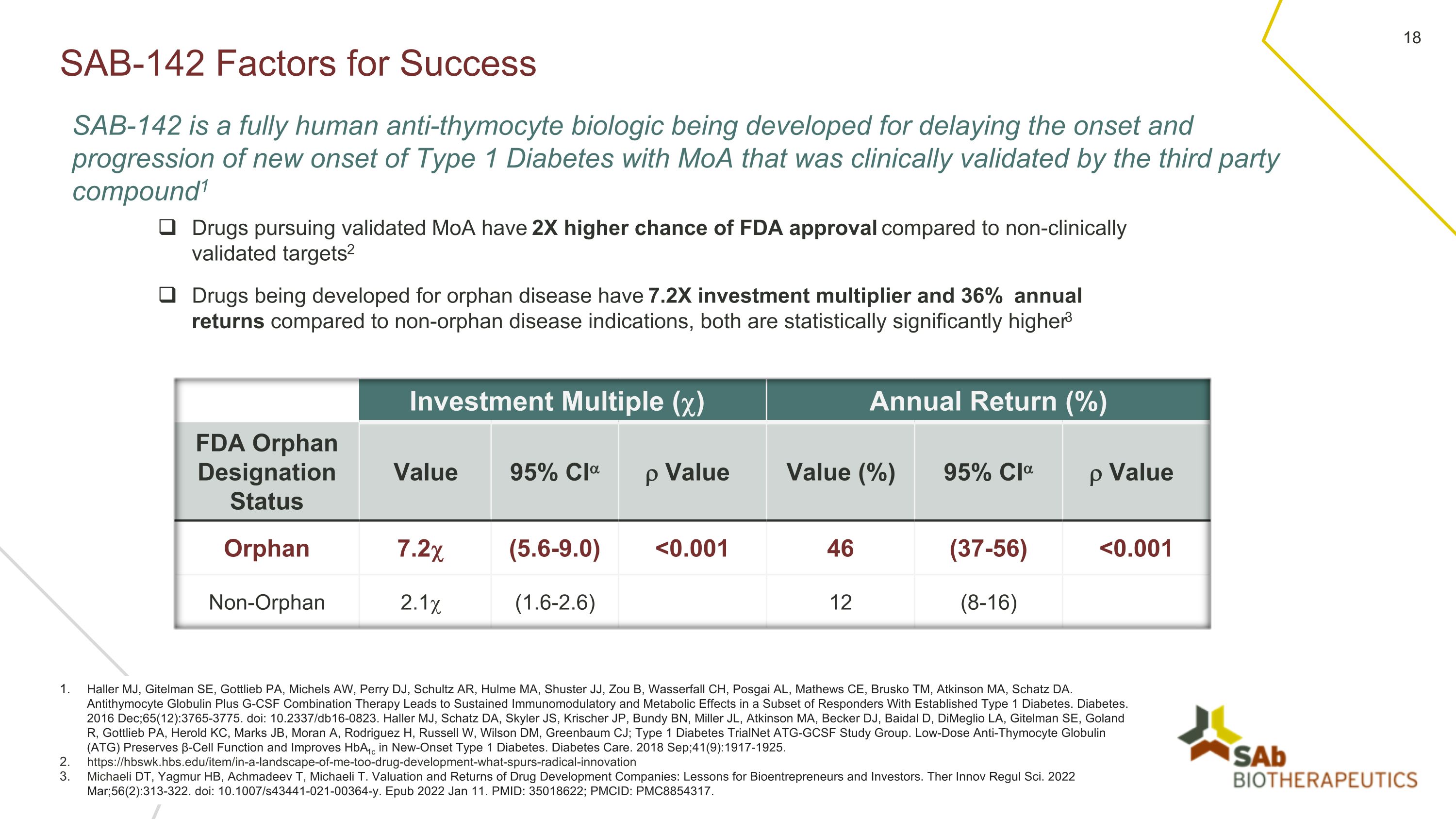
SAB-142 成功因素 Haller MJ、Gitelman SE、Gottlieb PA、Michels AW、Perry DJ、Schultz AR、Hulme MA、Shuster JJ、Zou B、Wasserfall CH、Posgai AL、Mathews CE、Brusko TM、馬薩諸塞州阿特金森、沙茨 DA。抗胸腺細胞球蛋白加G-CSF聯合療法可對一部分已確診的1型糖尿病應答者產生持續的免疫調節和代謝作用。糖尿病。2016 年 12 月;65 (12): 3765-3775. doi:10.2337/db16-0823。Haller MJ、Schatz DA、Skyler JS、Krischer JP、Bundy BN、Miller JL、Atkinson MA、Becker DJ、Baidal D、Dimeglio LA、Gitelman SE、Goland R、Gottlieb PA、Herold KC、Marks JB、Moran A、Rodriguez H、Russell W、Wilson DM、Greenbaum CJ;1 型糖尿病 TrialNet ATGG-Net CSF 研究小組。低劑量抗胸腺細胞球蛋白(ATG)可保留β細胞功能並改善新發的1型糖尿病的HbA1c。糖尿病護理。2018 年 9 月;41 (9): 1917-1925。https://hbswk.hbs.edu/item/in-a-landscape-of-me-too-drug-development-what-spurs-radical-innovation Michaeli DT、Yagmur HB、Achmadeev T、Michaeli T.《藥物開發公司的估值和回報:生物企業家和投資者的教訓》。Ther Innov Regul Sci.2022年3月;56 (2): 313-322. doi:10.1007/s43441-021-00364-y。Epub 2022 年 1 月 11 日。PMID:35018622;PMCID:PMC8854317。SAB-142 是一種全人源抗胸腺細胞生物製劑,正在開發用於延緩新發的 MoA 型 1 型糖尿病的發作和進展,已通過第三方化合物的臨牀驗證。1 與未經臨牀驗證的靶點相比,追求經驗證的 MoA 藥物獲得 FDA 批准的機率高出 2 倍2 與非孤兒病適應症相比,投資倍數和年回報率均高達 36%,兩者在統計學上均顯著提高 er3 投資倍數 () 年回報率 (%) FDA 孤兒稱號狀態值 95% 置信區間值值 (%) 95% 置信區間值 Orphan 7.2 (5.6-9.0)

附錄 © 2024 SAB BIOTHERAPEUTICS, INC.

IgG 多克隆抗體產品的行之有效的臨牀監管路徑人類 IgG 多克隆抗體(Tc 牛源性產品)人源性多克隆抗體(人類源性免疫球蛋白產品)動物多克隆抗體(動物源性免疫球蛋白產品)肉毒中毒雙價(馬)A 型和 B 型 IgG1 多克隆抗體免疫療法已通過 FDA 批准生物製劑評估與研究中心 (CBER) © 2024 SAB BIOTHERAPEUTICS, INC.
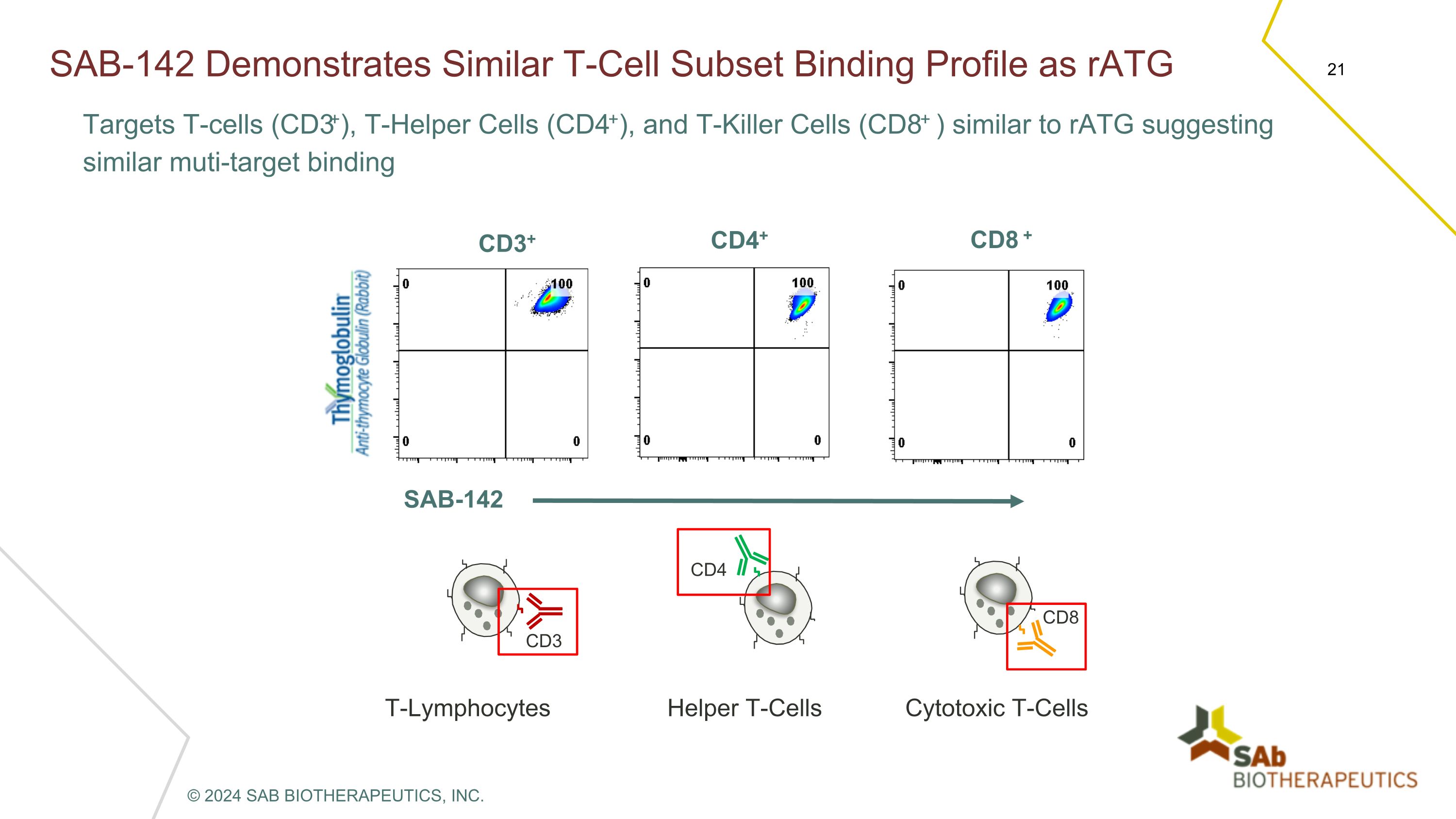
SAB-142 表現出與 raTG 靶向 T 細胞 (CD3+)、T 輔助細胞 (CD4+) 和 T 殺傷細胞 (CD8+) 相似的 T 細胞亞集結合特徵,類似於 raTG,表明多靶結合 CD3+ CD4+ CD8 + SAB-142 T淋巴細胞 CD3 輔助性 T 細胞 CD4 細胞毒性 T 細胞 CD8 © 2024 SAB BIOTHERAPEUTICS, INC.
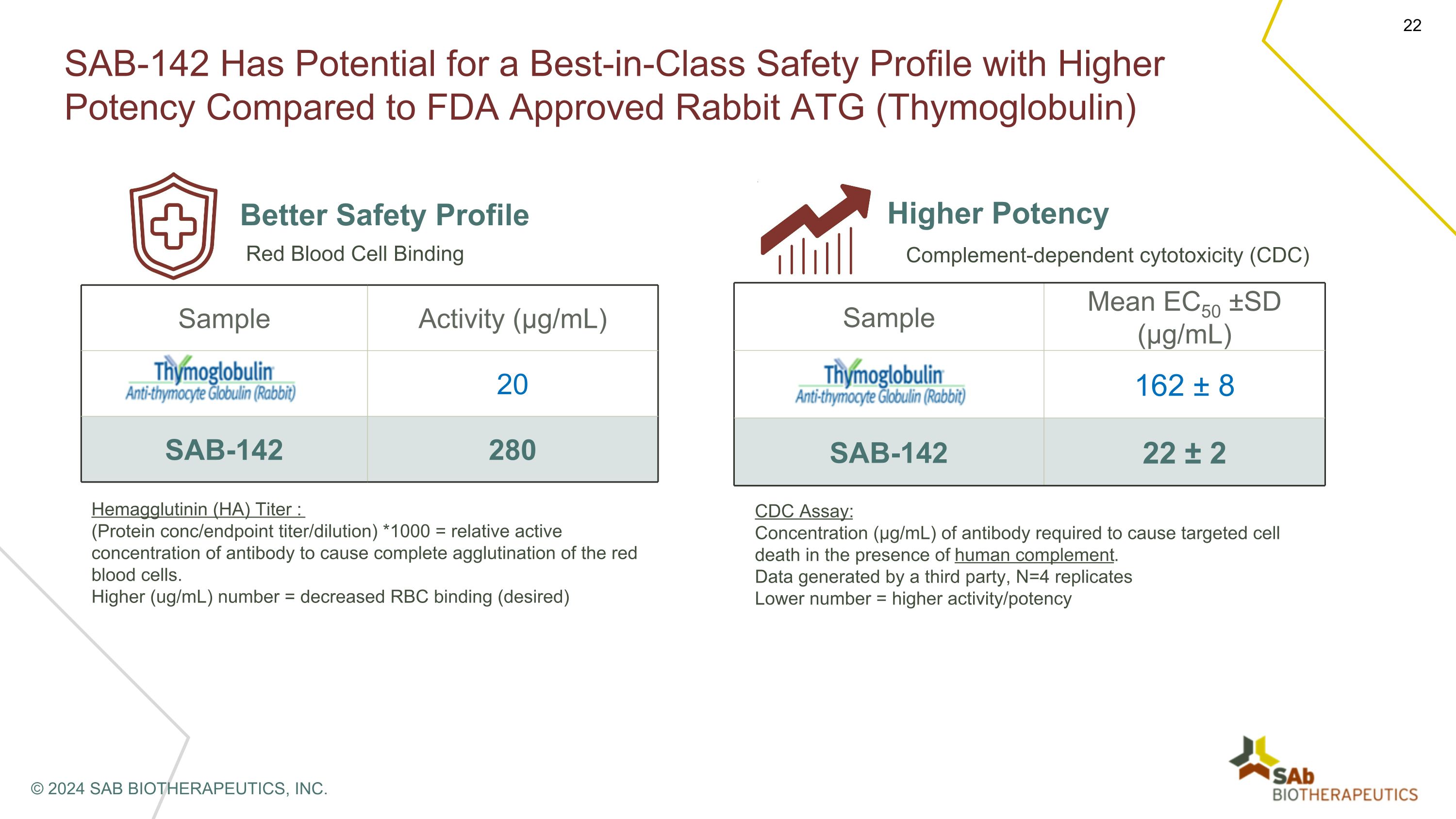
與美國食品藥品管理局批准的兔子 ATG(胸腺球蛋白)相比,SAB-142 有可能獲得同類最佳的安全特徵和更高的效力。更好的安全概況樣本活性(µg/mL)胸腺球蛋白® 20 SAB-142 280 紅細胞結合血凝素(HA)滴度:(蛋白質濃度/終點滴度/稀釋)*1000 = 導致紅細胞完全凝集的抗體的相對活性濃度。(微克/毫升)數值越高 = 紅細胞結合力降低(所需)更高效力的樣本平均值 EC50 ±SD(µg/mL)胸腺球蛋白 162 ± 8 SAB-142 22 ± 2 補體依賴性細胞毒性(CDC)CDC 測定:在存在人類補體的情況下導致靶向細胞死亡所需的抗體濃度(µg/mL)。第三方生成的數據,N=4 重複較低的數字 = 更高的活性/效力 © 2024 SAB BIOTHERAPEUTICS, INC.
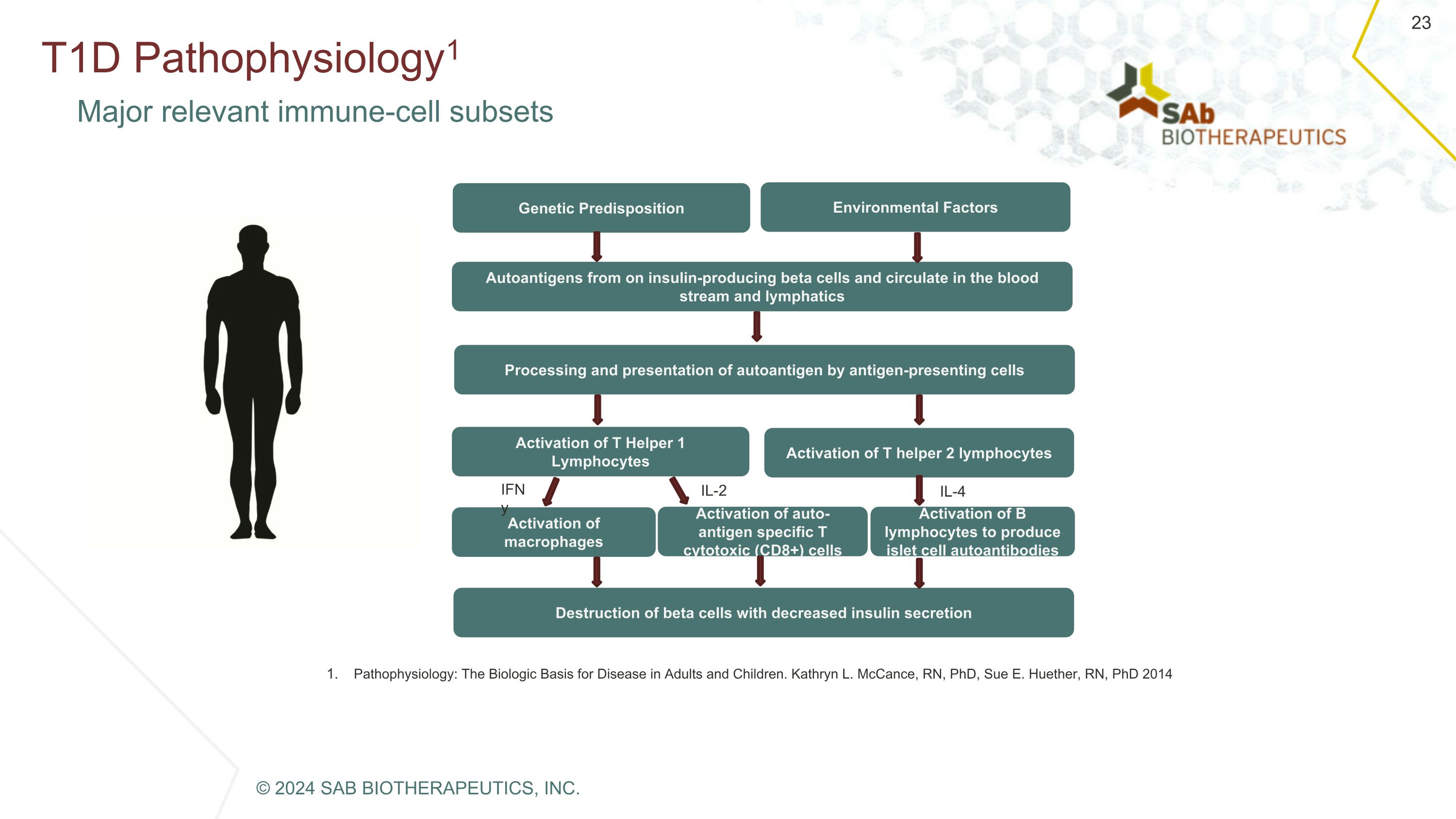
T1D Pathophysiology1 主要的相關免疫細胞亞羣在胰島素分泌減少的情況下破壞 β 細胞的自身抗原從產生胰島素的 β 細胞中循環通過抗原呈遞細胞處理和呈現自身抗原通過抗原呈遞細胞激活 T Helper 1 淋巴細胞激活 T Helper 2 淋巴細胞激活巨噬細胞產生胰島細胞自身抗體激活自身抗原特異性 T 細胞毒性 (CD8+) 細胞環境因素遺傳易感性 iFNY IL-2 IL-4病理生理學:成人和兒童疾病的生物學基礎。Kathryn L. McCance,註冊護士,博士,Sue E. Huether,註冊護士,博士 2014 © 2024 SAB BIOTHERAPEUTICS, INC.
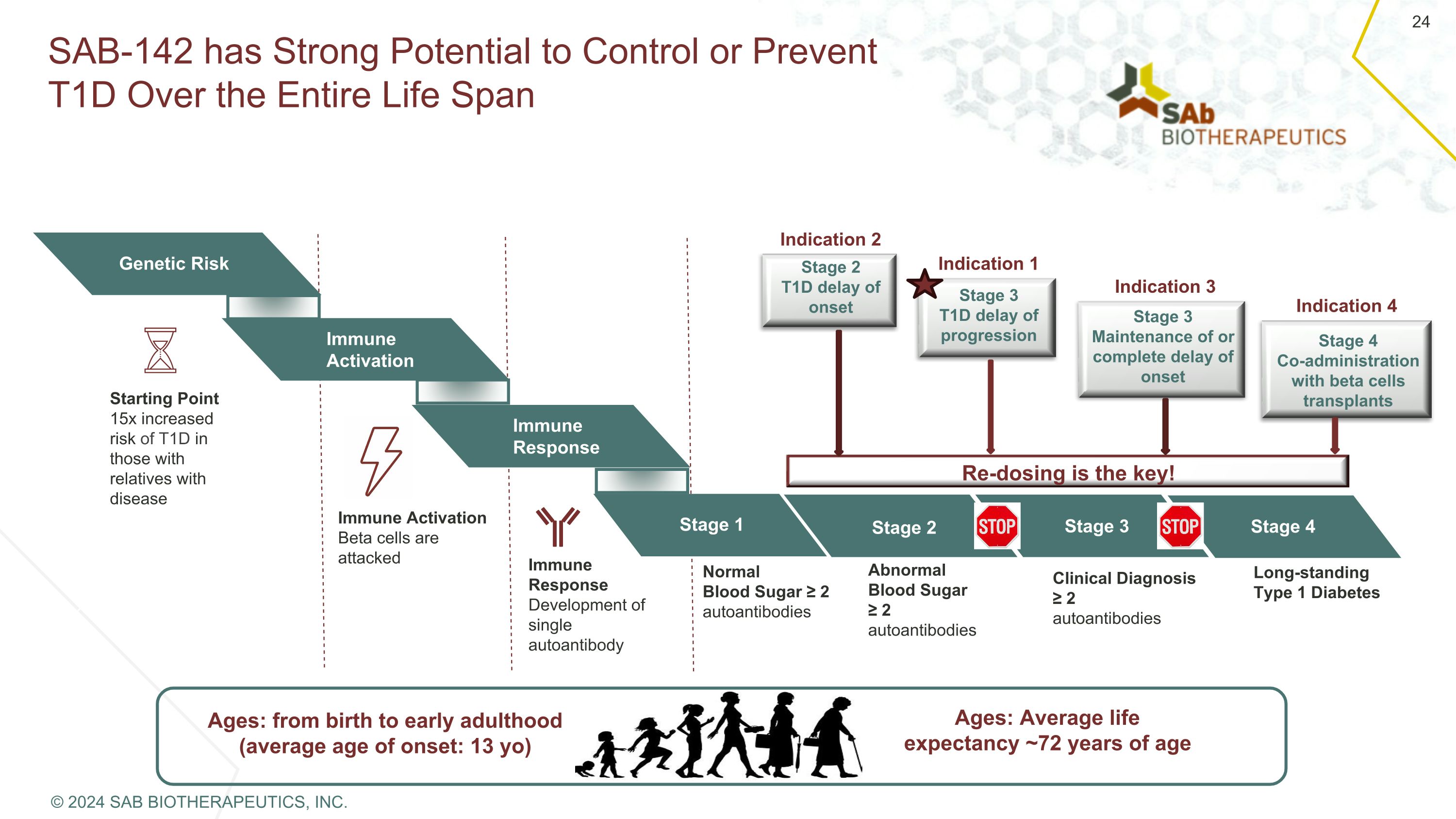
SAB-142 具有在整個生命週期中控制或預防 T1D 的強大潛力:從出生到成年早期(平均發病年齡:13 歲)年齡:平均預期壽命約 72 歲遺傳風險免疫激活免疫反應第 1 階段起點有疾病親屬的患者出現 T1D 的風險增加 15 倍免疫激活 β 細胞受到攻擊免疫反應單一自身抗體的開發正常血糖 ≥ 2 自身抗體異常血糖 ≥ 2 自身抗體臨牀診斷 ≥ 2 種自身抗體長期存在的 1 型糖尿病第 2 階段第 3 階段第 4 階段重新給藥是關鍵!第 2 階段 T1D 發病延遲第 3 階段 T1D 進展延遲階段 3 維持或完全延遲發作 4 期與 β 細胞移植聯合給藥適應症 2 適應症 1 適應症 3 適應症 4 © 2024 SAB BIOTHERAPEUTICS, INC.
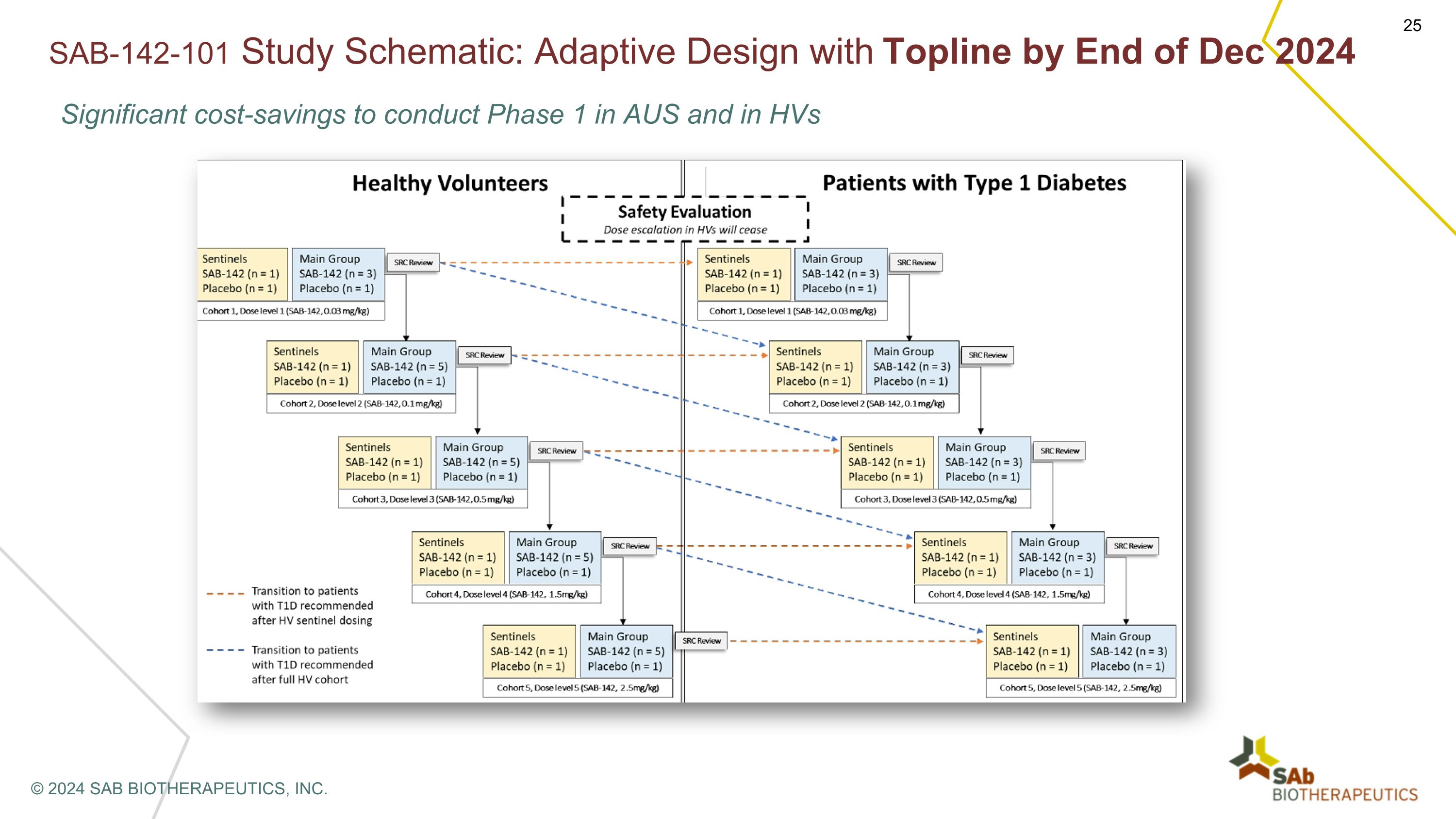
SAB-142-101 研究示意圖:截至 2024 年 12 月底,在澳大利亞和混合動力汽車進行第一階段可節省大量成本 © 2024 SAB BIOTHERAPEUTICS, INC.

SAB-142-201 SAFEGUARD 研究的關鍵設計包括 111 名 T1D 患者入組 SAB-142 高、SAB-142 低、安慰劑 1:1:1 入組 37 名患者/組 SAB-142 劑量:高劑量待定基於 1 期數據低劑量:待定基於 1 期數據註冊開始 Q12025 註冊期限:如果允許將青少年包括在內,則目標 12 個月國家:*澳大利亞/新西蘭-提早開始 *英國提前開始歐盟美國/加拿大地點:30 多個密鑰包括納入/排除年齡:隨機對前 15 名患者(10 名活躍患者)進行隨機分組和治療後,18-25 歲降至 12 歲潛在降至 12 歲年齡在 8 或 5 歲後,又有 15 名成人和青少年在第 1 天的最後 9 周內被診斷出患有 T1D(定義為第一劑胰島素)C-肽大於 200pmol/L 一種或多種與糖尿病相關的自身抗體排除 2 型糖尿病具有臨牀意義的實驗室全血細胞數、腎功能、肝功能。使用免疫抑制或免疫調節療法先前或當前結核病篩查時或進入治療時活性或慢性感染惡性腫瘤史使用其他非胰島素產品控制血糖先前使用 ATG、abatacept 或抗 CD3 抗體治療 A 2B 期、隨機、雙盲、安慰劑對照、劑量範圍研究評估 SAB-142 延緩進展的療效和安全性新發/最近發作的 3 期 T1D 患者中的 1 型糖尿病 DRF 與 POC 當前劑量範圍測定 (DRF) 2B 期設計允許:兩隻活躍的手臂使POS升高人抗胸腺細胞免疫球蛋白 SAB-142 的安全性和有效性阻止 1 型糖尿病的進展 © 2024 SAB BIOTHERAPEUTICS, INC.

一項 2B 期、隨機、雙盲、安慰劑對照、劑量範圍研究,評估 SAB-142 對延緩 1 型糖尿病在新發/最近發病的 3 期 T1D 患者中的療效和安全性 SAB-142-201:2B 期研究 27 主要目標:評估單劑量 SAB-142 後第 12 個月受刺激 C 肽反應的變化次要目標:確定 SAB-142 對時間範圍內的影響 (TIR) 確定 SAB-142 對 T1D Beta 分數(複合終點)的影響以確定SAB-142 在 3、6、9 和 12 個月時對 HbA1c 進行測定 SAB-142 在 3、6、9 個月時對刺激 C 肽的影響。確定 SAB-142 對胰島素需求的影響確定 SAB-142 對 CD4+ T 細胞還原和保存 CD8+-T 細胞的影響評估與 SAB-142 相關的安全參數評估第 3 期 T1D 患者中 SAB-142 的 PK 和免疫原性探索目標:研究治療對與 1 型糖尿病相關的 “應答者” 生物標誌物的影響 © 2024 SAB BIOTHERAPEUTICS, INC.

摘要 28 SAB-142:首創的全人源多靶點抗體治療旨在為延遲 1 型糖尿病的發作或進展提供卓越的安全性和有效性。T1D 中 SAB-142 的 MoA 已在眾多臨牀試驗中得到臨牀驗證,兔子 ATG 安全數據庫包含超過 700 名患者的人體數據 DIVERSITABTM 平臺生產的 SAB 抗體支持即將進行的 T1D 研究中預期的零 (0) 個血清病和零 (0) 個 SAB-142 中和抗體建立了監管路徑,SAB-142 資產為全人類多表位多靶點模式下一步:完成 2024 年底前首次進行人體 1 期 SAB-142-101 研究 © 2024 SAB BIOTHERAPEUTICS, INC.