| MARKER THERAPEUTICS 公司介紹 2024 年 1 月 |
| 前瞻性陳述 此處包含的某些陳述是 1934 年《證券交易法》第 21E 條、經修訂的 、經修訂的 1934 年《證券交易法》第 27A 條和經修訂的 1933 年《證券法》第 27A 條 所指的前瞻性陳述,涉及風險和不確定性。除與歷史事項有關的陳述以外的所有陳述,包括大意是我們 “相信”、“預期”、“計劃”、“目標”、“打算” 和類似表述的陳述,包括但不限於關於Marker Therapeutics, Inc.(“Marker” 或 “公司”)與 其他內容有關的意圖、信念、預測、前景、分析或當前預期的陳述:公司的研究、與其非工程化多腫瘤抗原 特異性 T 細胞相關的開發和監管活動及期望療法;這些計劃的有效性或在 疾病治療中可能的應用範圍和潛在療效和安全性;公司對其候選產品進行臨牀試驗的時機、進行和成功,包括用於 治療 MT-401 用於治療急性髓系白血病(“AML”)患者的 MT-401 現成品(“OTS”),用於治療急性髓細胞白血病(“AML”)患者 以及 MT-601 用於治療復發的非霍奇金淋巴瘤患者;公司的長期穩定和現金流;{MT-401br} 公司優化的製造工藝;以及MultiTAA療法的未來發展。前瞻性陳述就其性質而言, 受風險、不確定性和其他因素的影響,這些因素可能導致實際結果與此類陳述中陳述的結果存在重大差異。此類 風險、不確定性和因素包括但不限於公司最新的10-K、10-Q表和 其他美國證券交易委員會文件中列出的風險,這些文件可通過EDGAR在WWW.SEC.GOV上查閲。對 不作任何陳述或保證(明示或暗示),也不應依賴此處所含信息的公平性、準確性或完整性。因此, 公司或其任何負責人、合夥人、子公司或關聯公司,或任何此類人員的董事會成員、高級職員或僱員均不接受因使用本演示文稿而直接或間接產生的任何 責任。此處列出的某些信息包括估計值、 預測和目標,並涉及主觀判斷和分析的重要內容,這些要素可能正確,也可能不正確。對於此類估計、預測或目標的準確性,或與此類估計、 預測或目標有關的所有假設均已考慮或陳述,或此類估計、預測或目標將得以實現,未作出 陳述。本演示文稿並非 意圖包含評估公司可能需要的所有信息,本演示文稿的任何接收者都應對公司以及其中包含的數據和信息進行自己的 獨立分析。任何前瞻性陳述都不能保證 的未來表現,實際結果可能與前瞻性陳述中的估計存在重大差異。除非另有説明,否則本演示文稿中的所有 信息均為截至本演示文稿封面之日,公司沒有義務修改這些 前瞻性陳述以反映本演示文稿發佈之日之後發生的事件或情況。 2 |
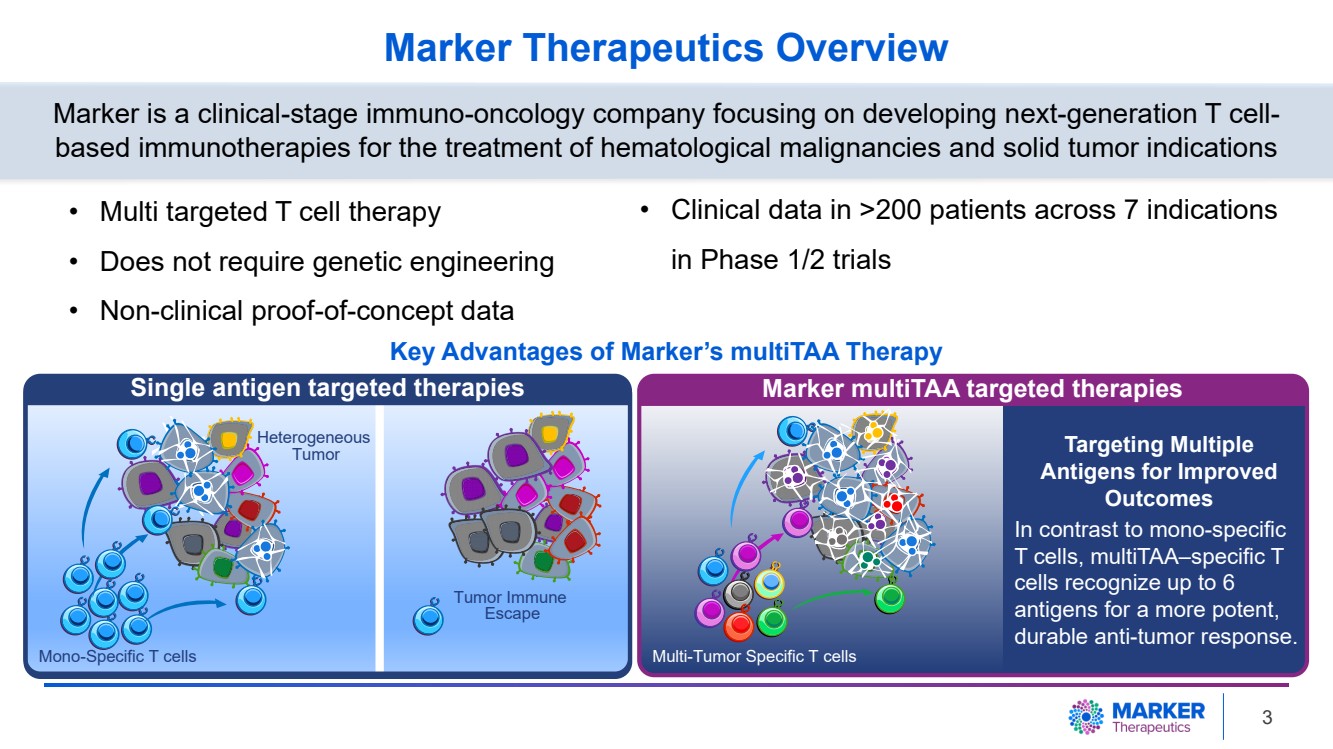
| Marker Therapeutics 概述 • 多靶向 T 細胞療法 • 無需基因工程 • 非臨牀概念驗證數據 Marker 是一家臨牀階段的免疫腫瘤學公司,專注於開發用於治療血液惡性腫瘤和實體瘤適應症的下一代基於 T 細胞的免疫療法 單一特異性 T 細胞 腫瘤免疫 異質性 } 腫瘤 多腫瘤特異性 T 細胞 單抗原靶向療法 Marker MultiTAA 靶向療法 靶向多種 抗原改善 結果 與單一特異性 T 細胞相比,MultiTAA 特異性 T 細胞可識別多達 6 種抗原,從而產生更有效、更持久的抗腫瘤反應。 • 1/2 期試驗中 7 種適應症 >200 名患者的臨牀數據 Marker MultiTAA 療法的主要優勢 3 |
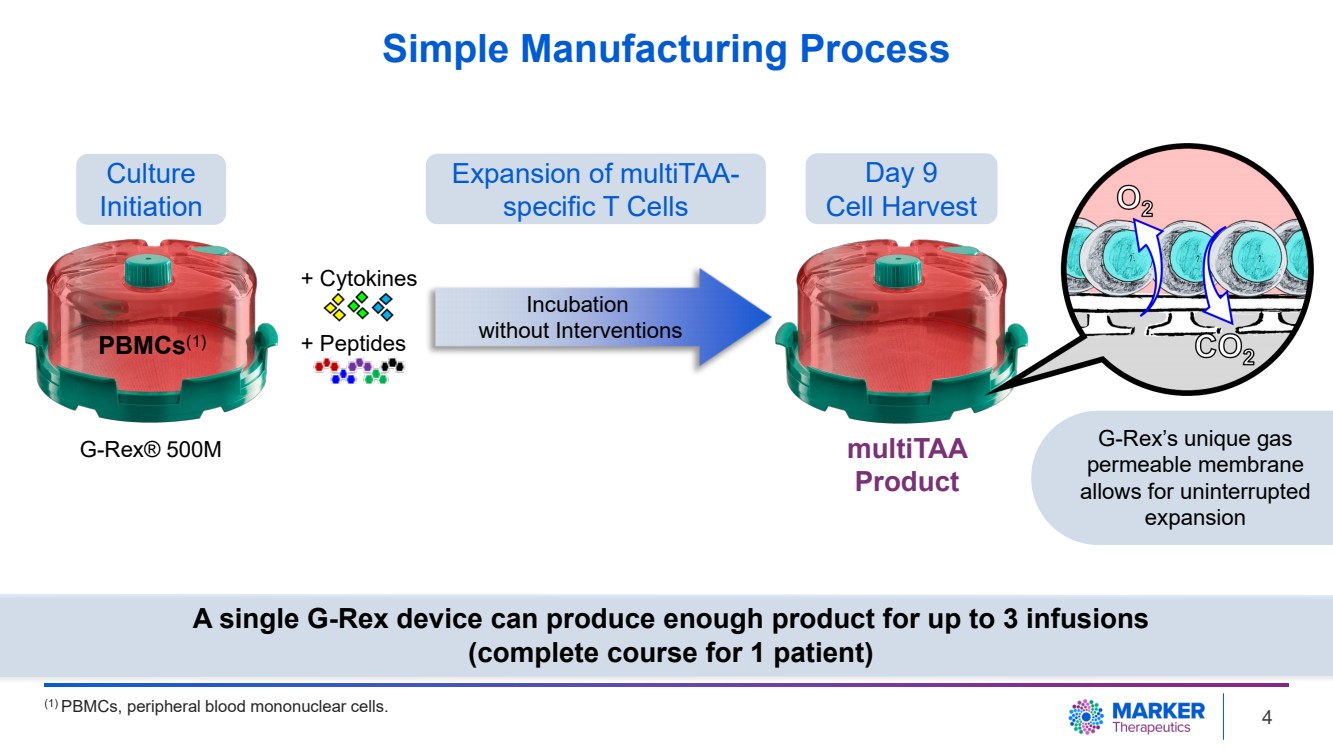
| 簡單製造流程 G-Rex® 500M 培養 啟動 擴展 MultiTAA 特異性 T 細胞 第 9 天細胞收穫 產品 + 細胞因子 + 肽 孵化 無需幹預 pbmcS (1) G-Rex 的獨特氣體 可滲透膜 允許 不間斷的 擴張 一臺 G-Rex 設備可以產生足夠的產品,最多可輸液 3 次 (1 名患者的完整療程) (1) PBMC、外周血單核細胞。4 |
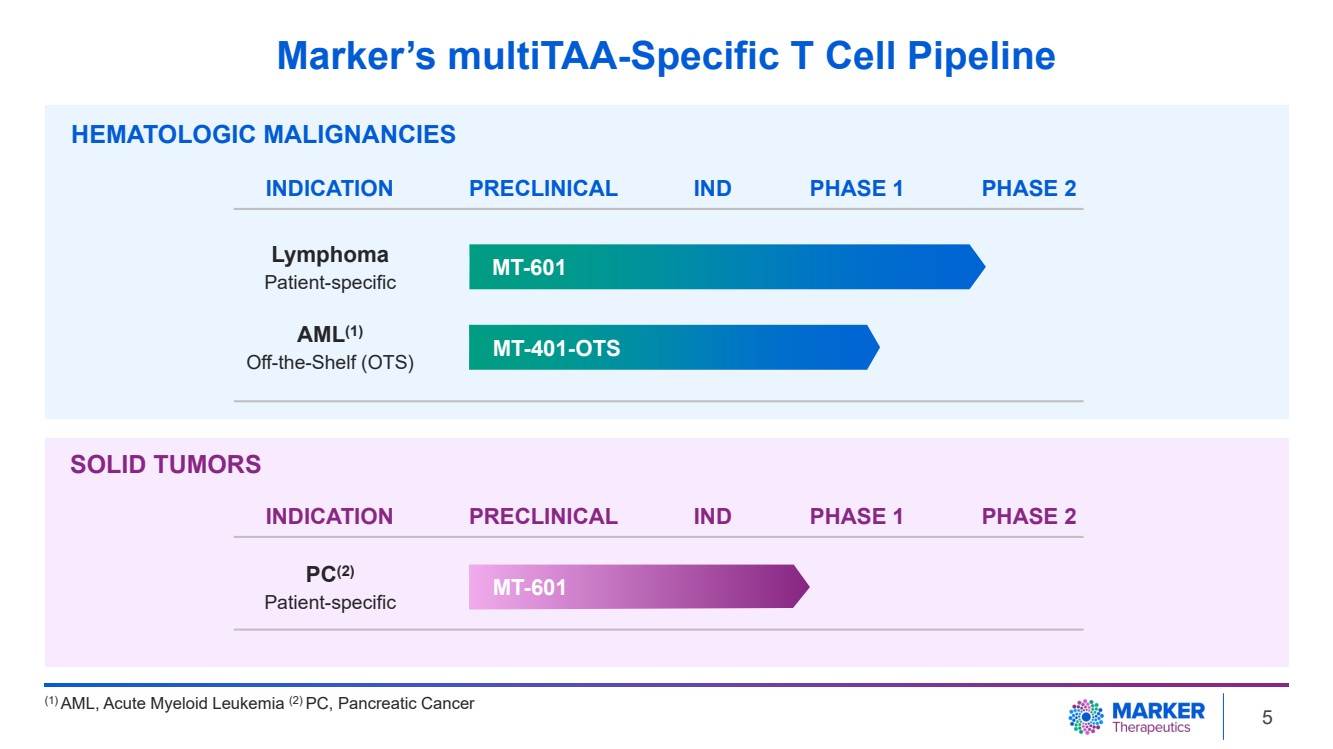
| Marker 的 MultiTAA 特異性 T 細胞管道 血液學惡性腫瘤 MT-601 MT-601 MT-401-OTS 適應症臨牀前 1 期 2 期 AML (1) 現成品 (OTS) 患者特異性 PC (2) 患者特異性 (1) AML、急性髓系白血病 (2) PC、胰腺癌症 IND 實體瘤 適應症臨牀前臨牀試驗 1 期 2 期 5 |
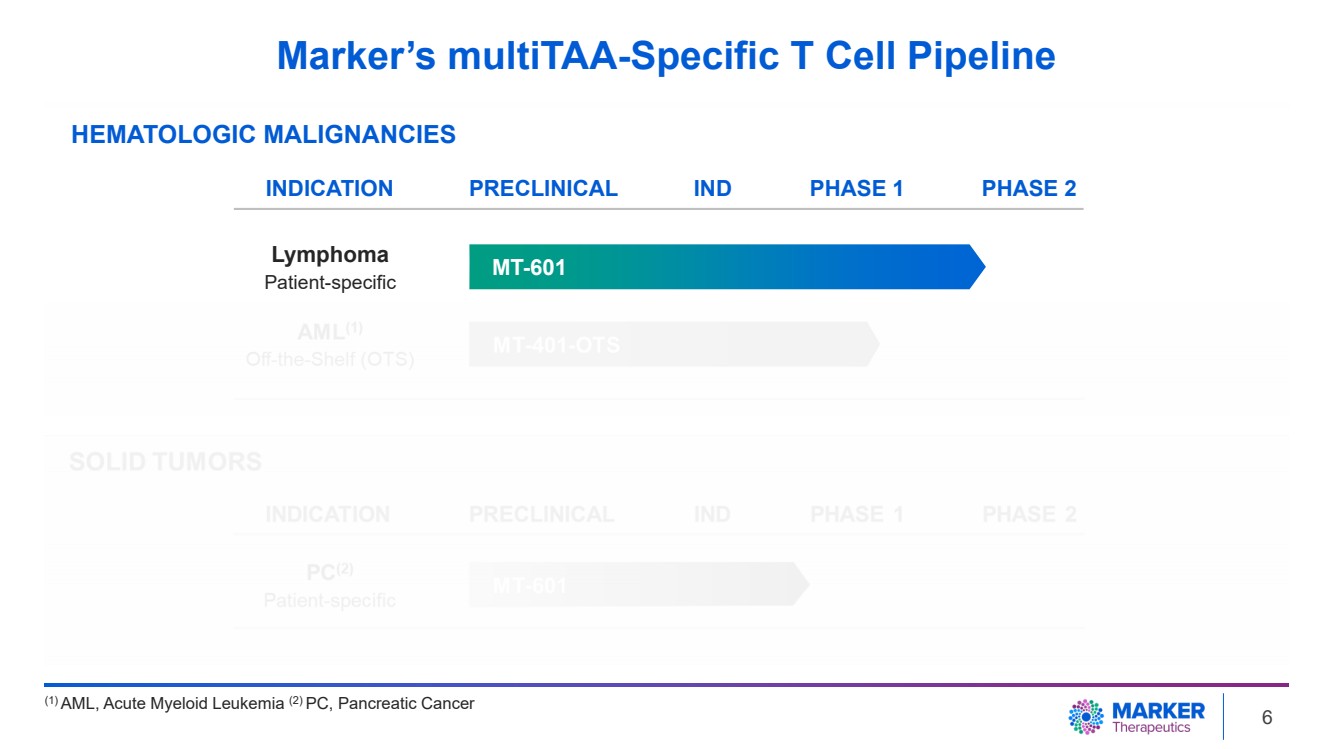
| Marker 的 Multitaa 特異性 T 細胞管線 (1) 急性髓系白血病 (2) PC、胰腺癌 血液系統惡性腫瘤 MT-601 適應症臨牀前 1 期 2 期淋巴瘤 患者特異性 IND 6 |
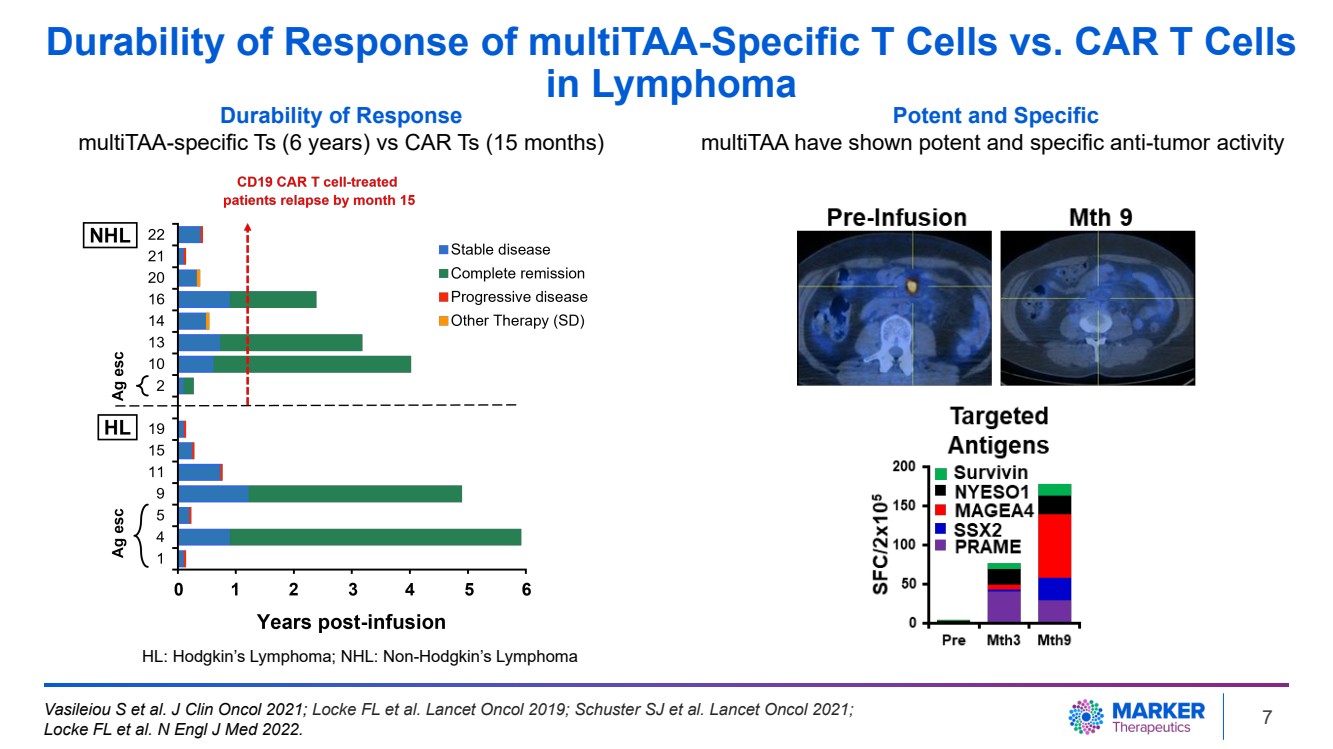
| 淋巴瘤中 MultiTAA 特異性 T 細胞與 CAR T 細胞反應的耐久性 反應耐久性 與 CAR Ts(15 個月)對比 CAR T(15 個月) 強效和特異性 MultiTAA 顯示出強大而特異的抗腫瘤活性 HL:霍奇金淋巴瘤;NHL:非霍奇金淋巴瘤 Vasililoma Eiou S 等人J Clin Oncol 2021;Locke FL 等人。Lancet Oncol 2019;Schuster SJ 等人。Lancet Oncol 2021; Locke FL 等人N Engl J Med 2022.7 |
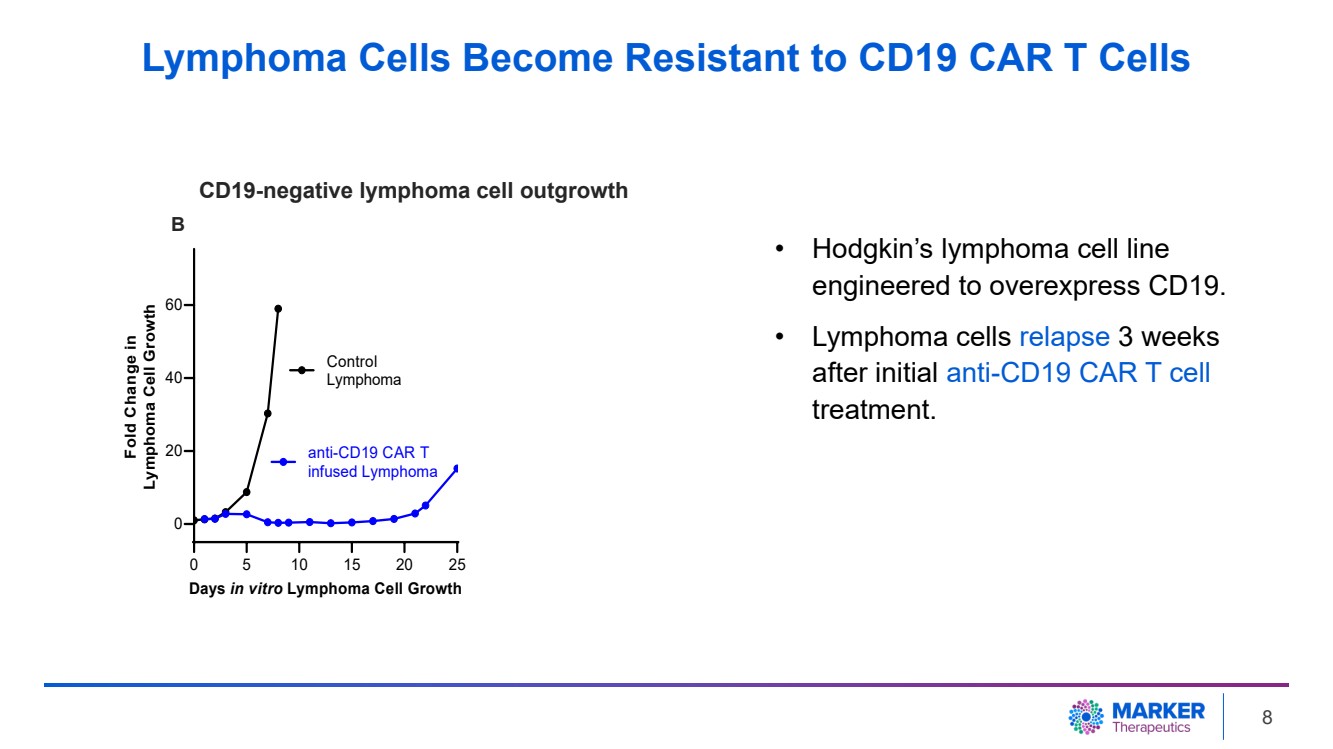
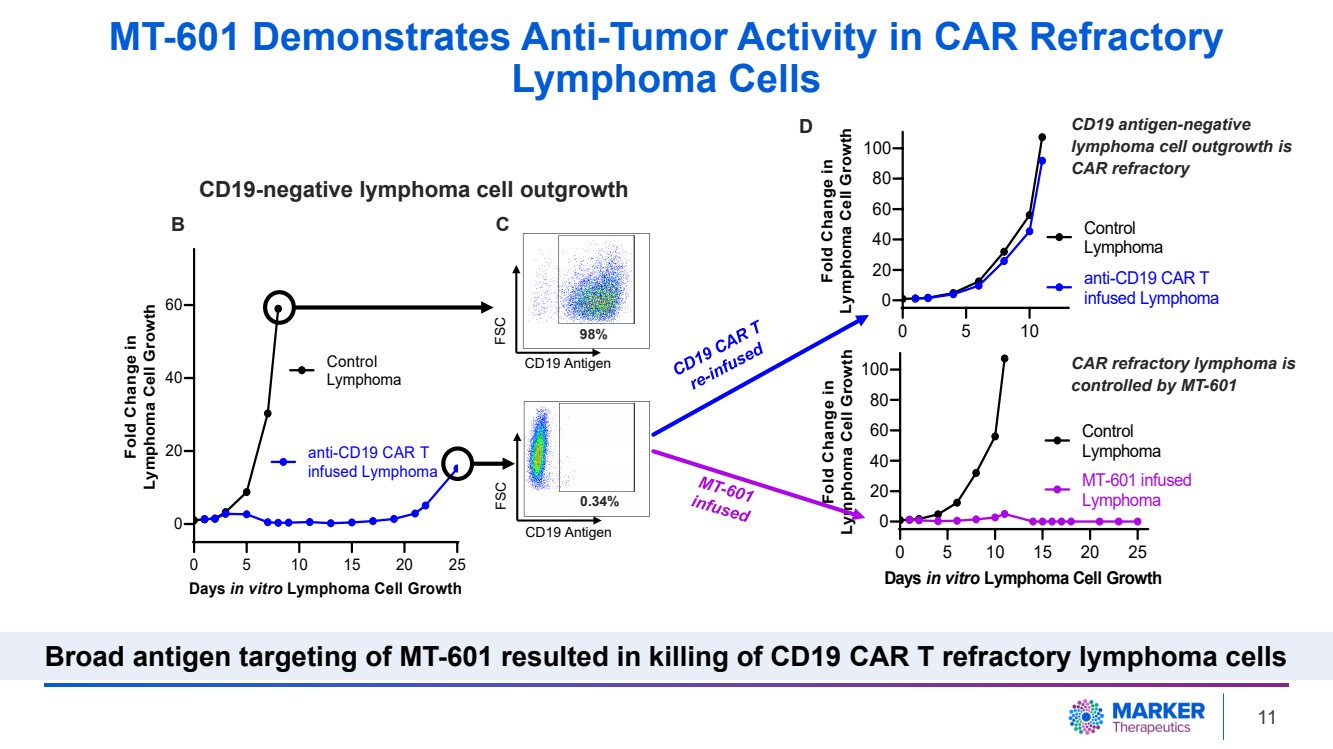
| • 霍奇金淋巴瘤細胞系 專為過度表達 CD19 而設計。 • 淋巴瘤細胞在首次抗CD19 CAR T 細胞 治療 3 周後復發 。 0 5 10 15 20 25 0 20 40 60 天體外淋巴瘤細胞生長 淋巴瘤細胞生長摺疊變化 控制 淋巴瘤 抗 CD19 CAR T 注入淋巴瘤 B CD19 陰性淋巴瘤細胞產生 淋巴瘤細胞對 CD19 CAR T 細胞產生耐藥性 } 8 |
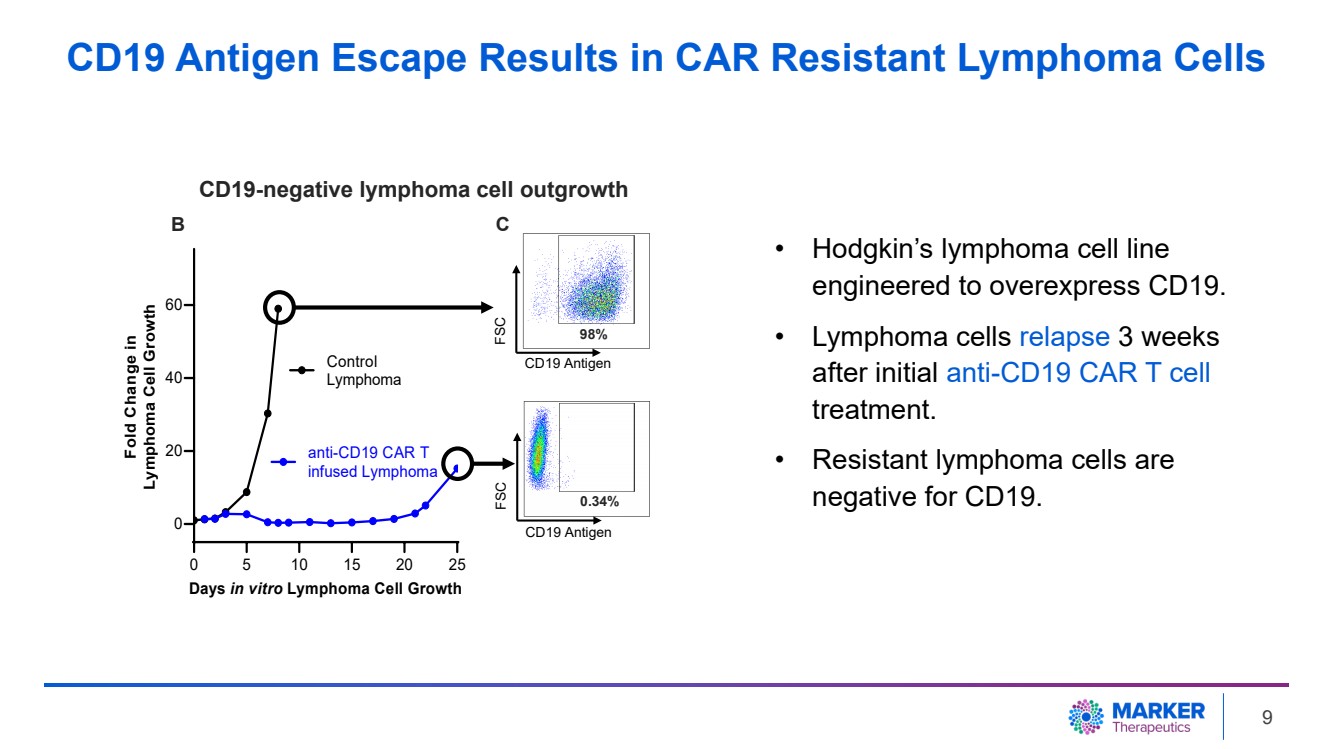
| • 霍奇金淋巴瘤細胞系 專為過度表達 CD19 而設計。 • 淋巴瘤細胞在首次抗CD19 CAR T 細胞 治療 3 周後復發 。 • 耐藥淋巴瘤細胞 CD19 陰性。 0 5 10 15 20 25 0 20 40 60 天體外淋巴瘤細胞生長 淋巴瘤細胞生長 對照 淋巴瘤 抗 CD19 CAR T 注入淋巴瘤 CD19 抗原 FSC 98% 0.34% CD19 抗原 CD19 抗原 SC B C CD19 陰性淋巴瘤細胞產生 CD19 抗原逃逸導致耐藥淋巴瘤細胞 9 |
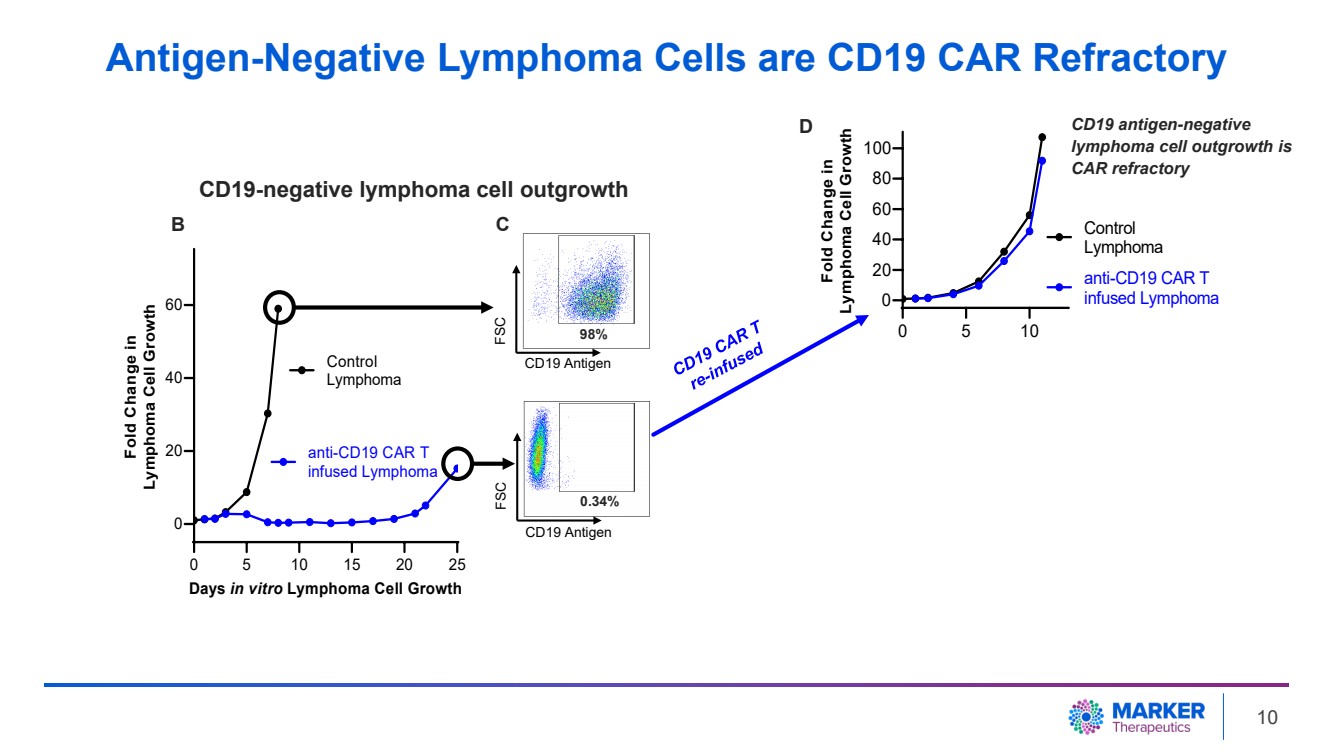
| 抗原陰性淋巴瘤細胞是 CD19 CAR 難治性 0 5 10 15 20 25 0 40 60 天體外淋巴瘤細胞生長 淋巴瘤細胞生長倍數變化 控制 淋巴瘤 抗 CD19 CAR T 注入淋巴瘤 0 5 10 0 20 40 60 80 100 淋巴瘤的變化瘤細胞生長 控制 淋巴瘤 抗 CD19 CAR T 注入淋巴瘤 CD19 抗原 FSC 98% 0.34% CD19 抗原 FSC B C CD19 抗原陰性 淋巴瘤細胞的生長是 CAR 難治性 br} D CD19 陰性淋巴瘤細胞產生 10 |
| 0 5 10 15 20 25 0 20 40 60 天體外淋巴瘤細胞生長 淋巴瘤細胞生長倍數變化 控制 淋巴瘤 抗 CD19 CAR T 注入淋巴瘤 0 5 10 0 20 40 60 80 100 倍變化 淋巴瘤細胞生長 控制 淋巴瘤 抗CD19 CAR T 注入淋巴瘤 CD19 抗原 FSC 98% 0.34% CD19 抗原 FSC B C 0 5 10 15 20 20 20 40 60 80 100 天體外淋巴瘤細胞生長 淋巴瘤細胞生長摺疊變化 對照 br} 淋巴瘤 注入 MT-601 的 淋巴瘤 CD19 抗原陰性 淋巴瘤細胞生長是 CAR 難治性 CAR 難治性淋巴瘤由 MT-601 控制 D CD19 陰性淋巴瘤細胞產生 MT-601 在 CAR 難治 淋巴瘤細胞中表現出抗腫瘤活性 靶向 MT-601 的廣泛抗原可殺死 CD19 CAR T 難治性淋巴瘤細胞 11 |
| 在 1 期阿波羅試驗中首位接受 MT-601 治療的研究參與者 人口統計 • 57 歲女性 • 被診斷患有 DLBCL (1) 臨牀史 • 先前的 4 種治療系列,包括 CD19 CAR T 細胞 • 在 CD19 CAR T 細胞療法 90 天內復發 • 隨後使用 2 劑 MT-601(200x106 細胞劑量)進行治療 (1) DLBCL,瀰漫性大 B 細胞淋巴瘤 12 |
| 在 CAR T 復發後接受 MT-601 治療的淋巴瘤患者的完全反應 MT-601 臨牀安全 • MT-601 治療耐受性良好 • 否 > 1 級治療相關不良事件 臨牀反應 • 研究參與者在第二次輸注 MT-601 後 8 周實現完全代謝反應 • 患者在 MT-601 治療 6 個月後仍處於完全緩解狀態 13 |
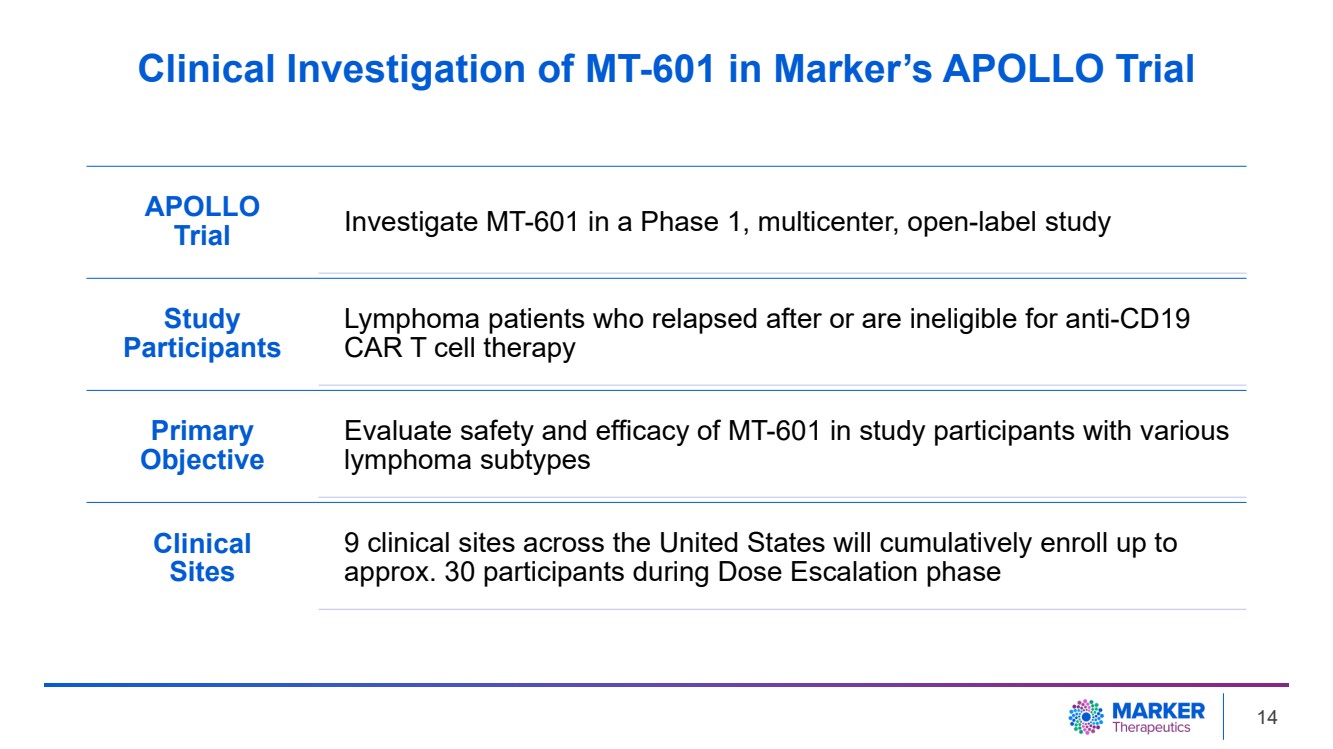
| Marker 的 APOLLO 試驗 APOLLO 試驗在 1 期多中心開放標籤研究中研究 MT-601 研究 參與者 參與者 淋巴瘤患者 在抗CD19 CAR T 細胞療法後復發或沒有資格接受抗 CD19 CAR T 細胞療法 主要目標 評估 MT-601 對各種 淋巴瘤亞型研究參與者的安全性和有效性 } 臨牀 站點 在劑量升級階段 14 期間,美國各地的 9 個臨牀場所將累計招收最多 大約 30 名參與者 MT-601 |
| 未來發展 |
| Marker 的 MultiTAA 特異性 T 細胞管線 (1) 急性髓系白血病 (2) PC、胰腺癌 血液系統惡性腫瘤 適應症臨牀前臨牀研究第 1 期 2 期 MT-401-OTS AML (1) 現貨 (OTS) 16 |
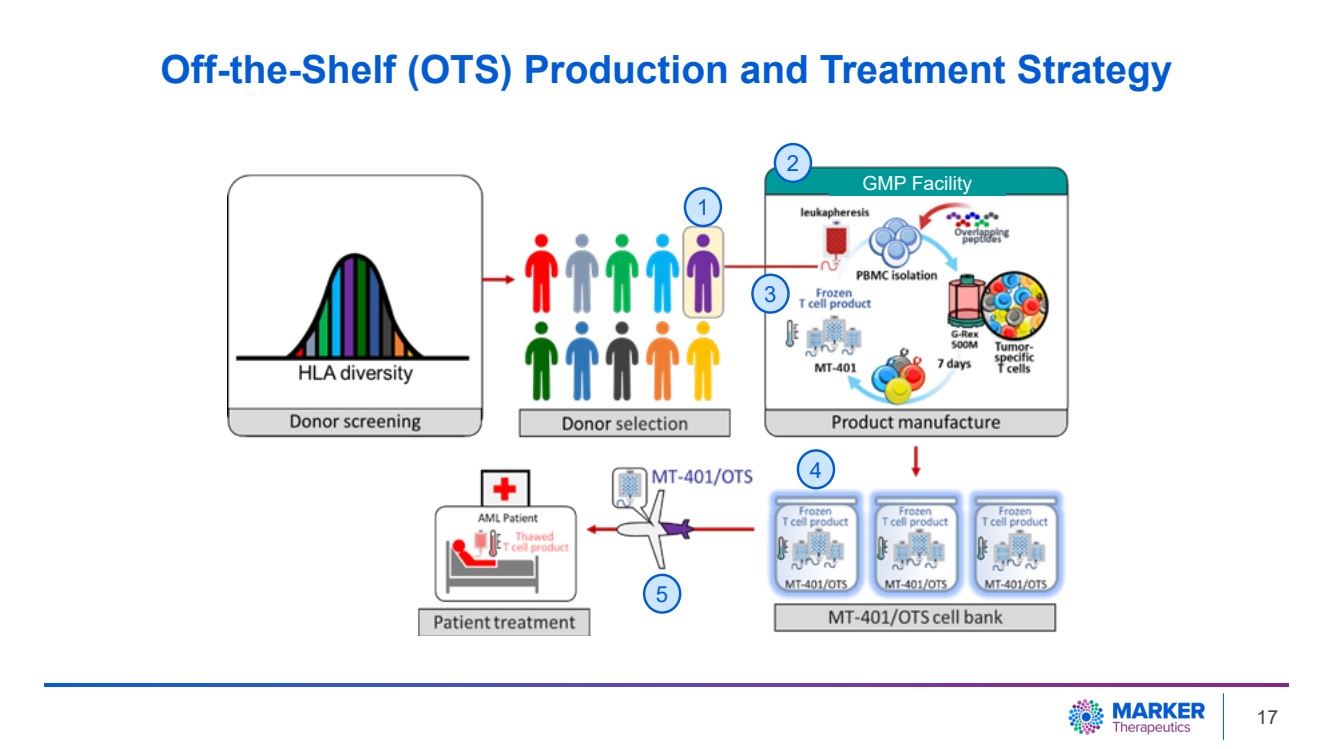
| 現貨 (OTS) 生產和處理策略 2 GMP 設施 1 3 4 5 17 |
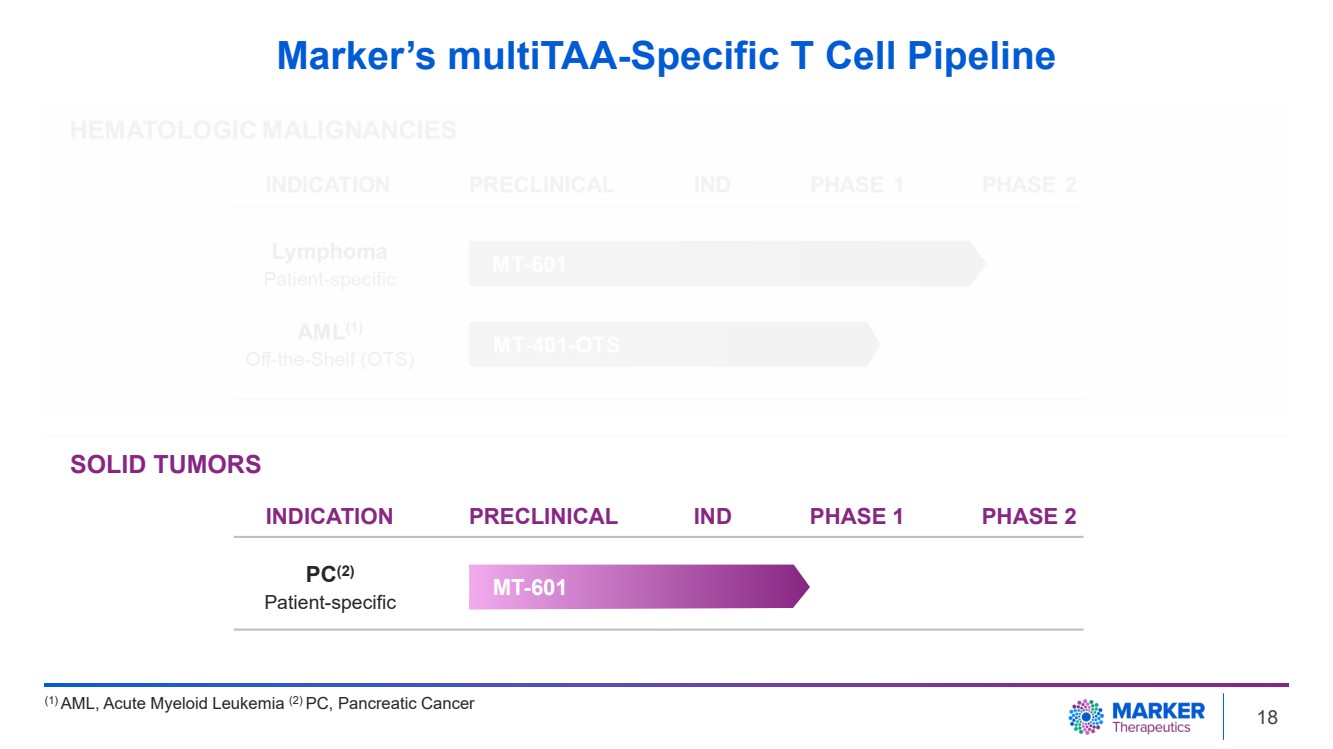
| Marker 的 MultiTAA 特異性 T 細胞管線 (1) 急性髓系白血病 (2) PC、胰腺癌 MT-601 PC (2) 患者特異性 實體瘤 適應症臨牀前研究 1 期 2 期 18 |
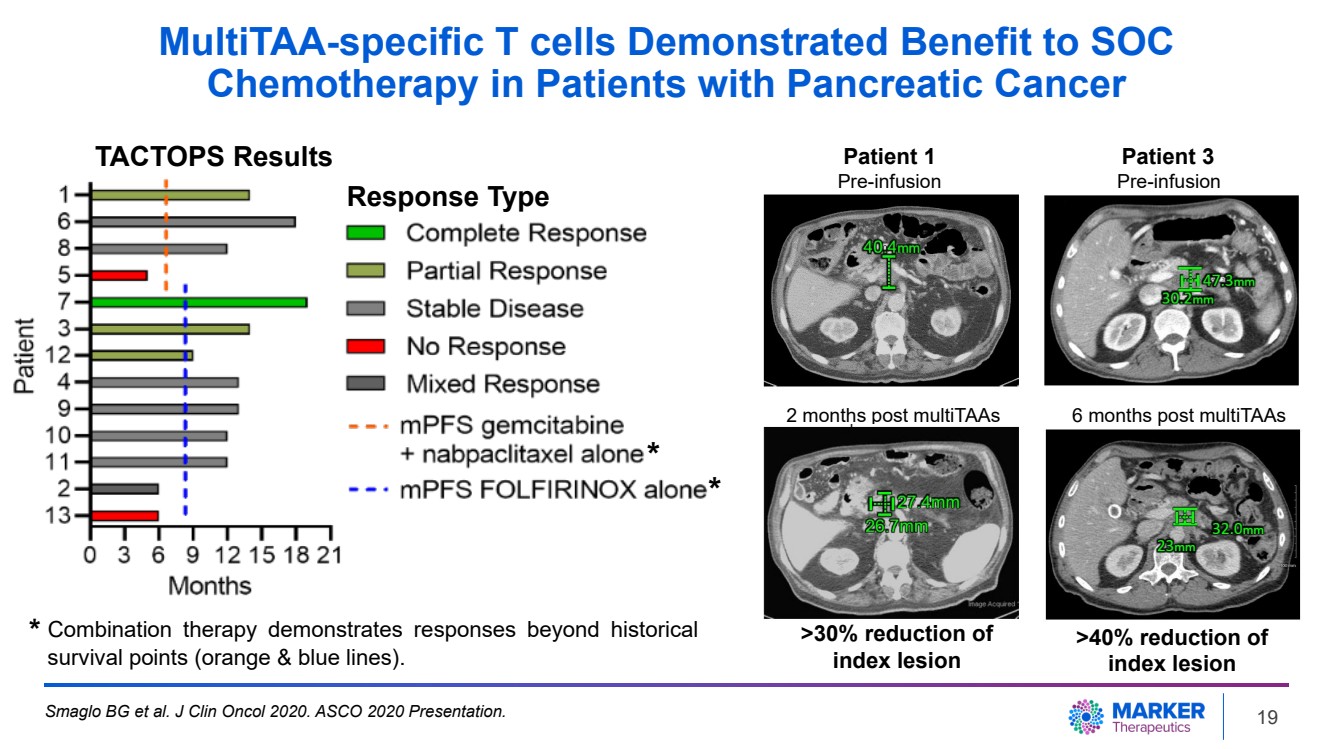
| MultiTAA-specific T cells Demonstrated Benefit to SOC Chemotherapy in Patients with Pancreatic Cancer Smaglo BG et al. J Clin Oncol 2020. ASCO 2020 Presentation. * Combination therapy demonstrates responses beyond historical survival points (orange & blue lines). Patient 1 Patient 3 Pre-infusion Pre-infusion 2 months post multiTAAs 6 months post multiTAAs >30% reduction of index lesion >40% reduction of index lesion * * TACTOPS Results Response Type 19 |
| Corporate & Financial Highlights Demonstrated clinical response in hematological malignancies and solid tumors Favorable safety profile in clinical trials to date 3 FDA-approved INDs Awarded over $17 million non-dilutive funding through grants Cash & Cash Equivalents of $17.5 million(1) Current cash runway expected through Q4 2025 (1) As of September 30, 2023. 20 |
| THANK YOU 21 |