| 2024 年 1 月未來的 Precision 抗體療法 由機器 學習提供支持 |
| 2 前瞻性陳述 本演示文稿中的某些陳述構成 修正後的1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”。諸如 “可能”、“可能”、“將”、“應該”、“相信”、“預期”、“估計”、“繼續”、“預測”、“預測”、“項目”、“計劃”、“打算” 等詞語或有關意圖、信念或當前預期的陳述,均為前瞻性陳述。這些前瞻性陳述 基於當前的估計。儘管特拉華州的一家公司iBio, Inc.(包括其合併子公司 “iBio”、“公司”、“我們” 或 “我們的”) 認為這些前瞻性陳述是合理的,但不應過分依賴任何此類前瞻性陳述,這些陳述以 我們在本演講之日獲得的信息為基礎。這些前瞻性陳述受到各種風險和不確定性的影響,其中許多風險和不確定性難以預測,可能導致實際結果與當前的預期和假設與 任何前瞻性陳述所提出或暗示的預期和假設存在重大差異。可能導致實際結果與當前預期存在重大差異的重要因素包括, 公司獲得監管部門批准以實現其候選產品的商業化或遵守現行監管要求的能力、 與其針對特定適應症推廣或商業化候選產品的能力相關的監管限制、候選產品 在市場上的接受程度以及成功開發、營銷或銷售產品、獲得許可的能力協議,其專利資產的持續維護和 增長、建立和維持合作的能力、獲得或維持為其 研發活動提供資金所需的資本或補助金的能力、競爭、其留住關鍵員工或維持其在紐約證券交易所美國上市的能力,以及公司最新的10-K表年度報告和公司隨後向美國證券交易委員會提交的文件(包括後續的定期報告)中討論的其他因素在 表單 10-Q 和 8-K 上。本演示文稿中的信息僅從今天起提供,除非法律要求,否則我們沒有義務因新信息、未來事件或其他原因更新本演示文稿中包含的任何前瞻性 陳述。本陳述以及與本演示相關的任何 口頭陳述均不構成出售要約、收購要約或建議 購買公司任何股權、債務或其他證券,也不構成與公司發行的任何證券相關的任何州或其他司法管轄區出售 這些證券屬於非法的州或其他司法管轄區在根據該州或司法管轄區的 證券法進行註冊或獲得資格之前。 |
| * 美國專利號 11,545,238 3 我們正在為下一代 高難度靶標和 作用模式開發抗體 ,目標是 為我們的分子提供高的 可開發性和增強 安全性 |
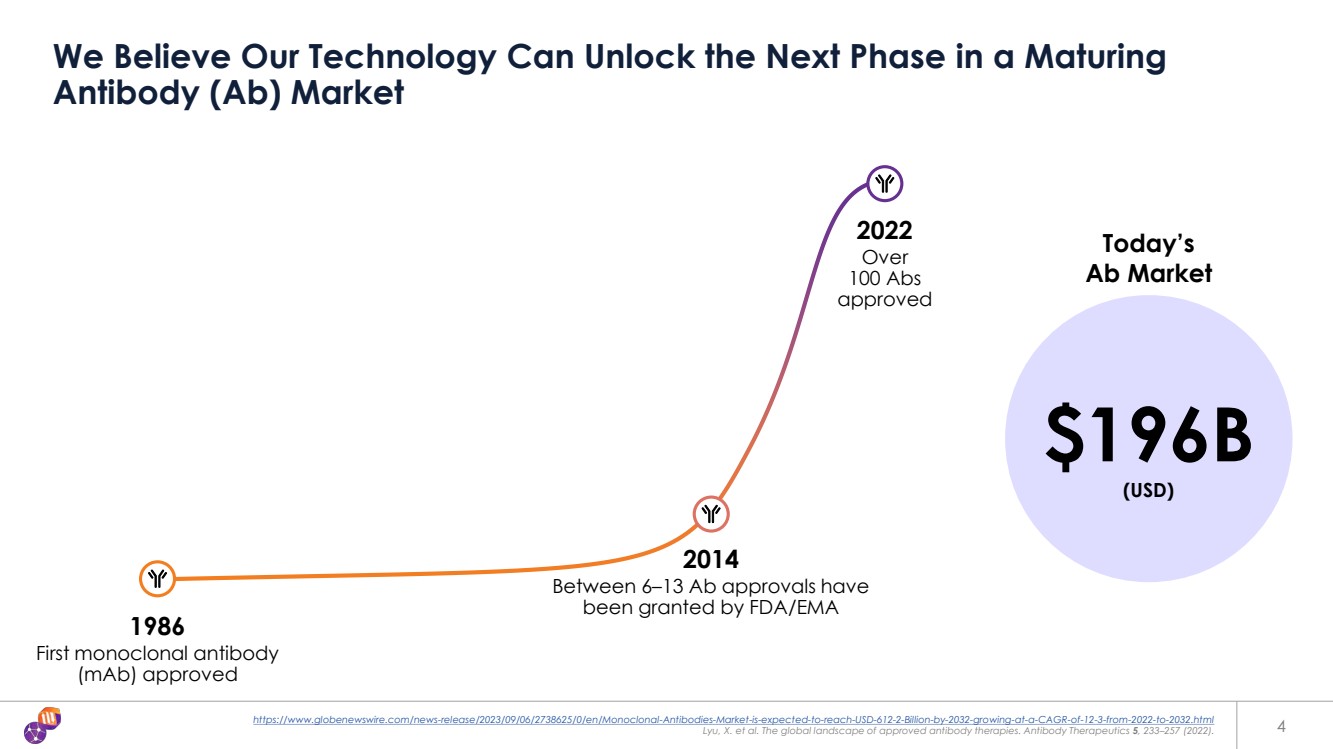
| https://www.globenewswire.com/news-release/2023/09/06/2738625/0/en/Monoclonal-Antibodies-Market-is-expected-to-reach-USD-612-2-Billion-by-2032-growing-at-a-CAGR-of-12-3-from-2022-to-2032.html Lyu,X 等人。已獲批准的抗體療法的全球格局。Antiby Therapeutics 5,233—257(2022)。4 我們相信我們的技術可以開啟成熟的 抗體(Ab)市場的下一階段 1986 年首個單克隆抗體 (maB) 獲得批准 2022 年超過 100 Abs 獲得批准 2014 年 FDA/EMA 批准了 196B 美元 (美元) 今天的 Ab 市場 |
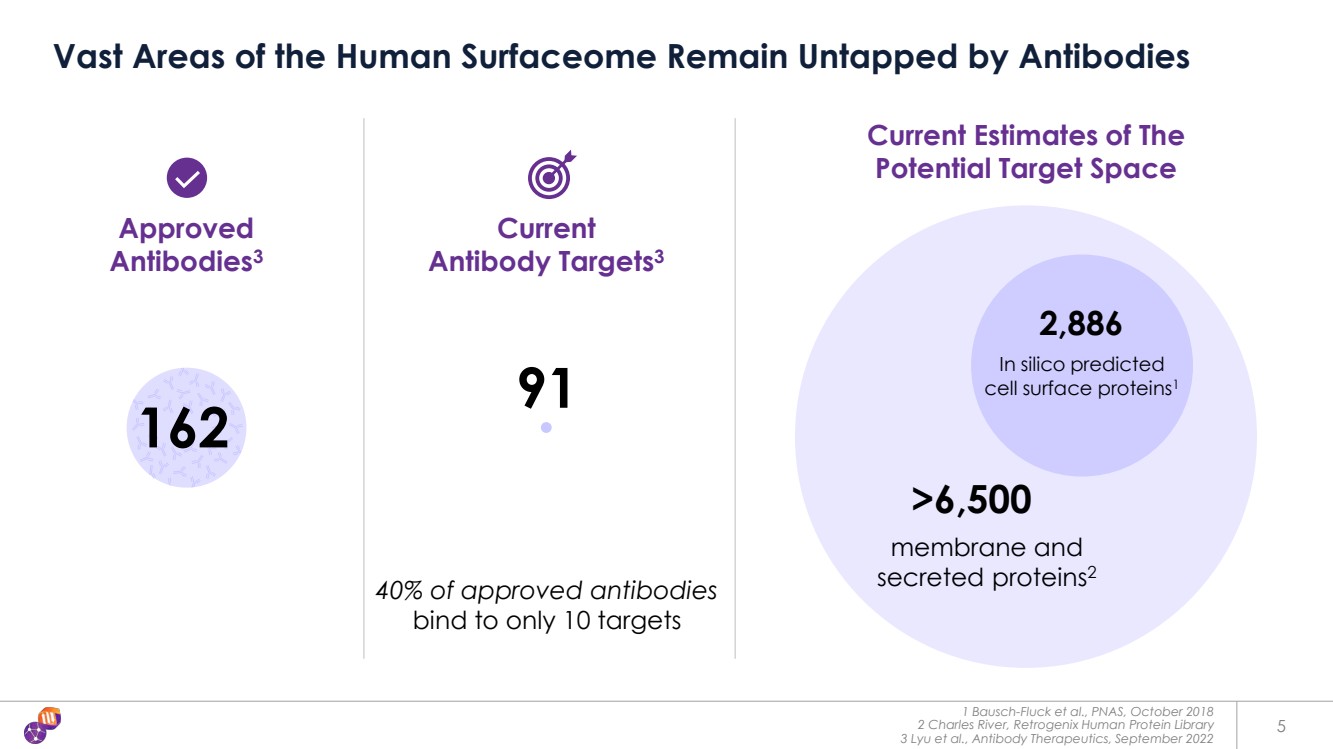
| 1 Bausch-Fluck 等人,PNAS,2018 年 10 月 2 Charles River,Retrogenix 人類蛋白質庫 3 Lyu 等人,抗體療法,2022年9月 5 人體表面組的大片區域仍未被抗體開發 91 已獲批准 抗體3 2,886 >6,500 在計算機上預測 細胞表面蛋白1 膜和 分泌的受保護物 ins2 當前 抗體靶點3 目前對 潛在靶標空間的估計 162 40% 的批准抗體 僅與 10 個靶標結合 |
| 輕而易舉的時代 已過飽和 現有技術 無法解決 不斷增加的靶標 複雜性和 作用模式 已被證明是成功的 但是 透露組織外 安全問題 抗體 可開發性已被證明是關鍵 hurddles 6 當今的 Ab 市場挑戰:複雜的目標、安全性和可開發性問題 |
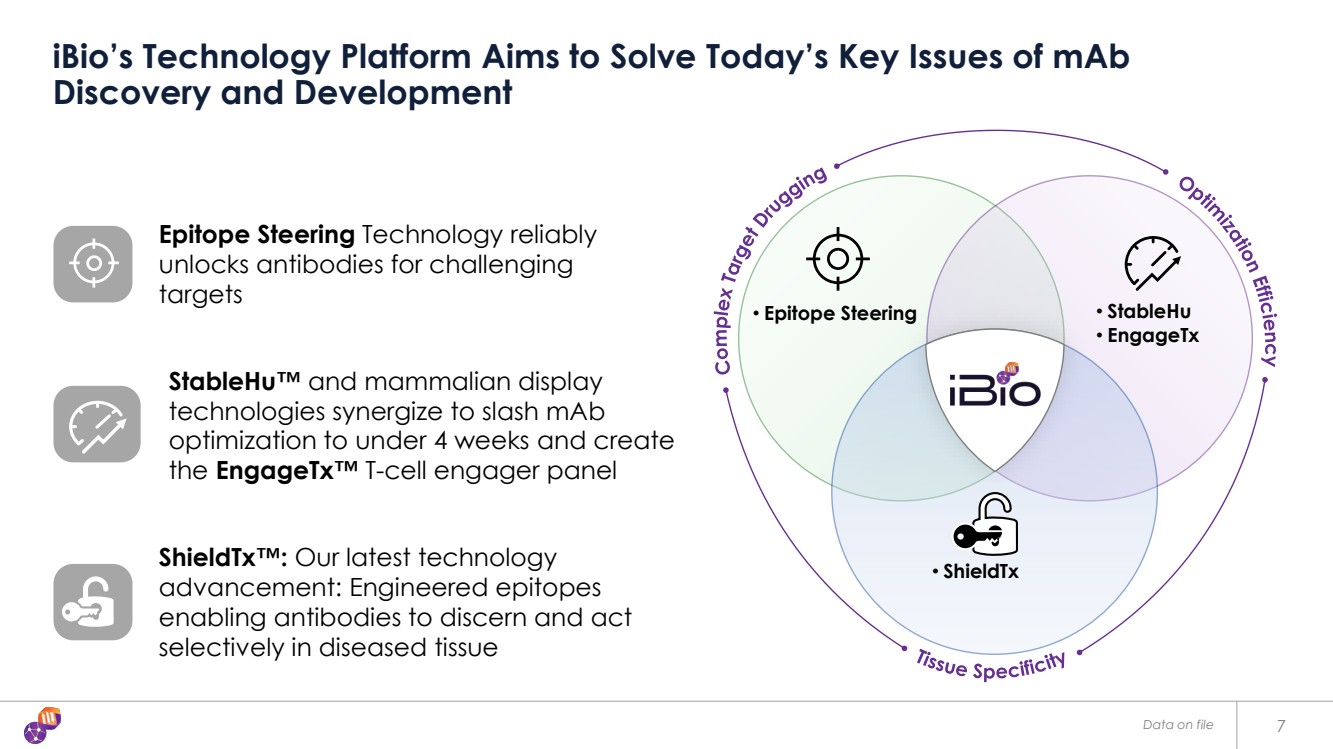
| 7 iBio 的技術平臺旨在解決當今的 maB 發現和開發的關鍵問題 表位轉向技術可靠地解鎖抗體 具有挑戰性的 靶標 StableHu™ 和哺乳動物顯示器 技術協同作用,將 maB 優化縮短至 4 周以下,並創建 engageTX™ T 細胞接觸面板 ShieldTX™: 我們的最新技術 進步:工程表位 使抗體能夠辨別和選擇性地在患病組織中起作用 優化 Efficie n c y o o m plex target藥物治療 組織特異性 • 表位指導 • StableHU • engagetX • ShieldTX • ShieldTX 存檔數據 |
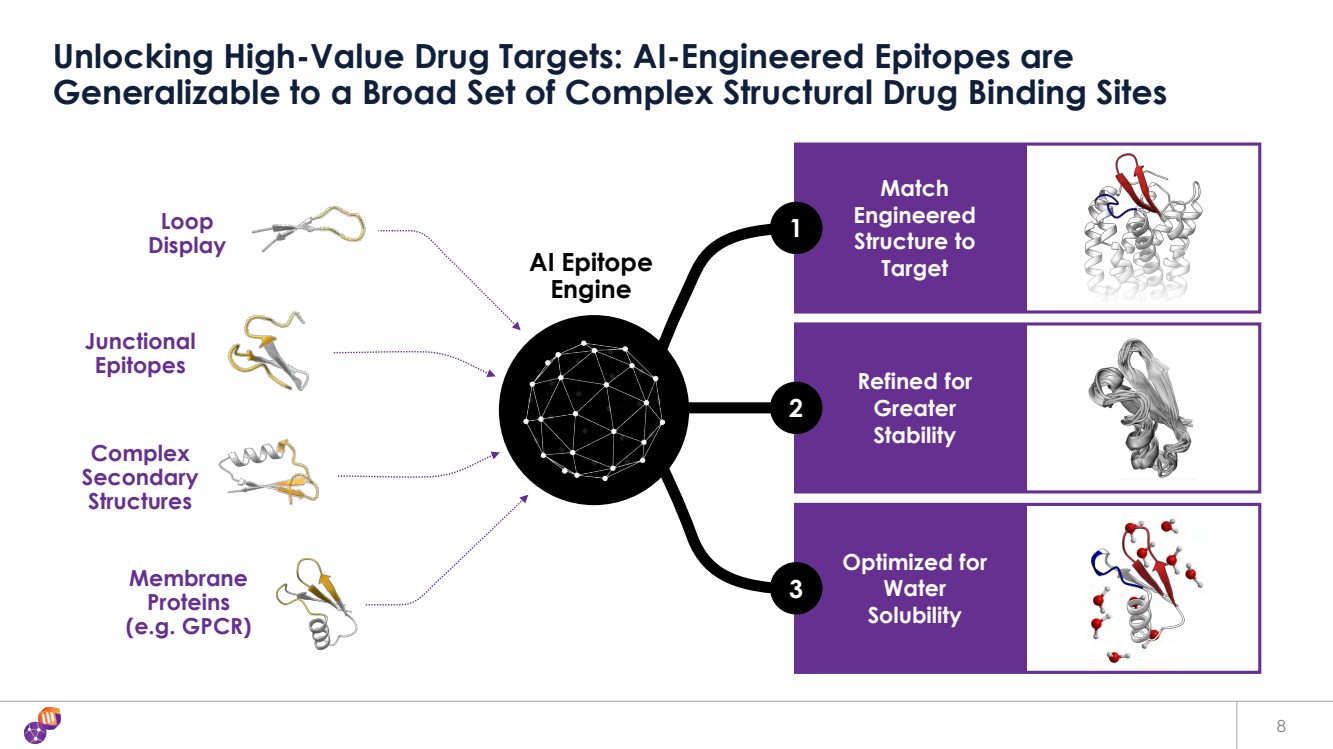
| 將 工程化 結構與 靶點 精製以提高 穩定性 優化 水 溶解度 解鎖高價值藥物靶標:AI 設計的表位可推廣到多種複雜結構藥物結合位點 連接性 表位 複雜 二級 表位 } 結構 膜 蛋白 (例如 GPCR) 循環 顯示 1 2 3 AI 表位 引擎 引擎 8 |
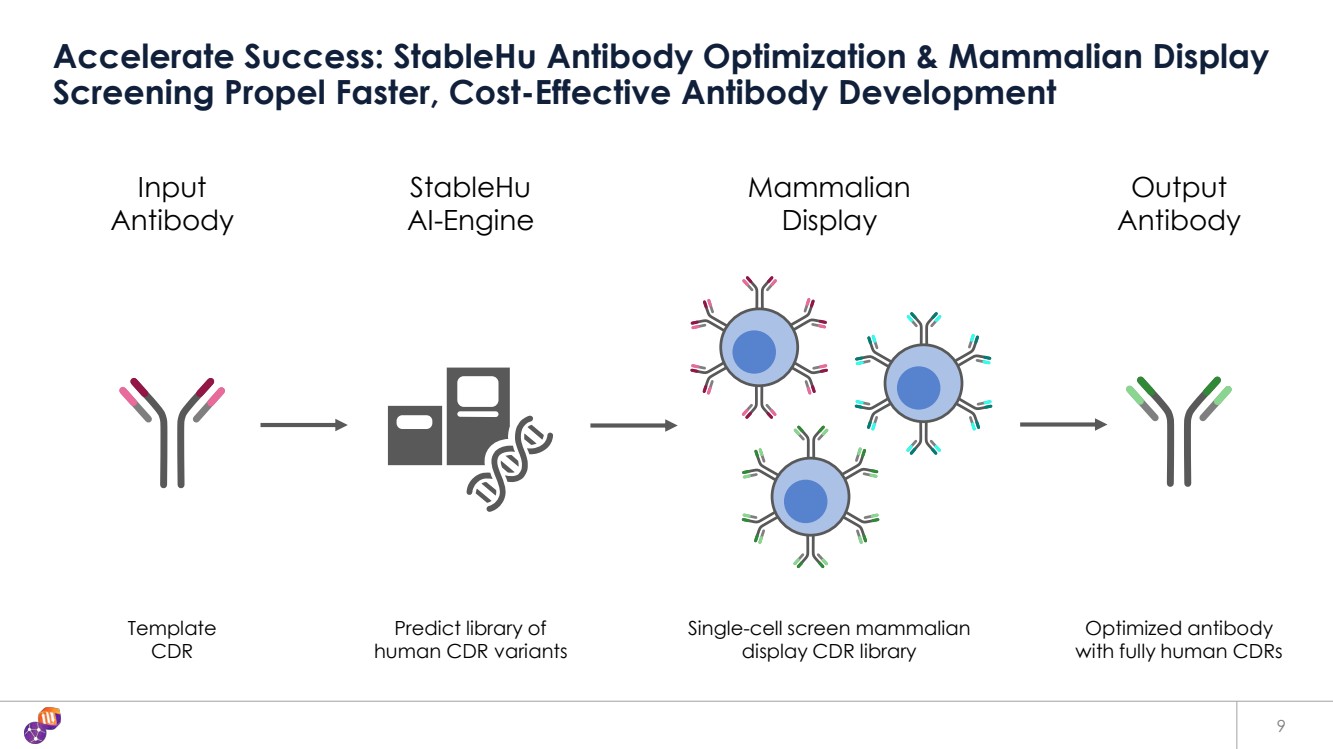
| 輸入 抗體 stableHu AI-Engine 顯示哺乳動物 輸出 抗體 模板 預測人類 CDR 變體庫 顯示單細胞篩選哺乳動物 顯示CDR庫 優化抗體 加速成功:StableHU 抗體優化和哺乳動物顯示屏 篩查推動了更快、更具成本效益的抗體開發 9 |
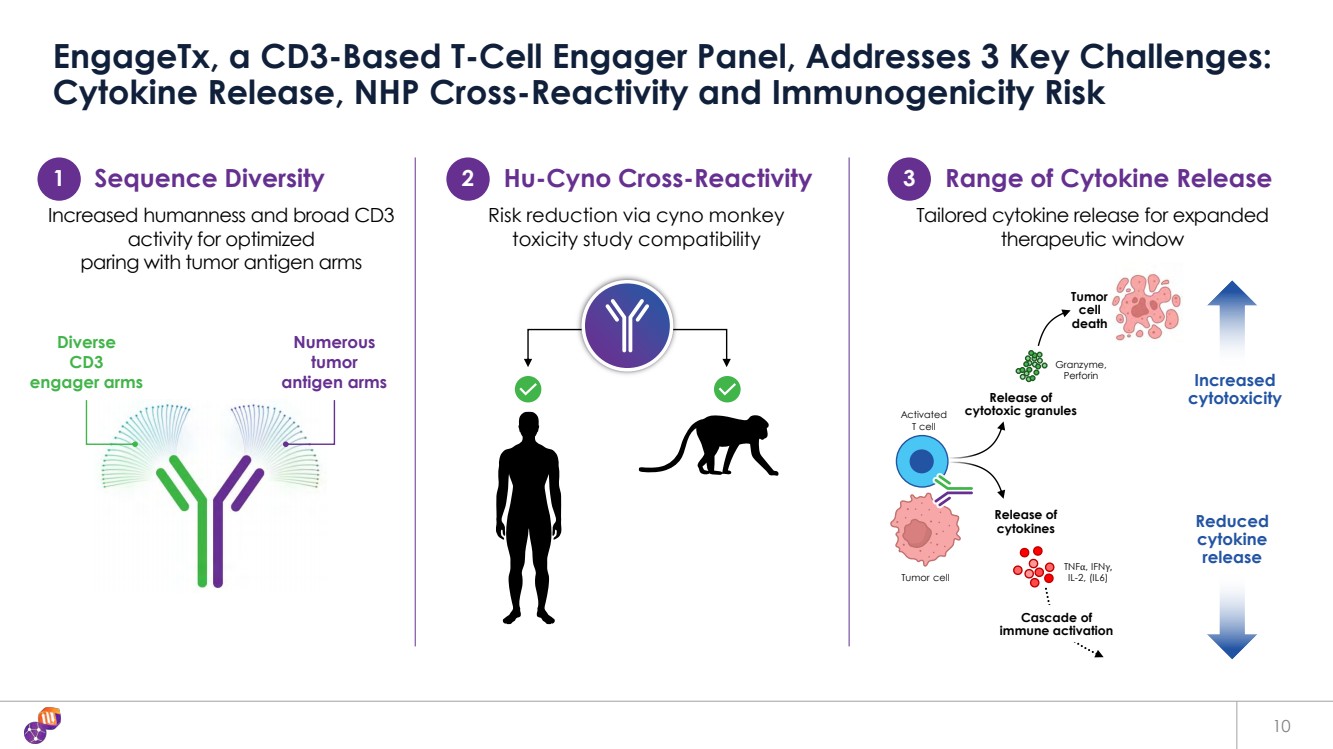
| 10 EngageTX 是基於 CD3 的 T 細胞參與者小組,解決了 3 個關鍵挑戰: 細胞因子釋放、NHP 交叉反應和免疫原性風險 眾多 腫瘤 抗原組 多樣性 1 序列多樣性 2 Hu-Cyno 交叉反應 3 細胞因子釋放範圍 人性化和 CD3 範圍廣優化 與腫瘤抗原組配對的活性 通過 cyno monkey 毒性研究兼容性降低風險 為擴大 治療窗口量身定製的細胞因子釋放 細胞因子 TNFα、IFNγ、 IL-2、(IL6) 細胞毒性增加 細胞因子 釋放減少 釋放 細胞毒性顆粒 Granzyme, 穿孔素 免疫激活級聯 腫瘤 細胞 死亡 活化 T 細胞 腫瘤細胞 腫瘤細胞 腫瘤細胞 腫瘤細胞 |
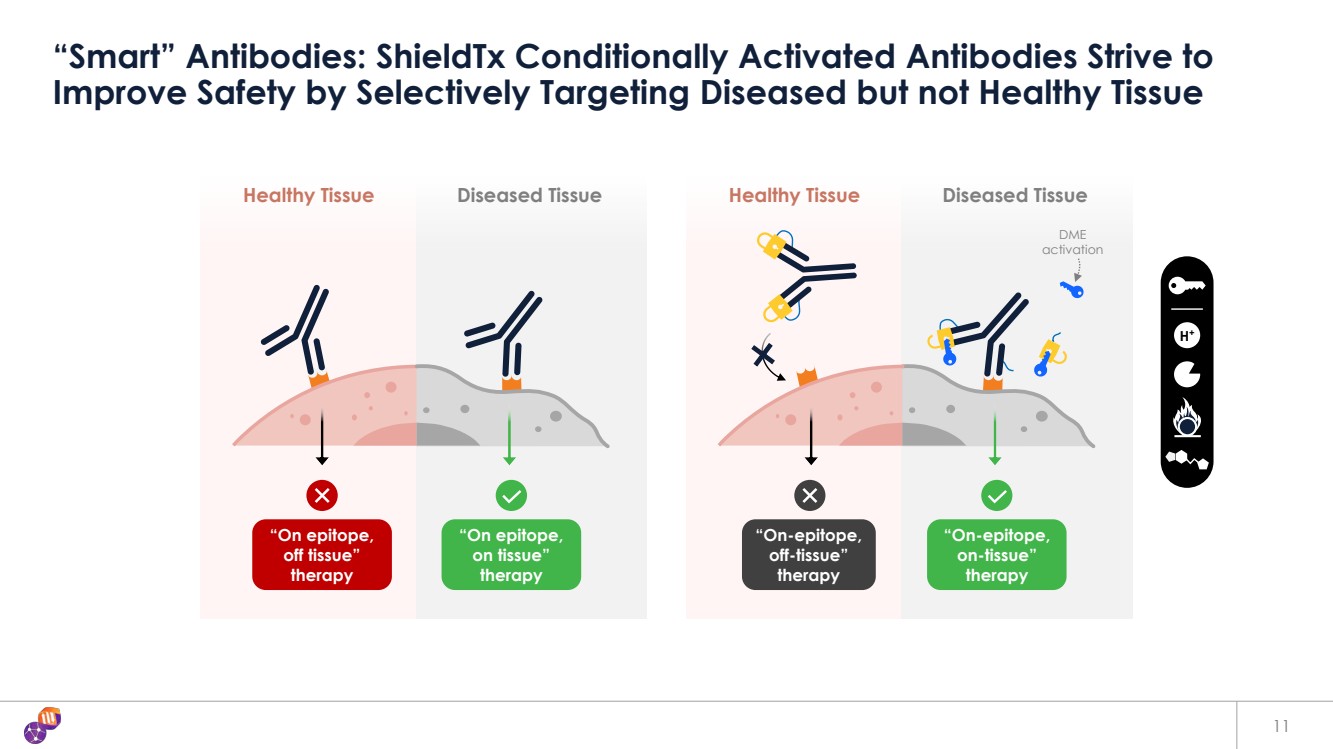
| 11 種 “智能” 抗體:ShieldTx 條件激活抗體通過選擇性地靶向患病但不健康的組織 H+ 病變組織 “表位上, 組織外” 療法 健康組織 “表位上, 組織上” 療法 DME } 激活 病變組織 “在表位上, 在組織上” 療法 健康組織 “在表位上, 脱離組織” 療法 |
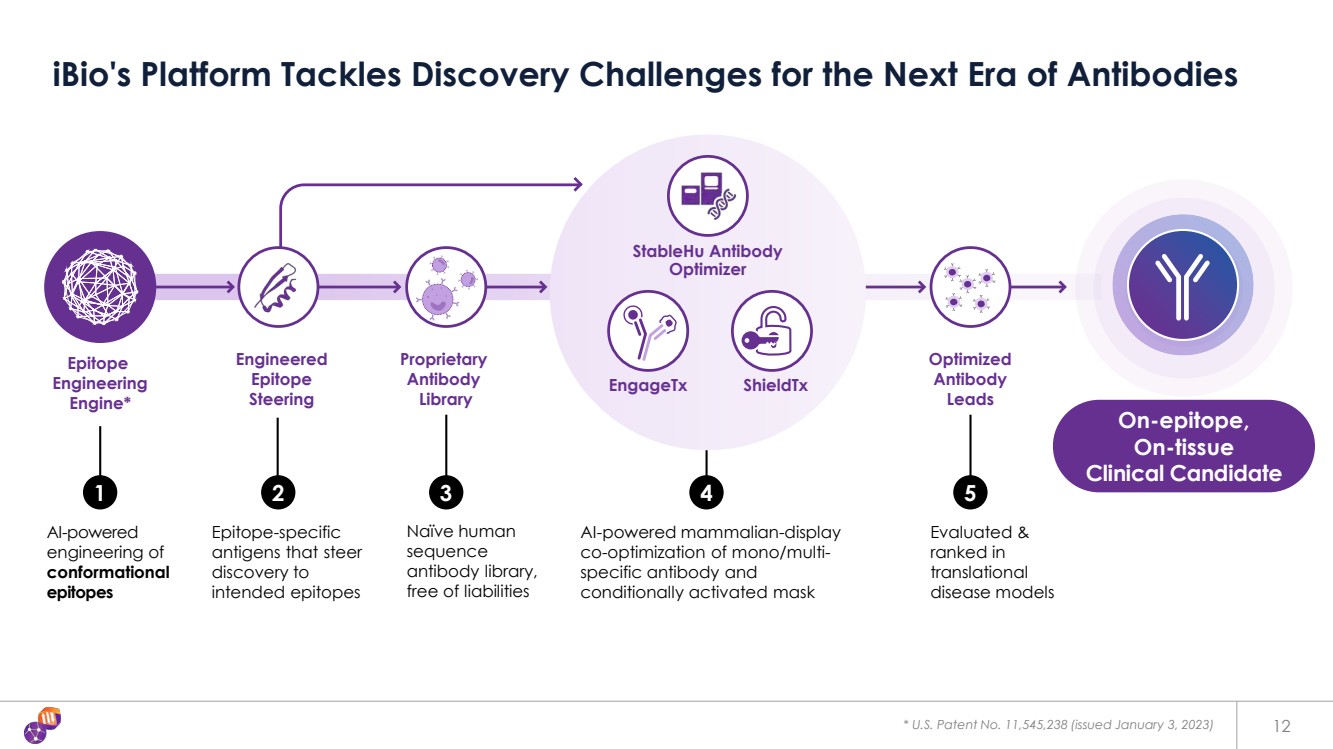
| 表位 工程 引擎* 專有 抗體 庫 人工智能驅動的哺乳動物顯示屏 對單/多特異性抗體和 條件激活面膜進行協同優化 Epitope Epitope Epitope Epitope Epitope Epitope Epitope Epitope Epitope-Ongineering Epitope Epitope Epitope {br 引導 發現到 預期表位的特異性 抗原 1 2 3 4 天真的人類 序列 抗體庫, 無責任 優化的 抗體 領先 5 評估和 在 轉化 疾病模型中排名 * 美國專利號11,545,238(2023 年 1 月 3 日發佈) iBio 的平臺應對下一個抗體時代的發現挑戰 engagetX ShieldTX StableHU 抗體 Optimizer On-epitope, 組織上 臨牀候選藥物 12 |
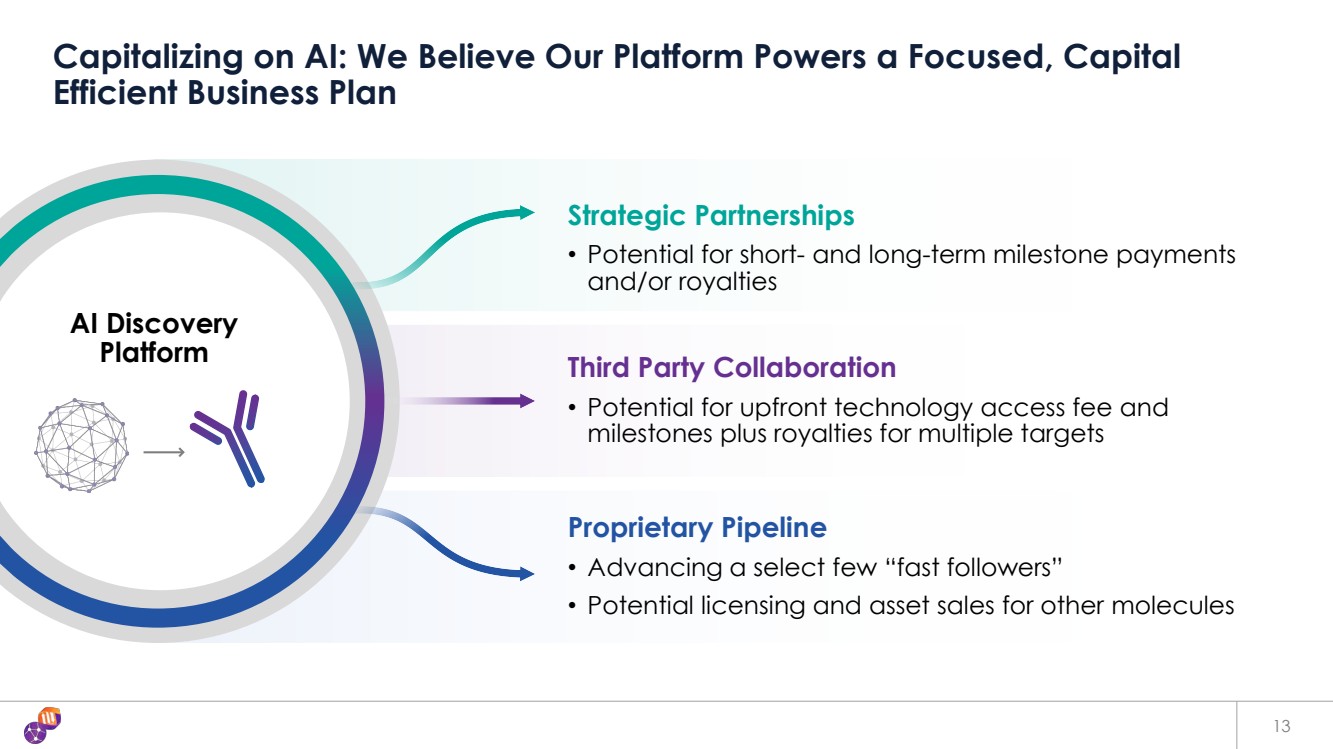
| AI Discovery 平臺 專有渠道 • 推動少數幾個 “快速追隨者” • 其他分子的潛在許可和資產出售 第三方合作 • 可能收取前期技術准入費和 里程碑加上多個目標的特許權使用費 利用人工智能:我們相信我們的平臺為專注的資本 高效商業計劃提供動力 13 戰略合作伙伴關係 • 可能獲得短期和長期里程碑付款 和/或特許權使用費 |
| 與現有分子或發現項目 合作對抗新靶標 戰略夥伴關係 14 合作伙伴和合作者相信iBio有能力解決當今藥物 發現挑戰 非核心治療領域 向第三方(疫苗等)獨家許可 第三方合作 NIH Eli Lilly 合作 合作 ... 還有更多 |
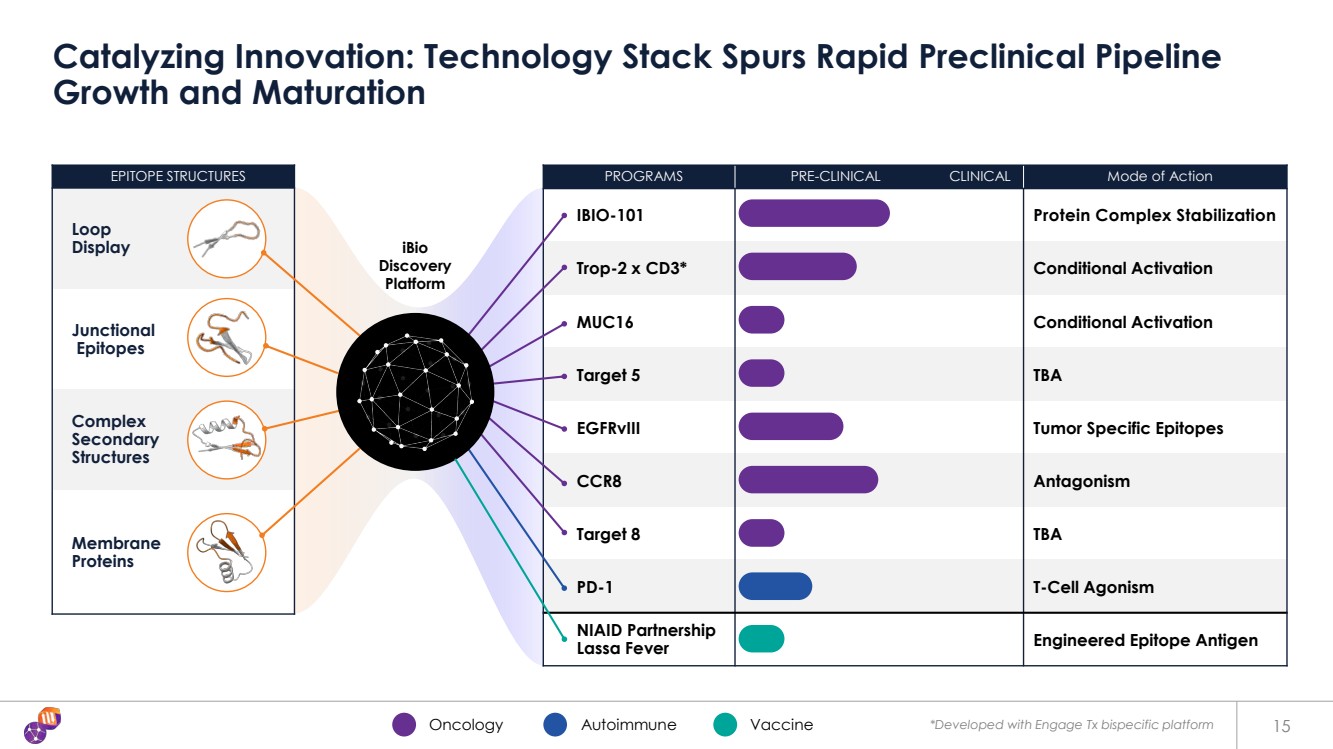
| 表位結構 Loop 顯示 連接性 表位 複合物 二級結構 膜 蛋白 項目臨牀前臨牀作用模式 IBIO-101 蛋白複合物穩定 Trop-2 x CD3* 條件激活 靶標 5 TBA egfrVIII 腫瘤特異表位 Opes CCR8 拮抗作用 Target 8 TBA PD-1 T 細胞激動劑 NIAID 夥伴關係 Lassa Fever 工程表位抗原 15 催化創新:技術堆棧刺激了快速的臨牀前產品線 的生長和成熟 * MUC16使用 Engage Tx 雙特異性平臺 iBio Discovery 平臺 腫瘤學自身免疫疫苗開發 |
| * 收購/合併 + 許可或合作 16 項經過市場考驗的潛力:競爭對手的早期交易表明 我們的產品線有望帶來機遇 2019 年前 2021 2021 CCR8 Gilead/Jounce+ : 8,500 萬美元預付款, 3,500 萬美元股權投資, 685 萬美元里程碑 2021 年 2 月 PD-1 激動劑 默沙克東/潘迪恩*: 2018 年 9 月以 18.5 億美元的價格收購羅氏/Tusk Therapeutics *: 8100 萬美元預付款, 6.77 億美元的里程碑 IBIO-101 (CD25) 2021 年 6 月和 12 月 CCR8 Fibrogen/HiFibio+ 2,500 萬美元的期權行使, 1300 萬美元的期權行使, 1300 萬美元的期權行使, 1300 萬美元的期權行使, 1300 萬美元的期權行使, 1300 萬美元的期權行使,SEP 10B 里程碑2022 egfrVIII Seagen/LAVA Therapeutics+ : 預付5000萬美元,里程碑6.5億美元 2022年8月 PD-1激動劑 Gilead/Mirobio*: 2022年5月以4.5億美元 收購 egfrVIIII Taiho/Cullinan Oncology+ : 預付2.75億美元,1.3 億美元的里程碑 2022 年 10 月 CD3 Gilead/MacroGenics+ : 預付6000萬美元,17億美元里程碑 2021 年 7 月 CD3 禮來/Merus+ 預付 4000 萬美元,2,000萬美元投資 5.4 億美元里程碑 2021 年 7 月 CD3 Amgen/Teneobio*: 900萬美元預付百萬美元, 16億美元里程碑 2023 CCR8 CHERUS/Surface Oncology*: 以 6,500 萬美元的價格收購 2023 年 6 月 2023 年 1 月CD3 GSK /WuXi Biologics+ : 預付4000萬美元, 14.6億美元里程碑 CCR8 Gilead/Jounce+ : 6700萬美元用於 CCR8 項目 2023 年 1 月 的剩餘股份 TROP-2 吉利德/Immunomedics*: 2020 年 9 月 TROP-2 阿斯利康/Daiichi+ : 預付10億美元(部分延期), 50億美元里程碑 2020 年 7 月 2023 年 4 月 egfrVIII Pierre Fabre/Scorpion+ : 預付6500萬美元, 5.53億美元里程碑 賽諾菲/Amunix* 以美元的價格收購 B,2.25 億美元的里程碑 2021 年 12 月 ShieldTX Regeneron/Cytomx+ 3000萬美元預付款,20億美元里程碑 2022年11月 |
| 17 iBio公司亮點 • 股票代碼:IBIO(紐約證券交易所-A);截至23財年6月12日已發行3,655,036股股票* • 從23財年第一季度至第四季度從CDMO撤資後,成本降低了約68% • 大部分債務由德克薩斯州布萊恩的待售房產擔保 Financial 人工智能驅動的發現 技術堆棧 • 專利表情工程技術 • StableHu 抗體優化器與哺乳動物顯示屏相結合 • EngagetX 下一代雙特異性抗體平臺 • ShieldTx 抗體屏蔽完全集成到技術堆棧中 分層 商業模式 • 戰略合作伙伴關係 • 專有渠道 • I/O 難以找到的生物製劑管道之外的特定疾病領域的獨家平臺許可 • 8 個難以藥物靶標的臨牀前項目管道 • 擁有 大量交易流的主要免疫腫瘤學 (I/O) 公司重點關注的目標 • 主要資產 IBIO-101 的早期CMC開發數據有望實現 • 包括預先資助的認股權證和假設沒有行使2023年12月發行的任何普通認股權證。 |
| 技術平臺和臨牀前管道 18 |
| 19 IBIO-101 IL-2 備用抗CD25 |
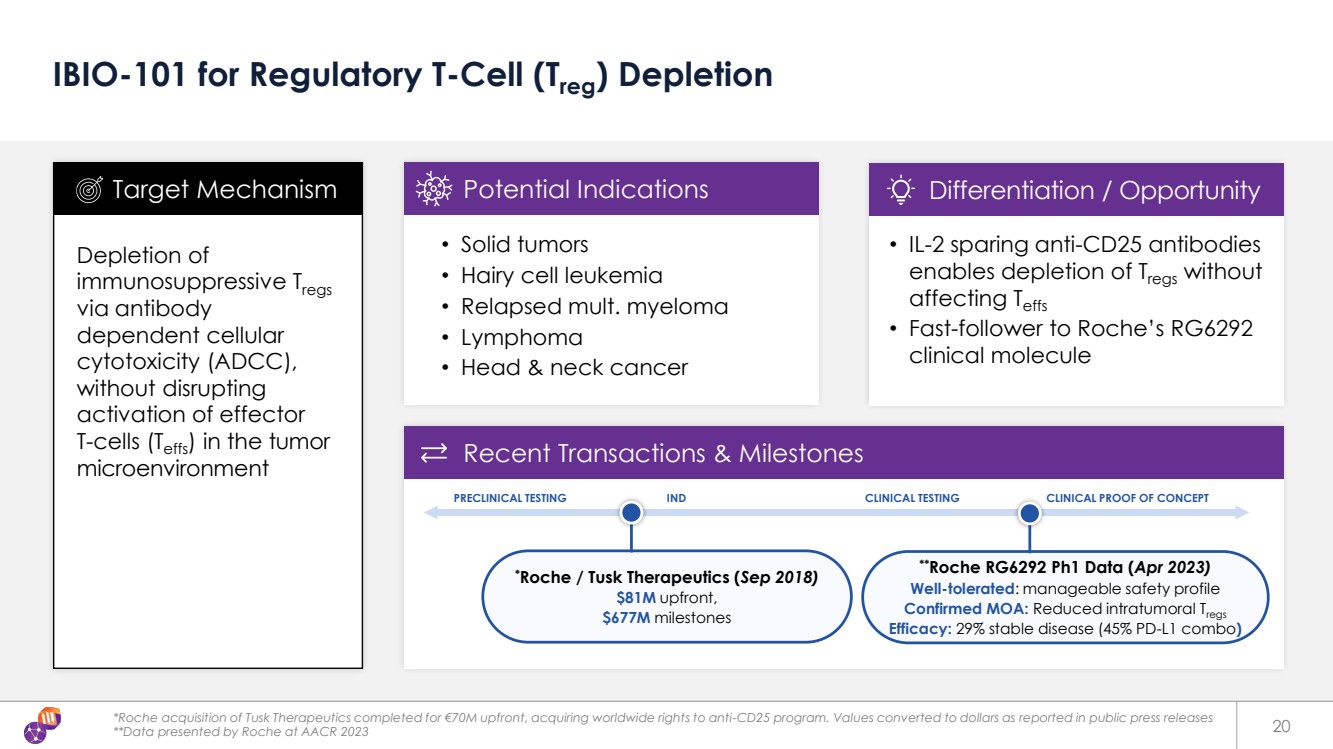
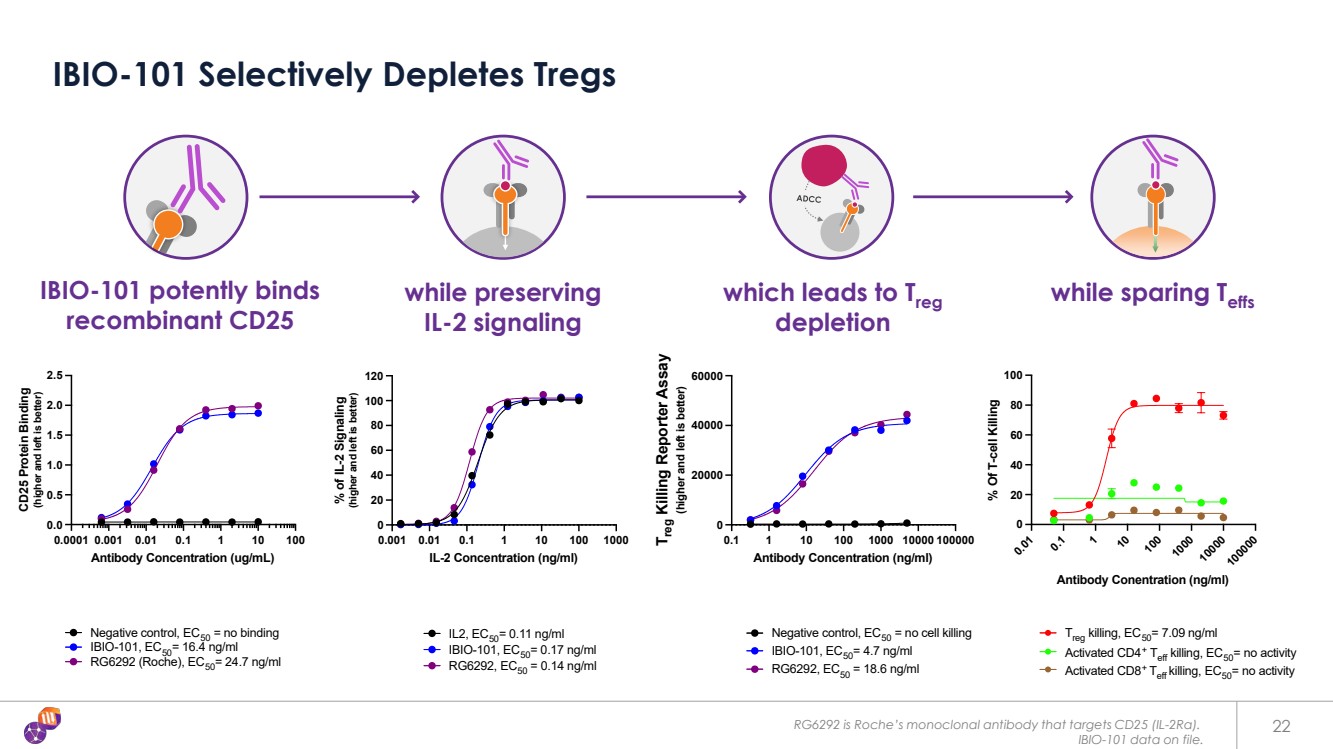
| 最近的交易和里程碑 *羅氏以7000萬歐元的預付費用完成了對Tusk Therapeutics的收購,獲得了抗CD25計劃的全球版權。根據公開新聞稿的報道,價值轉換為美元 **羅氏在 AACR 2023 20 IBIO-101 上公佈的監管性 T 細胞 (Treg) 消耗 通過抗體 依賴性細胞 細胞毒性 (ADCC) 消耗 免疫抑制性 Treg 的調節性 細胞毒性 (ADCC), 在不幹擾效應 T 細胞 (TEFFS) 激活的情況下, 腫瘤 微環境 • 實體瘤 • 毛細胞白血病 • 復發的多發性骨髓瘤 • 淋巴瘤 • 頭頸部癌 *Roche/Tusk Therapeutics(2018 年 9 月) 預付 8100 萬美元, 6.77 億美元里程碑 • IL-2 備用資金抗 CD25 抗體 可在不影響 Teff 的情況下消耗 Tregs。• 快速關注羅氏 RG6292 臨牀分子 靶向機制潛在適應症差異化/機會 臨牀前測試 IND 臨牀測試臨牀試驗概念驗證 **羅氏 RG6292 Ph1 數據(2023 年 4 月) 耐受性良好:安全性概況 已確認 MOA:減少腫瘤內口服 Trege s 功效:29% 病情穩定(45% PD-L1 組合) |
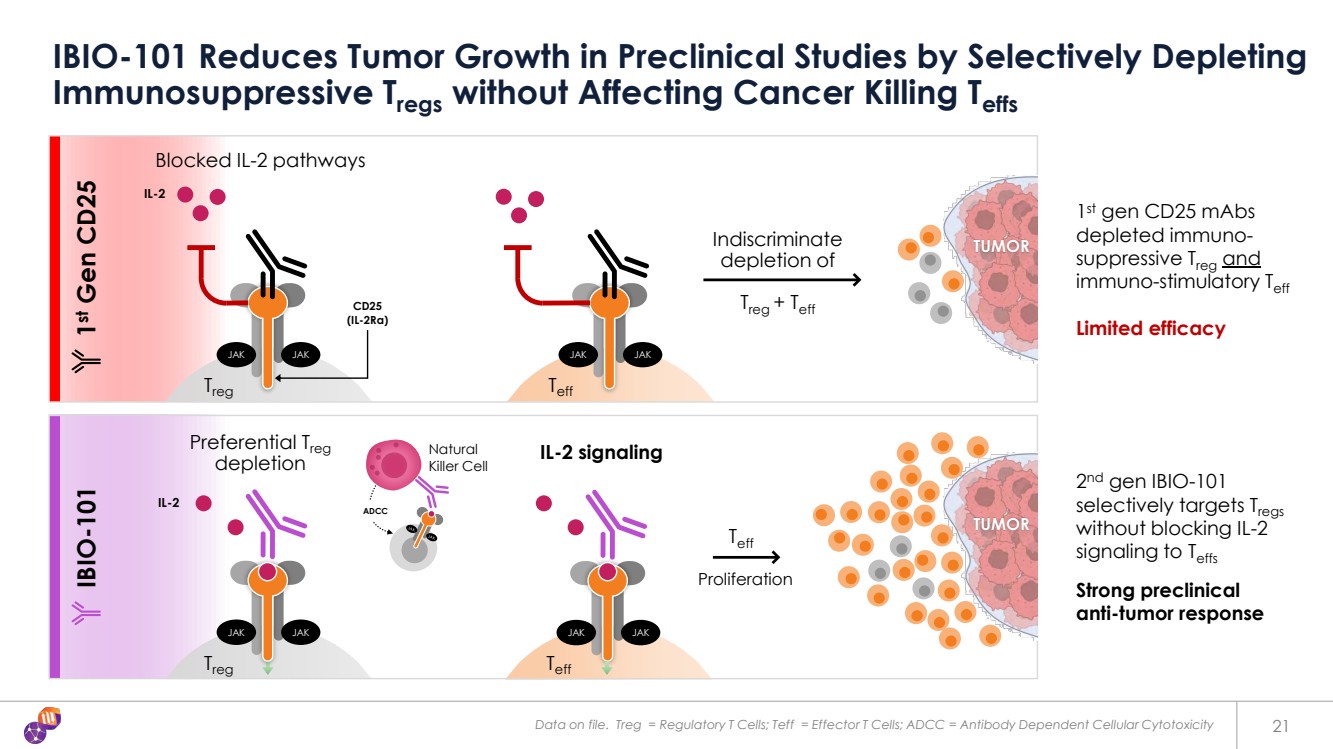
| 存檔的數據。Treg = 調節性 T 細胞;Teff = 效應 T 細胞;ADCC = 抗體依賴性細胞毒性 21 IBIO-101 在臨牀前研究中通過選擇性消耗 免疫抑制 Treg 來減少腫瘤的生長,而不會影響癌症的殺傷 Teff 不分青紅皂白 不分青紅皂白 不分青紅皂白 不分青紅皂白 消耗 Teff 第一代 CD25 mAbs 免疫抑制性 Treg 和 免疫刺激 Teff 療效有限 第二代 IBIO-101 可選擇性靶向 Tregs 而不會阻斷向 Teff 的 IL-2 信號 臨牀前強烈的 抗腫瘤反應 IBIO 增殖 -101 天然 殺傷細胞 優先 Treg 耗盡 ADCC 第一代 CD25 腫瘤 IL-2 CD25 (IL-2rα) JAK JAK Treg JAK JAK Treg JAK JAK Treg JAK JAK Treg JAK JAK Teff IL-2 信號 阻塞 IL-2 通路 IL-2 |
| RG6292 是羅氏針對 CD25 (IL-2Rα) 的單克隆抗體。 IBIO-101 數據存檔。 22 IBIO-101 選擇性地消耗 Treg 同時保留 IL-2 信號 IBIO-101 能有效結合 重組 CD25,導致 Treg 消耗 0.0001 0.001 0.01 1 100 0.0 0.5 1.0 2.0 2.5 抗體濃度 (ug/mL) CD25 蛋白結合 (向上向左越好) 陰性對照,EC50 = 無結合 IBIO-101,EC50= 16.4 ng/ml RG6292(羅氏),EC50= 24.7 ng/ml 0.1 1 10 100 1000 10000 10000 10000 0 20000 20000 20000 40000 抗體濃度(ng/ml) (向上和向左)更好) 陰性對照,EC50 = 無細胞殺死 IBIO-101,EC50= 4.7 ng/ml RG6292,EC50 = 18.6 ng/ml 0.001 0.01 0.1 1 1 10 100 1000 20 40 60 80 100 120 IL-2 濃度 (ng/ml) % 的 IL-2 信號 (越高越好) IL2,EC50= 0.11 ng/ml IBIO-101,EC50= 0.17 ng/ml RG6292,EC50 = 0.14 ng/ml 0.0001 0.001 0.1 1 10 100 0.0 0.0 0.0 0.5 1.0 1.5 2.5 抗體濃度 (ug/mL) (越高越好) 陰性對照,EC50 = 無結合 ,IBIO-101 EC50= 16.0 4 納克/毫升 RG6292(羅氏),EC50=24.7 ng/ml 0.001 0.1 1 10 100 1000 0 20 40 60 80 100 120 IL-2 濃度 (ng/ml) % IL-2 信號 (越高越好) IL2,EC50= 0.11 ng/ml IBIO-101,EC50= 0.17 ng/ml RG6292,EC50 = 0.14 ng/ml 1 10 100 1000 10000 10000 10000 0 20000 40000 60000 抗體濃度 (ng/ml) Treg Killing Reporter 試驗 (越高越好) 陰性對照,EC50 = 無細胞殺傷 IBIO-101,EC50= 4.7 ng/ml 0.01 1 1 10 1000 10000 10000 0 20 40 60 80 100 抗體濃度 (ng/ml) % RG6292在殺死 T 細胞 Treg 中,EC50= 7.09 ng/ml 活化 CD4+ Teff 殺死,EC50= 無活性 激活 CD8+ Teff 殺死,EC50= 無活性 0.01 1 1 10 100 1000 1000 1000 10 000 20 40 60 80 100 抗體濃度 (ng/ml) % T細胞殺死 Tref 擊殺,EC50= 7.09 ng/ml 激活 CD4+ Teff 擊殺,EC50= 無活性 激活 CD8+ Teff 殺死,EC50= 無活性 |
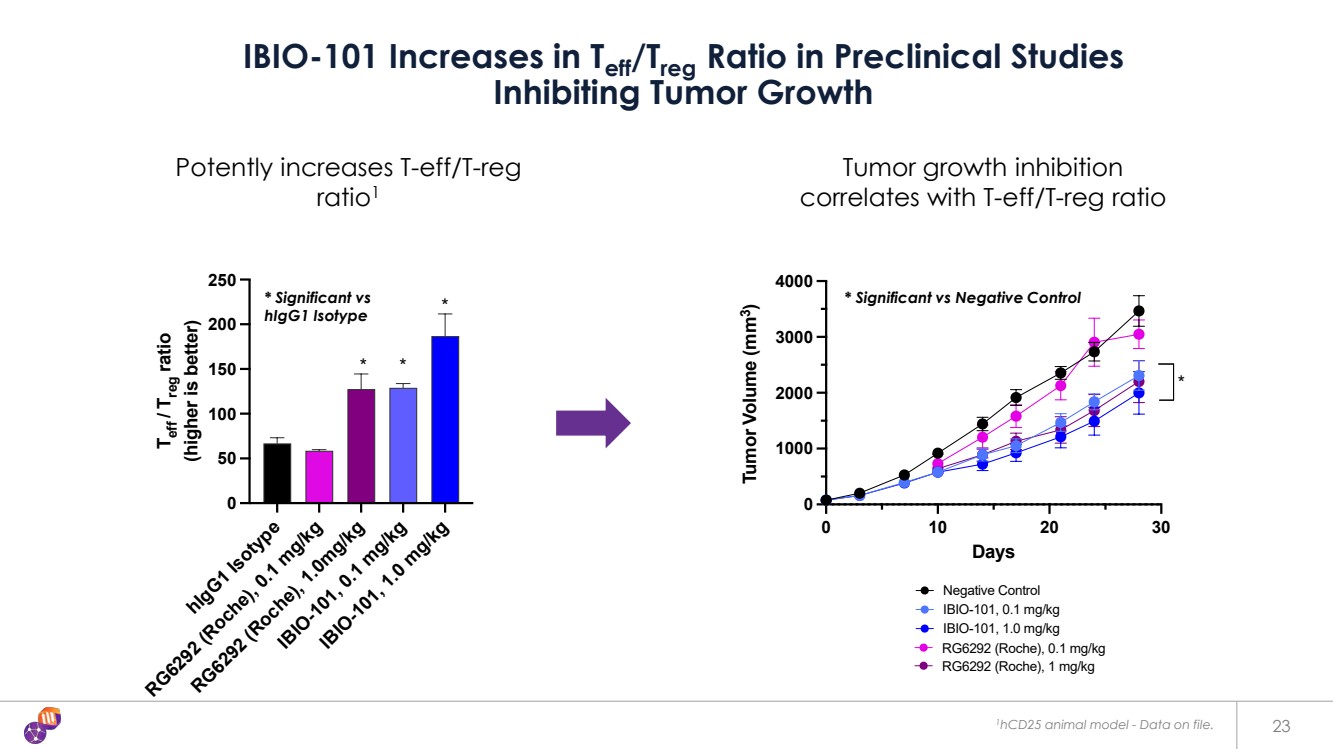
| 23 IBIO-101 臨牀前研究中 Teff/Treg 比率的增加 抑制腫瘤生長 腫瘤生長抑制 與 t-eff/t-reg 比值相關 有效增加 t-eff/t-reg ratio1 0 10 20 30 0 000 2000 3000 3000 4000 天 腫瘤體積 (mm3) 陰性對照 IBIO-101,0.1 mg/kg IBIO-101,1.0 mg/kg RG6292(羅氏),0.1 mg/kg RG6292(羅氏),1 mg/kg * 0 10 20 30 0 1000 3000 3000 3000 4000 天 陰性對照 IBIO-101,0.1 mg/kg IBIO-101,1.0 mg/kg RG6292(羅氏),0.1 mg/kg RG6292 mg/kg(羅氏),1 mg/kg mg/kg,1 mg/kg mg/kg mg/kg mg/kg /kg * HigG1 同型 RG6292(羅氏),0.1 mg/kg RG6292(羅氏),1.0mg/kg IBIO-101,0.1 mg/kg IBIO-101,1.0 mg/kg 0 50 100 150 200 250 250 Teff/Treg 比率 (越高越好) * * 1HCD25 動物模型-相關數據文件。 * 顯著 vs * 顯著對照與陰性對照 HigG1 同型對照 |
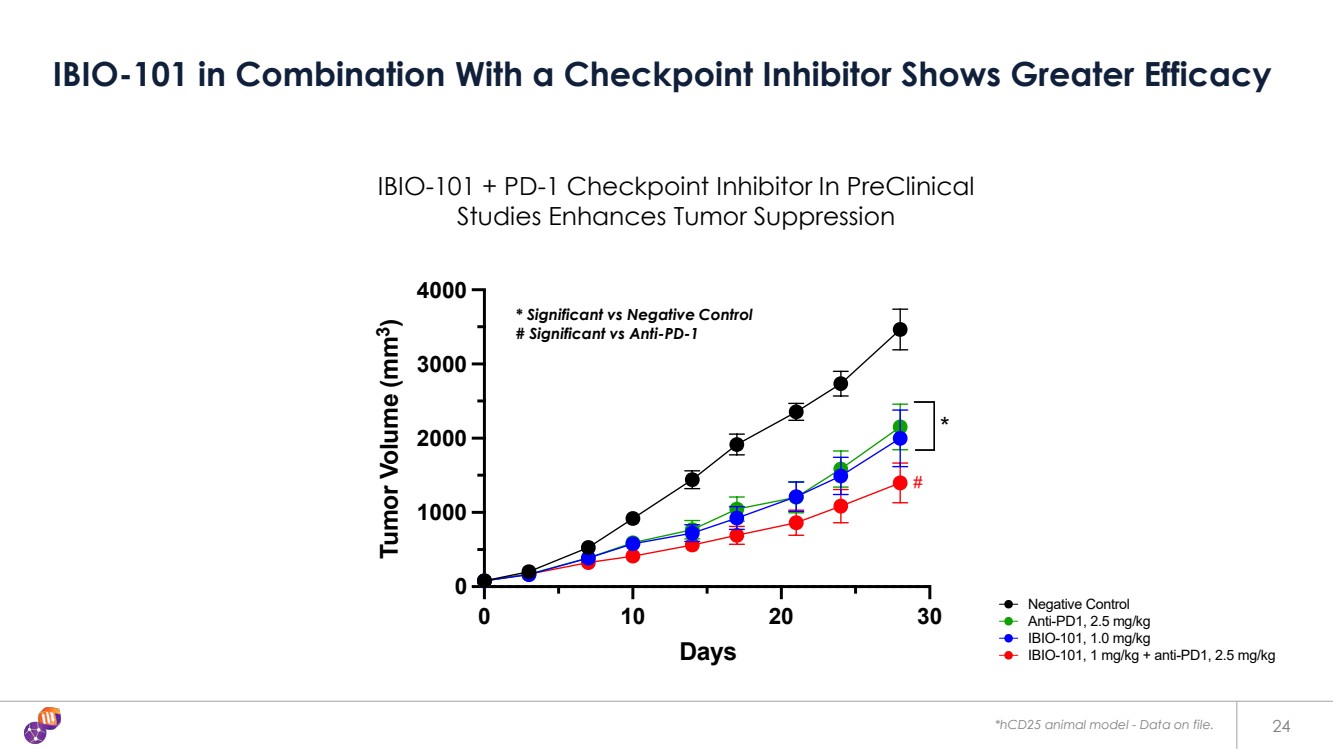
| 24 IBIO-101 與檢查點抑制劑聯合使用顯示出更高的療效 0 10 20 30 0 1000 2000 3000 4000 天 腫瘤體積 (mm3) 陰性對照 * 抗 PD1,2.5 mg/kg IBIO-101,1 mg/kg + 抗 PD1,2.5 mg/kg IBIO-101,1.0 mg/kg 0 10 20 30 0 1000 2000 3000 4000 天 腫瘤體積 (mm3) 陰性對照 * 抗 PD1,2.5 mg/kg IBIO-101,1 mg/kg + 抗 PD1,2.5 mg/kg IBIO-101,1.0 mg/kg IBIO-101 + PD-1 檢查點抑制劑增強腫瘤抑制 *HCD25 動物模型-相關數據文件。 * 顯著對照與陰性對照 # 顯著對比 PD-1 |
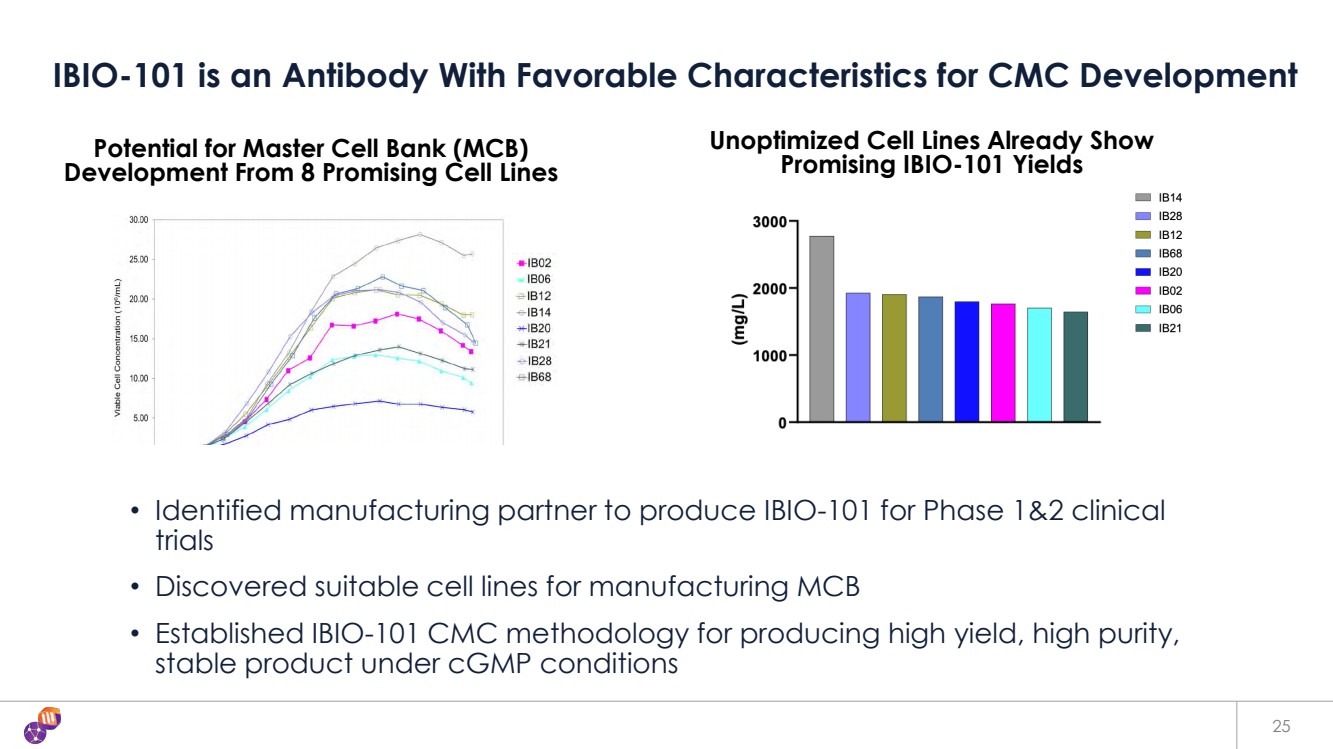
| 25 IBIO-101 是一種具有良好特性的抗體,適合 CMC 開發 • 已確定為一期和二期臨牀 試驗生產 IBIO-101 的生產合作夥伴 • 發現了適合製造 MCB 的細胞系 • 已建立 IBIO-101 CMC 方法,用於在 cGMP 條件下生產高產量、高純度 穩定的產品 從 8 種有前景的細胞系中開發主細胞庫 (MCB) 的潛力 未經優化的細胞系已經顯示出 有希望的 IBIO-101 產量 |
| 26 抗CCR8 高 ADCC 抗 CCR8 用於消耗 T 調節細胞 |
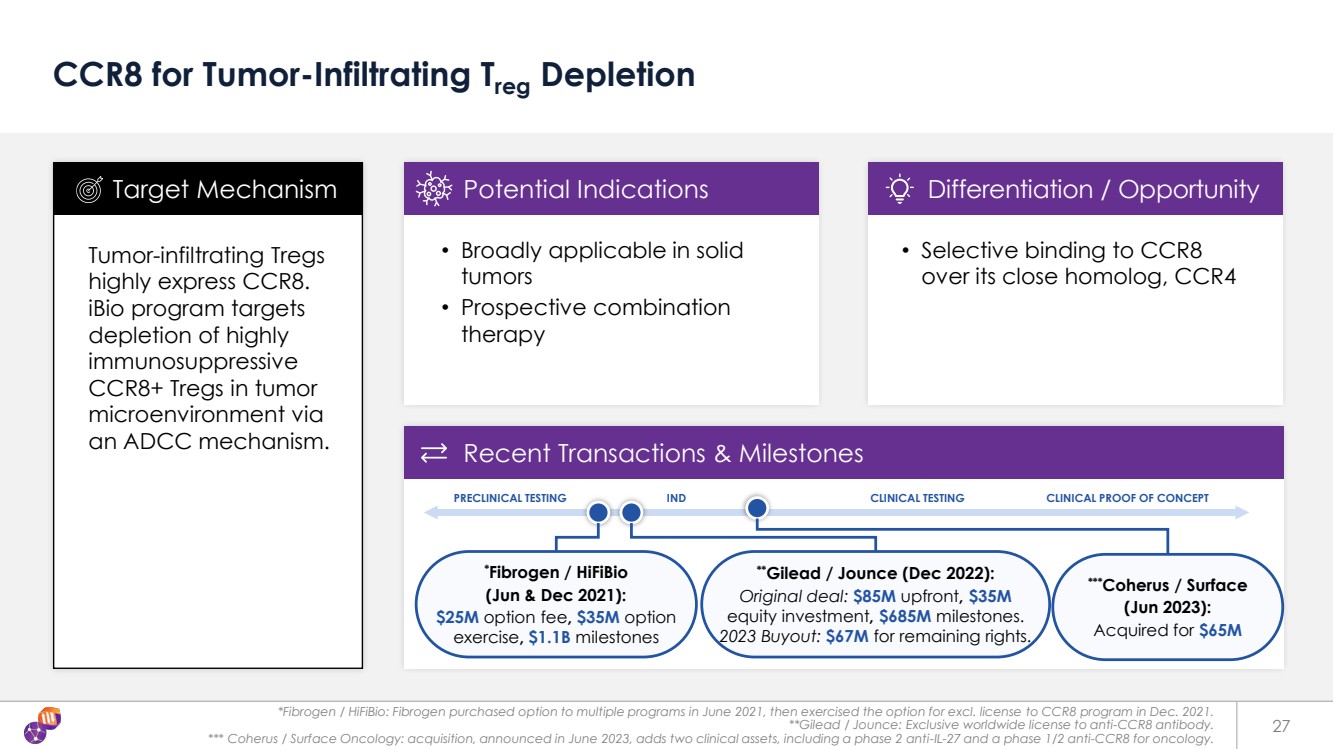
| *Fibrogen/HiFiBio:Fibrogen於2021年6月購買了多個項目的期權,然後在2021年12月行使了CCR8項目不包括許可的期權。 **吉利德/Jounce:抗 CCR8 抗體的全球獨家許可。 *** Coherus/Surface Oncology:2023 年 6 月宣佈的收購增加了兩項臨牀資產,包括用於腫瘤學的 2 期抗IL-27和1/2期抗CCR8。 27 CCR8 用於腫瘤浸潤 Treg 消耗 腫瘤浸潤 Treg 高度表達 CCR8。 iBio 計劃的目標是通過 一種 ADCC 機制消耗腫瘤 微環境中高度 免疫抑制性 CCR8+ Tregs。 • 廣泛適用於實體瘤 • 前瞻性組合 療法 靶向機制潛在適應症差異化/機會 最近的交易和里程碑 • 選擇性結合 CCR8 的近似同系物 CCR4 **Gilead/Jounce(2022年12月): 原始交易:預付8500萬美元,3500萬美元 股權投資,6.85 億美元里程碑。 2023 年收購:6700 萬美元用於剩餘版權。 *Fibrogen/HiFiBio (2021 年 6 月和 12 月): 2,500 萬美元的期權費、3,500 萬美元的期權 行使、11 億美元的里程碑 臨牀前測試 IND 臨牀測試臨牀試驗臨牀概念驗證 ***Coherus/Surface (2023 年 6 月): 以 6500 萬美元收購 |
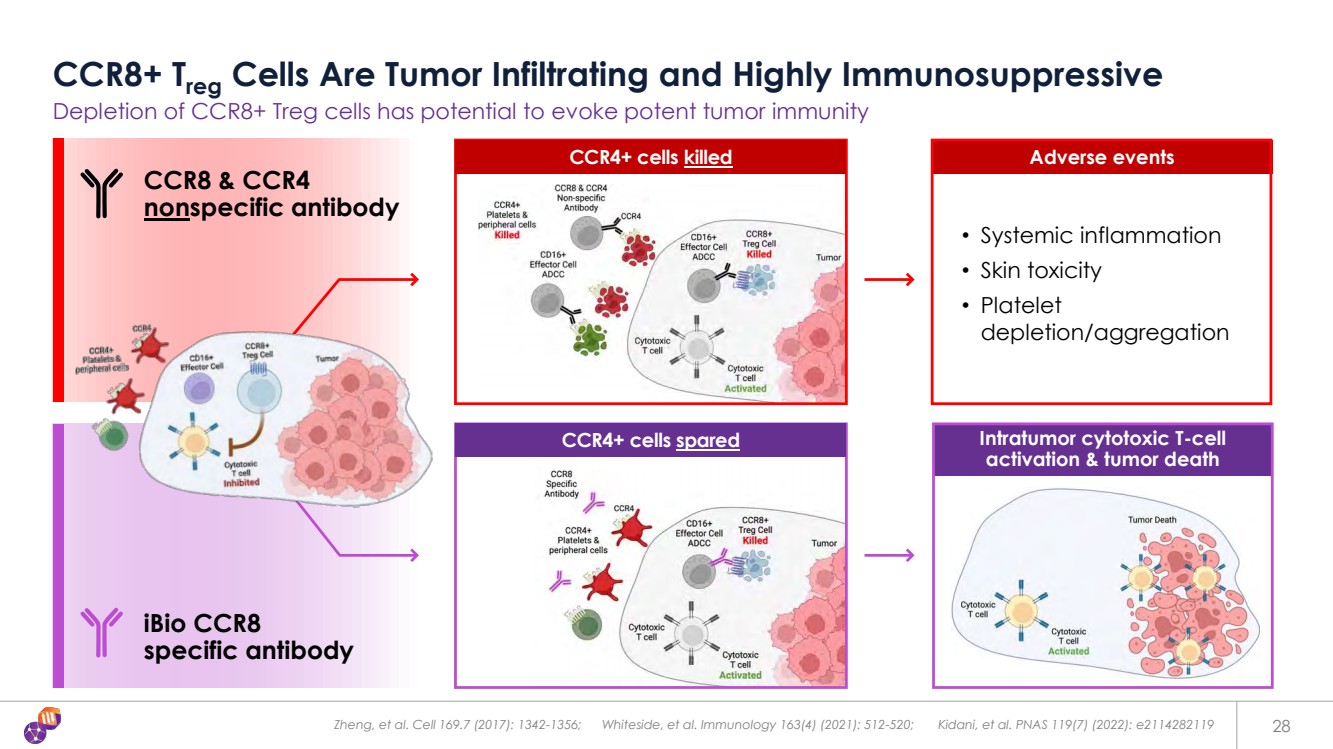
| Zheng 等Cell 169.7(2017):1342-1356;Whiteside等人免疫學 163 (4) (2021):512-520;Kidani 等。PNAS 119 (7) (2022):e2114282119 28 CCR8+ Treg 細胞具有腫瘤浸潤和高度免疫抑制性 CCR8+ Treg 細胞的耗盡有可能激發強大的腫瘤免疫力 • 全身性炎症 • 皮膚毒性 • 血小板 消耗/聚集 腫瘤內細胞毒性 T 細胞 } 激活和腫瘤死亡 不良事件 iBio CCR8 特異性抗體 CCR8 和 CCR4 非特異性抗體 CCR4+ 細胞被殺死 CCR4+ 細胞倖免 |
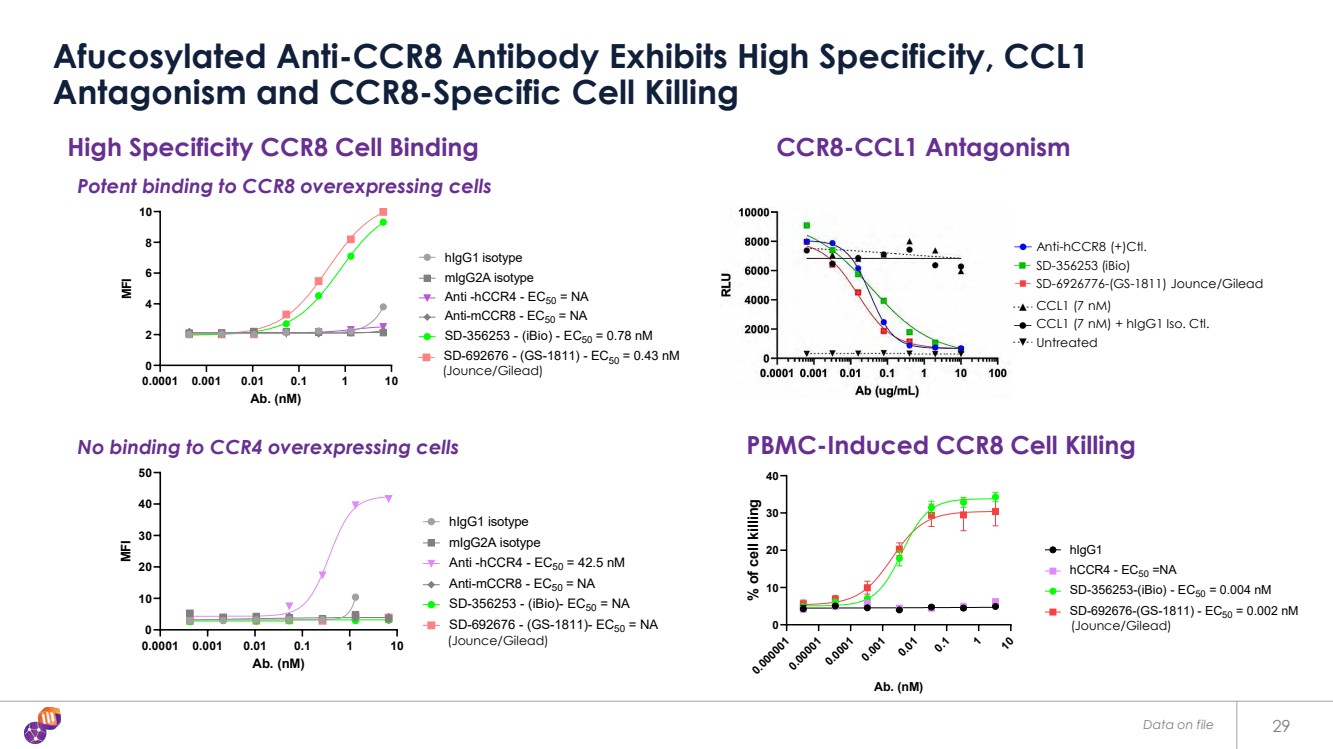
| 檔案中的數據 29 核糖化抗 CCR8 抗體表現出高特異性、CCL1 拮抗作用和 CCR8 特異性細胞殺傷 高特異性 CCR8 細胞結合 0.0001 0.001 0.01 1 1 10 0 0 2 4 6 8 10 HCCR8 過度表達細胞 Ab。(nM) MFI HigG1 同種型 migg2A 同種型抗-HCCR4-EC50 = NA 抗 mcCR8-EC50 = NA SD-356253-(iBio)-EC50 = 0.78 nM SD-692676-(GS-1811)-EC50 = 0.43 nM 0.0001 0.001 0.01 1 1 10 10 20 30 40 50 hccr4 受壓細胞 Ab.(nM) MFI HigG1 同種型 migg2A 同種型抗-HCCR4-EC50 = 42.5 nM 抗 mcCR8-EC50 = NA SD-356253-(iBio)-EC50 = NA SD-692676-(GS-1811)-EC50 = NA 0.000001 0.0010.00010.0010.0010.0010.01 0.1 1 10 10 20 30 40 CCR8 過度表達細胞 Ab。(nM) 細胞殺傷百分比 HigG1 HCCR4-EC50 =NA SD-356253-(iBio)-EC50 = 0.004 nM SD-692676-(GS-1811)-EC50 = 0.002 nM pbmc 誘導的 CCR8 細胞殺傷 與 CCR8 過度表達細胞的強效結合 不結合 CCR4 過度表達細胞 (Jounce/Giles)) (Jounce/Gilead) (Jounce/Gilead) 未經處理 CCL1 (7 nM) CCL1 (7 nM) CCL1 (7 nM) + HigG1 Iso。Ctl。 抗 HCCR8 (+) Ctl。 SD-6926776-(GS-1811) Jounce/Gilead SD-356253 (iBio) CCR8-CCL1 對抗 |
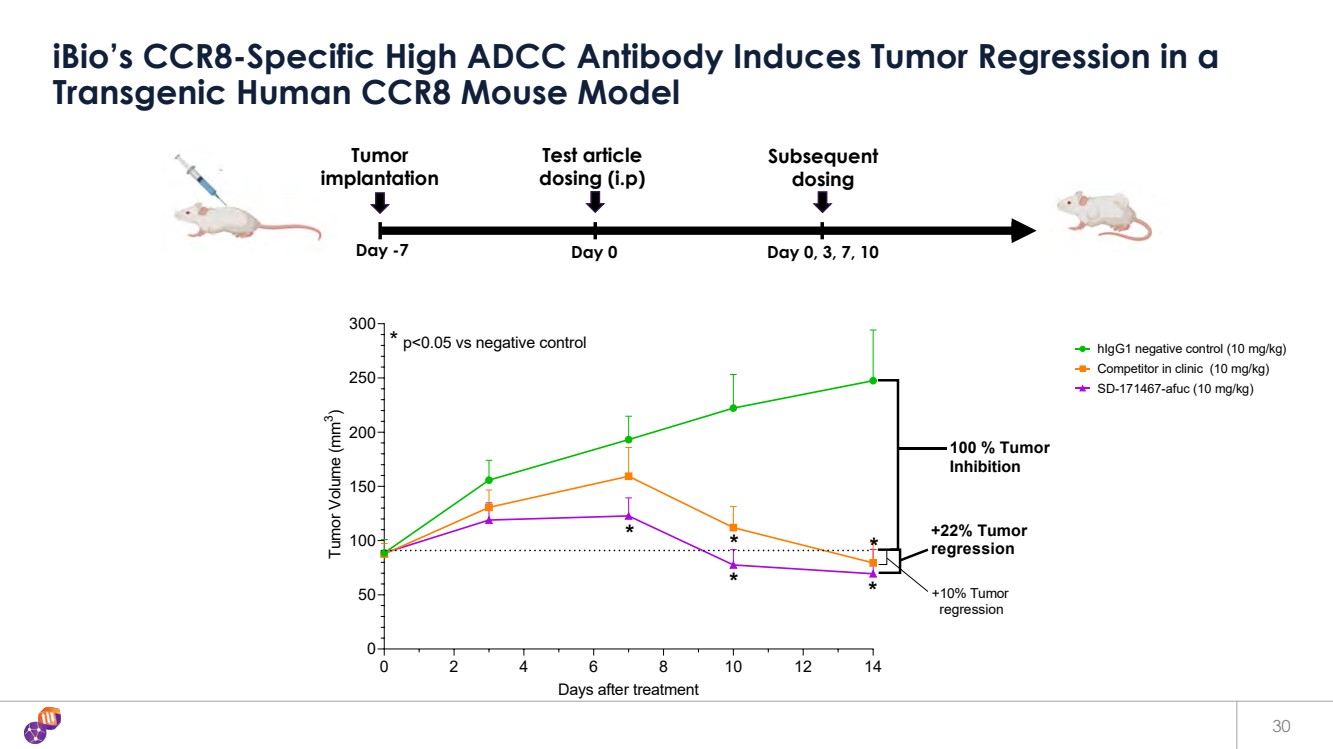
| 30 iBio 的 CCR8 特異性高 ADCC 抗體在 轉基因人類 CCR8 小鼠模型中誘導腫瘤消退 第 -7 天 0 天 0 天 0、3、7、10 天腫瘤 後續給藥 測試文章 劑量 (i.p) 0 2 4 6 8 10 12 14 0 50 100 150 200 250 300 天后治療腫瘤體積 (mm 3) HigG1 陰性對照(10 mg/kg)臨牀競爭對手(10 mg/kg)SD-171467-AFUC(10 mg/kg) * * * p |
| 31 使用 engageTX 釋放雙特異性抗體的力量 ,我們的多功能 CD3 單抗試劑盒 具有廣泛的親和力、NHP 交叉反應性、 高可開發性 |
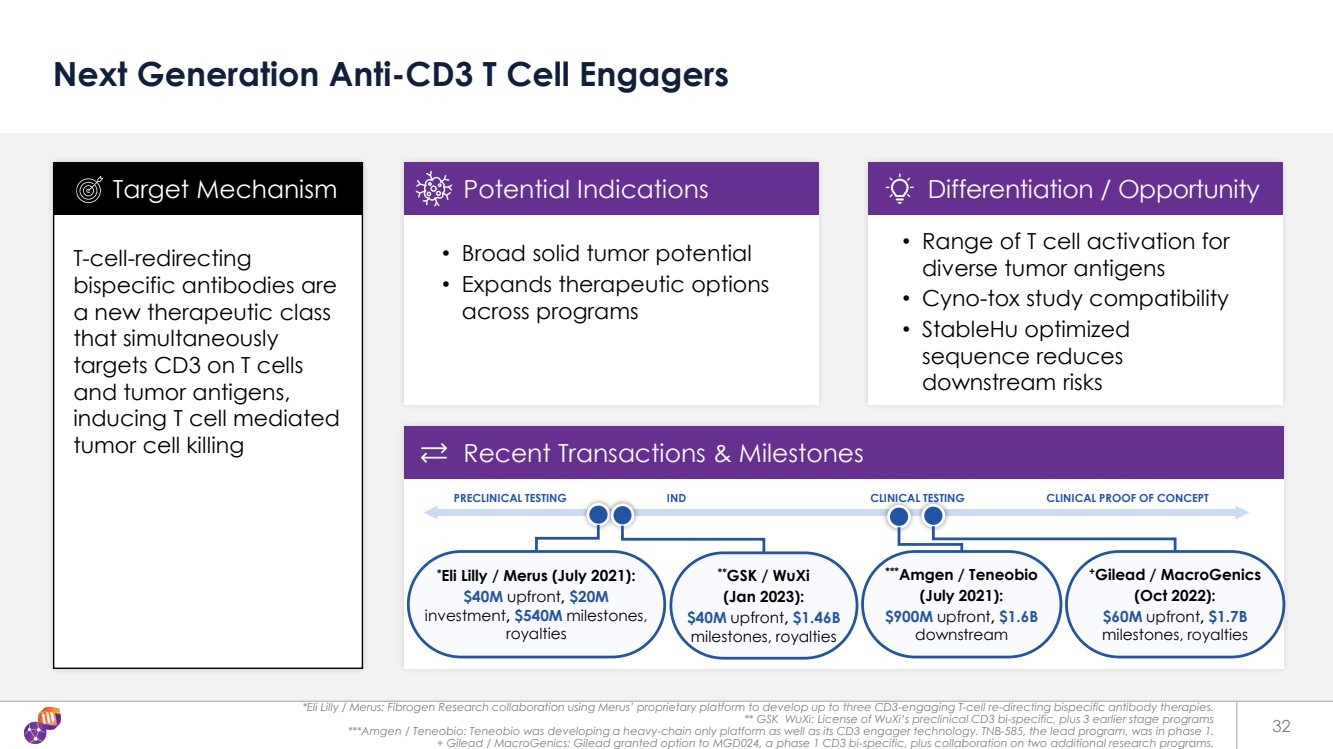
| *禮來/梅魯斯:Fibrogen Research合作使用梅魯斯的專有平臺開發了多達三種與CD3相關的T細胞重定向雙特異性抗體療法。 ** 無錫葛蘭素史克:無錫臨牀前CD3雙特異性項目以及3個早期項目的許可 ***Amgen/Teneobio:Teneobio正在開發一個僅限重鏈的平臺及其CD3參與者技術。主導項目 TNB-585 處於第 1 階段。 + 吉利德/MacroGenics:吉利德授予了 MGD024(第一階段 CD3 雙特異性)的選擇權,以及在另外兩個研究項目上的合作。 32 下一代抗 CD3 T 細胞參與者 T 細胞重定向 雙特異性抗體是 一種新的治療類別 ,它可同時靶向 T 細胞 和腫瘤抗原上的 CD3, 誘導 T 細胞介導的 腫瘤細胞殺死 • 擴大各項目的治療選擇 br} 靶向機制潛在適應症分化/機會 最近的交易和里程碑 • 多種腫瘤抗原的 T 細胞激活範圍 • Cyno-Tox 研究兼容性 • StableHU 優化 序列降低了 下游風險 *禮來公司/梅魯斯(2021 年 7 月): 預付 4000 萬美元,2,000 萬美元 投資,5.4 億美元的里程碑, 特許權使用費 臨牀試驗臨牀測試臨牀試驗概念驗證 ***Amgen/Teneobio (2021 年 7 月): 預付 9 億美元,16億美元 下游 +Gilead /MacroGenics (2022年10月): 預付6000萬美元,17億美元 里程碑,特許權使用費 **葛蘭素史克/無錫 (2023 年 1 月): 預付款 4,000 萬美元,14.6億美元 里程碑,特許權使用費 |
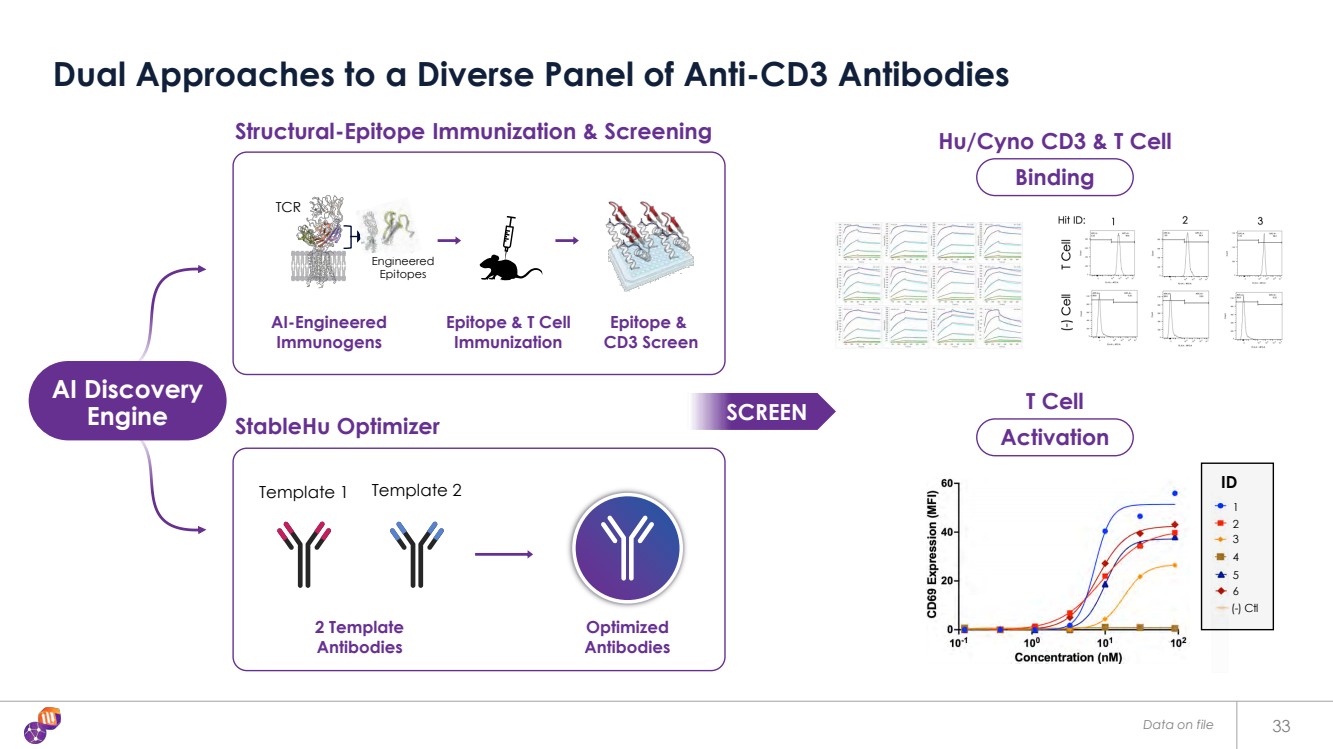
| 檔案中的數據 33 種抗體多樣化組合的雙重方法 Hu/Cyno CD3 和 T 細胞 TCR CD3 工程 CD3 表位 T 細胞 模板 1 模板 2 結構表位免疫和篩查 StableHU Optimizer AI Discovery 引擎 人工智能工程的 免疫原 } 表位和 T 細胞 免疫 表位和 CD3 篩查 2 模板 抗體 優化 抗體 優化 SCREEN 激活 結合 結合 1 2 3 4 5 6 (-) Ctl ID |
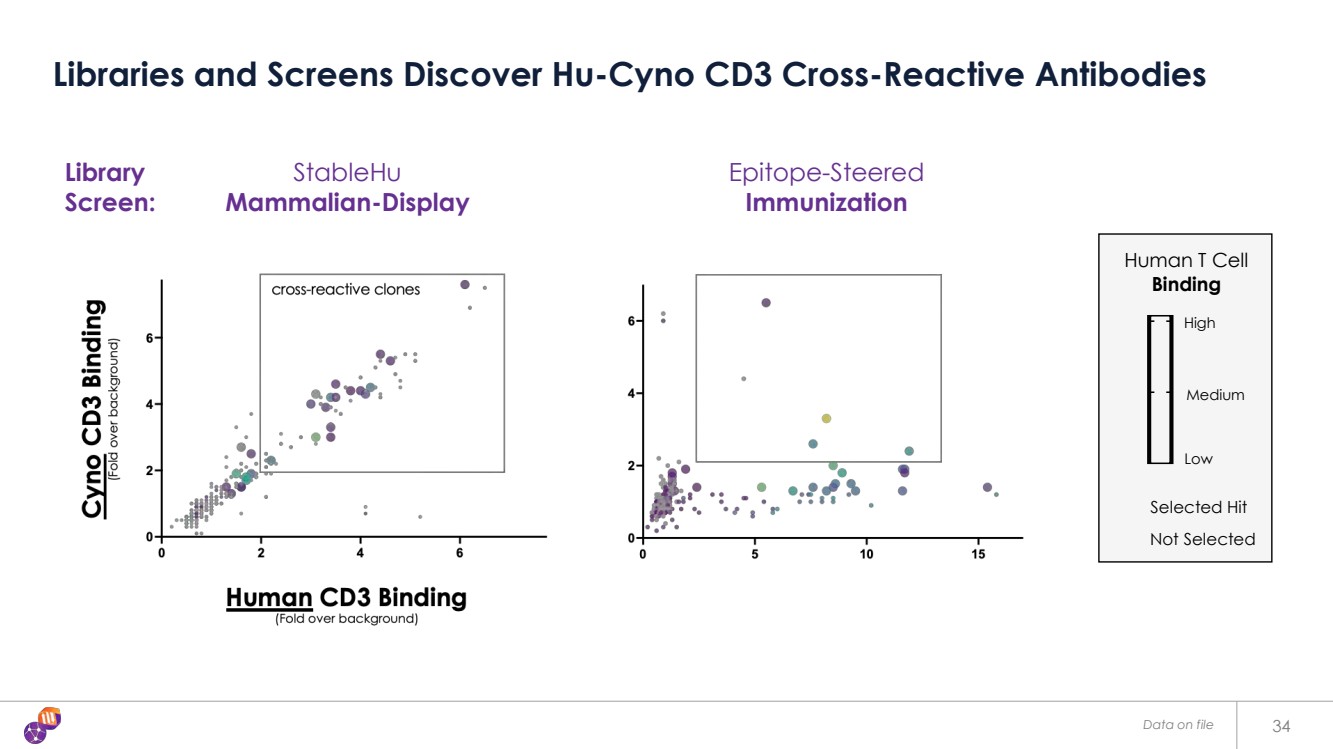
| 檔案中的數據 34 個庫和屏幕發現 Hu-Cyno CD3 交叉反應抗體 表位引導 免疫 0 5 10 15 0 2 4 6 人類 CD3 ELISA foldChange /背景 Cyno CD3 ELISA foldChange foldChange /背景 foldChange/背景 免疫庫 1 100 200 人類 T 細胞結合摺疊 變化/背景 HIT 0 人類 T 細胞 結合 精選命中 低 中等 高 高 StableHu 哺乳動物顯示屏 未選擇 庫 屏幕: |
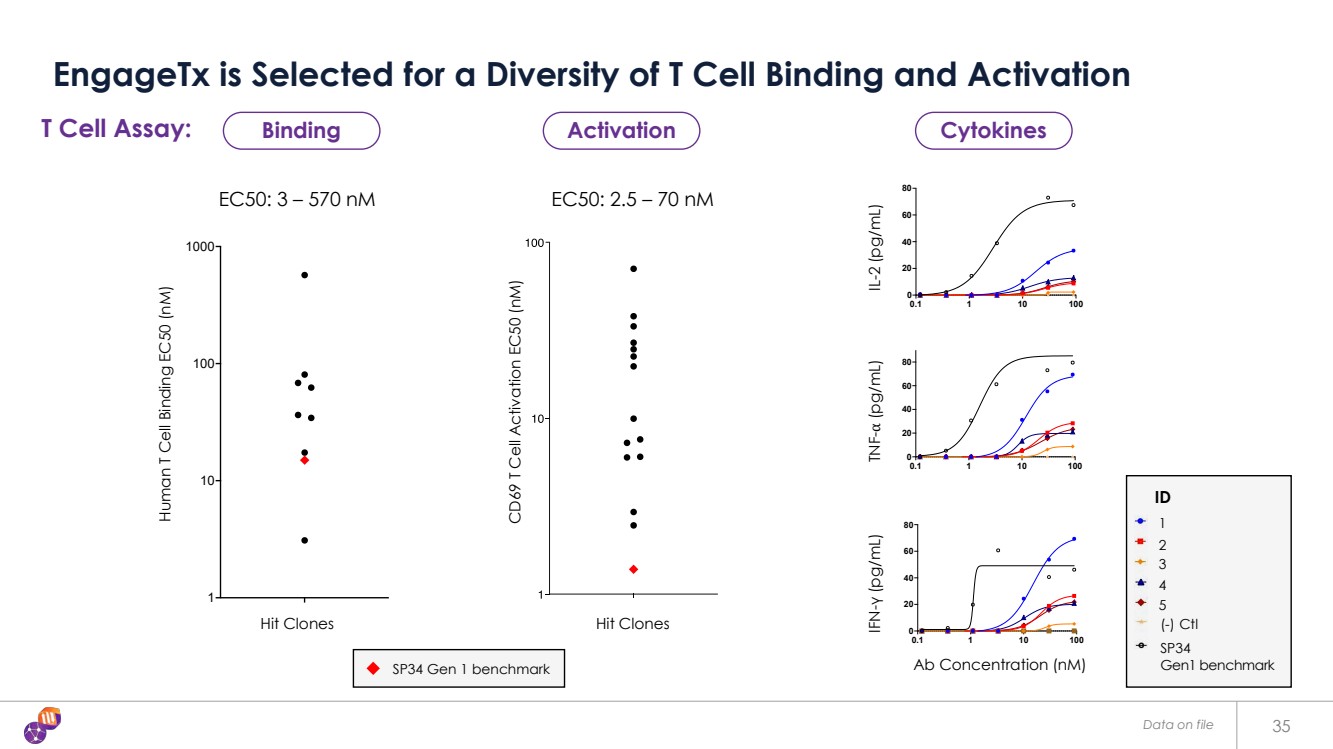
| 存檔數據 35 engagetX 被選中用於多樣化 T 細胞結合和激活 EC50:3 — 570 nM EC50:2.5 — 70 nM 人體 T 細胞結合 EC50 (nM) 0.1 1 10 100 0 20 40 60 80 濃度 (nM) 人類 T 細胞激活 M80-H1-1 M80-H1-2 M80-H3-1 M80-L1-1 M80-L2-1 IgG1 同種型 (-) Ctl SP34 (+) 控制 0.1 1 10 100 0 20 40 60 80 濃度 (nM) TNF-a (pg/mL) 人類 T 細胞激活 M80-H1-1 M80-H1-2 M80-H3-1 M80-L1-1 M80-L2-1 IgG1 同型 (-) 控制 SP34 (+) 控制 0.1 1 1 10 100 0 20 40 60 80 濃度 (nM) IFN-g (pg/mL) 人類 T 細胞激活 M80-H1-1 M80-H1-2 M80-H3-1 M80-H3-2 M80-L1-1 M80-L2-1 IgG1 同型 (-) 控制 SP34 (+) 控制 CD69 T 細胞激活 EC50 (nM) 命中克隆 T 細胞 CD3 EC50 1 10 100 1000 人類 T 細胞結合 EC50 (nM) 命中克隆 T 細胞 CD3 EC50 1 10 100 1000 人類 T 細胞結合 EC50 (nM) T 細胞 CD3 EC50 T 細胞測定: 抗體濃度 (nM) IFN-γ基準 (pg/mL) TNF-( pg/mL) IL-2 (pg/mL) ID 1 2 3 5 (-) Ctl 4 SP34 Gen1 基準 SP34 Gen1 基準 結合激活細胞因子 |
| 36 ShieldTx 抗體掩蔽技術用於提供表位上組織上具有增強安全性和可發育性的臨牀候選藥物 |
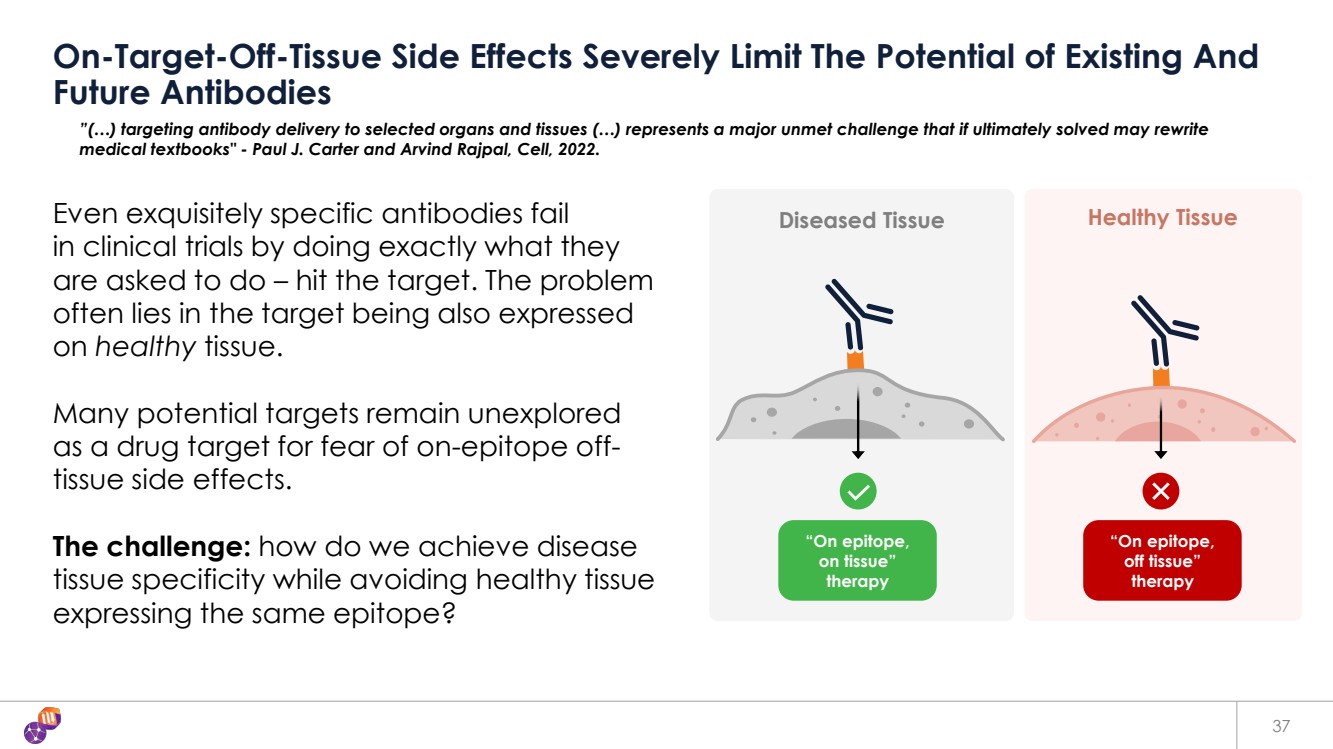
| 病變組織健康組織 37 非靶向副作用嚴重限制了現有和 未來抗體的潛力 即使是精緻的特異性抗體 在臨牀試驗中,如果完全按照要求 去做——擊中目標,也會失敗 。問題 通常在於靶標也在健康組織上表達 。 由於擔心表位外組織副作用,許多潛在靶標仍未被開發 作為藥物靶標。 挑戰:我們如何實現疾病 組織特異性,同時避免表達相同表位的健康組織 ? “在表位上, 在組織上” 療法 “在表位上, 脱離組織” 療法 ”(...)靶向抗體遞送到選定的器官和組織(...)是一個尚未解決的重大挑戰,如果最終得到解決,可能會重寫 醫學教科書” ——保羅·卡特和阿文德·拉傑帕爾,《細胞》,2022年。 |
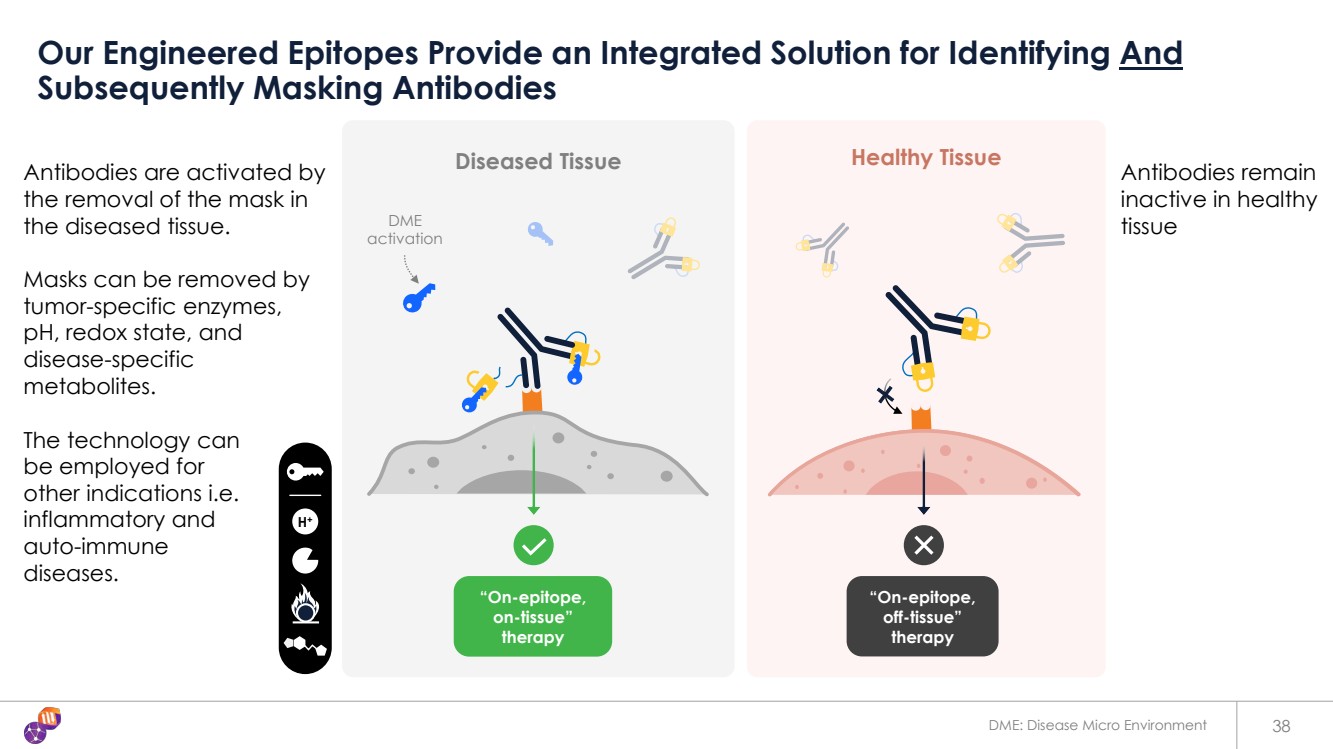
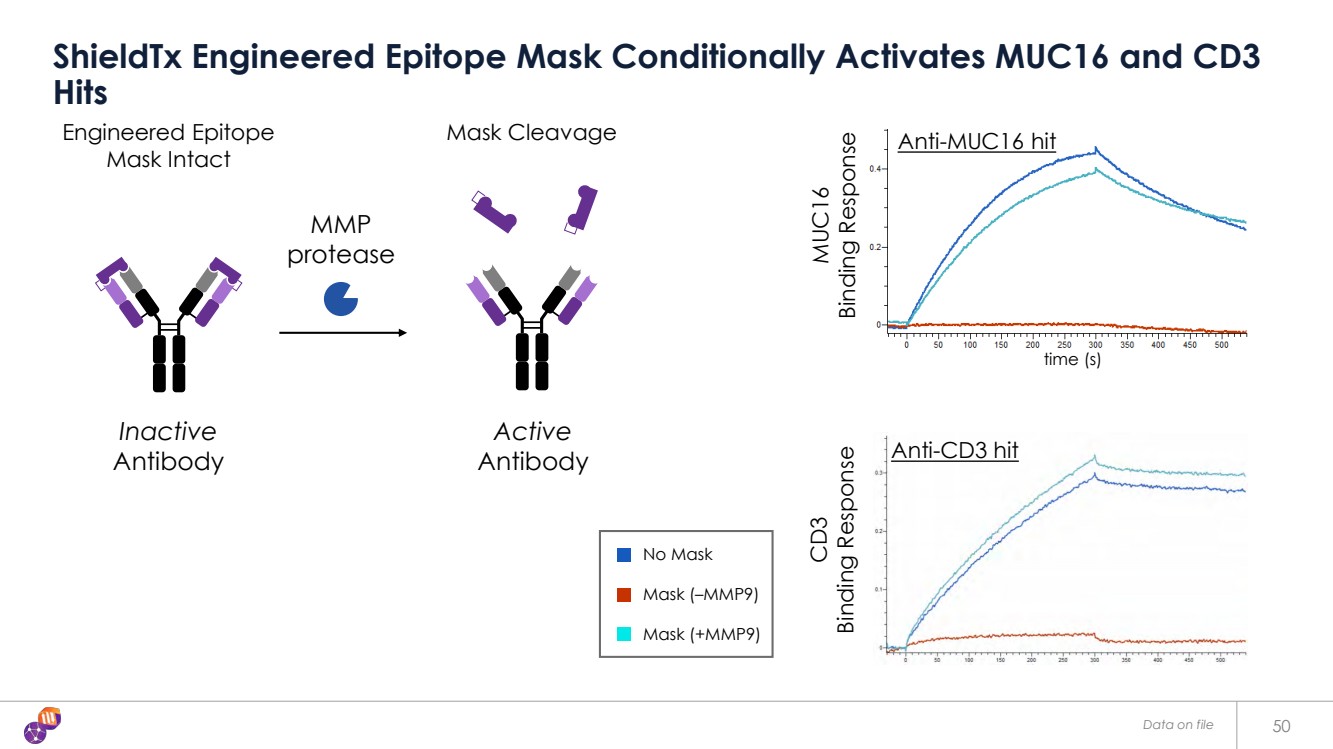
| 38 我們的工程表位為識別和 隨後掩蓋抗體 病變組織 “表位上, 組織外” 療法 健康組織 健康組織 DME 激活 “表位, 組織上” 療法 H+ DME:疾病微環境 br} 抗體由 摘下 患病組織中的面膜來激活。 口罩可以被 腫瘤特異性酶、 pH、氧化還原狀態和 疾病特異性 代謝物去除。 該技術 可用於 其他適應症,即 炎症和 自身免疫 疾病。 抗體在健康 組織中保持 無活性 |
| 掩蓋抗體是一個行之有效的概念,iBio 的平臺有潛力 解決剩餘的關鍵挑戰 39 問題我們的解決方案 1 單獨的抗體和掩膜 的發現過程效率低下 共同發現表位引導抗體 且掩膜效率更高 Discovery 流程 2 單獨的發現過程 不能共同演化出最佳抗體, 掩膜、連接劑組合 抗體庫、掩碼 和連接劑庫的共同進化,以最大限度地提高 屏蔽和解除掩蓋的效果 屏蔽 性能 3抗體 + 掩膜 + 連接劑 組合未在生產細胞 系中篩選出高 可發育性 哺乳動物顯示抗體、 掩膜和連接劑庫在生產 CHO 細胞系中篩選 可發育性 可開發性 4 隨機肽或抗獨特型口罩 增加掩膜抗體 免疫原性風險 工程表位風險 ope 口罩的設計 旨在最大化表位的自然 序列並最小化 免疫原性 免疫原性 免疫原性 |
| 40 種針對非脱落 MUC16 區域的條件激活抗 MUC16 x CD3 雙特異性 抗體 利用 iBio 的表位轉導、ShieldTX 和 engageTX 技術 |
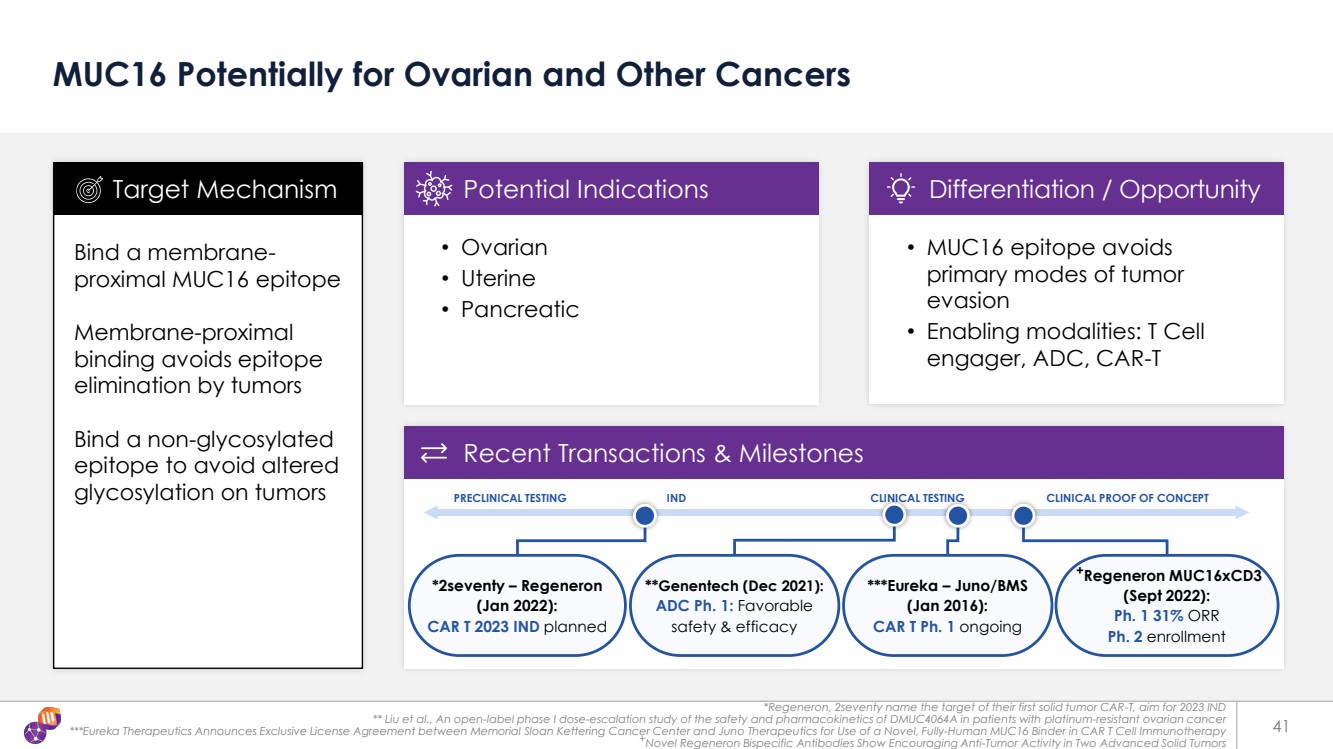
| +Regeneron muc16xCD3(2022年9月): Ph. 1 31% ORR Ph. 2 入組 41 MUC16 可能用於卵巢和其他癌症 結合膜近端 MUC16 表位 可避免表位 被腫瘤消除 結合非糖基化的 表位 避免腫瘤 糖基化發生改變 • 卵巢 • 子宮 • 胰腺 靶向機制潛在適應症 • MUC16 表位避免 腫瘤的主要逃避模式 • 啟用方式:T 細胞 參與者、ADC、CAR-T 分化/機會 最近交易與里程碑 臨牀前測試 IND 臨牀測試臨牀概念驗證 ***Eureka — Juno/BMS (2016 年 1 月): CAR T 第 1 期正在進行中 *270ty — Regeneron (2022 年 1 月): CAR T 2023 IND 計劃 **基因泰克(2021 年 12 月): ADC 第 1 階段:優惠 安全性和有效性 *Regeneron,270% 命名了他們的第一個實體瘤 CAR-T 的靶標,目標是 2023 年 IND ** Liu 等人,一項關於 DMUC4064A 在耐鉑卵巢癌患者中的安全性和藥代動力學的開放標籤 I 期劑量遞增研究 ***EurekaTherapeutics 宣佈 Memorial Sloan Kettering Cancer Center 與 Juno Therapeutics 簽訂獨家許可協議,在 CAR T 細胞免疫療法中使用一種新型的全人類 MUC16 粘合劑 +新型再生子雙特異性抗體在兩種晚期實體瘤中顯示出令人鼓舞的抗腫瘤活性 |
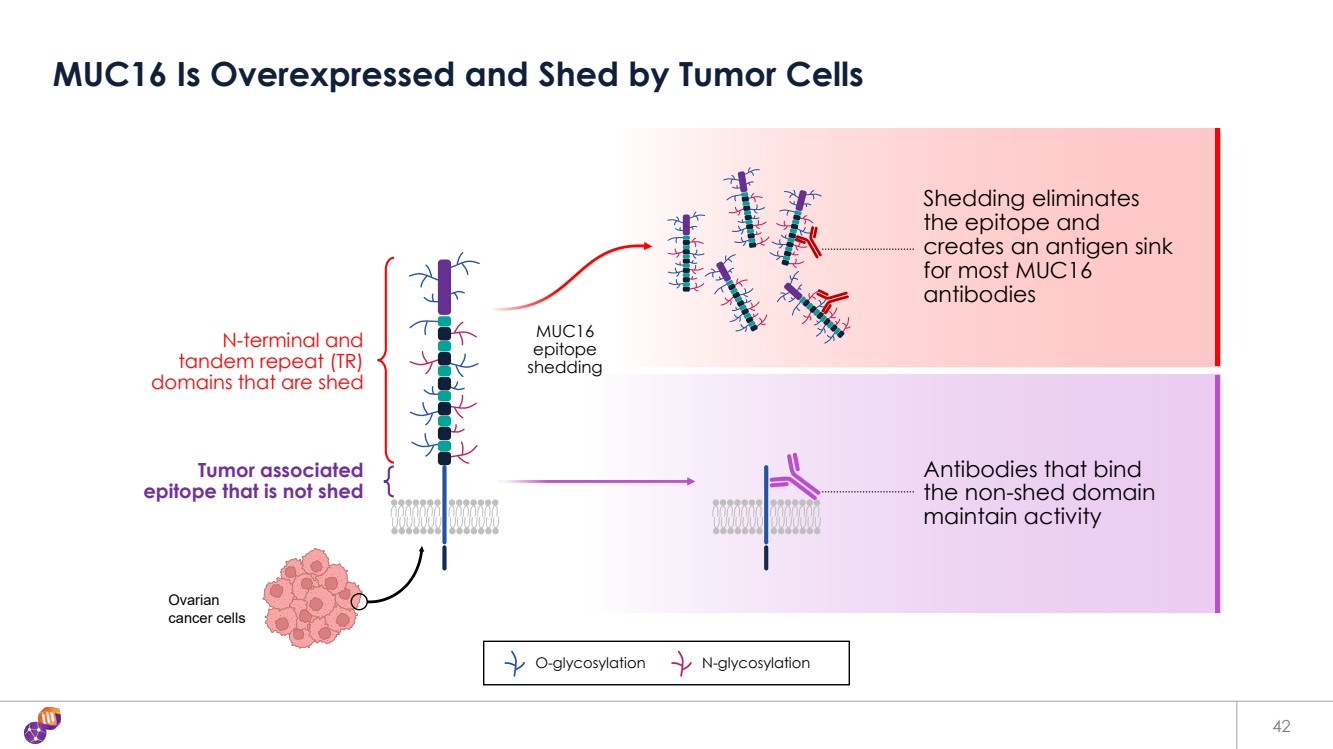
| 42 MUC16 被腫瘤細胞過度表達和脱落 O 糖基化 N-糖基化 MUC16 表位 脱落 脱落會消除 表位和 為大多數 MUC16 抗體生成抗原匯點 結合 非脱落結構域 的抗體維持活性 N 末端和 dem repeat (TR) 脱落的結構域 腫瘤相關的 表位未脱落 卵巢 癌細胞 |
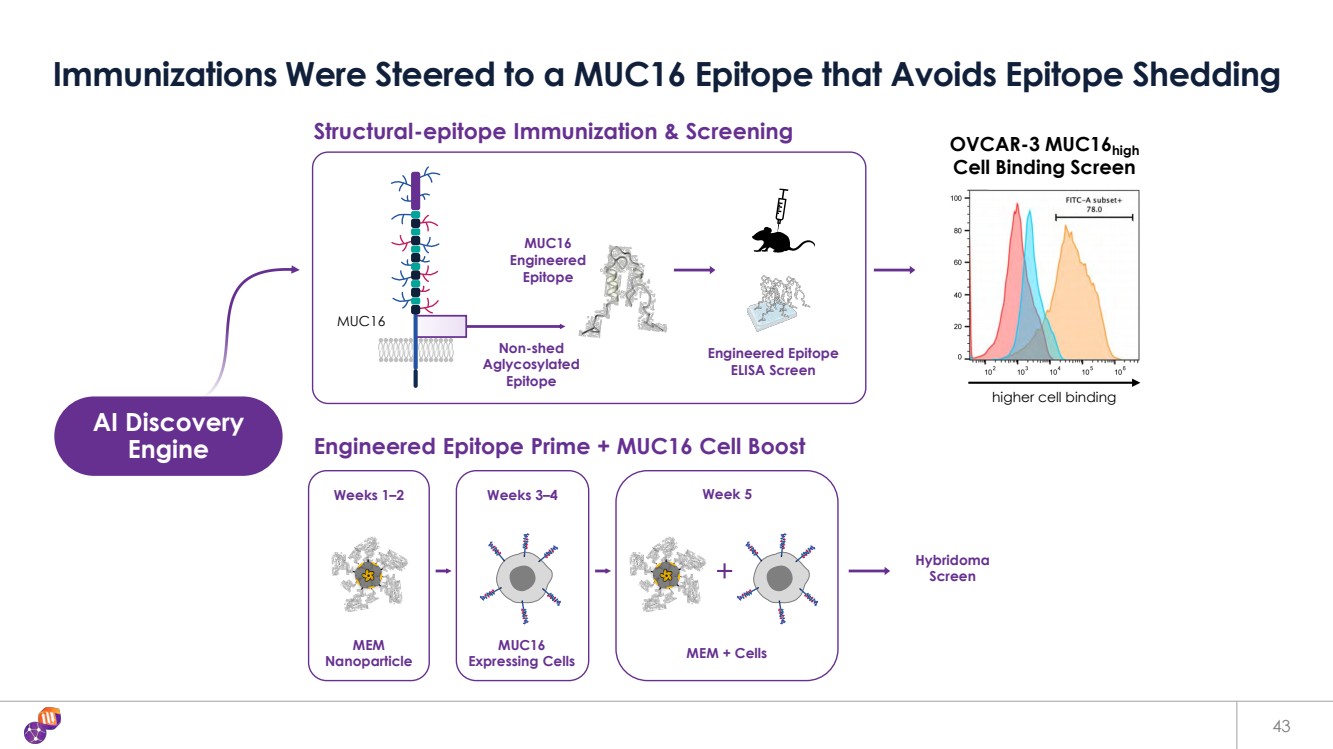
| 第 1-2 周 3—4 周 5 周 43 次免疫接種被引向避免表位脱落的 MUC16 表位 工程表位 Prime + MUC16 Cell Boost AI Discovery 引擎 MUC16 工程 表位 結構表位免疫和篩查 工程表位 ELISA Screen MUC16 OVCAR-3 muc16High 細胞結合篩選 更高的細胞結合 MEM 納米粒子 MUC16 表達細胞 MEM + 細胞 雜交瘤 屏幕 非脱落 無糖化 表位 |
| 44 個排名前三的命中克隆結合離膜最近的非糖基化 MUC16 表位 1D7 8G4 21G6 命中不結合 shed 230-mer 命中結合非糖基化的非脱落 29-mer 結合 時間 O-糖基化 N-糖基化 N 末端和 串聯重複 (TR) 脱落 表位 KD = 8.0 nM KD = 5.4 nM KD = 14 nM 未脱落 未脱落 29-mer 29-mer Shed 230-mer 存檔數據 |
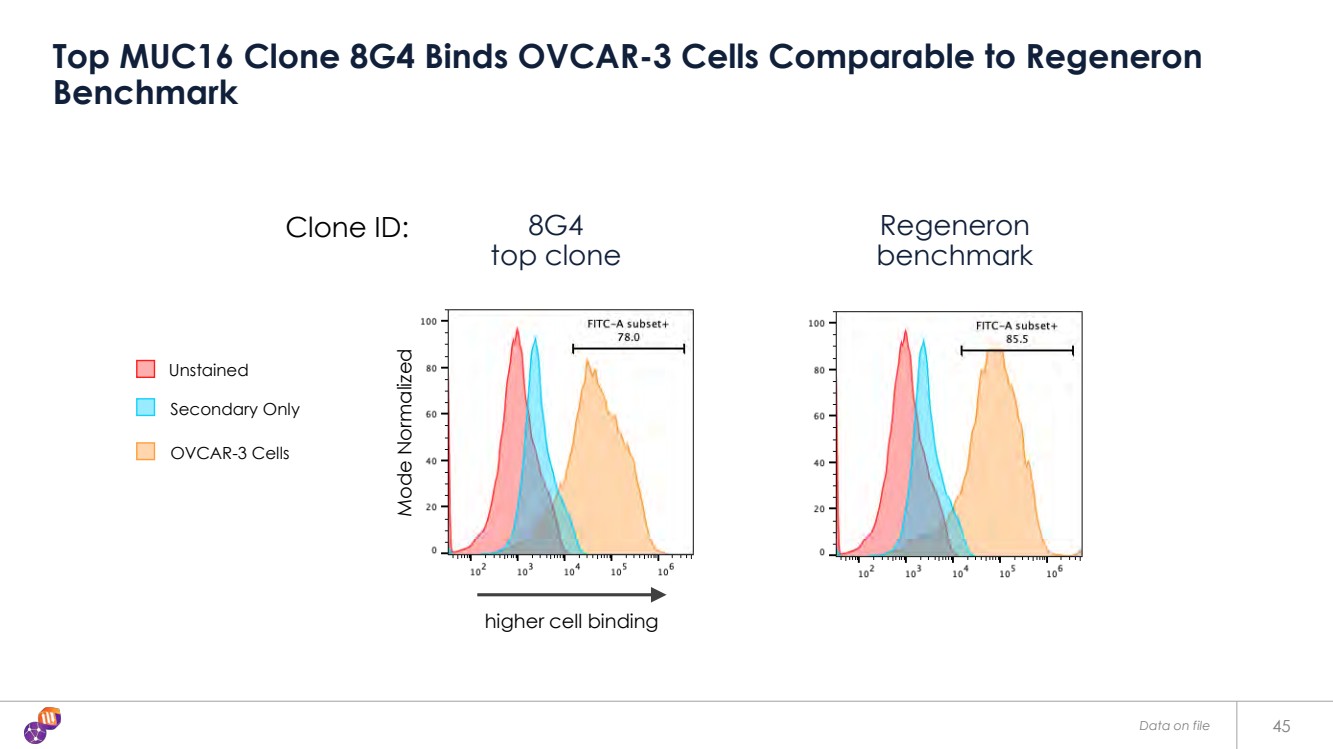
| 45 個頂級 MUC16 克隆 8G4 綁定 OVCAR-3 細胞與 Regeneron 基準 Regeneron 基準測試 基準測試 克隆 ID: 未染色 OVCAR-3 細胞 頂級克隆 更高的細胞結合 模式歸一化 存檔數據 |
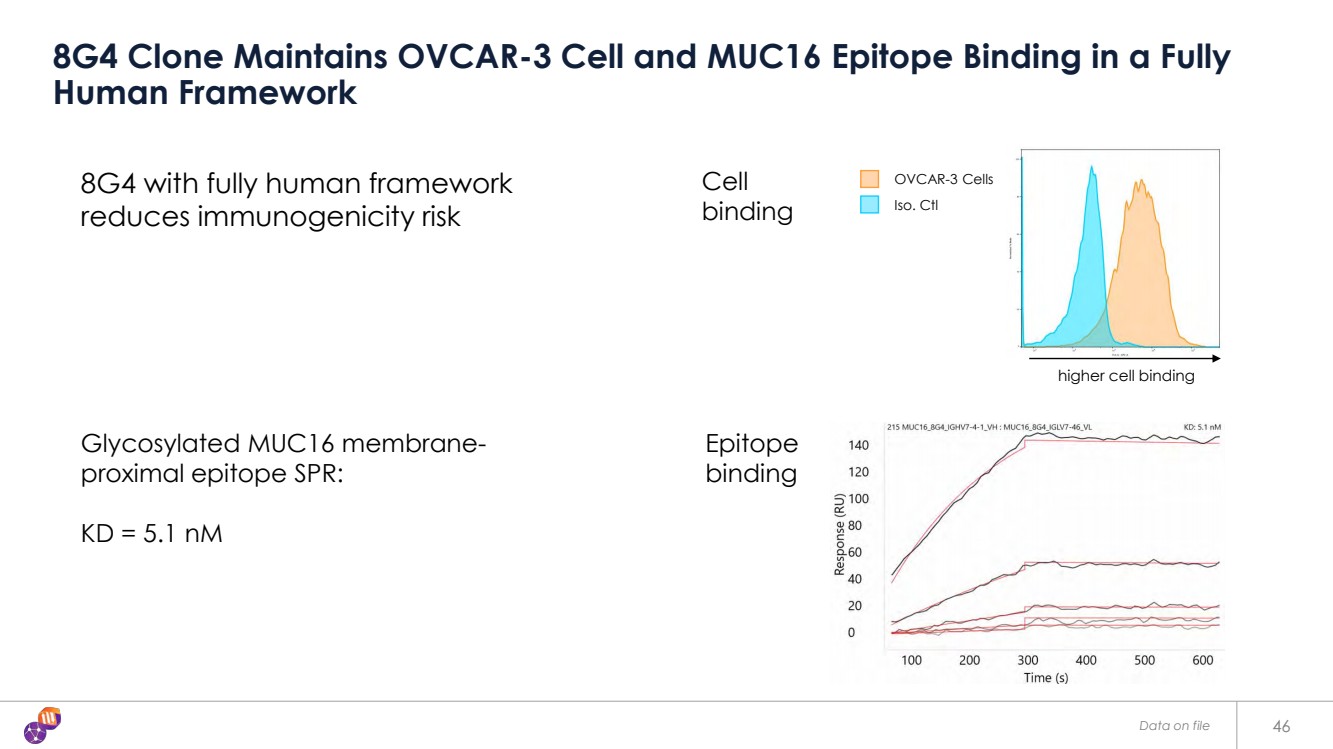
| 46 8G4 克隆在完全 人體框架中保持 OVCAR-3 細胞和 MUC16 表位的結合 8G4 採用完全人體框架 可降低免疫原性風險 糖化 MUC16 膜近端表位 SPR: KD = 5.1 nM Iso。Ctl OVCAR-3 細胞 表位 結合 細胞 結合 更高的細胞結合 更高的細胞結合 檔案中的數據 |
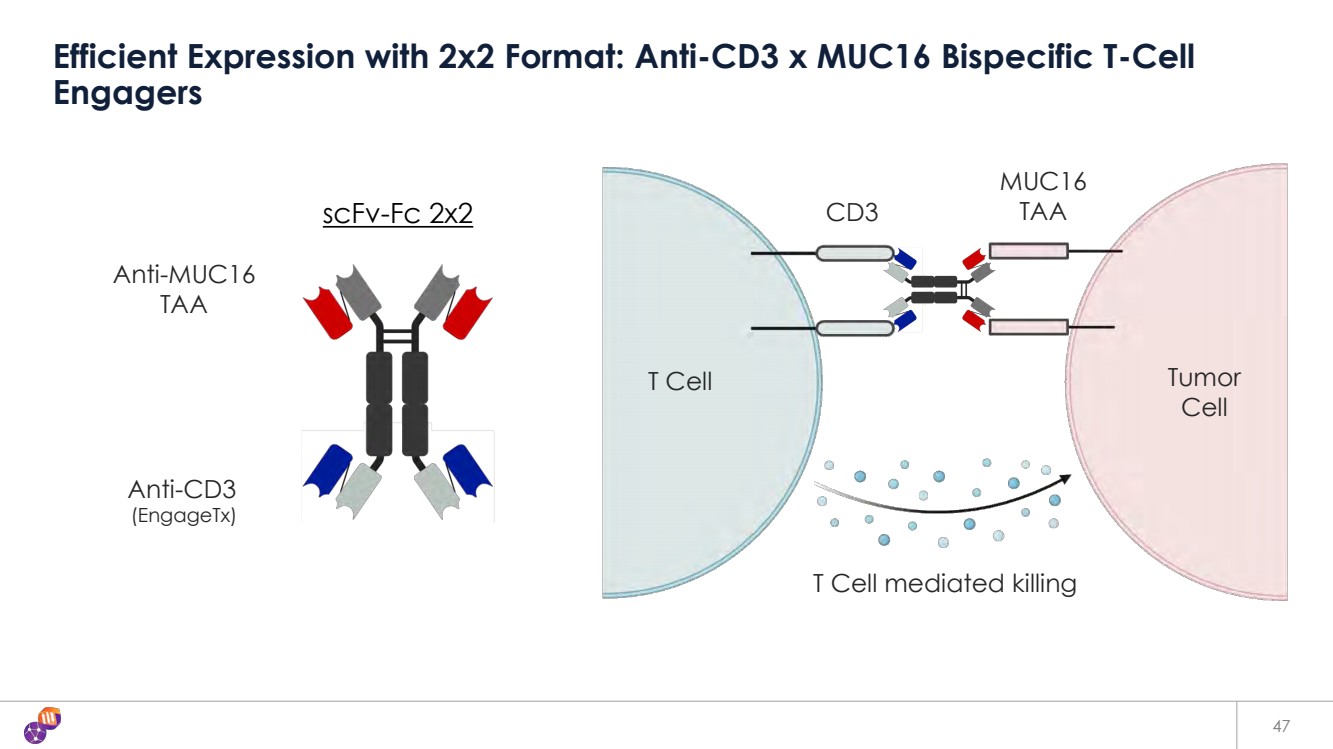
| 47 採用 2x2 格式的高效表達:抗 CD3 x MUC16 雙特異性 T 細胞 Engagers scfv-FC 2x2 抗 TAA 抗 CD3 (engageTX) MUC16 TAA T 細胞瘤 T 細胞介導的殺傷 |
| EC50 = 14 nM EC50 = 62 nM EC50 = 19 nM EC50 = 126 nM 存檔數據 48 2X2 抗 CD3 X MUC16 T 細胞參與者刺激供體 pbmcs 中的 T 細胞 EC50 >> 100 nM MUC16 臂 1 (-) CD3 臂 表位引導 免疫命中 } stableHu Hit CD69 MFI 濃度 (nM) MUC16 Arm 2 CD3 Arms MUC16 武器 武器 |
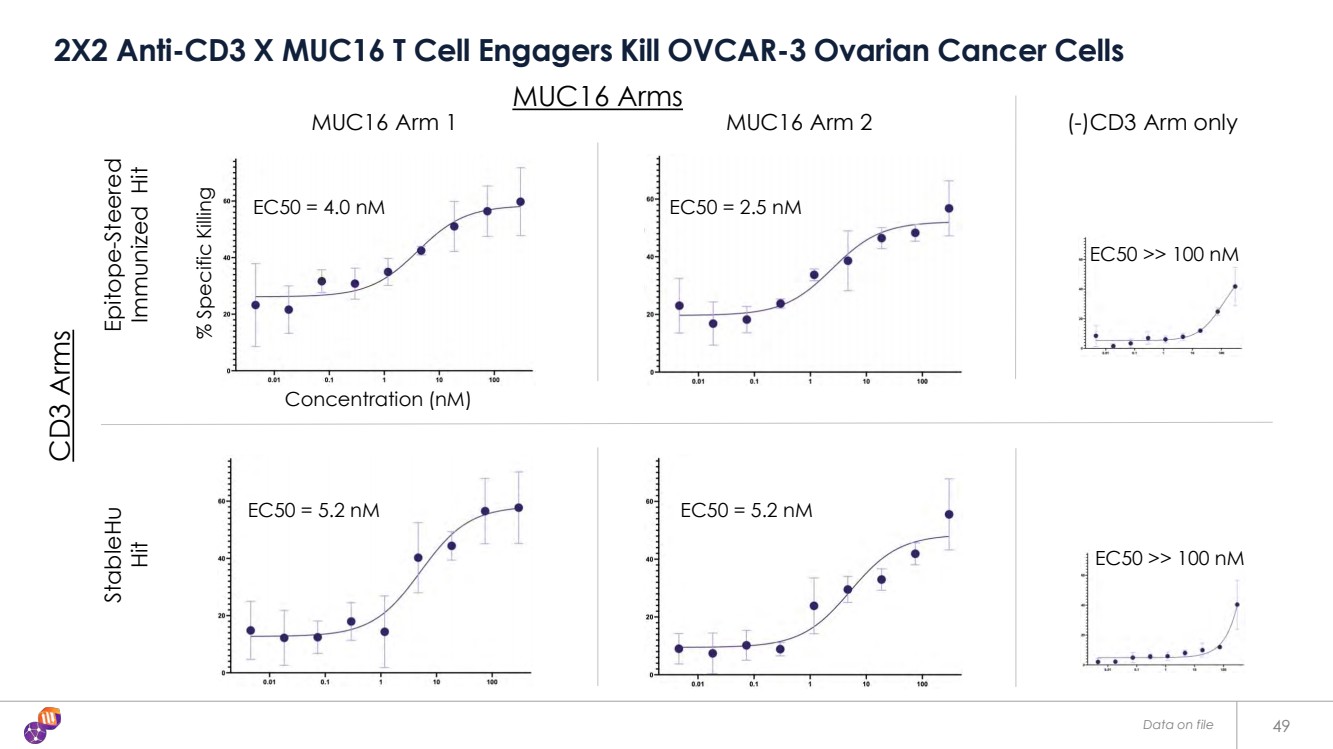
| EC50 = 4.0 nM EC50 = 2.5 nM EC50 = 5.2 nM EC50 = 5.2 nM 存檔數據 49 2X2 抗 CD3 X MUC16 T 細胞參與者殺死 OVCAR-3 卵巢癌細胞 EC50 >> 100 nM MUC16 臂 1 (-) 僅限 CD3 臂 Epitope-Steered 免疫命中 leHu 命中 濃度 (nM) MUC16 Arm 2 CD3 Arms MUC16 Arms Arms % 特定擊殺 |
| 存檔數據 50 ShieldTX 工程表位面膜有條件地激活 MUC16 和 CD3 命中 口罩分裂 無掩膜 口罩 (—MMP9) 掩膜 (+MMP9) 蛋白酶 工程表位 面膜完好無損 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 抗體 {br muc16 命中 抗 CD3 命中 MUC16 結合反應 CD3 結合反應 CD3 結合反應 時間 (s) |
| 51 抗腫瘤特異性 Trop-2 x CD3 雙特異性抗體 |
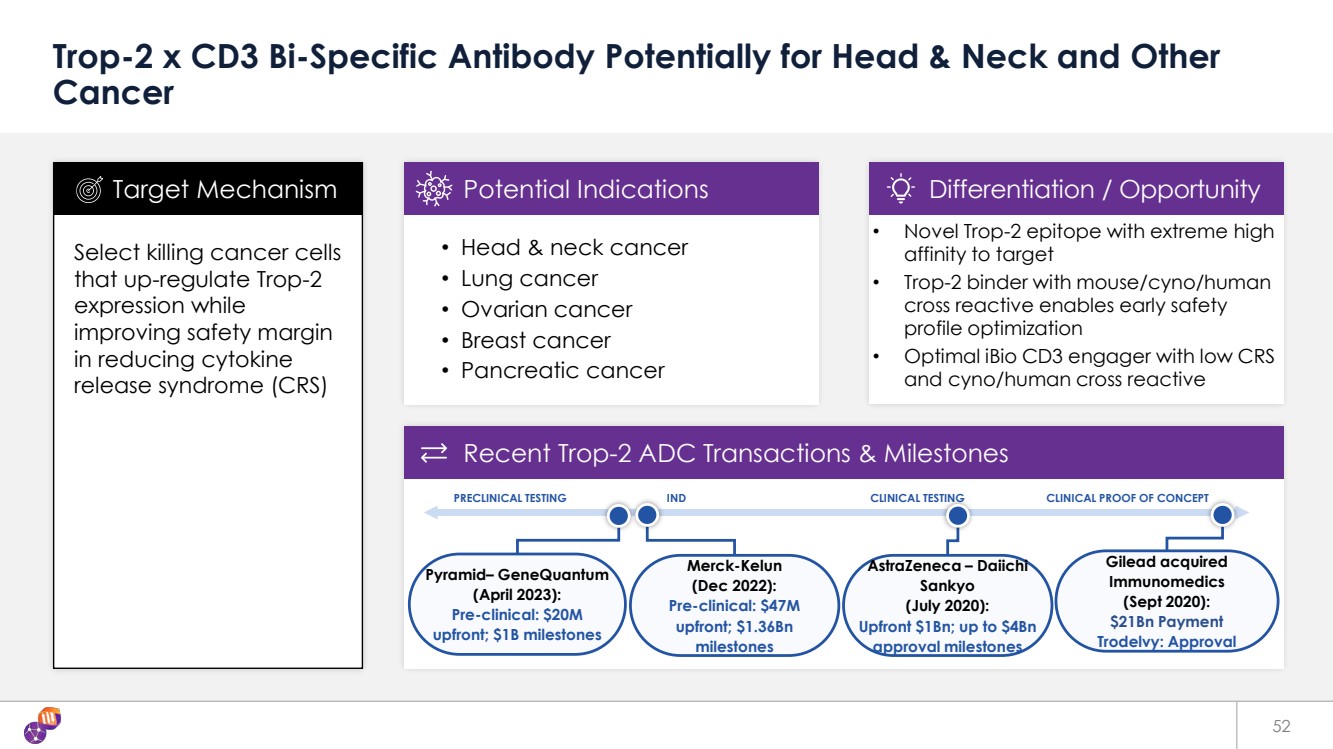
| 最近的交易 靶向機制潛在適應症差異化/機會 吉利德收購 Immunomedics (2020年9月): 210億美元付款 Trodelvy:批准 52 Trop-2 x CD3 雙特異性抗體可能用於頭頸部和其他 癌症 選擇殺死上調Trop-2表達的癌細胞 ,同時改善 表達減少細胞因子 釋放綜合徵 (CRS) 的安全邊距 • 頭頸部癌 • 肺癌 • 卵巢癌 • 乳腺癌 • 乳腺癌 • 胰腺癌 靶向機制潛在適應症 • 新型 Trop-2 表位對靶標具有極高 親和力 • 具有鼠標/cyno/人類 交叉反應的 Trop-2 粘合劑可實現早期安全性 配置優化 • 具有低 CRS 和賽諾/人交叉反應 差異化/機會 最近的 Trop-2 ADC 交易和里程碑 臨牀前期交易和里程碑 測試 IND 臨牀測試臨牀概念驗證 阿斯利康 — 第一重工 三共 (2020 年 7 月): 預付款 10 億美元;高達 40 億美元 批准里程碑 Pyramid— Genequantum (2023 年 4 月): 臨牀前:預付2000萬美元 ;10億美元里程碑 默克科倫 (2022年12月): 臨牀前:預付4,700萬美元 ;13.6億美元 里程碑 |
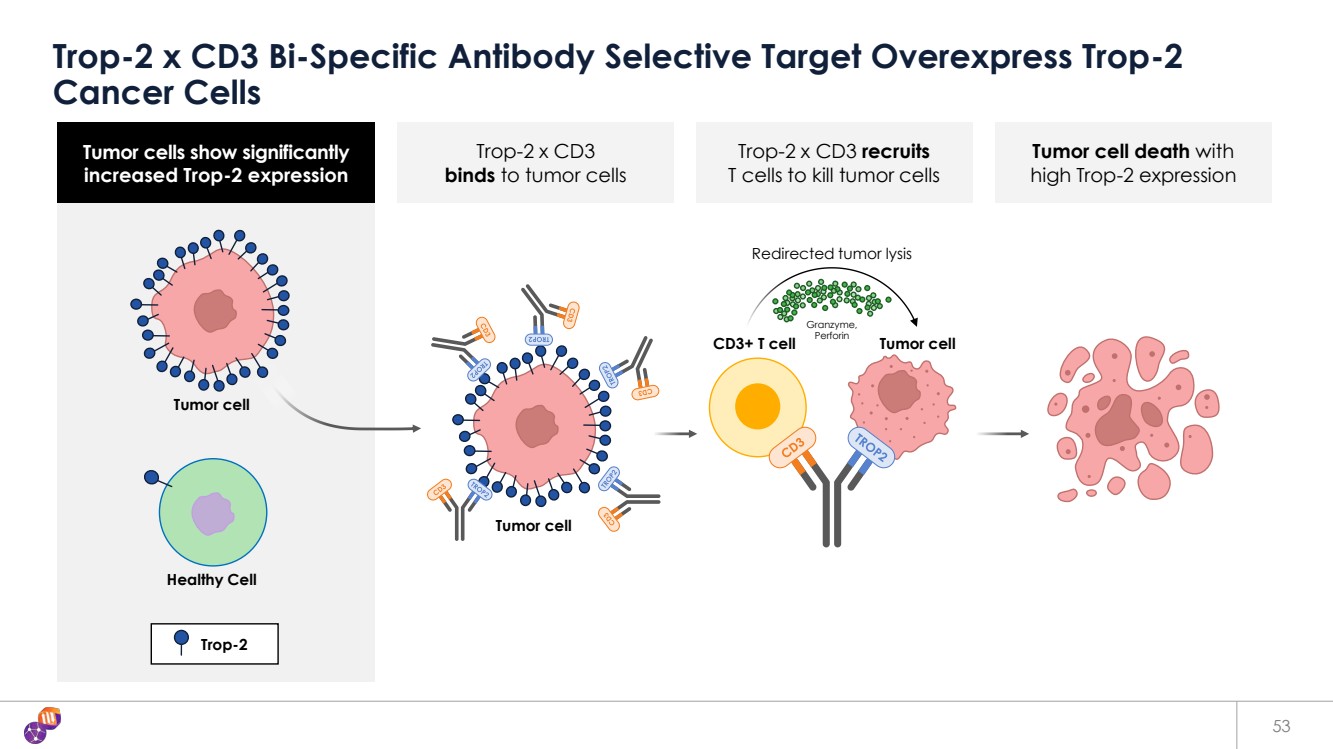
| 腫瘤細胞顯示 Trop-2 表達明顯增加 Trop-2 表達量高 腫瘤細胞死亡 Trop-2 x CD3 與腫瘤細胞結合 Trop-2 x CD3 招募 T 細胞殺死腫瘤細胞 53 Trop-2 x CD3 雙特異性抗體選擇性靶向過表達的 Trop-2 癌細胞 Trop-2 腫瘤細胞 Trop-2 腫瘤細胞 健康細胞 腫瘤細胞 腫瘤細胞 重定向腫瘤溶解 CD3+ T 細胞 Granzyme, Perforin |
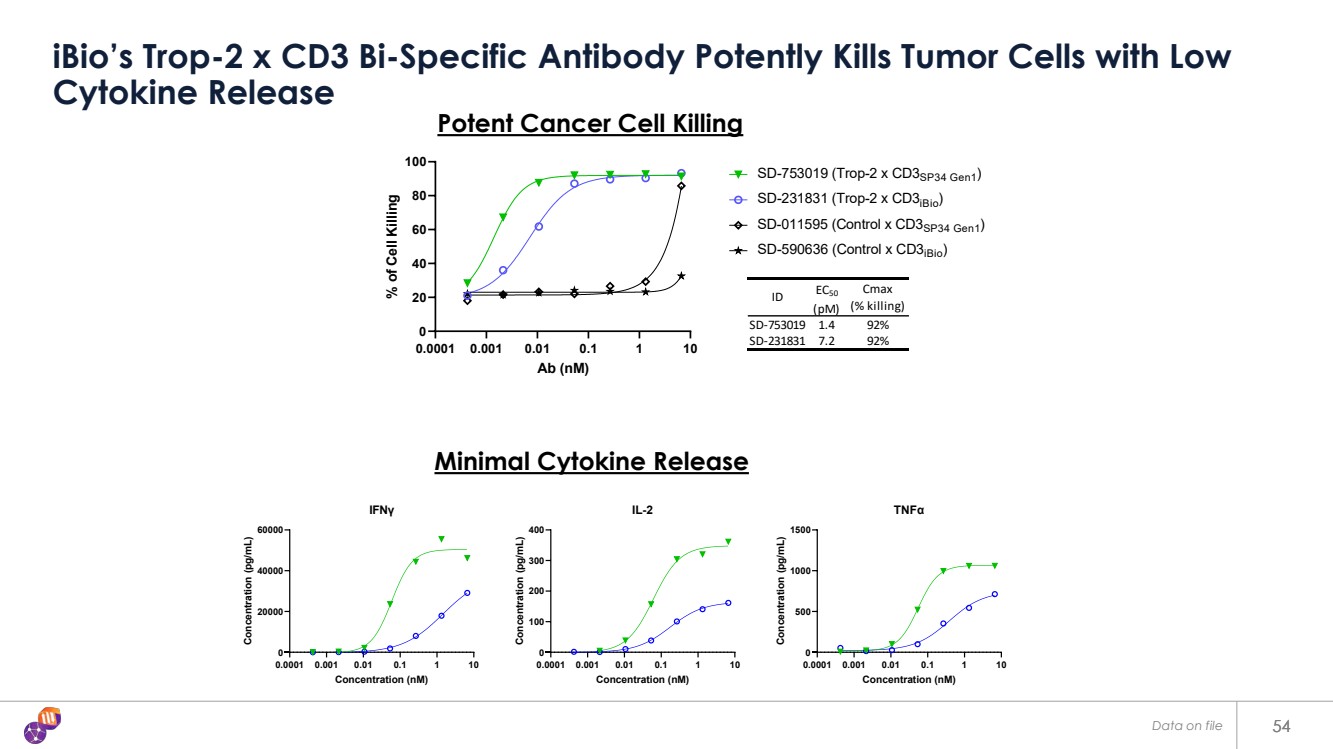
| 54 iBio 的 Trop-2 x CD3 雙特異性抗體以 細胞因子釋放量低 54 0.0001 0.001 0.01 0.1 1 1 10 0 20 40 60 80 100 Ab (nM)% 的細胞殺傷 ID EC50 (pM) Cmax (% 殺傷率) SD-753019 1.4 92% SD-231831 7.2 92% SD-753019 (Trop-2) x CD3SP34 Gen1) SD-231831(Trop-2 x CD3iBio)SD-011595(控制 x CD3SP34 Gen1)SD-590636(控制 x CD3iBio) 0.0001 0.01 0.01 1 1 10 0 20000 40000 40000 IFNγ濃度 (pg/mL) 濃度 (pg/mL) 0.0001 0.01 1 1 10 0 100 200 300 400 400 IL-2 濃度 (nM)(pg/mL) 0.0001 0.001 0.1 1 10 0 500 1000 1500 TNFα 濃度 (nM) 濃度 (pg/mL) 最低細胞因子釋放 強效癌細胞殺傷 存檔數據 |
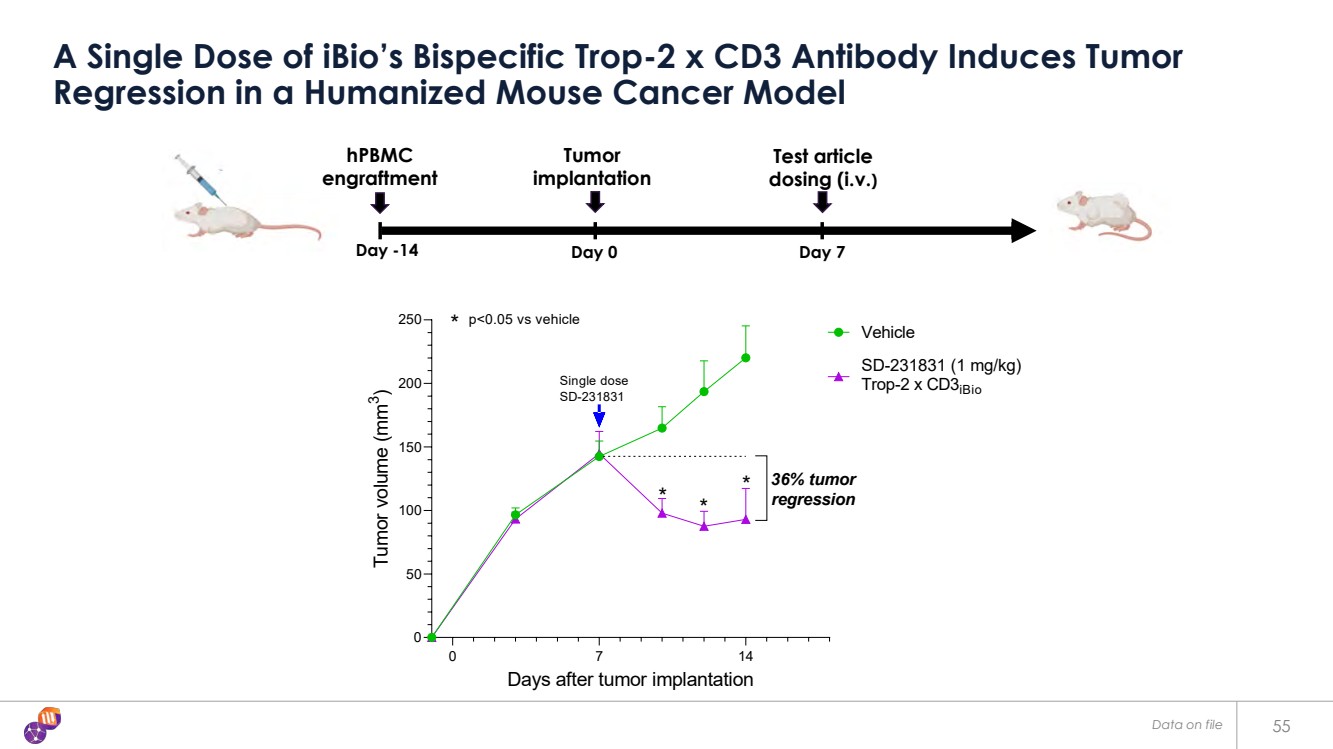
| 55 單劑量 iBio 的雙特異性 Trop-2 x CD3 抗體在人源化小鼠癌症模型中誘導腫瘤 迴歸 0 7 14 0 50 150 200 200 腫瘤體積 (mm 3) 載體 SD-231831 (1 mg/kg) Trop-2 x CD3iBio * * * * * * * * * * * * * * * * * * *} p |
| 56 抗腫瘤特異性 egfrVIII 高 ADCC 單抗腫瘤特異性 egfrVIII 細胞 |
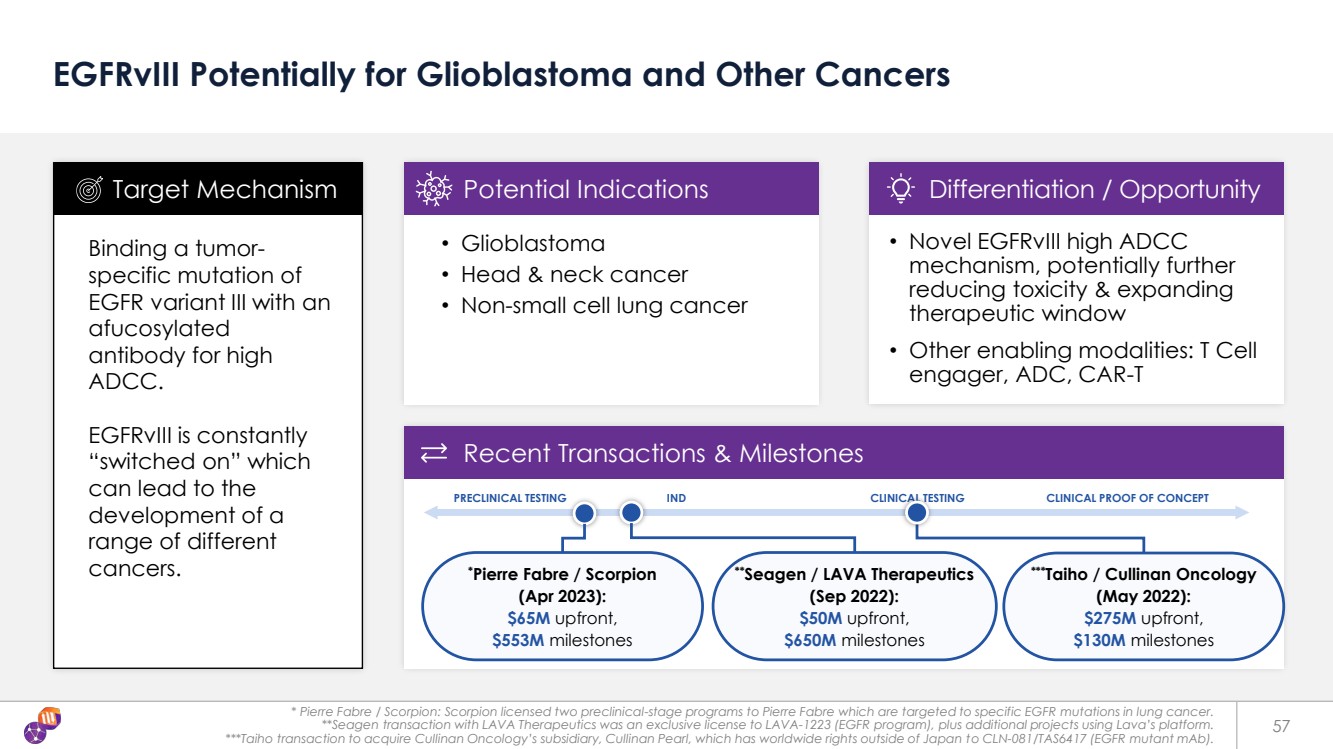
| **Seagen/LAVA Therapeutics (2022年9月): 預付5000萬美元, 6.5億美元里程碑 ***Taiho/Cullinan Oncology (2022年5月): 1.3億美元里程碑 * Pierre Fabre/Scorpion:Scorpion 向皮爾法伯許可了兩個臨牀前階段的靶向項目針對肺癌中的特異表皮生長因子突變。 **Seagen 與 LAVA Therapeutics 的交易是 LAVA-1223(表皮生長因子計劃)的獨家許可,以及使用 Lava 平臺的其他項目。 ***Taiho交易收購庫裏南腫瘤的子公司庫裏南珍珠,該公司擁有CLN-081/TAS6417(表皮生長因子突變體單抗體)在日本以外的全球版權。 57 EGFRVIII 可能用於膠質母細胞瘤和其他癌症 將 EGFR 變體 III 的腫瘤特異性突變與 afucosylated 抗體結合,用於高 ADCC。 egfrViii 不斷 “開啟”,這 可能導致 一系列不同的 癌症的發展。 • 膠質母細胞瘤 • 頭頸部癌 • 非小細胞肺癌 靶向機制潛在適應症 • 新型 egfrVIII 高 ADCC 機制,有可能進一步降低毒性並擴大 治療窗口 • 其他支持方式:T 細胞 參與者、ADC、CAR-T 差異化/機會 最近的交易和里程碑 臨牀前測試 IND 臨牀測試臨牀概念驗證 *Pierre/Scorpion (2023 年 4 月): 6,500 萬美元的預付款, 5.53 億美元的里程碑 |
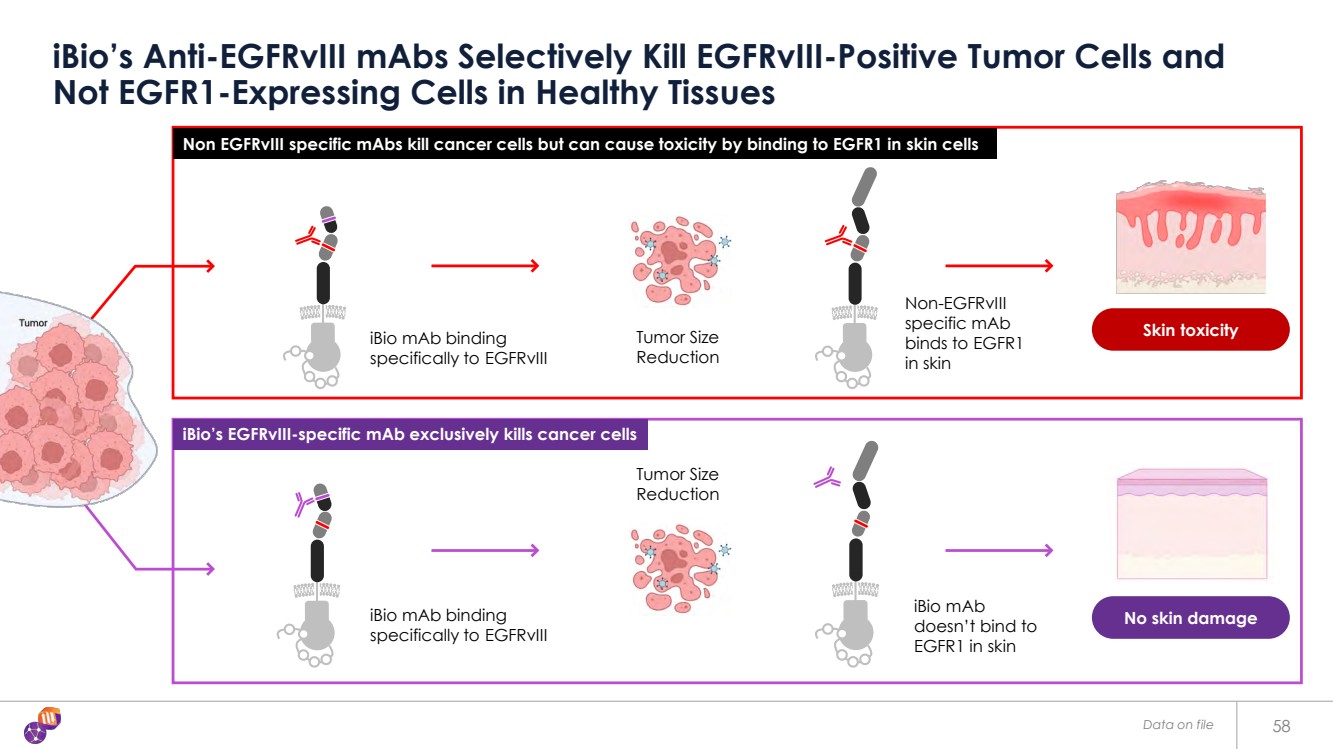
| 皮膚毒性 無皮膚損傷 58 iBio 的抗 EGFRVIII 單克隆有選擇地殺死 EGFRVIII 陽性腫瘤細胞和 健康組織中不表達 EGFR1 的細胞 iBio maB 特異性結合 與 egfrViii 特異性結合 腫瘤大小 縮小 皮膚中的 EGFR1 不結合 非 EGFRVIII frViii 特異性單抗 與皮膚中的 EGFR1 結合 iBio maB 特異性結合 特異性結合 egfrViii 腫瘤大小 非 EGFRVIII 特異性單克隆抗體可殺死癌細胞,但可通過與皮膚細胞中的 EGFR1 結合而導致毒性 iBio 的 egfrVIII 特異性單克隆抗體僅能殺死癌細胞 iBio 的 egfrVIII 特異性單克隆抗體殺死癌細胞 存檔數據 |
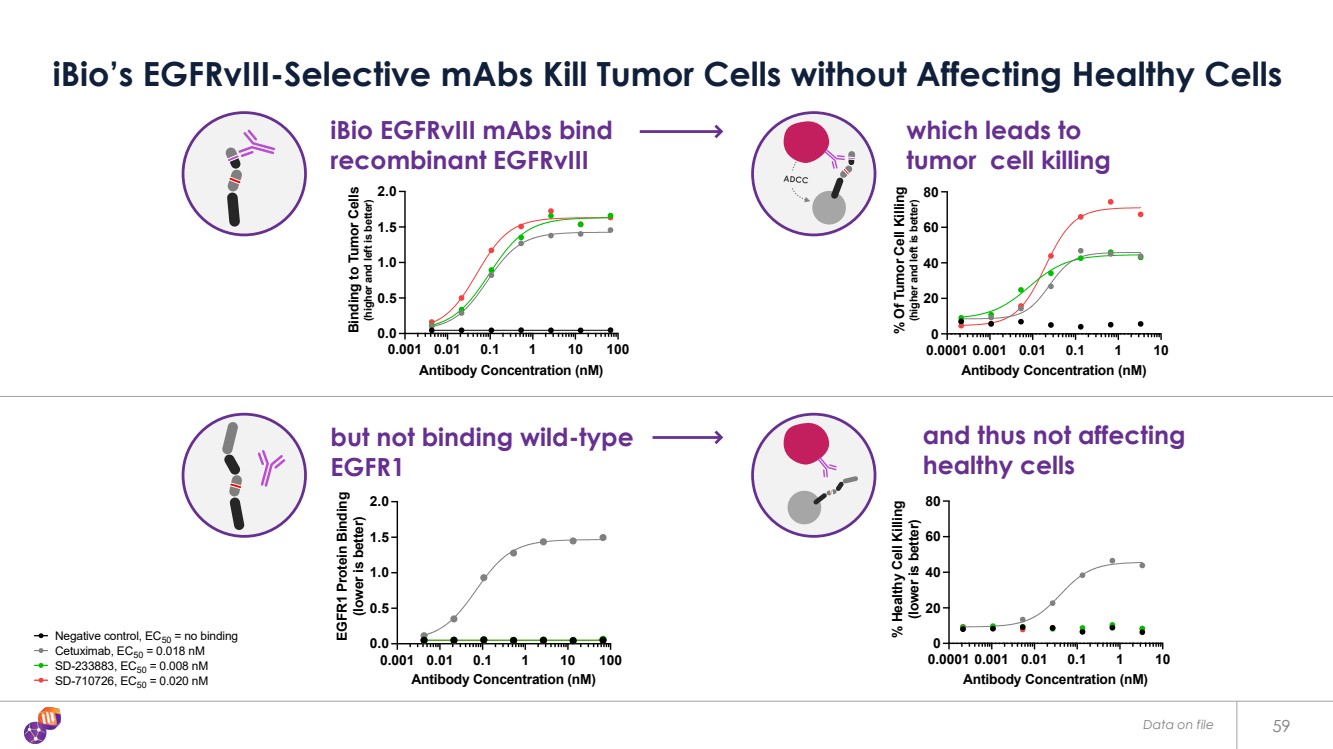
| 59 iBio 的 EGFRVIII 選擇性單抗在不影響健康細胞的情況下殺死腫瘤細胞 陰性對照,EC50 = 無結合 西妥昔單抗,EC50 = 0.018 nM SD-233883,EC50 = 0.008 nM SD-710726,EC50 = 0.020 nM 0.0001 0.001 0.01 1 1 1 10 0 20 40 60 80 抗體濃度 (nM) % 腫瘤細胞殺傷率 (向高和向左越好) 陰性對照,EC50 = 無結合 西妥昔單抗,EC50 = 0.018 nM SD-233883,EC50 = 0.008 nM SD-710726,EC50 = 0.020 nM iBio egfrVIII mAbs 結合 重組 egfrVIII 0.001 0.1 1 10 100 0.0 0.5 1.0 2.0抗體濃度 (nM) 與腫瘤細胞的結合 (越高越好) 陰性對照,EC50 = 無結合 西妥昔單抗,EC50 = 0.12 nM SD-233883,EC50 = 0.12 nM SD-710726,EC50 = 0.05 nM 這導致 腫瘤細胞殺死 0.0001 0.01 1 10 0 20 40 60 80 抗體濃度 (nM) % 健康細胞殺死 (越低越好) 陰性對照,EC50 = 無結合 西妥昔單抗,EC50 = 0.029 nM SD-233883,EC50 = 無結合 SD-710726,EC50 = 無結合 但不結合野生型 EGFR1 0.001 0.01 1 10 100 0.0 0.5 1.0 1.5 2.0 抗體濃度 (nM) EGFR1 蛋白結合 (越低越好) 陰性對照,EC50 = 無結合 西妥昔單抗,EC50 = 0.08 nM SD-233883,EC50 = 無結合 ,EC50 = 無結合 健康細胞 存檔數據 SD-710726 |
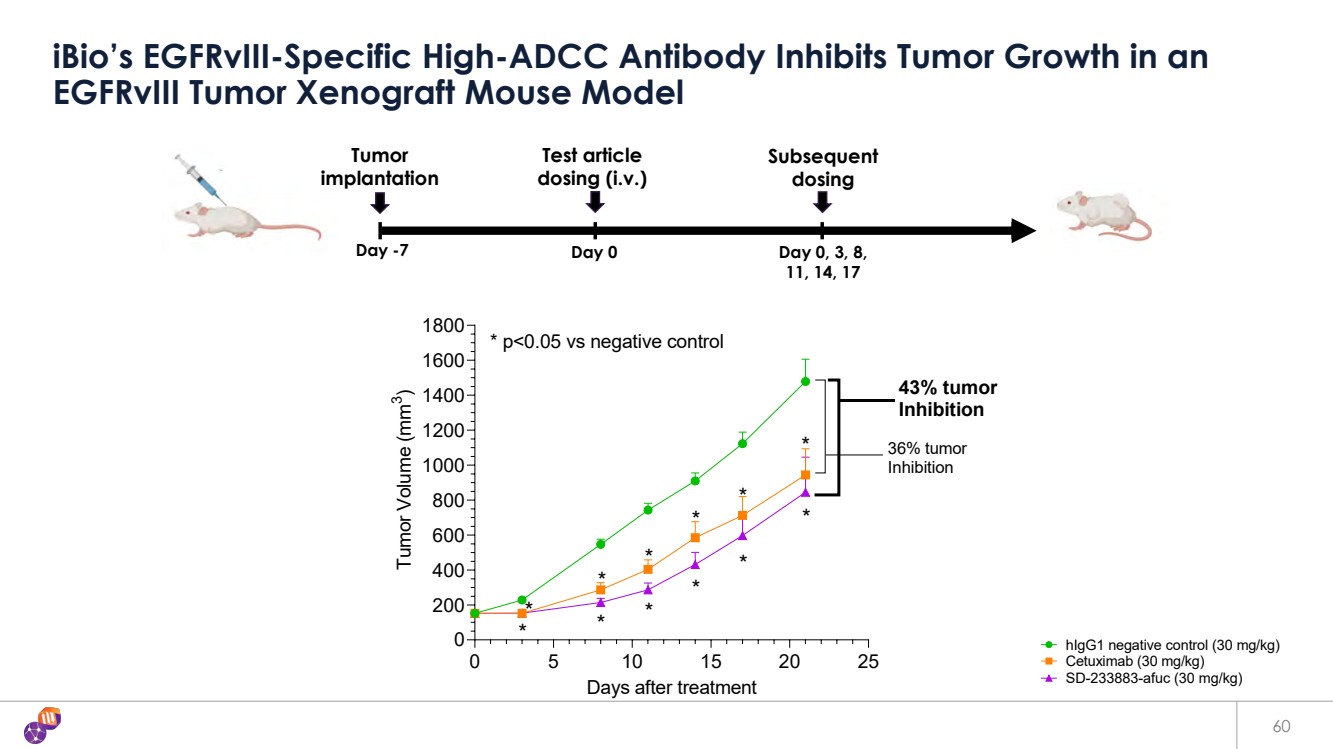
| 60 iBio 的 EGFRVIII 特異性高 ADCC 抗體可抑制 EGFRVIII 腫瘤異種移植小鼠模型中的腫瘤生長 第 -7 天 0 天 0 天、3、8 天, 11、14、17 腫瘤 植入 後續劑量 測試文章 劑量(i.v.) 0 5 10 15 20 25 0 200 400 600 800 1000 1200 1400 1600 1800 治療後腫瘤體積 (mm 3) HigG1 陰性對照 (30 mg/kg) 西妥昔單抗 (30 mg/kg) SD-233883-AFUC (30 mg/kg) * * * * * * * * * * * * * * * * * * * * * * * * * * * p |
| 61 PD-1 激動劑 支持恢復炎症 疾病的動態平衡 |
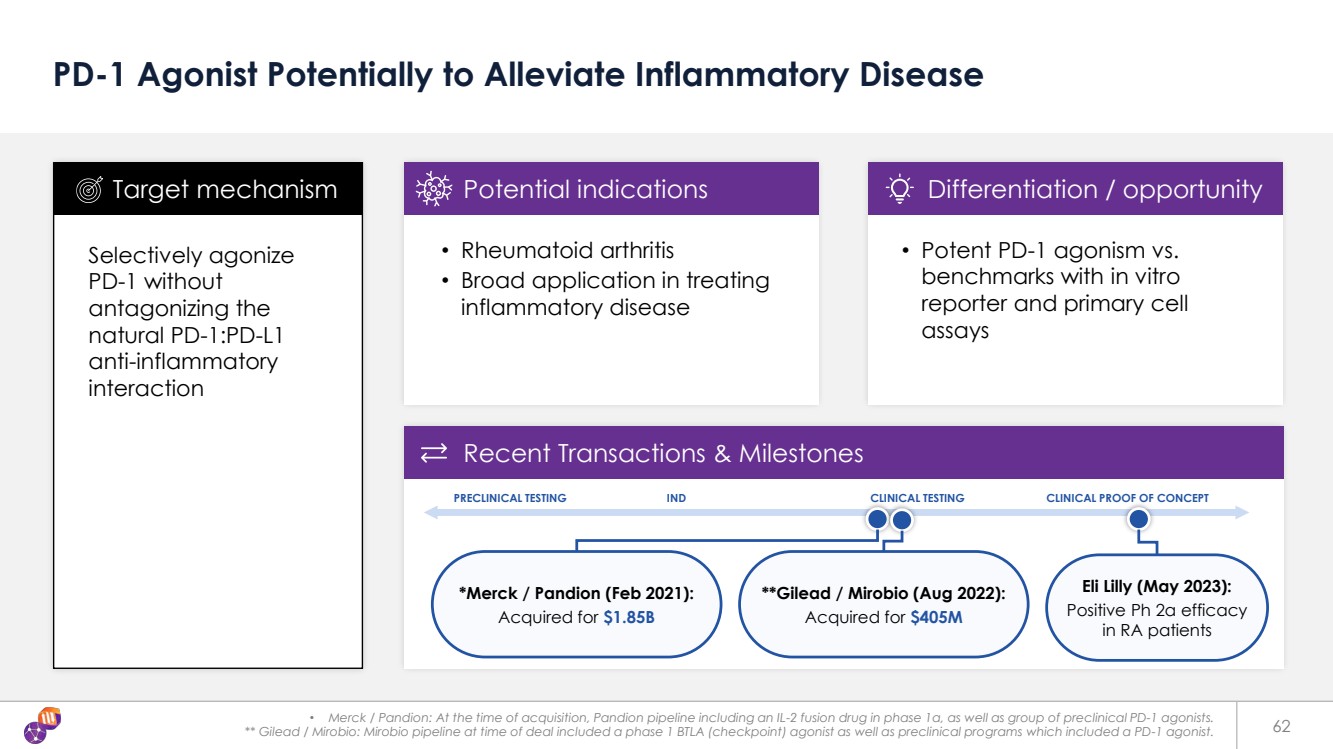
| 62 PD-1 Agonist Potentially to Alleviate Inflammatory Disease Selectively agonize PD-1 without antagonizing the natural PD-1:PD-L1 anti-inflammatory interaction • Rheumatoid arthritis • Broad application in treating inflammatory disease Target mechanism Potential indications Differentiation / opportunity Recent Transactions & Milestones • Potent PD-1 agonism vs. benchmarks with in vitro reporter and primary cell assays **Gilead / Mirobio (Aug 2022): Acquired for $405M *Merck / Pandion (Feb 2021): Acquired for $1.85B PRECLINICAL TESTING IND CLINICAL TESTING CLINICAL PROOF OF CONCEPT Eli Lilly (May 2023): Positive Ph 2a efficacy in RA patients • Merck / Pandion: At the time of acquisition, Pandion pipeline including an IL-2 fusion drug in phase 1a, as well as group of preclinical PD-1 agonists. ** Gilead / Mirobio: Mirobio pipeline at time of deal included a phase 1 BTLA (checkpoint) agonist as well as preclinical programs which included a PD-1 agonist. |
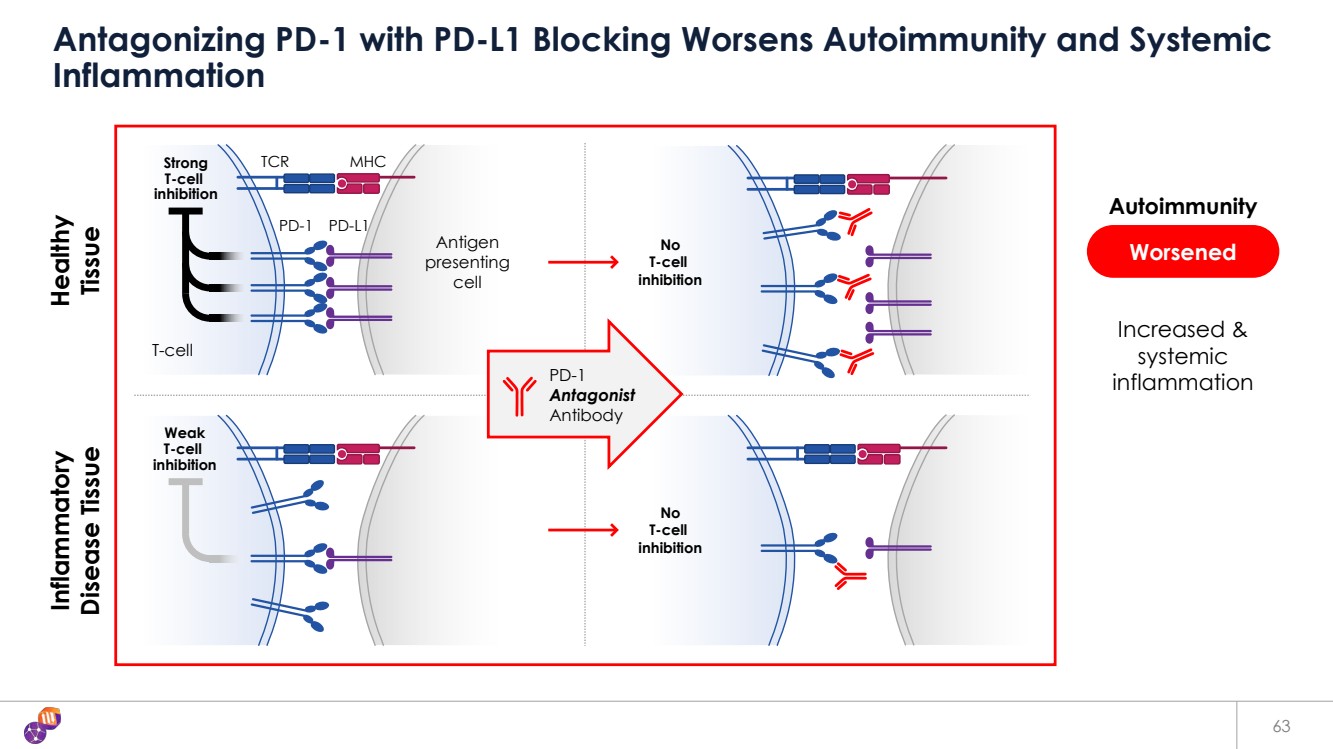
| PD-1 PD-L1 TCR MHC T-cell Antigen presenting cell 63 Antagonizing PD-1 with PD-L1 Blocking Worsens Autoimmunity and Systemic Inflammation Inflammatory Disease Tissue Healthy Tissue Increased & systemic inflammation No T-cell inhibition No T-cell inhibition Worsened Strong T-cell inhibition Weak T-cell inhibition Autoimmunity PD-1 Antagonist Antibody |
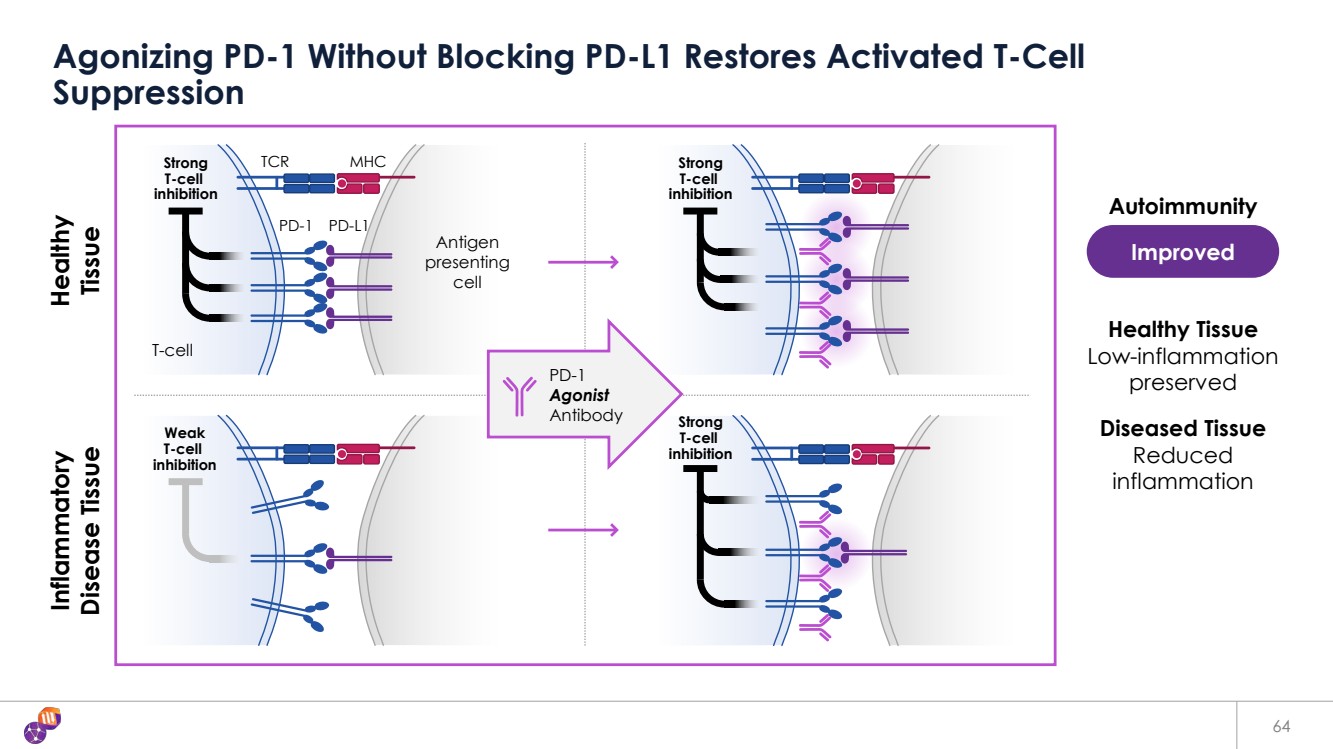
| 64 Agonizing PD-1 Without Blocking PD-L1 Restores Activated T-Cell Suppression Diseased Tissue Reduced inflammation Healthy Tissue Low-inflammation preserved PD-1 PD-L1 Strong TCR MHC T-cell inhibition T-cell Inflammatory Disease Tissue Healthy Tissue Weak T-cell inhibition Strong T-cell inhibition Strong T-cell inhibition Improved Autoimmunity Antigen presenting cell PD-1 Agonist Antibody |
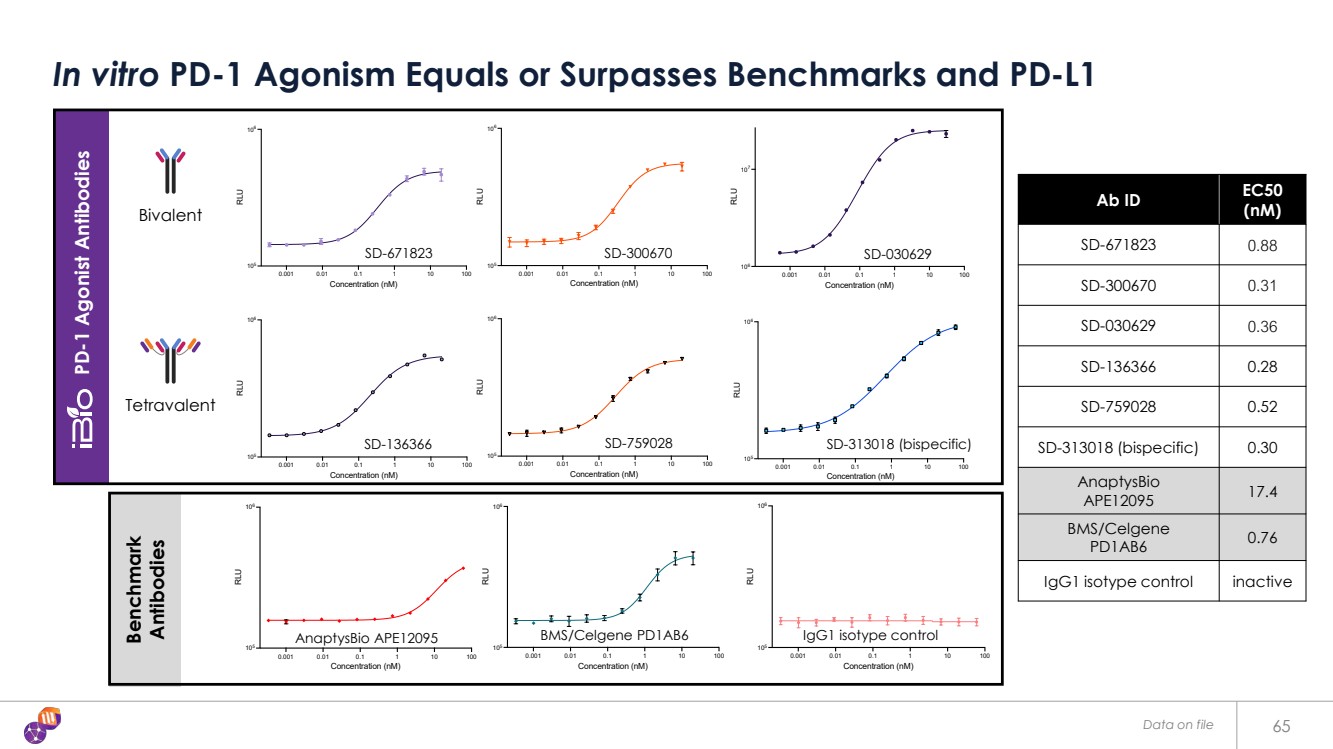
| Benchmark Antibodies PD-1 Agonist Antibodies 65 In vitro PD-1 Agonism Equals or Surpasses Benchmarks and PD-L1 Ab ID EC50 (nM) SD-671823 0.88 SD-300670 0.31 SD-030629 0.36 SD-136366 0.28 SD-759028 0.52 SD-313018 (bispecific) 0.30 AnaptysBio APE12095 17.4 BMS/Celgene PD1AB6 0.76 IgG1 isotype control inactive 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay 07 bivalent 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay H01 bivalent 0.001 0.01 0.1 1 10 100 106 107 Concentration (nM) RLU D4-A7-7_201 EC50: 0.36 ± 0.11 nM D4_A7_7 IgG SD-671823 SD-300670 SD-030629 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay 07 + H01 Tandem bispecific 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay 07 Tandem tetravalent 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay H01 Tandem tetravalent SD-136366 SD-759028 SD-313018 (bispecific) 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay AnaptysBio APE12095 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay BMS/Celgene PD1AB6 0.001 0.01 0.1 1 10 100 105 106 Concentration (nM) RLU PD-1 Agonism Reporter Assay IgG1 Isotype control AnaptysBio APE12095 BMS/Celgene PD1AB6 IgG1 isotype control Tetravalent Bivalent x x Data on file |
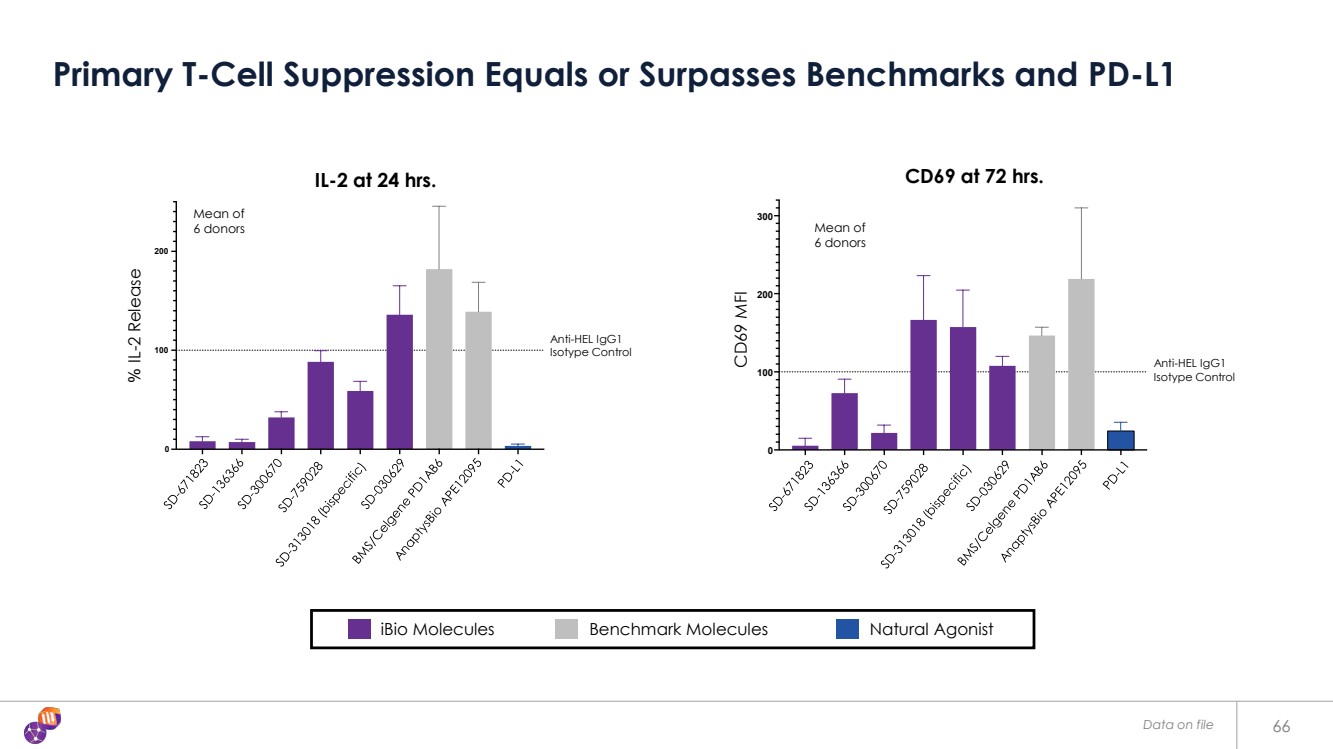
| Data on file 66 Primary T-Cell Suppression Equals or Surpasses Benchmarks and PD-L1 IL-2 at 24 hrs. % IL-2 Release Mean of 6 donors 0 100 200 Anti-HEL IgG1 Isotype Control CD69 at 72 hrs. CD69 MFI Mean of 6 donors 0 100 200 300 Anti-HEL IgG1 Isotype Control iBio Molecules Benchmark Molecules Natural Agonist |