

摩根大通醫療保健會議演講2024年1月10日醫學博士傑伊·杜克總裁兼首席執行官 ©2023 EyePoint Pharmicals, Inc. 版權所有展品 99.1

法律免責聲明 ©2023 EyePoint 製藥公司版權所有根據1995年《美國私人證券訴訟改革法》的定義,本演示文稿中的各種陳述均具有前瞻性,並且本質上受風險、不確定性和可能不準確的假設的影響。所有涉及我們打算、預期、計劃或認為未來可能發生的活動、事件或發展的陳述,包括但不限於通過三期 DAVIO 3 臨牀試驗的頭條數據得出的現有現金資源充足的陳述;我們對包括 EYP-1901 和 EYP-2301 在內的候選產品時機和臨牀開發的預期;EYP-1901 作為嚴重眼部疾病(包括濕性年齡相關性黃斑變性)的新型持續療法的可能性,非增殖糖尿病視網膜病變和糖尿病黃斑水腫;以及我們的長期財務和業務目標和預期,均為前瞻性陳述。可能導致實際結果與我們的前瞻性陳述中表達、預期或暗示的預期結果或其他預期存在重大差異的一些因素是我們業務固有的風險和不確定性,包括但不限於:臨牀試驗的有效性和及時性以及數據的有用性;監管部門批准的及時性;我們獲得所需資金的能力;當前和未來的許可協議的終止或違反;我們對合同研究組織的依賴、共同推廣合作伙伴以及其他外部供應商和服務提供商;指導方針、建議和研究的影響;保護我們的知識產權和避免知識產權侵權;保留關鍵人員;產品責任;行業整合;遵守環境法;製造風險;國際業務運營的風險和成本;我們股價的波動;可能的稀釋;沒有股息;總體商業和經濟狀況不穩定的影響,包括通貨膨脹和利息的變化利率和勞動力市場;以及我們在向美國證券交易委員會提交的文件中描述的其他因素。我們無法保證任何前瞻性陳述中表達、預期或暗示的結果和其他預期能夠實現。包括這些風險在內的各種因素可能導致我們的實際業績和其他預期與前瞻性陳述中表達、預期或暗示的預期業績或其他預期存在重大差異。如果已知或未知風險出現,或者基本假設被證明不準確,則實際結果可能與過去的業績以及前瞻性陳述中的預期、估計或預測的業績存在重大差異。在考慮任何前瞻性陳述時,應牢記這一點。我們的前瞻性陳述僅代表其發表之日。即使經驗或未來的變化明確表明此類陳述中表達或暗示的任何預期業績都無法實現,我們也沒有義務公開更新或修改我們的前瞻性陳述。

©2023 EyePoint 製藥公司版權所有IVT,玻璃體內注射管道利用我們的可生物腐蝕的 Durasert E IVT 輸送技術 EYP-1901 — vorolanib,Durasert E Positive Topline 濕式 2 期數據中的選擇性專利 AMD 濕式 3 期試驗 AMD 計劃於 2024 年下半年啟動 NPDR 的 Topline 2 期數據預計於 2024 年第二季度在第 2 期試驗中給藥的第一位患者 DME;DME 的關鍵數據預計將在 2025 年第一季度發佈 EYP-2301 — razuprotafib,Durasert E Durasert® 中用於嚴重視網膜疾病的專利 TIE-2 激動劑-經過驗證,安全IVT 藥物輸送技術 Bioerodible Durasert E 和不可腐蝕製劑通過四種經美國食品藥品管理局批准的非腐蝕配方的產品安全地注射給成千上萬名患者的眼睛強勁的資產負債表 2023 年 12 月 31 日有超過 3.3 億美元的現金和投資 2023 年 12 月 5 日完成 2.3 億美元的股權融資。通過三期濕式 AMD 關鍵試驗的頭條數據,致力於開發改善嚴重視網膜疾病患者生活的療法
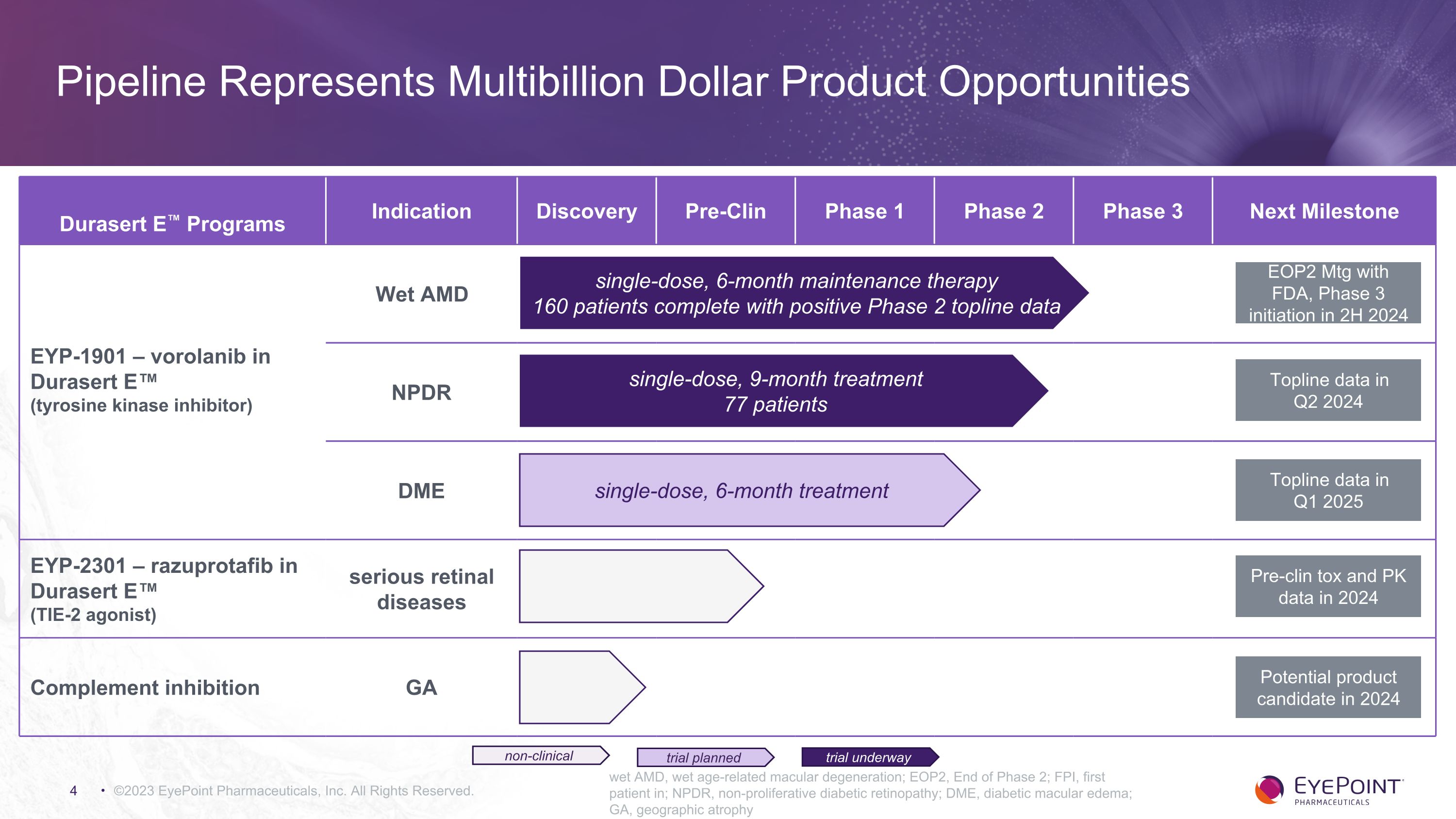
©2023 EyePoint Pharmicals, Inc. 版權所有。濕性 AMD,濕性年齡相關性黃斑變性;EOP2,第二期結束;FPI,首位患者;NPDR,非增殖性糖尿病視網膜病變;DME,糖尿病黃斑水腫;GA,地理萎縮 Durasert E 項目適應症發現臨牀前 1 期 2 期 3 期下一個里程碑 EYP-1901 — vorolanib Durasert E(酪氨酸激酶抑制劑)Wet AMD NPDR DME EYP-2301 — razuprotafib 用於 Durasert E(TIE-2 激動劑)嚴重視網膜疾病中的補體抑制 GA EOP2 Mtg,第 3 階段於 2 小時啟動2024 年第二季度的關鍵數據 2025 年第一季度的 Topline 數據 2024 年的臨牀前毒素和 PK 數據 2024 年的潛在候選產品試驗正在進行中的非臨牀單劑量 6 個月維持療法 160 名患者完成單劑量、9 個月的治療 77 名患者單劑量、6 個月的治療管道代表數十億美元的產品機會
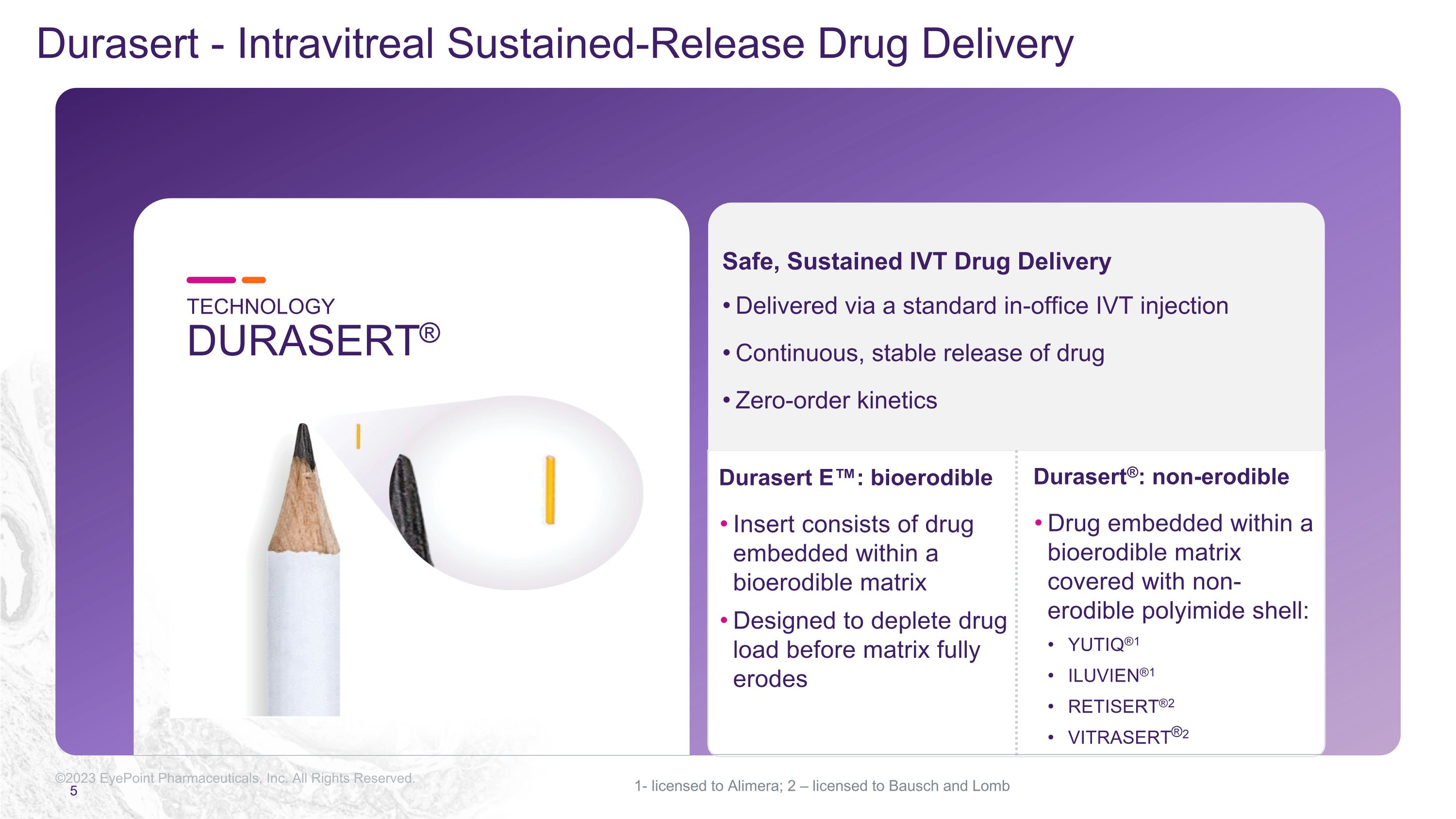
©2023 EyePoint 製藥公司版權所有通過標準的室內 IVT 注射劑實現安全、持續的 IVT 藥物輸送持續、穩定地釋放藥物零階動力學 Durasert®:嵌入在覆蓋有不可腐蝕聚酰亞胺外殼的可生物腐蝕基質中的非腐蝕性藥物:YUTIQ® 1 ILUVIEN® 1 RETISERT® 1 RETISERT® 2 VITRASERT® 2 Durasert E:可生物腐蝕性插入物由嵌入生物二極管內的藥物組成 ble matrix 專為在基質完全腐蝕之前消耗藥物負荷而設計 TECHNOLOGYDURASERT® 1-已獲得 Alimera 的許可;2 — 向 Bausch 和 Lomb Durasert 授權-玻璃體內緩釋藥物輸送

©2023 EyePoint 製藥公司版權所有。SoC,護理標準;ANG,血管生成素;PDGF(R),血小板衍生生長因子(受體);PLGF,胎盤生長因子;TIE-2,酪氨酸蛋白激酶受體 TIE-2;VEGF(R),血管內皮生長因子(受體)。有效和選擇性的 pan—VEGF 受體抑制 2037 年的物質組成專利(可能的專利期限延長至 2042 年)在經過驗證的視網膜脱離動物模型中顯示出神經保護作用阻斷 PDGF 減少脱靶結合-在臨牀相關劑量下不抑制 TIE-2 Vorolanib 通過阻斷 VEFG 的所有異構體為血管內皮生長因子介導的視網膜疾病的治療帶來潛在的新 MOA 和 PDGF

©2023 EyePoint 製藥公司版權所有。每片玻璃體積約為 1/5000 通過標準玻璃體內注射技術送達醫生辦公室立即進行生物利用,首先釋放藥物,然後零階動力學釋放持續約 9 個月 1 期 DAVIO 和 2 期 DAVIO 2 臨牀試驗的陽性療效數據正在進行的 2 期臨牀試驗中良好的安全性數據在環境温度下發貨和儲存 EYP-1901:受體結合沃羅拉尼布在 Bioerodible Durasert E 中 IVEGF — 血管內皮生長因子:AMD — 與年齡相關的黃斑變性;

©2023 EyePoint 製藥有限公司。版權所有。第 2 階段 DAVIO 2 臨牀試驗標題結果是一項非劣質試驗,與 AFLIBERCEPT 對照組相比

©2023 EyePoint 製藥公司版權所有DAVIO 2 臨牀試驗一項評估濕性 AMD 中兩劑阿立西普對照組的非劣勢試驗 DAVIO 2 臨牀試驗旨在評估濕性 AMD 中的 EYP-1901 並支持基於 C 型臨牀試驗與美國食品藥品管理局會談的 3 期臨牀試驗設計:針對先前接受過濕式 AMD 抗 VEGF 補充劑的患者的多中心、隨機、雙面試驗:使用 75 微米的新液體丟失 5 封信其他標準 10 字母由於潮濕的 AMD 100 微米新液體而流失 x 2 次就診濕性 AMD 研究人員出現新的視網膜出血 EYP-1901自由裁量主要結果:第1天至第28周和第32周BCVA的平均變化差異(混合)關鍵次要終點:安全性、減輕治療負擔、六個月內不使用眼部補充劑的百分比和解剖學結果
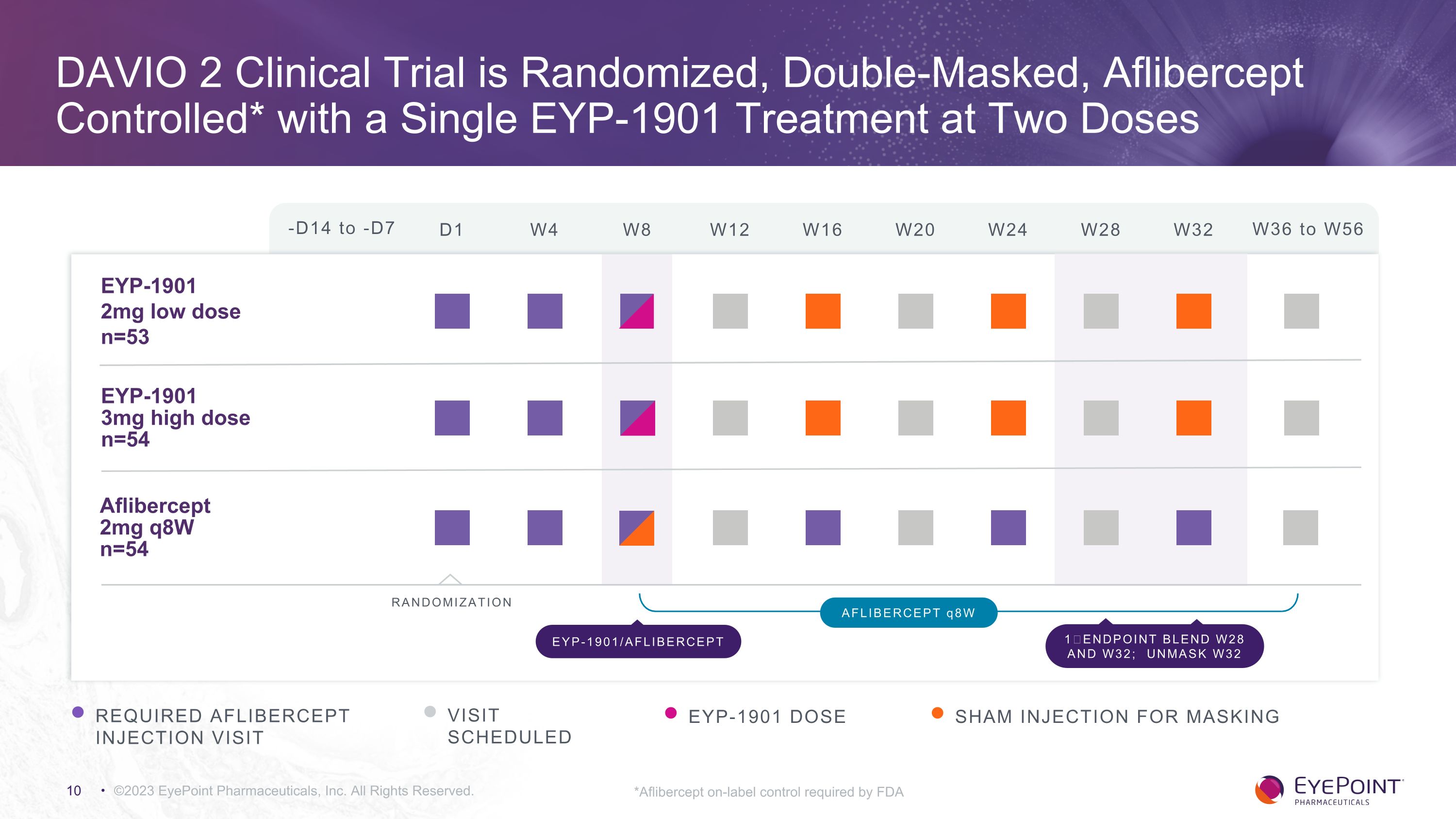
DAVIO 2 臨牀試驗採用隨機、雙面罩、Aflibercept 控制*,採用單劑量 EYP-1901 治療 ©2023 EyePoint Pharmicals, Inc. 版權所有。-D14 到-D7 D1 W4 W8 W12 W16 W24 W32 W36 到 W56 W20 W28 EYP-1901 2mg 低劑量 n=53 EYP-1901 3mg 高劑量 n=54 Aflibercept 2mg q8w n=54 需要隨機分組 aflibercept 訪問預定劑量 aflibercept q8w EYP-1901/AFLIBERCEPT 1BLEND W28 和 W32; UNMASK W32 用於掩蓋的假冒注射 *FDA 要求的 Aflibercept 標籤上控制 EYP-1901
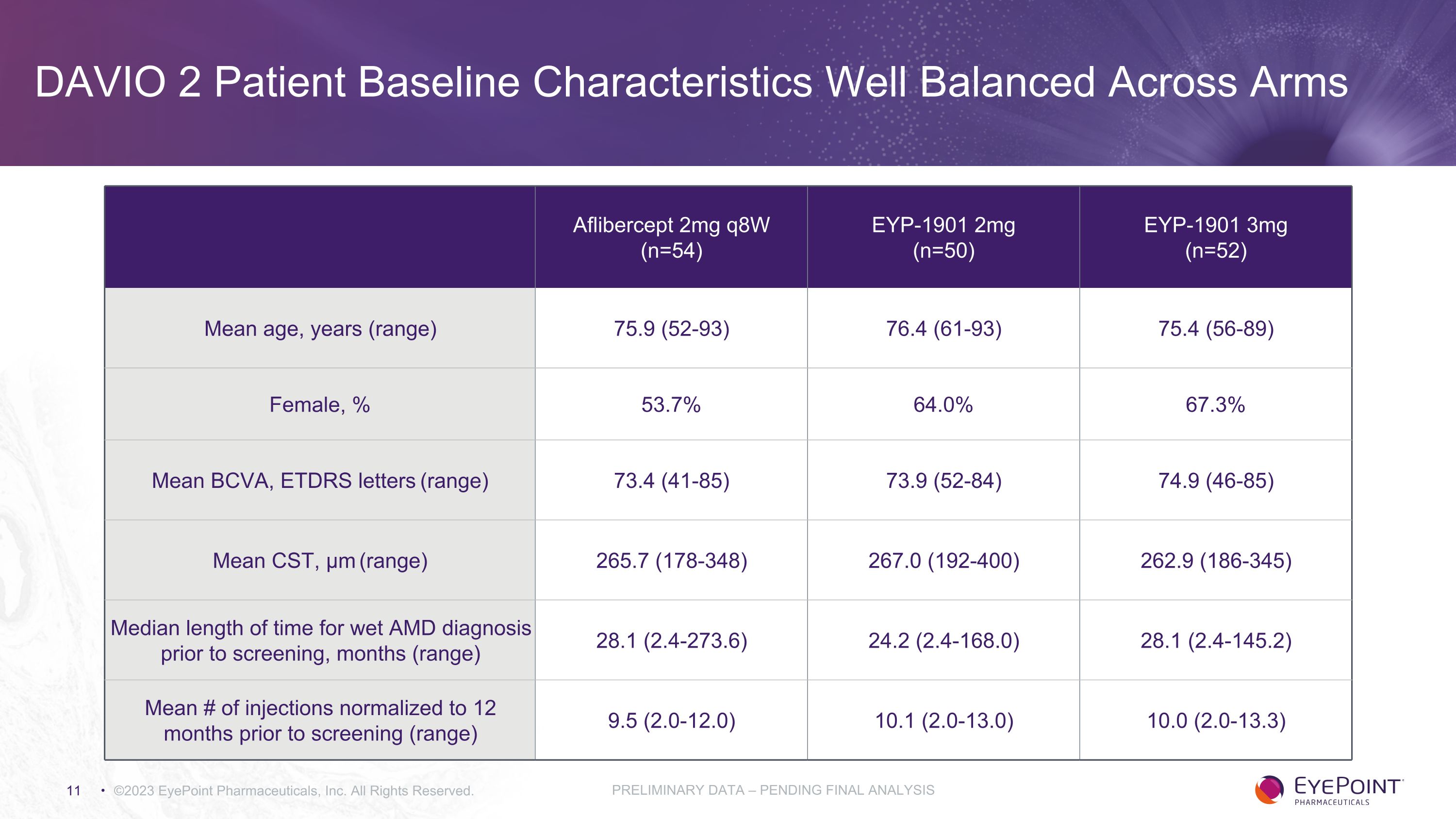
DAVIO 2 患者基線特徵在兩臂之間保持良好平衡 ©2023 EyePoint Pharmicals, Inc. 版權所有。Aflibercept 2mg q8w (n=54) EYP-1901 2mg (n=50) EYP-1901 3mg (n=52) 平均年齡、年齡(範圍)75.9 (52-93) 76.4 (61-93) 75.4 (56-89) 75.4 (56-89) 女性,% 53.7% 64.0% 67.3% 平均值 BCVA,ETDRS 字母(範圍)73.4(41-85)73.9(52-84)) 74.9 (46-85) 平均值 CST,μm(範圍)265.7(178-348)267.0(192-400)262.9(186-345)篩查前 AMD 濕式診斷的平均時長,月數(範圍)28.1(2.4-273.6)24.2(2.4-168.0)28.1(2.4-145.2)平均注射次數恢復到篩查前 12 個月(範圍) 9.5 (2.0-12.0) 10.1 (2.0-13.0) 10.0 (2.0-13.3) 初步數據 —尚待最終分析
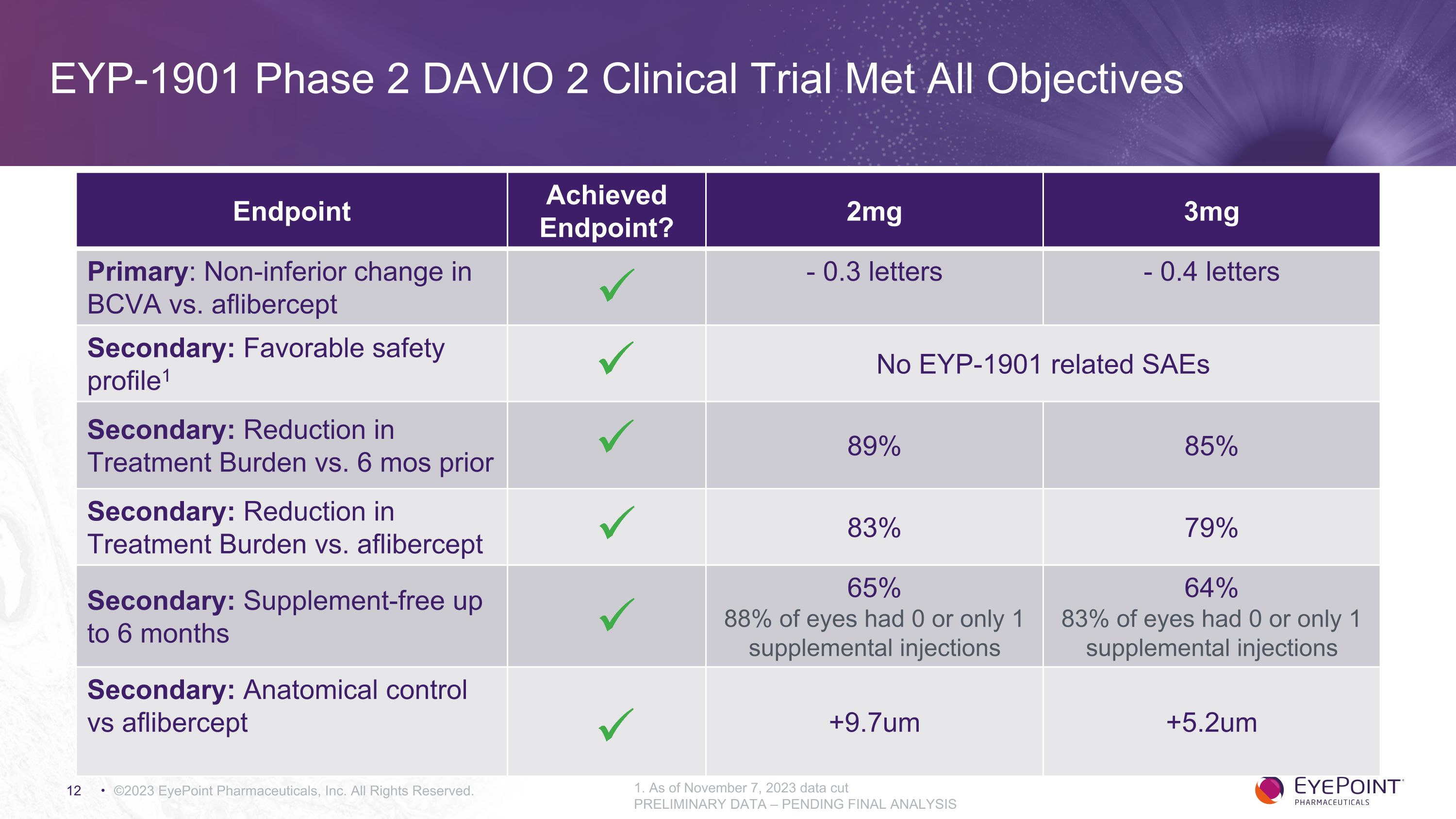
EYP-1901 二期 DAVIO 2 臨牀試驗已實現所有目標 ©2023 EyePoint 製藥公司版權所有。1.截至2023年11月7日,數據削減了初步數據——待最終分析終點已達到終點?2mg 3mg 初級:BCVA 與 aflibercept 的變化不遜色-0.3 個字母-0.4 個字母次要:良好的安全特徵1 沒有 EYP-1901 相關的 SAE 次要的:治療負擔較前 6 個月 89% 85% 次要:治療負擔與 aflibercept 相比減輕 83% 79% 次要:6個月內無補充劑 65% 88% 的眼睛進行了 0 次或只注射 1 次 64% 83% 只注射了 0 次或只有 1 次輔助注射:解剖學對比 aflibercept +9.7um +5.2um
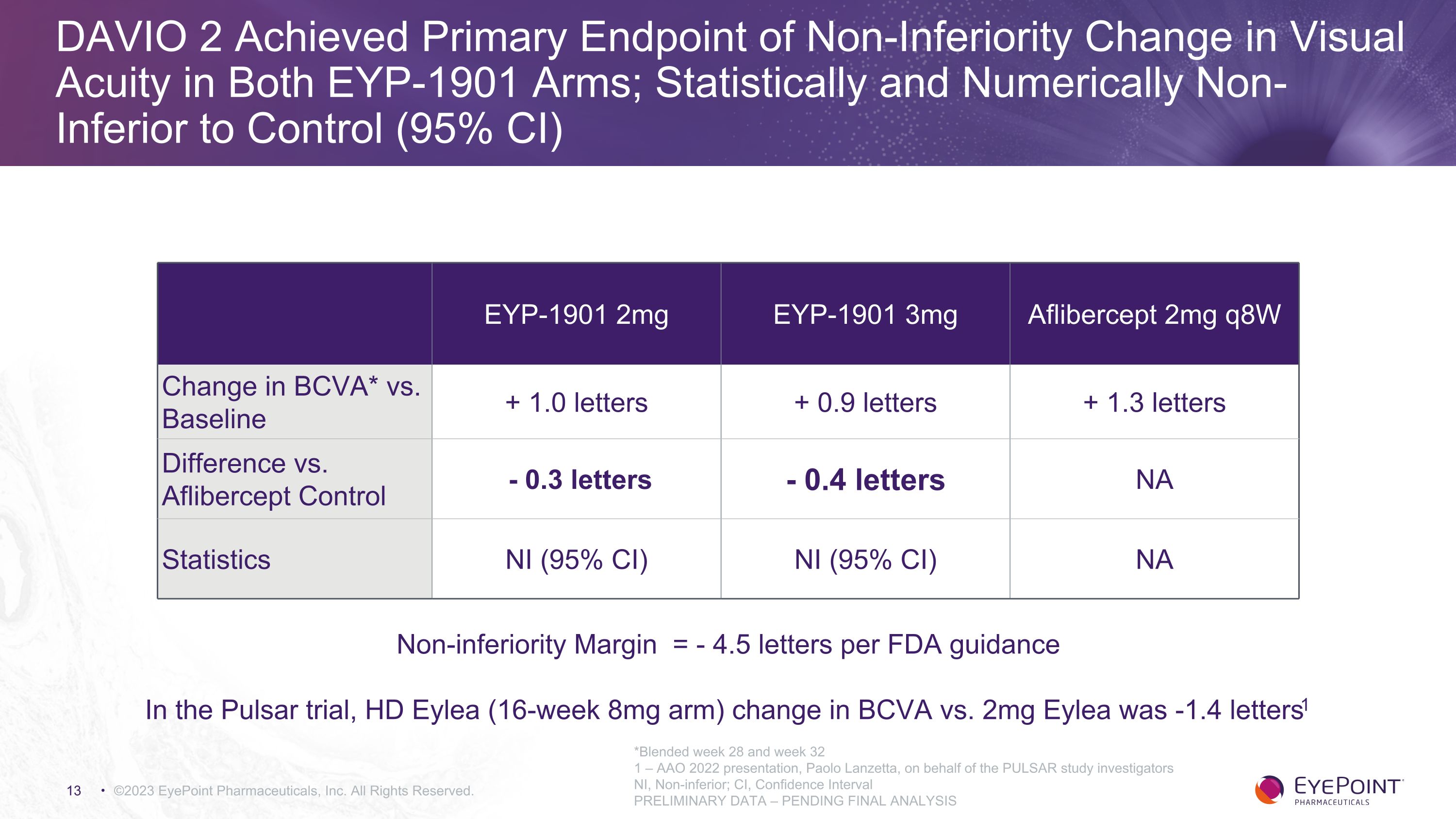
DAVIO 2 實現了兩個 EYP-1901 組視力非劣勢變化的主要終點;統計和數值均不低於對照組(95% 置信區間)©2023 EyePoint Pharmaceuticals, Inc. 版權所有。EYP-1901 2mg EYP-1901 3mg Aflibercept 2mg q8w BCVA* 與基線的變化 + 1.0 個字母 + 0.9 個字母 + 1.3 個字母與 Aflibercept 對照的區別-0.3 個字母 NI (95% CI) NI (95% CI) NA *混合第 28 周和第 32 周 1 — AAO 2022年演講,保羅·蘭澤塔代表 PULSAR 研究調查者 NI,非劣等;CI,信心間隔初步數據 — 待最終分析非劣勢差距 =-根據美國食品藥品管理局的指導方針 4.5 個字母在 Pulsar 試驗中,HD Eylea(16 周 8 毫克手臂)與 2mg Eylea 的變化為 -1.4 個字母1
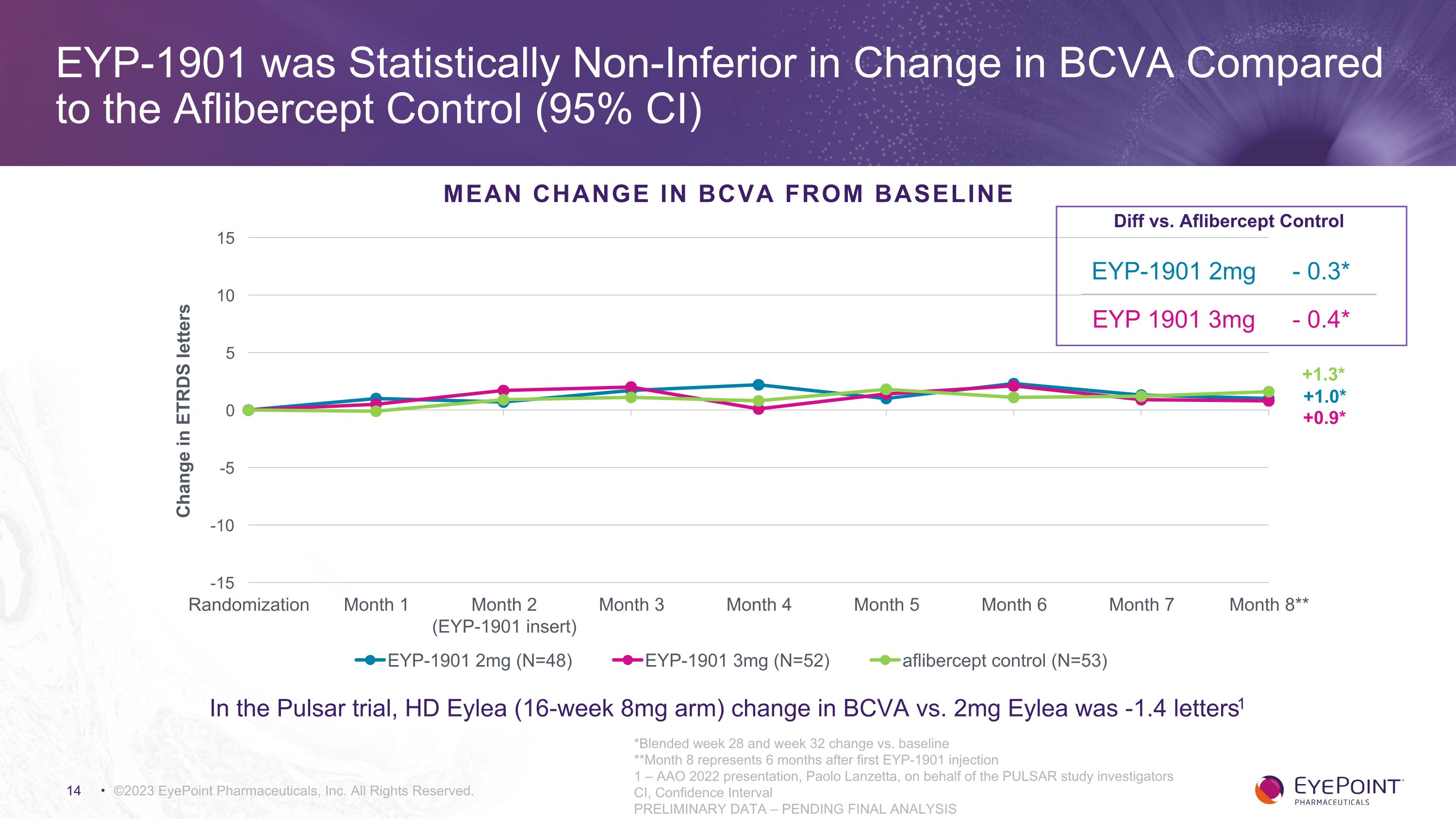
©2023 EyePoint Pharmicals, Inc. 版權所有。+0.9* +1.3* 統計學上,與阿弗西普對照組相比,EYP-1901 BCVA 的變化並不遜色(95% 置信區間)BCVA 與基線的平均變化 EYP-1901 2mg-0.3* EYP 1901 3mg-0.4* 與 Aflibercept 對照組的差異 *第 28 周和第 32 周與基線的混合變化 **第 8 個月表示 6 個月後第一次 EYP-1901 注射 1 — AAO 2022年演講,保羅·蘭澤塔代表 PULSAR 研究調查人員 CI,置信區間初步數據 — 待最終分析在 Pulsar 試驗中,HDEylea(16 周 8 毫克手臂)BCVA 與 2mg 的變化 Eylea 為 -1.4 個字母1

EYP-1901 在第二階段 DAVIO 2 臨牀試驗中表現出良好的安全性1 ©2023 EyePoint Pharmicals, Inc. 版權所有。SAE,嚴重不良事件;AE,不良事件;IVT,玻璃體內注射初步數據截止——待最終分析 1-截至2023年11月7日,研究人員認為沒有報告與EYP-1901相關的眼部或全身性 SAE 研究眼睛中報告了四種眼部 SAE ——均未被視為 EYP-1901 相關2 > 97% 的報告不良反應為輕度(1 級或 2 級),通常在進行靜脈注射時預計會出現無插入向前房遷移無視網膜閉塞性血管炎患者停藥率低至第 32 周患者停藥率為 4% 無中斷與 EYP-1901 有關治療

在第二階段 DAVIO 2 試驗中,所報告的 SAE 發生在注射阿立西普或帕拉塞普後,被認為與 EYP-19011 無關 ©2023 EyePoint Pharmicals, Inc. 版權所有。SAE,嚴重不良事件;CPAP,持續氣道正壓初步數據截止——待最終分析 1-截至 2023 年 11 月 7 日,數據已刪除 2-研究人員認為,研究眼中報告的四種眼部 SAE ——均在第 1 周確定與 EYP-19012 視網膜脱離無關;首次注射阿弗西普一週後,第 32 周注射 EYP-1901 之前細菌性眼內炎;前房隔兩天後在第 29 周使用 CPAP 非傳染性眼內炎的患者進行穿刺術;注射 aflibercept 七天後 Retinal第 36 周流淚;注射阿佛西普四周後
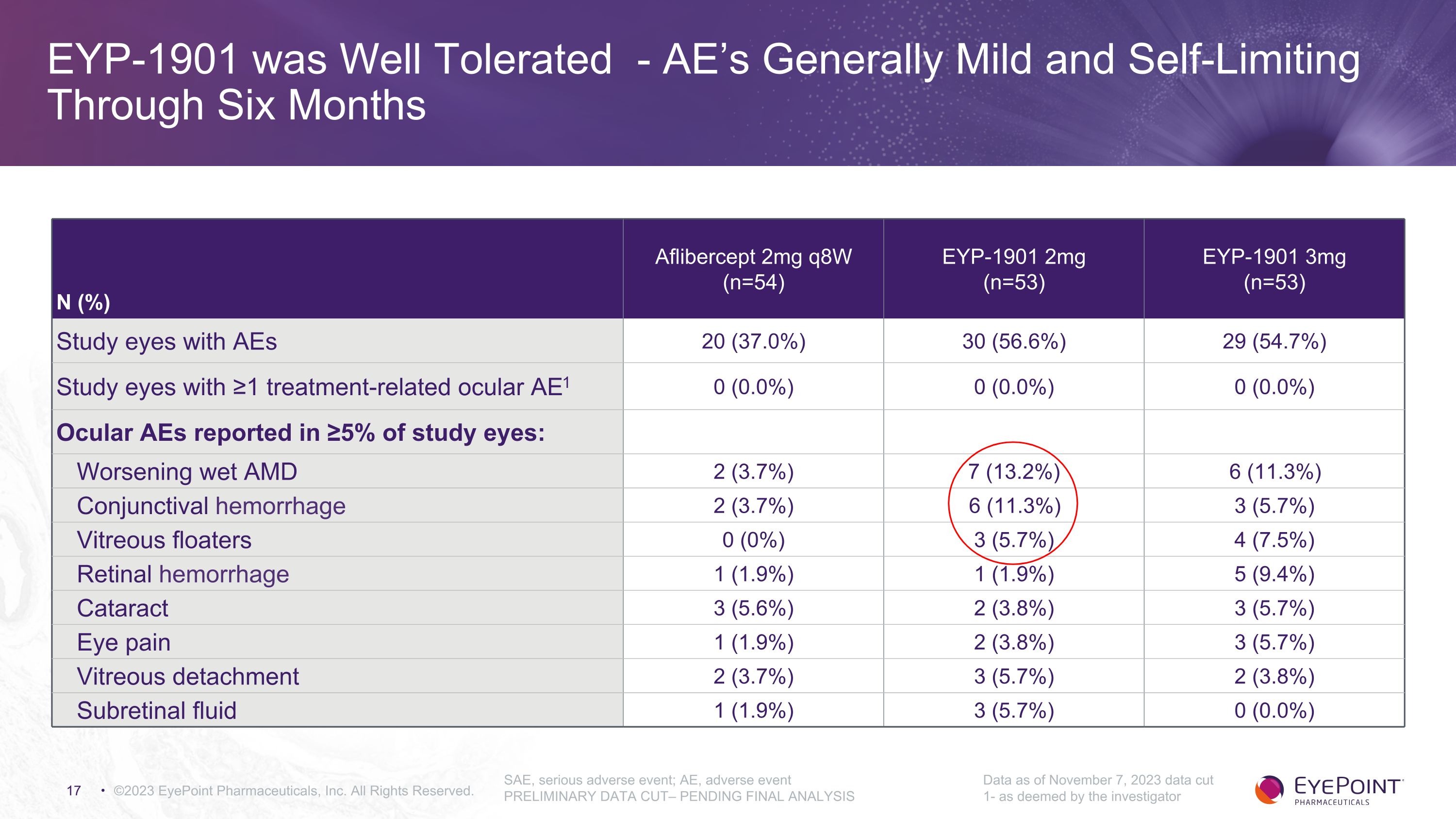
EYP-1901 耐受性良好-AE 通常為温和且自限性持續六個月 ©2023 EyePoint Pharmicals, Inc. 版權所有SAE,嚴重不良事件;AE,不良事件初步數據截止——待最終分析數據截至 2023 年 11 月 7 日 1-研究人員認為 N (%) Aflibercept 2mg q8w (n=54) EYP-1901 2mg (n=53) EYP-1901 3mg (n=53) AEs 20 (37.0%) 30 (56.6%) 29 (54.7%) ≥1 的研究眼睛大於 5% 的研究眼睛中報告眼部不良反應 0 (0.0%) 0 (0.0%) 0 (0.0%):濕性 AMD 2 (3.7%) 7 (13.2%) 6 (11.3%) 6 (11.3%) 6 (3.7%) 6 (3.7%) 6 (11.7%) 6 (11.7%) 6 (11.7%) 3 (5.7%) 3 (7.5%) 4 (7.5%) 視網膜出血 1 (1.9%) 1 (1.9%) 5 (9.4%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 1 (1.9%) 2 (3.8%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 3 (5.7%) 0 (0.0%)
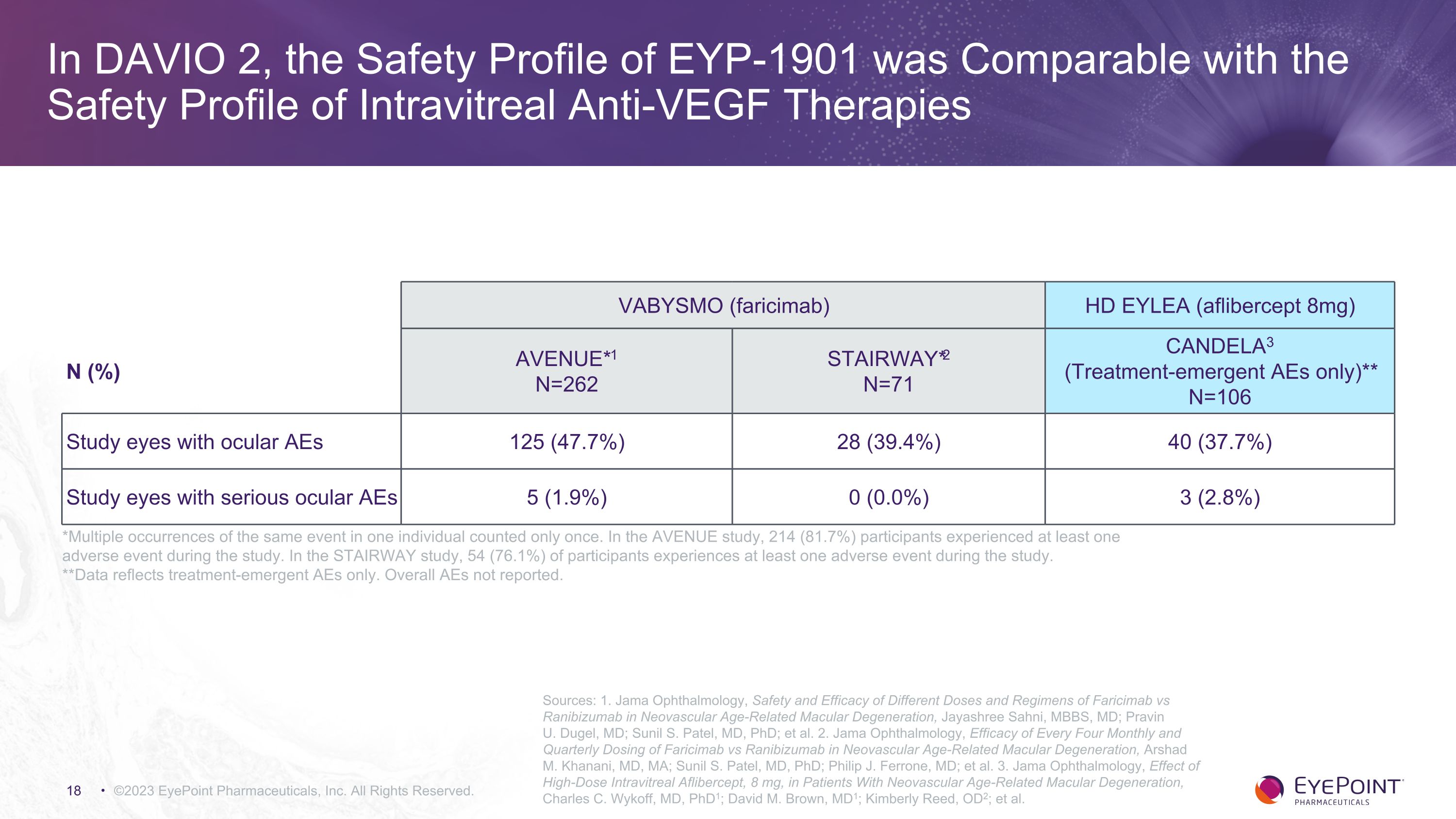
在 DAVIO 2 中,EYP-1901 的安全概況與玻璃體內抗血管內皮生長因子療法的安全概況相當 ©2023 EyePoint Pharmicals, Inc. 版權所有。*同一事件在一個人中多次出現僅計算一次。在AVENUE研究中,有214名(81.7%)的參與者在研究期間經歷了至少一次不良事件。在STAIRWAY研究中,54%(76.1%)的參與者在研究期間經歷過至少一次不良事件。**數據僅反映治療中的急性不良反應。未報告總體不良事件。VABYSMO (faricimab) HD EYLEA (aflibercept 8mg) N (%) AVENUE*1 N=262 STAIRWAY*2 N=71 CANDELA3(僅限治療緊急AE)** N=106 有眼動不良的研究眼睛 125 (47.7%) 28 (39.4%) 40 (37.7%) 有嚴重眼部不良反應的研究眼睛 5 (1.9%) 0 (0.0%) 3(2.8%)資料來源:1.Jama 眼科,法裏西單抗與雷尼珠單抗不同劑量和方案在新生血管年齡相關性黃斑變性中的安全性和有效性,Jayashree Sahni,MBBS;Pravin U. Dugel,醫學博士;Sunil S. Patel,醫學博士;等。2.Jama Othalmology,每四個月和每季度給藥法瑞西單抗與雷尼珠單抗治療新生血管年齡相關性黃斑變性的療效,Arshad M. Khanani,醫學博士,醫學博士,醫學博士,Arshad M. Khanani;醫學博士 Sunil S. Patel;醫學博士;Philip J. Ferrone,醫學博士;等。3.Jama Othalmology,大劑量玻璃體注射 Aflibercept,8 mg,對新生血管年齡相關性黃斑變性患者的影響,Charles C. Wykoff,醫學博士,pHd1;David M. Brown,MD1;Kimberly Reed,OD2;等

©2023 EyePoint 製藥公司版權所有。截至 2023 年 11 月 7 日的數據 1-Data 為初步數據,尚待研究完成和最終報告。SAE,嚴重不良事件摘要:DAVIO(第 1 期):17 名患者接受了 DAVIO 2(第 2 期)1:102 名患者接受了 PAVIA(第 2 期)1:約 51 名患者在 EYP-1901 注射後至少六個月內治療了大約 170 名接受治療的患者,但沒有與 EYP-1901 相關的眼部或全身 SAE 的 EYP-1901 在多項臨牀試驗中繼續顯示出良好的安全性
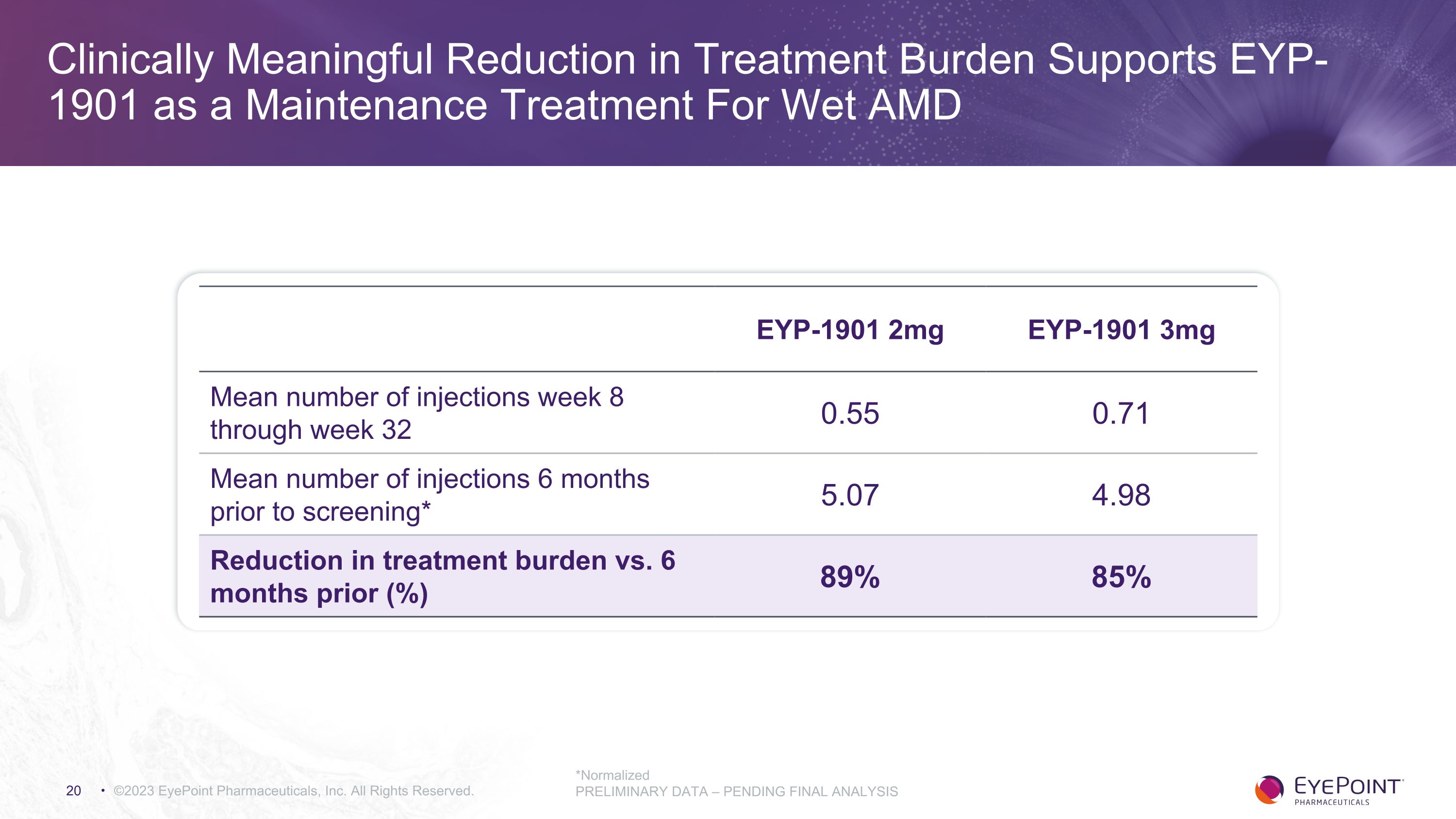
臨牀上有意義的減少治療負擔支持 EYP-1901 作為濕性 AMD 的維持療法 ©2023 EyePoint Pharmicals, Inc. 版權所有。*標準化初步數據 — 待最終分析 EYP-1901 2mg EYP-1901 3mg 第 8 周至第 32 周的平均注射次數 0.55 0.71 篩查前 6 個月的平均注射次數* 5.07 4.98 治療負擔與 6 個月前相比有所減少 (%) 89% 85%
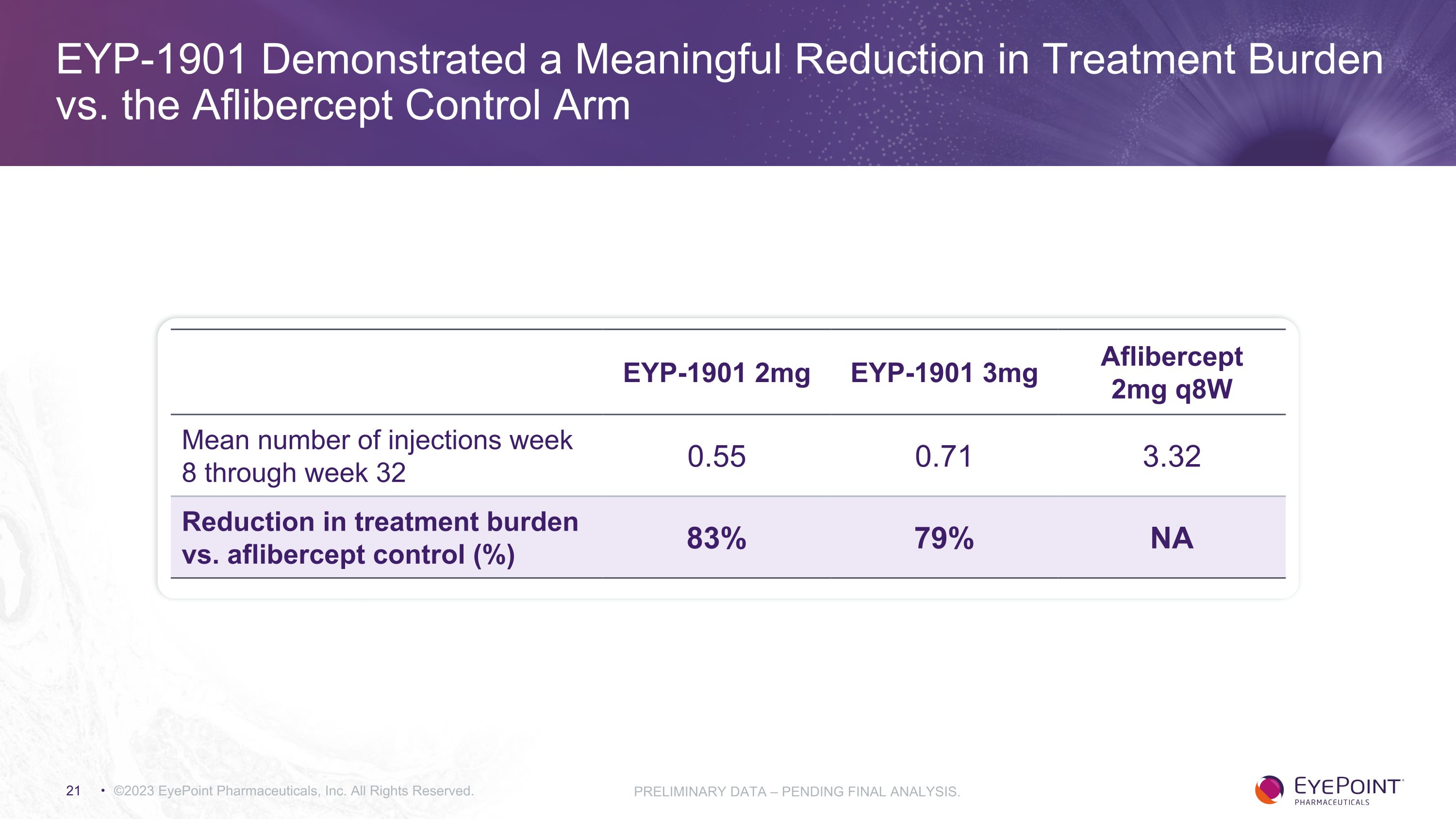
與 Aflibercept 對照組相比,EYP-1901 顯著減輕了治療負擔 ©2023 EyePoint Pharmicals, Inc. 版權所有。初步數據 — 尚待最終分析。EYP-1901 2mg EYP-1901 3mg Aflibercept 2mg q8w 第 8 周至第 32 周的平均注射次數 0.55 0.71 3.32 與阿弗西普對照組相比,治療負擔減輕(%)83% 79% NA

EYP-1901 顯示出具有臨牀意義的無補充劑費率 ©2023 EyePoint 製藥公司版權所有初步數據 — 尚待最終分析 EYP-1901 2MG EYP-1901 3mg 無補充劑率 65% 88% 的眼睛接受了 0 次或只注射 1 次補充注射 64% 83% 的眼睛接受了 0 次或只注射 1 次補充劑的患者百分比患者百分比在給藥 EYP-1901 後的六個月內無需補充

在接受 EYP-1901 治療的眼睛中,將近三分之二在單次注射後的六個月內無需補充劑 ©2023 EyePoint Pharmicals, Inc. 版權所有。*首次就診患者有資格獲救 **第 8 個月代表 EYP-1901 注射後 6 個月初步數據 — 待最終分析 100% 按月分列的無補充劑率摘要 100%
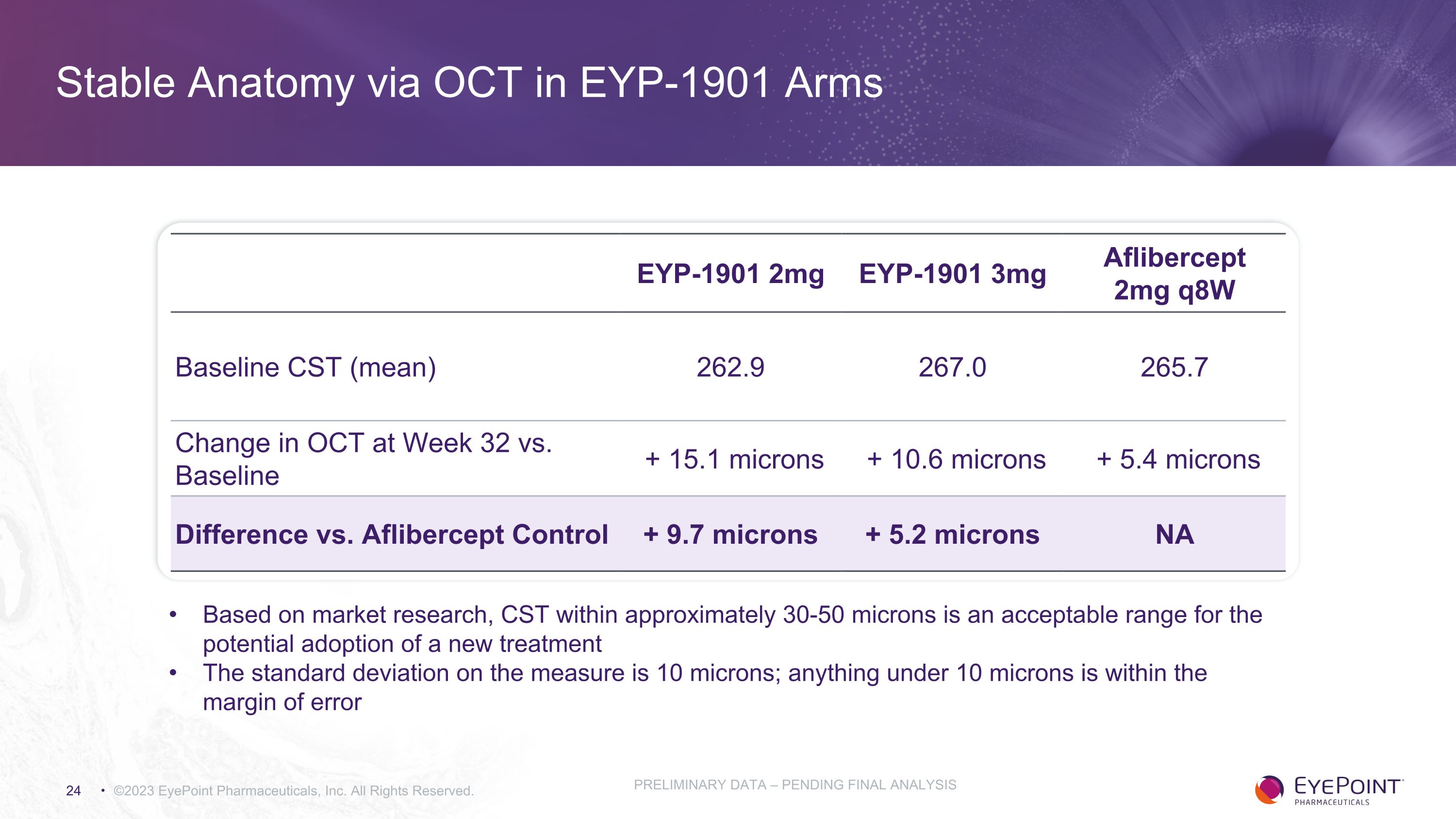
EYP-1901 武器中通過 OCT 實現穩定解剖學 EYP-1901 2mg EYP-1901 3mg Aflibercept 2mg q8w 基線 CST(平均值)262.9 267.0 265.7 第 32 周 OCT 與基線的變化 + 15.1 微米 + 10.6 微米 + 5.4 微米與 Aflibercept 對照組的差異 + 9.7 微米 + 5.2 微米 NA ©2023 EyePoint Pharmicals, Inc. 版權所有。初步數據 — 待最終分析根據市場研究,大約30-50微米內的CST是可能採用新療法的可接受範圍。測量標準差為10微米;低於10微米的任何值都在誤差範圍內
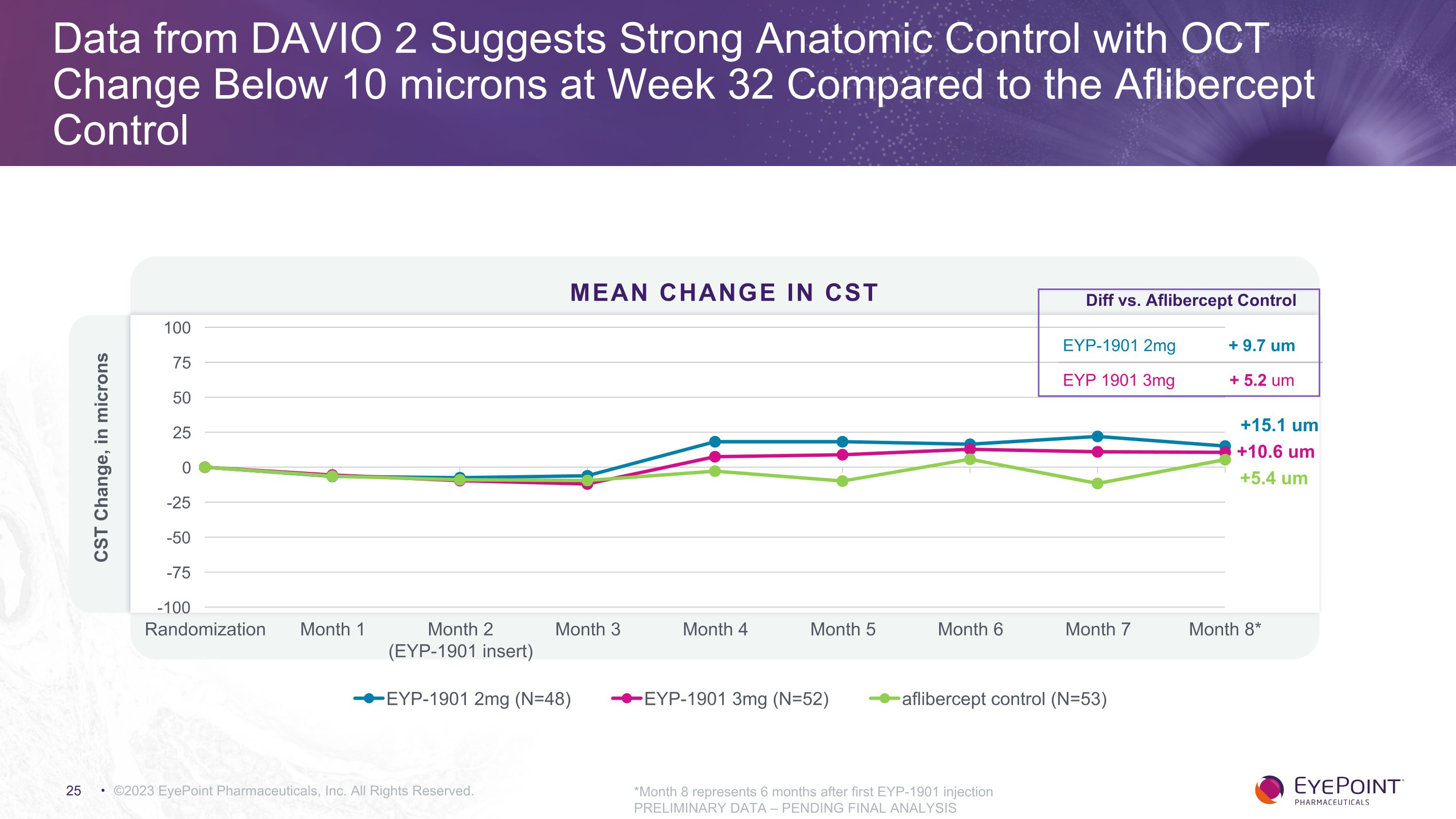
來自DAVIO 2的數據表明,與Aflibercept對照組相比,第32周OCT變化低於10微米,解剖學控制力強 ©2023 EyePoint Pharmicals, Inc. 版權所有。*第 8 個月代表首次注射 EYP-1901 後的 6 個月初步數據 — 待最終分析 CST 的平均變化 +10.6 um +15.1 um +5.4 um EYP-1901 2mg + 9.7 um EYP 1901 3mg + 5.2 um 與 Aflibercept 對照組的差異

©2023 EyePoint 製藥公司版權所有對不含抗血管內皮生長因子補充劑的患者進行第 2 階段 DAVIO 2 亞組分析,最長可達 6 個月

©2023 EyePoint Pharmicals, Inc. 版權所有。+1.9* +2.4* +1.8* *第 28 周和第 32 周與基線置信區間的混合變化,置信區間初步數據 — 待最終分析 EYP-1901 顯示 BCVA 變化在患者亞組分析中具有數值優勢無補充劑最多 6 個月患者亞組分析 BCVA 與基線 EYP-1901 2mg + 0.6* EY* 1901 3mg + 0.1* 與 Aflibercept 對照組的差異
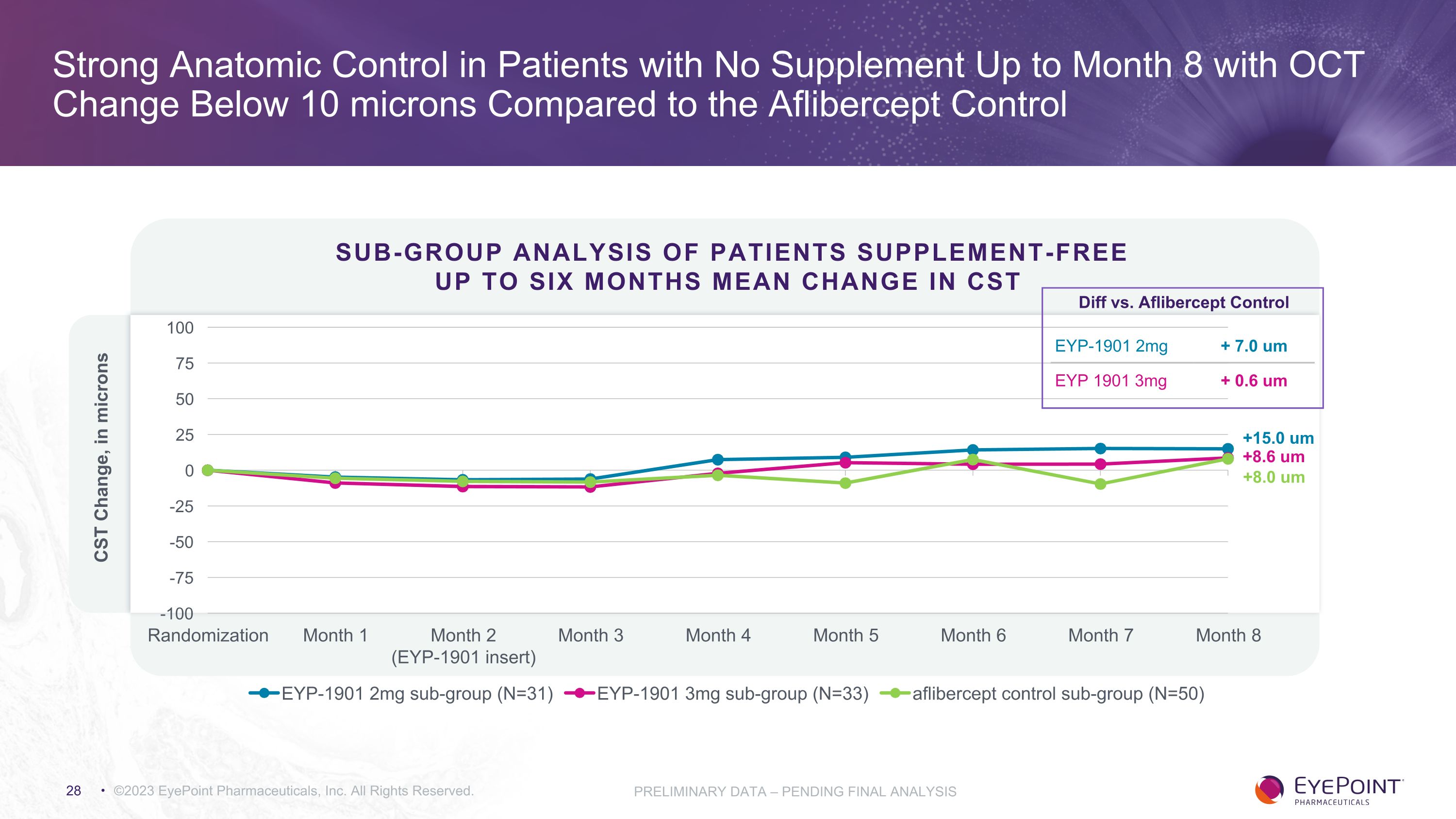
與Aflibercept對照組相比,對不超過8個月沒有補充劑且OCT變化低於10微米的患者實行強有力的解剖學控制 ©2023 EyePoint 製藥公司版權所有。初步數據 — 待最終分析患者分組分析不含補充劑最多六個月的 CST 平均變化 +8.6 um +15.0 um +8.0 um 與 Aflibercept 對照組的差異 EYP-1901 2mg + 7.0 um EYP 1901 3mg + 0.6 um
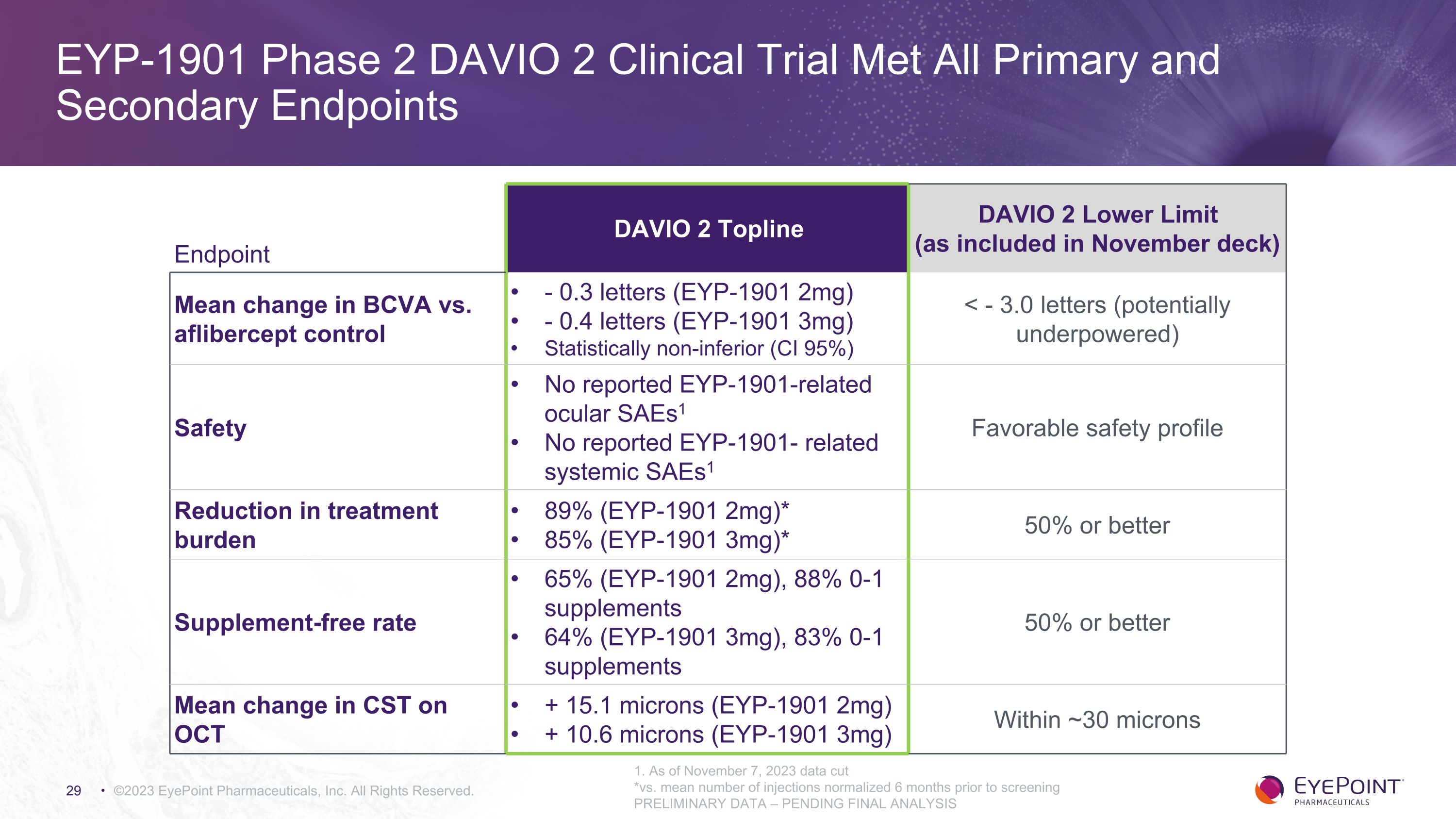
©2023 EyePoint 製藥公司版權所有。1.截至2023年11月7日,數據削減*與篩查前6個月恢復正常的平均注射次數相比初步數據——待最終分析終點 DAVIO 2 頂線 DAVIO 2 下限(包含在 11 月套牌中)BCVA 與 aflibercept 對照的平均變化-0.3 個字母(EYP-1901 2mg)-0.4 個字母(EYP-1901 3mg)統計學上不遜色(CI 95%)

©2023 EyePoint 製藥公司版權所有初步的第三階段關鍵試驗概述與AFLIBERCEPT對照組的非劣勢試驗

陽性的 DAVIO 2 數據支持濕式 AMD 向非劣等級 3 期關鍵試驗的推進 ©2023 EyePoint Pharmicals, Inc. 版權所有。DAVIO 2 和 3 期 Pivotal 試驗計劃由與 FDA 舉行的 C 型會議提供信息,符合隨後的非劣勢臨牀試驗濕式 AMD 指導方針草案。3 期非劣勢試驗設計與 DAVIO 2 類似,不同之處是:每隔六個月重新注射 EYP-1901 主要療效終點在 12 個月混合時進行主要療效終點(保密協議提交的依據)安全性監測長達 24 個月;計劃提交 12 個月安全數據 Aflibercept 對照組僅在最初的 12 個月內進行了兩項註冊試驗:美國和 OUS DAVIO 2 的平行統計數據如果置信區間較高,則表明規模明顯縮小、成本更低的 3 期試驗 EYP-1901 劑量可能為 1 或 2 次(而 DAVIO 2 中為 2 或 3 次)預計於 2024 年下半年啟動首項關鍵試驗 FDA、食品藥品監督管理局;NDA,新藥申請;OU,美國以外地區;CI,置信區間
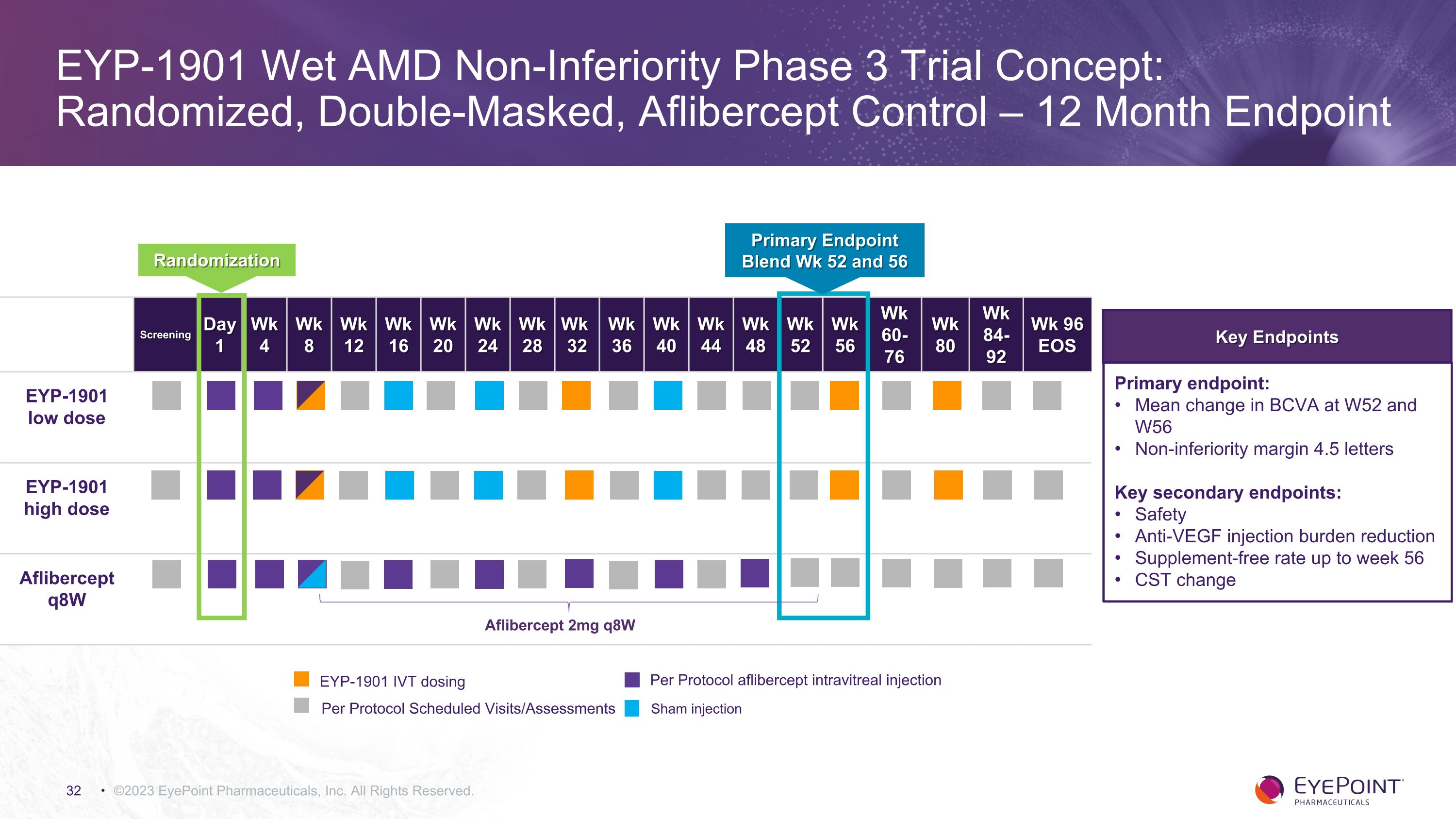
©2023 EyePoint 製藥公司版權所有。EYP-1901 濕式 AMD 非劣勢 3 期試驗概念:隨機、雙重掩碼、阿立貝西普對照 — 12 個月終點篩查第 1 周 4 周 8 周 12 周 16 周 20 周 24 周 28 周 32 周 36 周 40 週週 44 週週 48 周 52 周 56 周 60-76 周 80 周 84-92 周 96 周 96 周 EOS EYP-1901 低劑量 EYP-1901 高劑量 Aflibercept Q8w 主要終點混合物 Wk 52 和 56 隨機分配 Aflibercept 2mg q8w 關鍵終點主要終點:W52 和 W56 時 BCVA 的平均變化非劣性邊距 4.5 個字母關鍵次要終點:安全抗血管內皮生長因子注射負擔減輕補充劑率至多第 56 周 CST 變更 EYP-1901 IVT 劑量根據協議的預約就診/評估 aflibercept 玻璃體內注射假注射

©2023 EyePoint 製藥公司版權所有。EYP-1901:Vorolanib 用於 Durasert E 非增殖性糖尿病視網膜病變 (NPDR) — PAVIA 2 期臨牀試驗
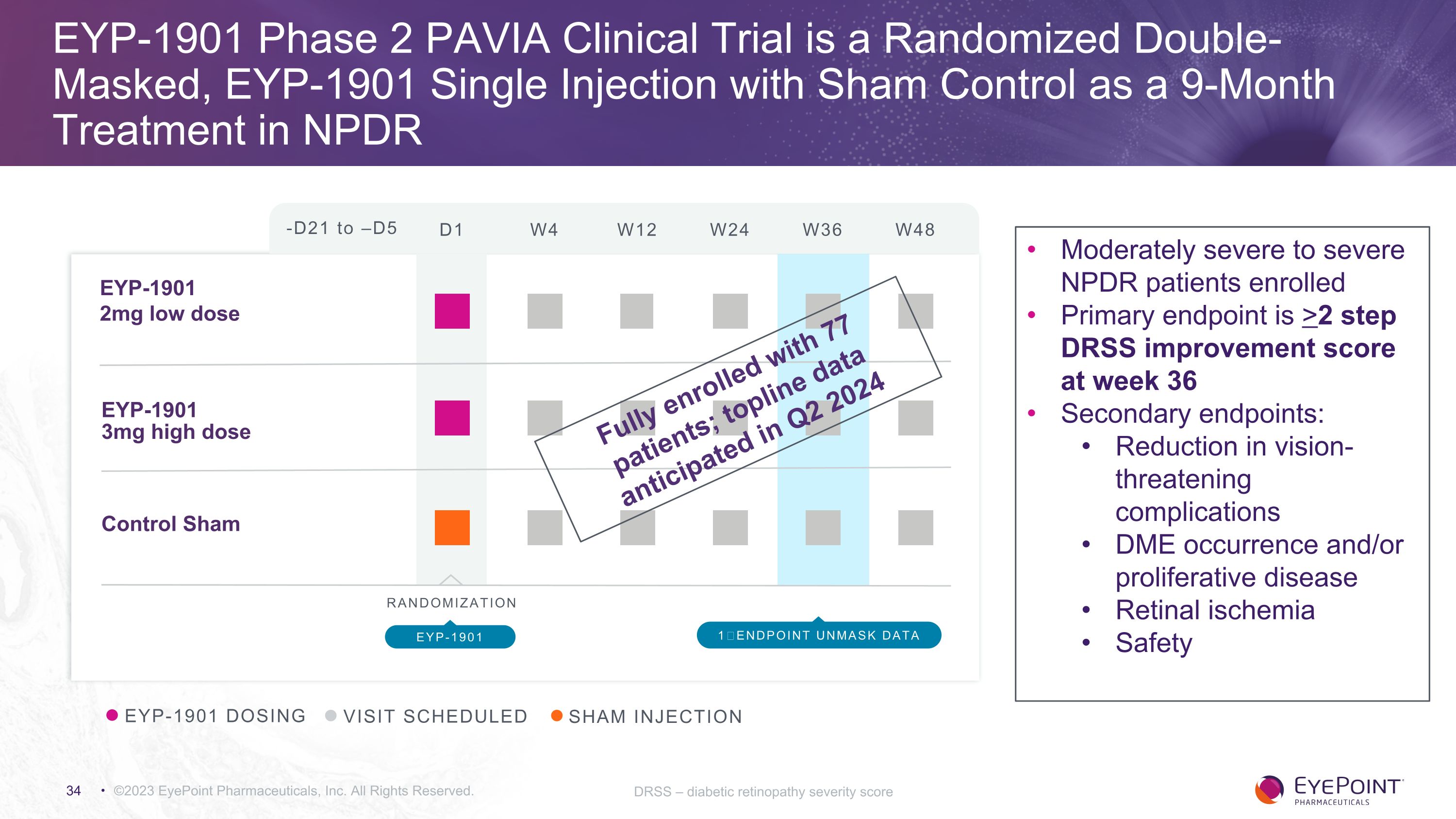
©2023 EyePoint 製藥公司版權所有DRSS — 糖尿病視網膜病變嚴重程度分數 EYP-1901 給藥就診預定 SHAM 注射-D21 至 —D5 D1 W4 W12 W24 W36 W48 EYP-1901 2mg 低劑量 EYP-1901 3mg 高劑量對照假隨機化 EYP-1901 1終點取消掩碼數據入組中度重度 NPDR 患者主要終點是第 36 周的 DRSS 改善分數> 2 步次要終點:危及視力的併發症減少 DME 發生和/或增生視網膜缺血安全性全員入組 77 名患者;預計將在 2024 年第二季度公佈頭條數據 EYP-1901 第 2 階段 PAVIA臨牀試驗是一項隨機雙面罩 EYP-1901 單次注射,在 NPDR 中進行假對照,作為為期 9 個月的治療

©2023 EyePoint Pharmicals, Inc. 版權所有。1-截至 2023 年 10 月 1 日截止數據主要發現:沒有與藥物相關的眼部 SAE 沒有藥物相關的系統性 SAE 兩種眼部 SAE,研究人員認為與 EYP-1901 無關:研究眼部出血性後玻璃體脱離 (PVD) 給藥黃斑水腫導致非研究同行眼睛視力喪失 PAVIA Masked 安全摘要 1 預計將在 2024 年第二季度發佈頂線數據

©2023 EyePoint 製藥公司版權所有EYP-1901:沃羅拉尼布參與糖尿病黃斑水腫 (DME) 的 Durasert E 2 期 VERONA 臨牀試驗
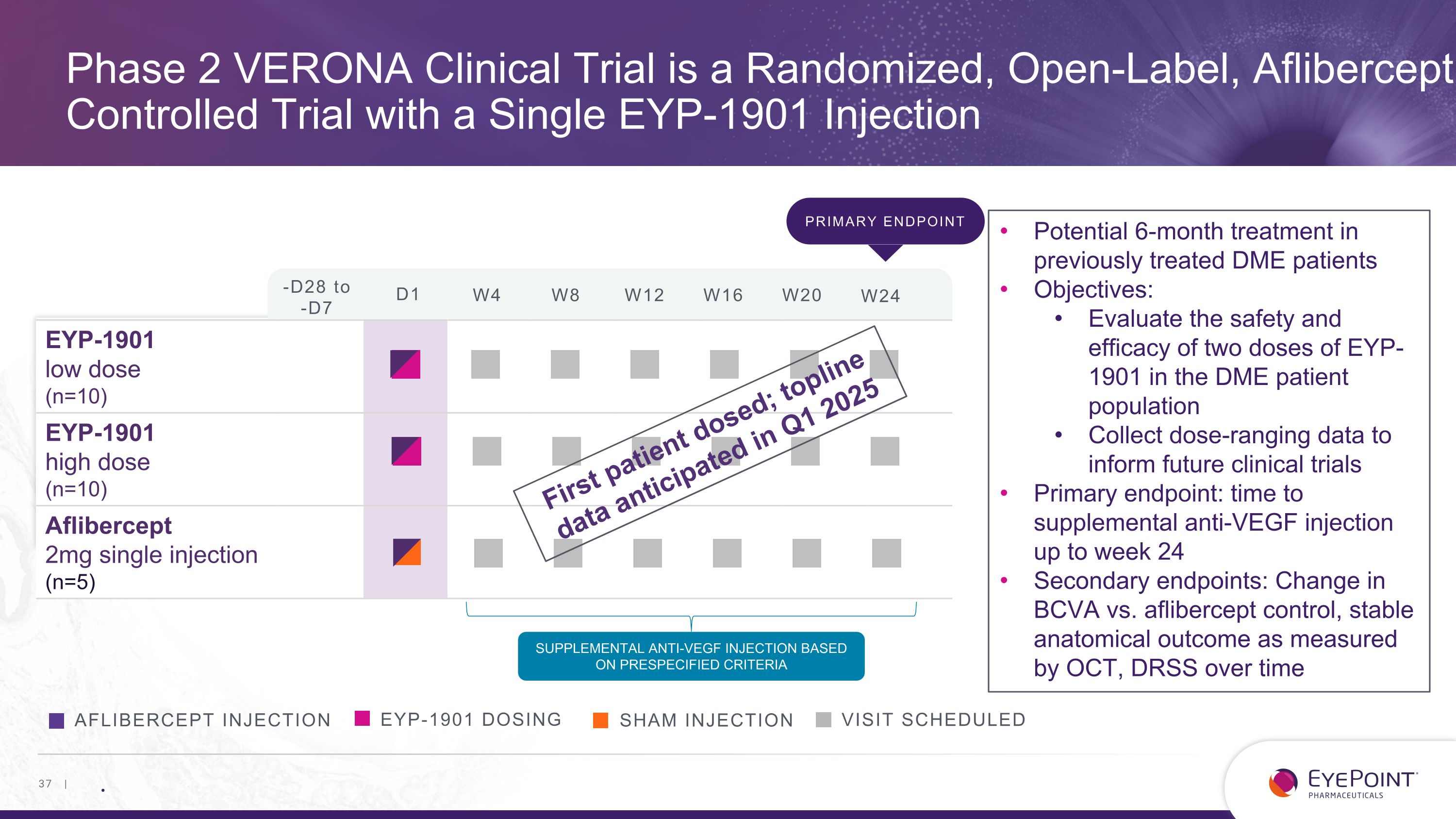
VERONA 2 期臨牀試驗是一項隨機、開放標籤、Aflibercept 對照試驗,單次 EYP-1901 注射 EYP-1901 劑量就診預定阿弗西普注射假注射 EYP-1901 低劑量 (n=10) EYP-1901 高劑量 (n=10) Aflibercept 2mg 單次注射 (n=5) 基於預先設定標準的補充抗血管內皮生長因子注射對先前接受過治療的 DME 患者進行 6 個月治療目標:評估安全性和有效性 DME 患者羣體中的兩劑 EYP-1901 收集劑量範圍數據,為未來的臨牀試驗提供信息主要終點:補充抗血管內皮生長因子注射的時間最多24周次要終點:BCVA與aflibercept對照的變化,OCT測得的穩定的解剖學結果,隨時間推移的DRSS主要終點-D28至-D7 D1 W4 W8 W12 W16 W20 W24 首例患者給藥;頂線數據預計將於2025年第一季度發佈

VERONA 主要終點:補充注射時間至第 24 周 — 補充標準 ©2023 EyePoint Pharmicals, Inc. 版權所有。1. 對比最佳研究測量;2. 根據光譜域 OCT (SD-OCT) BCVA 測量,最佳校正視力;CST,中心子場厚度從第 4 周開始:由於 DME1 減少 5-9 個字母和 >75 micva,BCVA 降低 ≥ 10 個字母連續兩次訪問新流體1新流體比基準值增加 ≥100 微米(第 1 天)2 研究者的自由裁量權從第 12 周開始:缺乏 10%與基準相比,CST 降低(第 1 天)

©2023 EyePoint 製藥公司版權所有。EYP-2301:Durasert E 中的razuprotafib 是一種用於嚴重視網膜疾病的持續分娩 tie-2 激動劑
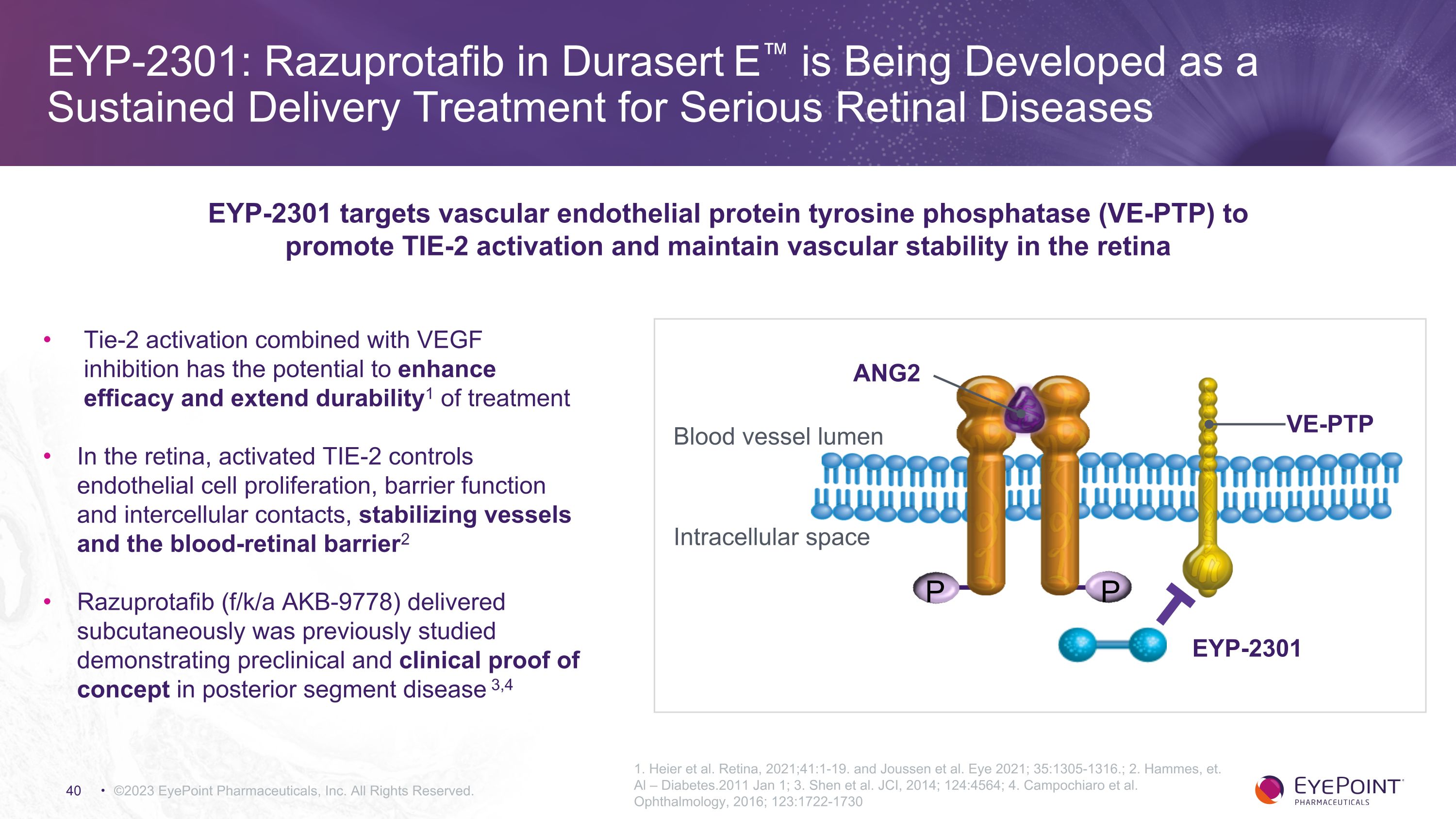
EYP-2301:Durasert E 中的 Razuprotafib 正在開發用於嚴重視網膜疾病的持續交付療法 ©2023 EyePoint Pharmicals, Inc. 版權所有。1.Heier 等人視網膜,2021 年;41:1-19。以及 Joussen 等人。Eye 2021;35:1305-1316。;2.哈姆斯等Al — Diabetes.2011 年 1 月 1 日;3.Shen 等人JCI,2014;124:4564;4.坎波基亞羅等人眼科,2016 年;123:1722-1730 Tie-2 激活結合血管內皮生長因子抑制有可能提高療效並延長治療的耐久性1 在視網膜中,活化的 TIE-2 控制內皮細胞增殖、屏障功能和細胞間接觸、穩定血管和視網膜血液屏障2 Razuprotafib(f/k/a AKB-9778)皮下交付的研究表明,臨牀前和臨牀證據後段疾病的概念 3,4 EYP-2301 靶向血管內皮蛋白酪氨酸磷酸酶 (VE-PTP)促進 TIE-2 激活並維持視網膜的血管穩定 P EYP-2301 血管流明細胞內空間 VE-PTP ANG2

©2023 EyePoint 製藥公司版權所有。穩健的資產負債表和現金流通過潮濕的 EYP-1901 第三階段試驗的頭條數據 2023 年 12 月 31 日現金和投資超過 3.3 億美元的現金和投資 2023 年 12 月 5 日完成 2.3 億美元的股權融資 2023 年 12 月 5 日完成了未來 12 個月內多個關鍵數據和價值轉折點

通過 EYP-1901 的關鍵里程碑持續執行並獲得充足的資金 ©2023 EyePoint Pharmicals, Inc. 版權所有。EYP-1901 Corporate ✓ DAVIO 2 註冊已完成 2023 年第一季度 ✓ PAVIA 註冊已完成 2023 年第二季度 ✓ DAVIO 2 頭條數據 2024 年 12 月 ✓ 維羅納——DME 第 2 階段試驗啟動 2024 年第一季度 EOP2 與 FDA 會面 2024 年第 2 季度首次濕式 AMD 三期試驗啟動 2024 年下半年 VERONA 頂線數據 ✓ YUTIQ 以 8250 萬美元外加特許權使用費進行交易 2023 年 2 月 ✓ 債務退回,現金流延至 2025 年 2023 年第二季度 ✓ 超額認購的 2.3 億美元股權融資已於 2023 年 12 月結束

摩根大通醫療保健會議演講2024年1月10日醫學博士傑伊·杜克總裁兼首席執行官 ©2023 EyePoint Pharmicals, Inc. 版權所有