

附錄 99.1 條件活性生物製劑:改變癌症療法 2024 年 1 月公司演示文稿

重要聲明和免責聲明本由 BioAtla, Inc.(“我們”、“我們的”、“BioAtla” 或 “公司”)發佈的演示文稿( “演示文稿”)包含 1995 年《私人證券 訴訟改革法》所指的 “前瞻性陳述”,涉及我們的業務、運營和財務狀況,包括但不限於有關商業計劃和前景以及我們的臨牀試驗是否將進行的陳述支持註冊; 里程碑的實現;我們的研發計劃的成果、實施、進展和時機,以及臨牀試驗;對臨牀試驗註冊和劑量的預期;對未來數據更新、臨牀 試驗、監管會議和監管機構申報的計劃和預期;針對選定資產建立合作或其他戰略夥伴關係的計劃;我們的候選產品的潛在監管批准路徑;對我們 現金和現金等價物充足性的期望,以及優先開發和重點開發選定資產和適應症的計劃。諸如但不限於 “預測”、“相信”、“可能”、“估計”、 “期望”、“打算”、“可能”、“計劃”、“潛在”、“預測”、“項目”、“應該”、“將” 或否定等詞語, 以及傳達未來事件或結果不確定性的類似表述可識別前瞻性陳述。這些前瞻性陳述反映了管理層對未來事件的信念和觀點,基於截至本演示文稿之日的估計 和假設,受風險和不確定性的影響,包括公司向美國證券交易委員會提交的文件中描述的風險和不確定性,包括但不限於公司最新的10-Q表季度報告。 此外,公司在競爭激烈且瞬息萬變的環境中運營。新的風險不時出現。管理層無法預測所有風險,公司也無法評估所有因素對其業務的影響 ,也無法評估任何因素或因素組合在多大程度上可能導致實際業績與我們可能做出的任何前瞻性陳述中包含的結果存在重大差異。鑑於這些不確定性,您不應過分依賴這些 前瞻性陳述。公司通過這些警示性陳述對本演示文稿中的所有前瞻性陳述進行了限定。除非法律要求,否則公司沒有義務公開更新任何前瞻性 陳述,無論是由於新信息、未來事件還是其他原因。除非另有説明,否則本演示文稿中包含的聲明均自本演示之日起作出,在任何情況下,本演示文稿均不暗示此處包含的信息在該日期之後的任何時候都是正確的,或者將對信息進行更新或重新審閲,以反映隨後可用的信息或在此日期之後發生的變化。 本演示文稿中包含的某些信息涉及或基於從獨立行業出版物和獨立第三方進行的研究、調查和研究中獲得的統計數據和其他行業和市場數據,如 ,以及公司自己對某些疾病和病症患病率的估計。本演示文稿中使用的市場數據涉及許多假設和侷限性,請您不要過分重視此類數據。 行業出版物和第三方研究、調查和研究通常表明,他們的信息是從被認為可靠的來源獲得的,儘管它們不能保證此類信息的準確性或完整性。 該公司對公司可能開發的任何候選產品都有可能從治療中受益的患者羣體的估計包括基於其行業知識、行業出版物和 第三方研究的幾項關鍵假設,這些假設可能基於較小的樣本量,可能無法準確反映可解決的患者羣體。儘管公司認為其內部假設是合理的,但沒有獨立消息來源證實了這種 假設。本演示文稿可能包含屬於其他實體的商標、商品名稱或服務標誌。本公司無意使用或展示其他方的商品名稱、商標或服務商標來暗示 與這些其他方的關係,或對這些其他方的認可或贊助。公司或其任何董事、高級職員、員工、承包商、代理人、顧問、顧問或其他代表均未對本演示文稿中包含的信息的準確性或完整性作出任何明示或 暗示的陳述或保證。BioAtla | 概述 2

© BioAtla 是一家臨牀階段公司,專注於使用條件活性生物製劑 (CAB) 改造 癌症療法,兩期 2 期 CAB-ADC,優先管道一 2 期 CAB-CTLA-4 專有技術 1.413 億美元的現金和臨牀讀數,截至 在 2024 年之前廣泛適用於固體多適應症/雙特異性 T 細胞參與者 09/30/23 腫瘤資產 BA3011 提高足夠的現金狀況以增加治療推進2025年下半年可能註冊的戰略性試驗合作肉瘤的視窗以及其他適應症的潛在討論 BioAtla | 概述 3

領導團隊首席財務官埃裏克·西弗斯,醫學博士傑伊·肖特, 博士理查德·沃爾德隆,工商管理碩士。謝裏·利迪克首席醫學官董事長、首席執行官兼聯合創始人首席商務官基因醫學公司首席財務官張斌,醫學博士威廉·博伊爾博士莫妮卡·沙利文·蘇西·梅洛迪臨牀高級副總裁 開發。高級研究員知識產權與合同高級副總裁人力資源高級副總裁 CapaIP BioAtla | 概述 4

董事會和顧問委員會傑伊·肖特****、首席執行官 高管瑪麗·安·格雷博士西爾維亞·麥克布林博士蘇珊·莫蘭醫學博士蘇珊·莫蘭醫學博士兼董事總監斯科特·史密斯勞倫斯·斯坦曼,醫學博士埃迪·威廉姆斯董事總監勞倫斯·方博士,癌症 免疫療法醫學博士安德森癌症中心項目,加州大學舊金山分校科學顧問科學顧問帕德曼尼·夏爾馬,醫學博士,醫學博士邁克爾·馬尼亞克醫學博士,醫學博士安德森癌症中心葛蘭素史克科學顧問科學顧問 BioAtla | 概述 5
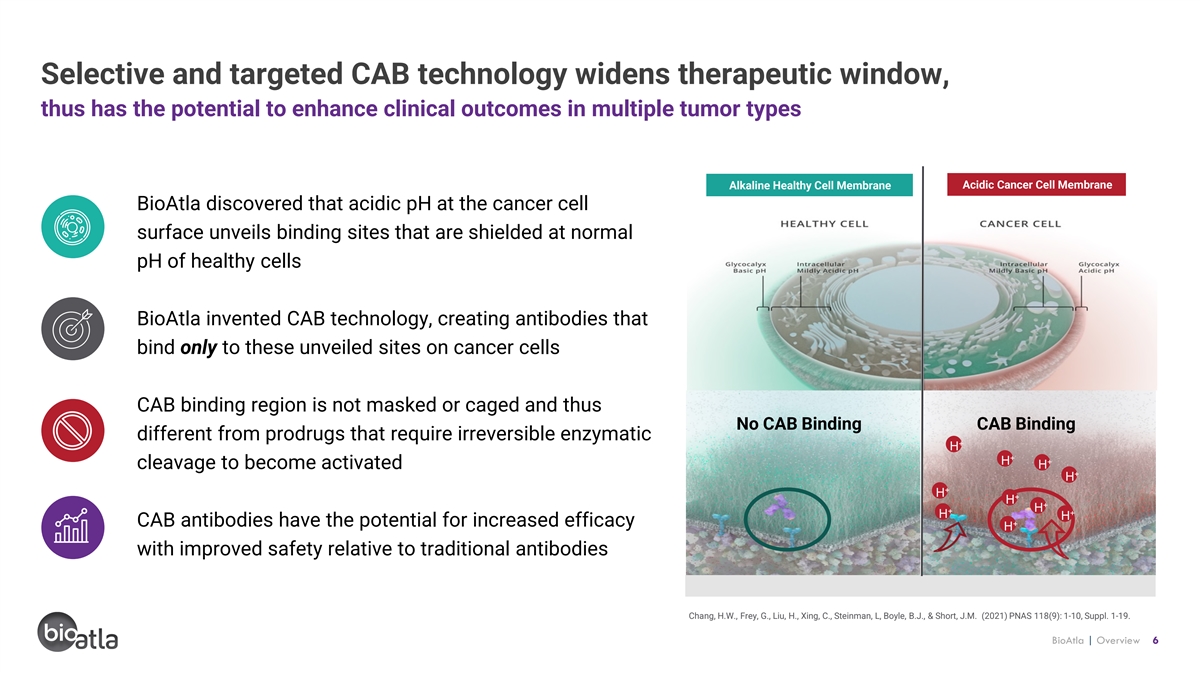
選擇性和靶向性 CAB 技術拓寬了治療窗口,因此 有可能增強多種腫瘤類型的臨牀療效酸性癌細胞膜鹼性健康細胞膜 bioAtla 發現,癌細胞表面的酸性 pH 值會揭示在 健康細胞正常 pH 值下屏蔽的結合位點 bioATLA 發明的 CAB 技術,產生僅與癌細胞上已公開位點結合的抗體,不會被掩蓋或籠住因此,沒有CAB結合CAB的結合與需要的前藥不同不可逆的 酶 + H + H + H 裂解被激活 + H + H + H + H + + H + + H CAB 抗體相對於傳統抗體 Chang、H.W.、Frey、G.、Liu、H.、Xing、C.、Steinman、L、B.J. 和 Short,J.M.(2021)PNAS,有可能提高療效 + H,同時提高安全性 118 (9): 1-10,補編 1-19。BioAtla | 概述 6

BioAtla 的 CAB 平臺對多種 抗體類型的廣泛適用性有可能治療多種實體瘤 ADC I/O 抗體雙特異性 TCE 靶標:AXL、ROR2 靶標:CTLA-4 靶標:epCam 和 CD3 CTLA-4 阻滯劑激活效應因子廣泛表達在各種腫瘤中雙特異性 抗體橋接癌症 T 細胞,從而增強抗型、AXL 和 ROR2 過度表達細胞和 ROR2 過度表達細胞和細胞毒性 T 淋巴細胞、腫瘤免疫與預後不佳、激活 T 細胞和促進轉移以及對 PD-1 癌細胞裂解的耐藥性相關和 EGFR 療法 CAB-CTLA4 CAB-CTLA4 腫瘤細胞靶標 CAB-腫瘤細胞靶標 cab-epCAM 細胞毒性有效載荷 CAB-CD3 T 細胞靶標和連接物 BioAtla | 概述 7 ADC — 抗體藥物偶聯物;IO — 免疫腫瘤學;TCE — T 細胞參與者

具有差異化 CAB 資產廣泛適用性的重點產品線 旨在提供近期價值 IND 支持第 1 階段 2 期 CAB 計劃的目標適應症臨牀前臨牀 BA3011 UPS AXL Mecbotamab Vedotin NSCLC CAB-ADCS BA3021 黑色素瘤 ROR2 Ozuriftamab Vedotin SCCHN 黑素瘤 BA3071 CAB-I/O CTLA-4 NSCLC Evalstotug calinomas CAB-BA3182 epCam x CD3 多種腫瘤類型雙特異性 TCE CAB 附加項目各種多種腫瘤類型 BioATLA | 概述 8 IND,在研新藥;UPS,未分化多形肉瘤;NSCLC, 非小細胞肺癌;SCCHN,頭頸部鱗狀細胞癌

I/O 抗體平臺:CTLA-4 (BA3071) — 籃子試驗

CAB-CTLA4 在腫瘤微環境中有選擇性活性,因此 減少免疫相關不良事件 (iRAE) 嚴重的 iRAE 最大限度地減少了 iRAES 非 CAB CTLA-4 CAB CTLA-4 正常細胞(鹼性)抑制劑腫瘤選擇性結合抗 CTLA4 抗 CTLA4 CAb-抗 CTLA4 CAB-抗 CTLA4 CAB-抗 CTLA4 CAb-抗 CTLA4 癌細胞(酸性)細胞毒性(CD8+) T 細胞 T 調節細胞正常細胞 bioATLA | 概述 10

CAB BA3071 有效降低 NHP 中與臨牀相關的胃腸道毒性 * 車輛控制 Nivo + IPI Nivo + Ipi 20mg/kg + 15mg/kg 陽性對照 GI 症狀 Nivo + CAB-BA3071 液體糞便 20mg/kg + 15mg/kg 非成型糞便其他 GI 症狀 Nivo:20mg/kg QW(約 14.6mg/kg 人類劑量)+ Ipi 或 BA3071:15mg/kg QW(~11mg/kg 人體劑量)劑量) 每週一次,連續四周接觸 Nivo + Ipi 或 BA3071 NHP — 非人類靈長類動物 *Chang 等人,PNAS 118 (9):1-10,2021 BA3071 與 nivo BioAtla 聯合使用 ipilimumab 類似物可顯著降低胃腸道毒性 | 概述 11

聯合療法 1 期 BA3071 劑量遞增正在進行中(Q3W)週期 1 週期 2+ 關鍵目標:定義安全概況並確定 2 期劑量和 MTD 700 mg 評估抗腫瘤活性和免疫原性(~10mg/kg)確定 PK 參數 350 mg(約 5mg/kg)關鍵資格標準:210 mg CTLA-4 naíve 治療難治性:70 mg 黑色素瘤非小細胞肺癌 (NSCLC) 腎癌細胞癌 21 mg 尿路上皮癌胃癌 7 mg 肝細胞癌 (HCC) 宮頸癌小細胞肺癌 (SCLC) BA3071 BA3071 + 240 mg nivolumab bioAtla| 概述 12 計劃進一步增加劑量至 1,000 mg

第 1 階段 BA3071:人口統計學——基線患者特徵先前至少 3 條治療線路的中位數 總計(N = 18)年齡、y、平均值(範圍)65.5(43-79)心電圖狀態,n(%)0 10(55.6)1 8(44.4)先前的全身療法數量,n(%)1 5(27.8)2 2(11.1)3 4(22.2)≥4 7(35.2)8.9) 數據截止日期:23 年 11 月 15 日 BioAtla | 概述 13

第 1 期 BA3071:人口統計 — 腫瘤類型所有患者 先前的 PD1 治療失敗總數腫瘤類型先前治療 Tx (N=18) pt、抗血管內皮生長因子、抗 PD1 子宮頸 1 (5.6) 3 4 (22.2) 4 — 6 抗 PD1 和 pt 化療胃部 1 — 2 抗 PD1 黑色素瘤 5 (27.8) Uveal 3 (16.7) 皮膚 2 (16.7) Cutinical 2 (11.1) 4 (22.2) 1 — 6 先前的抗 PD1 和 TKI 腎細胞尿路上皮 1 (5.6) 4 pt 化療、抗 PD1 和 ADC pt 化療、紫杉烷、抗 PD1、TKI、抗血管內皮生長因子 NSCLC 2 (11.1) 3 — 7 1 (5.6) 3 pt 化療, 抗 PD1 SCLC 鉑金;數據截止日期:23 年 11 月 15 日 BioAtla | 概述 14

3+ 級特別關注的不良事件 BA3071 Q3W + 7 mg 21 mg 70 mg 210 mg 總計 350 mg 700 mg (N=7) * (N=3) nivolumab 240 mg Q3W (N=1) (N=1) (N=3) (N=3) (N=18) 至少有一個 3+ 的受試者數量 AESI 0 0 2 0 1 2 5 (27.8) 毒性 0 0 1 0 1 0 2 (11.1) 腹痛 0 0 0 0 0 1 (5.6) 腹瀉 0 0 0 0 1 (5.6) 肝毒性 0 0 2 0 0 2 (11.1) AST 增加 0 0 0 0 0 0 0 1 (5.6) ALP 升高 0 0 0 0 0 0 2 (11.1) 肺毒性 0 0 0 0 1 (5.6) 肺毒性 0 0 0 0 0 1 (5.6) 肺毒性 0 0 0 0 0 0 1 (5.6) 肺毒性 0 0 0 0 0 0 1 (5.6) 肺炎 0 0 0 0 0 1 (5.6) 肺毒性 0 0 0 0 0 1 (5.6) 肺炎 0 0 0 0 0 1 (5.6) 肺毒性 0 0 0 0 0 1 (5.6) 肺炎 0 0 0 0) 內分泌毒性 0 0 0 0 0 1 1 (5.6) 糖尿病酮症酸中毒 0 0 0 0 0 1 1 (5.6) ^腹瀉患者也出現了 3 級胃炎 * 1 Pt 劑量為 350 mg,包括第 2 期紅色文字表示免疫相關不良反應數據截止日期:15 Nov23 BioATLA | 概述 15 AST-天門冬氨酸氨基轉移酶;ALP- 鹼性磷酸酶

3+ 級特別關注的不良事件 BA3071 Q3W + 7 mg 21 mg 70 mg 210 mg 總計 350 mg 700 mg (N=7) * (N=3) nivolumab 240 mg Q3W (N=1) (N=1) (N=3) (N=3) (N=18) 至少有一個 3+ 的受試者數量 AESI 0 0 2 0 1 2 5 (27.8) 毒性 0 0 1 0 1 0 2 (11.1) 腹痛 0 0 0 0 0 1 (5.6) 腹瀉 0 0 0 0 1 (5.6) 肝毒性 0 0 2 0 0 2 (11.1) 在 18 名接受治療的患者中僅觀察到 2 名具有免疫相關不良反應的患者 AST 增加 0 0 0 0 0 0 0 1 (5.6) ALP 升高 0 0 0 0 0 2 (11.1) 肺毒性 0 0 0 0 1 (11.1) 肺毒性 0 0 0 0 1 (1) 5.6) 肺炎 0 0 00 0 1 1 (5.6) 內分泌毒性 0 0 0 0 0 1 1 (5.6) 糖尿病酮症酸中毒 0 0 0 0 0 1 1 (5.6) ^腹瀉患者也出現了 3 級胃炎 * 1 Pt 在 350 mg 劑量下納入第 2 期紅色文字表示免疫相關不良反應數據截止日期: 15Nov23 bioAtla | 概述 16 AST-天冬氨酸氨基轉移酶;ALP-鹼性磷酸酶

第 1 期 BA3071:16 名可評估患者中有確診反應(n=2)和穩定疾病(n=9) 葡萄膜黑色素瘤 SCLC 皮膚黑色素瘤胃食管(確認 PR,腫瘤減少 54.3%,數據削減後)子宮頸數據截止日期:15 年 Nov23 BioAtla | 概述 17

1 期 BA3071:350 mg 與 PD1 聯合使用 350 mg 時有意義的臨牀益處葡萄膜黑色素瘤 (PD) 葡萄膜黑色素瘤 (SD) 迄今為止的總體反應 N=5 NSCLC(PD — 非靶向/新病變)完全反應 1 部分反應 1 胃食管穩定疾病 1(已確認 PR, 數據剪切後)進行性疾病 2 宮頸 (CR) 數據截止日期:23 年 11 月 15 日 BioAtla | 概述 18

已確診的 PR-胃食管癌 63 歲男性,IV 期 胃食管癌 HER2 陰性,後 folfox、紫杉烷、TKI、抗 PD1 和抗 VEGFL bioATLA | 概述 19 基準——2023 年 7 月 31 日治療——2023 年 10 月 23 日

確診的 CR-宮頸癌 43 歲女性,IV 期宮頸癌 HPV+16 陽性,鉑後、紫杉烷、抗 PD1 和抗血管內皮生長因子基線 — 2023 年 3 月 23 日治療中 — 2023 年 8 月 9 日 “沒有縱隔、肺門或腋窩淋巴結腫大。可以持續消退 “先前注意到的縱隔和右肺門淋巴結腫大的多處縱隔部、副食道淋巴結...” 食管旁淋巴結。”BioAtla | 概述 20

BA3071-001 劑量滴定正在進行中 3 名患者在 聯合使用 nivolumab 週期中以 700 mg Q3W 的劑量給藥總體癌症類型年齡之前的 Tx 不良事件 DLT 處置已完成反應 G1 發燒和寒戰;腎細胞 78 5 No 6 SD 正在進行 G2 短暫性缺氧 DC-受試者胃食管 66 4 G1 發燒和寒戰否 2 SD 決定 G1 發燒和寒戰;是(心房)NSCLC 76 7 2 SD DC-AE G2 短暫性缺氧(顫動)• 腎細胞患者開始預防性託珠單抗第 4 週期,現已過去 6 個週期並耐受持續治療 • 進一步使用預防性託珠單抗 bioAtla 對 700 mg 和 1000 mg 進行評估 | 概述 21

BA3071 二期單一和組合研究目前正在進行研究 用於多種批准途徑治療難治性:• 單一療法評估 350 mg • 黑色素瘤 • 評估潛在路徑 • 癌症加速審批 • 進一步表徵安全性和有效性單一療法和 潛在的更高劑量聯合治療(1 L):350 mg • 黑色素瘤 • NSCLC • 為獲得全面批准的關鍵隨機對照試驗提供信息 PD1 潛在的更高劑量 BioAtla | 概述 22

CAB-AXL-ADC 平臺 BA3011 Mecbotamab Vedotin:肉瘤和 非小細胞肺癌

未分化多形肉瘤的潛在市場機會 (UPS)新診斷的靶向療法患者/年人羣中排名第二 Av Ava ail ila abl ble e T Tre rea attm me en ntt:: 特別常見的軟性肉瘤(美國)— 大多數 15% ~20萬 0 >54萬美國人獲準治療晚期組織 肉瘤/1 1L:批准的治療肺癌 5 1,2 UPS 1L: Chemo + ICI 50% ORR (STS) 亞型 2 7 轉移為肉瘤 ORR ~ 15% 6,7 2L+: SOC 10%-20% ORR 儘管非鱗狀患者出現進展 1L 護理的時間中位數, 佔多數細胞代表復發或約 55% 1 年轉移/局部 2L+ ~ 75% 的患者大多數 4,5,6 轉移性復發 3 4 進展 3,4 名患者疾病 1 2 Brennan MF、Antonescu CR、Moraco N、Singer S. 從 10,000 名軟組織肉瘤患者的研究中吸取的經驗教訓。Ann Surg. 2014;260 (3): 416—21;Penel N、Coindre J-M、Giraud A、Terrier P、Ranchere-Vince D、Collin F 等常見和罕見肉瘤組織學亞型的表現和預後:一項針對在參考文獻3中心管理的10,262名局部內臟/軟組織肉瘤患者的研究。巨蟹座。2018;124 (6): 1179—87;Vodanovich DA、Spelman T、May D、Slavin J、Choong PFM。預測未分化多形性軟組織 肉瘤的預後:266 4 例病例的 20 年經驗。澳新銀行 J Surg.2019;89 (9): 1045-1050;Roland CL,CD 5 月,Watson KL 等分析影響未分化多形肉瘤腫瘤結局的臨牀和分子因素。Ann 5 Surg Oncol 2016;23 (7): 2220-2228;Delisca GO、Mesko NW、Alamanda VK 等MFH 和高級未分化多形肉瘤——名字裏有什麼?J Surg Oncol. 2015;111 (2): 173-177;6 7 Winchester D、Lehman J、Tello T 等。未分化多形性 肉瘤:預測不良結局的因素。J Am Acad Dermatol。2018;79 (5): 853-859;產品 USPI bioAtla | 概述 24 ORR,客觀迴應率(最佳客觀反應是確認的完全反應或部分反應)

未分化多形肉瘤(UPS):ORR 50%,PFS 中位數 10.9 個月 1 期和第 2 期,第 1 部分目標病變和無進展存活率(1.8mg/kg;n=10)從基線開始改變目標病變(%)無進展生存事件中位數(mos)(95% PFS 3mo n(%)CI)%(95% 置信區間)所有患者 6 (60.0) 10.0 9 (1.4 — NE) 60.0 (18.4, 75.3) c 自第一劑量起的幾個月所有患者 10 10 8 4 4 4 4 4 4 4 3 3 3 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 0 § 1 1 1 1 1 0 § 可評估的療效 = 10 tmps ≥ 50% § 帕唑帕尼布與安慰劑的第 3 期隨機研究 在轉移性軟組織肉瘤(包括 UPS 在內的 “其他” 隊列)中,儘管之前進行了化療,但仍在進展。他們報告説,帕唑帕尼的中位PFS為4.6個月,其中5/ 10名患者達到PR, OR為50%,安慰劑的PFS率為3個月為60%,1.0個月。* — BA3011 治療的反應持久,DOR 目前超過 8 個月 § pembb的單臂 SARC028 研究晚期UPS中的rolizumab報告的PFS中位數為 3.0個月** § 中期結果滿足了UPS隊列在第二階段研究的第二部分中預先定義的圍棋標準 §比較研究時應考慮交叉試驗比較的侷限性 § 全身療法的先前平均線路 = 3 中期數據——2023 年 1 月 18 日截止數據 bioAtla | 概述 25 *Votrient 包裝説明書,2023 年 3 月訪問。**DOI:10.1200/jco.2019.37.15_suppl.11015《臨牀腫瘤學雜誌》37,第 15_suppl(2019 年 5 月 20 日)11015-11015。 TMP,腫瘤膜百分比分數;ORR,客觀緩解率;PFS,無進展存活率;DOR,反應持續時間。

第 2 階段,第 1 部分 Topline 中期分析結果證實了其餘肉瘤亞型 BA3011 之後的 1 階段信號 肉瘤亞型 Pt PFS 率 PR/CR 平滑肌肉瘤 19 28.8% (Q2W) 0 1 13 10.3% (3Q4W) 如果 ≥1 CR/PR Synovial 7 35.7% 0 或 3 個月時 PFS 率 ≥ 40%,則 “開始” 8 62.5% 0 骨肉瘤 12 45.5% 2 pR 如果 0 CR/PR 和 PFS 率為 3 尤因肉瘤 8 18.8% 0 個月

RP2D 1.8 mg/kg Q2W BA3011 BA3011 + Opdivo 特徵 (N=73) (N=26) § 無治療相關死亡任何不良事件 (AE) 69 (94%) 24 (92%) § 很少與治療相關的SAE,與 1 2 個相關 AE 一致,基於 CTCAE 3 或 4 級 20 (27%) 10 (39%) MMAE 毒性,包括可逆性 2 任何相關的嚴重不良事件 5 (7%) 5 (19%) 骨髓抑制、短暫性肝酶 2 升高、代謝失調導致死亡的相關不良反應 0 0 導致治療的相關不良事件 § ^ 4 (5%) 1 (4%) 2 § 導致停藥的相關不良反應極少 1-2 級 (21%) 便祕 3 級 (1%) § 無臨牀意義的靶向毒性所有 1-2 級 (16%) 在背景下觀察到的外周 神經病變等級 3-4 (0%) § 由於避免了靶向 1-2 級 (16%) 腹瀉腫瘤外毒性 3-4 級 (0%) 觀察到的低度便祕與晚期癌症患者的基線水平一致中期 數據——2023 年 1 月 18 日截止數據 1 CTCAE:不良事件的通用術語標準。NCI 不良事件通用術語標準是一種描述性術語,用於不良反應 BioAtla | 概述 2 27 7 2 § 事件 (AE) 報告。為每個 AE 術語提供了分級(嚴重程度)量表。根據調查人員的評估。缺失的回覆被視為相關回應。公司二級外圍材料 — 機密神經病變;胰腺炎;^2 級腸梗阻

第 2 階段可能註冊的 UPS 研究設計 • UPS 第 2 階段,第 2 部分可能的註冊研究 — 第 2 階段共招收了約 80 名錶達 AXL 的 UPS 患者,第 2 部分 o FDA 支持研究更頻繁的給藥方案(第三季度第四季度暴露量比第二季度增加 44%,第二季度暴露量比第二季度增加 38%)o 前 40 名 TMPs >= 50% 的患者將隨機分配 1:1 至 3Q4W 或 2Q3W 給藥方案 o 將按所選劑量再入組 40 名患者 — 根據 RECIST v1.1,主要療效終點是客觀反應率 (ORR) o 主要療效 分析將是基於在選定給藥方案中治療的大約 60 名患者 — 先前的全身治療方案僅限於 ≤3 bioATLA | 概述 28 UPS = 未分化多形肉瘤;LMS = 平滑肌肉瘤

轉移性非小細胞肺癌的潛在市場機會是新的 dia ag gn no os see end d p pai not ts s//yeea r r p pe eo op polle e i in n n n th e e Ava ail ila ble ble e tre tree attm me enntt:: ~200K ((美國美國)) — — 我是 Tori City ty ty >540K ~200K >540K 美國美國 liiv viin ng g wit with h a adv dva an nc ce ed d/1 1 llu un ng g c ca nc ca nc ca nc ce er r 5 5 1L:化療 + ICI 50% ORR 1L:化療 + ICI 50% ORR 2 2 m me et tas st tia tia 6 6,7 2L+:SOC 14%-23% ORR;2L+:SOC 10%-20% ORR 6 儘管取得了進展 儘管在非鱗狀非鱗狀非鱗狀治療中位數 PFS 4.5 個月,大多數在 1L 護理,但大多數代表細胞佔大約 75-80% 2L+ 2L+ ~ 75% 的 ma pja 或 tiie ty ntof s tii e ty ntof s 3 4 進展患者 1 2https://www.lung.org/lung-health-diseases/lung-disease-lookup/lung-cancer/resource-library/lung-cancer-fact-sheet https://www.cancer.net/cancer-types/lung-cancer-non-small-3 4 個細胞/統計數據, https://thoracickey.com/carcinomas-of-the-lung-classification-and-genetics/#F1-72,Wang F,Wang S 和 Zhou Q(2020)肺癌的耐藥機制 5 6 免疫療法。正面。Oncol. 10:568059. doi:10.3389/fonc.2020.568059,Transl Lung Cancer Res 2021;10 (7): 3093-3105。Cyramza 包裝説明書(2023 年 3 月訪問)bioAtla | 概述 29 1L,第一線;2L+,第二線或以上;NSCLC,非小細胞肺癌;ORR,客觀緩解率(經確認的最佳客觀反應 完全反應或部分反應)、SOC、護理標準(單獨使用多西他賽、多西他賽 + 拉穆西魯單抗)

AXL 表達與轉移性非小細胞肺癌預後不佳有關 在 98 名轉移性非小細胞肺癌患者中,早期手術切除的肺腺癌患者的總存活率 (OS) 較低 OS 對於那些通過組織水平高的 IHC 進行高表達的患者 AXL Wu 等人,J Cancer Res 和 Clin Oncol,2017 年來自 de Replicated Miguel-Perez D 等人。2019 BioAtla | 概述 30

BA3011-002 非小細胞肺癌多中心,2 期,開放標籤 試驗,評估 BA3011 單獨使用以及聯合使用 nivolumab 的療效和安全性患者處置:主要終點:• 確診局部晚期或轉移性 BA3011 • 通過 RECIST v1.1 NSCLC 1.8 mg/kg Q2W、2Q3W • AES 的發病率和嚴重程度* • 年齡 ≥ 18 歲 • 心電圖表現狀態 0 或 1 個次要終點:• PD-1/L1 抑制劑治療失敗或 • DOR BA3011 + nivolumab 批准的表皮生長因子或 ALK 療法 • PFS 1.8 mg/kg Q2W 基因組腫瘤畸變• BOR、DCR、TTR、OS • AXL+ 腫瘤染色(TMP ≥ 1%)*由 MedDRA 編碼,根據 NCI CTCAE v5 進行分級 Rotow J、Dy GK、Camidge DR. 海報發表於:國際 肺癌研究協會 2023 年北美肺癌會議;2023 年 12 月 1-3 日;伊利諾伊州芝加哥。BioAtla | 概述 13

第 2 階段 BA3011-002 NSQ NSCLC:基線人口統計學和特徵 BioATLA 研究招收了一項經過大量預處理的 3L+ 人羣 BA3011 單一療法 BA3011 + nivolumab (N=23) (N=17) 總計 (N=40) 年齡、y、平均值 (SD) 68.9 (8.2) 68.6 (8.0) 先前的全身療法數量,n (%) 1 4 (17.7) 4) 2 (11.8) 6 (15.0) 2 6 (26.1) 3 (17.6) 9 (22.5) 3 9 (39.1) 2 (11.8) 11 (27.5) ≥4 4 (17.4) 10 (58.8) 14 (35.0) 之前接受過抗 PD-1/L1 治療,n (%) 是 21 (91.3) 15 (88.2) 36 (90.0) 否 2 (8.7) 2 (11.8) 4 (10.0) 表皮生長因子突變狀態,n (%) Wild-type 13 (76.5) 27 (67.5) 16 (69.6) 突變體 4 (17.4) 2 (11.8) 6 (15.0) 未知或缺失 2 (11.8) 7 (17.5) 3 (13.0) Rotow J、Dy GK、Camidge DR. 海報發表於:國際肺癌研究協會 2023 年北美肺癌會議; 2023 年 12 月 1-3 日;伊利諾伊州芝加哥。BioAtla | 概述 32 數據截止日期:23 年 6 月 30 日

第 2 階段 BA3011 非鱗狀非小細胞肺癌先期 PD-1/L1 治療 EGFR 野生型 (N=15) 之前的 PD-1/L1 治療 (N=18) 數據截止日期:23 年 6 月 30 日單一療法 1.8 mg/kg Q2W 顯示出令人鼓舞的療效信號最佳總體反應,n (%) 已確認 PR 3 (20.0) 3 (16.7) 未經證實的 PR 2 (13.3) 2 (11.1 SD) 7 (46.7) 10 (55.6) PD 2 (13.3) 2 (11.1) NA(由於 AE 提前停藥)1 (6.7) 1 (5.6) 回覆率 n (%) 5 (33.3) 5 (27.8) 確切的 95% 置信區間 11.8、61.6 9.7、53.5 疾病控制率 n (%) 8 (53.3) 10 (55.6) 確切的 95% 置信區間 26.6、78.8 7 30.8、78.5 • 單一療法 中位數緩解持續時間估計為 4.8 個月,範圍為 2.3-12.1 個月以上* • 聯合療法(n=17):o 可評估的患者(大多數先前接受過 4 種以上的治療)接受了 BA3011 + nivolumab o 一名患者經歷了 持續的完全緩解 (CR),2 名患者經歷了 PR,8 名患者出現穩定疾病 (SD) bioAtla | 概述 33 Rotow J、Dy GK、Camk Idge DR. 海報發表於:國際肺癌研究協會 *截至 2023 年 11 月 20 日 北美肺癌會議;2023 年 12 月 1-3 日;伊利諾伊州芝加哥
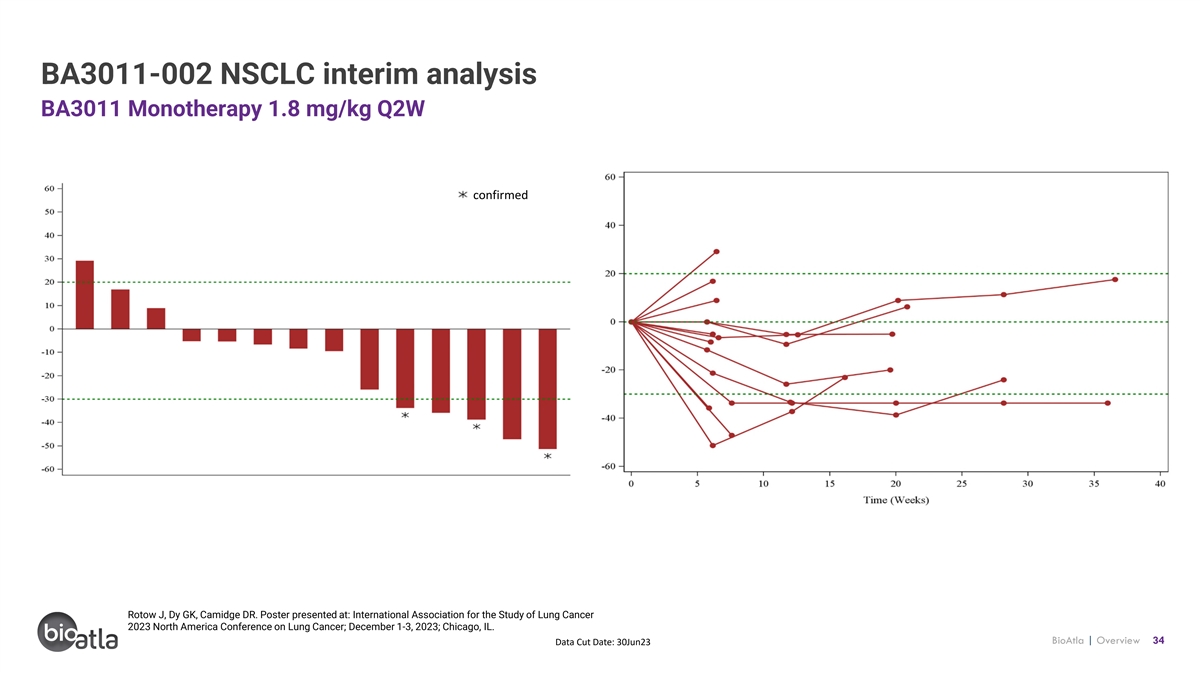
BA3011-002 NSCLC 中期分析 BA3011 單一療法 1.8 mg/kg Q2W 證實 Rotow J、Dy GK、Camidge DR. Poster 發表於:國際肺癌研究協會 2023 年北美肺癌會議;2023 年 12 月 1-3 日;伊利諾伊州芝加哥。BioAtla | 概述 34 數據截止日期:23 年 6 月 30 日

BA3011-002 NSCLC 中期分析 BA3011 單一療法 1.8 mg/kg Q2W PR SD PD 持續反應 AXL TMPs = 1% 下一張幻燈片中的患者自願戒斷患者因 AE 掃描日期 Rotow J、Dy GK、Camidge DR. 海報發表於:國際肺癌研究協會 bioATLA | 概述 35 年 2023 年北美肺癌會議;2023 年 12 月 1-3 日;伊利諾伊州芝加哥。數據截止日期:23 年 6 月 30 日

BA3011 單一療法的射線照相反應 53 歲患有 肺腺癌的男性,2023 年 9 月 20 日 2023 年 3 月 6 日 — 基線掃描 PDL1

治療緊急不良事件(非鱗狀非小細胞肺癌)摘要 BA3011 BA3011 + 總單一療法 nivolumab (N=40) (n=23) (n=17) 具有 CTCAE 3 或 4 級的 TEAE 15 (65.2) 8 (47.1) 23 (57.5) 相關的 3 或 4 級 AEs 8 (34.8) 3 (17.6) 11 (27.5) 任何嚴重的 TEAE 9 (57.5) 39.1) 5 (29.4) 14 (35.0) 相關的 SAE 3 (13.0) 1 (5.9) 4 (10.0) 導致治療 d/c 1 (4.3) 1 (5.9) 2 (5.0) 導致治療 d/c 1 (4.3) 1 (4.3) 1 (5.9) 2 (5.0) TEAE 導致死亡 0 1 (5.9) 1 (2.5) 導致死亡的相關不良事件 0 0 0 Ros Town J、Dy GK、Camidge DR. Poster 現已發佈在:國際肺癌研究協會2023年北美肺癌會議;2023年12月1日至3日;伊利諾伊州芝加哥。BioAtla | 概述 37 數據截止日期:23 年 6 月 30 日

治療緊急不良事件(非鱗狀非小細胞肺癌)* 研究人羣中任何等級 (≥ 15% 的患者)或 ≥3 級(≥ 3% 的患者)任何等級的首選術語 TEAE,n (%) 3 級 TEAE,n (%) 疲勞 14 (35.0) 1 (2.5) 腹瀉 10 (25.0) 1 (2.5) 便祕 9 (22.5) 0 食慾下降 9 (22.5) 1 (2.5) 貧血 8 (20.0) 2 (5.0) 噁心 8 (20.0) 0 周圍神經病變 7 (17.5) 1 (2.5) AST 7 (17.5) 3 (7.5) 呼吸困難 6 (15.0) 2 (5.0) 中性粒細胞減少症 6 (15.0) 2 (5.0) ALT 5 (12.5) 3 (7.5) * 沒有 4+ 級 TEAE} 最常見的 RotowJ、Dy GK、Camidge DR. Poster 發表於:國際肺癌研究協會 2023 年北美肺癌會議;2023 年 12 月 1-3 日;伊利諾伊州芝加哥。BioAtla | 概述 38 數據截止日期: 23 年 6 月 30 日

第 2 階段 BA3011 NSCLC 劑量優化符合美國食品藥品管理局的 Optimus 項目 • 第二季度第三季度給藥方案 • 11 名患者接受了治療 • 截至 12 月 4 日,已有 4 名患者進行了評估(3 個 SD 和 1 個 PD);目標不可知數據預計將在 2024 年上半年出現 • 3Q4W 給藥方案 • 觀察到的依從性不太理想, 已停止入組 ,迄今觀察到的收益風險分佈為 1.8 mg/kg Q2K W 支持在註冊研究中推進該劑量 Rotow J、Dy GK、Camidge DR. 海報發表於:國際肺癌研究協會 2023 年北美 會議肺癌;2023 年 12 月 1-3 日;伊利諾伊州芝加哥。BioAtla | 概述 39

BA3011 NSCLC AXL 表達與抗腫瘤活性的關係 無論AXL表達水平如何,患者都有相當大的抗腫瘤活性,目標病變總和的最佳百分比變化 BA3011 Q2W Mono 40 30 20 0 -10 -20 -30 -40 -50 -60 0 10 20 30 40 50 60 70 80 90 100 tmps (%) 抗腫瘤活性在 AXL 低表達支持水平的患者中可見靶向不可知的 患者的抗腫瘤活性開發 BioAtla | 概述 40% 變化

BA3011 NSCLC 隨機註冊研究設計了通過 FDA C 型會議啟用的兩條可能 註冊路徑和 2 線 + • 開放標籤;對照:多西他賽 • 先前接受過至少一種轉移性疾病治療的非小細胞肺癌患者 • 雙 主要終點:無進展存活率和總存活率 rd 3 線 + • 失明;對照:單化學療法 • 非小細胞肺炎患者之前接受過至少兩線轉移性疾病治療的C • 主要終點:總體生存 BioAtla | 概述 41

CAB-ROR2-ADC 平臺 BA3021 Ozuriftamab Vedotin — NSCLC, 黑色素瘤,SCCHN

轉移性非小細胞肺癌的潛在市場機會是新的 dia ag gun no os see end d p pai no os no op op op polle e e i i i i la ble ble te tre at tm men ent t:: ~200K ((美國美國)) — — m ma aj jor ori city ty >540K ~200K >540K 美國美國 liiv viin ng g wit with h a adv dva an nc ce ed d/1 1 5 llu un ng g g c ca nc ca nc ca nc ce er r 5 1L:Chemo + ICI 50% ORR 1L:Chemo + ICI 50% ORR 2 2 m me et taas st tac tiic 6 6,7 2L+:SOC 14%-23% ORR;2L+:SOC 10%-20% ORR 6 儘管取得了進展 儘管在1L治療中非鱗狀非鱗狀非鱗狀的PFS中位數4.5個月,大多數在1L護理中,但大多數代表細胞佔約75-80% 2L+ 2L+ ~ 75% 的患者大多數是非小細胞肺癌的進展患者 患者 1 2https://www.lung.org/lung-health-diseases/lung-disease-lookup/lung-cancer/resource-library/lung-cancer-fact-sheet https://www.cancer.net/cancer-types/lung-cancer-non-small-3 4 個細胞/統計數據, https://thoracickey.com/carcinomas-of-the-lung-classification-and-genetics/#F1-72,Wang F,Wang S 和 Zhou Q(2020)肺部 5 6 癌症免疫療法的耐藥機制。正面。Oncol. 10:568059. doi:10.3389/fonc.2020.568059,Transl Lung Cancer Res 2021;10 (7): 3093-3105。Cyramza 包裝説明書(2023 年 3 月訪問)bioAtla | 概述 43 1L,第一線;2L+,第二線或以上;NSCLC,非小細胞肺癌;ORR,客觀緩解率(經確認的最佳客觀反應 完全反應或部分反應)、SOC、護理標準(單獨使用多西他賽、多西他賽 + 拉穆西魯單抗)

BA3021(Ozuriftamab Vedotin)在 可變劑量下出現非小細胞肺癌反應的難治患者 30% ROR2 + ROR2 — ROR2 + 不是 ROR2 + ROR2 +(**tmps=100)(**tmps=0)(**tmps=45)可評估(**tmps=95)(**tmps=95)(**tmps=70)(**tmps=50)(**tmps=45)可評估(**tmps=95)(**tmps=95)(**tmps=70)(**tmps=50)(**tmps=45)(**) 1.2mg/kg d1,8 3mg/kg d1 3.3mg/kg d1 1.5mg/kg d1,8 3.3mg/kg d1 3mg/kg d1 20% 10% § 三分之二的 ROR2+ 患者在 -10% 次優劑量 ozuriftamab vedotin c (1.2mg/kg 2Q3W) -20% 患者在轉移進展之前出現了腫瘤治療萎縮的部分 0% 骨損傷 -30% 非小細胞肺癌鱗狀腫瘤:首次掃描時為 10mm 至 0mm -40% -50% -60% 注意:無法評估(報告了強烈、廣泛的纖維細胞間質陽性)**次優劑量 1.2 mg/kg 2Q3W。腫瘤萎縮發生在轉移性骨 病變進展之前。首次掃描時,非小細胞肺癌鱗狀腫瘤為 10mm 至 0mm。BioAtla | 概述目標病變總數與基線相比的最大變化百分比

轉移性黑色素瘤現有治療的潛在市場機會 3 1L 新診斷患者:ICI 33%-50% ORR;(BRAF 侵入性病例/美國生活在大約 130 萬~10 萬 1 年(美國)/用於 BRAF+ 的 Mek 抑制劑)黑色素瘤 2L+:ICI 9%-28% ORR(分別為單 — 4 組合)對初始 反應者沒有反應到 PD-1 治療 30-40% ~ 50% 2 在 1L 設置中進展 2 1 2 3 Clarivate,《疾病現狀與預測:惡性黑色素瘤》(2022年)。www.cancer.net;www.cancer.org;腫瘤學(威利斯頓公園)。33 (4): 141-8。Keytruda USPI於2022年6月訪問;4 Opdivo USPI於2022年6月訪問。VanderWalde A、Moon J、Bellasea S 等。對於對抗PD-1治療無反應的轉移性或不可切除的黑色素瘤患者,使用伊匹木單抗加nivolumab對比單獨使用ipilimumab。發表於:2022年AACR 年會;2022年4月8日至13日;洛杉磯新奧爾良。摘要 CT013。bioAtla | 概述 45 1L,第一線;2L+,第二線或以上;ICI — 免疫檢查點抑制劑。

IV 期多難治性黑色素瘤的 2 期 BA3021 有望出現早期療效信號-繼續在正在進行的研究中收集數據 • 已完成先前在 PD-1/L1 治療方面取得進展的第二季度目標隊列的入組 • 截至 11 月 3 日,八名黑色素瘤單一療法患者可進行評估*,報告了 1 期和第 2 期的首次掃描數據 § 我們共觀察到四種反應,兩種穩定疾病和兩種進行性疾病 § 在 ROR2 TMP 陰性患者中觀察到兩種反應 • 2 期初始數據讀取(n = ~20) 預計將於 2024 年上半年發佈 *7第 2 階段的患者接受了 1.8 mg/kg Q2W,1 名患者在 1 期接受了 3.0 mg/kg Q3W 的 Q3W BioAtla | 概述 46

新診斷為頭部和1L的SCCHN患者的潛在市場機會 新診斷為頭部和1L:Pembro、cetuximab,>40萬~6.6K 1例/年(美國)頸癌 4 鉑金 36% ORR 1(美國)4 2L+:ICI 13%-16% ORR 局部晚期疾病有效在伊爾 或難治性 2 後出現復發 2L+ 3 ~ 50% 疾病 1 2 Clarivate,《疾病現狀與預測:SCCHN》(2022年)。www.cancer.net;Argiris A等人(2017年)複發性和/或轉移性鱗狀癌的循證治療選擇 3 4 頭頸部細胞。正面。 Oncol. 7:72;《未來腫瘤學》,2019 年 1 月。第 15 卷,第 8 期;Ketruda USPI 於 2022 年 6 月訪問;Opdivo USPI 於 2022 年 6 月訪問。SCCHN,頭頸部鱗狀細胞癌;1L,第一線;2L,第二線;2L+,第二線或以上;ICI — 免疫檢查點抑制劑。BioAtla | 概述 47

在多個 適應症中,BA3021 支持的 1 期結果進入第 2 階段 ROR2+ 腫瘤類型結果 2/ 3 名先前服用 PD-1 失敗且接受 2 期或更高劑量黑色素瘤的患者 NSCLC§ PR 對先前出現過 PD-1 失敗的 1/1 患者進行 CR § 肺轉移清除 隨後腺病正常化 § 持續 CR 停止治療 2 年以上 SCCHN § 1/1 ROR2+ 中的 PR 對包括西妥昔單抗和 PD-1(pembrolizumab)在內的先前四種療法具有難治性(pembrolizumab)有望實現安全性 和耐受性跨多種腫瘤類型的概況迄今為止,臨牀上沒有 ROR2 ADC 或小分子,這表明 CAB-ROR2-ADC 是針對多種腫瘤類型的首創療法 BioATLA | 概述 48

CAB-ROR2-ADC BA3021 Ozuriftamab Vedotin 劑量第 1 天第 8 天 15 天 22 Q2W 所有周期(28 天)1.8 mg/kg 無藥物 1.8 mg/kg 無藥物 2Q3W 1.8 mg/kg 1.8 mg/kg 無藥物 — 所有周期(21 天)1.3 mg/kg 1.3 mg/kg — 週期 1(21 天)1.3 mg/kg 1.3 mg/kg 1.3 mg/kg — 週期 1(21 天)1.3 mg/kg 1.3 mg/kg 1.3 mg/kg — 週期 1(21 天)1.3 mg/kg 1.3 mg/kg 1.3 mg/kg — kg 無藥物週期 2(28 天)及後續週期 BioAtla | 概述 49 來源:10-K 表格

使用 CAB-ROR2-ADC BA3021 Ozuriftamab Vedotin 適應症的 2 期臨牀研究給藥方案摘要 Q2W 單一療法 Q2W 單一療法 N ~ 20 √ NSCLC* Q2W 組合使用 nivolumab N ~ 20 √ 未推進;3Q4W 單一療法 N ~ 20 次最佳順應性 Q2W 單一療法 N ~ 25 完全入組 單一療法 N ~ 20 未推進頭頸部 2Q3W 單一療法 N ~ 20 已入組 *目前沒有計劃進一步內部探索非小細胞肺癌 bioAtla | 概述 50 NSCLC = 非小細胞肺癌

雙特異性平臺 cab-epCAM x CAB-CD3 (BA3182) — 腺癌

BA3182 — cab-epcamxCAB-CD3 雙特異性 T 細胞結合劑 (TCE) 安全有效 epcamxCD3 雙特異性的重要機會 • BA3182 表現出有效的腫瘤 • epCam 以正常的上皮收縮表達,具有優異的安全特徵細胞,在廣泛的範圍內過度表達 • 在 NHP 的非 GLP 和 GLP 毒素研究中,腫瘤(腺癌)雙重選擇可帶來高選擇性 • CD3-雙特異性藥物已證實 ► TI 可增加 160 倍的有益效果,但受到 ► 未達到 MTD (5mg/kg 最高劑量限制毒性,即細胞因子研究=NOAEL) 釋放綜合徵 (CRS) ► 未觀察到細胞因子釋放或其他已知的 epCam 或 CD3 相關毒性腫瘤收縮安全概況 wt-epCam x WT-CD3 cab-epCAM x CAB-CD3 (BA3182) *0.25mg/kg = 2 正常 *0.25mg/kg = 2 正常 *0.05 mg/kg = 2 過期 *2.5 mg/kg = 2 正常 *2.5 mg/kg = 2 正常 *2.5 mg/kg mg/kg = 10 正常 *5.0 mg/kg = 10 正常劑量 *單劑量 — 非 GLP 毒性研究 *QW x 4 周 — GLP 毒性研究 mixENO 模型,含 HCT116 = 結直腸癌細胞系 WT = 野生型;*來自獨立實驗 BioAtla | 概述 52 1mg/kg 兩次小鼠/周(相當於非人靈長類動物的 0.25mg/kg)MTD = 最大耐受劑量 TI = 治療指數 腫瘤體積 3 (mm)

FDA 批准了 CAB-epcamxCAB-CD3 雙特異性 TCE (BA3182) 晚期腺癌的 1/2 期臨牀試驗設計第 1 部分:最多 128 名晚期腺癌患者 • 加速滴定中最多 8 名患者 • 針對 10 種計劃標準滴定劑量水平的 2 種治療計劃中每項最多 60 個 第 2 部分:評估 BA3182 對患者的療效和安全性的開放標籤研究具有符合條件的表達 EpCam 的腫瘤膜百分比評分已清除 (TMP) 的晚期腺癌(將根據第 1 部分數據確定)。已清除 bioAtla | 概述 53

2024 年 2024 年 1H 2H 的關鍵里程碑和催化劑 • BA3071: • BA3071: o 讀取更多治療難治性實體瘤的 2 期數據 o 評估 BA3071 在 10mg/kg 劑量水平下的安全性和有效性 o 確定 BA3071 在治療難治性適應症中的關鍵路徑 o 治療難治性實體瘤的第二階段(約 20 分)• 啟動可能的註冊研究要麼是實體瘤中的 BA3071 o 證明支持數據為單一療法和組合療法和/或 BA3011 在 NSCLC 中 • BA3011: •為 BA3071 和/或一個 CAB ADC 建立戰略合作,以確認與靶標無關的 NSCLC 患者的臨牀益處(約 30 分)• epCam 1 期數據讀取;啟動第 2 階段作為數據支持 o 更新 UPS 狀態 • BA3021:讀出黑色素瘤(n = 約 25 分)和 SCCHN(約 20 分)BioAtla 的最終數據集 | 概述 54

© BioAtla 是一家臨牀階段公司,專注於使用條件活性生物製劑 (CAB) 改造 癌症療法,兩期 2 期 CAB-ADC,優先管道一 2 期 CAB-CTLA-4 專有技術 1.413 億美元的現金和臨牀讀數,截至 在 2024 年之前廣泛適用於固體多適應症/雙特異性 T 細胞參與者 09/30/23 腫瘤資產 BA3011 提高足夠的現金狀況以增加治療推進2025年下半年可能註冊的戰略性試驗合作肉瘤的視窗以及其他適應症的潛在討論 BioAtla | 概述 55