

2024 年 1 月公司介紹附錄 99.1

法律披露本演示文稿 包含前瞻性陳述,所有前瞻性陳述均受本警示性陳述的全面限制。此處包含的許多前瞻性陳述可以通過使用前瞻性詞語來識別,例如 “可能”、 “預期”、“相信”、“可能”、“預期”、“應該”、“計劃”、“打算”、“估計”、“將”、“潛在” 和 “持續” 等,儘管並非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述 包括有關我們的研發項目以及我們當前和未來的臨牀前研究和臨牀試驗的啟動、時間、進展、結果和成本的陳述,包括關於啟動和完成研究或試驗的時間以及相關準備工作的陳述、試驗結果公佈的時間段以及我們的研發計劃;我們成功製造藥物物質和前體候選產品 候選產品的能力臨牀用途,用於臨牀試驗和更大規模的商業用途(如果獲得批准);我們的第三方戰略合作者繼續與我們的 開發候選品和候選產品相關的研發活動的能力和意願;我們為完成候選產品的進一步開發和商業化所需的運營獲得資金的能力;我們獲得和維持監管部門對 候選產品的批准的能力;候選產品的市場規模和增長潛力,以及我們的為這些市場服務的能力;我們的財務業績;我們的業務模式的實施,以及我們的業務和 候選產品的戰略計劃。除非另有説明,否則這些前瞻性陳述僅代表截至本演講之日,我們沒有義務更新或修改任何此類陳述以反映本演示之後 發生的事件或情況。由於前瞻性陳述本質上受風險和不確定性的影響,其中一些是無法預測或量化的,有些是我們無法控制的,因此您不應依賴這些前瞻性 陳述作為對未來事件的預測。有關這些風險和不確定性以及其他重要因素的討論,其中任何一個都可能導致我們的實際業績與前瞻性陳述中包含的有所不同,請參閲 我們最近向美國證券交易委員會提交的10-K表年度報告和10-Q表季度報告中題為 “風險因素” 的部分,以及我們隨後向美國證券交易委員會提交的其他文件中對潛在風險、不確定性和其他重要 因素的討論證券交易委員會。我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中預測的 存在重大差異。我們提醒您不要過分依賴本演示文稿中包含的前瞻性陳述。本演示文稿討論了正在進行臨牀前或臨牀 評估且尚未獲得美國食品藥品監督管理局或任何其他監管機構批准上市的候選產品。在臨牀研究報告最終確定之前,此處提供的臨牀試驗數據仍有待調整, 是臨牀現場審計和其他審查過程的結果。沒有就這些候選產品的安全性或有效性作出任何陳述,以供研究此類候選產品的用途。根據任何此類州或其他司法管轄區的證券法, 在註冊或獲得資格 之前,在任何州或其他司法管轄區的要約、招標或出售為非法的州或其他司法管轄區,本演示不構成出售要約或徵求買入要約,也不得出售這些證券。
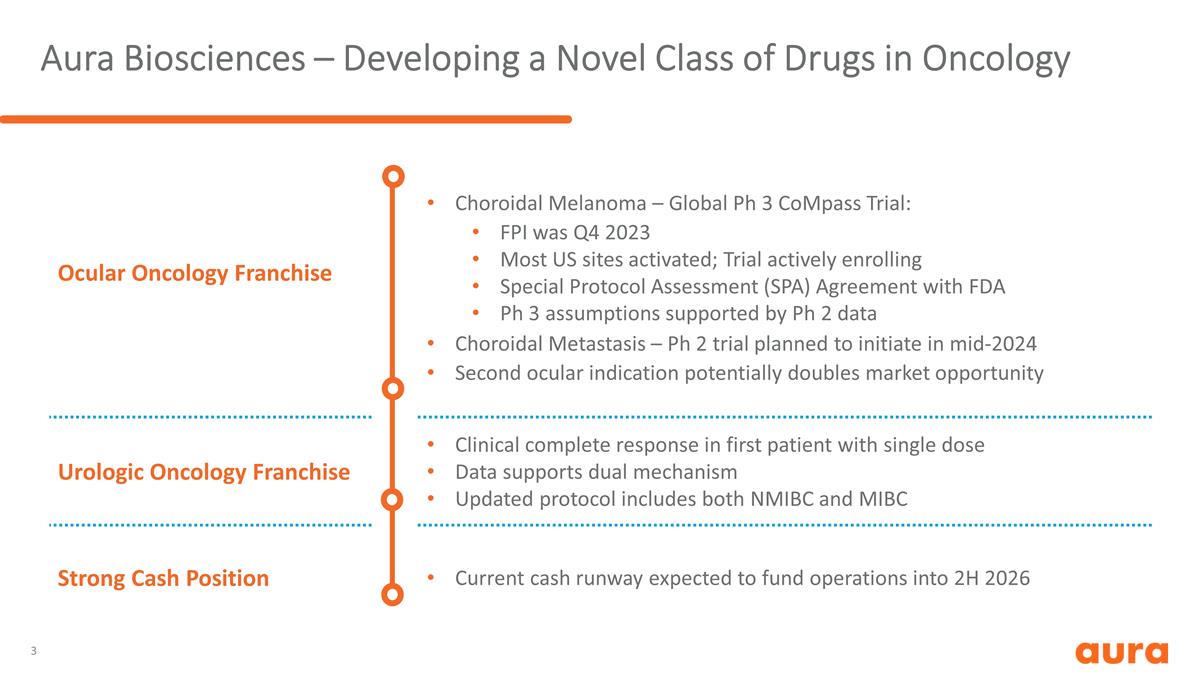
Aura Biosciences — 開發 一類新型腫瘤學藥物眼部腫瘤特許經營權脈絡膜黑色素瘤 — 全球Ph 3 Compass試驗:FPI 已於 2023 年第四季度啟動;試驗正在積極註冊特殊協議評估 (SPA) 與 FDA Ph 3 假設達成協議 Ph 2 數據支持,脈絡膜轉移——Ph 2 試驗計劃於 2024 年中期啟動第二項眼部腫瘤適應症可能使市場機會翻倍泌尿外科腫瘤學特許經營首例單劑量患者的臨牀完全反應 數據支持雙重機制已更新協議包括NMIBC和MIBC的強勁現金狀況。當前的現金流預計將為2026年下半年的運營提供資金
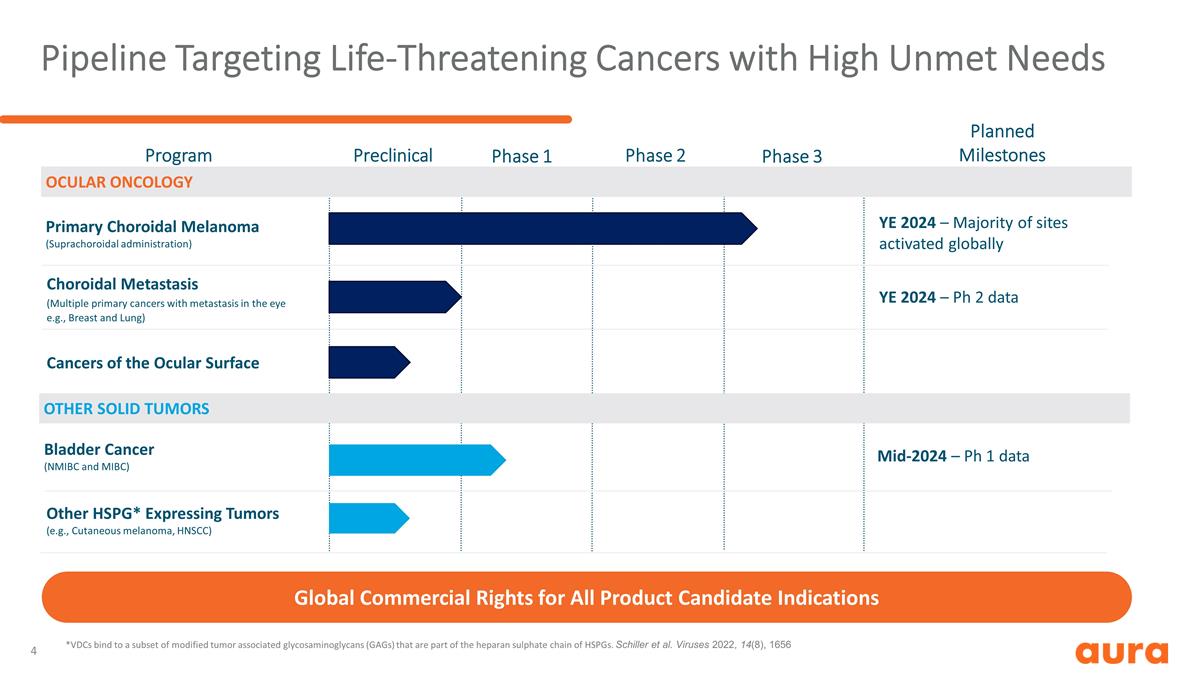
針對高未滿足需求的危及生命的 癌症項目其他實體瘤眼部腫瘤臨牀前 1 期 2 期 3 期計劃里程碑脈絡膜轉移(多種原發性眼部轉移的癌症,例如乳腺和肺部)原發性脈絡膜 黑色素瘤(脈絡膜上給藥)眼表癌膀胱癌(NMIBC 和 MIBC)其他 HSPG* 表達性腫瘤(例如皮膚黑色素瘤、HNSCC)YE 2024 — Ph 2 數據 2024 年中期 — Ph 1 數據 所有候選產品適應症的全球商權 *VDC 綁定轉化為一部分改良的腫瘤相關糖胺聚糖(GAG),這些糖胺聚糖是HSPGs硫酸肝素鏈的一部分。席勒等病毒 2022, 14 (8), 1656 YE 2024 — 全球激活的網站大多數

靶向腫瘤學平臺:類病毒 藥物偶聯物 (VDC) 與細胞毒性載荷偶聯的病毒樣顆粒選擇性結合腫瘤相關 HSPG* 病毒樣顆粒 (VLP) 病毒樣藥物偶聯物 (VDC) Cx 細胞毒性藥物 Kines 等;《國際癌症雜誌》, 138;901—911,2016 年 2 月;Kines 等人;分子癌症療法,17 (2) 2018 年 2 月;Kines 等人;《癌症免疫學研究》,2021 年 5 月潛在的關鍵區別: 多種實體瘤的效力、多價結合和選擇性潛在治療 *VDC 結合改性腫瘤相關糖胺聚糖(GAG)的子集,是HSPGs硫酸肝素鏈的一部分。席勒等病毒 2022, 14 (8), 1656
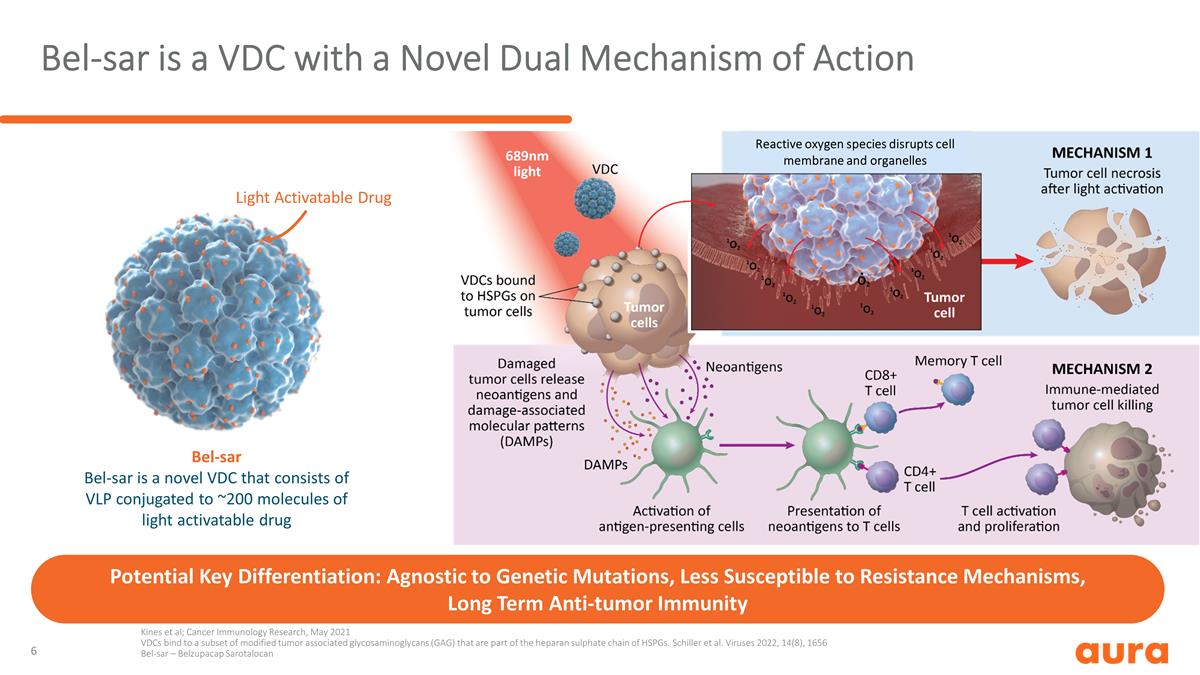
Bel-SAR 是一種具有新型雙 作用機制的 VDC 光激活藥物 Bel-SAR Bel-SAR 是一種新型 VDC,由與約 200 個光活化藥物分子偶聯的 VLP 組成。潛在的關鍵區別:與基因突變無關,不易受耐藥性 機制,長期抗腫瘤免疫Kines等人;癌症免疫學研究,2021年5月 VDC與其中的一部分結合改性腫瘤相關糖胺聚糖(GAG),是HSPGs硫酸肝素鏈的一部分。席勒等 病毒 2022、14 (8)、1656 Bel-SAR — Belzupacap Sarotalocan 活性氧會破壞細胞膜和細胞器
眼部腫瘤專營權 Bel-sar INN: belzupacap sarotalocan 靶向適應症:早期脈絡膜黑色素瘤脈絡膜轉移其他眼癌
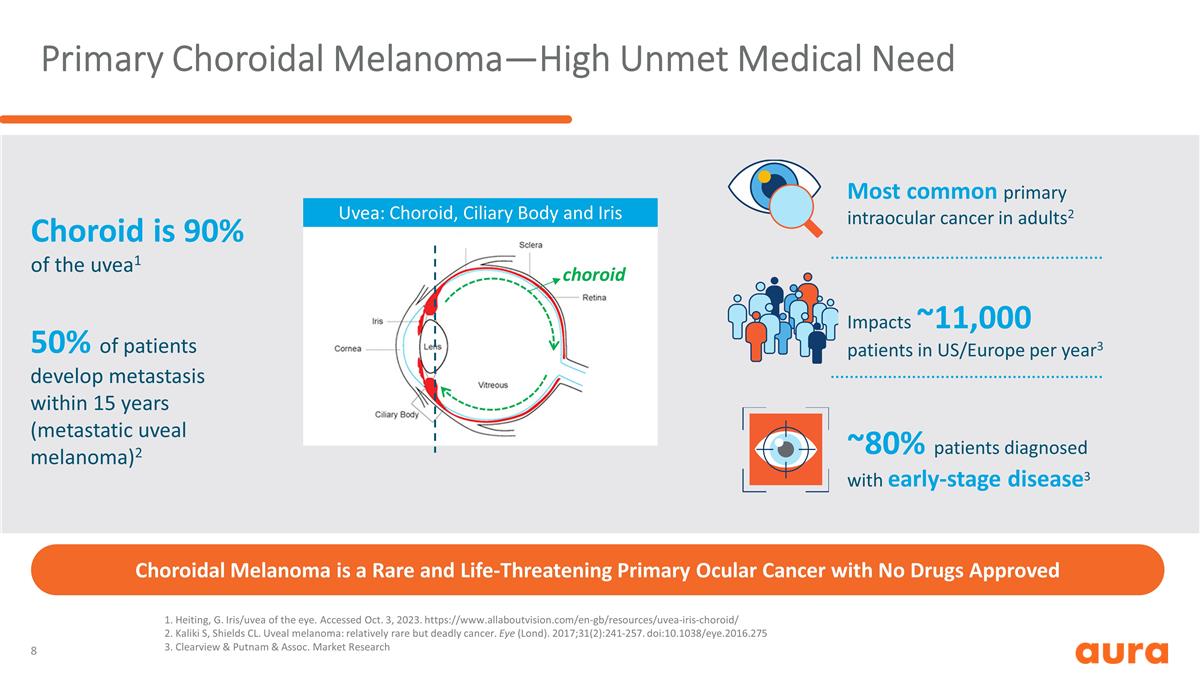
原發性脈絡膜黑色素瘤—高 未滿足的醫療需求脈絡膜黑色素瘤是一種罕見且危及生命的原發性眼癌,未獲批准任何藥物 1.Heiting,G. Iris/UVEA of the eye。已於 2023 年 10 月 3 日訪問。https://www.allaboutvision.com/en-gb/resources/uvea-iris-choroid/ 2.Kaliki S,Shields CL。葡萄膜黑色素瘤:相對罕見但致命的癌症。眼睛(倫敦大學)。2017;31 (2): 241-257. doi: 10.1038/eye.2016.275 3.Clearview & Putnam & Assoc。市場研究成人中最常見的原發性眼內癌2 每年影響美國/歐洲的約 11,000 名患者3 ~ 80% 被診斷為早期疾病的患者3 脈絡膜佔葡萄膜的 90% 1 50% 的患者在 15 年內出現轉移(轉移性葡萄膜黑色素瘤)2 脈絡膜:脈絡膜、睫狀體和虹膜
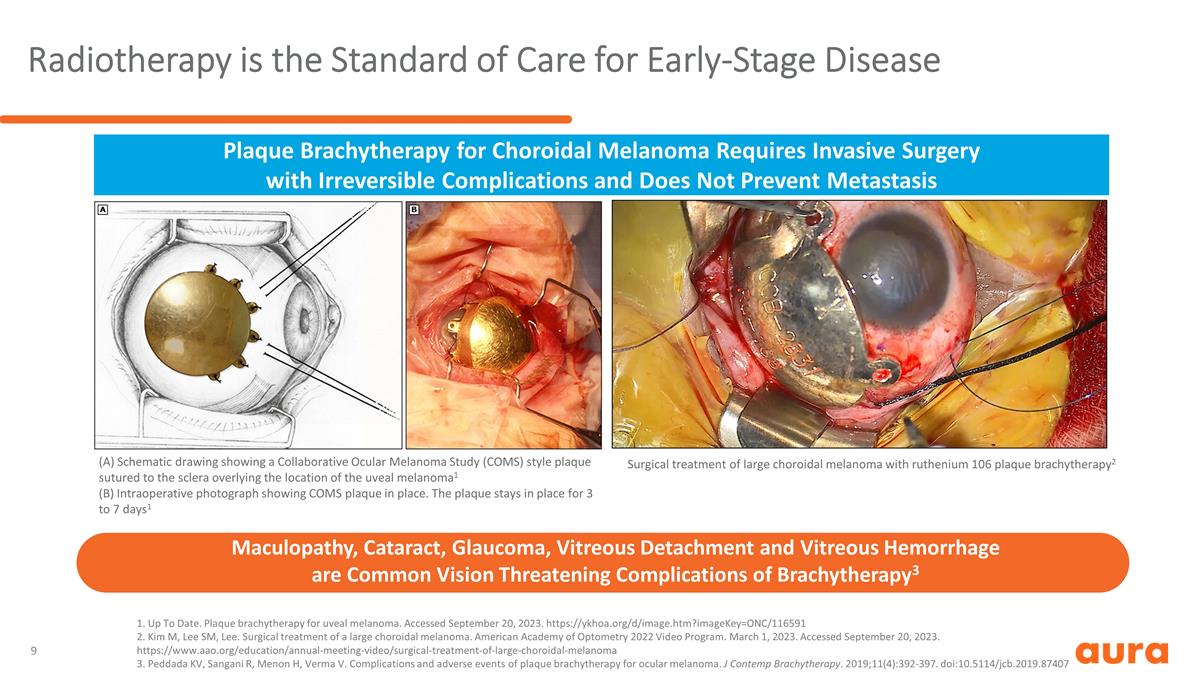
放射治療是早期疾病的護理標準 使用釕106斑塊近距離療法2對大型脈絡膜黑色素瘤進行外科治療。最新。葡萄膜黑色素瘤的斑塊近距離放療。已於 2023 年 9 月 20 日訪問。 https://ykhoa.org/d/image.htm?imageKey=ONC/116591 2.Kim M,Lee SM,Lee。大型脈絡膜黑色素瘤的手術治療。美國驗光學會2022年視頻節目。2023 年 3 月 1 日。已於 2023 年 9 月 20 日訪問。 https://www.aao.org/education/annual-meeting-video/surgical-treatment-of-large-choroidal-melanoma 3.Peddada KV、Sangani R、Menon H、Verma V. 眼部黑色素瘤斑塊近距離放射治療的併發症和不良事件。J Contemp 近距離放射療法。 2019;11 (4): 392-397。doi: 10.5114/jcb.2019.87407 (A) 示意圖顯示了一張眼部黑色素瘤合作研究 (COMS) 式斑塊縫合在葡萄膜黑色素瘤位置上覆蓋的鞏膜1 (B) 術中照片顯示 COMS 斑塊就位。斑塊會在原位停留 3 到 7 天1 脈絡膜黑色素瘤的斑塊近距離放射治療需要進行侵入性手術,具有不可逆轉的併發症,不能預防轉移黃斑病、白內障、青光眼、玻璃體脱離 和玻璃體出血是近距離放射療法常見的威脅視力的併發症3
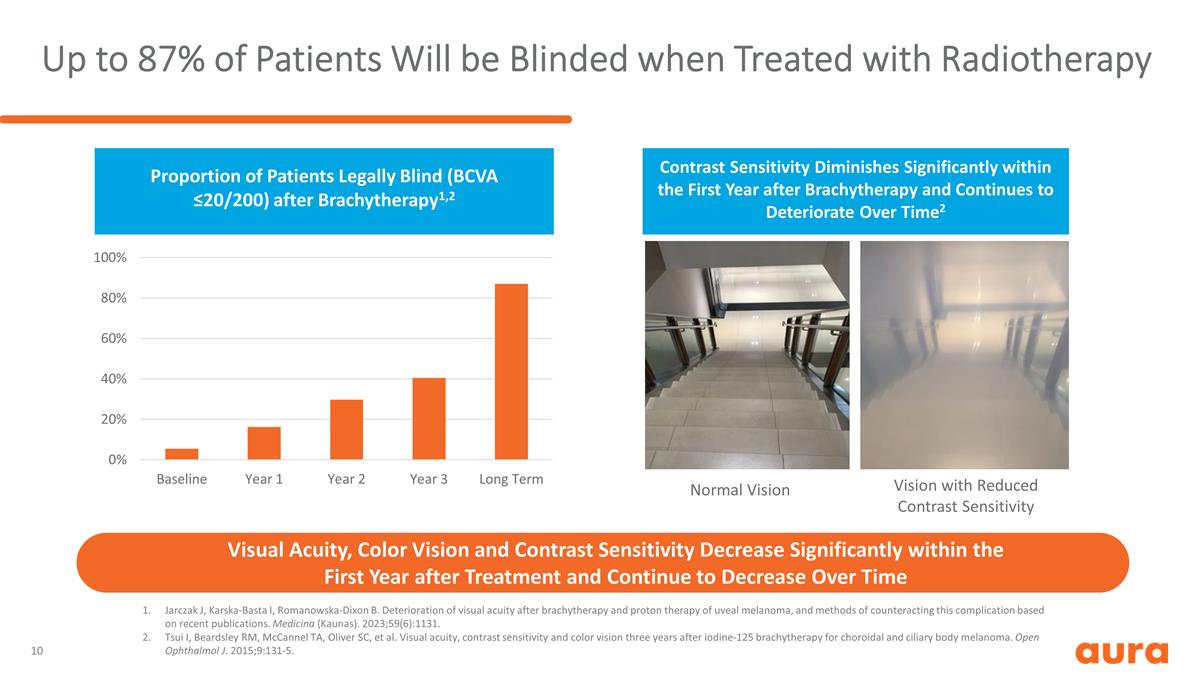
根據最近出版的 出版物,多達 87% 的患者在接受放射治療時會失明 Jarczak J、Karska-Basta I、Romanowska-Dixon B。葡萄膜黑色素瘤的近距離放射治療和質子治療後的視力下降以及對抗這種併發症的方法。醫學(考納斯)。2023;59(6):1131。Tsui I、Beardsley RM、McCannel TA、Oliver SC 等對脈絡膜和睫狀體黑色素瘤進行碘125近距離放射三年後的視力、對比敏感度和色覺。打開 Ophthalmol J. 2015;9:131-5。對比度靈敏度降低的正常視力視力、色覺和對比度靈敏度在治療後的第一年內顯著下降,近距離治療後合法失明(BCVA ≤20/200)患者的比例隨着時間的推移持續下降1,2 對比度靈敏度在近距離放射治療後的第一年內顯著下降並隨着時間的推移繼續惡化2
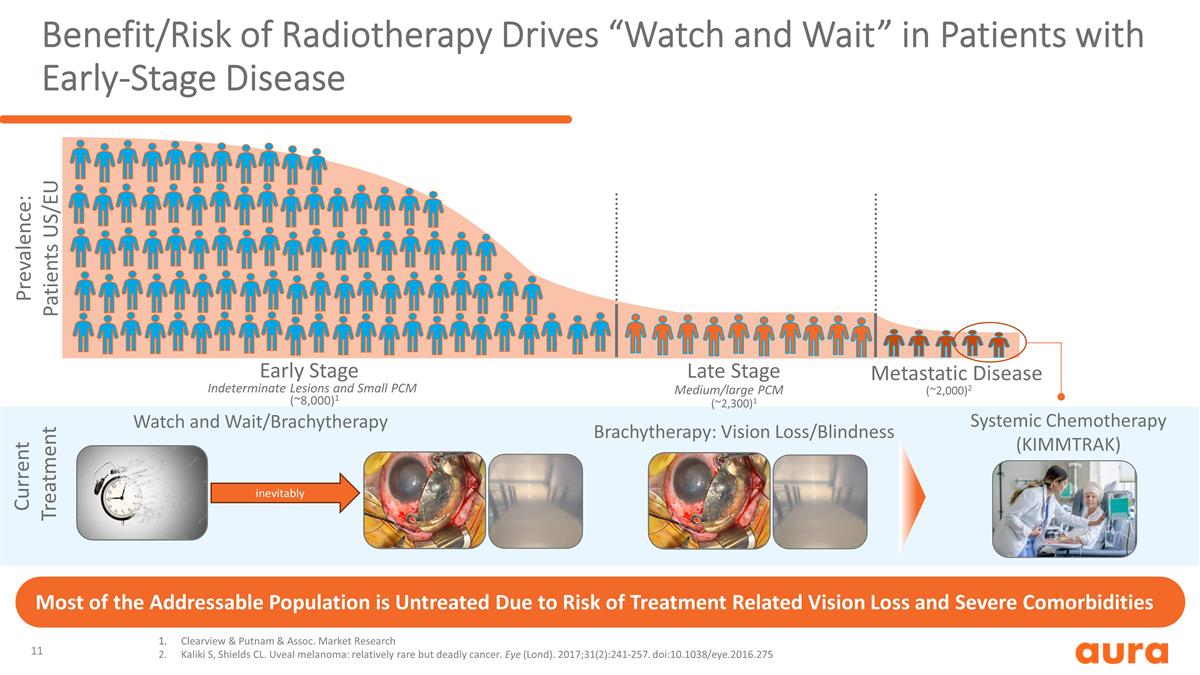
放射治療的益處/風險驅動 早期疾病患者的 “觀察並等待”:視力喪失/失明 Clearview & Putnam & Assoc。市場研究 Kaliki S、Shields CL。葡萄膜黑色素瘤:相對罕見但致命的癌症。眼睛(Lond)。 2017; 31 (2): 241-257. doi: 10.1038/eye.2016.275 (~8,000) 1 (~2,300) 1 (~2,000) 2 不確定的病變和小型 PCM 中型/大型 PCM 患病率:患者美國/歐盟早期晚期轉移性疾病系統性化療 (KIMMTRAK) 目前的治療 觀察和等待/近距離放射療法大部分可以解決的問題由於不可避免地會出現與治療相關的視力喪失和嚴重合並症的風險,人羣得不到治療
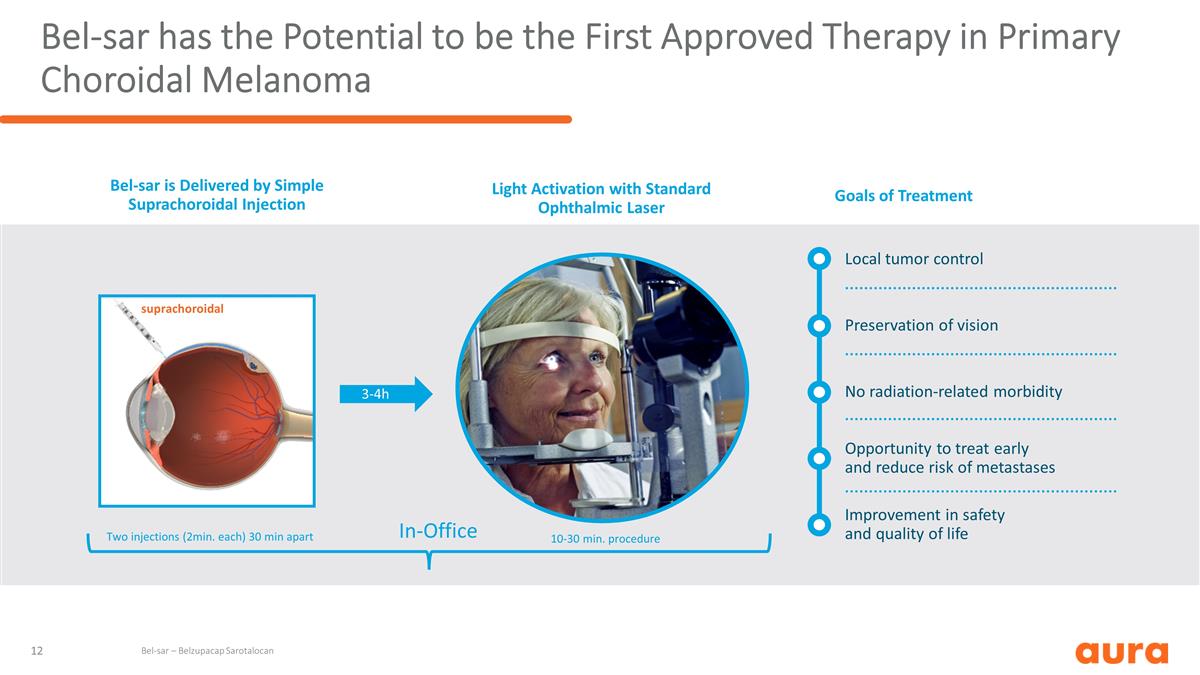
Bel-sar 有可能成為 首個獲批准的原發性脈絡膜黑色素瘤療法無輻射相關發病率保持視力局部腫瘤控制有機會及早治療並降低轉移風險改善安全性和生活質量 Bel-sar 由 實現簡單上絡膜注射治療目標使用標準眼科激光激活上絡膜光 Bel-sar — Belzupacap Sarotap Sarotap Alocan 3-4 小時辦公室內兩次注射(每次 2 分鐘)間隔 30 分鐘 10-30 分鐘手術

眼部腫瘤學特許經營 代表着數十億美元的潛在市場機會眼部腫瘤特許經營權總潛在市場(美國/歐盟)約80%的患者在早期被診斷出來(不確定病變(IL)和小腫瘤)當前的放射治療 治療使大約 87% 的患者出現嚴重不可逆轉的視力喪失 ~100 名眼部腫瘤學家——重點呼叫點
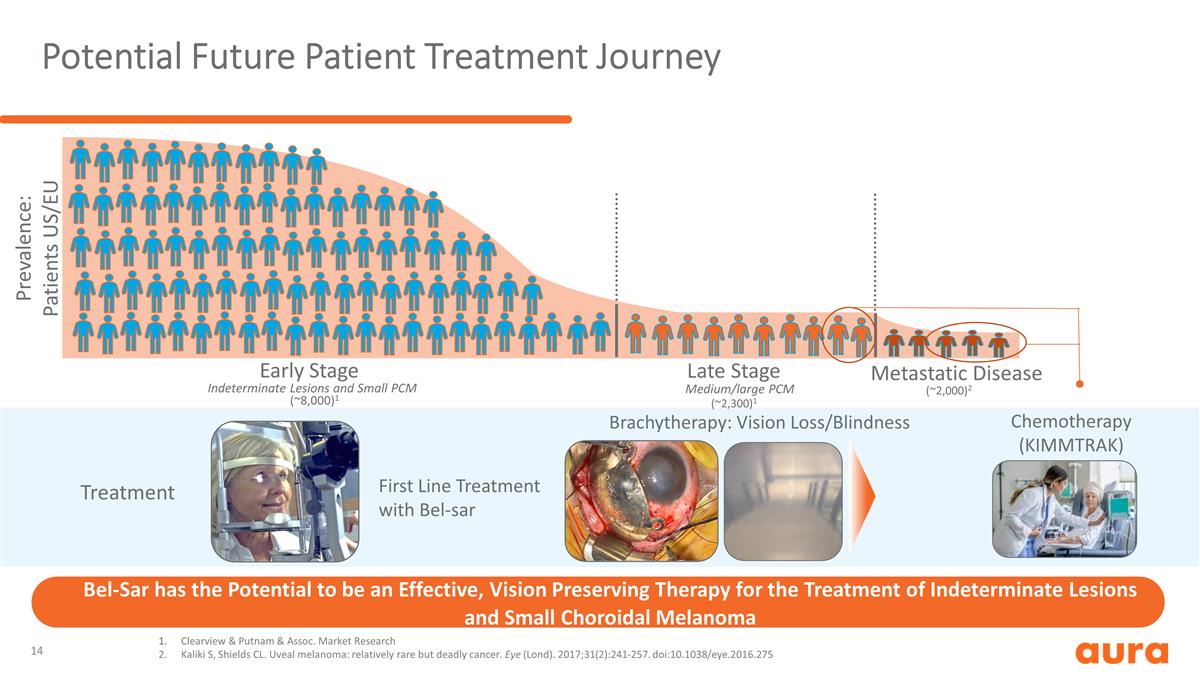
Bel-Sar 有可能成為 有效的視力保持療法,用於治療不確定病變和小脈絡膜黑色素瘤潛在的未來患者治療旅程使用 Bel-sar 近距離放射療法進行一線治療:視力喪失/失明 (~8,000) 1 (~2,300) 1 (~2,000) 2 不確定的病變和小型 PCM 中/大型 PCM 早期晚期轉移性疾病化療 (KIMMTRAK) 患病率:患者美國/歐盟 Clearview & Putnam & Assoc市場研究 Kaliki S、Shields CL。葡萄膜 黑色素瘤:相對罕見但致命的癌症。眼睛(倫敦大學)。2017;31 (2): 241-257. doi: 10.1038/eye.2016.275
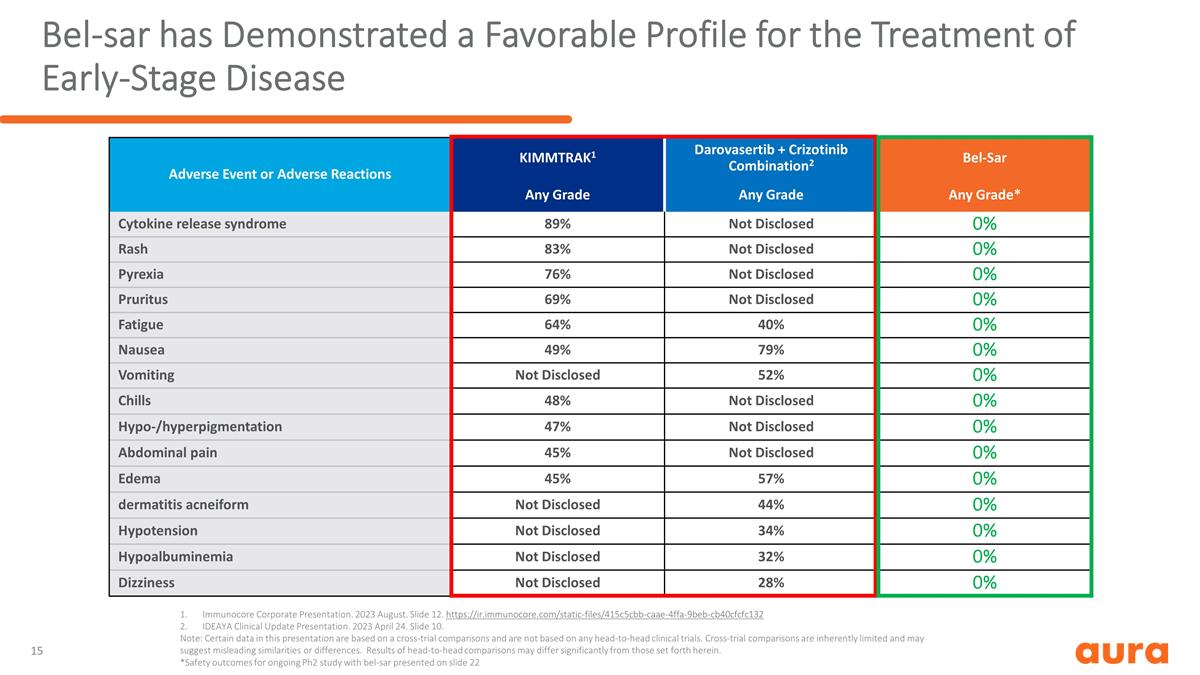
不良事件或不良反應 KIMMTRAK1 Darovasertib + Crizotinib 組合2 Bel-Sar 任何等級任何等級任何等級* 細胞因子釋放綜合徵 89% 未披露 0% 皮疹 83% 未披露 0% 瘙癢 69% 未披露 0% 疲勞 64% 0% 噁心 49% 未披露 52% 0% 寒戰 48% 未披露 0% 低潮 0% /色素沉着 47% 未披露 0% 腹痛 45% 未披露 0% 水腫 45% 57% 0% 痤瘡樣皮炎未披露 44% 0% 低血壓未披露 34% 0% 未披露 34% 0% 低白蛋白血癥未披露 32% 0%頭暈未披露 28% 0% Immunocore 公司簡報。2023 年 8 月。幻燈片 12。https://ir.immunocore.com/static-files/415c5cbb-caae-4ffa-9beb-cb40cfcfc132 IDEAYA 臨牀更新演示。2023 年 4 月 24。幻燈片 10。注意:本演示文稿中的某些數據基於跨試驗比較,不基於任何正面交鋒的臨牀試驗。交叉試驗比較本質上是有限的,可能暗示誤導性的相似之處或 差異。正面比較的結果可能與此處列出的結果有很大不同。*幻燈片 22 中顯示的 bel-sar 正在進行的 Ph2 研究的安全結果 Bel-sar 已顯示出 早期疾病的治療效果良好

脈絡膜黑色素瘤 Ph 2 數據
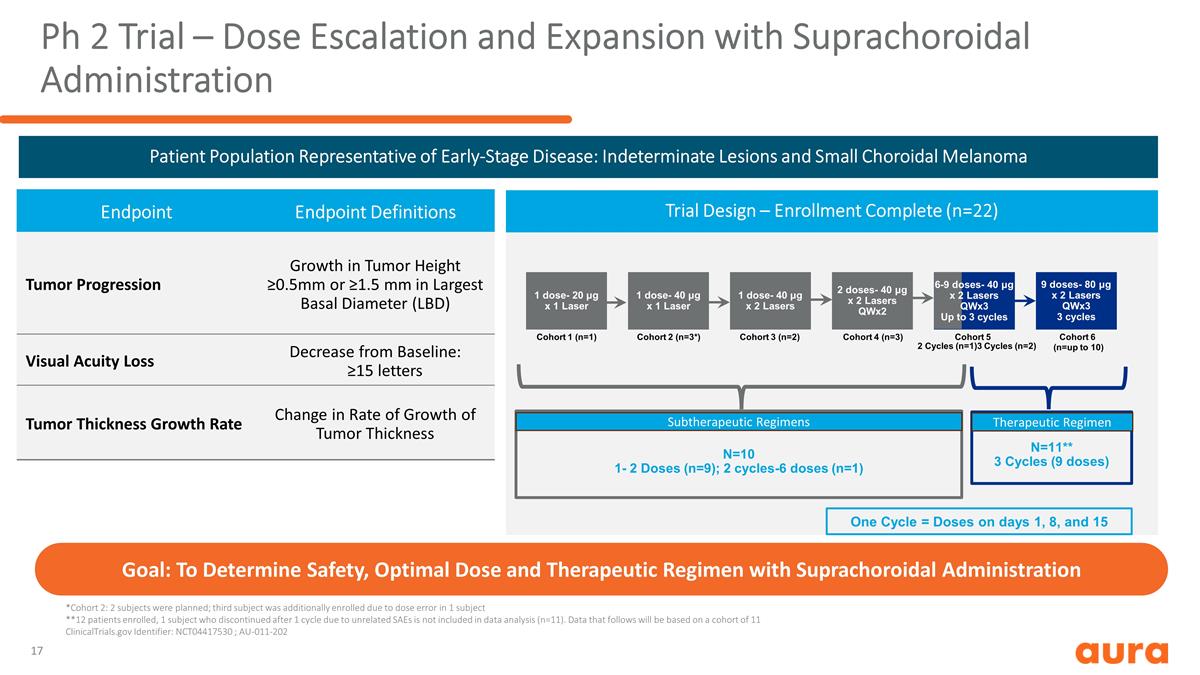
Ph 2 試驗 — 劑量遞增 和擴大劑量上腔給藥試驗設計 — 入組完成(n=22)*隊列 2:計劃了 2 名受試者;由於1名受試者的劑量錯誤,增加了第三名受試者 **12名患者入組,1名因無關SAEs 在 1 個週期後停藥的受試者不包括在數據分析中(n=11)。以下數據將基於由 11 個 ClinicalTrials.gov 組成的隊列標識符:NCT04417530;AU-011-202 目標:確定安全性、最佳劑量和 治療方案一個週期 = 第 1 天、第 8 天和第 15 天的劑量 1 劑量-20 μg x 1 激光 1 劑量-40 μg x 2 激光 2 劑量 q-40 μg x 2 激光 2 劑量 q-40 μg x 2 激光 wx2 隊列 1 (n=1) 隊列 2 (n=3*) 隊列 3 (n=2) 隊列 4 (n=3) 隊列 5 9 劑量-80 μg x 2 激光 qwX3 3 週期隊列 6 (n=最多 10) 2 個週期 (n=1) 3 個週期 (n=2) N=10 1-2 劑量 (n=9);2 個週期 (n=9) 劑量 (n=1) N=11** 3週期(9 劑量)6-9 劑量-40 μg x 2 激光器 qwx3 向上 至 3 個週期早期疾病代表患者羣體:不確定的病變和小脈絡膜黑色素瘤終點定義腫瘤進展腫瘤高度≥0.5mm 或 ≥1.5 mm 最大基底直徑 (LBD) 視力下降較基線下降:≥15 個字母腫瘤厚度增長率生長速率變化腫瘤厚度亞治療方案治療方案
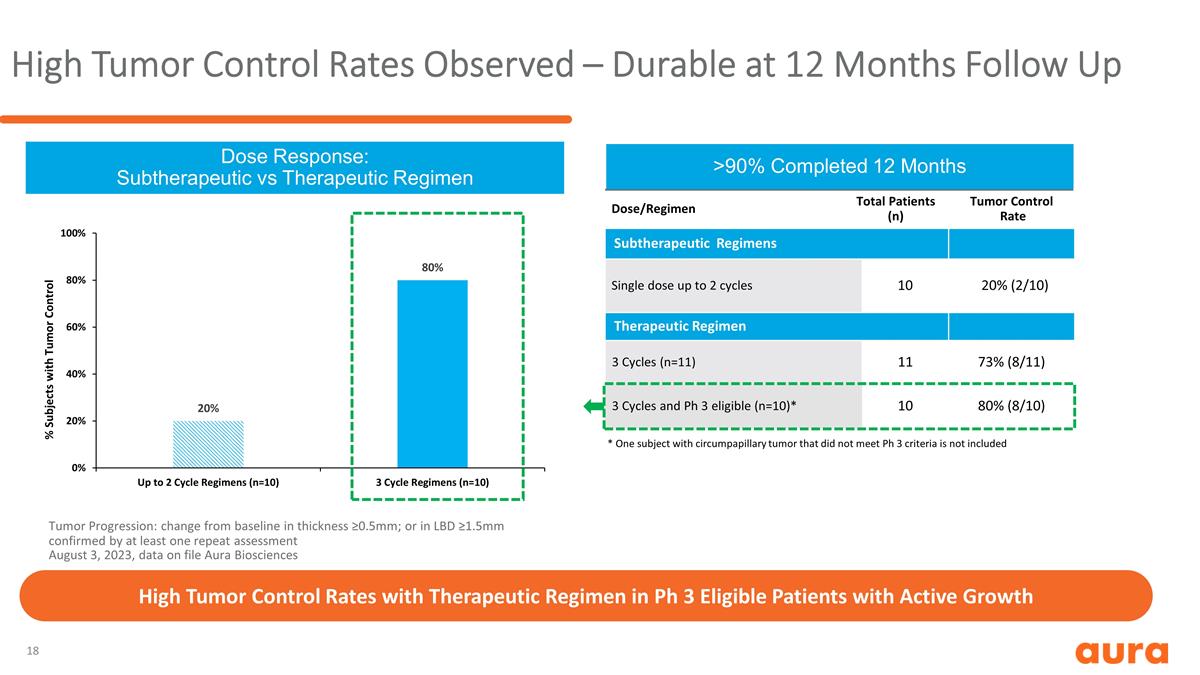
觀察到較高的腫瘤控制率 — 持續12個月的隨訪劑量反應:亞治療與治療方案腫瘤進展:厚度與基線相比變化≥0.5mm;或者 2023 年 8 月 3 日至少一次重複評估證實了 LBD ≥1.5mm, 文件中的數據 Aura Biosciences 劑量/方案患者總數 (n) 腫瘤控制率亞治療方案單劑量最多 2 個週期 10 20% (2/10) 治療方案 3 個週期 (n=11) 11 73% (8/11) 3 個週期和 Ph 3 合格 (n=10) * 10 80% (8/10) > 90% 已完成 12 個月 * 一個受試者對於不符合 Ph 3 標準的環乳頭狀腫瘤,不包括在符合Ph 3條件的活躍生長患者中,治療方案具有較高的腫瘤控制率
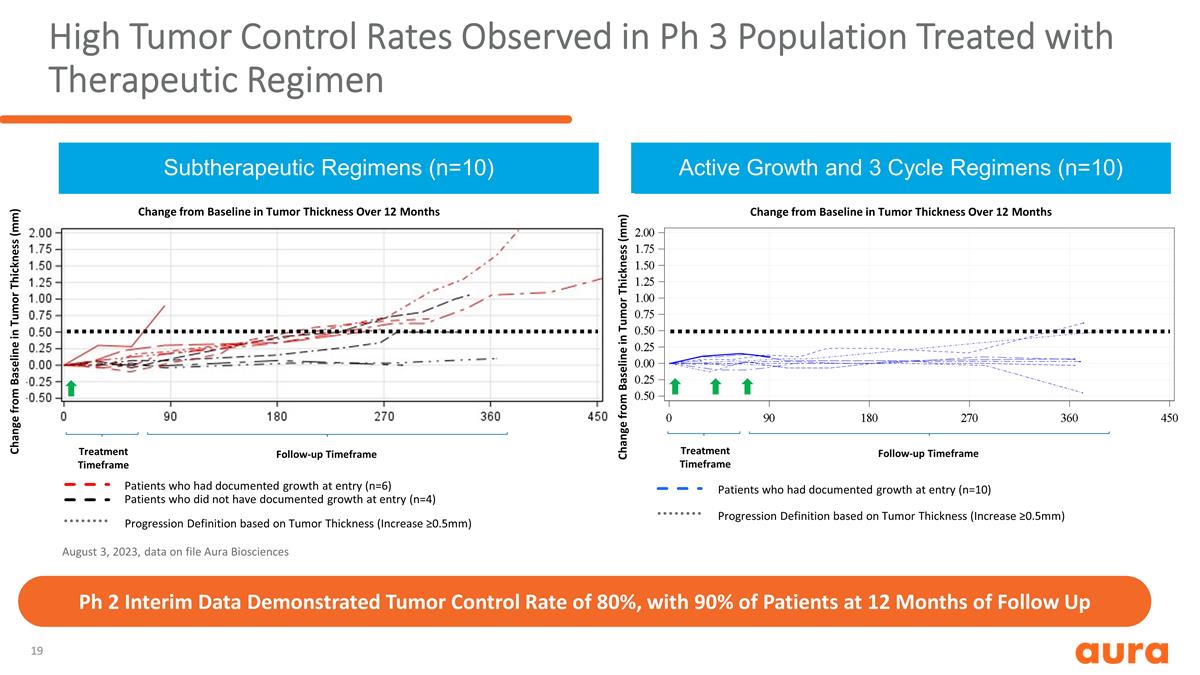
2023 年 8 月 3 日,在接受治療方案治療的 Ph 3 人羣中觀察到較高的腫瘤控制率 ,存檔數據 Aura Biosciences 活性生長和三週期方案(n=10)進展定義基於腫瘤厚度(增加 ≥0.5mm)腫瘤厚度 厚度在 12 個月內治療時間框架與基線的變化(n=10)Ph 2 中期數據顯示腫瘤對照率為 80%,隨訪 12 個月後 90% 的患者的腫瘤厚度 (mm) 與基線相比變化在入院時記錄增長的患者(n=6)未記錄入院時生長的患者(n=4)進展定義基於腫瘤厚度(增加 ≥0.5mm)在 12 個月內腫瘤厚度與基線的變化治療時間框架隨訪時間框架有記錄的患者在入院時出現增長(n=10)
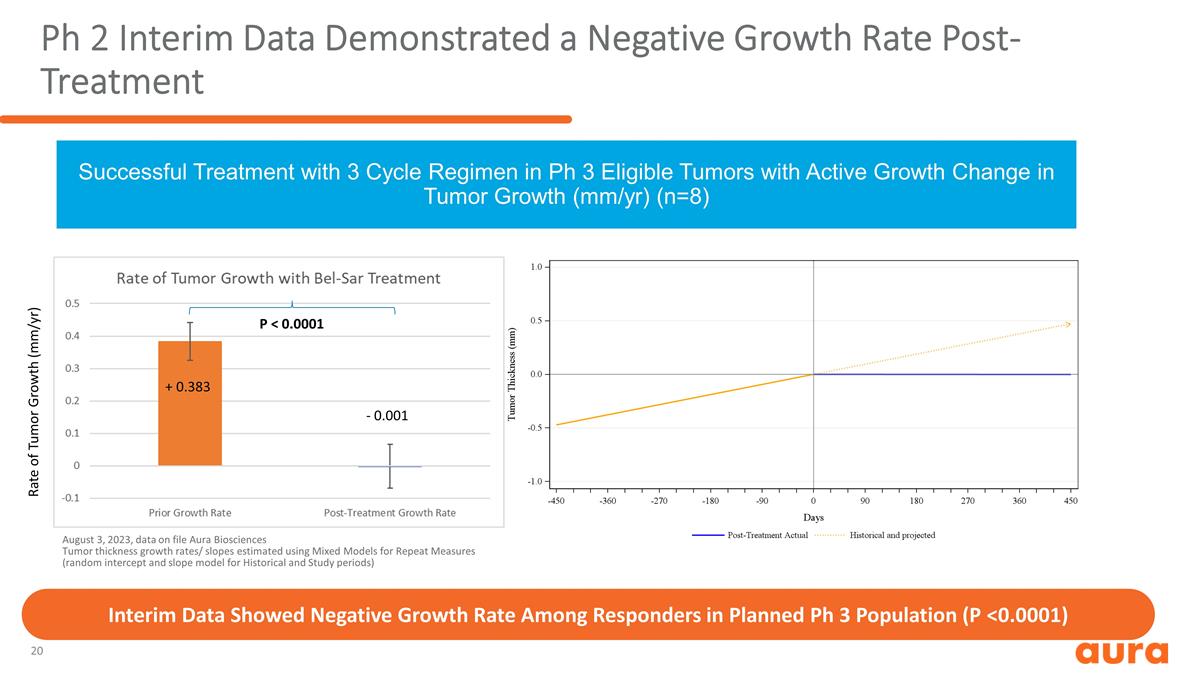
第 2 期中期數據顯示,2023 年 8 月 3 日,在 Ph 3 合格腫瘤生長髮生活躍變化 (mm/yr) (n=8) 的腫瘤中,治療後出現負增長率 ,使用重複測量混合模型(歷史和研究期的隨機截距和斜率模型)估算出的 中期數據顯示,受訪者在計劃中的增長率為負數第 3 期人口 (P )
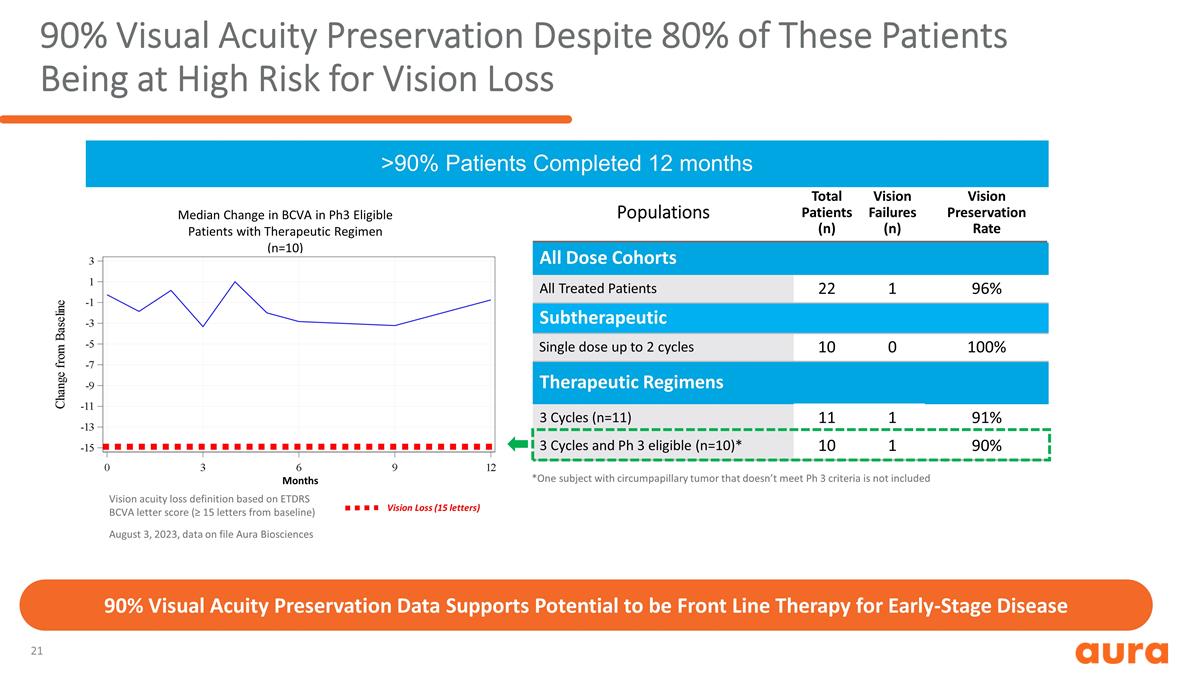
。患者總數 (n) 視力衰竭 (n) 視力保持率所有劑量隊列所有接受治療的患者 22 1 96% 亞治療單劑量最多 2 個週期 10 0 100% 治療方案 3 個週期 (n=11) 11 1 91% 3 個週期和 Ph 3 合格 (n=10) * 10 1 90% > 90% 患者完成了 12 個月 90% 的視力保持,儘管這些患者中有 80% 的視力下降風險很高 *2023 年 8 月 3 日不包括一名患有環乳頭狀腫瘤且不符合 Ph 3 標準的受試者,存檔數據 Aura Biosciences 視力敏度下降定義根據ETDRS BCVA字母分數(距基線至少15個字母),90% 的視力保持數據支持有潛力成為早期疾病的一線治療方案符合Ph3條件的患者BCVA的中位數變化(n=10)視力喪失(15 個字母)月
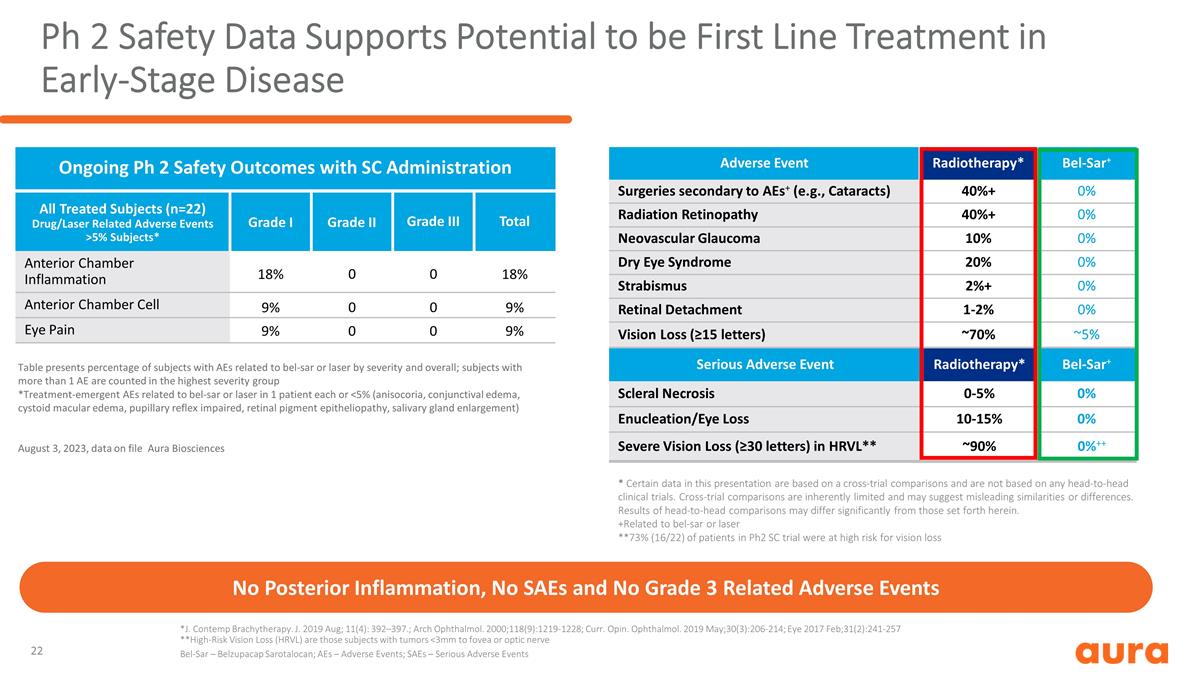
Ph 2 安全數據支持 有可能成為早期疾病的一線治療,無後部炎症,無 SAE,無 3 級相關不良事件 *J. Contemp 近距離放射治療。J. 2019 年 8 月;11 (4):392—397。;Arch Ophthalmol. 2000;118 (9): 1219-1228;Curr。Opin。 ophthalmol. 2019 年 5 月;30 (3): 206-214;眼部 2017 年 2 月;31 (2): 241-257 **高風險視力喪失 (HRVL) 是那些患有腫瘤的受試者 5% 受試者* I 級二級三級前腔總炎症 18% 0 18% 前房細胞 9% 0 9% 眼痛 9% 0 9%

隨機對照全球 Ph 3 試驗
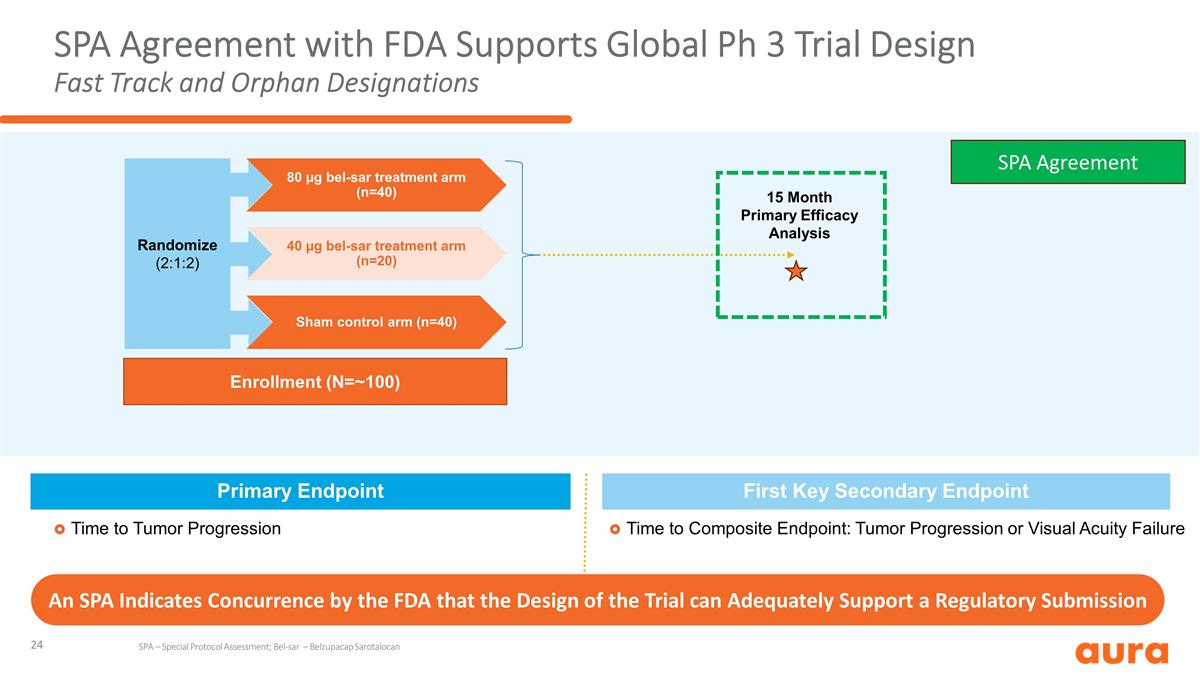
SPA 與 FDA 的協議支持 全球 Ph 3 試驗設計快速通道和孤兒指定複合終點所需時間:腫瘤進展或視力衰竭腫瘤進展時間首要終點註冊 (N=~100) 隨機化 (2:1:2) 80 µg bel-sar 治療組 (n=40) 40 µg bel-sar 治療組 (n=20) Sham 對照組 (n=40) 15 個月主要療效分析 SPA 表示美國食品和藥物管理局同意該試驗的設計能夠充分支持監管機構提交的 申請 SPA 協議 SPA — 特別協議評估;Bel-SAR — Belzupacap Sarotalocan
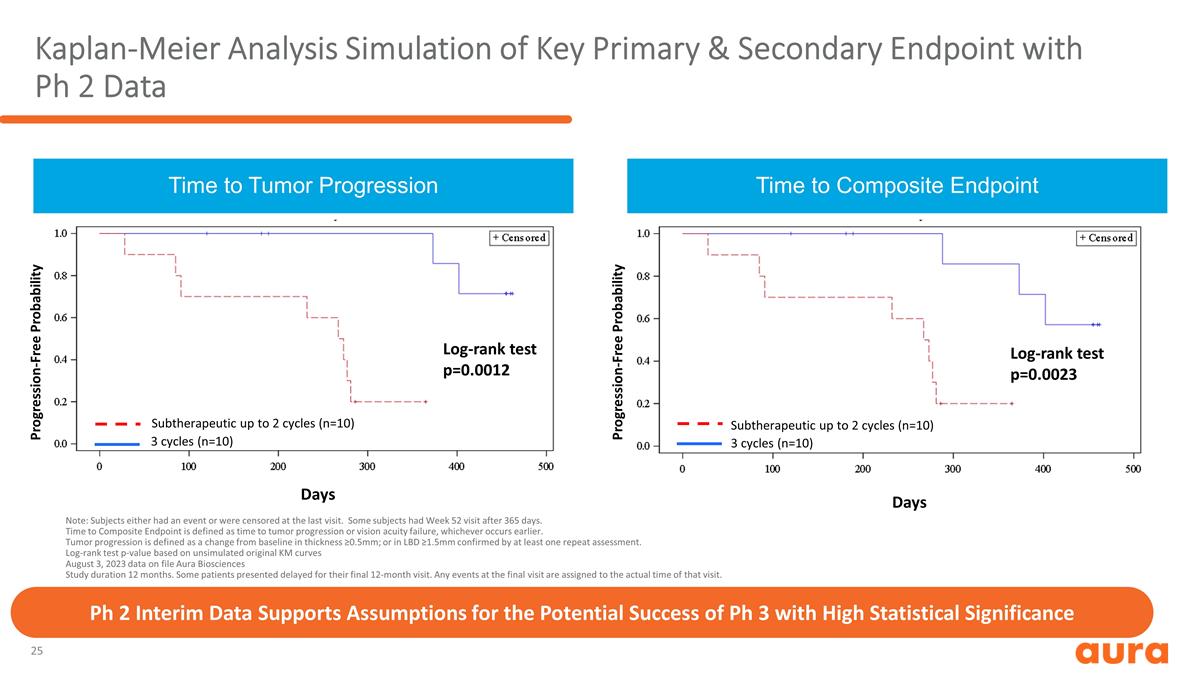
注意:受試者要麼有活動 ,要麼在上次訪問時受到審查。有些受試者在 365 天后接受了第 52 周的就診。到達複合終點的時間定義為腫瘤進展或視力衰竭的時間,以較早發生者為準。腫瘤進展定義為厚度與 基線相比的變化(≥0.5mm);或經至少一次重複評估證實的LBD≥1.5mm。對數排名測試 p 值基於未模擬的原始 KM 曲線 2023 年 8 月 3 日存檔數據 Aura Biosciences 研究持續時間 12 個月。一些 患者出現了最後12個月的就診延遲。最後一次訪問中的任何活動都將以該次訪問的實際時間為準。達到複合終點的時間第 3 天週期 (n=10) 亞治療最多 2 個週期 (n=10) 對數等級測試 p=0.0023 到腫瘤進展的時間 3 個週期 (n=10) 亞治療最多 2 個週期 (n=10) 無進展概率對數排名測試 p=0.0012 Ph 2 中期數據支持具有高統計學意義的 Ph 3 可能成功的假設 Kaplan-Meier 分析使用 Ph 2 數據無進展概率模擬關鍵主要和次要終點
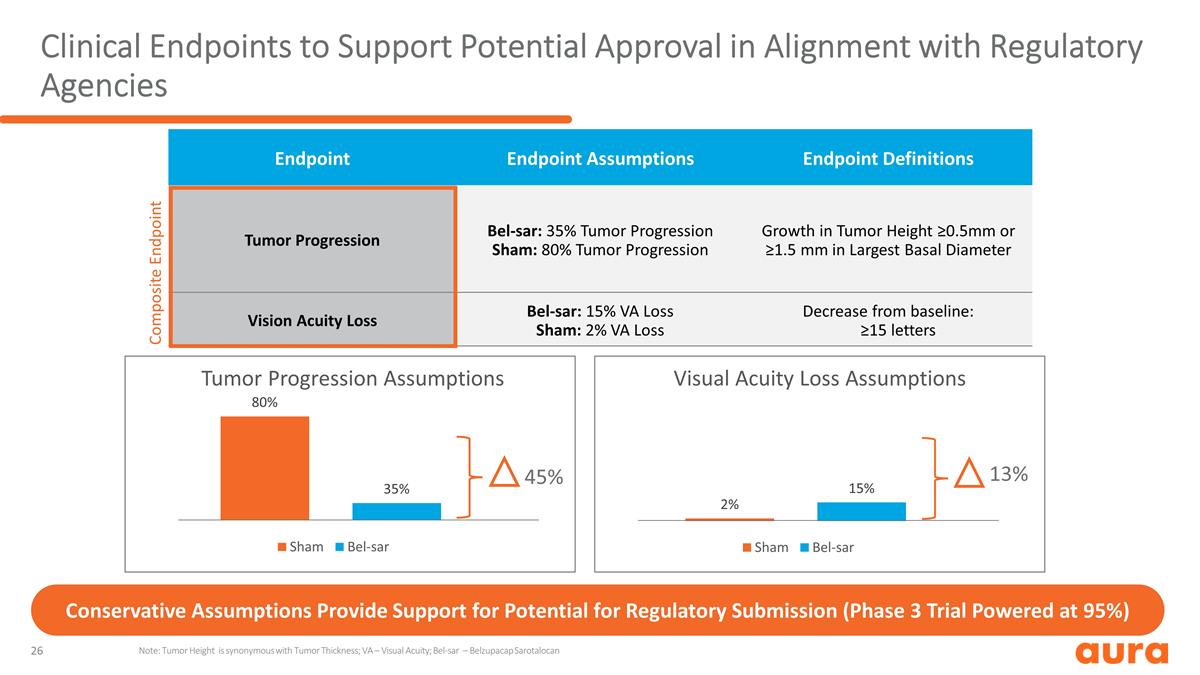
支持 可能獲得監管機構批准的臨牀終點注意:腫瘤高度是腫瘤厚度的代名詞;VA — 視力;Bel-SAR — Belzupacap Sarotalocan 保守假設為監管機構 提交的可能性提供了支持(3 期試驗的支持率為 95%)45% 13% 腫瘤進展假設視力損失假設終點假設終點定義腫瘤進展 bel-SAR:35% 腫瘤進展假設:80% 腫瘤生長進展 腫瘤高度 ≥0.5mm 或最大基底腫瘤高度 ≥1.5 mm直徑視敏度損失 Bel-SAR:15% VA 損失 Sham:2% VA 損耗比基線降低:≥15 個字母複合終點

脈絡膜轉移
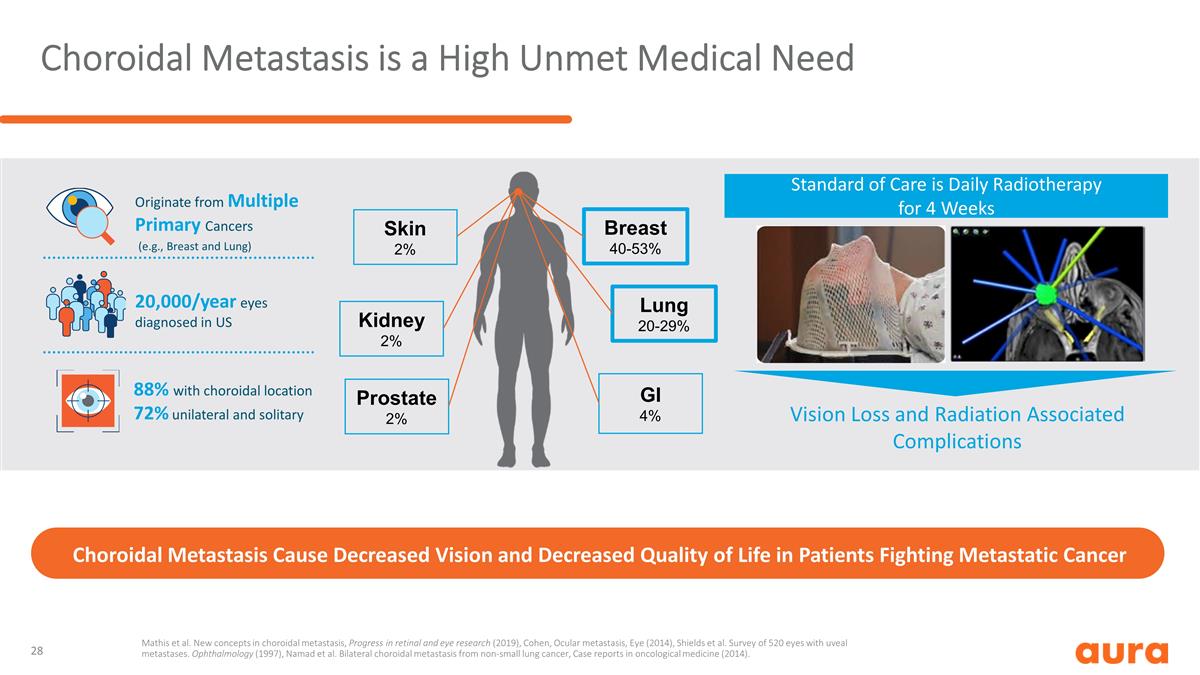
脈絡膜轉移是一種高的 未得到滿足的醫療需求脈絡膜轉移會導致對抗轉移性癌症的患者視力下降和生活質量下降起源於多種原發性癌症(例如乳腺癌和肺癌)20,000/年在美國被診斷出患有脈絡膜 位置 72% 的單側和單獨護理標準是為期 4 周的每日放射治療,視力喪失和與乳房放射相關的肺部併發症 40-53% 20-29% GI 4% 腎臟 2% 前列腺 2% 皮膚 2% Mathis 等人脈絡膜 轉移的新概念,《視網膜和眼科研究進展》(2019),Cohen,《眼部轉移》,《眼部轉移》(2014),Shields等人。對520只患有葡萄膜轉移的眼睛進行了調查。眼科(1997),納馬德等人。來自非小肺癌 的雙側脈絡膜轉移,腫瘤醫學病例報告(2014)。
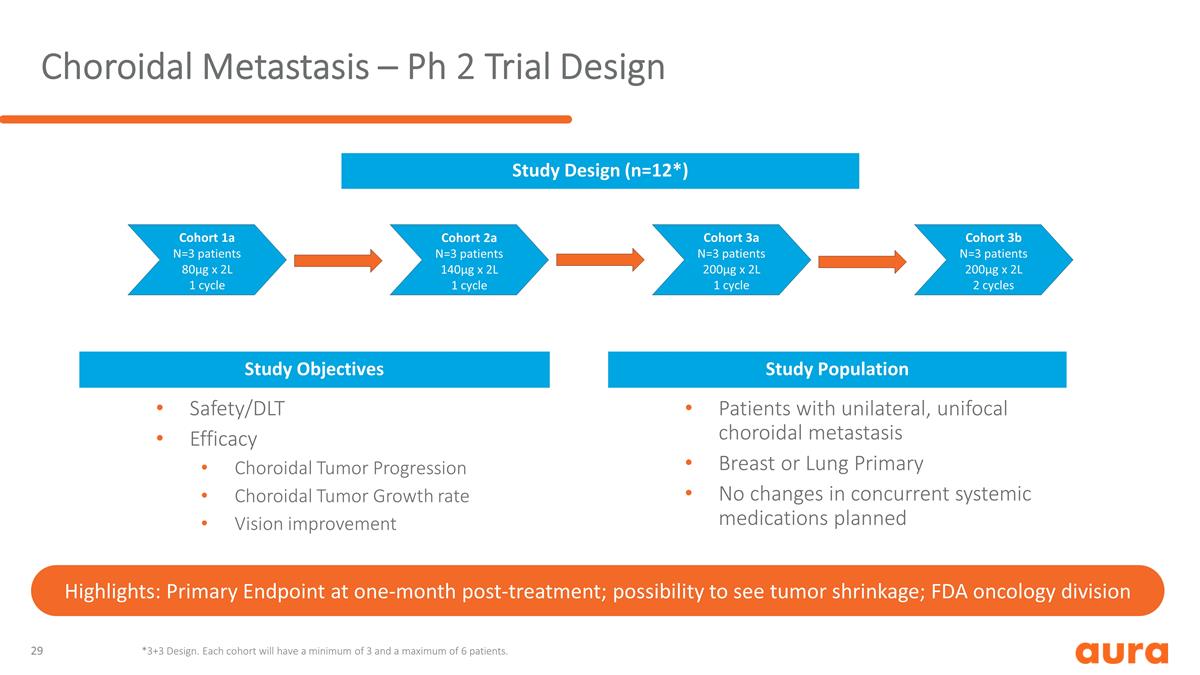
脈絡膜轉移 — Ph 2 試驗設計隊列 1a N=3 名患者 80µg x 2L 1 個週期隊列 2a N=3 名患者 140µg x 2L 1 週期隊列 3a N=3 名患者 200µg x 2L 1 週期隊列 3b N=3 名患者 200µg x 2L 2 個週期安全/dlt 療效脈絡膜腫瘤進展 脈絡膜腫瘤生長率視力改善研究目標研究羣體單側單灶脈絡膜轉移患者乳房或肺部原發性全身藥物未發生變化研究設計(n=12*)*3+3 設計。 每個隊列將至少有 3 名患者,最多 6 名患者。亮點:治療後一個月的主要終點;腫瘤萎縮的可能性;美國食品藥品管理局腫瘤學部
泌尿外科腫瘤學 Bel-sar INN: belzupacap sarotalocan 靶向適應症:膀胱癌

膀胱癌是高未得到滿足的 醫療需求非肌肉浸潤性膀胱癌肌肉浸潤性膀胱癌全球每年約500,000例新增病例1 61,000例美國每年新增病例2萬Putnam & Assoc。流行病學分析 Campbell-Walsh-wein 泌尿學,2021 年,第 12 版;第 137 章,第 3112 頁復發、多次 TURBT 手術、疾病進展、膀胱喪失/膀胱切除術的進展、膀胱/膀胱切除術、轉移和存活未滿足的需求 需求
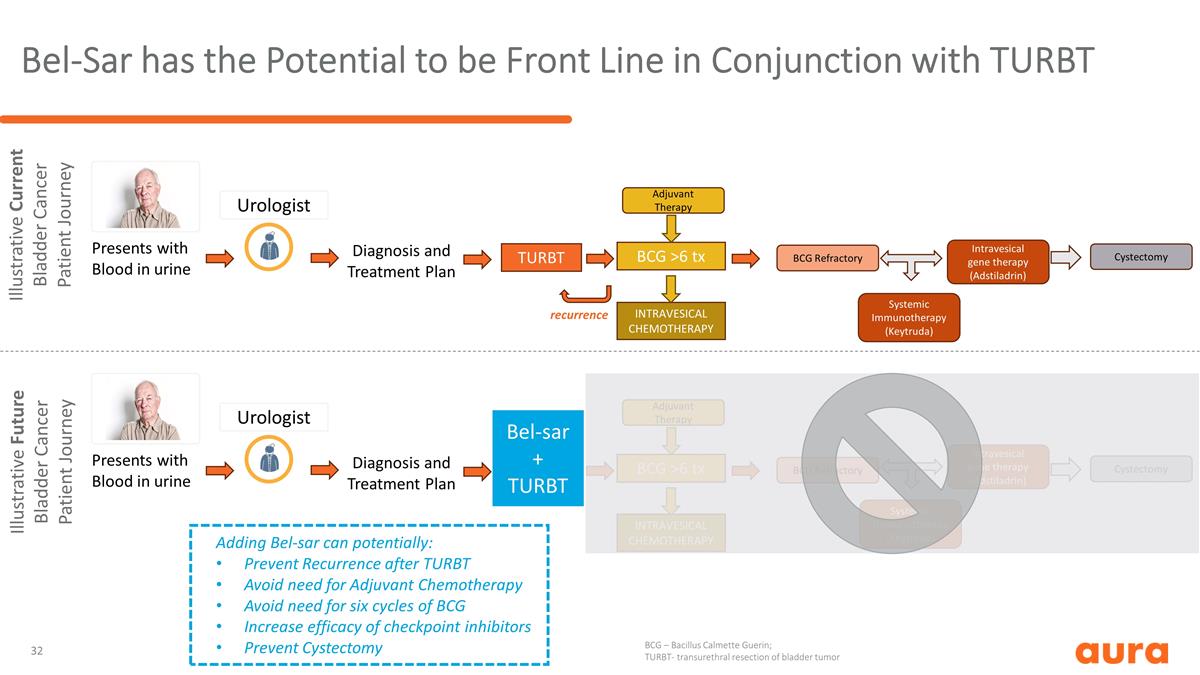
膀胱內基因療法 (Adstiladrin)系統性免疫療法(Keytruda)膀胱內化療 Bel-Sar 有可能成為第一線 Bel-Sar 與 TURBT 聯合使用尿中帶血 TURBT BCG >6 tx 膀胱內化療添加 bel-SAR 有可能: 預防 TURBT 後復發避免輔助化療需要六個週期的卡介苗提高療效的檢查點抑制劑預防膀胱切除術泌尿科醫生輔助治療卡介苗難治性膀胱內基因療法(Adstiladrin) 系統性免疫療法(Keytruda)膀胱切除術説明性當前膀胱癌患者旅程診斷和治療計劃説明性未來膀胱癌患者旅程展示尿中帶血 BCG >6 tx 泌尿科醫生輔助治療 BCG 難治性膀胱切除術診斷和治療計劃 bel-sar + TURBT 復發 BCG — Bacillus Calmette Guerin;TURBT-經尿道膀胱腫瘤切除術
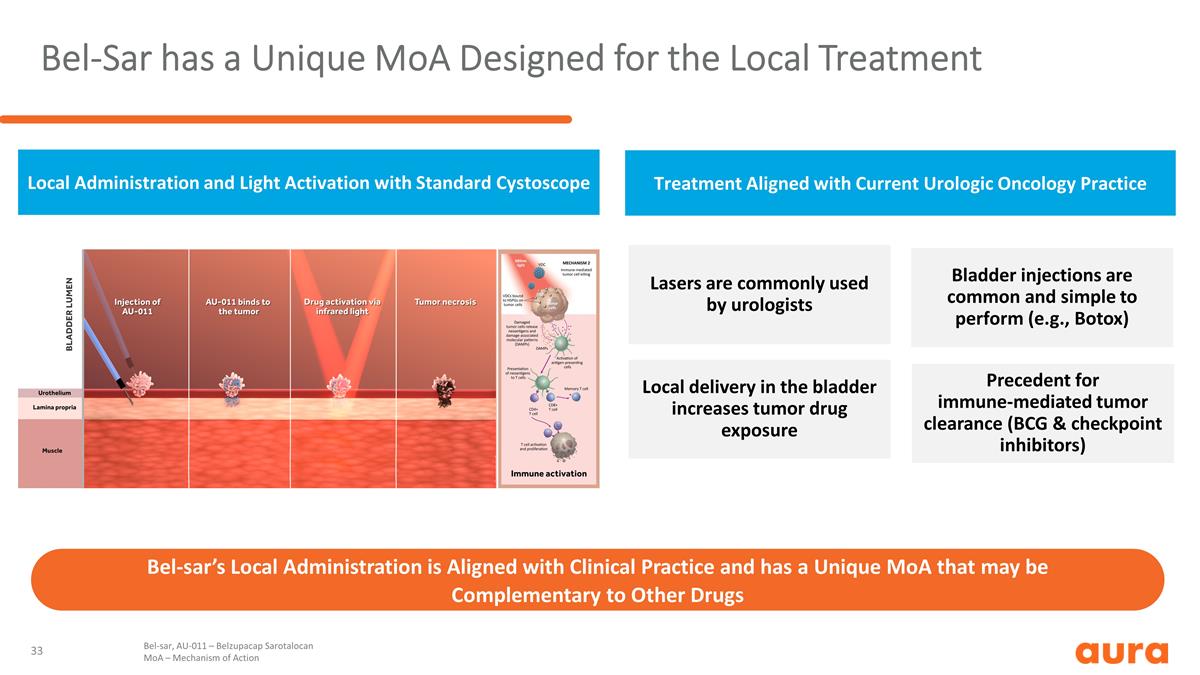
Bel-Sar 擁有專為局部治療而設計的獨特的 MoA Bel-Sar 的當地管理符合臨牀實踐,具有獨特的 MoA,可以補充其他藥物的局部給藥和使用標準膀胱鏡 Bel-SAR 進行光激活,AU-011 — Belzupacap Sarotalocan MoA — 作用機制膀胱注射很常見且易於執行(例如肉毒桿菌毒素)是免疫介導腫瘤清除的先例(卡介苗和檢查點抑制劑)膀胱局部分泌會增加 腫瘤藥物暴露泌尿科醫生通常使用激光器治療符合當前的泌尿外科腫瘤學實踐
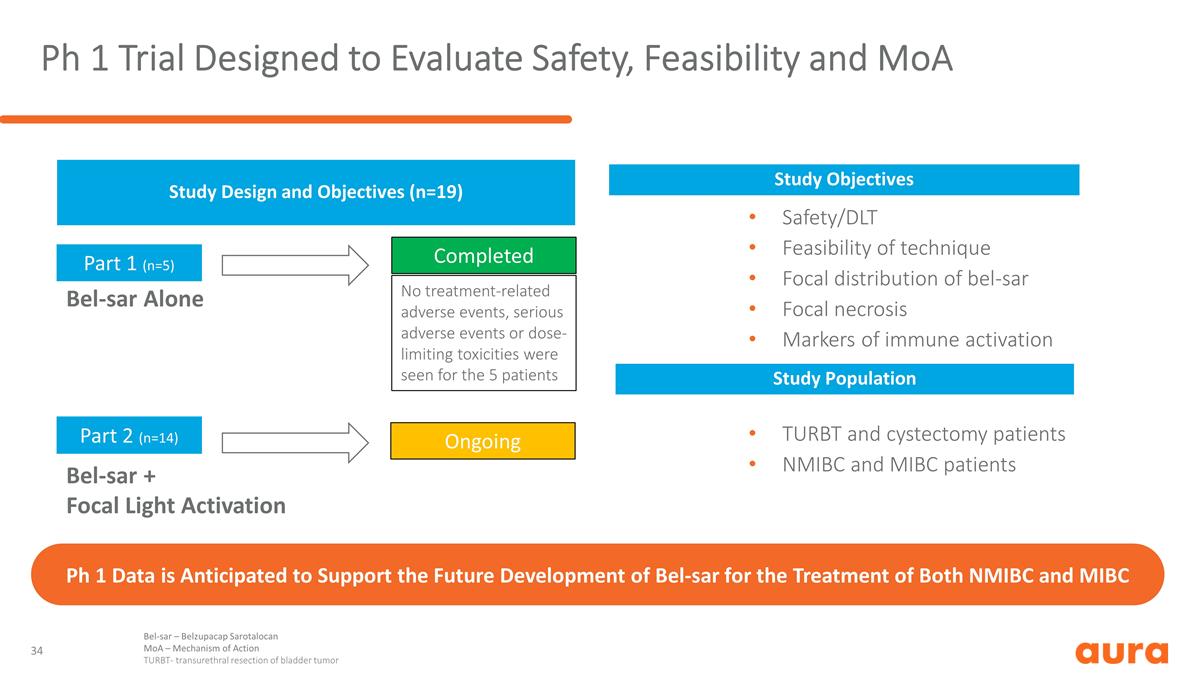
旨在評估 安全性、可行性和 MoA Ph 1 數據的第 1 期試驗預計將支持 Bel-SAR 的未來發展,用於治療 NMIBC 和 MIBC 研究設計和目標 (n=19) Bel-SAR 單獨第 1 部分 (n=5) 第 2 部分 (n=14) bel-SAR + 焦點光 激活已完成持續安全性/DLT 技術焦點分佈的可行性免疫激活的標誌物 TURBT 和膀胱切除術患者 NMIBC 和 MIBC 患者未出現與治療相關的不良事件、嚴重的不良事件 事件或劑量限制毒性針對5名患者的研究目標研究人羣 Bel-sar — Belzupacap Sarotalocan MoA — 作用機制 TURBT-經尿道膀胱腫瘤切除術
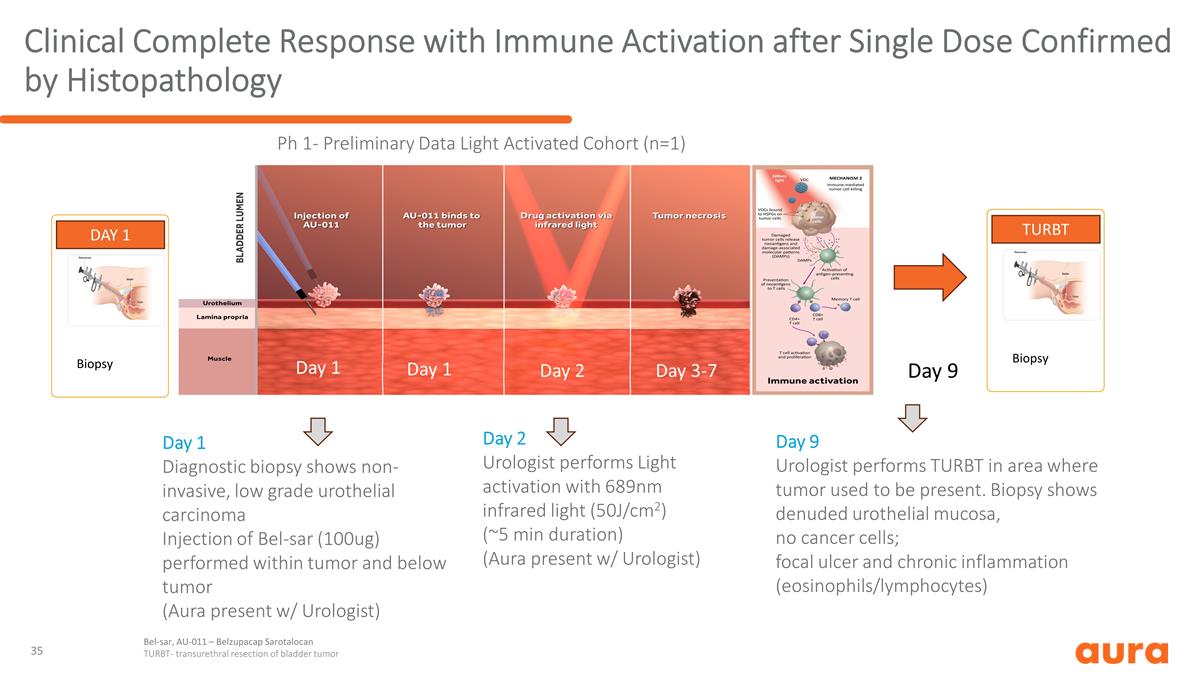
經組織病理學證實單劑量激活後 免疫激活的臨牀完全反應第 1 天診斷活檢顯示在腫瘤內及腫瘤下方進行非侵入性 bel-sar(100ug)注射 Bel-sar(100ug)第 1 天活檢 第 2 天泌尿科醫生使用 689nm 紅外光(50J/cm2)進行光激活(約 5 分鐘)(持續時間約 5 分鐘)(Aura 現身泌尿科醫生)第 9 天泌尿科醫生在曾經存在腫瘤的區域進行 TURBT。活檢顯示尿路上皮粘膜裸露,無癌細胞 細胞;局灶性潰瘍和慢性炎症(嗜酸性粒細胞/淋巴細胞)TURBT 活檢第 1 天 1 天 2 天 3-7 天 Bel-sar,AU-011 — Belzupacap Sarotalocan TURBT — 膀胱腫瘤經尿道切除第 9 天 Ph 1-初步數據 Light Activated 隊列(n=1))
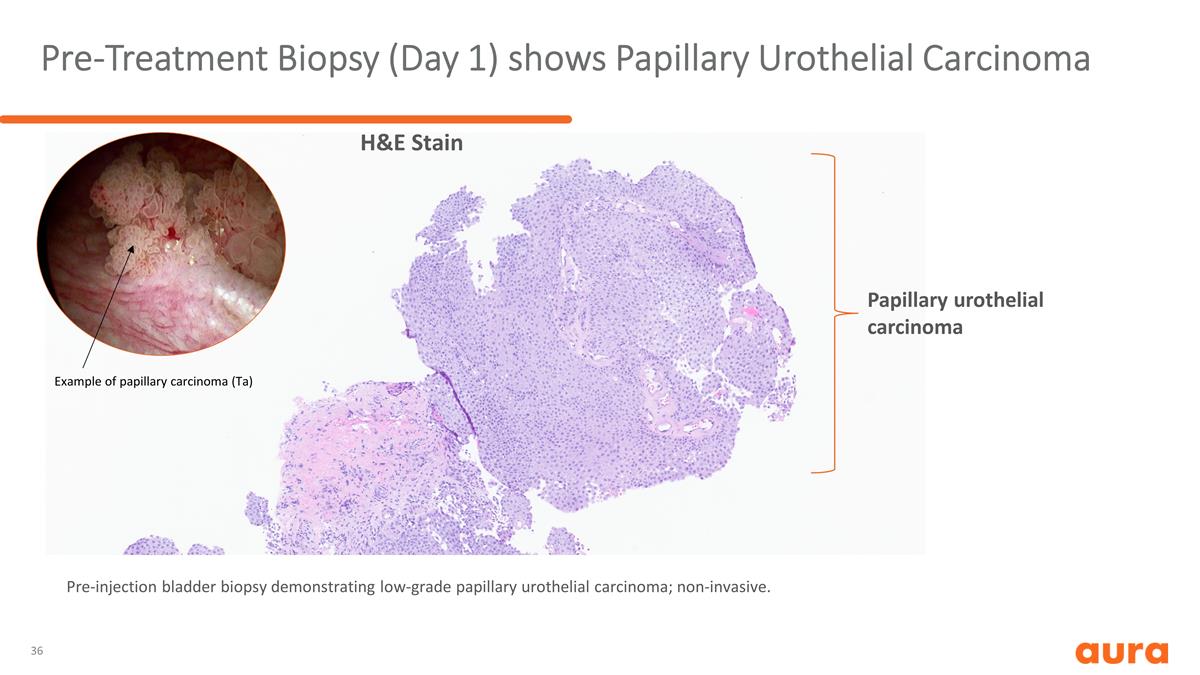
治療前活檢(第 1 天)顯示 乳頭狀尿路上皮癌乳頭狀尿路上皮癌乳頭狀癌(Ta)示例 H&E Stain 注射前膀胱活檢顯示低度乳頭狀尿路上皮癌;非侵入性。
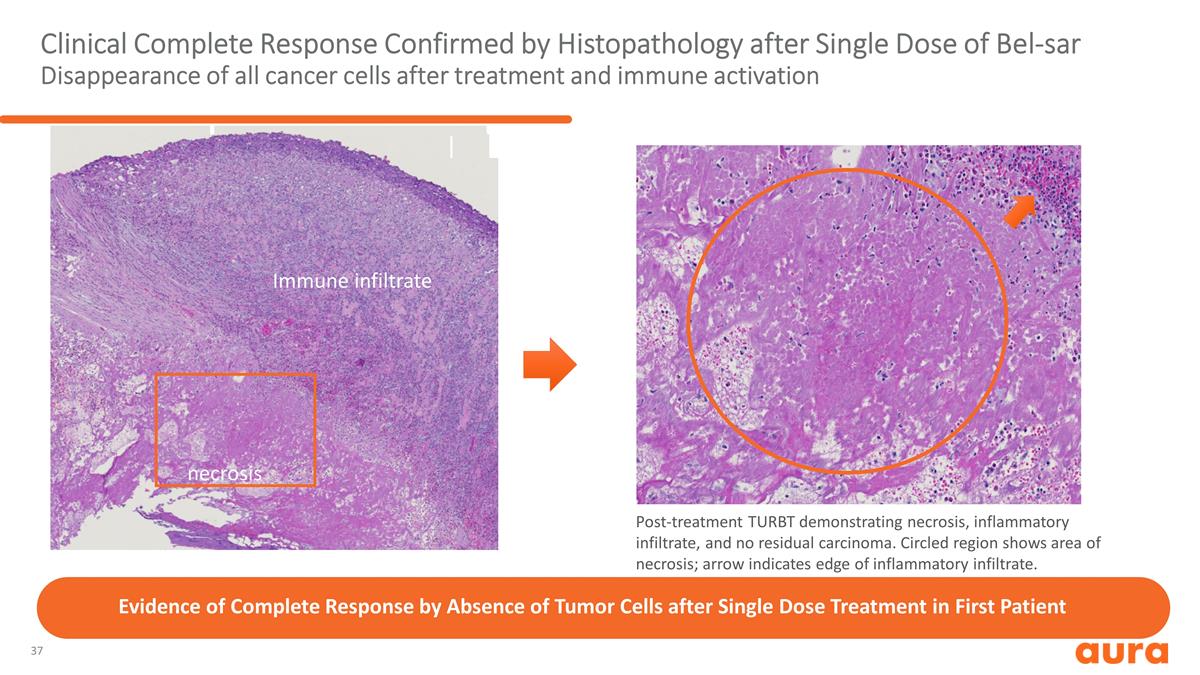
單劑量 Bel-SAR 治療後所有癌細胞消失後,臨牀完全反應 經組織病理學證實,治療後免疫激活 TURBT 顯示壞死、炎症浸潤,無殘留癌。圓圈區域顯示 壞死區域;箭頭表示炎症浸潤的邊緣。壞死免疫浸潤有證據表明首位患者在單劑量治療後腫瘤細胞缺失會產生完全反應
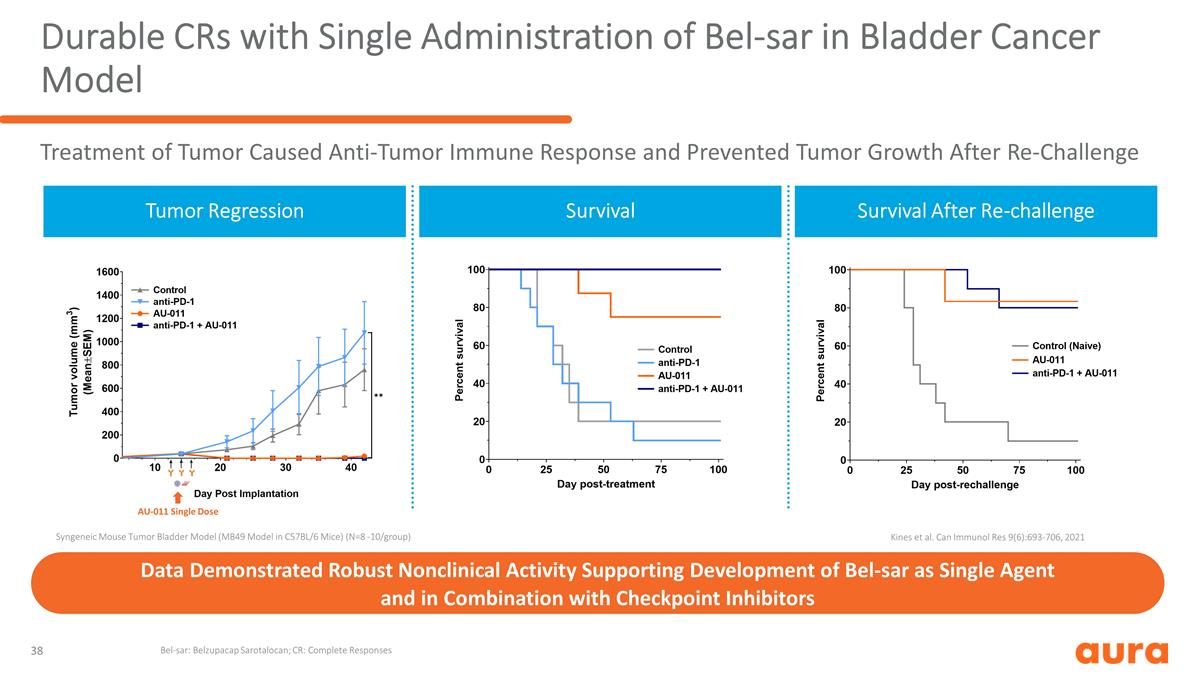
在膀胱癌模型數據中單次 給藥 Bel-SAR 的耐用 CR 顯示出強大的非臨牀活性,支持 Bel-SAR 作為單一藥物的開發以及與檢查點抑制劑聯合使用的同源小鼠腫瘤膀胱模型( C57BL/6 小鼠中的 MB49 模型)(N=8 -10/組)腫瘤迴歸再挑戰後的存活率 AU-011 單劑量腫瘤治療引起抗腫瘤免疫反應並阻止腫瘤生長-SAR:Belzupacap Sarotalocan;CR:完成 迴應 Kines 等人。Can Immunol Res 9 (6): 693-706,2021

戰略和關鍵里程碑
Aura Biosciences — 開發 一類新型腫瘤學藥物眼部腫瘤特許經營權脈絡膜黑色素瘤——全球 Ph 3 Compass 試驗:FPI 已於 2023 年第四季度啟動大多數美國研究中心激活;該試驗正在積極註冊與美國食品藥品管理局 Ph 3 假設達成協議,由第 2 期數據支持脈絡膜轉移——Ph 2 試驗計劃於 2024 年中期啟動第二項眼部適應症可能會使市場機會翻倍泌尿外科腫瘤學特許經營完成 首例單劑量患者的反應數據支持雙重機制更新的協議包括NMIBC和MIBC的強勁現金狀況當前的現金流預計將為2026年下半年的運營提供資金
