| 切實改善針對肺動脈高壓過度增殖原因 的罕見 心肺疾病 患者的生活 2024 年 1 月納斯達克:AVTE |
| 本演示文稿由Aerovate Therapeutics, Inc.(“我們”、“我們的”、“Aerovate” 或 “公司”)編寫,僅供參考。此處列出的 信息並不聲稱完整,也不包含您可能想要的所有信息。除非另有説明,否則此處包含的聲明均自本 演示之日起作出,並且本演示在任何情況下均不得暗示此處包含的信息在該日期之後的任何 時間是正確的,也不得對該信息進行更新或修訂以反映隨後可獲得的信息或在本演示之日之後發生的變化。 以下演示文稿包含1995年《美國私人證券訴訟改革法》安全港條款所指的前瞻性陳述。 前瞻性陳述可以用 “預測”、“相信”、“可能”、“估計”、“預期”、“未來”、“目標”、“打算”、“展望”、“可能”、 “計劃”、“潛力”、“預測”、“項目”、“尋求”、“戰略”、“應該”、“將”、“將” 等詞語來識別關於未來的時期。這些前瞻性陳述 包括但不限於有關Aerovate業務計劃和目標的陳述;AV-101 的未來計劃,包括對 計劃臨牀試驗的時機和成功、治療潛力、臨牀益處和安全性的預期;公司的增長;AV-101 的潛在價值和市場;以及當前或將來 資本、支出和其他財務業績的用途和需求。這些前瞻性陳述不是承諾或保證,涉及重大風險和 不確定性,是基於我們當前對未來狀況的信念、預期和假設。由於前瞻性陳述與未來有關,因此它們 會受到固有的不確定性、風險和環境變化的影響,這些變化難以預測,其中許多是我們無法控制的。我們的實際業績和 財務狀況可能與前瞻性陳述中顯示的有重大差異。因此,您不應依賴這些前瞻性陳述中的任何一項。 可能導致實際事件或結果與本 演示文稿中任何前瞻性陳述所表達或暗示的內容存在重大差異的因素包括但不限於與以下內容相關的風險和不確定性:COVID-19 疫情對公司業務、運營的影響、 患者入組和留存率、戰略、目標和預期里程碑;AV-101 的治療潛力,以及與啟動、持續或 相關的時機 Aerovate 正在進行或計劃中的成功AV-101 的臨牀試驗;Aerovate 執行其戰略的能力;臨牀前或臨牀研究的積極結果不一定能預測未來或正在進行的臨牀研究的結果;AV-101 可能無法成功開發和商業化; 美國和國外的監管發展;Aerovate 保護和維持其知識產權地位的能力;以及更全面地闡述的風險和不確定性 我們在10-Q表季度報告中標題為 “風險因素”,如以及我們隨後向美國證券交易所 委員會(SEC)提交的文件中詳述的其他風險。我們做出的任何前瞻性陳述僅基於我們目前可用的信息,並且僅代表截至發表之日的信息。我們 沒有義務公開更新可能不時發表的任何前瞻性陳述,無論是書面還是口頭陳述,無論是由於新的 信息、未來發展還是其他原因。 本演示文稿中包含的某些信息涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據,以及公司 自己的內部估計和研究。儘管公司認為截至本演示文稿之日這些第三方來源是可靠的,但它尚未獨立核實 ,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。此外,本演示文稿中包含的所有市場數據 都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。最後, 雖然我們認為自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。 2 免責聲明;前瞻性陳述 |
| 經驗豐富的管理團隊 3 Ben Dake 博士 總裁兼創始人 • 企業家、癌症生物學家 和投資者 • 概念化的 AV-101 和 為 Aerovate Hunter Gillies、MB chB 首席醫學官 提供了高達 7900 萬美元的融資 • 領導了建立當前一線的吉利德 的 AMBITION 試驗 br} PAH 聯合療法 • 在輝瑞和吉利德成功領導了 PAH 候選產品 的二期和三期試驗 Ralph Niven 博士 首席開發官 • 在 轉化醫學和 方面擁有 25 年的豐富專業知識吸入劑型 • 管理 公共和私營 公司的實驗和 臨牀開發,包括安進、 AIR 和諾華 首席執行官 Timothy Noyes • 在製藥和 生物技術領域擁有 30 年的商業 經驗,包括默沙東、 Genzyme、Proteon • 在製藥和 生物技術領域擁有 30 年的商業 經驗,包括默沙東、 Genzyme、Proteon • 廣泛的上市規劃 和商業發行 經驗 George Eldridge 首席財務官 • 在 生物技術領域擁有 25 年的經驗,曾在上市 和私營公司工作, 包括 Curis、Targanta、 Proteon • 豐富的背景 } 籌集私募資金、 首次公開募股和後續的 設置、投資 銀行和併購 Timothy Pigot 首席商務官 • 在 生物技術和製藥領域擁有 25 年的經驗 致力於推出一系列 產品和 將其商業化 • 在 PAH 監督美國 推出 Revatio 有10年的經驗和 Leairis 分別在輝瑞 和吉利德科學任職, Susan Fischer 臨牀運營高級副總裁。 • 在 學術和 製藥 行業擁有 20 年臨牀運營經驗。 • 曾在 Syndax、EMD Serono、 Acetylon 建立/領導的 臨牀運營團隊 Donna Dea 監管主管 • 在阿斯利康 有 35 年的製藥 經驗 • 20 年的全球監管 經驗設計/ 實施戰略,導致 獲得批准 哮喘的治療藥物慢性阻塞性肺病、鼻炎等 Marco Verwijs 首席技術官 • 15 年藥物開發經驗 從 臨牀產品 開發到 商業上市 • 藥物 產品擴大和 驗證領域久經考驗的領導者。 |
| 大量未得到滿足 需求 儘管有三種藥物 類別獲得批准, 新診斷的多環芳烴 患者的5年存活率為 61% 已證實 臨牀益處 在 諾華口服 進行的 3 期臨牀試驗 中顯示出臨牀 益處在兩種或更多 標準護理 療法的 療法基礎上的 PAH 患者中使用甲磺酸伊馬替尼。AV-101 不幸的是,使用口服伊馬替尼 的 AE 很常見, 的開發已停止 高效執行 FDA 和 EMA 孤兒 指定用於治療 健康志願者的 第 1 階段 SAD/MAD 針對 PAH 患者的2b/3試驗。AV-101預計 2024 年 6 月 完全註冊了 pH2b 數據的 pH2b 部分 成熟市場 60 億美元以上,但是 業績不佳 Aerovate:PAH 的創新前進方向 發明的 解決方案 靶向吸入乾粉 PAH 產品 候選產品 AV-101 使用口服 伊馬替尼觀察到不含 全身性不良反應的伊馬替尼具有明顯的臨牀益處 |
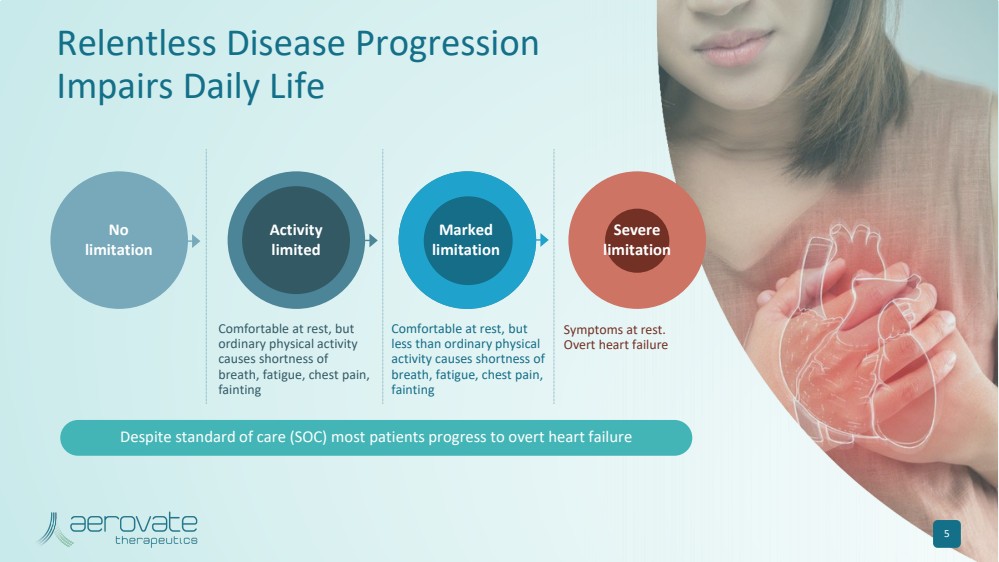
| 休息時很舒服,但是 普通的體育活動 會導致 呼吸急促、疲勞、胸痛、 昏厥 休息時舒服,但是 少於普通體力 活動會導致 呼吸急促、疲勞、胸痛、 昏厥 休息時的症狀。 明顯心力衰竭 沒有 限制 持續的疾病進展 會損害日常生活 5 活動 有限 標記 限制 嚴重 限制 儘管有標準護理 (SOC),但大多數患者還是會出現明顯的心力衰竭 |
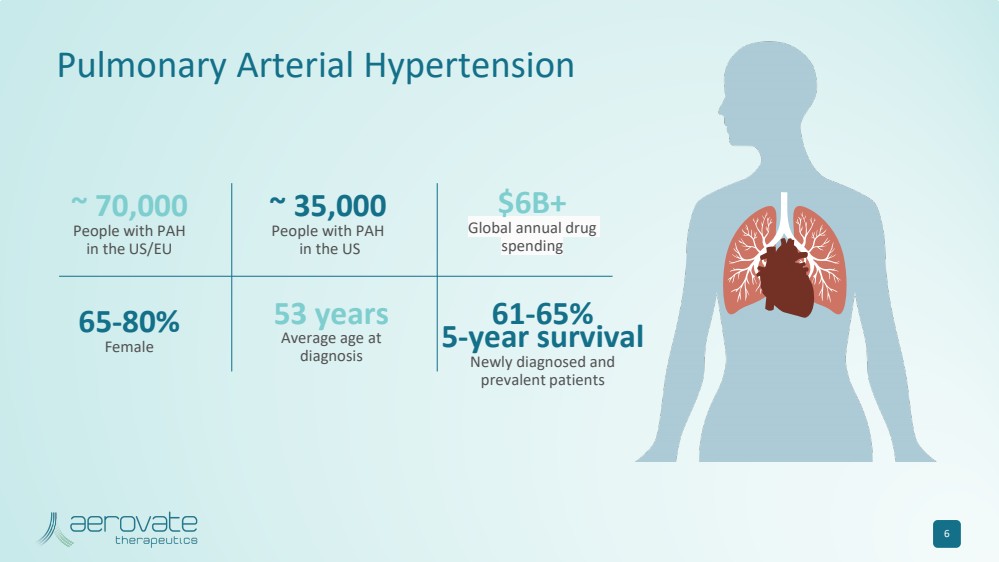
| 6 ~ 70,000 美國/歐盟 PAH 患者 ~ 35,000 名美國 PAH 患者超過 600 億美元 全球年度藥物 支出 65-80% 女 61-65% 5 年存活率 新診斷和 流行患者 53 歲 診斷時的平均年齡 肺動脈高壓 |
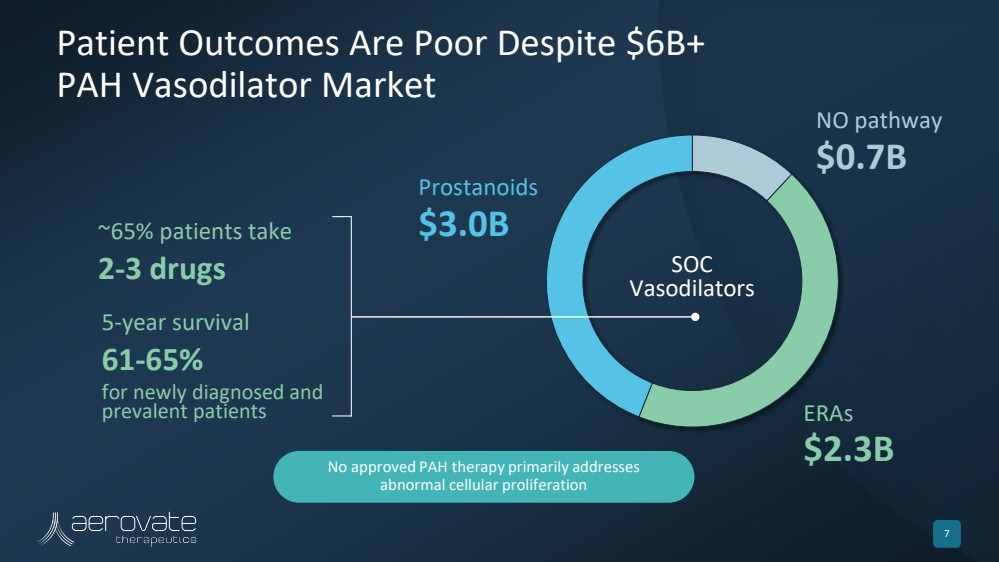
| 儘管有60億美元以上 PAH 血管擴張劑市場 7 無路徑 7億美元 ERA 23億美元 前列腺素 30億美元 SOC 血管擴張劑 5 年存活率 新診斷和 流行患者 ~ 65 年存活率 5% 的患者服用 2-3 種藥物 未獲批准的 PAH 療法主要解決 異常的細胞增殖 |
| 將伊馬替尼從一種癌症 藥物重塑為一種潛在的多環芳烴療法 88 |
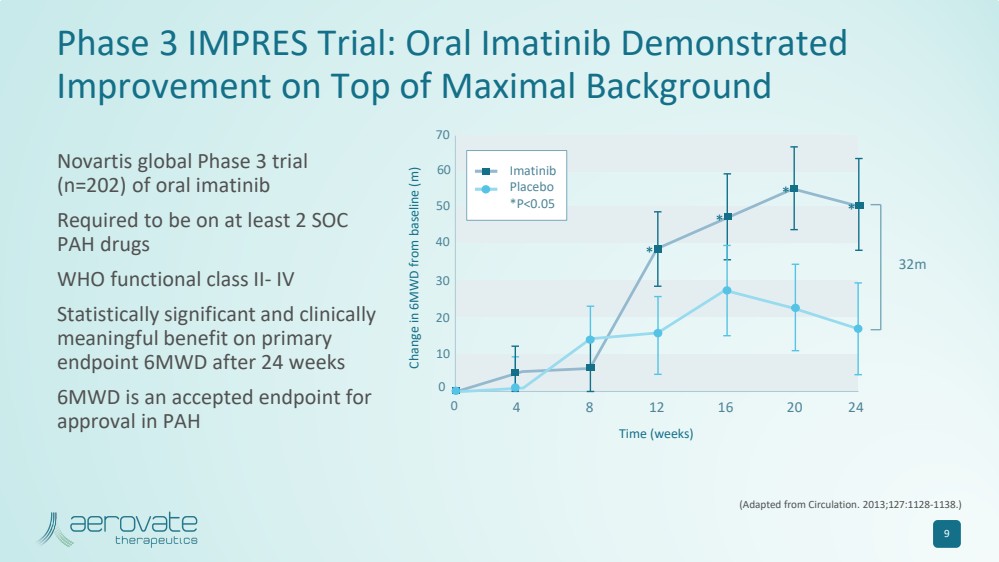
| 9 Impres 三期試驗:口服伊馬替尼在最大背景 的基礎上顯示 有所改善(改編自《循環》。2013;127:1128-1138。) 6MWD 與基線的變化 (m) 時間(周) 0 4 8 12 16 20 24 32m 0 10 20 30 40 50 60 70 * * * * * * * * 伊馬替尼 安慰劑 *P |
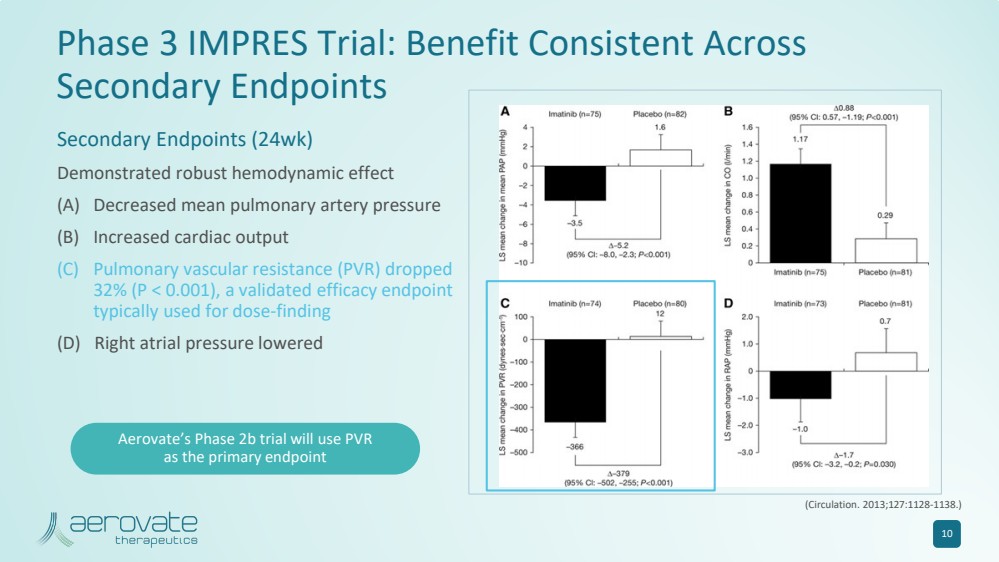
| IMPRES 3 期試驗:在 次要終點受益一致 次要終點(24 周) 顯示出強大的血液動力學效應 (A) 平均肺動脈壓降低 (B) 心輸出量增加 (C) 肺血管阻力 (PVR) 下降 32% (P |
| 伊馬替尼 n=103 (%) 安慰劑 n=98 (%) 不良事件 + 100 (97) 94 (96) 噁心 57 (55) 23 (24) 外周水腫 45 (44) 20 (20) 腹瀉 36 (35) 19 (19) 嘔吐 31 (30) 10 (10) 周圍眶水腫 30 (29) 7 (7) 頭痛 25 (24) 22 (22) 呼吸困難 19 (18) 13 (13) 鼻咽炎 18 (18) 19 (19) 低鉀血癥 16 (16) 3 (3) 貧血 14 (14) 3 (3) 咳嗽 11 (11) 15 (15) } 疲勞 11 (11) 7 (7) 面部水腫 10 (10) 1 (1) 肌肉痙攣 10 (10) 2 (2) 伊馬替尼 n=103 (%) 安慰劑 n=98 (%) 嚴重不良事件 + 45 (44)29 (30) 肺動脈高壓惡化 6 (6) 8 (8) 貧血 7 (7) 1 (1) 呼吸困難 6 (6) 2 (2) 外周水腫 6 (6) 0 Presyncope 5 (5) 0 腹瀉 3 (3) 2 (2) 設備相關感染 3 (3) 0 Syncope 1 (1) 5 (5)) 硬膜下血腫 * 2 (2) 0 口服伊馬替尼引起的全身性不良事件 11(循環。2013;127:1128-1138。) * 在試驗的長期延期部分中,另有6名 患者出現硬膜下 血腫。 + 在伊馬替尼組中,如果個別不良事件發生在 10% 以上,則會顯示這些不良事件。如果 發生在任一組 ≥3 名患者中,則顯示個體嚴重不良事件。 |
| AV-101 PAH 的潛在靶向治療 1212 |
| 13 AV-101 AV-101 是一種組合產品 由專有的乾粉 伊馬替尼配方組成,膠囊 由乾粉吸入器 輸送,旨在: • 將藥物輸送到肺部 • 限制全身暴露 • 易於給藥 伊馬替尼分子結構未經修改 |
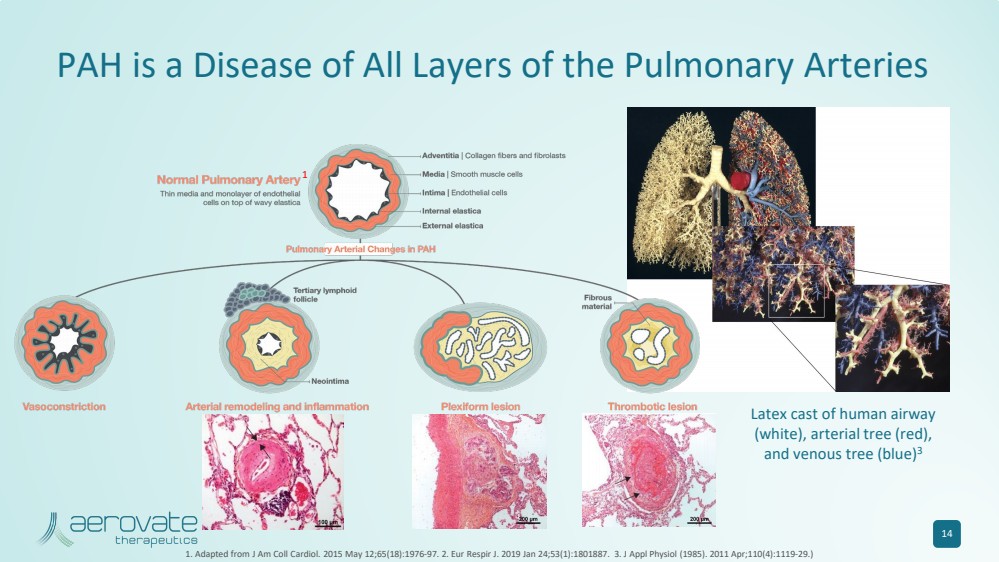
| PAH 是一種肺動脈各層的疾病 14 1.改編自 J Am Coll Cardiol。2015 年 5 月 12 日;65 (18): 1976-97。2.Eur Respir J. 2019 年 1 月 24 日;53 (1): 1801887. 3.應用生理學雜誌 (1985)。2011 年 4 月;110 (4): 1119-29。) 人體氣道 (白色)、動脈樹(紅色)、 和靜脈樹(藍色)的乳膠模型 3 1 |
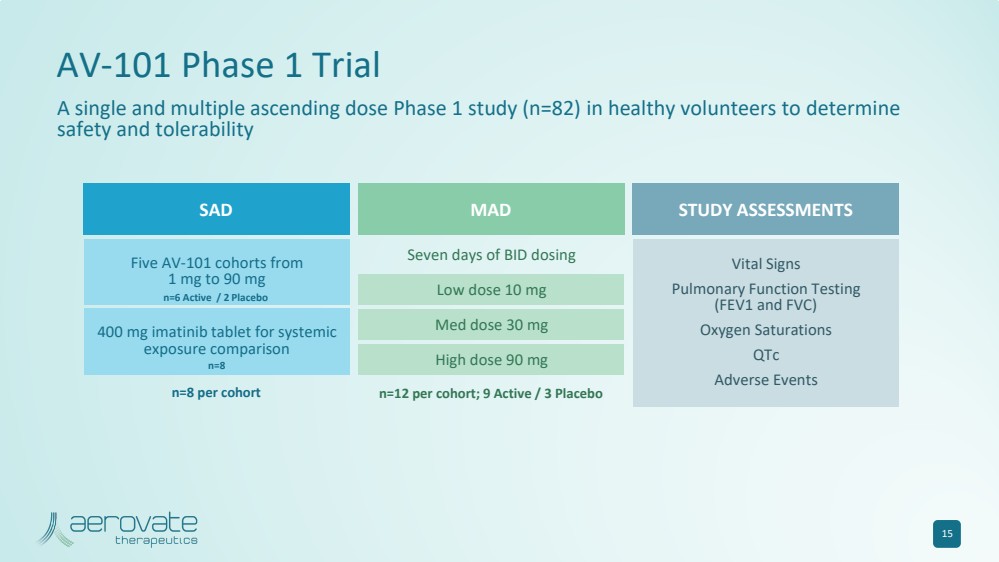
| 15 AV-101 第 1 期試驗 一項針對健康志願者的單劑量和多次遞增劑量 1 期研究(n=82),旨在確定每個隊列的 MAD n=12;9 活性/3 安慰劑 低劑量 10 mg 中劑量 30 mg 高劑量 90 mg BID 給藥七天 SAD 研究評估 每個隊列 五個 AV-101 隊列從 1 mg 到 90 mg 400 mg 的伊馬替尼片劑用於全身 暴露比較 生命體徵 肺功能測試 (FEV1 和 FVC) 氧飽和度 不良事件 n=6 Active/2 安慰劑 n=8 |
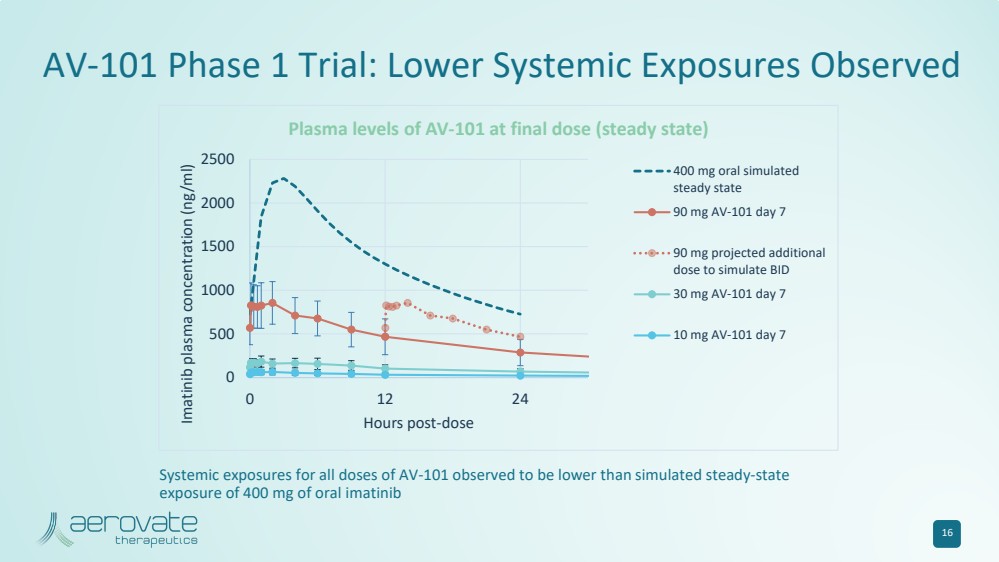
| 16 AV-101 第 1 期試驗:觀察到較低的全身暴露 0 500 1000 1500 2000 2500 0 12 24 伊馬替尼血漿濃度 (ng/ml) 劑量後 AV-101 在最終劑量(穩定狀態)時的血漿水平 400 mg 口服模擬 90 mg AV-101 第 7 天 90 mg 預計會增加 30 mg AV-101 第 7 天 10 天 mg AV-101 第 7 天觀察到所有劑量 AV-101 的全身暴露量低於400 mg口服伊馬替尼的模擬穩態 暴露量 |
| 17 AV-101 第 1 期耐受性概況 AV-101 總體耐受性良好 • 未報告嚴重不良事件 • 肺功能、氧 飽和度和 qtC 間隔沒有變化 • 大多數不良反應輕度至中度 • MAD 90 mg 隊列 第 1 天因嘔吐而停藥 • 最常見的 AE,咳嗽,為最大劑量和 } 限於給藥後 30 分鐘內 不良事件 n (%) 10 mg (n=8) 30 mg (n=9) 90 mg* (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) 噁心--2 (22) 胸部不適--2 (22) 喉嚨發炎-1 (11) 肌肉骨骼疼痛--2 (22) 單發性病例:嘔吐(已停產)、消化不良、肌肉骨骼胸痛、 鼻塞、口咽痛、背痛、腹痛、Covid-19、Presyncope、 br} 丙氨酸氨基轉移酶增加 *90mg 劑量以 9 x 10mg 膠囊的形式給藥 |
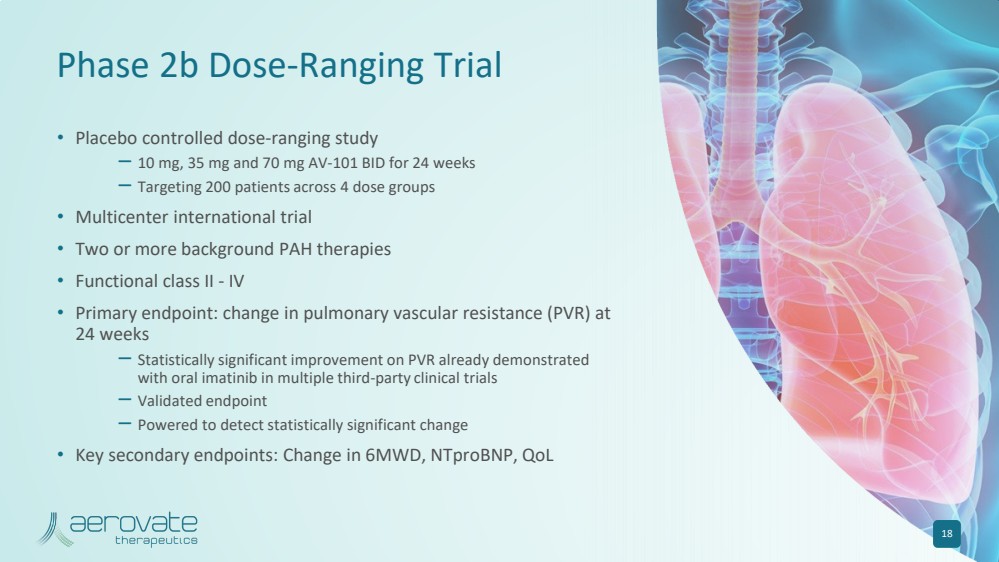
| 2b 期劑量範圍試驗 • 安慰劑對照劑量範圍研究 — 10 mg、35 mg 和 70 mg AV-101 BID,持續 24 周 — 針對 4 個劑量組 200 名患者 • 兩種或更多背景多環芳烴療法 • 功能二類-IV • 主要終點: 24 的肺血管阻力 (PVR) 變化周 — 在多項第三方臨牀試驗中,口服伊馬替尼已證實 PVR 有統計學上的顯著改善 — 經過驗證的終點 — 可檢測出具有統計學意義的顯著結果更改 • 關鍵輔助終端節點:6MWD、ntproBNP、QoL 18 中的變化 |
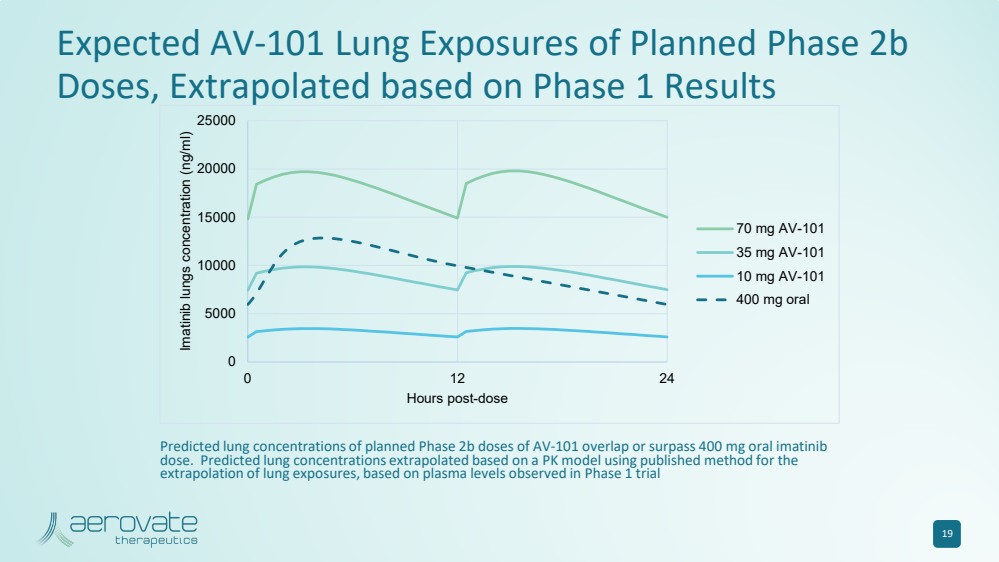
| 19 計劃期 2b 劑量的 AV-101 肺部暴露量,根據第 1 階段結果推斷 0 5000 10000 15000 2500 25000 0 12 24 伊馬替尼肺部濃度 (ng/ml) 70 mg AV-101 35 mg AV-101 10 mg AV-101 400 mg 400 mg AV-101 重疊或超過 400 mg 口服 2b 期劑量的預計肺濃度 inib 劑量。根據在 1 期試驗中觀察到的血漿水平,使用已發佈的 肺部暴露外推方法,基於 PK 模型推斷出預測的肺濃度 |
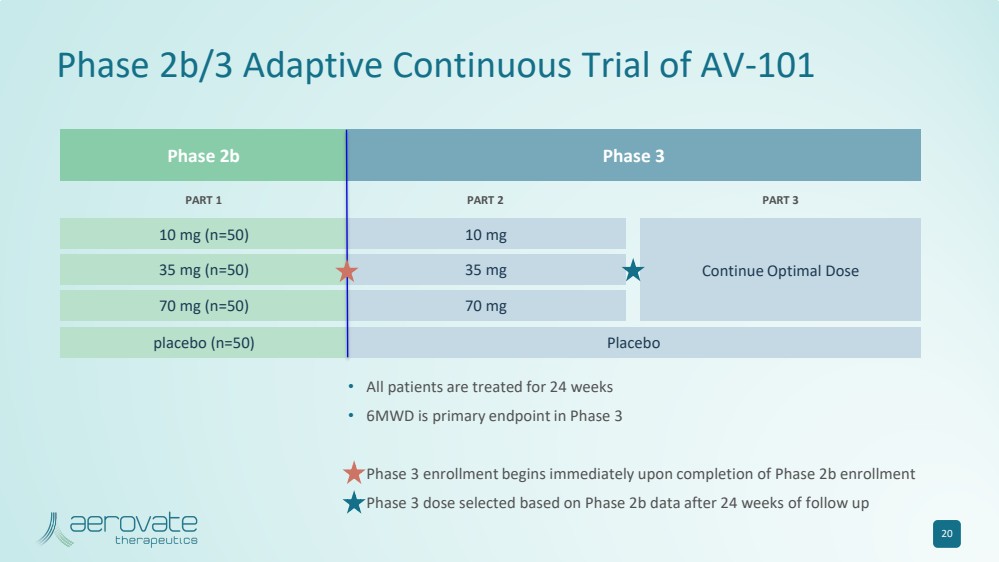
| AV-101 20 的 2b 期 3 期 2b/3 期適應性持續試驗 • 所有患者均接受了 24 周的治療 • 6MWD 是 3 期的主要終點 • 3 期註冊在 2b 期註冊完成後立即開始 • 根據隨訪 24 周後的 2b 期數據選擇的 3 期劑量 第 1 部分第 3 部分 10 mg (n=50) 35 mg (n=50) 35 mg (n=50) 70 mg (n=50) 安慰劑 (n=50) 10 mg 35 mg 70 mg 70 mg 70 mg 安慰劑 繼續最佳劑量 |
| 使用非血管舒張劑 MOA 的 PAH 試驗: 21 口服伊馬替尼 Merck/Acceleron 索他西普(激活素陷阱) Gossamer Seralutinib (TKI) IMPRES (Ph3) PULSAR (Ph2) TORREY (Ph2) 低高 PVR 31.8% -20.5% -33.9% -30.7% -14.3% 6MWD +32 m p=0.002 +29 m p=0.02 +21 m p=0.08 +40.8 m p=0.001 *中位數 +6.5m p=0.597 PAH 用於新機制的臨牀管道有限 其他潛在的非藥物血管舒張劑 臨牀 開發中的多環芳烴療法: • Aerami/Philip Morris — AER-901(霧化伊馬替尼) 第 1 階段完成 •住友(Enzyvant)— Rodatristat(色氨酸 羥化酶抑制劑)處於 第二階段(失敗的試驗) 上圖中的數據基於跨試驗比較,而不是頭對頭的臨牀試驗。由於試驗設計、研究方案、條件和患者羣體的差異,此類數據可能無法直接比較 。 |
| AV-101:有可能成為理想的附加藥物 • Al Launch,AV-101 有望成為理想的附加藥物* — 與當前療法相結合具有吸引力的臨牀概況 — 簡單易用 — 有可能成為未來護理標準的一部分 • 在目標人羣中的潛在定位* — 在吸入和口服前列環素療法之前 — 對於不符合條件的患者,在索他西普之前 和偏愛吸入而不是注射的患者 — 仍處於中到高預後不良風險的患者 br} 儘管接受了索他西普和前列環素治療 — 不耐受索他西普和前列環素 療法的患者 22 *假設數據和美國食品藥品管理局的討論支持美國食品藥品管理局的批准並附有支持性標籤 |
| AVTE 對當前和未來多環芳烴格局的看法以 豐富的經驗、利益相關者的參與和市場研究為依據 • 由 PAH 專家和 PAH 患者組成的全球顧問委員會 • 與研究人員、KOL、PAH 治療人員、護士、患者、權益協會的互動* • 穩健的市場研究 — 100 多項美國醫生市場格局研究 (10 月) 2021) — 100 多位歐洲醫師市場格局 研究(2022 年 6 月) — 150 多位美國醫生聯合需求研究帖子 Sotatercept 數據(2023 年 8 月) *個人互動只關注治療格局,除非 通過適當的諮詢協議尋求真正的建議 23 醫學博士 Vizza 教授研究人員討論 |
| PAH 治療路徑自 2005 年以來一直沒有改變,療效依然不佳 依普羅替尼波生坦安美利生坦西地那非他達拉非 前列環素途徑內皮素途徑一氧化氮途徑 新診斷和流行患者 61%-65% 5 年存活率 更便捷的前列環素途徑給藥途徑 輸液吸入口服 更具侵略性的治療方法 初始單一療法前期聯合療法低風險治療 為優化傳統療法付出重大努力路徑 24 24 |
| Sotatercept 之外的未滿足需求 STELLAR 試驗表明 PAH 治療 取得了重大進展... • 60% 的患者未達到多組分 改善措施 • 60% 的患者在簡化的 風險模型中未達到低風險 • 70% 的患者沒有改善功能類別 • 長期效果尚未完全確定 25 |
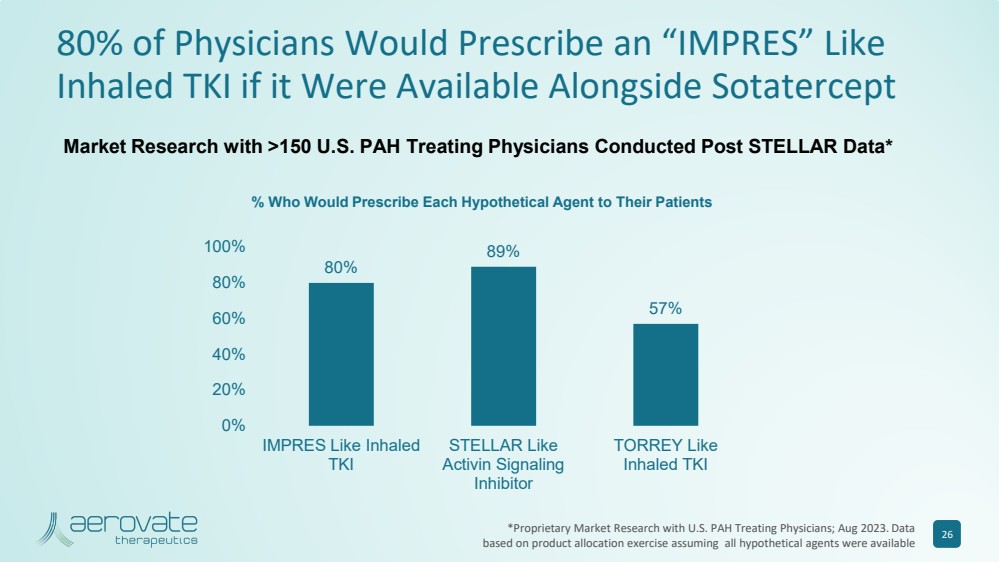
| 如果與 Sotatercept 80% 89% 57% 57% 57% 0% 20% 40% 40% 80% 100% 100% 100% 像吸入式 TKI STELLAR 一樣 恆星像 Activin Signaling 一樣 40% 80% 100% 100% br} 抑制劑 TORREY Like 吸入式 TKI 市場研究在 STELLAR 數據發佈後,對超過 150 名美國多環芳烴治療醫生進行了市場研究* % 誰會給患者開每種假設藥物的處方 26 *與美國多環芳烴治療醫生進行專有市場研究;2023 年 8 月。數據 基於產品分配活動,假設所有假設代理都可用 |
| AV-101:需求未得到滿足,潛力巨大 27 定位 在 前列環素 添加到 3 種藥物之前 在 注射前列環素 ~ 35,000 名患者接受 PAH 治療 ~ 35,000 名患者 。我們估計 服用 2-3 種藥物 ~ 65% (~22,750) |
| 積極的初始監管相互作用和反饋 已完成 • FDA 於 2020 年 1 月舉行了 IND 預會議 • FDA 和 EMA 批准了用於治療 PAH 的 AV-101 孤兒稱號 • 2021 年 3 月收到 EMA 的科學建議 • FDA 和 EMA 於 2021 年 4 月結束了臨牀開發反饋 • 終點在 2b/3 階段上達成一致可能提交的保密協議/MAA 28 |
| AV-101 至 2040+ 的知識產權保護 多項已頒發的涉及 AV-101 藥物產品和使用方法的美國專利 • 專利覆蓋範圍至少延長至 2040 年 • 目前的美國專利在全球範圍內延長 還有多項待處理的申請 • 其他氣溶膠成分的申請 • 申請其他氣溶膠成分 • 提交作用機理(成分無關) 為延長或提交新的審查而頒佈的定期審查知識產權基於研究、 臨牀試驗和 CMC 29 中的發現 |
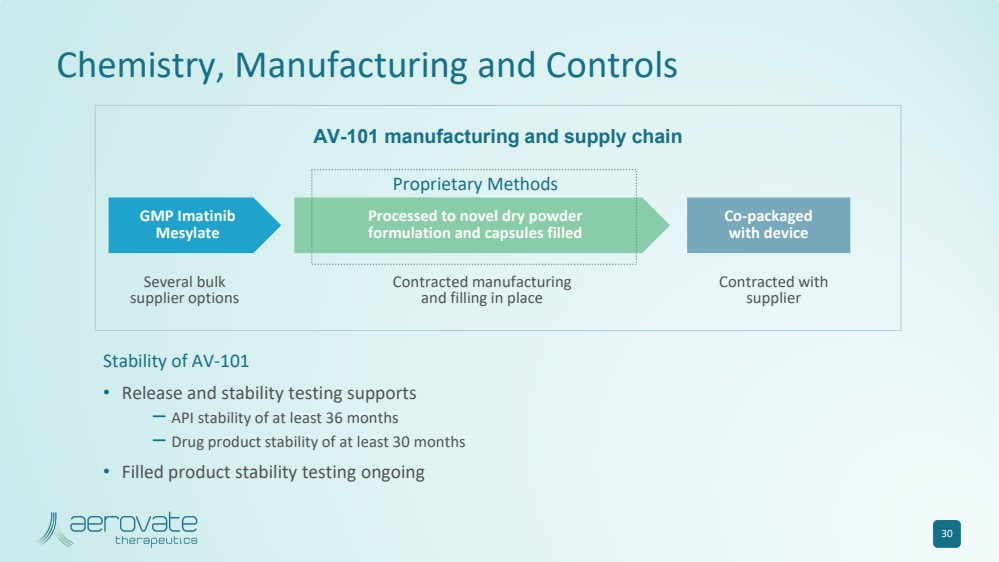
| AV-101 的化學、製造和控制 穩定性 • 釋放和穩定性測試支持 — API 穩定性至少 36 個月 — 藥品穩定性至少 30 個月 • 填充產品穩定性測試正在進行中 30 專有方法 幾種批量 供應商選項 幾種批量 供應商選項 和填充物 與 供應商 簽約 AV-101 製造和供應鏈 br} GMP 伊馬替尼 甲磺酸鹽 加工成新型乾粉 配方和用設備填充 聯合包裝 的膠囊 |
| 31 AV-101 Device and Delivery Performance AV-101 Device • Off-the-shelf commercial scale dry powder inhaler – No batteries, compressors or cords – No sterile vials containing solutions or suspensions – CE mark in EU and Device Master File registered with FDA • Designed for ease of use and convenience • Intended dosing of 2 capsules twice a day • Replaced weekly AV-101 Delivery Performance • Consistently high delivered and fine particle dose • Ideal size and size distribution for lung penetration NOTE: Device planned for Phase 2b/3 trial was not used in Phase 1 trial, but delivery performance has been assessed. |
| Significant Unmet Need Despite three drug classes approved, 5-year survival for newly diagnosed PAH patients is 61% Demonstrated Clinical Benefit The molecule in AV-101, imatinib, already has shown clinical benefit in a Phase 3 clinical trial conducted by Novartis of oral imatinib mesylate in PAH patients on top of two or more standard of care therapies. Unfortunately, AEs with oral imatinib were common and development was discontinued Efficient Execution FDA and EMA orphan designation for AV-101 for the treatment of PAH Phase 1 SAD/MAD in healthy volunteers complete Phase 2b dose-ranging portion of a Phase 2b/3 trial in PAH patients. Ph2b portion fully enrolled with Ph2b data expected in June 2024 Established Market $6B+ market, yet outcomes are poor Aerovate: An Inventive Way Forward in PAH 32 Inventive Solution Anti-proliferative targeted inhaled dry powder PAH product candidate AV-101 designed to provide robust clinical benefit of imatinib without systemic AEs observed with oral imatinib |
| 3333 Thank you! |