
公司概述 2024 年 1 月 Sutro BiopharmanasDAQ:STRO 附錄 99.1

前瞻性陳述本演示和隨附的口頭陳述包含 “前瞻性” 陳述,這些陳述基於我們管理層的信念和假設以及管理層目前可獲得的信息。前瞻性陳述包括本演示文稿中除歷史事實陳述以外的所有陳述,包括有關我們未來財務業績的信息;業務計劃和目標;預期的臨牀前和臨牀開發活動,包括註冊和研究中心激活;公佈臨牀結果、試驗啟動和監管申報的時間;監管決策的結果;我們對現金流的預期;luvelta和其他候選產品和平臺的潛在收益;潛在的收益;潛在的收益擴展到其他指標和組合,包括與此類擴張相關的時機和開發活動;潛在的增長機會、融資計劃、潛在的未來里程碑和特許權使用費支付、競爭地位、行業環境和公司候選產品的潛在市場機會。前瞻性陳述受已知和未知風險、不確定性、假設和其他因素的影響,包括與我們的現金預測相關的風險和不確定性、我們和我們的合作者推進候選產品的能力、潛在監管機構提交的接收、反饋和時間、候選產品的指定、批准和商業化、臨牀前和臨牀試驗的設計、時間和結果,以及 COVID-19 疫情對我們運營的預期影響。我們的管理層無法預測所有風險,也無法評估所有因素對我們業務的影響,也無法評估任何因素或因素組合在多大程度上可能導致實際業績與我們可能做出的任何前瞻性陳述中包含的結果存在重大差異。這些因素,加上我們最新的10-K表年度報告、10-Q表季度報告以及公司不時向美國證券交易委員會提交的其他報告中的 “風險因素” 標題下可能更詳細描述的因素,可能導致我們的實際業績、業績或成就與我們的前瞻性陳述的預期或暗示的業績、業績或成就存在重大和不利的差異。您不應依賴前瞻性陳述作為對未來事件的預測。儘管我們的管理層認為我們的前瞻性陳述中反映的預期是合理的,但我們不能保證前瞻性陳述中描述的未來業績、活動水平、業績或事件和情況能夠實現或發生。此外,我們和我們的管理層都不對前瞻性陳述的準確性和完整性承擔責任。除非法律要求,否則在本演示文稿發佈之日之後,我們沒有義務出於任何原因公開更新任何前瞻性陳述,以使這些陳述符合實際業績或我們的預期變化。本演示文稿還包含獨立方和我們提供的與市場規模和增長相關的估計和其他統計數據以及有關我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此外,對我們未來表現的預測、假設和估計以及我們經營的市場的未來表現必然受到高度的不確定性和風險的影響。
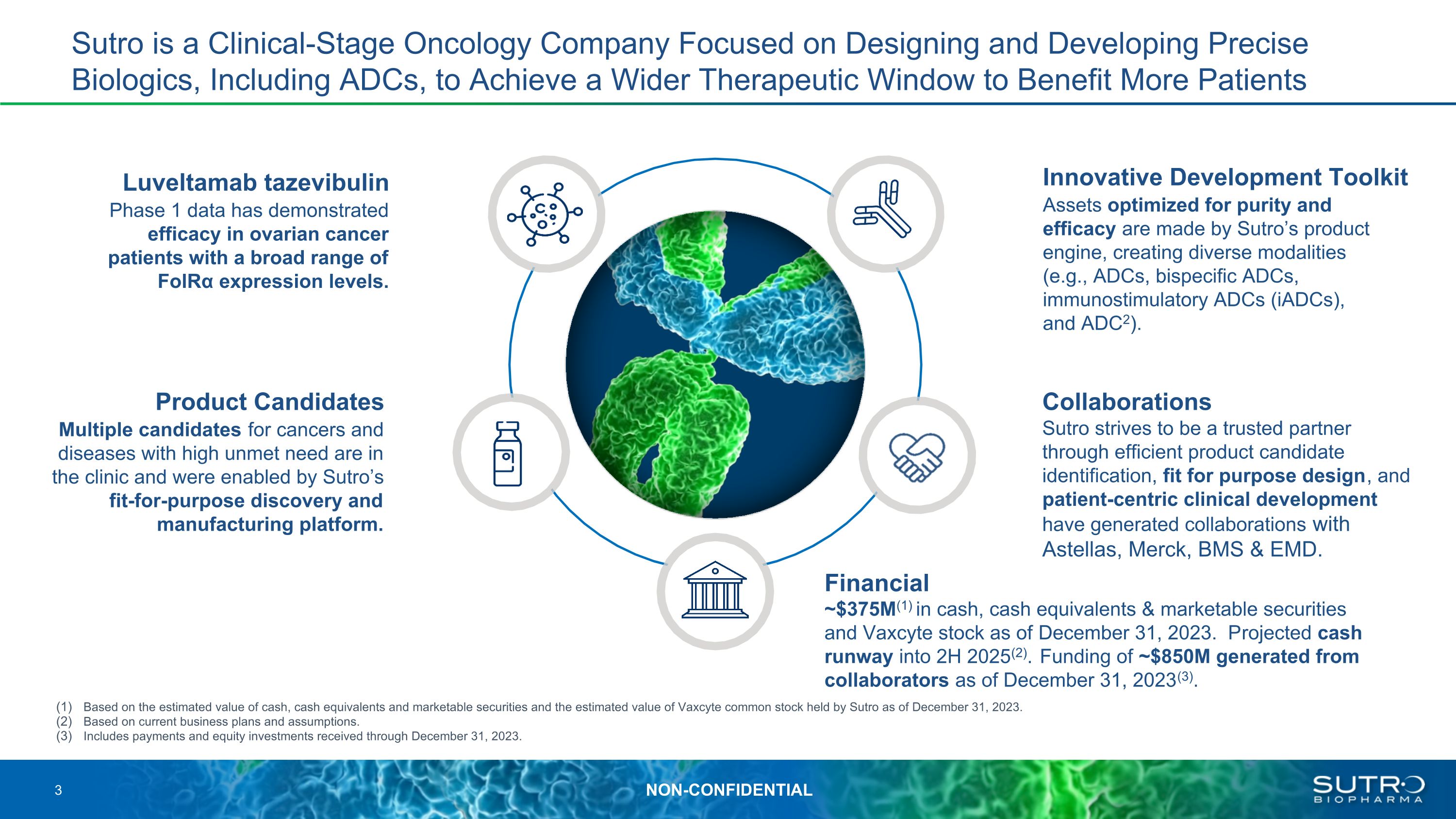
Luveltamab tazevibulin 1期數據已證明對卵巢癌患者有效,其FOLRα表達水平各不相同。針對純度和功效進行了優化的創新開發工具包資產由Sutro的產品引擎製成,創造了多種模式(例如ADC、雙特異性ADC、免疫刺激性ADC(IADC)和ADC2)。金融產品候選藥物臨牀上有多種未得到滿足的癌症和疾病的候選藥物,並由Sutro的適合用途的發現和製造平臺提供支持。Sutro是一家臨牀階段的腫瘤學公司,專注於設計和開發包括ADC在內的精密生物製劑,以實現更大的治療窗口,使更多患者受益。Sutro致力於通過高效的候選產品識別、適合用途的設計和以患者為中心的臨牀開發成為值得信賴的合作伙伴,已經與安斯泰來、默沙東、BMS和EMD進行了合作。約3.75億美元(1)美元的現金,現金等價物截至2023年12月31日,有價證券和Vaxcyte股票。預計現金流將持續到2025年下半年(2)。截至2023年12月31日,合作者共籌集了約8.5億美元的資金(3)。基於截至2023年12月31日現金、現金等價物和有價證券的估計價值以及Sutro持有的Vaxcyte普通股的估計價值。基於當前的業務計劃和假設。包括截至2023年12月31日收到的款項和股權投資。

Sutro強大的候選產品線展示了我們的創新流程,旨在擴大未滿足需求高領域的患者受益計劃模式/靶向適應症發現全球臨牀前1/1B期2/3期或地理合作夥伴 SUTRO主導的項目 Luveltamab tazevibulin(Luvelta,STRO-002)FOLRα抗體藥物偶聯物(ADC)卵巢癌卵巢癌(貝珠單抗組合)子宮內膜癌 CBF/GLIS2 兒科急性髓細胞腺癌、NSCLC STRO-001 (1) CD74 ADC B 細胞惡性腫瘤 STRO-003 ROR1 ADC 實體瘤和血液學癌症 STRO-004 組織因子 ADC 實體瘤合作伙伴計劃 VAX-24 24 價偶聯疫苗侵入性肺炎球菌病 VAX-31 31 價偶聯疫苗侵入性肺炎球菌病 MK-1484 選擇性 IL-2 激動劑晚期或轉移性實體瘤未公開項目免疫刺激性 ADC (IADC) 癌症(大中華版權)快速通道指定孤兒藥和罕見兒科疾病指定多個項目 1.美國的1階段劑量升級已經完成,由BioNova 4牽頭的大中華區的臨牀開發正在進行中

成就與里程碑 5 針對多種適應症的靶向計時 Luveltab tazevibulin(luvelta,STRO-002)在 2024 年 1 月的綜合報告中重點介紹 luvelta 的潛在多癌機會 Reframe-O1 第 1 部分 LPI,一項針對鉑耐藥卵巢癌的 2/3 期註冊導向試驗 2024 年 1H 啟動Reframe-P1,一項針對兒科復發/難治性 CBF/2/3 期註冊的試驗 GLIS2 AML 2024 年上半年提交非小細胞肺癌 (NSCLC) 的研究性新藥 (IND) 申請 2024 年上半年啟動 Reframe 的第 2 部分-O1,一項針對鉑耐藥卵巢癌的 2/3 期註冊導向試驗 2024 年下半年啟動非小細胞肺癌 (NSCLC) 的臨牀試驗 2024 繼續子宮內膜癌的臨牀開發 2024 繼續與貝伐珠單抗聯合用於治療卵巢癌的臨牀開發 2024 其他管道項目提交 STRO-003 的研究性新藥 (IND) 申請,ROR1 ADC 2024 提交研究性新藥 (IND)) 申請 STRO-004,一種針對組織因子的 ADC 2025 合作與夥伴關係 Vaxcyte:延續長達十年的合作與夥伴關係 2024 安斯泰來:推進免疫刺激性 ADC (IADC) 2024 默沙東和天士力的臨牀前研究合作:為臨牀供應提供製造支持和材料 2024 ✓

Luveltamab Tazevibulin — 一種藥物的管道(Luvelta,STRO-002)

Luvelta:體現了Sutro在ADC開發方面的創新無細胞 XpressCF® 成熟技術和合作模式 Luvelta Folrα靶向ADC:Apipeline-in-a-Drug Optication下一代ADC有潛力改善臨牀結果和可組合性——到2025年下半年有現金跑道*,該團隊將在Luvelta註冊下向臨牀交付由Sutro Technology支持的6個分子,另外還有2個分子臨牀前階段截至2023年12月31日,包括IADC和ADC2在內的多種模式產生的約8.5億美元產生包括與Vaxcyte、安斯泰來、默沙東、百時美施貴寶和EMD Serono在內的合作伙伴關係在所有評估的適應症中均顯示出良好的臨牀活性,可解決低FOLRα表達的腫瘤註冊試驗;有可能成為低中表達患者的第一種療法肺癌臨牀前數據提高效力和療效提高反應ADC創新領導者的耐受性和耐久性 * 基於現金、現金等價物和有價物的估計價值證券和截至2023年12月31日Sutro持有的Vaxcyte普通股的估計價值。適應症:卵巢癌、Peds AML 和子宮內膜
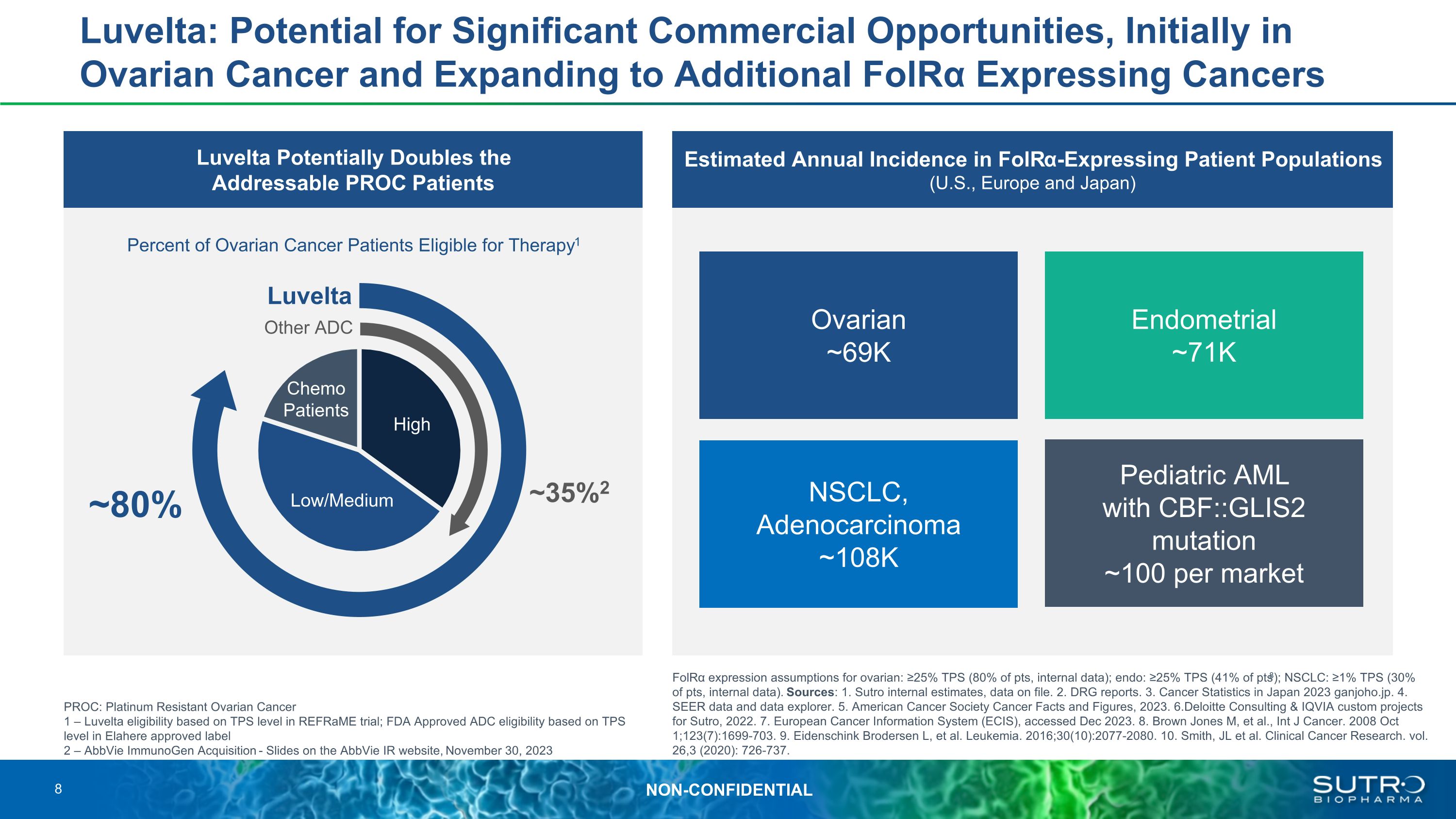
Luvelta:潛在的重大商業機會,最初是在卵巢癌領域,然後擴展到其他表達FOLRα的癌症 Luvelta有可能使表達FOLRα的患者羣體(美國、歐洲和日本)中可尋址的PROC患者估計年發病率翻一番 PROC:鉑耐藥卵巢癌 1 — 根據Reframe試驗中的TPS水平獲得Luvelta資格;根據Elahere批准的標籤2中的TPS水平,獲得美國食品藥品管理局批准的ADC資格 — AbbVie ImmunoGen 收購——AbbVie IR 網站上的幻燈片,2023 年 11 月 30 日 FOLRα 表達卵巢假設:≥ 25% TPS(佔總分數的 80%,內部數據);內部:≥ 25% TPS(pts8 的 41%);非小細胞肺癌:≥ 1% TPS(佔總分數的 30%,內部數據)。資料來源:1.Sutro 內部估計,存檔數據。2.DRG 報告。3.2023 年日本癌症統計 ganjoho.jp. 4.SEER 數據和數據瀏覽器。5.美國癌症協會癌症事實與數據,2023年。6.德勤諮詢和IQVIA為蘇特羅定製項目,2022年。7.歐洲癌症信息系統 (ECIS),2023 年 12 月訪問。8.Brown Jones M 等人,《國際癌症雜誌》。2008 年 10 月 1 日;123 (7): 1699-703。9.Eidenschink Brodersen L,等。白血病。2016; 30 (10): 2077-2080. 10.史密斯、JL 等。臨牀癌症研究。第 26,3 卷(2020):726-737。符合治療條件的卵巢癌患者百分比1 卵巢 ~69K NSCLC,腺癌 ~108K 帶有 CBF 的兒科急性髓細胞白血病:: GLIS2 突變每個市場 ~100 個子宮內膜 ~71K 其他 ADC Luvelta 高低/中度化療患者 ~ 35% 2 ~ 80% 8

Luvelta:旨在實現全部潛在治療領域的戰略發展計劃 2024 年 1/1B 期第 2/3 期里程碑卵巢癌第 1 部分:LPI — 1H 第 2 部分:開放歐盟基地 — 2H 卵巢癌完成完成持續臨牀開發子宮內膜癌持續臨牀開發 RAM AML 啟動試驗 1H NSCLC IND 1H 早期信號:可能是 2H24—1H25 加上 G-CSF 劑量擴張劑量增加含貝伐珠單抗的組合來源:clinicaltrials.gov NCT05870748。存檔的 Sutro 內部數據。表示試驗註冊或計劃開始註冊第一階段計劃支持啟動試驗 refrαME-P1 註冊導向試驗 refrαme-O1 註冊導向試驗 9

Luvelta:Peds RAM-AML 處於戰略地位,可應對潛在的 PRV,加速市場進入和商業準備工作 OC 資格劑量擴張劑量擴張關鍵終點復發/難治性 CBFA2T3:: GLIS2 AML ≥ 5% 骨髓參與白血病細胞完全緩解 (CR) 率可測量的殘留疾病 (MRD) 陰性反應率完全緩解,部分血液學恢復 (cRH) 率 EFS、RFS 和操作系統安全,PK 選定劑量 N = ~18 PRV:兒科審查券來源:clinicaltrials.gov NCT05870748。存檔的 Sutro 內部數據。資格第 2 階段:劑量查找關鍵終點第 3 階段:隨機試驗耐鉑卵巢癌至第 1 鉑金或進展至 ≤ 6m 至最後一鉑金的 1-3 系 ECOG PS 0-1 排除原發鉑難治性 folR1 表達 ≥ 25% 最終分析以獲得全面批准:PFS、OS 中期分析計劃支持加速審批:ORR、DOR 安全、QoL、PK 優化劑量方案研究者選擇化療 R 1:1 N = ~258 N = ~258 N = ~258 N = ~258 N = ~258 N = ~ 258 劑量 A:5.2 mg/kGIV q3w + 預防性 G CSF 4.3 mg/kg,2 個週期後,劑量 B:4.3 mg/kGIV q3w R 1:1 N = 25 N = 25 3。5 mg/kg IV q2w 劑量中的鉛 4.3 mg/kg IV q2w R 1:1 N = 3-6 N = 3-6 N = 3-6 10
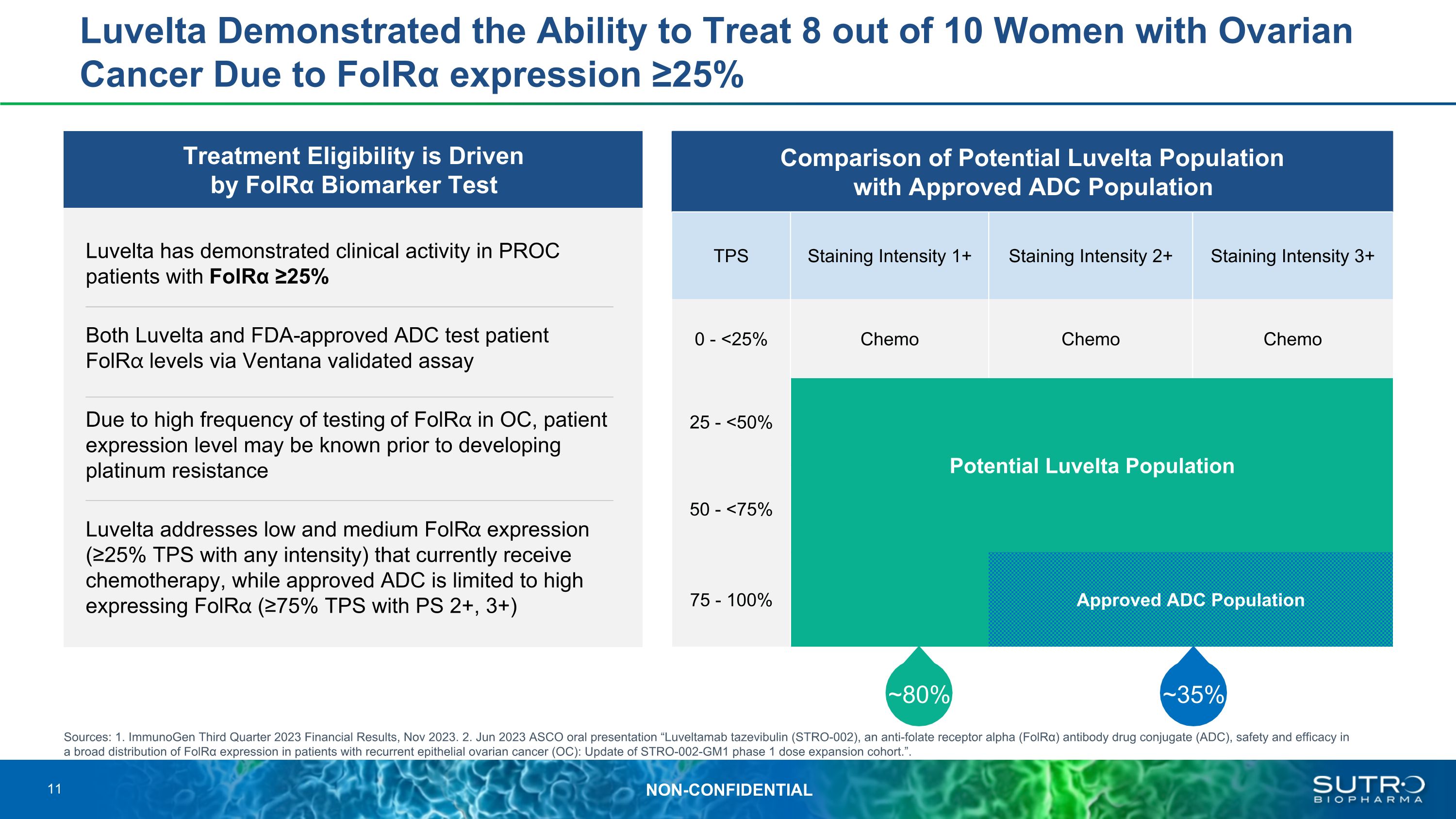
治療資格由FOLRα生物標記物測試驅動Luvelta已在PROC患者中表現出臨牀活性,FOLRα≥25%。Luvelta和美國食品藥品管理局批准的ADC通過Ventana驗證的檢測患者folr水平由於在OC中進行Folr的測試頻率很高,在出現鉑耐藥性之前可能就知道患者的表達水平 Luvelta可以解決低和中等Folr的表達(在任何強度下均為≥ 25% TPS)目前正在接受化療的人,而批准的 ADC 僅限於高表達 folr(使用 PS 2+、3+ 時 TPS ≥ 75%)Luvelta 演示了由於FOLRα表達可以治療每10名患有卵巢癌的女性中有8名 ≥ 25% 潛在Luvelta人羣與批准的ADC羣體的比較 TPS 染色強度 1+ 染色強度 2+ 染色強度 3+ 0-
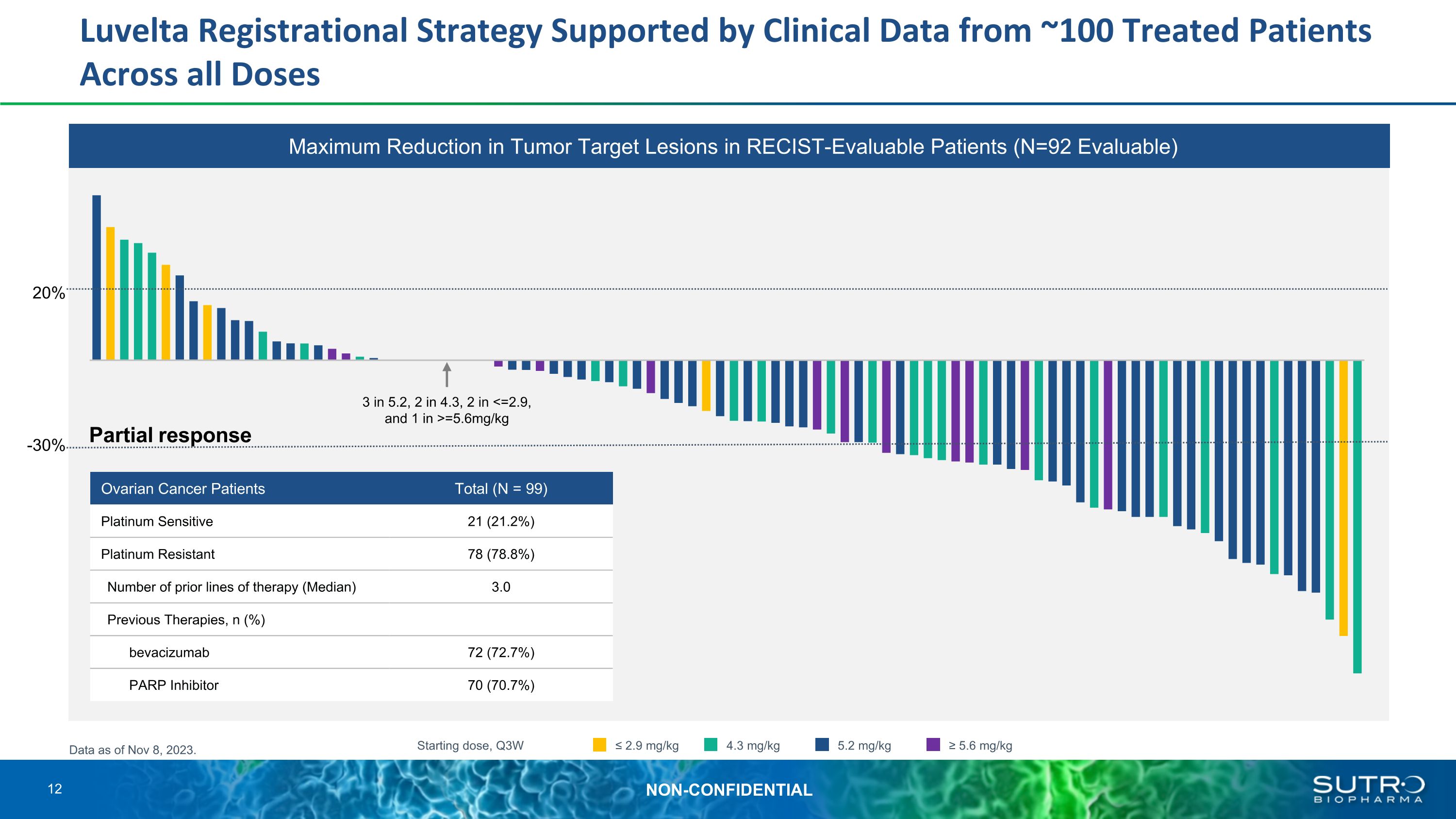
Luvelta註冊策略得到來自所有劑量中約100名接受治療患者的臨牀數據的支持。截至2023年11月8日,所有劑量中3分之5.2,2分之4.3,2英寸 =5.6mg/kg 起始劑量,Q3W ≤ 2.9 mg/kg 4.3 mg/kg 5.2 mg/kg ≥ 5.6 mg/kg 20% -30% 的數據。卵巢癌患者總數(N = 99)鉑敏感 21(21.2%)鉑耐藥性 78(78.8%)先前的治療線路數量(中位數)3.0 先前的療法,n(%)貝伐珠單抗 72(72.7%)PARP 抑制劑 70(70.7%)RECST 可評估患者的腫瘤靶損最大降低(N=92 可評估)12

第 1 階段:尋求劑量擴張信號增強型 G-CSF(中性粒細胞減少管理)N = 44 N = 16 已建立 FOLRα ≥ 25% PROC 降低了高級中性粒細胞減少症 Luvelta 在卵巢癌中表現出令人信服的抗腫瘤活性和可耐受的安全性 1 期:劑量遞增組合含貝伐珠單抗 N = 39 N = 18 最佳劑量範圍卵巢癌患者可耐受和活躍的綜合分析改善臨牀結果 SoC 化療(歷史)與 SoC 化療相比,耐受性狀況有所改善(歷史)在未滿足的需求中顯示出臨牀益處表達患者的心情 13
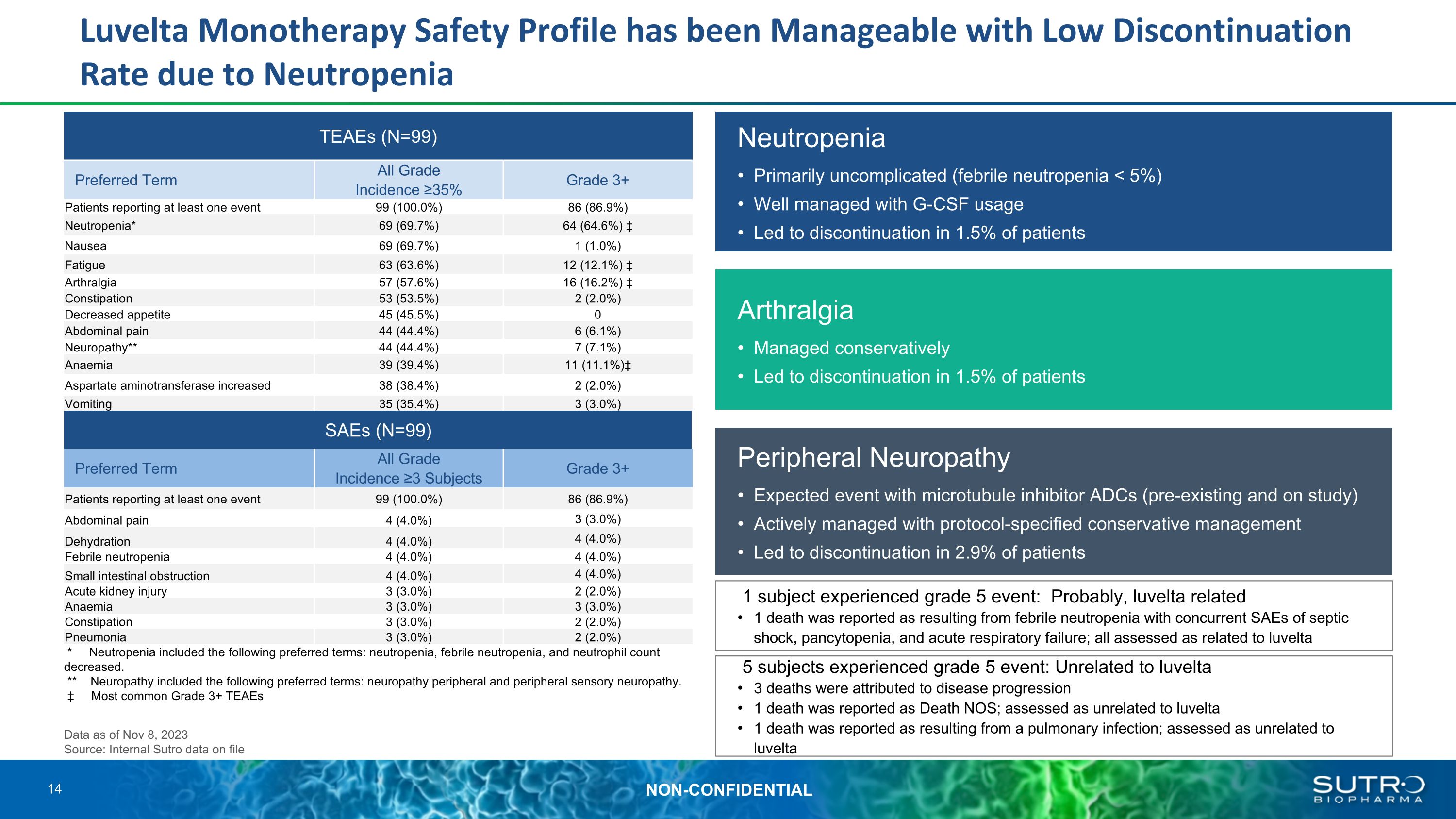
由於中性粒細胞減少症 TEAE (N=99) TEAE (N=18) 首選術語所有等級發病率 ≥ 35% 3級以上患者報告至少一個事件 99 (100.0%) 86 (86.9%) 中性粒細胞減少* 69 (69.7%) 64 (64.6%) 噁心 69 (69.7%) 1 (1.0%) 疲勞 63 (1.0%) 63 (1.0%) 63 (1.0%) 疲勞 63 (1.0%) 64 (64.6%),Luvelta 單一療法安全概況一直處於可控狀態 63.6%) 12 (12.1%) 關節痛 57 (57.6%) 16 (16.2%) 便祕 53 (53.5%) 2 (2.0%) 食慾下降 45 (45.5%) 0 腹痛 44 (44.4%) 6 (6.1%) 神經病變** 44 (44.4%) 7 (7.1%) 貧血 39 (39.4%) 11 (11.1%) 天冬氨酸氨基轉移酶升高38 (38.4%) 2 (2.0%) 嘔吐 35 (35.4%) 3 (3.0%) SAE (N=99) TEAE (N=18) 首選術語所有等級發病率 ≥3 受試者 3 級以上報告至少一個事件的患者 99 (100.0%) 86 (86.9%) 腹痛 4 (4.0%) 3 (3.0%) 脱水 4 (4.0%) 4 (4.0%) 中性粒細胞發熱 4 (4.0%) 4 (4.0%) 小腸梗阻 4 (4.0%) 4 (4.0%) 急性腎損傷 3 (3.0%) 2 (2.0%) 貧血 3 (3.0%) 3 (3.0%) 2 (2.0%) 肺炎 3 (3.0%) 2 (2.0%) * 中性粒細胞減少包括以下首選術語:中性粒細胞減少症、發熱性中性粒細胞減少症,和中性粒細胞數降低。** 神經病變包括以下首選術語:神經病變周圍和周圍感覺神經病變。最常見的 3+ 級 TEAES 周圍神經病變微管抑制劑 ADC 的預期事件(已存在且正在研究中)使用協議指定的保守治療進行積極管理導致 2.9% 的患者停藥中性粒細胞減少主要無併發症(發熱性中性粒細胞減少症

Luvelta:在低和/或可變FOLRα表達的腫瘤中表現出令人信服的抗腫瘤活性和可控的安全性其他適應症第 1 階段:劑量擴大(全單一藥物)子宮內膜 RAM AML1 NSCLC N = 17 N = 25 臨牀前證據未觀察到新的安全信號持續臨牀開發有意義的臨牀反應,包括完全緩解和延長總體存活期,耐受性良好,可作為門診患者進行註冊試驗單劑量並與 PD-1 聯合使用封鎖顯示出抗腫瘤活性 IND 1H 2024 5 15 1 2 99 6 25 45 15 35 8 45 45 75 18 70 30 2 點有 0% 局部反應 20% -30% TPS (%) 正在進行治療 TPS > 25% ≤ 25% Luvelta EAP moS 未達到 1.0 0.8 0.4 0.0 0 0 2 2 4 6 8 10 12 14 自首次接種 IP 或復發以來的存活時間(月)存活概率歷史 Luvelta 歷史(N=Historical)26) moS = 目標病變最大減少6.1個月*接受Luvelta非分餾給藥方案(N=21)採用單劑量 Luvelta 單一療法的 NSCLC PDX 模型的兒童的總體存活率數據截止時間:2023 年 8 月 4 日。*n=16 個可評估反應的患者。PR,部分反應;TPS,腫瘤比例分數。1-這些數據由主治醫生生成,由Sutro收集並可供呈現。子宮內膜來源:2023 年 10 月 ESMO 迷你口服報告 “741MO-Luveltamab tazevibulin (STRO-002),一種抗葉酸受體 α (FOLRα) 抗體偶聯物 (ADC),顯示了復發/進行性上皮性子宮內膜癌 (EEC) 的臨牀活性:STRO-002-GM1 I 期劑量擴大。”RAM AML 來源:2023 年 12 月 ASH 海報 “Luveltamab Tazevibulin(LT,STRO-002)的抗白血病活性,這是一種用於復發/難治性 CBFA2T3:: GLIS2 AML 的新型葉酸受體-α(FR-α)靶向抗體藥物偶聯物(ADC)。”NSCLC 來源:Sutro 內部臨牀前數據存檔。審查的研究天數 800 600 400 200 0 0 0 0 20 40 60 80 100 腫瘤大小 (mm3) 載體 5 mg/kg luvelta(單劑量)10 mg/kg luvelta(單劑量)15
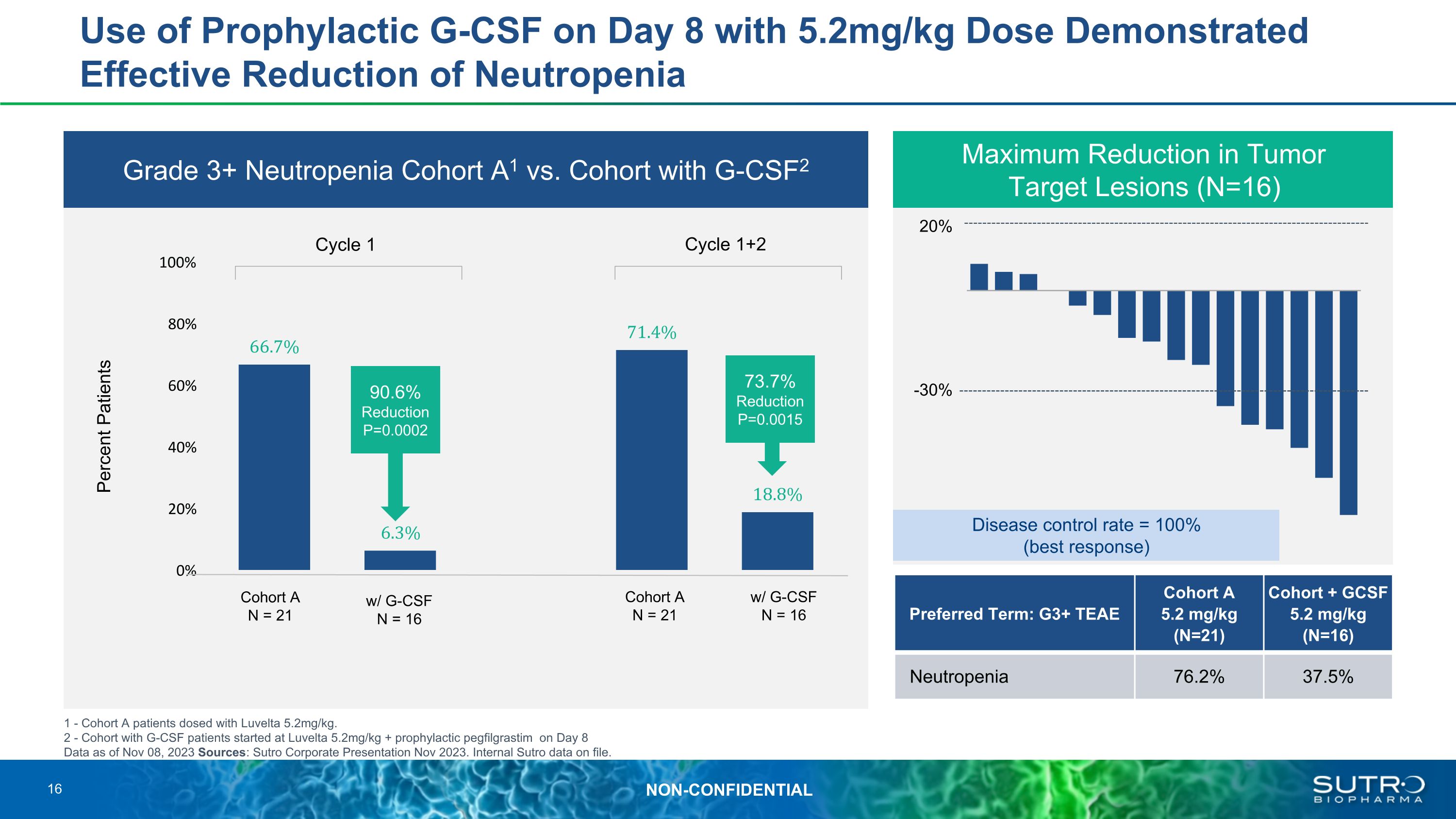
與使用 G-CSF2 的隊列相比,第 8 天使用預防性 G-CSF 劑量為 5.2mg/kg 的中性粒細胞減少症 A1 隊列顯示可有效降低 3 級以上中性粒細胞減少隊列 A1 ——隊列 A 患者服用 Luvelta 5.2mg/kg。2-G-CSF 患者的隊列於第 8 天開始服用 Luvelta 5.2mg/kg + 預防性 pegfilgrastim,數據來源 2023 年 11 月 8 日:Sutro 2023 年 11 月公司發佈會。存檔的 Sutro 內部數據。腫瘤目標病變的最大減少量(N=16)20% -30% 隊列 A N = 21 w/ G-CSF N = 16 隊列 A N = 21 w/ G-CSF N = 16 週期 1+2 百分比患者 90.6% 降低 P=0.0002 7% P=0.0015 疾病控制率 = 100%(最佳反應)首選術語:G3+ TEAE 隊列 A 5.2 mg/kg(N = 21)) 隊列 + GCSF 5.2 mg/kg (N=16) 中性粒細胞減少症 76.2% 37.5% 16

Luvelta 顯示出表達子宮內膜癌的 FOLRα 具有抗腫瘤活性的證據:在 ESMO 2023 上公佈的數據目標病變的最大減少量* 觀察到的一致安全信號為 0% 部分反應 20% -30% TPS (%) 5 15 1 2 99 6 25 45 15 35 8 45 45 75 18 70 30 中位隨訪時間:10.1 個月持續治療 TPS > 25% ≤ 25% TEAE,n(%)最常見事件總數(N = 17)AE,n(%)任何等級*等級 ≥3 報告至少 1 起事件的患者 17(100.0)15(82.2)貧血 13(76.5)4(23.5)關節痛 12(70.6)3(17。6) 中性粒細胞減少症 11 (64.7) 9 (52.9) 噁心 10 (58.8) 1 (5.9) 食慾下降 10 (58.8) 0 17 名患者中有 5 名 (29%) 接受 ≥5 個週期數據截止日期:2023 年 8 月 4 日。*n=16 個可評估反應的患者。DCR,疾病控制率;EC,子宮內膜癌;PR,部分反應;Q3W,每 3 週一次;TPS,腫瘤比例評分。中性粒細胞減少包括以下首選術語:中性粒細胞減少症、發熱性中性粒細胞減少症和中性粒細胞數量減少。來源:2023年10月ESMO迷你口頭報告 “741MO——抗葉酸受體α(FOLRα)抗體偶聯物(ADC)Luveltamab tazevibulin(STRO-002)顯示了復發/進行性上皮性子宮內膜癌(EEC)的臨牀活性:STRO-002-GM1 I 期劑量擴大。”TPS > 25% 患者的 ORR 為 29% 17
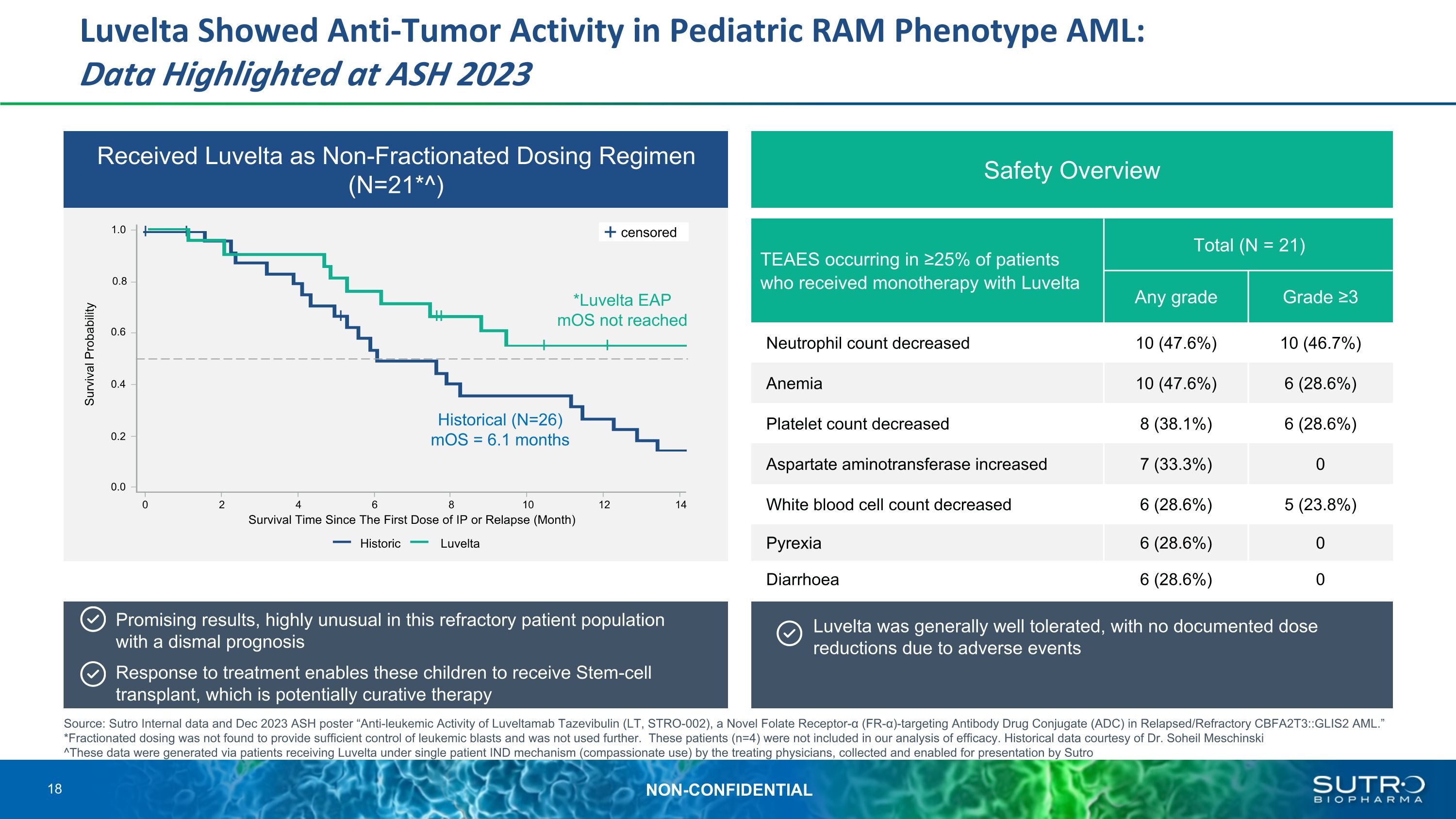
Luvelta 在兒科 RAM 表型 AML 中顯示出抗腫瘤活性:在 ASH 2023 上強調的數據顯示 Luvelta 為非分餾給藥方案(N=21*^)安全概述 TEAES 發生在接受 Luvelta 總計 (N = 21) AE 單一療法的患者中,n (%) 任何等級 ≥3 的中性粒細胞計數減少 10 (47.6%) 10 (46.7%) 貧血 10 (47.6%) 6 (28.6%) 血小板計數減少 8 (38.1%) 6 (28.6%) 天冬氨酸氨基轉移酶增加 7 (33.3%) 0 白細胞計數下降 6 (28.6%) 5 (23.8%) Pyrexia 6 (28.6%) 0 有希望結果,在這些預後不佳的難治患者羣體中非常不尋常。治療反應使這些兒童能夠接受幹細胞移植,這可能是治療方法 Luvelta 總體耐受性良好,沒有記錄到因不良事件導致的劑量減少 *Luvelta EAP moS 未達到 1.0 0.8 0.6 0.4 0.0 0 0 2 4 4 4 6 8 10 12 14 自首次接種 IP 或復發(月)以來的存活時間(月)歷史生存概率 Velta Historical (N=26) mOs = 6.1 個月來源:Sutro 內部數據和 2023 年 12 月 ASH 海報 “抗白血病Luveltamab Tazevibulin(LT,STRO-002),一種新的葉酸受體α(FR-α)靶向抗體藥物偶聯物(ADC)在復發/難治性 CBFA2T3:: GLIS2 AML 中的活性。”*未發現分餾劑量可以充分控制白血病細胞,因此未進一步使用。這些患者(n=4)未包括在我們的療效分析中。歷史數據由 Soheil Meschinski 博士提供 ^這些數據是由主治醫生根據單一患者 IND 機制(同情使用)接受 Luvelta 治療的患者生成的,由 Sutro 收集並允許呈現
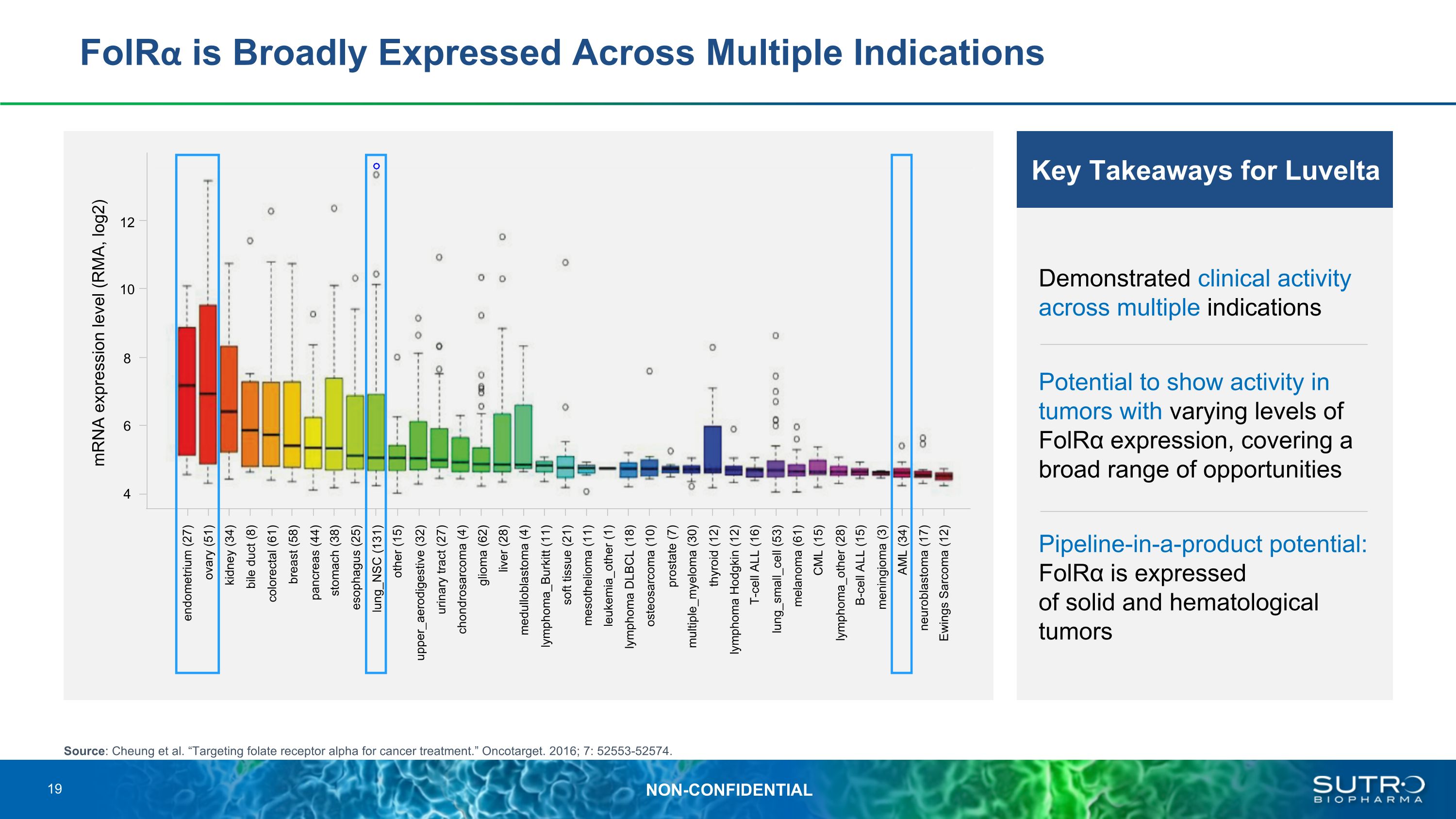
FOLRα在多種適應症中廣泛表達來源:Cheung等人。“靶向葉酸受體α用於癌症治療。”Oncotarget。2016;7:52553-52574。Luvelta的關鍵要點在多種適應症中表現出臨牀活性可能在FOLRα表達水平不同的腫瘤中顯示出活性,涵蓋了廣泛的機會產品管道潛力:FOLRα表達於實體和血液學腫瘤 mRNA 表達水平 (RMA,log2) 12 10 8 6 4 子宮內膜 (27) 卵巢 (51) 腎臟 (34) 膽管 (8) 結直腸管 (8) (61) 乳房 (58) 胰腺 (44) 胃 (38) 食道 (25) Lung_NSC (131) 上部空氣消化系統 (32) 其他 (15) 尿路 (27) 軟骨肉瘤 (4) 膠質瘤 (62) 肝臟 (28)髓母細胞瘤 (4) 淋巴瘤伯基特 (11) 軟組織 (21) 間皮瘤 (11) 白血病_其他 (1) 淋巴瘤 DLBCL (18) 骨肉瘤 (10) 前列腺 (7) 多發性骨髓瘤 (30) 甲狀腺 (12) 霍奇金淋巴瘤 (12) T 細胞 (16) lung_small_cell (53)) 黑色素瘤 (61) CML (15) 淋巴瘤_其他 (28) B 細胞 ALL (15) 腦膜瘤 (3) AML (34) 神經母細胞瘤 (17) 尤因斯肉瘤 (12) 19

STRO-003和新興研究組合

2。不同機制的單偶或雙共軛 1.靶向單特異性或雙特異性 TAA Sutro 靈活的設計和創新工具包為改善患者體驗提供了潛力利用細胞毒有效載荷增強腫瘤靶向雙特異性 ADC 可更好地靶向腫瘤抗原的新型有效載荷雙腫瘤抗原偶聯抗體腫瘤抗原模態藥物特性靶結構 ADC/ISAC iADC/ADC2 具有互補模式的位點特異性雙藥偶聯物我們的 ADC 設計流程提供經過優化和一致的候選產品,已設計造福更廣泛的患者羣體,為有害的 ADC 類效應提供解決方案 Linker-Payloads 工具包 DNA 靶向/靶向細胞毒素的微管蛋白免疫調節劑其他機械協同有效載荷專有可分解/不可切割的連接劑
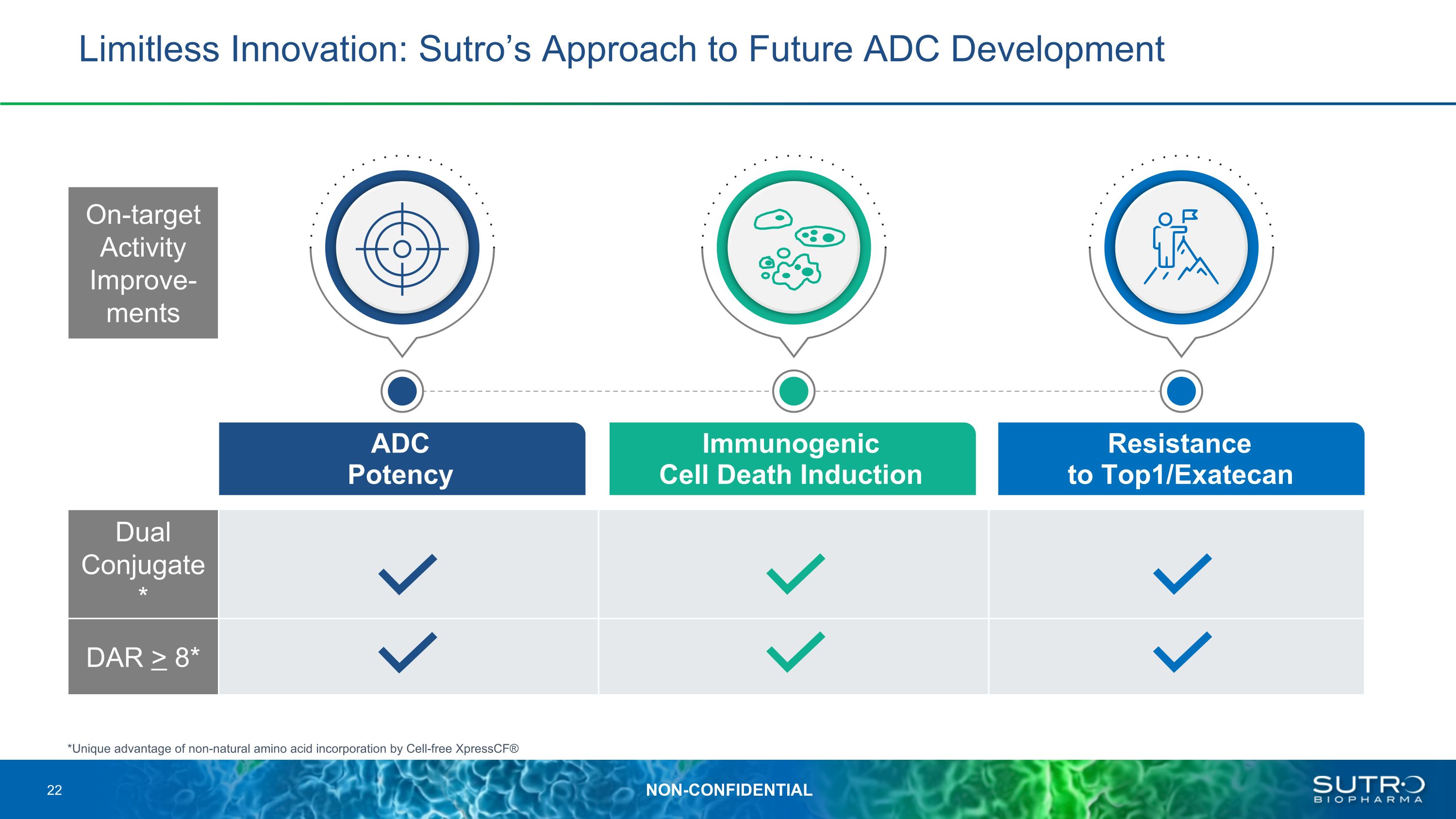
無限創新:Sutro 的未來 ADC 開發方法 ADC 效力免疫原性細胞死亡誘導抗性 Top1/Exatecan *通過無細胞 XpressCF® 雙偶聯物摻入非天然氨基酸的獨特優勢* DAR > 8* 靶向活性改善

STRO-003:一種專為特定目的而設計的新型ROR1靶向ADC靶點ROR1生物學使其成為有吸引力的腫瘤學適應症空間廣闊的臨牀表現潛力 ROR1:在癌症進展中起作用並在腫瘤和腫瘤起始細胞中表達,由於正常組織表達和臨牀安全性驗證受限,ROR1在血液系統惡性腫瘤中的臨牀驗證和實體瘤的潛在機會廣泛,包括非小細胞肺癌等大型適應症還有乳腺癌低拷貝數而且 ROR1 抗原在腫瘤中的異質表達有利於具有高耐受性的強效 ADC STRO-003 優化的連接劑設計和有效載荷選擇,以及每個抗體 8 個鏈接有效載荷的精確定位,在抗原表達量低的人類腫瘤 (PDX) 中具有強效的療效,並且在臨牀前研究中是可以耐受的 STRO 003
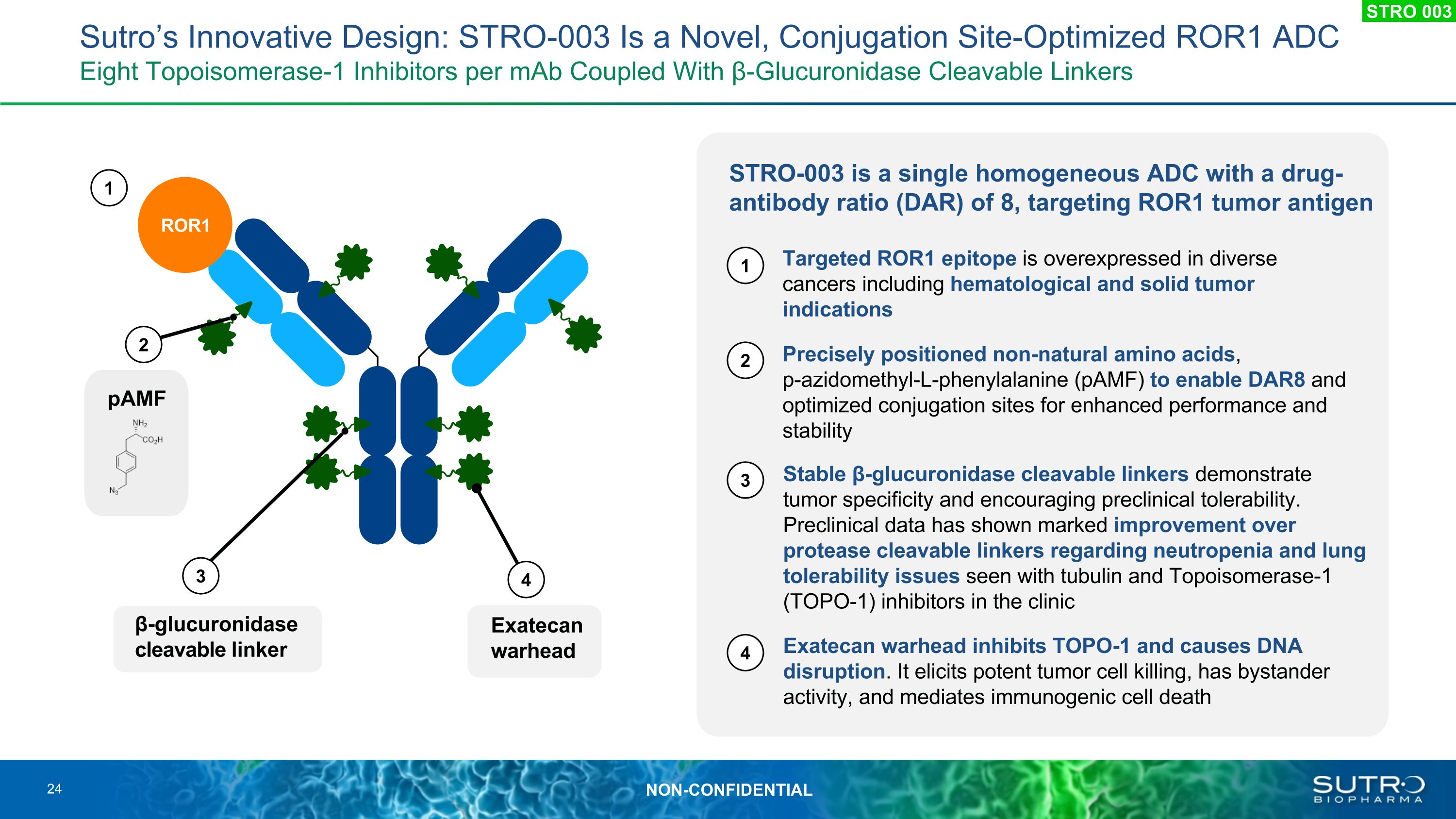
STRO-003 是一種單一均質 ADC,藥物抗體比 (DAR) 為 8,靶向 ROR1 腫瘤抗原 pamF ROR1 靶向 ROR1 表位在包括血液學和實體瘤適應症在內的多種癌症中過度表達。精確定位的非天然氨基酸、p-疊氮甲基-L-苯丙氨酸 (pamF) 以啟用 DAR8 和優化偶聯位點以增強性能和穩定性穩定性 β-葡萄糖醛酸酶可分解的連接劑顯示出腫瘤特異性,並具有良好的臨牀前耐受性。臨牀前數據顯示,臨牀中微管蛋白和拓撲異構酶-1(TOPO-1)抑制劑在中性粒細胞減少和肺耐受性問題上與蛋白酶可分解的連接劑相比有顯著改善 Exatecan 彈頭抑制 TOPO-1 並導致 DNA 破壞。它能引發強效的腫瘤細胞殺傷,具有旁觀者活性,介導免疫原性細胞死亡 Exatecanwarhead β-葡萄糖醛酸酶可分解連接物 Sutro 的創新設計:STRO-003 是一種新穎的、經過偶聯位點優化 ROR1 ADceIGHT 拓撲異構酶-1 抑制劑,每單抗與 β-葡萄糖醛酸酶可分解連接劑 24 STRO 003 4 3 2 1 1 2 3 4
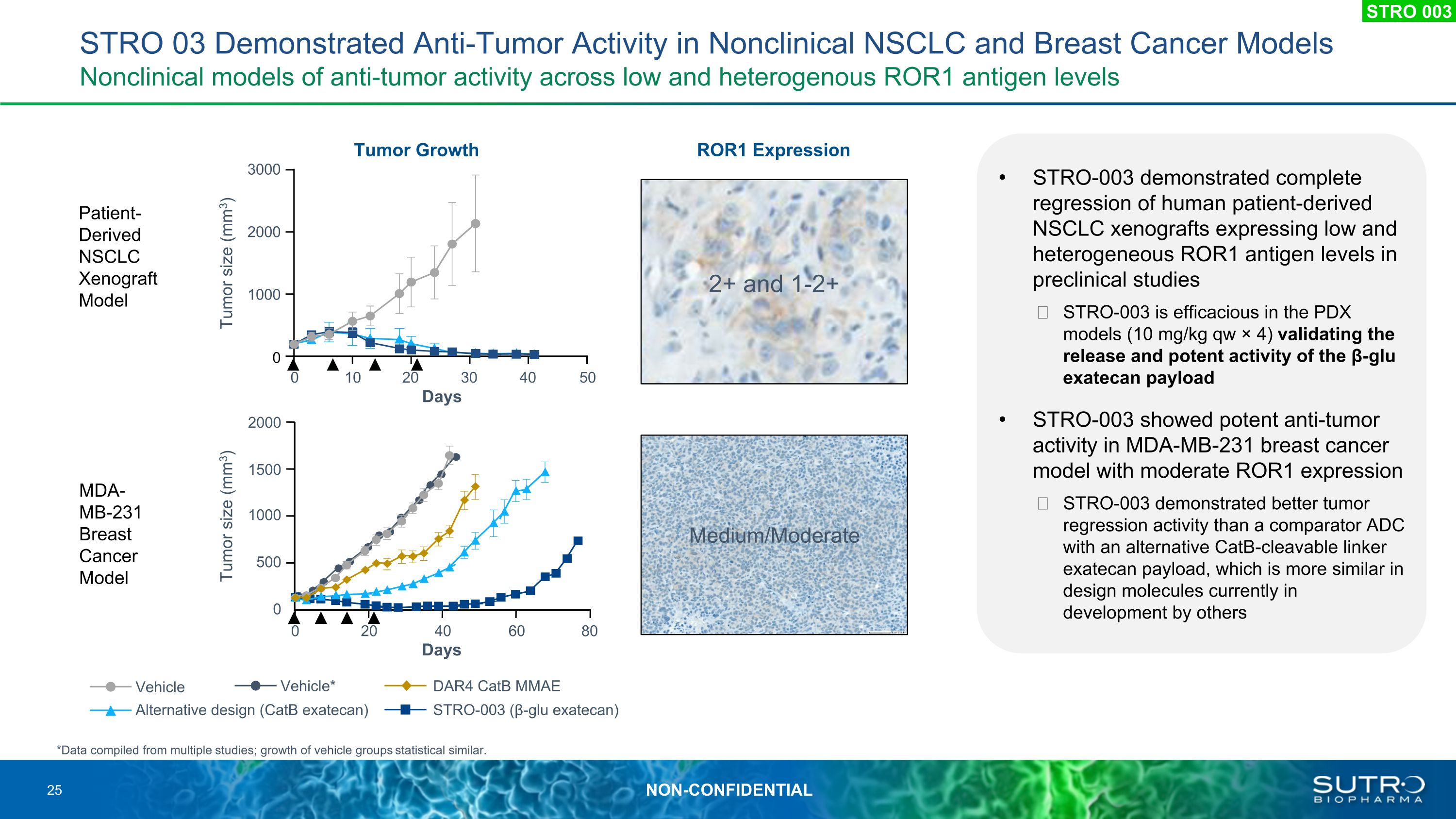
STRO 03 在非臨牀非小細胞肺癌和乳腺癌模型中顯示出抗腫瘤活性的非臨牀模型 STRO-003 顯示,在臨牀前研究中表達低和異質 ROR1 抗原水平的人類患者源性非小細胞肺癌異種移植物完全迴歸 STRO-003 在 PDX 模型(10 mg/kg qw × 4)中具有有效性,可驗證 β-gl的釋放和強效活性 u exatecan 有效載荷 STRO-003 在中等 ROR1 的 MDA-MB-231 乳腺癌模型中顯示出強大的抗腫瘤活性表達 STRO-003 表現出更好的腫瘤迴歸活性,與具有替代 CATB 可分解連接器 exatecan 有效載荷的比較器 ADC 相比,後者在其他人目前正在開發的設計分子中更為相似患者衍生的 NSCLC 異種移植模型 MDA-MB-231 乳腺癌模型 ROR1 表達腫瘤生長 2+ 和 1-2+ 中度/中度 2000 1500 1000 0 20 60 80 腫瘤大小 (mm3) Days 500 2000 1000 0 0 0 10 20 30 40 40 days 500 2000 1000 0 0 0 10 20 30 40 40 50 個腫瘤大小 (mm3) 天*數據來自多項研究;載體組的增長統計學相似。STRO-003 (β-glu exatecan) DAR4 CatB MMAE 車輛替代設計 (CatB exatecan) 車輛* STRO 003
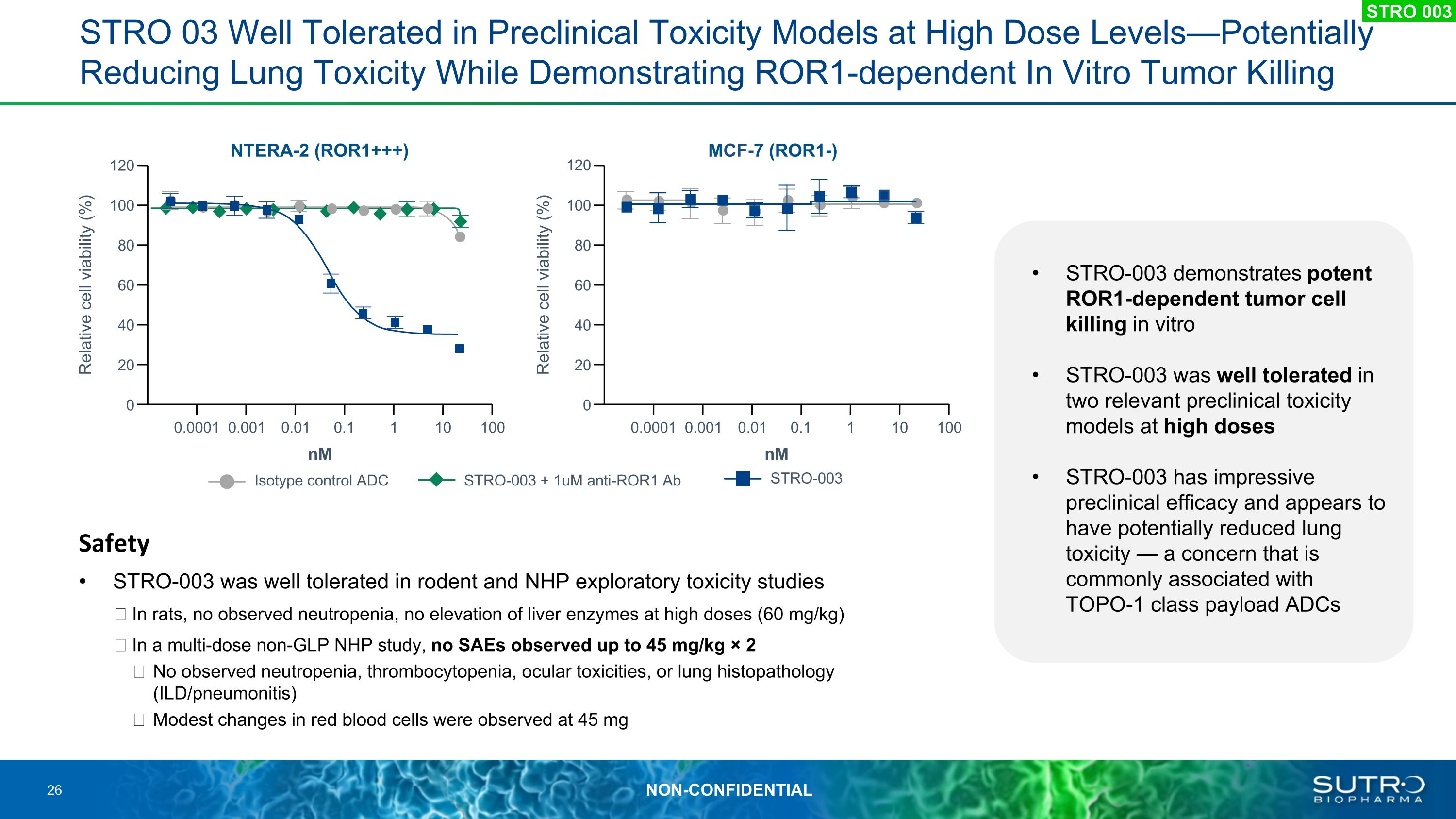
STRO 03 在高劑量水平的臨牀前毒性模型中耐受性良好 — 有可能降低肺毒性,同時證明 ROR1 依賴的體外腫瘤殺滅安全性 STRO-003 在齧齒動物和 NHP 的探索性毒性研究中耐受性良好。在大鼠中,未觀察到中性粒細胞減少症,高劑量 (60 mg/kg) 肝酶沒有升高在一項多劑量非 GLP NHP 研究中,未觀察到高達 45 mg/kg × 2 的 SAE 減少症、血小板減少症、眼部毒性或肺組織病理學(ILD/肺炎症)在45 mg時觀察到紅細胞略有變化STRO-003 同型對照 ADC STRO-003 + 1um 抗 ROR1 Ab NTERA-2 (ROR1+++) nM 120 60 40 0 0.0001 相對細胞活力 (%) 100 80 20 0.001 0.01 0.1 1 10 100 MCF-7 (ROR1-) 60 40 0 0.0001 相對細胞活力 (%) nM 100 80 20 0.001 0.01 1 10 100 120 STRO 003 STRO-003 在體外表現出強效的 ROR1 依賴性腫瘤細胞殺傷 STRO-003 在兩個相關的高劑量臨牀前毒性模型中具有良好的耐受性 STRO-003 具有令人印象深刻的臨牀前療效,似乎有可能降低肺毒性——這一問題通常與TOPO-1 級有效載荷 ADC

預付9000萬美元用於為最多三個目標開發IADC研究活動正在針對兩個不同的目標開展研究活動,每個候選產品的開發、監管和商業里程碑均為422.5萬美元,外加從低兩位數到中等百分比的分級特許權使用費建立在Sutro的ADC平臺和工程專業知識的基礎上,利用安斯泰來對免疫腫瘤學的主要關注 Sutro可以選擇共享美國產品的成本/利潤開發 Sutro 保留了在此之外/之外開發 IADC 的選項在其他目標方面的合作戰略iADC合作於2022年6月27日啟動冷腫瘤的新模式:免疫刺激性抗體藥物偶聯物(iADC)採用同時使用細胞毒素和免疫調節劑的雙重藥物偶聯技術 27

根據目前的業務計劃和假設,約3.75億美元(1)的現金、現金等價物和有價證券以及Vaxcyte股票預計到2025年下半年的現金流將達到2025年下半年。Vaxcyte(納斯達克股票代碼:PCVX)的約70萬股股票包含在上述金額中,我們的合作者產生的約8.5億美元(2)1。基於截至2023年12月31日現金、現金等價物和有價證券的估計價值以及Sutro持有的Vaxcyte普通股的估計價值。2.包括截至2023年12月31日收到的款項和股權投資。財務概覽 — 2023 年 12 月 31 日通過多種資金來源實現資本充足 28
經驗豐富的領導團隊 Lynx Neurex 29 安妮·博格曼,醫學博士首席醫學官 Venkatesh Srinivasan,博士,首席技術運營官 Linda Fitzpatrick 首席人事和傳播官 Nicki Vasquez,博士,首席投資組合戰略和聯盟官 Jane Chung,RpH 總裁兼首席運營官埃德·阿爾比尼,工商管理碩士首席財務官漢斯-彼得·格伯,博士首席科學官威廉·紐厄爾,京東首席執行官兼董事會成員董事會