

突破界限。點燃變革。 納斯達克:IOBT 2024 年 1 月公司簡報附錄 99.1

免責聲明 | 前瞻性 陳述本演示文稿中包含的某些信息包括經修訂的1933年《證券法》第27A條和經修訂的 1934年《證券交易法》第21E條所指的 “前瞻性陳述”,與我們的業務計劃、臨牀試驗和監管文件有關。在某些情況下,我們可能會使用 “可能”、“應該”、“將”、“期望”、“計劃”、 “預期”、“可能”、“打算”、“目標”、“項目”、“考慮”、“相信”、“估計”、“預測”、“潛在” 或 “繼續” 之類的術語或其他向他們傳達未來事件或結果的不確定性的詞語識別這些前瞻性陳述。我們的前瞻性陳述基於管理團隊當前的信念和期望, 涉及風險、環境的潛在變化、假設和不確定性。任何或全部前瞻性陳述可能被證明是錯誤的,或者受到我們可能做出的不準確假設或已知或未知的風險和 不確定性的影響。這些前瞻性陳述受風險和不確定性的影響,包括與我們的業務計劃的執行、臨牀試驗或其他研究的成功和時機相關的風險,以及我們在向美國證券交易委員會提交的 文件中列出的其他風險。出於所有這些原因,實際業績和發展可能與我們的前瞻性陳述中表達或暗示的業績和發展存在重大差異。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅在本演示之日作出。我們沒有義務公開更新此類前瞻性陳述以反映隨後的事件或情況。

適應症:黑色素瘤 SCCHN NSCLC 3 T-win 癌症疫苗技術平臺 1 3 管道項目 17 專利家族專注於在不增加全身毒性的情況下改善臨牀效果 50% 80% * 1/2 期 MM1636 黑色素瘤結果 25.5 個月 MPFs* 提供快速持久的 反應亮點 | 打破界限。Ignite Change。24 年第 3 季度第 3 期中期分析結果 IO102-IO103 第 3 期晚期黑色素瘤關鍵試驗已全部入組 2025 年潛在美國市場準入 ORR* CRR*

患者和市場視角 1 我們的 獨特的價值主張 2 我們的產品線及其背後的科學 3 增長戰略和展望 4 IO 生物技術團隊 5 內容
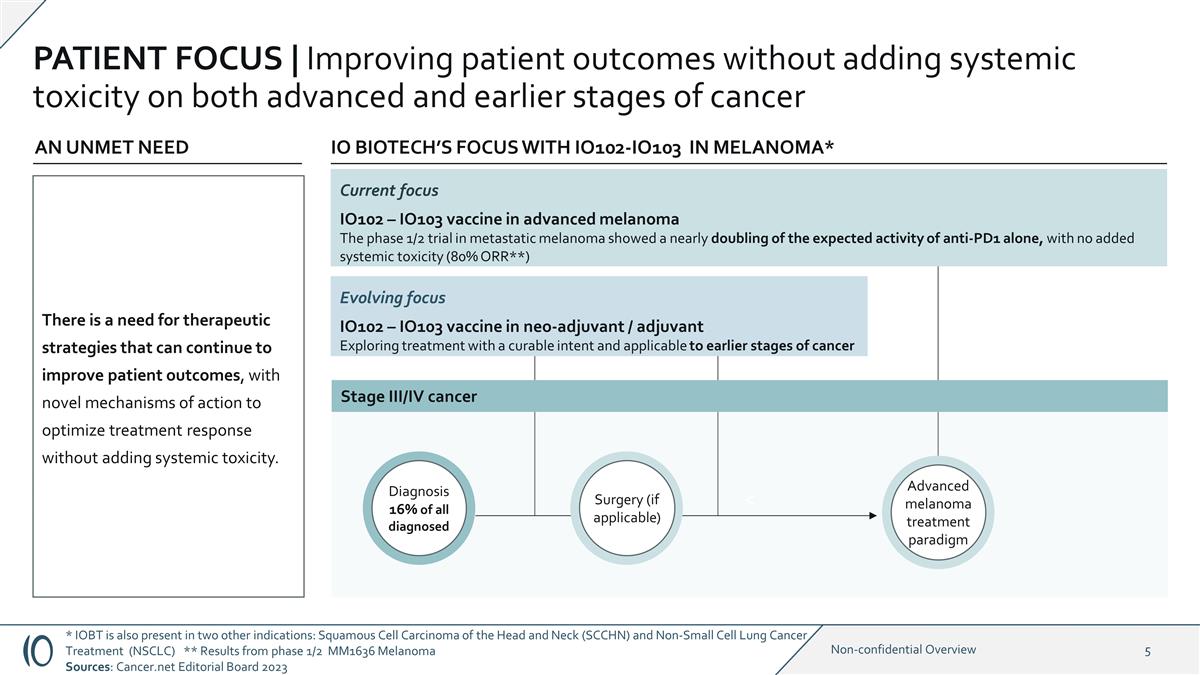
患者焦點 | 在不增加癌症晚期和早期階段全身毒性的前提下改善患者 預後 * IOBT 還存在於另外兩個適應症中:頭頸部鱗狀細胞癌 (SCCHN) 和非小細胞肺癌治療 (NSCLC) ** 1/2 期 MM1636 黑色素瘤結果 來源:Cancer.net 編輯委員會 2023 不斷演變的焦點 IO102 — IO103 新輔助劑疫苗/輔助藥物 IO BIOTECH 以可治癒的目的探索適用於癌症早期階段的治療方法* Currenoma* Current IO102-IO103焦點 IO102 — 用於晚期黑色素瘤的 IO103 疫苗轉移性黑色素瘤的 1/2 期試驗顯示,單獨使用抗 PD1 的預期活性幾乎翻了一番,沒有增加全身毒性 (80% ORR**) 未滿足的需求

市場 | IO Biotech 旨在解決 3種大型且不斷增長的適應症中未得到滿足的需求:頭頸部鱗狀細胞癌*(SCCHN)非小細胞肺癌治療**(NSCLC)黑色素瘤新病例、全球死亡病例、全球新發病例、 全球死亡人數,2020年全球估計 2040 ~510 000 ~325,000 ~57,000 ~57,000 ~57,000 ~744,000 1,109,000 ~364,000 ~1,875,000 ~3,084,000 ~1,526,000 ~556,000 ~2,557,000 +57% +68% +49% +52% +64% +68% *此處顯示的數據是脣部、口腔、喉部的發病率總和下嚥癌和口咽癌**此處顯示的數據相當於氣管、支氣管和肺部發病率的85%。來源:國際癌症研究機構
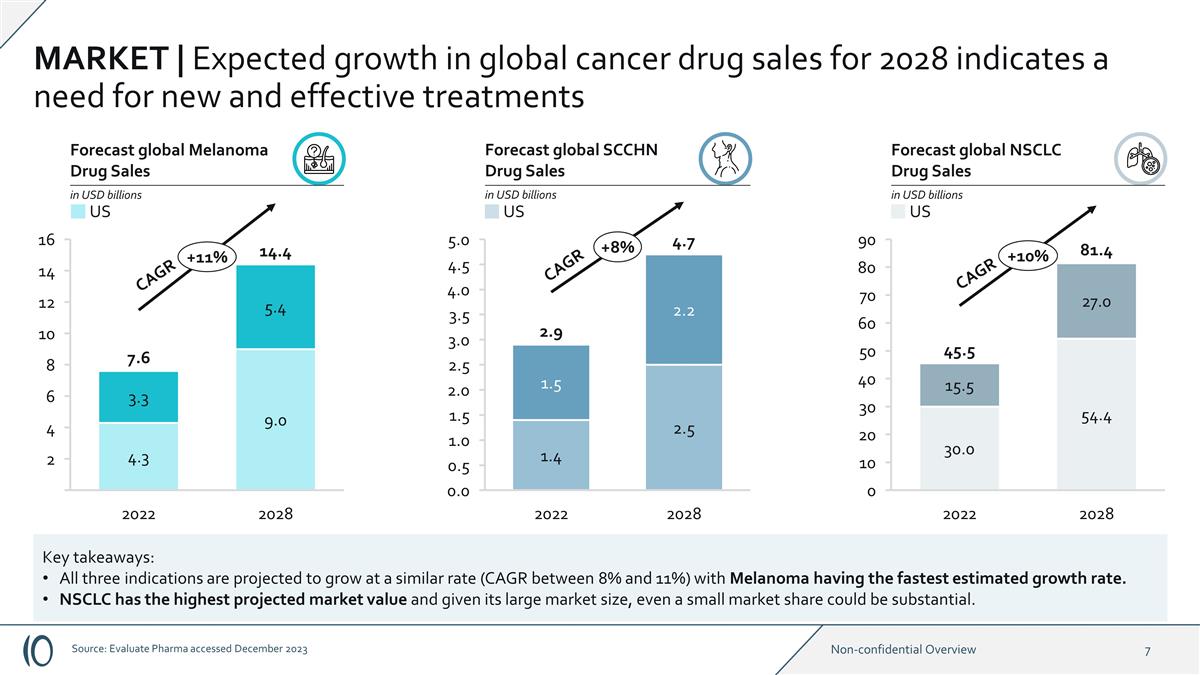
2028 2022 16 14 12 10 8 6 4 2 +11% 2028 2028 2028 2022年預測全球黑色素瘤藥物銷售額十億美元預測全球非小細胞肺癌藥物銷售額十億美元預測全球非小細胞肺癌藥物銷售額以十億美元計 0.0 4.0 5.0 4.5 3.5 3.5 2.5 1.0 1.0 1.0 0.5 +8% 0 90 80 70 60 40 4.0 9.0 5.3 10 +10% 複合年增長率 30.0 54.0 27.0 15.5 14.4 7.6 2.9 4.7 CAGR 45.5 81.4 CAGR 市場 | 2028年全球抗癌藥物銷售的預期增長表明需要新的有效療法關鍵要點:預計所有三種適應症都將以類似的速度(CAGR)增長介於8%至11%之間),其中黑色素瘤的估計生長速度最快。NSCLC的預計市場價值最高,鑑於其龐大的市場規模,即使很小的市場份額也可能很大。美國美國美國來源: Evaluate Pharma 於 2023 年 12 月訪問
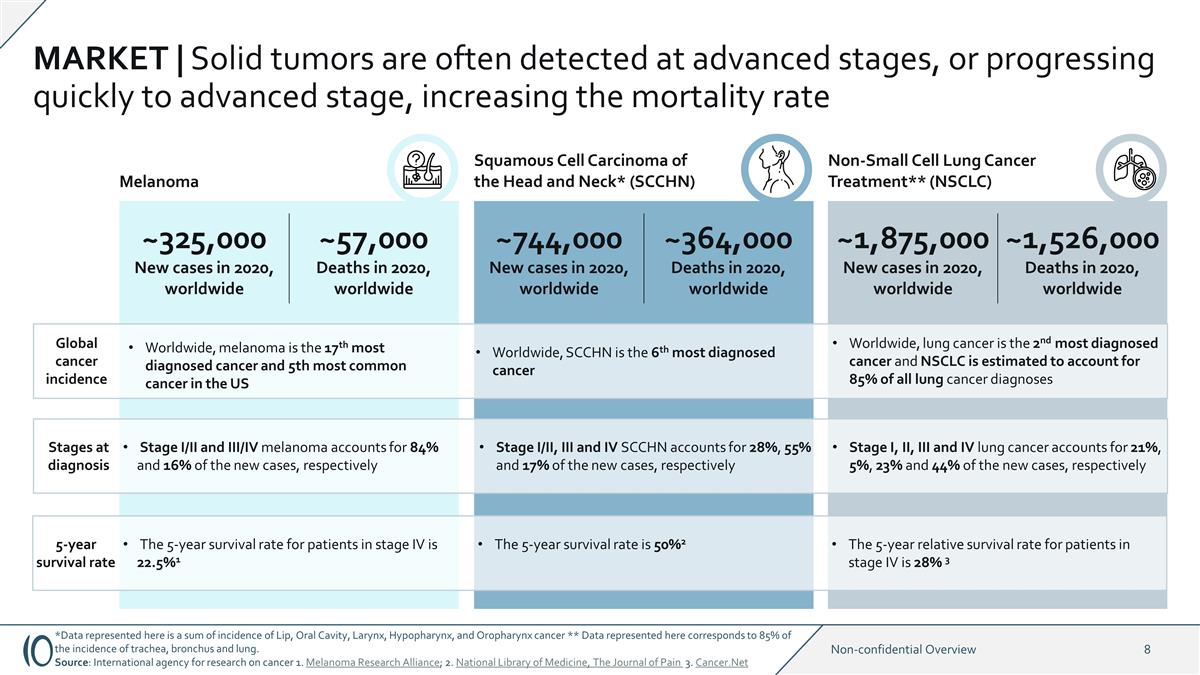
市場 | 實體瘤通常在晚期檢測到 ,或迅速發展到晚期,使死亡率增加約32.5萬例新發病例,2020年全球約57,000例死亡,2020年全球約74.4萬例新發病例,2020年全球約36.4萬例死亡,全球 黑色素瘤非小細胞肺癌治療**(NSCLC)頭頸部鱗狀細胞癌*(SCCH* N) 2020 年新增約 1,875,000 例新發病例,2020 年全球約 1,526,000 例死亡,全球癌症發病率在全球範圍內,肺癌是診斷率第二高的癌症,NSCLC 是估計佔所有肺癌診斷的85% 5年存活率IV期患者的5年存活率為22.5% 1 5年存活率為50% 2 IV期患者 的5年相對存活率為28% 3個診斷階段的I/III和III/IV階段黑色素瘤分別佔新發病例的84%和16%,SCCHN佔28%,新發病例的55%和17%,分別是I、II、III和IV期肺癌 分別佔新發病例的21%、5%、23%和44%,在全球範圍內,SCCHN是6個黑色素瘤是全球診斷最多的癌症,是美國第17大最常見的癌症和第5大最常見的癌症。*此處顯示的數據是脣癌、口腔癌、喉癌、下嚥癌和口咽癌發病率的總和 ** 此處顯示的數據對應氣管、支氣管和肺部發病率的85%。資料來源:國際癌症研究機構 1.黑色素瘤研究聯盟; 2.國家醫學圖書館,《疼痛雜誌》3.Cancer.net
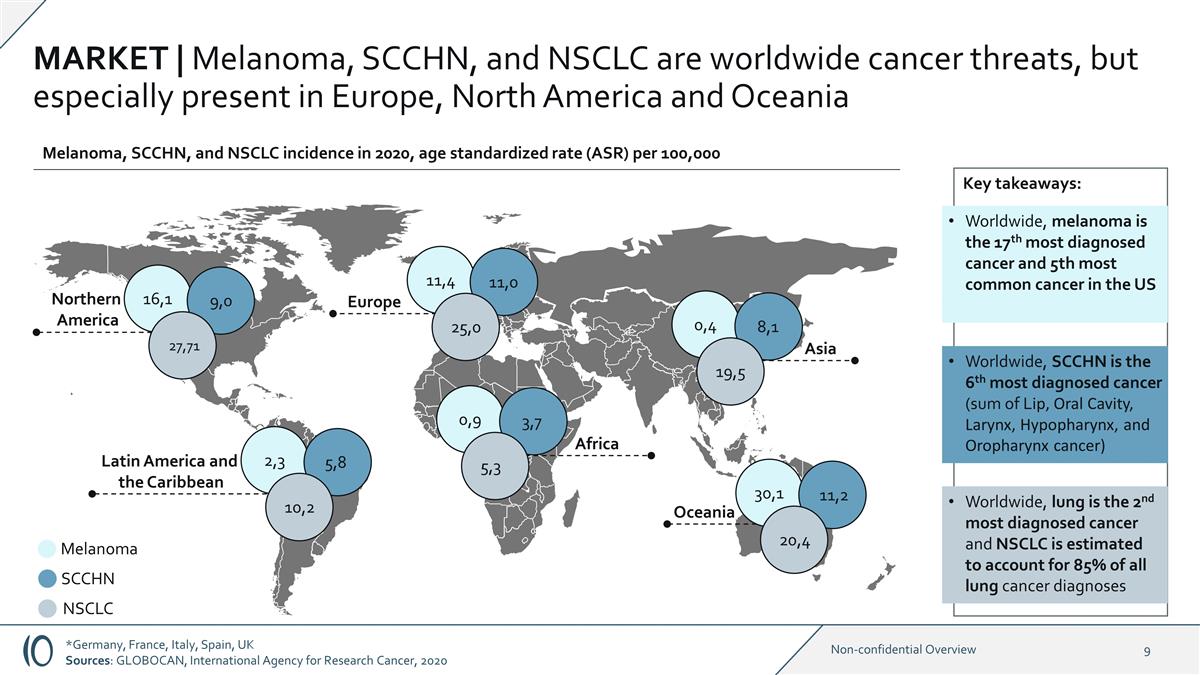
市場 | 黑色素瘤、SCCHN 和 NSCLC 是全球性的癌症威脅,但尤其存在於歐洲、北美和大洋洲 16,1 北美大洋洲歐洲 9,0 黑色素瘤 SCCHN NSCLC 27,71 11,0 25,0 30,1 11,2 20,4 亞洲 0,4 8,1 19,5 黑色素瘤、SCCHN 和 NSCLC 發病率 2020,每 100,000 人的年齡標準化率 (ASR) 關鍵要點:在全球範圍內,黑色素瘤是美國全球診斷率第 17 位的癌症和第 5 位最常見的癌症,SCCHN 是診斷率排名第 6 的癌症(脣癌、口腔癌、喉癌、下嚥癌、 和口咽癌之和)在全球範圍內,肺是診斷率第二高的癌症,據估計,非小細胞肺癌佔所有肺癌診斷的85% 拉丁美洲和加勒比地區 2,3 5,8 10,2 非洲 0,9 3,7 5,3 *德國、法國、意大利、西班牙、英國 來源:GLOBOCAN,國際癌症研究機構,2020

患者和市場視角 1 我們獨特的價值主張 2 我們的產品線及其背後的科學 3 增長戰略和展望 4 IO生物技術團隊 5 內容
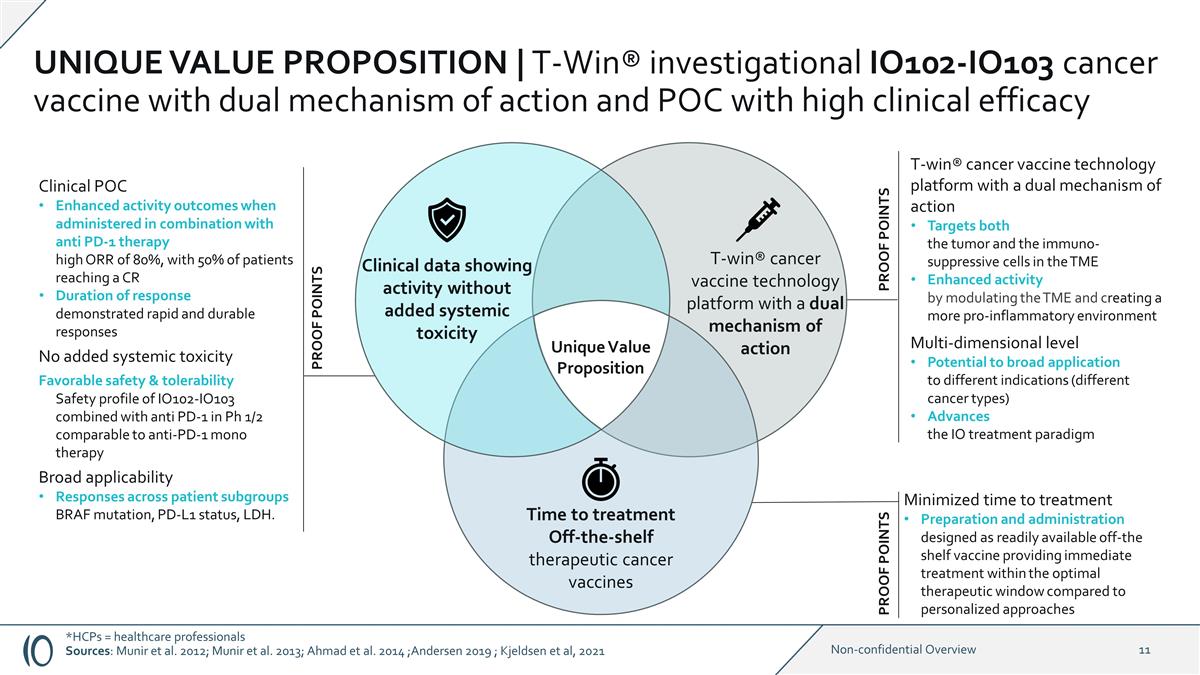
臨牀 POC 與抗 PD-1 療法聯合使用時活性增強 結果高達 80%,50% 的患者達到 CR 反應持續時間表現出快速而持久的反應沒有增加全身毒性良好的安全性和耐受性 IO102-IO103 在 pH 1/2 中聯合抗PD-1的安全特徵與抗 PD-1 單一療法相似的廣泛適用性對患者亞組的反應 BRAF 突變、PD-L1 狀態、LDH。最大限度地縮短了治療時間準備和 給藥設計為現成疫苗,與個性化方法相比,可在最佳治療窗口內立即進行治療具有雙重作用機制的 T-win® 癌症疫苗技術平臺 同時靶向 TME 中的腫瘤和免疫抑制細胞通過調節 TME 和創造更具促炎性的環境增強活性多維水平廣泛應用於不同適應症(不同 癌症)類型)進度IO 治療模式臨牀數據顯示活性不增加全身毒性 T-win® 癌症疫苗技術平臺具有雙重作用機制治療時間現成治療性癌症 疫苗獨特的價值主張證明點證明點 *HCPs = 醫療保健專業人員來源:穆尼爾等人。2012 年;穆尼爾等人。2013 年;安徒生 2019 年;Kjeldsen 等人,2021 年獨特的價值主張 | T-Win® 正在研究的 IO102-IO103 癌症疫苗具有雙重作用機制和具有高度臨牀意義的 POC功效

獨特的價值主張 | 來自市場研究的初步醫生反饋凸顯了 IO Biotech 疫苗 IO102-IO103 的潛力 MoS 是提供的最令人印象深刻的數據 —— 法國 KOL(如果)ORR 優於 ipi + nivo,該產品將成為新的護理標準 — 美國 KOL 無論是 BRAF 或 PD-L1 狀態如何,我都可能會將其用於所有患者 — 美國 KOL 很高興能提供更多幫助患者看看從長遠來看會有什麼好處- KOL 鼓勵AE和AE之間沒有權衡利弊功效-KOL 它可以廣泛擴展到更大的患者羣體,並具有出色的療效-KOL 來源:醫師市場研究,2023 年第四季度;腦外科和 IO 生物技術(2023 年); 對 Ph1/2 數據和目標產品概況的反應
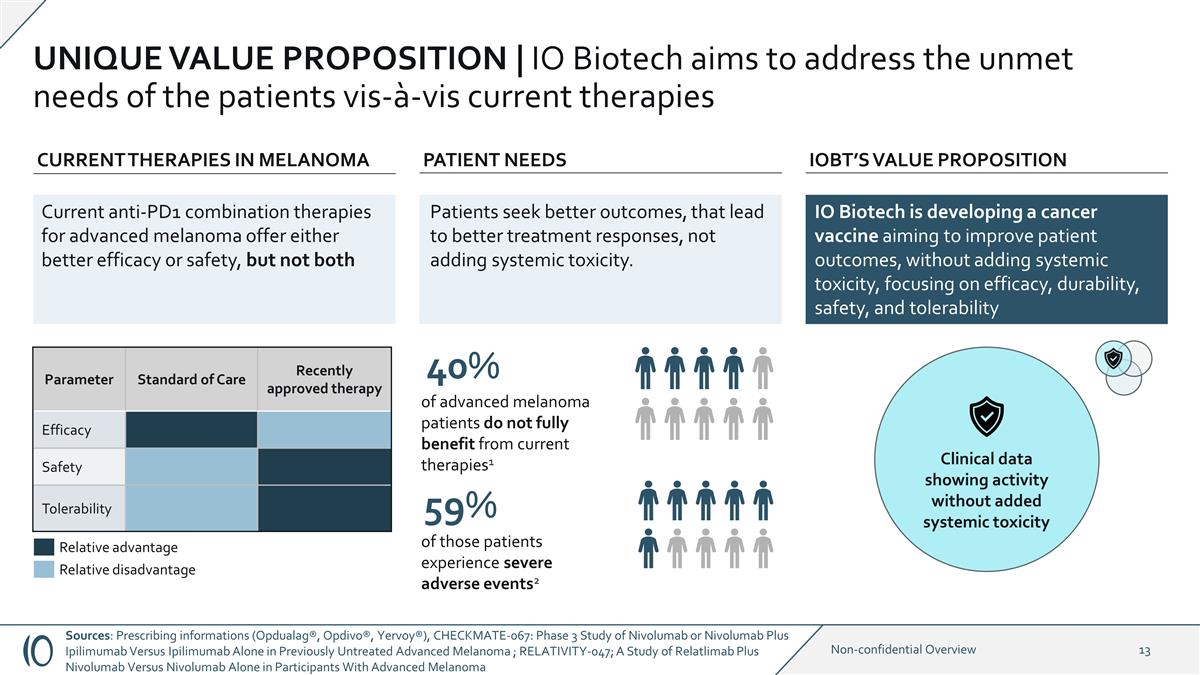
IO Biotech正在開發一種癌症 疫苗,目的是在不增加全身毒性的情況下改善患者的預後,重點關注療效、耐久性、安全性和耐受性獨特的價值主張 | IO Biotech旨在解決患者相對於當前 療法未滿足的需求參數護理標準最近批准的療法療效安全性耐受性黑色素瘤的當前療法 IOBT 的價值主張縮寫:這些患者中有59%出現嚴重不良事件 2 40% 的晚期 黑色素瘤患者無法完全受益當前療法1 臨牀數據顯示活性不增加全身毒性當前針對晚期黑色素瘤的抗 PD1 聯合療法具有更好的療效或安全性,但並非兩者都需要 1/10 2/10 3/10 5/10 6/10 7/10 7/10 8/10 9/10 9/10 10/10 10/10 2/10 3/10 7/10 7/10 8/10 9/10 10/10 相對劣勢相對優勢患者尋求更好的治療反應,而不是增加全身毒性。來源: 處方信息(Opdualag®、Opdivo®、Yervoy®),CHECKMATE-067:Nivolumab 或 Nivolumab Plus Ipilimumab 對比單獨使用伊匹木單抗對比單獨治療的晚期黑色素瘤的三期研究;RELATIVITY-047;對晚期黑色素瘤參與者的 Relatlimab Plus Nivolumab 對比單獨使用 Nivolumab 的研究

患者和市場視角 1 我們獨特的價值主張 2 我們的產品線及其背後的科學 3 增長戰略和展望 4 IO生物技術團隊 5 內容
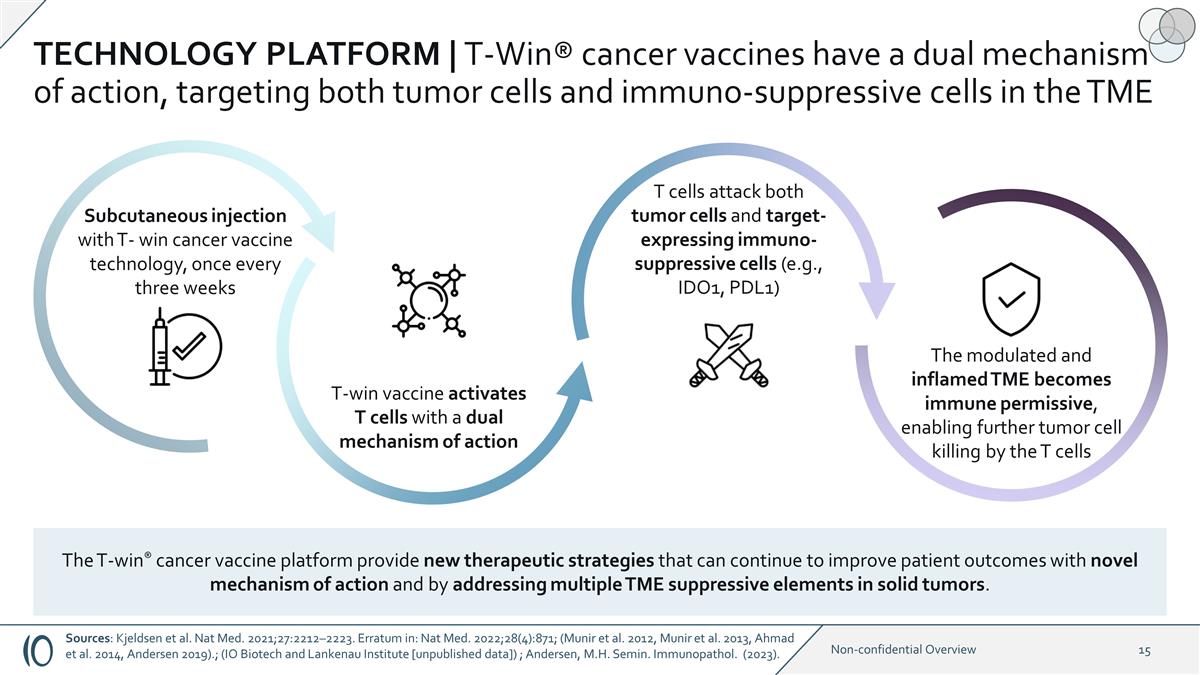
技術平臺 | T-Win® 癌症疫苗具有雙重作用機制,靶向 TME 中的腫瘤細胞和免疫抑制細胞 T 細胞同時攻擊腫瘤細胞和靶向表達免疫抑制細胞(例如 IDO1、PDL1)。調製和發炎的 TME 成為允許免疫的,允許T細胞進一步殺死腫瘤細胞 T-win 疫苗使用雙重激活T細胞作用機制 T-win 癌症疫苗技術皮下注射,每三週一次 T-win® cancer 疫苗平臺提供新的治療方法這些策略可以通過新的作用機制和解決實體瘤中的多種TME抑制因素來繼續改善患者預後。資料來源:Kjeldsen等人。Nat 2021 年中學;27:2212 —2223。勘誤表:Nat Med. 2022;28 (4): 871;(穆尼爾等人,2012 年,穆尼爾等人,2013 年,艾哈邁德等人,2014 年,安德森 2019)。(IO 生物技術和蘭克瑙研究所)。 [未發佈的數據]); 安徒生,M.H. Semin。免疫療法。(2023)。
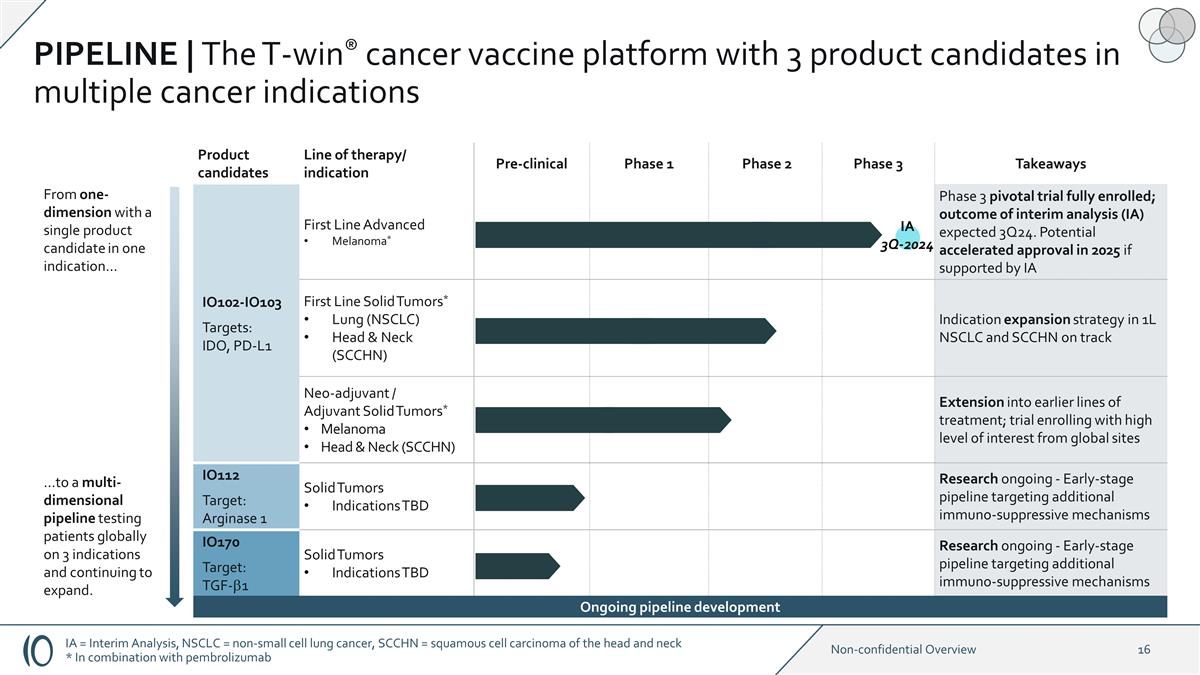
IA 3Q-2024 候選產品系列 療法/適應症臨牀前 1 期 2 期 3 期要點 IO102-IO103 目標:IDO、PD-L1 一線晚期黑色素瘤* 3 期關鍵試驗已全部入組;中期分析 (IA) 的結果預計在 24 年第 3 季度。如果 IA IO102—IO103 一線實體瘤*肺部 (NSCLC) 頭頸部 (SCCHN) 1L NSCLC 和 SCCHN 的適應症擴展策略有望在 2025 年加快批准速度* 頭部和 頸部黑色素瘤 (SCCHN) 擴展到早期治療系列;備受關注的試驗來自全球站點 IO112 目標:精氨酸酶 1 實體瘤適應症待定研究正在進行中-針對其他 免疫抑制機制的早期產品線 IO170 靶標:TGF-b1 實體瘤適應症待定研究正在進行——針對其他免疫抑制機制的早期產品線從單一適應症中使用單一候選產品的一維度... ... 到針對3種適應症在全球範圍內對患者進行測試並持續擴大的多維管線。正在進行的研發管道 | T-win® 癌症疫苗平臺在多種癌症適應症中有3種候選產品 IA = 中期分析,NSCLC = 非小細胞肺癌,SCCHN = 頭頸部鱗狀細胞癌 * 與pembrolizumab聯合使用

臨牀試驗 | IO102-IO103 的所有 臨牀數據令人鼓舞,黑色素瘤 (MM1636) 的 Ph1/2,結果令人鼓舞,推動了一線晚期黑色素瘤 (IOB-013/KN-D18) 的持續臨牀開發。實體瘤籃子 (IOB-022/KN-D38) 的 pH2 持續 pH2,初步療效數據令人鼓舞;未觀察到新的安全信號 1/2 期轉移性黑色素瘤結果 (MM1636):80% ORR*,50% CR 狀態:目前處於第 3 階段,有 380 名患者第一線非小細胞肺癌 2 期結果 ORR 56% > 基準 ORR 39% ** 狀態令人鼓舞的初步數據(n=18)在ESMO 2023 FIRST LINE SCCHN上公佈的第二階段結果 ORR 3/6 > 基準 ORR 23% **狀態令人鼓舞的初步數據在ESMO 2023年上公佈的令人鼓舞的初步數據從一維度,在一個適應症中包含 單一產品候選藥物的單維度... 到對全球患者進行3種適應症的多維度測試,並持續擴展。*24 名出現反應的患者中有兩名在隨後的放射學 確認之前取得了進展(如先前在《自然醫學》RECIST1.1= 73.3% ORR 中所報道的那樣)**KEYNOTE-042(1L NSCLC PD-L1 ≥ 50%):ORR 39%;KEYNOTE-048(在 1L SCCHN CPS 中單獨使用 pembro ≥ 20%):ORR 23%
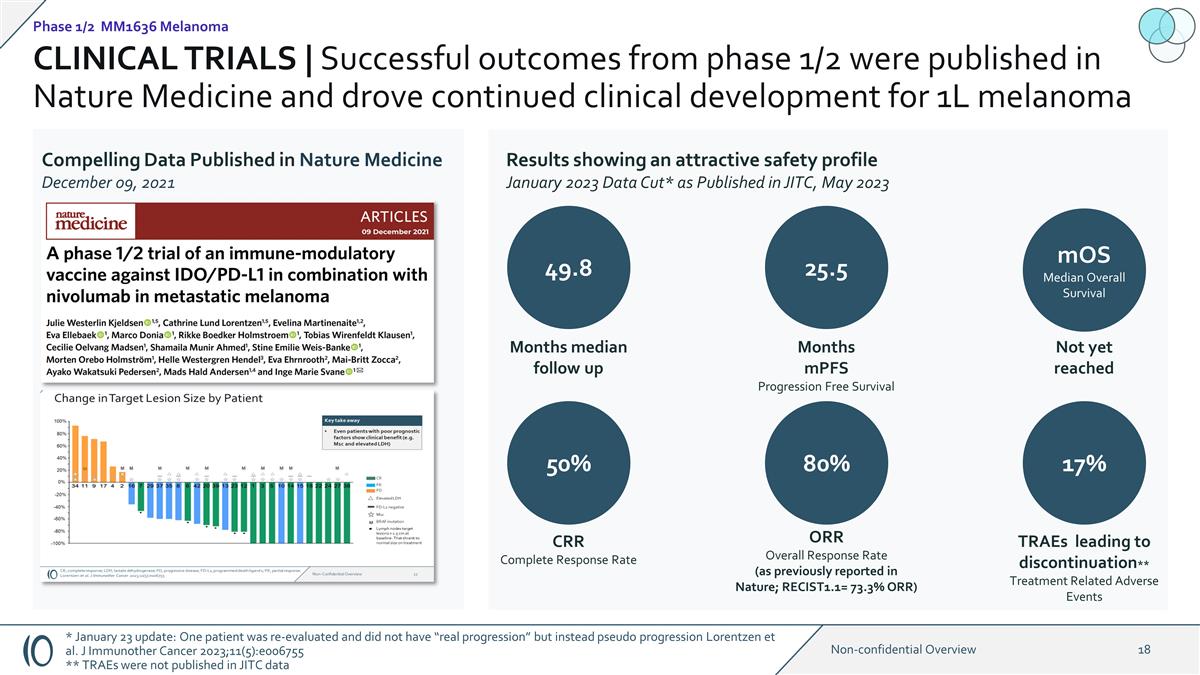
臨牀試驗 | 1/2 期成功的 結果發表在《自然醫學》雜誌上,推動了 1L 黑色素瘤的持續臨牀開發 2021 年 12 月 9 日發表在《自然醫學》上的令人信服的數據 2023 年 1 月 發佈於 JITC 的數據截圖* 49.8 個月隨訪中位數 25.5 MoS 總體存活率尚未達到 50% 80% 17% CRR 完全緩解率 ORR 總體緩解率 ORR 總緩解率(如先前在《自然》雜誌上報道)RECIST1.1= 73.3% ORR) TRAE 導致 停藥**治療相關不良事件月份 mpfs 無進展生存期 1/2 期 MM1636 黑色素瘤 * 1 月 23 日更新:一名患者接受了重新評估,並沒有 “實際進展”,而是假進展 Lorentzen 等人J Immunother Cancer 2023; 11 (5): e006755 ** TRAE 未在 JITC 數據中公佈
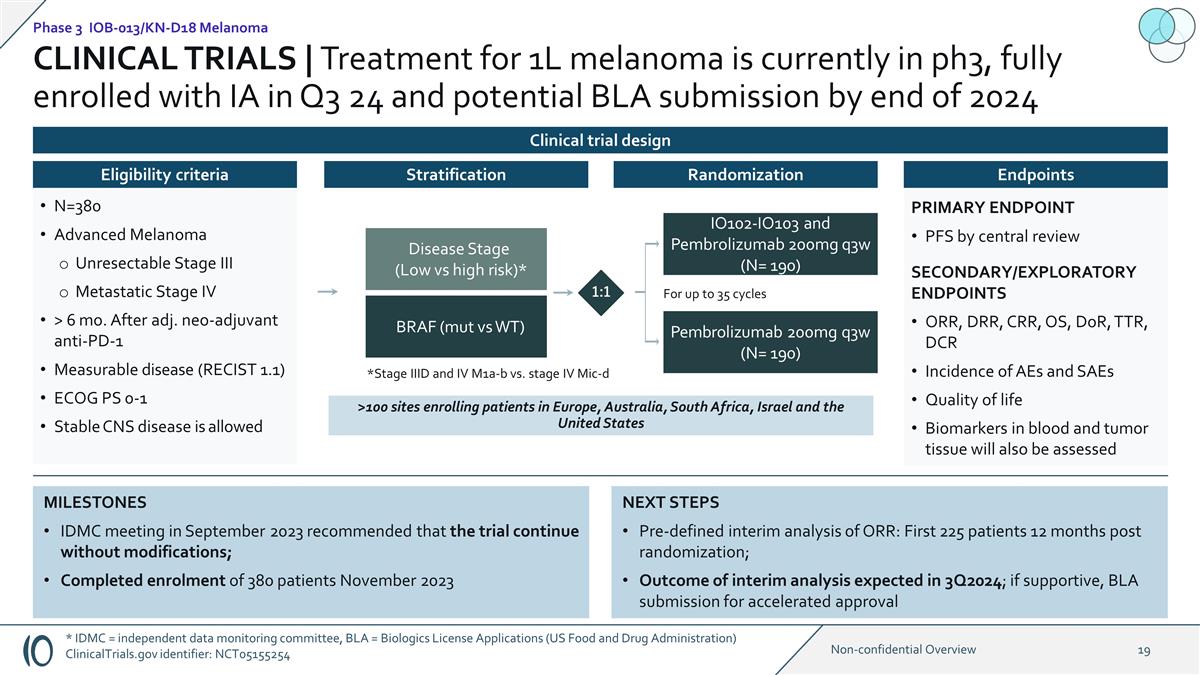
後續步驟預先定義的 ORR 中期 分析:隨機分組 12 個月後的前 225 名患者;3Q2024 預計中期分析結果;如果支持,BLA 於 2023 年 9 月提交加速批准里程碑 IDMC 會議建議在不進行修改的情況下繼續試驗 ;2023 年 11 月完成了 380 名患者的入組 >100 個研究中心按中心審查二級/探索性終點在歐洲、澳大利亞、南非、以色列和美國註冊患者的主要終點 PFS ORR、 DRR、CRR、OS、DoR、TTR、DCR 發生率血液和腫瘤組織中的生命質量生物標誌物還將評估疾病階段(低風險與高風險)* BRAF(mut vs WT)IO102-IO103 和 Pembrolizumab 200mg q3w(N= 190)Pembrolizumab 200mg q3w(N= 190)最多 35 個週期 1:1 *III 期和 IV 期 m1a-b 與 IV 期 mic-D 分層終點隨機分層 N=380 晚期黑色素瘤不可切除的 III 期轉移期 IV 期 > 6 mo。調整後。新輔助抗PD-1可衡量 疾病(RECIST 1.1)允許使用 ECOG PS 0-1 穩定的中樞神經系統疾病資格標準臨牀試驗 | 1L 黑色素瘤的治療目前處於第 3 階段,24 年第三季度已完全入組 IA,並可能在 2024 年底前提交 BLA 第 3 階段 IOB-013/KN-D18 黑色素瘤臨牀試驗設計 * IDMC = 獨立數據監測委員會,BLA,2024 年底前可能提交 BLA 第 3 階段 IOB-013/KN-D18 黑色素瘤臨牀試驗設計 * IDMC = 獨立數據監測委員會,BLA = 生物製劑許可證申請(美國食品藥品監督管理局)ClinicalTrials.gov 標識符:NCT05155254
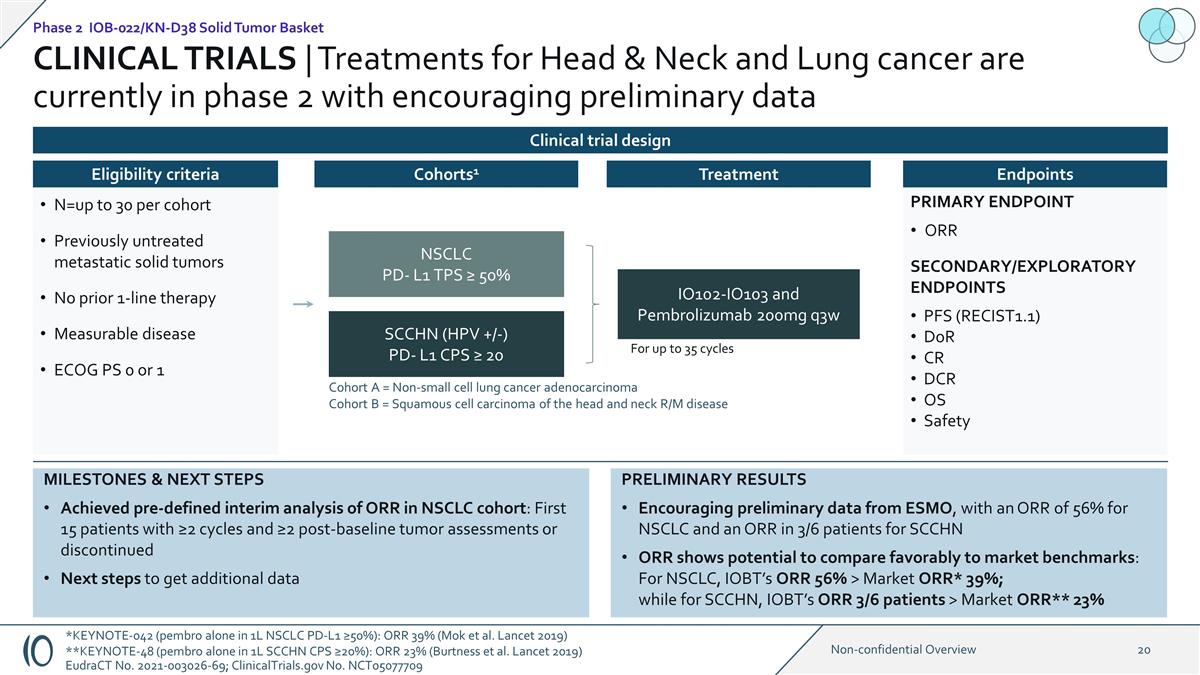
主要終點 ORR 次要/探索性終點 PFS (RECIST1.1) DoR CR DCR OS 安全性臨牀試驗 | 頭頸部和肺癌的治療目前處於第 2 階段,初步數據令人鼓舞 1:1 IO102-IO103 和 Pembrolizumab 200mg q3w NSCLC PD-L1 TPS ≥ 50% SCCHN (HPV +/-) PD-L1 CPS ≥ 20 隊列 A = 非小細胞肺癌腺癌隊列 B = 頭頸部鱗狀細胞癌 R/M 疾病長達 35 個週期 n=每個隊列最多 30 個先前未經治療的轉移性 實體瘤此前未經治療的轉移性 實體瘤此前沒有單線療法可衡量的疾病 ECOGPS 0 或 1 資格標準 Cohorts1 治療終點初步結果來自ESMO的初步數據令人鼓舞,非小細胞肺癌的ORR為56%,SCCHN ORR的3/6名患者顯示有可能與市場基準相提並論:對於非小細胞肺癌,IOBT的ORR 56%>市場ORR* 39%;而對於SCCHN,IOBT的ORR 3/6患者>市場ORR** 23% 里程碑和後續步驟對非小細胞肺癌隊列中的ORR進行了預定義的中期 分析:前15名週期≥2個且超過2次基線後腫瘤評估的患者或已停止的下一步獲取更多數據第 2 階段 IOB-022/KN-D38 實體瘤籃臨牀試驗設計 *KEYNOTE-042(pembro 單獨用於 1L NSCLC PD-L1 ≥ 50%):ORR 39%(Mok 等人Lancet 2019)**KEYNOTE-48(在 1L SCCHN CPS 中單獨使用 pembro ≥ 20%):ORR 23%(Burtness 等人《柳葉刀》(2019)歐盟法案第 2021-003026-69 號;ClinicalTrials.gov No.NCT05077709
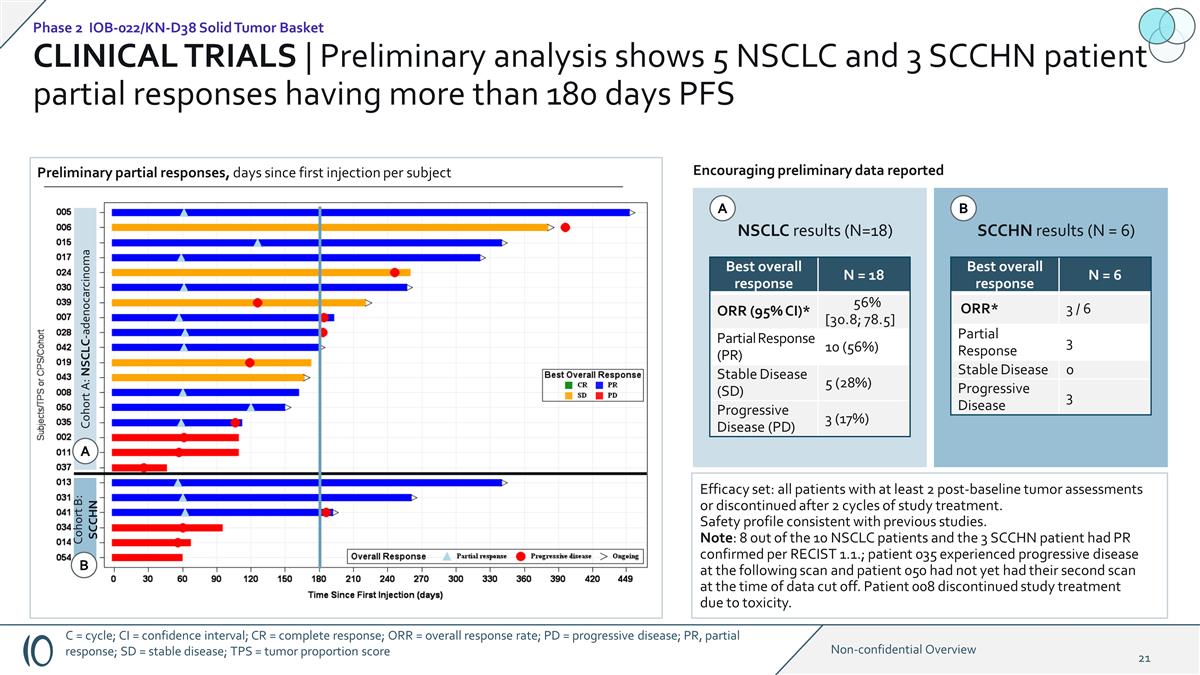
臨牀試驗 | 初步 分析顯示 5 名非小細胞肺癌和 3 名 SCCHN 患者部分反應超過 180 天 PFS 隊列 A:NSCLC-腺癌隊列 B:SCCHN NSCLC 結果(N=18)SCCHN 結果(N = 6)令人鼓舞的初步數據報告了最佳總體反應 N = 18 ORR(95% 置信區間)* 56% [30.8; 78.5]部分反應(PR)10(56%)穩定疾病(SD)5(28%)進行性疾病(PD)3(17%)療效組合:所有接受過至少2次基線後腫瘤評估或在兩個研究週期後停止治療的患者。 安全概況與先前的研究一致。注意:根據RECIST 1.1,10名非小細胞肺癌患者中有8名和3名SCCHN患者已確認PR;035名患者在接下來的掃描中出現進展性疾病,而050名患者在數據截斷時尚未進行第二次掃描。由於毒性,008號患者停止了研究治療。最佳總體反應 N = 6 ORR* 3/6 部分反應 3 穩定疾病 0 進展性疾病 3 初步部分反應,自每個受試者首次注射 後的天數 A A B B 第 2 期 IOB-022/KN-D38 實體瘤籃子 C = 週期;CI = 置信區間;CR = 完全反應;PD = 進展性疾病;PR,部分反應;SD = 穩定疾病;TPS = 腫瘤 比例分數
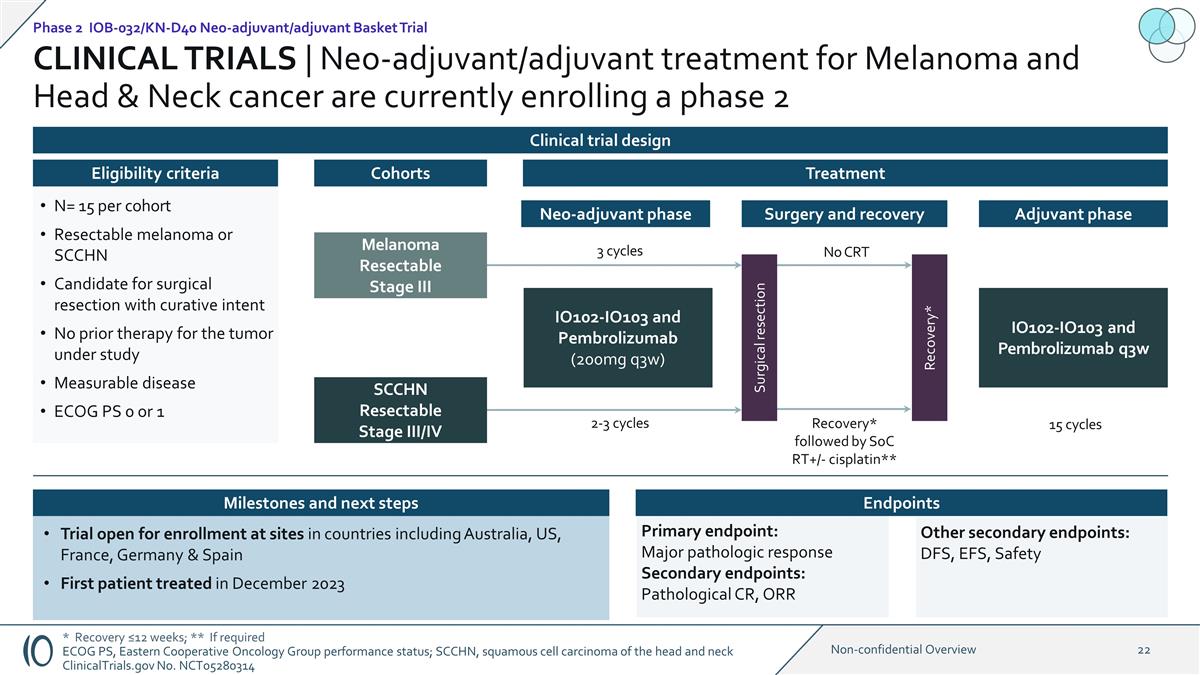
臨牀試驗 | 黑色素瘤和頭頸癌的新輔助/輔助治療目前正在註冊第二期 1:1 IO102-IO103 和 Pembrolizumab(200mg q3w)黑色素瘤可切除三期 SCCHN 可切除三期 SCCHN 可切除三期 N= 15 個可切除黑色素瘤 或 SCCHN 候選療法意圖之前沒有對研究中的腫瘤進行任何治療可衡量的疾病 ECOG PS 0 或 1 資格標準隊列治療試驗在 澳大利亞、美國、法國、德國和西班牙等國家的研究中心開放招募首位患者接受治療2023 年 12 月 2 期 IOB-032/KN-D40 新輔助/輔助籃子試驗臨牀試驗設計新輔助階段 2-3 週期手術切除手術和康復 康復* IO102-IO103 和 Pembrolizumab q3w 15 個週期輔助第 3 期週期 * 恢復 ≤12 周;** 如果需要 ECOG PS,東部合作腫瘤學小組的表現狀態;SCCHN,鱗狀頭部和頸部細胞癌 ClinicalTrials.gov No.NCT05280314 恢復* 其次是 SoC RT+/-cisplatin** 無 CRT 主要終點:主要病理反應次要終點:病理 CR、ORR 其他次要終點:DFS、EFS、安全里程碑和後續步驟 終點
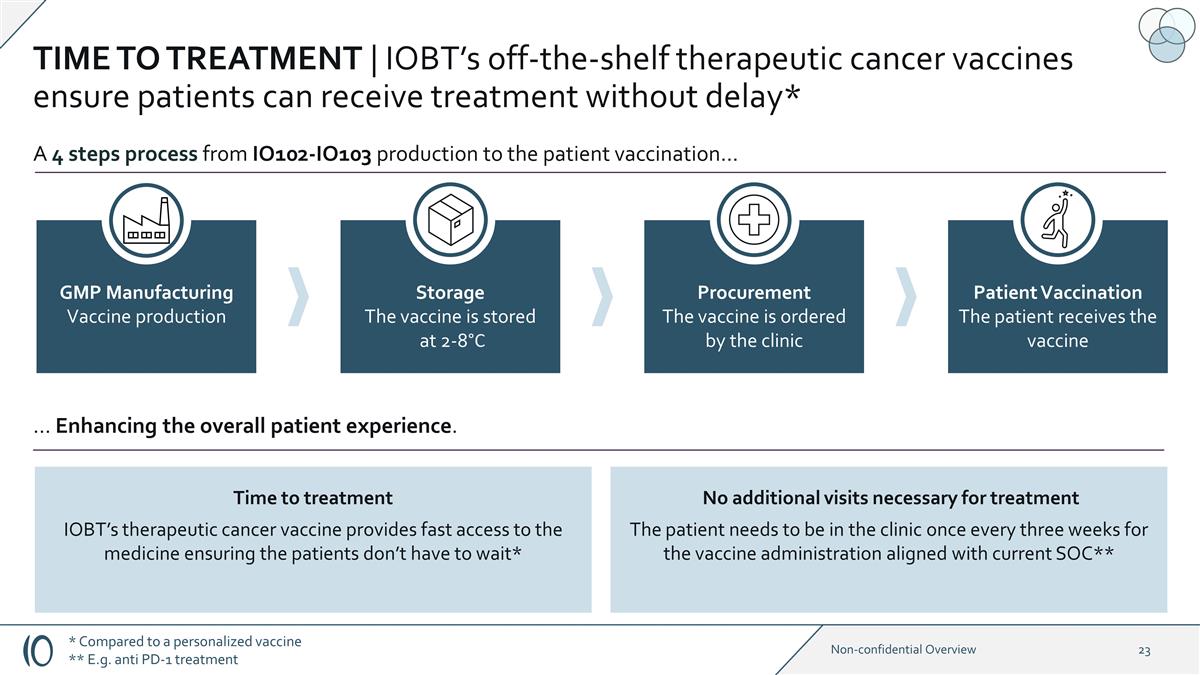
治療時間 | IOBT 現成的治療性癌症疫苗確保患者能夠毫不拖延地接受治療* GMP 製造疫苗生產存儲疫苗儲存在 2-8°C 採購疫苗由診所訂購患者疫苗接種 患者接種疫苗 A 從 IO102-IO103 生產到患者疫苗接種的四個步驟... 治療時間 IOBT 的治療性癌症疫苗可快速獲得藥物,確保患者不必這樣做 等等*... 增強整體患者體驗。無需額外就診治療患者需要每三週就診一次,以便疫苗接種符合當前 SOC** * 與個性化 疫苗相比 ** 例如抗 PD-1 治療
患者和市場視角 1 我們獨特的價值主張 2 我們的產品線及其背後的科學 3 增長戰略和展望 4 IO生物技術團隊 5 內容
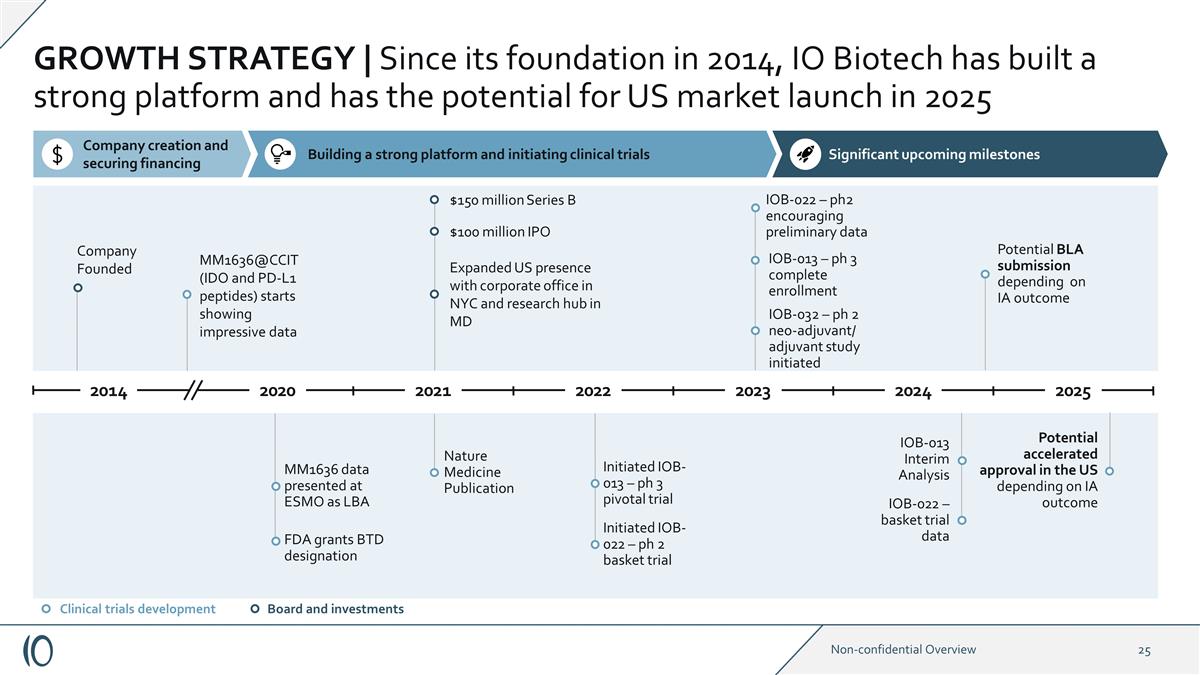
IOB-022 — 一攬子試驗數據 增長戰略 | 自2014年成立以來,IO Biotech已經建立了一個強大的平臺,有可能在2025年在美國上市。公司創立的 MM1636 @CCIT(IDO 和 PD-L1 肽)開始顯示令人印象深刻的數據 FDA 授予 BTD 稱號 MM1636 數據作為 LBA 自然醫學出版物 1.5 億美元 B 輪融資 1 億美元首次公開募股擴大了美國的影響力,在紐約設立了公司辦公室,馬裏蘭州啟動了研究中心 IOB-022 — ph 2 籃子試驗已啟動 IOB-013 — ph 3 關鍵試驗 IOB-022 — ph2 令人鼓舞初步數據董事會和投資臨牀試驗開發 IOB-013 中期分析 IOB-013 — ph 3 完成註冊根據 IA 的結果可能提交 BLA 提交 美國的批准可能性加快 即將到來的重要里程碑建立強大的平臺並啟動臨牀試驗 2021 年 2020 年 2014 2023 2024 2024 IOB-032 — ph 2 新輔助/輔助研究已啟動
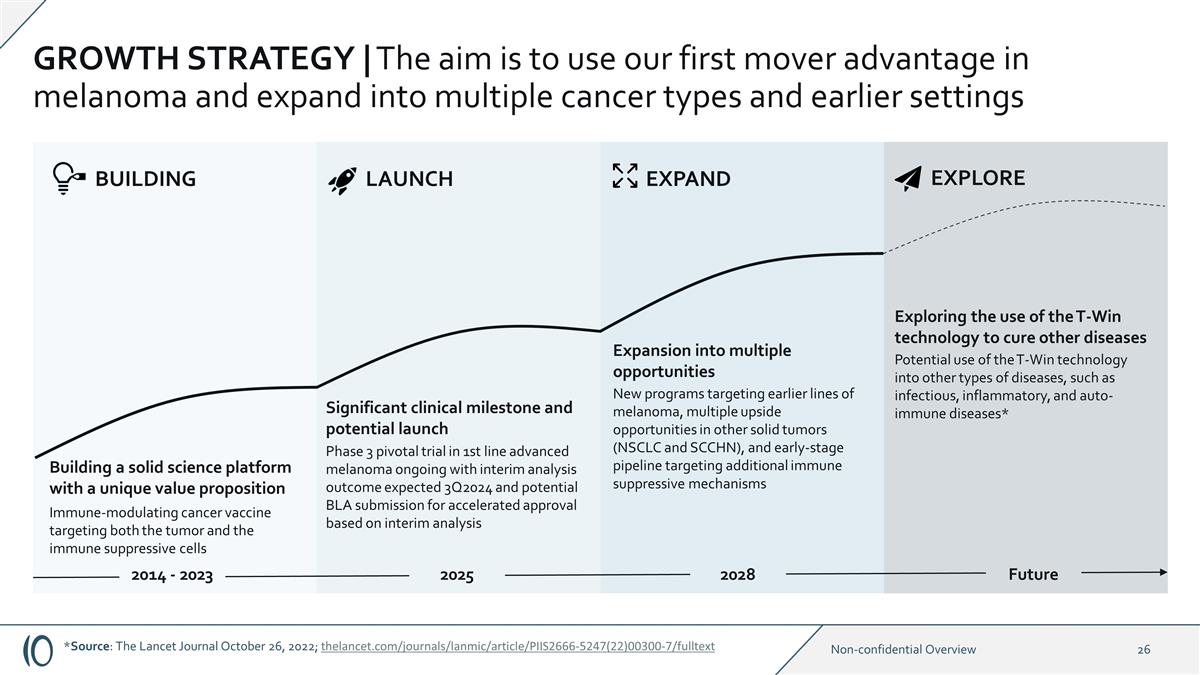
增長戰略 | 目標是利用我們在黑色素瘤領域的先發優勢,擴展到多種癌症類型和早期環境建立一個具有獨特價值主張的堅實科學平臺免疫調節癌症疫苗同時靶向腫瘤和免疫抑制性 細胞的重大臨牀里程碑和潛在的啟動一線晚期黑色素瘤的3期關鍵試驗正在進行中,中期分析結果預計 3Q2024,並可能根據中期分析提交 BLA 加速審批之前針對的新 程序黑色素瘤系、其他實體瘤(NSCLC 和 SCCHN)的多種上行機會,以及針對其他免疫抑制機制的早期產品線擴展到多種機會 2025 2028 擴展 BUILDING LAUNCH 2014-2023 年 T-Win 技術在其他類型的疾病中的潛在用途,例如傳染性、炎症和自身免疫性疾病* 探索使用 T-Win 技術治療其他疾病未來探索 *來源: 《柳葉刀日報》2022年10月26日;thelancet.com/journals/LANMIC/article/piis2666-5247 (22) 00300-7/全文

展望 | 預計未來兩年將出現重要的臨牀 里程碑,這得益於 4Q2025 項目階段適應症治療系列 IO102-IO103 目標:IDO、PD-L1 三期黑色素瘤一線晚期 IO102—IO103 Basket 試驗肺部 (NSCLC) 頭頸部 (SCCHN) 一線轉移性二期籃子試驗黑色素瘤頭頸部 (SCCHN) NEO-BR} 輔助/輔助 IO112 靶點:精氨酸酶 1 1/2 期實體瘤 IO170 靶標:TGF-b1 實體瘤到 2024 年的里程碑到 2025 年的里程碑到 2025 年的里程碑 2023 年 6 月入組 225 名患者在 2023 年年底前完成入組中期分析 (IA) 2Q2024,結果在 IA 支持下,美國可能加快批准速度 預計將在 25 年下半年達到無進展存活率的主要終點 附加數據啟動第 2 階段 2H2023 初始數據 IND 就緒 IND 申報;啟動 IST 研究臨牀前研究基於 IA 的潛在的 BLA 提交 * 截至 2023 年 9 月 30 日。

患者和市場視角 1 我們獨特的價值主張 2 我們的產品線及其背後的科學 3 增長戰略和展望 4 IO生物技術團隊 5 內容

團隊 | 我們擁有一支強大的 管理團隊,具有豐富的生物製藥和生物技術經驗 Mai-Britt Zocca,博士首席執行官卡西姆·艾哈邁德,醫學博士首席醫學官艾米·沙利文,工商管理碩士首席財務官埃裏克·福克納,工商管理碩士首席技術官德文·史密斯 總法律顧問丹·曼尼克斯博士,監管高級副總裁

董事會團隊 | 我們的 管理團隊得到董事會和科學顧問委員會的支持 Peter Hirth 博士主席 Kathleen Sereda Glaub,工商管理碩士成員 Christian Elling,博士成員 — Lundbeckfonden Hunter 成員 Jack B. Nielsen,M.Sc 成員 — Vivo Capital 大衞·史密斯,工商管理碩士 Mai-Britt Zocca Ca,博士科學顧問委員會主席兼首席執行官英格·瑪麗·斯瓦恩,醫學博士,博士創始人,臨牀顧問亞歷山大·埃傑蒙特,醫學博士,高級臨牀顧問卡皮爾·丁格拉, 醫學博士戰略研發顧問馬茲·哈爾德安德森,醫學博士,博士創始人,科學顧問海倫·柯林斯,醫學博士成員

適應症:黑色素瘤 SCCHN NSCLC 3 T-win 癌症疫苗技術平臺 1 3 管道項目 17 專利家族專注於在不增加全身毒性的情況下改善臨牀效果 50% 80% * 1/2 期 MM1636 黑色素瘤結果 25.5 個月 MPFs* 提供快速持久的 反應亮點 | 打破界限。Ignite Change。24 年第 3 季度第 3 期中期分析結果 IO102-IO103 第 3 期晚期黑色素瘤關鍵試驗已全部入組 2025 年潛在美國市場準入 ORR* CRR*