附錄 99.2

納斯達克:ABUS www.arbutusbio.com 2024 年 1 月 8 日公司介紹 © 2024 Arbutus Biopharma, Inc.

前瞻性陳述本演示文稿包含 U 所指的前瞻性陳述。S。1995 年的《私人證券訴訟改革法》和加拿大證券法。特此將所有非歷史事實的陳述確定為用於此目的的前瞻性陳述,其中包括以下方面的陳述:HBV的潛在市場機會;Arbutus滿足重大未滿足醫療需求的能力;Arbutus在預期期限內的現金和現金等價物的充足性;Arbutus臨牀開發計劃和臨牀試驗的預期成本、時間和結果,包括與第三方的臨牀合作;Arbutus 候選產品實現的潛力他們的預期或預期結果;Arbutus對Arbutus候選產品的時機和臨牀開發的期望,包括其明確的臨牀目標;HBV綜合治療的時間表;Arbutus對其授權給第三方的技術的期望;與戰略和/或許可協議相關的預期時間和付款;專利侵權訴訟;以及與Arbutus未來運營、未來財務業績、未來財務狀況、前景或其他相關的其他聲明未來的事件。關於本演示文稿中包含的前瞻性陳述,Arbutus對以下方面做出了許多假設:預期付款的及時到賬;臨牀前研究和臨牀試驗的有效性和及時性以及數據的有用性;監管部門批准的及時性;對Arbutus資產的持續需求;以及經濟和市場狀況的穩定性。儘管Arbutus認為這些假設是合理的,但這些假設本質上會受到重大的業務、經濟、競爭、市場和社會不確定性以及包括與專利訴訟事項相關的不確定性和突發事件在內的突發事件的影響。此處的前瞻性陳述涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致實際結果、事件或事態發展與此類前瞻性陳述所表達或暗示的任何未來業績、事件或發展存在重大差異。這些因素包括:預期的臨牀前和臨牀試驗可能比預期的更昂貴或需要更長的時間才能完成,可能永遠無法啟動或完成,或者可能無法產生值得未來開發測試候選藥物的結果;Arbutus關於其候選產品和臨牀開發活動的戰略發生變化;Arbutus可能無法獲得Arbutus產品臨牀開發所需的監管批准;經濟和市場狀況可能會惡化相關的不確定性;和一般是訴訟,特別是專利訴訟;市場變化可能需要改變戰略重點;雙方可能永遠無法意識到合作的預期收益。關於Arbutus面臨的風險和不確定性的更全面的討論見Arbutus的10-K表年度報告、10-Q表季度報告和Arbutus的定期披露文件,這些文件可在www.sec.gov和www.sedar.com上查閲。除非法律要求,否則Arbutus沒有義務修改或更新任何此類前瞻性陳述,也沒有義務公開宣佈對其中包含的任何前瞻性陳述進行任何修訂以反映未來的業績、事件或發展。2 © 2024 Arbutus Biopharma, Inc.

我們的價值創造戰略通過發現和開發針對慢性乙型肝炎的差異化療法管線,利用我們團隊在瞭解和治療病毒感染方面的專業知識所建立的良好成功記錄。開發一種包括抗病毒藥物和免疫藥物的組合療法,為ChbV患者提供有限療程,使功能治癒率超過20%。HBV:乙型肝炎病毒 | chbV:慢性 HB V 3 © 2024 Arbutus Biopharma, Inc.

投資亮點強勁的財務狀況具有重大未得到滿足的醫療需求和巨大的市場機會的適應症專利 LNP 技術組合內部發現的資產組合具有不同的 MOA 領先乙肝病毒化合物 — imdusiran (AB-729) 多項 2a 期聯合臨牀試驗中的 RNAi 治療具有病毒學專業知識和良好往績記錄的團隊專注於在 2026 年第一季度開發乙肝現金跑道的功能性治療方法數據顯示 imdusiran 總體上是安全且耐受性良好的已顯示出在開啟或關閉時對乙型肝炎抗原的有效抑制治療 RNAi 治療性 PD-L1 抑制劑收取 Alnylam Onpattro® 產生的許可使用費,並就針對 Moderna & Pfizer/BioNTech 的 COVID-19 疫苗銷售提起的專利訴訟尋求賠償。發現、開發和商業化多種藥物 MOA:作用機制 | PD-L1:程序性死亡-配體 1 | HbsAG:乙型肝炎表面抗原 4 © 2024 Arbutus Biopharma,Inc.
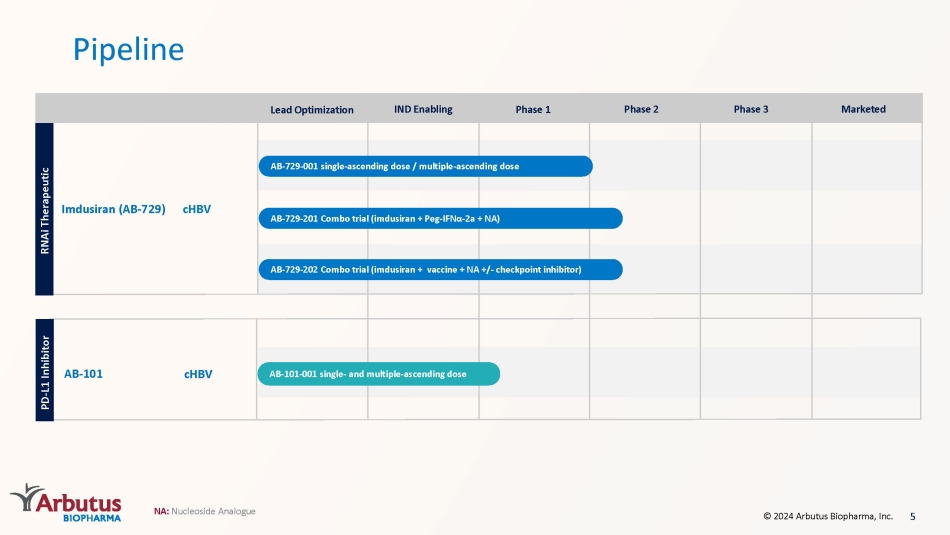
Pipeline AB-101 chbV NA:核苷類似物 5 Imdusiran(AB-729)chbV AB-729-201 組合試驗(imdusiran + Peg-IFN α-2a + NA)AB-729-202 組合試驗(imdusiran + 疫苗 + NA +/-檢查點抑制劑)AB-729-001 單劑量遞增劑量/多重上升劑量 RNaI 治療性 PD-L1 抑制劑 AB-101-001 單劑量和多次遞增劑量 © 2024 Arbutus Biopharma, Inc. 領先優化 IND 啟用第 1 階段 2 期 3 期已上市

HBV 概述由乙型肝炎病毒 (HBV) 引起的危及生命的肝感染通過體液傳播並由母嬰傳播長期慢性感染 (ChbV) 會導致更高的肝硬化和/或肝癌風險原因和症狀診斷 HbsAg 檢測確定疾病階段所需的額外生物標誌物治療 NA 療法 — 終身每日治療,旨在降低乙肝病毒DNA和/或肝硬化風險和/或HCC Peg-IF-IFN α — 每週給藥;耐受性差
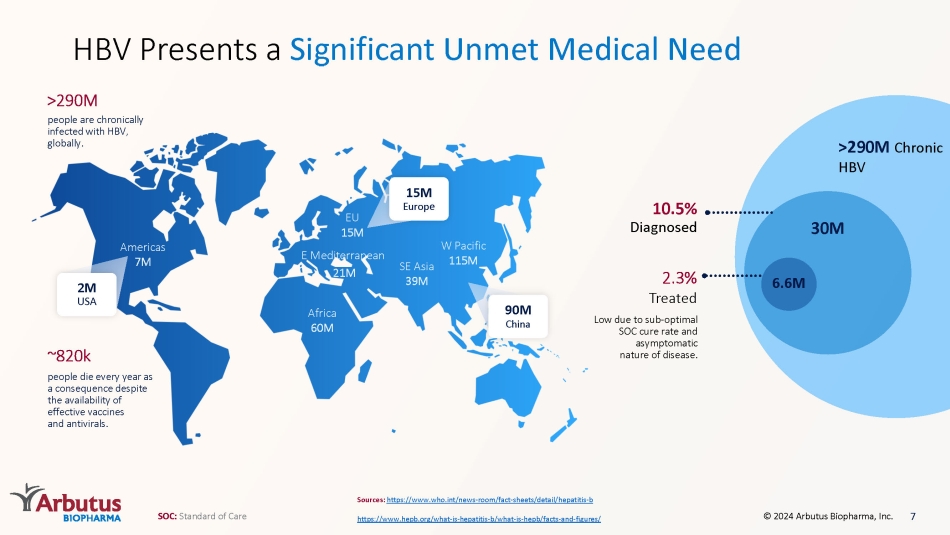
非洲6000萬東地中海2100萬東南亞3,900萬西太平洋地區1.15億歐盟1500萬美國儘管有有效的疫苗和抗病毒藥物可供使用,但每年仍有700萬至82萬人因此死亡。全球人們長期感染乙肝病毒。>2.9億>2.9億慢性乙型肝炎來源:https://www.who.int/news-房間/事實-表單/詳情/肝炎-b https://www.hepb.org/what-是-肝炎-b/什麼-heps-heps-heps-heps-heptiss-b/什麼-heps b/事實——和——數字/ HBV呈現出大量未得到滿足的醫療需求,3000萬660萬 2.3% 的治療量較低,這是由於SOC治癒率不佳和疾病的無症狀性質。10.5% 確診200萬美國1,500萬歐洲和9000萬中國 7 SOC:護理標準 © 2024 Arbutus Biopharma, Inc.

抑制減少增強病毒 DNA 和 ccDNA 池病毒抗原——HbsAg 宿主免疫系統導致 HBV Cure 3 — 成功治療的雙管齊下的方法治療成功需要將藥物與互補的 MOA 結合使用。抑制 HBV DNA 減少病毒抗原增強宿主免疫反應 8 NA RNaI RNaI RNaI PD-L1 抑制劑幹擾素治療疫苗 © 2024 Arbutus Biopharma, Inc.

9 RNaI 治療 © 2024 Arbutus Biopharma, Inc.

專有的 GalNAC-偶聯遞送技術提供肝臟靶向治療並支持皮下給藥針對所有 HBV 轉錄本的單觸發 RNAi 藥物抑制 HBV 複製並降低所有 HBV 抗原 Pan——跨乙肝基因型的基因型活性表現出與其他藥物互補性積極靶向肝臟活性對抗 cccDNA 衍生和整合的 HbSaG 轉錄本長期臨牀前安全性研究中的乾淨概況 RNAi 治療 ImbsAg 轉錄本 dusiran galNac n Linker 聚合酶、Core Ag、eAG、pgRNA saG saG HbX 10 © 2024 Arbutus Biopharma,公司
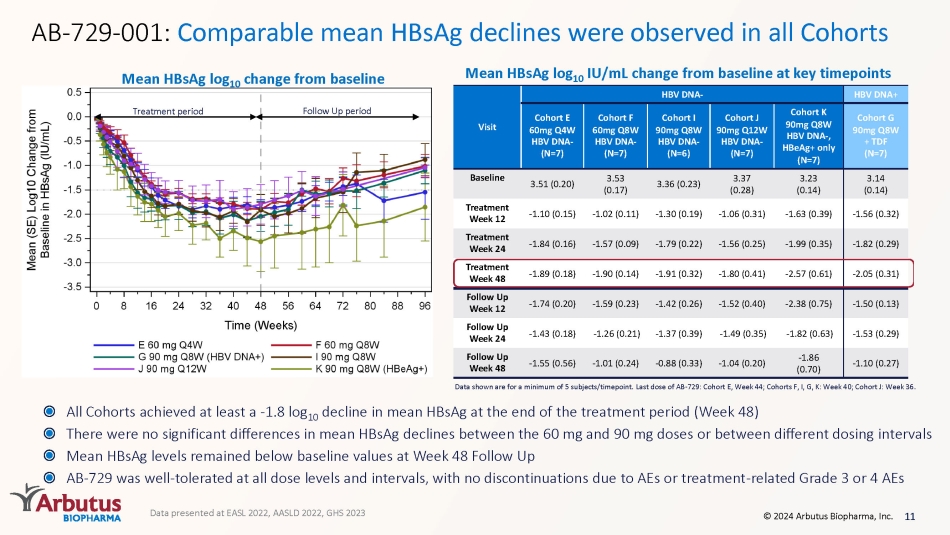
11 © 2024 Arbutus Biopharma, Inc. AB-729-001:在所有隊列中觀察到相似的平均乙肝表面抗原下降幅度在治療期結束時(第48周),所有隊列的平均HbsAg下降幅度均為-1.8 log 10。60 mg和90 mg劑量之間或不同劑量之間的平均HbsAg下降幅度沒有顯著差異在第48周隨訪中,bsAG水平仍低於基準值,AB-729在所有劑量水平和間隔下均具有良好的耐受性,沒有因不良反應或與治療相關的3級或4級不良反應而中斷顯示的數據是針對至少 5 個主題/時間點的數據。AB-729的最後一劑量:隊列 E,第 44 周;隊列 F、I、G、K:第 40 周;隊列 J:第 36 周。HbsAg log 10 與基線相比變化平均值 HbsAg log 10 IU/mL 在關鍵時間點與基線相比變化治療週期隨訪週期數據顯示為平均值 (SE) 日誌 10 IU/mL;最少 5 個受試者/時間點。最後一次 AB-729 劑量隊列 E:第 44 周,隊列 F、I、G、K:第 40 周,隊列 J:第 36 周;HbsAg 測定 LLOQ = 0.07 IU/mL;*N=6;# N=5 訪問 HBV DNA-HBV DNA+ coHorte 60mg Q4W HBV DNA-(N=7) 隊列 F 60mg Q8W BV DNA-(N=7) 隊列 I 90mg Q8W HBV DNA-(N=6) 隊列 J 90mg Q12W HBV DNA-(N=7) 隊列 K 90mg Q8W HBV DNA-,僅限 HBeag+ (N=7) cohortG 90mg Q8W + TDF (N=7) 基線 3.51 (0.20) 3.53 (0.17) 3.36 (0.23) 3.37 (0.28) 3.23 (0.14) 3.14 (0.14) 治療周 12 -1.10 (0.15) -1.02 (0.11) -1.30 (0.19) -1.06 (0.31) -1.63 (0.39) -1.56 (0.32) 治療周 24 -1.84 (0.16) -1。57 (0.09) -1.79 (0.22) -1.56 (0.25) -1.99 (0.35) -1.82 (0.29) 治療周 48 -1.89 (0.18) -1.90 (0.14) -1.91 (0.32) -1.80 (0.41) -2.57 (0.61) -2.05 (0.31) 隨訪周 12 -1.74 (0.20) -1.59 (0.23)) -1.42 (0.26) -1.52 (0.40) -2.38 (0.75) -1.50 (0.13) 隨訪周 24 -1.43 (0.18) -1.26 (0.21) -1.37 (0.39) -1.49 (0.35) -1.82 (0.63) -1.53 (0.29) 隨訪周 48 -1.55 (0.56) -1.01 (0.24) -1.01 (0.24) (0.33) -1.04 (0.20) -1.86 (0.70) -1.10 (0.27) 在 EASL 2022、AASLD 2022、GHS 2023 上公佈的數據

AB-729-001:使用 Imdusiran 治療可重新激活某些患者的乙肝病毒特異性免疫力 12 0 4 812162024283236404448525660 0 0 1 2 3 4 5 0 40 60 H B s a g (L o g 1 0 I U/m L) 患者 43 60 mg Q4W 0 4 8 1216202428323640444852 0 0 1 2 3 4 0 10 20 30 40 50 60 H B s A g (L o g 1 0 I U/m L) 患者 48 60 mg Q8W 在迄今評估的所有 7 名患者中均觀察到乙肝病毒——特異性 T 細胞激活標誌物的兩份特異性 T 細胞活化標誌物——特異性 T 細胞幹擾素——γ反應分佈在 Wk 16-28 之間,這與 HbsAg 降低的最低點相吻合 *imdusiran 給藥完成後,在 Wk 48-60 之間,在 EASL 2022 患者上提供的數據 42* 60 mg Q4W Imdusiran HBV 增加 — 特異性 T — 細胞激活 Imdusiran 精疲力盡 T — 細胞 B a s e l i n e e o t w k 3 ^ F/U k 3 ^ F/U k 5 6 B a s e l i n e o t W k 3 ^ F/U k 5 6 B a s e l i n e O T W k 3 ^ F/U k 5 6 B a s e l i n e O T W k 3 ^ F/U W k 5 6 0 10 20 30 F r e q u e n c y (%) 患者 43 ^ 最後一次-Wk 44 B a s e l i n e E O T W k 4 0 F/U W k 5 2 B a s e e o t w k 5 2 B a s e l i n e e e e e o s e l i n e e e e e e e l i n e e e e l i k 5 2 b a s e l i n e e e e l i n e e e e l i n e 2 B a s e l i n e e e e l i n e e e e l i n e 2 B a s e l i n e e e e l i n e e e e l i n e 2 B a s e l i n e e e e e l i n e e e e e y (%) 患者 48 B a s e l i n e E EO T W k 4 4 4 F/U W k 6 0 B a s e l i n e E O T W k 4 4 4 F/U W k 6 0 0 10 20 30 F r e q u e n c y (%) 患者 42 © 2024 Arbutus Biopharma, Inc.

AB-729-001 臨牀試驗關鍵要點無論劑量、給藥間隔、HBeAg 或 DNA 狀態如何,Imdusiran 都提供了強勁且相似的 HbsAg 下降幅度停止 imdusiran 和 NA — 治療導致大多數患者的 HbsAg 和 HBV DNA 持續降低 Imdusiran 在 41 名患者完成給藥後,總體上是安全且耐受性良好的 Imdusiran 結果在某些患者的 HBV(特異性 T 細胞免疫恢復和精疲力盡的 T 細胞減少)中 13 © 2024 Arbutus Biopharma, Inc.
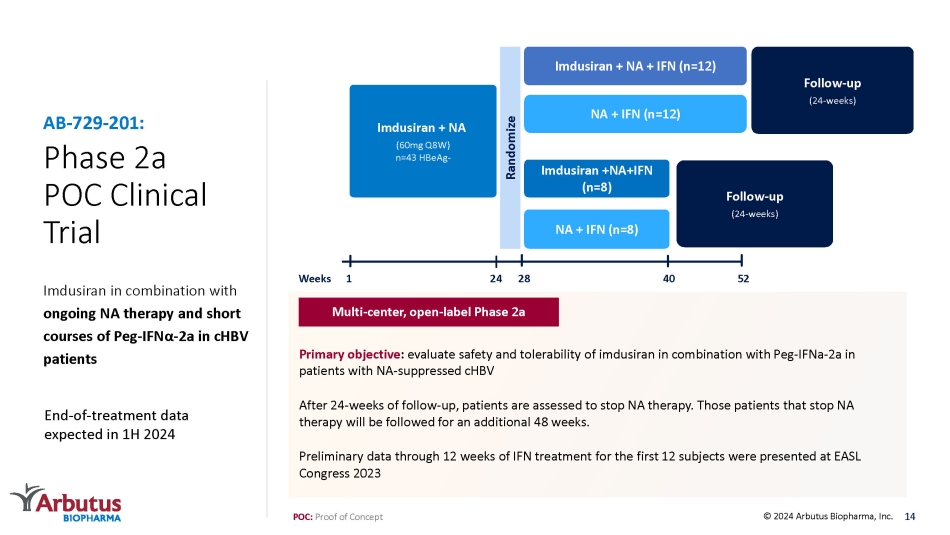
2a 期 POC 臨牀試驗 Imdusiran 與正在進行的 NA 療法和 Peg-IFN α-2 a 短期療程 ChbV 患者聯合使用 AB-729-201:隨訪(24 周)Imdusiran + NA + IFN(n=12)NA + IFN(n=12)Imdusiran +NA+IFN(n=8)Imdusiran +IFN(n=8)Imdusiran + IFN(n=8)Ibn(n = 8)Imdusiran + IFN(n = 8)Imdusiran + IFN(n = 8)Imdusiran + IFN(n = 8)Ibn dusiran + NA(60mg Q8W)n=43 HBeag-隨機隨訪(24 周)1 52 28 24 40 周 POC:概念驗證主要目標:評估 NA 抑制 chbV 患者中imdusiran與Peg-ifNA-2a聯合使用的安全性和耐受性。經過24周的隨訪,患者被評估為停止 NA 治療。對於停止NA治療的患者,將再接受48周的隨訪。前12名受試者接受12周幹擾素治療的初步數據已在EASL大會2023年多中心、開放標籤的2a期14期結束治療數據中公佈,預計將於2024年上半年發佈 © 2024 Arbutus Biopharma, Inc.

按隊列分列的個體和平均乙型肝炎表面抗原結果 15 AB-729-201:Imdusiran 治療導致 HbSaG 持續下降;IFN 可能導致額外下降平均值(SE)HbSag log 10 在關鍵時間點與基線相比的變化在 EASL 2023 上公佈的數據初步結果:在 IFN 治療期間,某些患者的乙型肝炎表面抗原持續下降在治療的第 24 周,先導期的 bsAg 下降幅度為 1.6 log 10,93% 的患者(41 名隨機分組的 38 名患者)有 HbsAg 水平
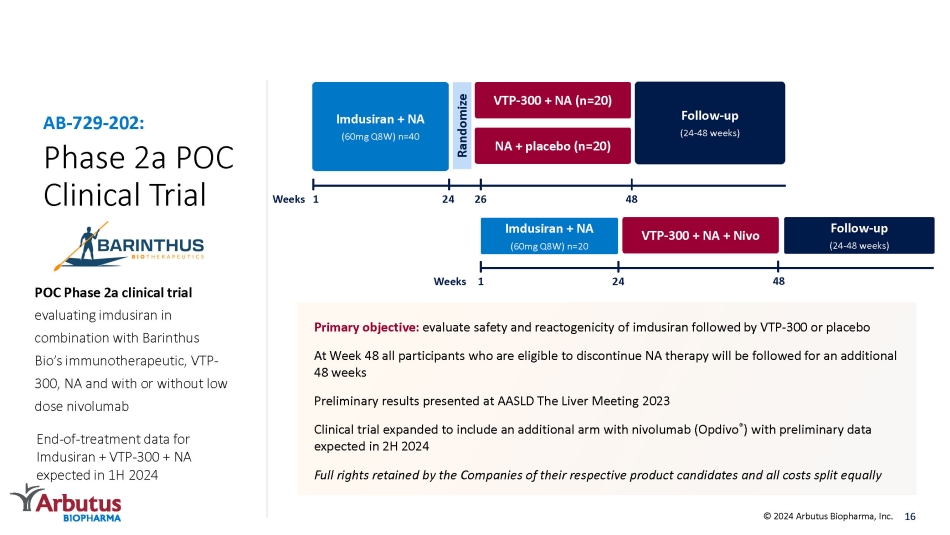
2a 期 POC 臨牀試驗 POC 2a 期臨牀試驗,評估伊姆杜西蘭與 Barinthus Bio 的免疫療法 VTP-300、NA 以及有或不使用低劑量 nivolumab AB-729-202:主要目標:評估伊姆度西蘭的安全性和反應原性,然後是 VTP-300 或安慰劑。第 48 周,將跟蹤所有有資格停止 NA 治療的參與者再延續 48 周在 AASLD 上公佈的初步結果 2023 年肝臟會議臨牀試驗擴大到包括另外一個組合 nivolumab (Opdivo®) 和初步數據預計將在2024年下半年公佈公司保留各自候選產品的全部權利,所有費用平均分配 16 隨訪(24-48 周)VTP-300 + NA(n=20)NA + 安慰劑(n=20)1 Imdusiran + NA(60mg Q8W)n=40 Randomize Weeks Imdusiran + NA(60mg Q8W)n=20 24 VTP-300 + NA + Nivo 1 48 26 24 周 48 周隨訪(24-48 周)© 2024 Arbutus Biopharma, Inc. Imdusiran + VTP-300 + NA 的終止治療數據,預計將在 2024 年上半年提供 300 + NA
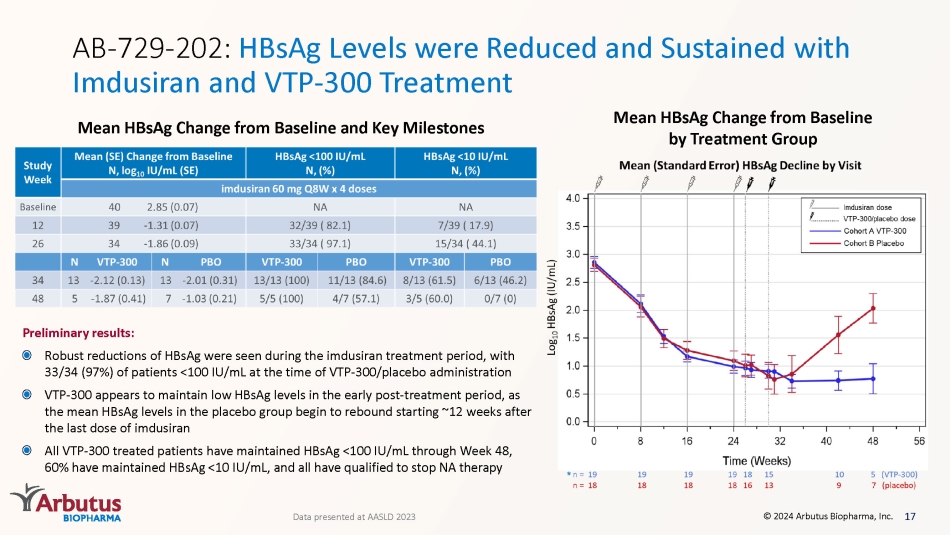
17 © 2024 Arbutus Biopharma, Inc. AB-729-202:Imdusiran 和 VTP-300 治療使乙型肝炎表面抗原水平與基線相比的平均變化和關鍵里程碑平均乙型肝炎表面抗原與基線的變化在 AASLD 2023 上公佈的初步結果:在 imdusiran 治療期間,HbsAg 水平大幅下降,33/34 (94) 7%) 的患者

18 © 2024 Arbutus Biopharma, Inc. AB-729-202:HBV-特異性 T 細胞反應和可溶性免疫生物標誌物在 VTP 300 劑量給藥後增加初步結果:在 imdusiran 鉛注入期間和疫苗接種後,觀察到乙型肝炎特異性 T 細胞反應增強在 VTP-300 名接受治療的患者(n=4)中 sAG、pres1/S2 肽,在 imdusiran 的引入和疫苗接種期間,還觀察到其他血漿免疫生物標誌物的短暫增加數據在 AASLD 2023 上發表的第 30 名患者(第 A/VTP-300 組)在 VTP-300 之後到第 48 周經歷了 HbSaG 下降和 IFN-γ產生(通過 eliSpot)增強(通過 eliSpot)

戰略合作獨家許可*和戰略合作伙伴關係在中國大陸、香港、澳門和臺灣開發、製造和商業化imdusiran Imdusiran 預付款(2022年收到)4000萬美元股權投資(2022年收到)1500萬美元商業化和里程碑式付款高達2.45億美元的分級特許權使用費年銷售額雙位數最高可達20%*ABUS保留在卡塔爾開發和製造的非獨家權利 Arbutus:齊魯製藥在世界其他地區開採AB-729的領土交易經濟學:中國領先的製藥公司之一,為該合作伙伴關係提供開發、製造和商業化專業知識 China 19 © 2024 Arbutus Biopharma, Inc.

口服 PD-L1 抑制劑 20 © 2024 Arbutus Biopharma, Inc.

AB-101:口服 PD-L1 抑制劑 HBV 免疫再激活 PD-1:程序性死亡配體蛋白 | Abs:抗體目前處於 1a/1b 期臨牀試驗理由 • 乙肝免疫耐受性是 ChbV 感染的關鍵驅動因素 • PD-1:PD-L1 檢查點軸在 ChbV 的免疫耐受性中起關鍵作用 • PD-L1 表達在 HBV 感染期間上調 • PD-1 上調 HBV 特異性 T 和 B 細胞 • 某些 ChbV 患者與 HbSaG 流失相關的抑制作用 AB-101 • 在低於 nM 的濃度下阻斷 PD-L1/PD-1 相互作用 • 激活HBV-體外來自 ChbV 患者 T 細胞的特異性免疫反應 • 已發現新的 MOA • 表現出強大的檢查點介導體內效應 • 改善體外的 HBV(特異性 T 和 B)細胞反應小分子抑制劑方法 • 允許對照檢查點阻斷 • 支持口服給藥 • 旨在減少 Abs 21 中出現的全身安全問題 © 2024 Arbutus Biopharma, Inc.

AB-101:小分子口服 PD-L1 乙肝病毒抑制劑 AB-101 非常有效,可激活慢性乙肝病毒患者的乙肝病毒特異性免疫細胞 AB-101 重振乙肝病毒——特異性 chbV 患者 T-細胞 pbmcs N= 來自 9 名 chbV 患者的細胞 *p

23 © 2024 Arbutus Biopharma, Inc. 第 1 部分:SAD(n=8/隊列 — 6:2)1C:劑量 3 1B:劑量 2 1A:劑量 1 第 2 部分:MAD(n=10/隊列 — 8:2)2A:劑量 ≤ 第 1 部分測試劑量;間隔待定 2B:劑量/間隔待定 3A:劑量 ≤ 第 2 部分測試劑量;間隔待定 x 28d B:劑量/間隔待定 x 28d 3C:劑量/間隔待定 x 28d AB-101-001:AB 1a/1b 期臨牀試驗-101 第 1 部分和第 2 部分 — 健康受試者第 3 部分 — ChbV 患者(n=12/隊列 — 10:2)病毒抑制的其他可選劑量試劑量試驗。健康受試者的初步數據,包括預計2024年上半年的靶標參與度和受體佔用率

24 LNP 訴訟:更新 Moderna* • 事實調查仍在進行中 • Markman 聽證會定於 2024 年 2 月 8 日舉行 — 法院將聽取關於索賠解釋的辯論,並預計將在聽證會結束後 60 天內發佈命令 • 後續步驟 — 專家證詞/證詞 — 審判日期未定;預計在 2025 年上半年審判 Genevant 80% 的股份 20% 的 Arbutus 特許權使用費/訴訟相關賠償金* 上述提及的日期/時間表包含在 2023 年 3 月 21 日法庭日程安排令(經修訂)中,可能會發生變化。© 2024 ArbutusBiopharma, Inc. Pfizer • 訴訟正在進行中 • 索賠解釋聽證會的日期尚未確定

2024 年關鍵里程碑 *初步現金餘額(包括現金等價物和投資)和現金消耗是在審計完成之前計算的,有待調整 25 預計時間 2024 年裏程碑 1H AB-729-201 第 2a 階段(imdusiran + IFN):結束治療數據 1H AB-729-202 階段 2a(imdusiran + VTP-300):結束治療數據 1H AB-729-202 第 2a 階段(imdusiran + VTP-300):結束治療數據 1H AB-729-202 階段 2a(imdusiran + VTP-300):結束治療數據 1H AB-729-202 階段 2a(imdusiran + VTP-300 AB-729-203(imdusiran + durvalumab):啟動 2a 期臨牀試驗 1H AB-101-001:來自健康受試者隊列的初步數據 2H AB-729-202 2a 期(imdusiran + VTP-300)+ nivolumab):初步數據 © 2024 Arbutus Biopharma, Inc. 截至2023年12月31日,現金餘額*為1.32億美元,現金流持續到2026年第一季度;2024年淨現金消耗*在6300萬美元至6700萬美元之間

謝謝 © 2024 Arbutus Biopharma, Inc.