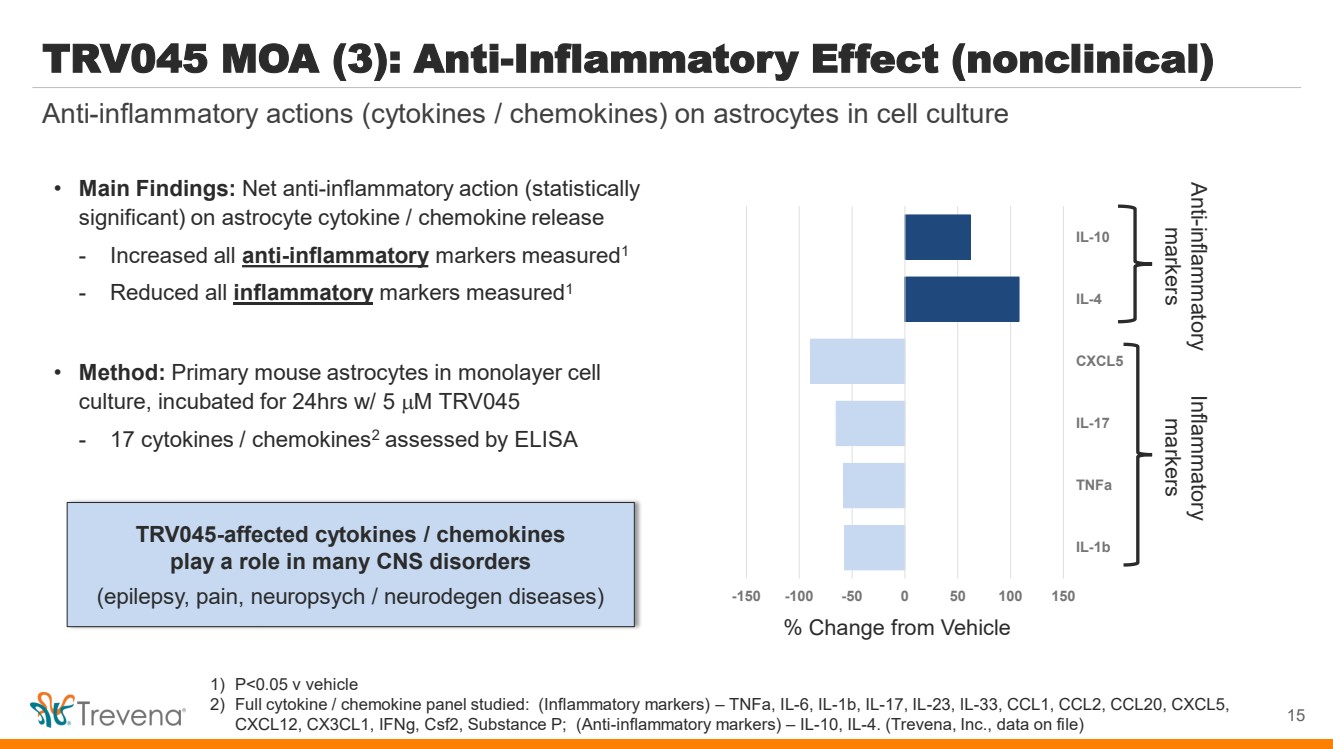
| 為患者創新 納斯達克:TRVN I 2024 年 1 月 |
| 前瞻性陳述 如果本演示文稿中包含的陳述不是對Trevena, Inc.(“公司” 或 “我們”)歷史事實的描述,則它們是反映管理層當前信念和預期的前瞻性陳述 。前瞻性陳述受已知和未知風險、不確定性和其他因素的影響,這些因素可能導致我們或我們的 行業的實際業績、活動水平、業績或成就與此類陳述的預期存在重大差異。您可以使用 術語識別前瞻性陳述,例如 “預測”、“相信”、“估計”、“預期”、“打算”、“可能”、“計劃”、“目標”、“預測”、“項目”、“建議”、“目標”、“潛在”、“將”、“可能”、“應該”、“繼續”、“繼續”、“繼續”、“繼續”、“繼續”、“正在進行”,或這些術語或類似表述的否定詞。本演示文稿中包含的前瞻性陳述包括但不限於:(i)關於 候選產品的預期臨牀試驗時間的陳述;(ii)收到候選產品的臨牀數據的時機;(iii)我們對候選產品的潛在安全性、療效、 或臨牀效用的預期;(iv)候選產品所針對的患者羣體規模以及醫生和患者對我們潛在藥物的市場採用情況; (v) 監管的時機或可能性申報和批准;以及 (vi) 我們的現金需求。 由於各種重要因素,實際結果可能與此類前瞻性陳述中顯示的結果存在重大差異,包括:任何經批准的藥物 產品的商業化、我們的臨牀試驗或任何未來在研藥物試驗的狀態、時間、成本、結果和解釋;進行臨牀 試驗固有的不確定性;對監管相互作用、提交和批准的預期,包括我們對與美國食品藥品管理局討論的評估或其他監管機構關於我們所有的 項目;與OLINVYK商業化相關的不確定性;可用資金;與我們的知識產權相關的不確定性;可能影響我們候選治療藥物可用性或 商業潛力的其他事項;以及我們在向美國證券交易委員會(SEC)提交的10-K表年度報告和10-Q表季度報告中以及我們提交的其他文件中討論的其他因素不時與美國證券交易委員會合作。此外,本演示文稿 中包含的前瞻性陳述僅代表我們截至本文發佈之日的觀點。我們預計,隨後的事件和事態發展可能會導致我們的觀點發生變化。但是,儘管我們可能會選擇在未來的某個時候更新這些 前瞻性陳述,但除非法律要求,否則我們明確聲明不承擔任何這樣做的義務。 2 |
| 董事會 Carrie L. Bourdow Jake R. Nunn Scott Braunstein,醫學博士 首席獨立董事安妮 M. Phillips,醫學博士 Mark Corrigan,M.D. Barbara Yanni 小馬文 H. Johnson 高級管理層 Carrie L. Bourdow 主席、總裁兼首席執行官 Mark A. Demitrack,醫學博士高級副總裁、首席醫療官 Patricia Drake 高級副總裁、首席商務官 Barry Shin 高級副總裁、首席商務官兼商業運營主管 特雷韋納經驗豐富的領導團隊 3 |
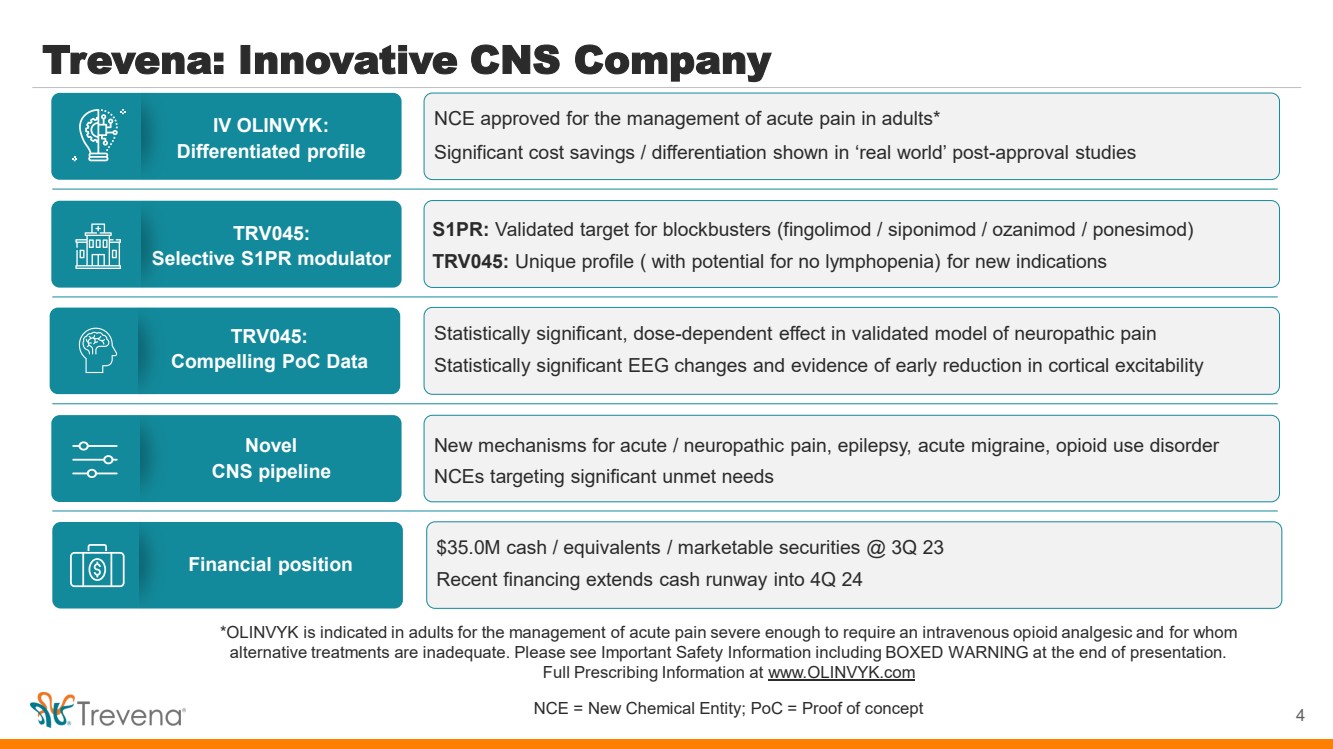
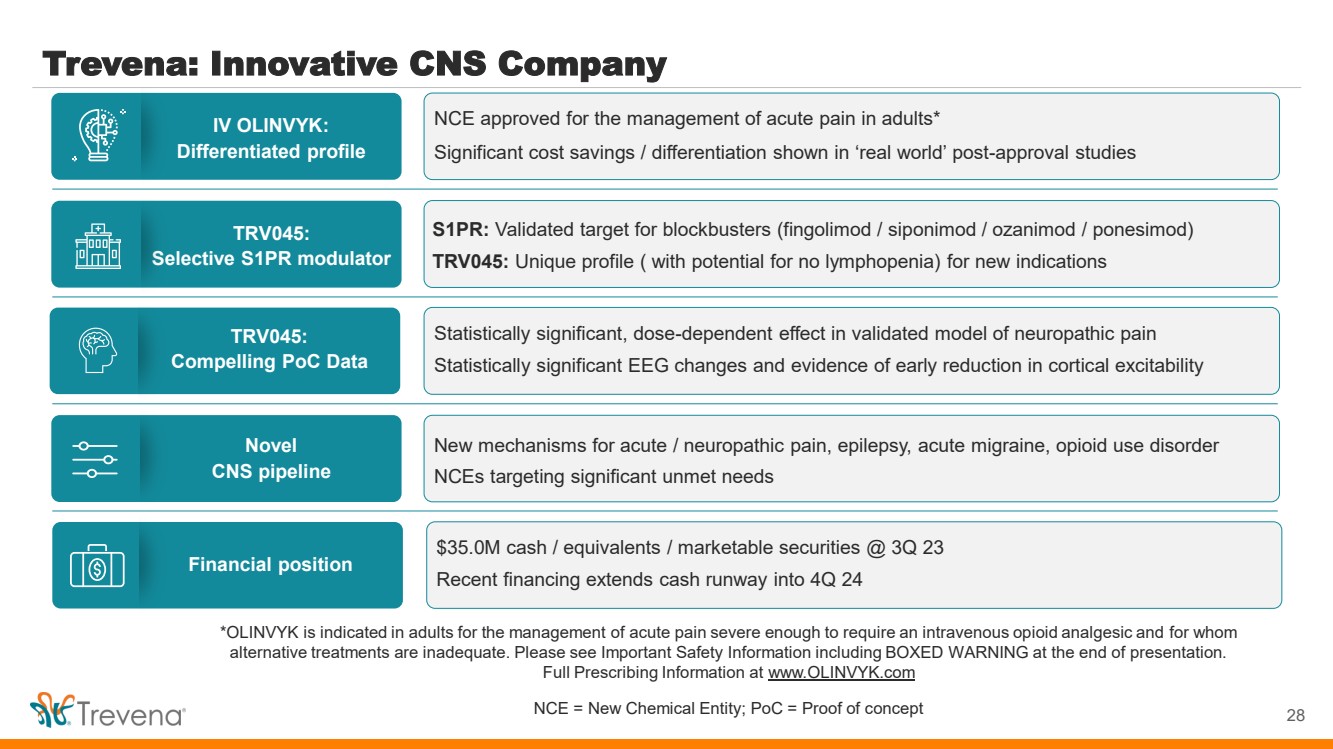
| *OLINVYK 適用於治療急性疼痛,嚴重到需要靜脈注射阿片類鎮痛藥以及 替代療法不足的成人。請在演示文稿結尾處查看重要安全信息,包括方框警告。 完整處方信息請訪問 www.olinvyk.com NCE = 新化學實體;PoC = 概念驗證 Trevena:創新型中樞神經系統公司 4 IV OLINVYK: 差異化概況 TRV045: 選擇性 S1PR 調節劑 新型 中樞神經系統管道 TRV045: 引人注目的 PoC 數據 財務狀況 br} NCE 獲準用於治療成人急性疼痛* 批准後的 “現實世界” 研究顯示出顯著的成本節省/差異化 S1PR:大片(芬戈莫德/西波尼莫德/ozanimod/ponesimod/ponesimod)的有效靶標 TRV045:獨特的概況(可能無淋巴細胞減少)出現新適應症 急性/神經性疼痛、癲癇、急性偏頭痛、阿片類藥物使用障礙的新機制 nCE 針對嚴重未滿足的需求 經驗證的神經病理性疼痛模型具有統計學意義的劑量依賴性影響 具有統計學意義的腦電圖變化和皮質興奮性早期降低的證據 3500萬美元現金/ 等價物/有價證券 @ 23 年第三季度最近的融資將現金流延伸至 24 年第四季度 |
| *OLINVYK 適用於治療急性疼痛,嚴重到需要靜脈注射阿片類鎮痛藥以及 替代療法不足的成年人。請在演示文稿結尾處查看重要安全信息,包括方框警告。 www.olinvyk.com 上的完整處方信息 TRV045 和 TRV734 是研究產品,未獲得 FDA 或任何其他監管機構的批准 NDA = 新藥申請;POC = 概念驗證 PRE-CLIN 第 1 階段第 2 階段第 3 階段保密協議 POST-APPR 亮點 新化學實體 (μ-阿片類受體) br} TRV045 選擇性 S1P 受體調節劑 • 報告的數據 • 報告的數據 • 第一季度 24 TRV734 G 蛋白選擇性激動劑 (mu-阿片受體) 多種預期催化劑 5 NIH/NIDA 合作。 IV 急性疼痛* VOLITION 臨牀結果 呼吸生理學 克利夫蘭診所/Wake Forest Baptist Health 合作。 PoC — 疼痛/靶向參與度 PoC-癲癇 已獲批准 • 真實世界差異 • 報告的數據 • POC研究正在進行中 • POC研究正在進行中 ARTEMIS 臨牀結果 • 880 萬美元/1.4 天節省 阿片類藥物使用障礙 Seiz。上一頁美國國立衞生研究院/ETSP 正在研究潛在的疾病改變作用 認知功能 克利夫蘭診所/維克森林浸信會健康合作。 • 已報告的數據 |
| OLINVYK 概述 |
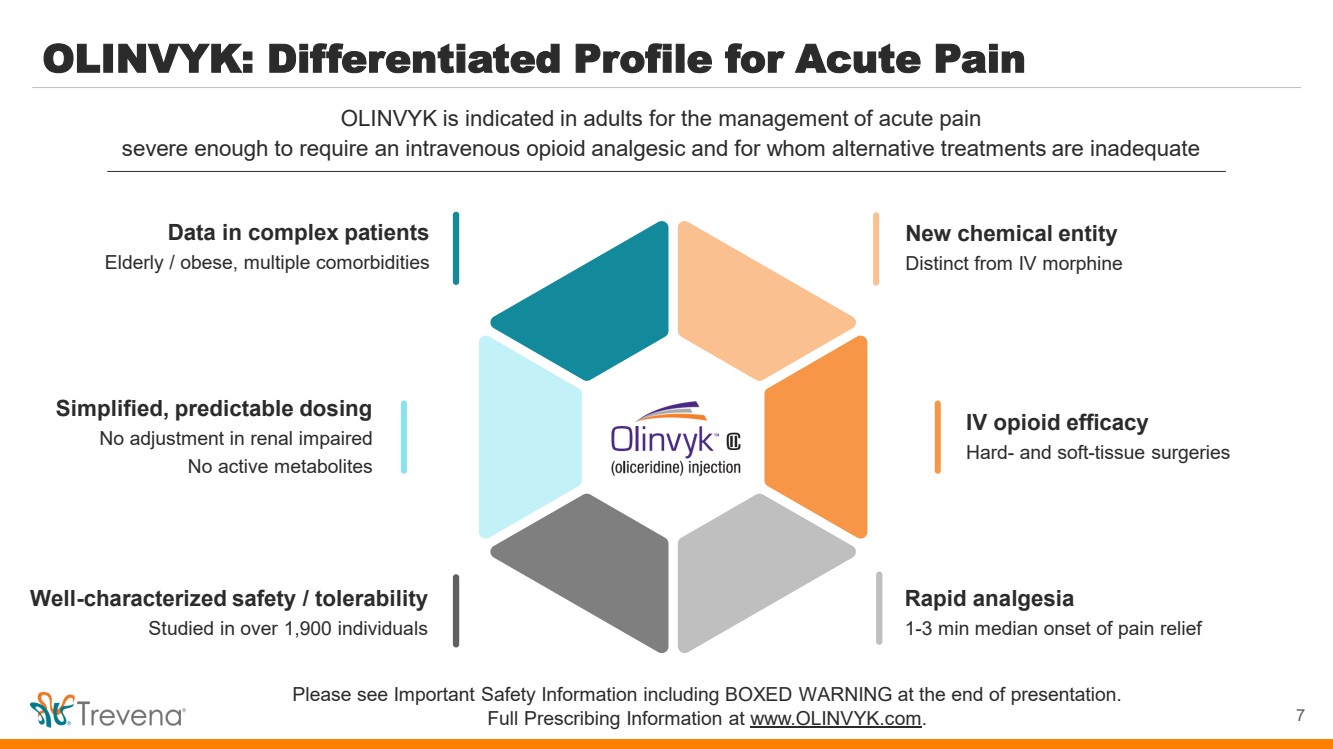
| OLINVYK:急性疼痛的差異化特徵 7 OLINVYK 適用於治療急性疼痛 嚴重到需要靜脈注射阿片類鎮痛藥且替代療法不足的成人 請參閲重要安全信息,包括演示末尾的方框警告。 完整的處方信息請訪問 www.olinvyk.com。 新的化學實體 不同於靜脈注射嗎啡 靜脈注射阿片類藥物療效 硬組織和軟組織手術 快速鎮痛 中位數緩解疼痛 對腎功能受損沒有調整 沒有活性代謝物 複雜患者的數據 老年人/肥胖,多種合併症 特徵明確的安全性/耐受性 對 1,900 多人進行了研究 |
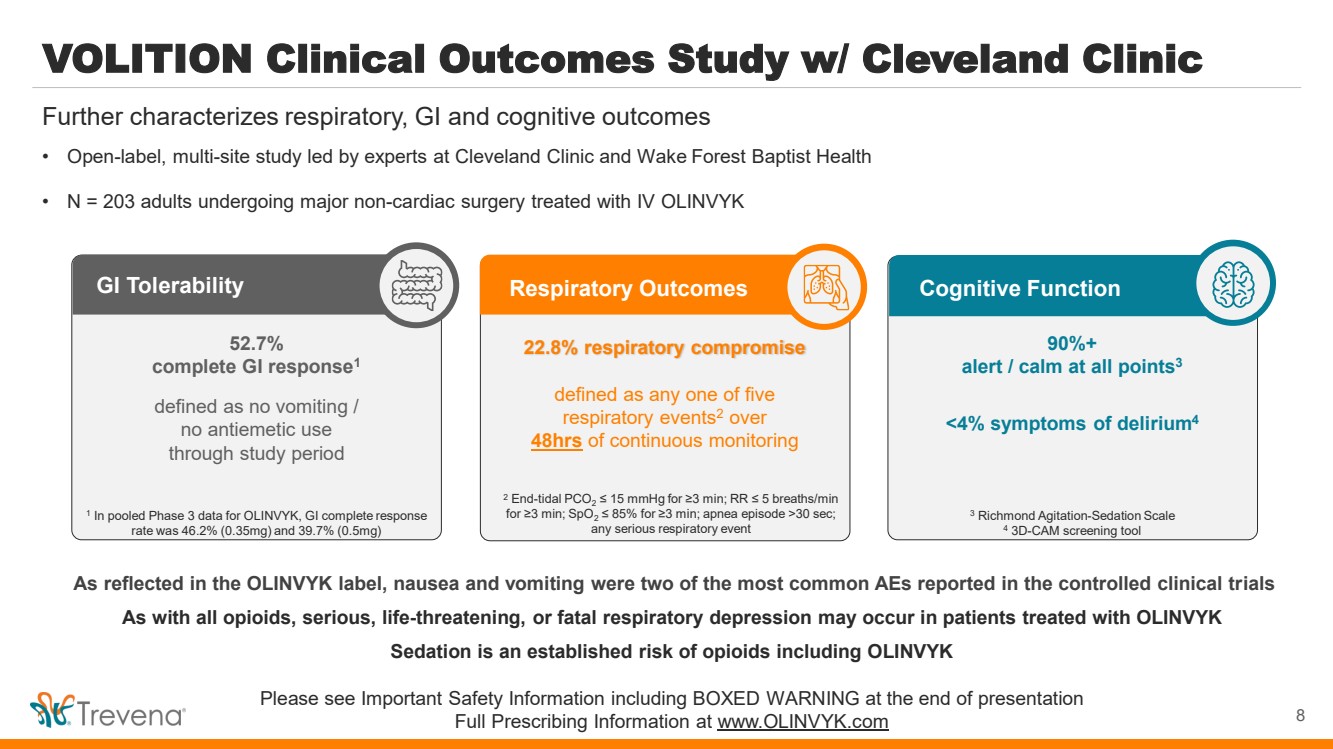
| VOLITION 與克利夫蘭診所合作的臨牀結果研究 • 由克利夫蘭診所和維克森林浸信會健康中心的專家領導的開放標籤多地點研究 • N = 203 名接受靜脈注射治療的成年人 OLINVYK 進一步描述了呼吸、胃腸道和認知結果 90% + 時刻警覺/平靜3 30 秒; 任何嚴重的呼吸道事件 8 |
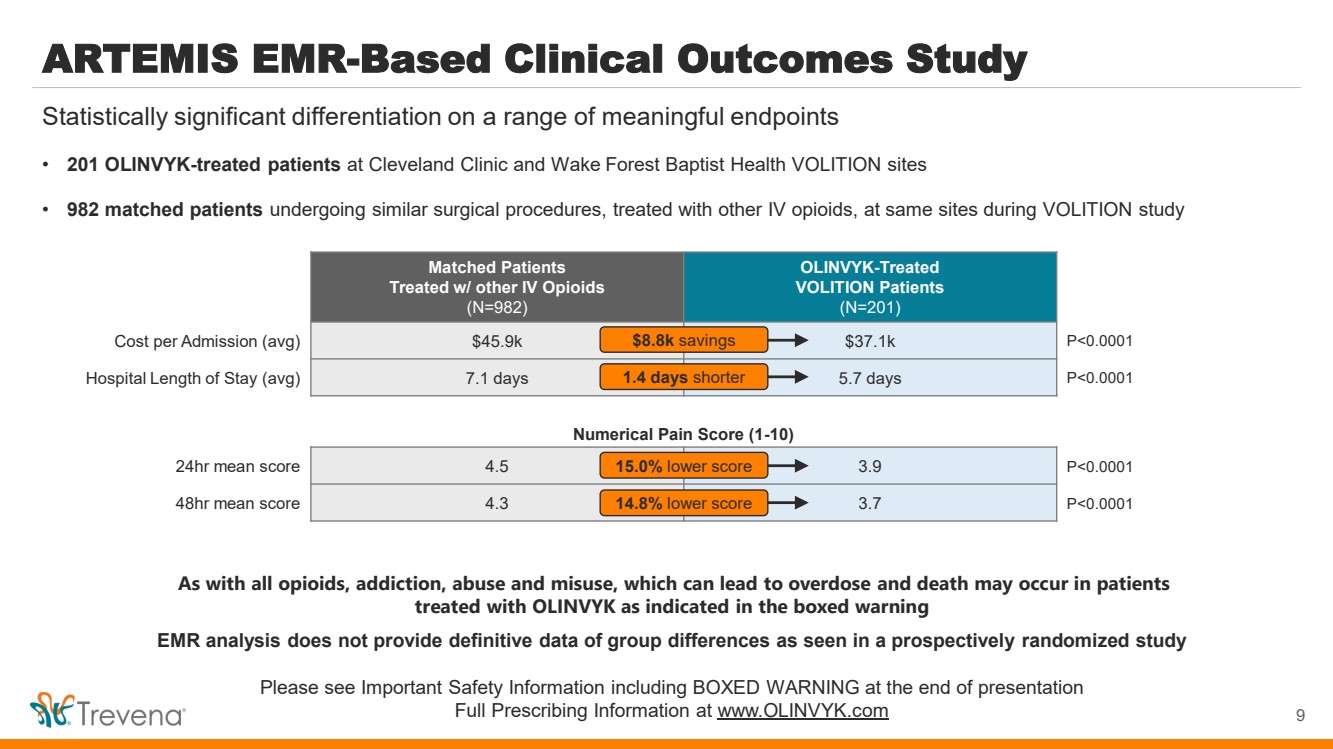
| 基於 ARTEMIS EMR 的臨牀結果研究 • 克利夫蘭診所和維克森林浸信會健康 VOLITION 站點的 201 名 Olinvyk 接受過治療的患者 • 在 VOLITION 研究期間,982 名患者匹配了在相同地點接受其他靜脈阿片類藥物治療的類似外科手術 (N=N=N=N=N=N=N=N=CLITION)。982) 接受了 Olinvyk 治療的 VOLITION 患者 (N=201) 每次入院費用(平均)459萬美元 3,71 萬美元 P |
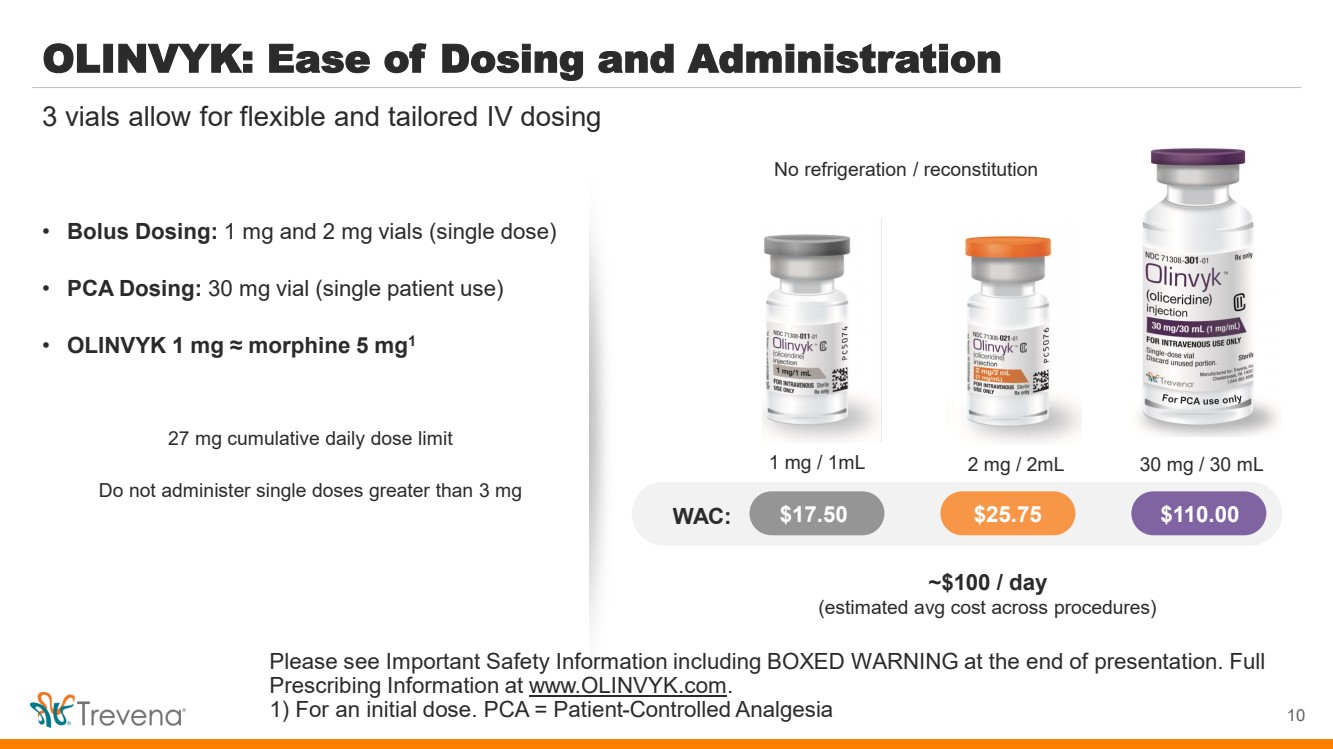
| OLINVYK:易於給藥和給藥 • 推注劑量:1 mg 和 2 mg 小瓶(單劑量) • PCA 劑量:30 mg 小瓶(單一患者使用) • OLINVYK 1 mg √ 嗎啡 5 mg1 27 mg 累計每日劑量限制 不要給予大於 3 mg 的單劑量 10 3 瓶允許靈活和量身定製的靜脈給藥 不可冷藏/重組 僅限五氯苯甲醚使用 WAC:17.50 美元 25.75 美元 110.00 美元 1 mg/1mL 2 mg/2mL 30 mg/30 mL ~100 美元/天 (各程序的估計平均成本) 請查看重要安全信息,包括 BOXED演示結束時發出警告。完整的 處方信息請訪問 www.olinvyk.com。 1) 用於初始劑量。PCA = 患者控制的鎮痛 |
| TRV045 S1P 受體調節劑 治療糖尿病神經病理性疼痛的新型 MOA |
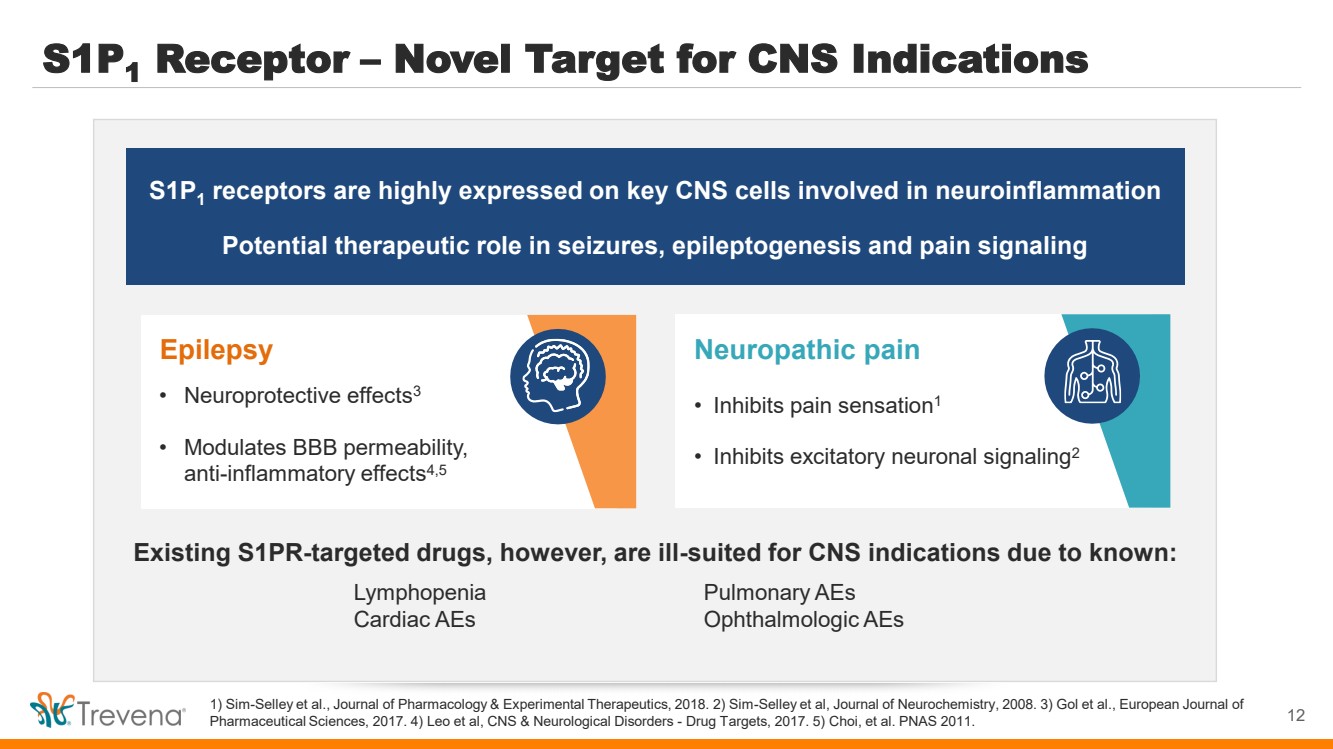
| S1P1 受體 — 中樞神經系統適應症的新靶標 1) Sim-Selley 等人,《藥理學與實驗療法雜誌》,2018 年。2) Sim-Selley 等人,《神經化學雜誌》,2008 年。3) Gol 等人,《歐洲 藥物科學雜誌,2017 年。4) Leo 等人,中樞神經系統和神經系統疾病——藥物靶標,2017 年。5) Choi 等人。PNAS 2011。 S1P1 受體在參與神經炎症的關鍵中樞神經系統細胞上高度表達 在癲癇發作、癲癇發生和疼痛信號傳導中的潛在治療作用 神經性疼痛 • 抑制疼痛感1 • 抑制興奮性神經元信號傳導2 但是,由於已知: 肺淋巴減少症,現有的 S1PR 靶向藥物不適合中樞神經系統適應症 aEs 心臟 aEs 眼科 aEs 癲癇 • 神經保護作用3 • 調節 BBB 通透性, 抗炎作用4,5 12 |
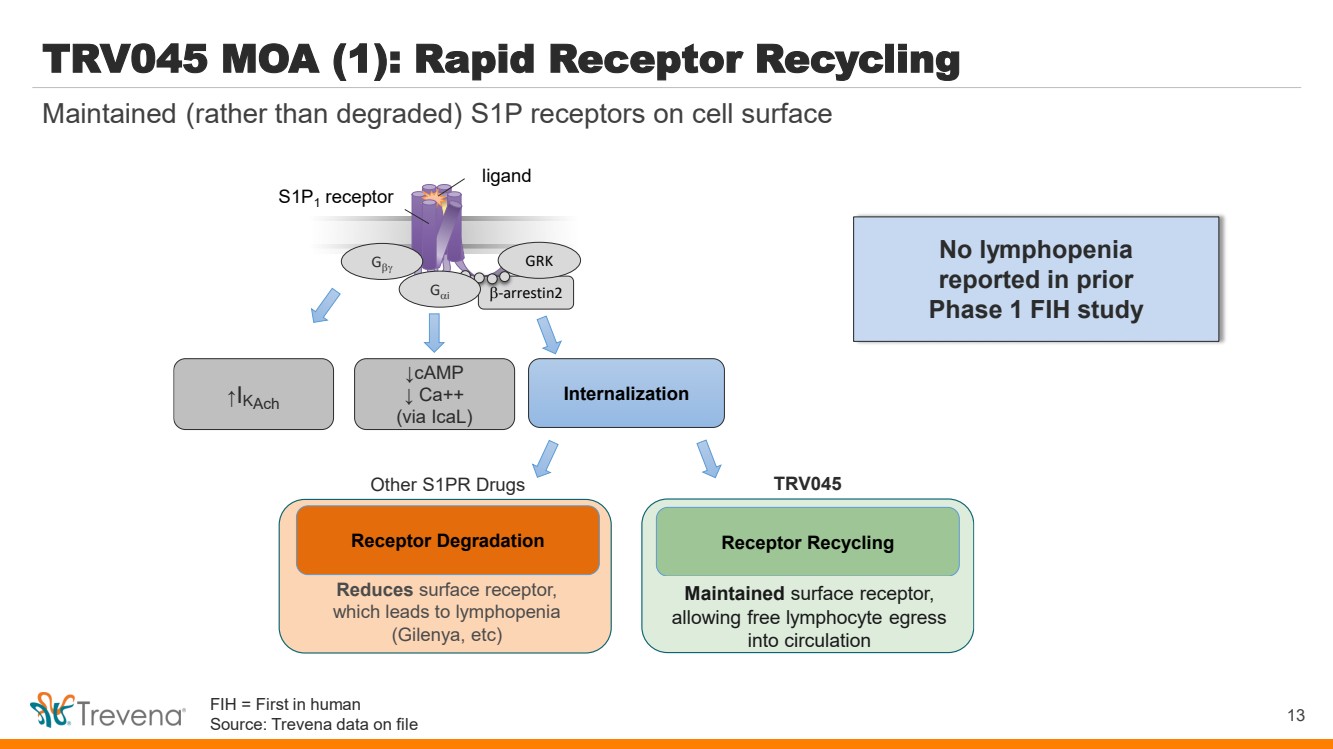
| TRV045 MOA (1):快速受體回收 b-arrestin2 S1P1 受體 Gb Gb GRK ↑I 內化 kAch 配體 ↓ Ca++ ↓ Ca++ (通過 iCal) 減少導致淋巴細胞減少的表面受體 (Gilenya 等)) 受體回收 維持表面受體和 避免淋巴減少,允許遊離 淋巴細胞進入循環 受體降解 其他 S1PR 藥物 TRV045 13 在細胞表面保持(而不是降解)S1P 受體 在先前的 第 1 階段 FIH 研究中未報告淋巴細胞減少 表面受體, 允許自由淋巴細胞流出 進入血液循環 FIH = 人類首創 來源:Trevena 存檔數據 |
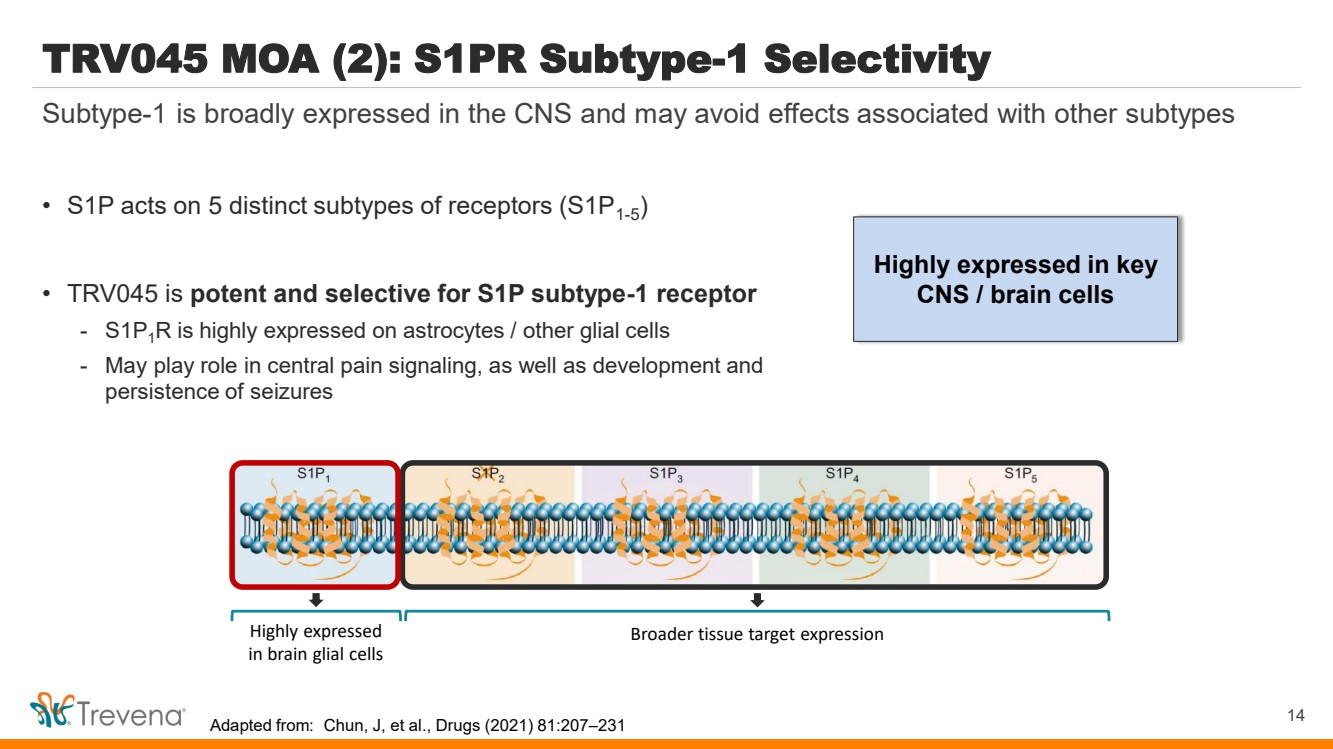
| 在關鍵 中樞神經系統/腦細胞中高度表達 TRV045 MOA (2):S1PR 亞型 1 選擇性 • S1P 作用於受體 5 種不同的亞型 (S1P1-5) • TRV045 對 S1P 亞型 1 受體 具有強效和選擇性 -S1P1R 在星形膠質細胞上高度表達 /其他神經膠質細胞 -可能在中樞疼痛信號,以及發育和 持續發作 14 亞型在中樞神經系統中廣泛表達,可以避免與其他亞型 腦膠質細胞中高度表達 腦膠質細胞中高表達 更廣泛的組織靶向表達 改編自:Chun, J 等人,《藥物》(2021) 81:207 —231 |
| 1) P |
| TRV045 概念驗證研究計劃 — 亮點 • 目標參與度。表現出中樞神經系統穿透力和靶向參與度 • 神經性疼痛。經驗證的神經病理性疼痛模型具有統計學意義的劑量依賴性效應 • EEG 光譜功率。與喚醒、警覺、認知處理、學習和記憶有關的 腦電波(α、β、伽瑪)具有統計學意義的顯著增加 三角腦電波的統計學顯著減少, theta 腦電波沒有顯著變化,兩者都與鎮靜/睡眠有關 • 皮質興奮性。皮質興奮性早期降低的方向性證據 初步數據* 並非所有結果都具有統計學意義; 以下幻燈片中顯示了研究結果的詳細信息 研究是在美國境外進行的,而不是在 IND 下進行的 TRV045 16 |
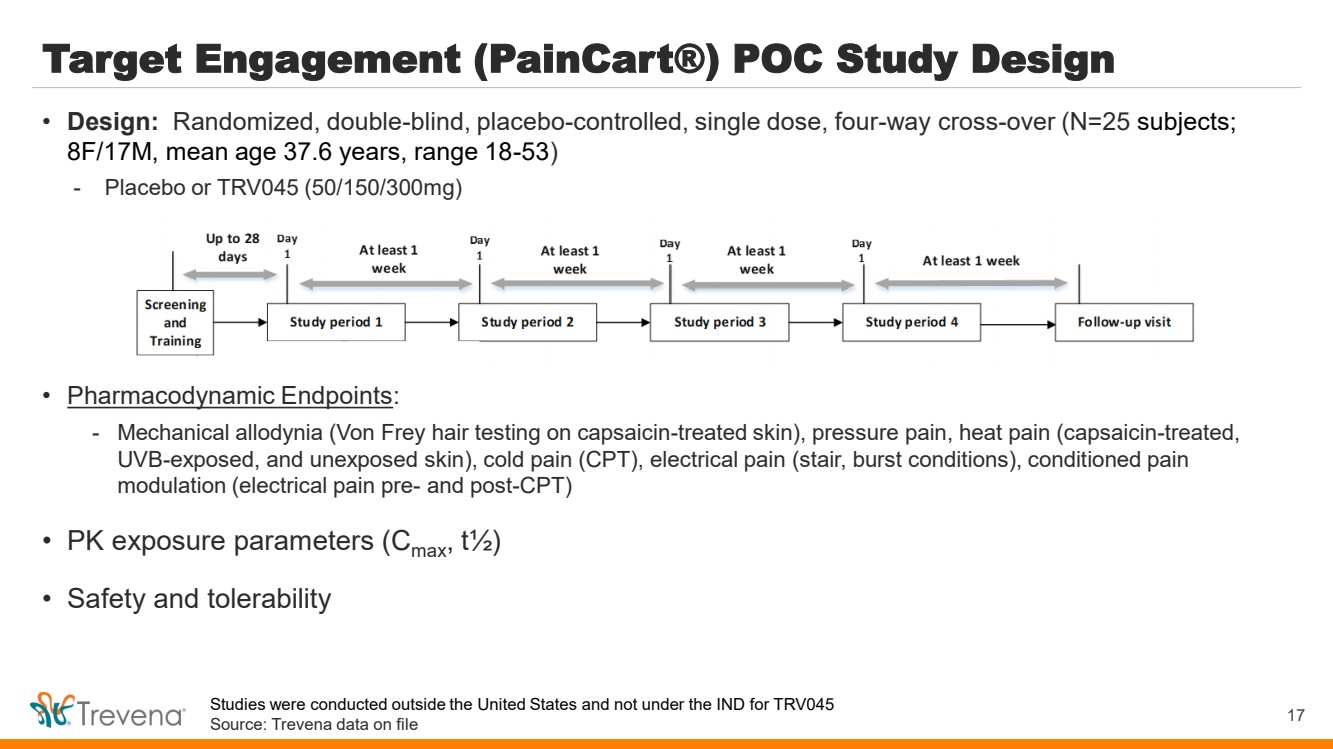
| 目標參與度 (PainCart®) POC 研究設計 • 藥效學終點: -機械性異常症(在辣椒素治療的皮膚上進行馮弗雷毛髮試驗)、壓力性疼痛、熱痛(經過辣椒素治療、 暴露於紫外線和未暴露的皮膚)、冷痛(CPT)、電痛(樓梯、爆裂狀態)、條件性疼痛 調節(CPT 前後電痛) • PK 暴露參數(Cmax,t½) • 安全性和耐受性 17 • 設計:隨機、雙盲、安慰劑對照、單劑量、四向交叉(N=25 名受試者; 8F/17M,平均年齡 37 歲。6 年,範圍 18-53) -安慰劑或 TRV045(50/150/300mg) 研究是在美國境外進行的,不在 TRV045 的臨牀試驗下進行來源:存檔的 Trevena 數據 |
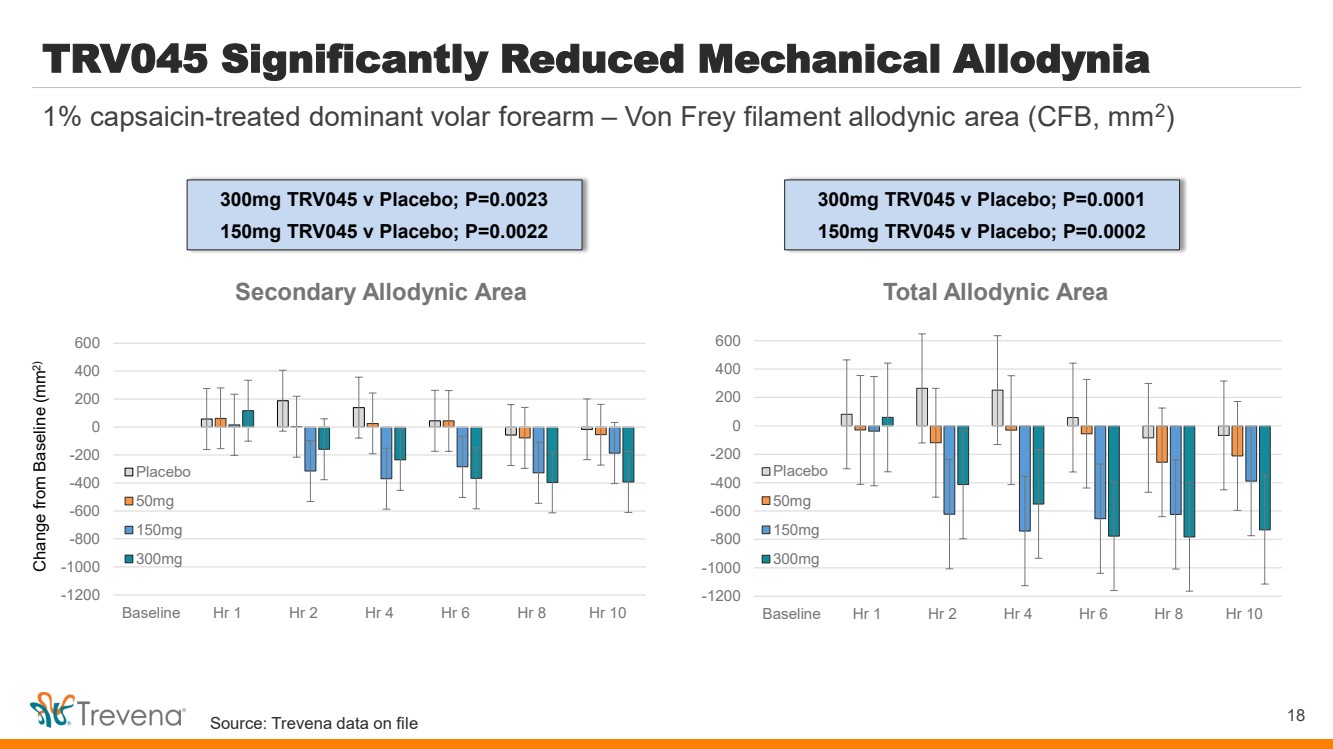
| TRV045 顯著減少機械異體感染 18 1% 經過辣椒素處理的佔主導地位的掌骨前臂 — Von Frey 燈絲異體力學面積(CFB,mm2) 與基線的變化(mm2) -1200 -1000 -600 -400 -400 -400 -200 400 600 基線 Hr 1 小時 2 小時 4 小時 6 小時 8 小時 10 總異常面積 安慰劑 500 mg 150mg 300mg -1200 -1000 -600 -400 -400 -200 400 600 基線 Hr 1 小時 2 小時 4 小時 6 小時 8 小時 10 次級異體力學區域 50mg 150mg 300mg TRV045 v 安慰劑;P=0.0023 150mg TRV045 v 安慰劑;P=0.0022 300mg TRV045 v 安慰劑;P=0.0001 150mg TRV045 v 安慰劑;P=0.0002 來源:Trevena 存檔數據 |
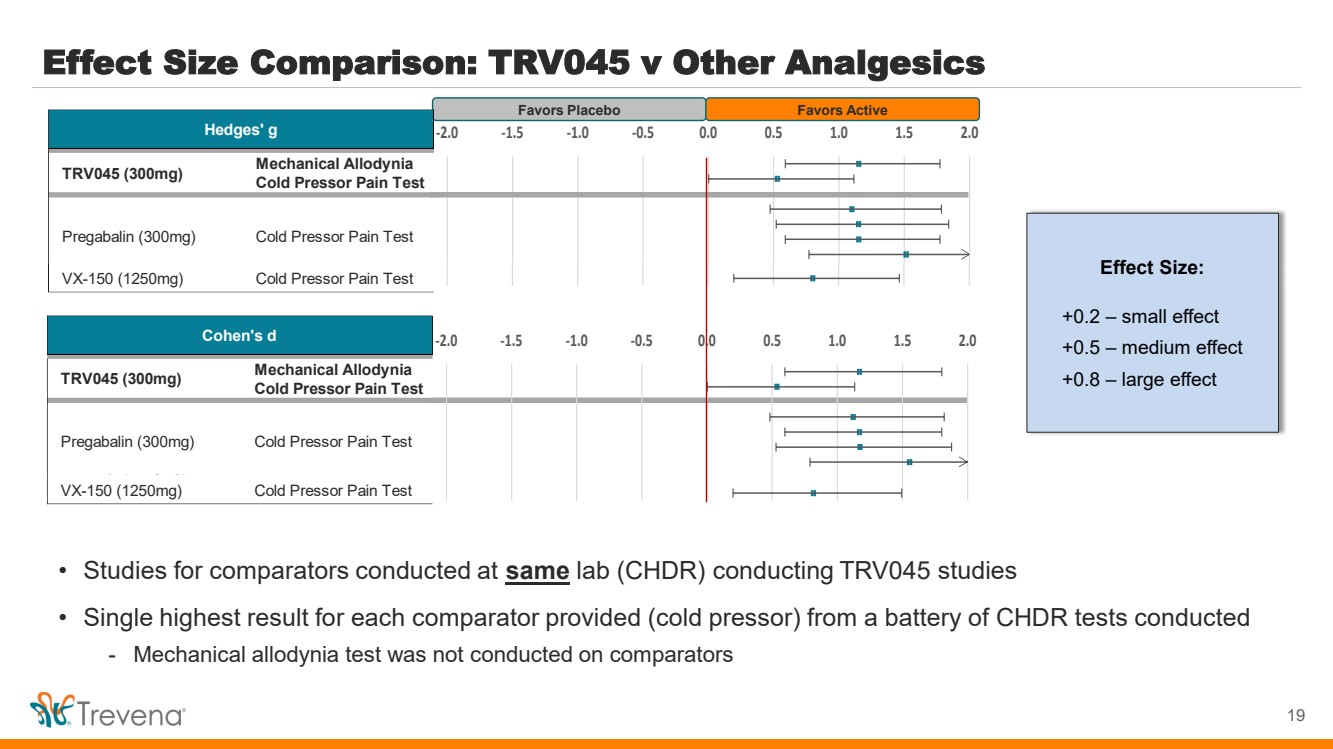
| 效果大小比較:TRV045 與其他鎮痛藥 19 有利於安慰劑有利於活性 • 在進行 TRV045 研究的同一個實驗室 (CHDR) 進行的對比研究 • 從進行的一系列 CHDR 測試中提供的每個比較器(冷壓器)的單一最高結果 -未對比較器進行機械異常試驗 效果尺寸: +0.2 — 小效應 br} +0.5 — 中等效果 +0.8 — 大效果 機械異常症 冷壓痛試驗 芬太尼(30µg/kg)冷壓痛試驗 VX-150(1250mg)冷壓痛試驗 (1250mg)冷壓痛試驗 Hedges's g 冷壓疼痛試驗 TRV045 (300 mg) 普瑞巴林 (300 毫克) -2.0 -1.0 -0.5 0.0 0.5 1.0 2.0 2.0 機械壓痛 冷壓痛試驗 芬太尼 (30µg/kg) 冷壓痛試驗 VX-150 (1250mg) 冷壓痛試驗 Hedges Ges's g 冷壓痛試驗 TRV045 (300 mg) 普瑞巴林 (300 毫克) -2.0 -1.0 -0.5 -0.5 0.5 1.0 2.0 2.0 機械壓痛 冷壓痛試驗 芬太尼 (30µg/kg) 冷壓痛試驗 VX-150 (1250mg) 冷壓痛試驗 Cohen's d 冷壓疼痛試驗 TRV045 (300 毫克) 普瑞巴林(300 毫克) -2.0 -1.0 -0.5 0.0 0.5 1.0 1.5 2.0 機械異常疼痛試驗 芬太尼(30µg/kg)冷壓痛試驗 VX-150(1250mg)冷壓痛試驗 Cohen's d 冷壓痛試驗 TRV045 (300 mg) Pregabalin (300mg) -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.0 1.5 2.0 |
| 來源:存檔的 Trevena 數據 靶向參與度 (PainCart®) 研究 • 辣椒素誘發的機械異位症模型具有統計學意義、劑量依賴性的治療效果 提供了 TRV045 在神經病理性疼痛中的治療潛力的證據 -中樞疼痛處理的公認和驗證研究指數(“中樞過敏”) -請注意,兩者 150mg 的效果看起來相似和 300 毫克劑量,有可能指導未來決定 在第 2 階段的使用劑量範圍 • 部分其他地區有鎮痛作用的支持性證據傷害感受模型 -其他終點未顯示出趨勢/具有統計學意義的結果(壓力性疼痛/條件性疼痛調節) • 總體而言,大力支持中樞神經系統穿透和大腦中疼痛信號通路的參與 -PK 暴露與第一階段 FIH 研究中在餵食條件下觀察到的參數一致 • 無 SAE,沒有藥物相關研究中止 20 Pain 購物車觀察 |
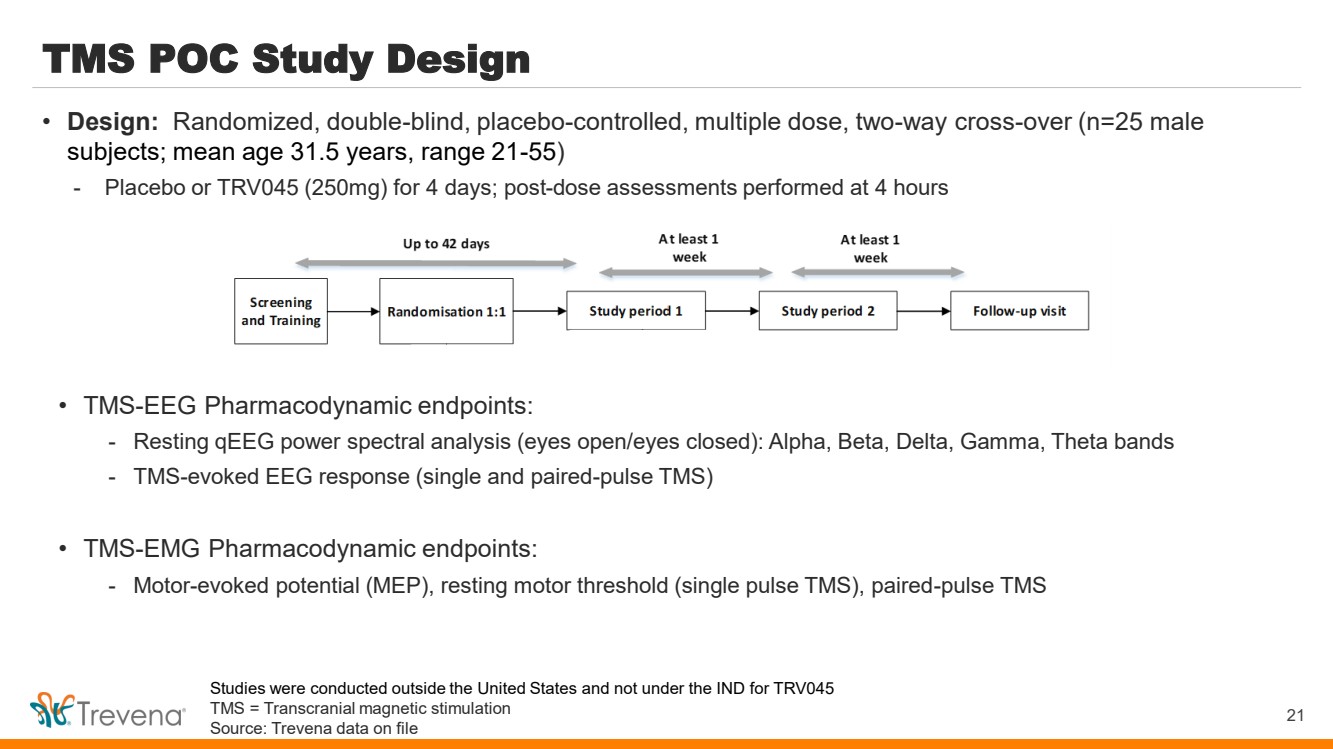
| TMS POC 研究設計 • TMS-EEG 藥效學終點: -靜息 qEEG 功率譜分析(睜開眼睛/閉上眼睛):α、Beta、Delta、Gamma、Theta 波段 -TMS 誘發的腦電圖反應(單脈衝和成對脈衝 TMS) • TMS-EMG 藥效學終點: -電機誘發電位(MEP)、靜息運動閾值(單脈衝 TMS)、配對脈衝 TMS 21 • 設計:隨機、雙盲、安慰劑對照、多劑量、雙向交叉(n=25 名男性 受試者;平均年齡 31.5 歲,範圍 21-55 歲) -安慰劑或 TRV045(250 mg),持續 4 天;給藥後在 4 小時內進行的評估 研究是在美國境外進行的,而不是在 IND 下進行的 TRV045 TMS = 經顱磁刺激 來源:Trevena 存檔數據 |
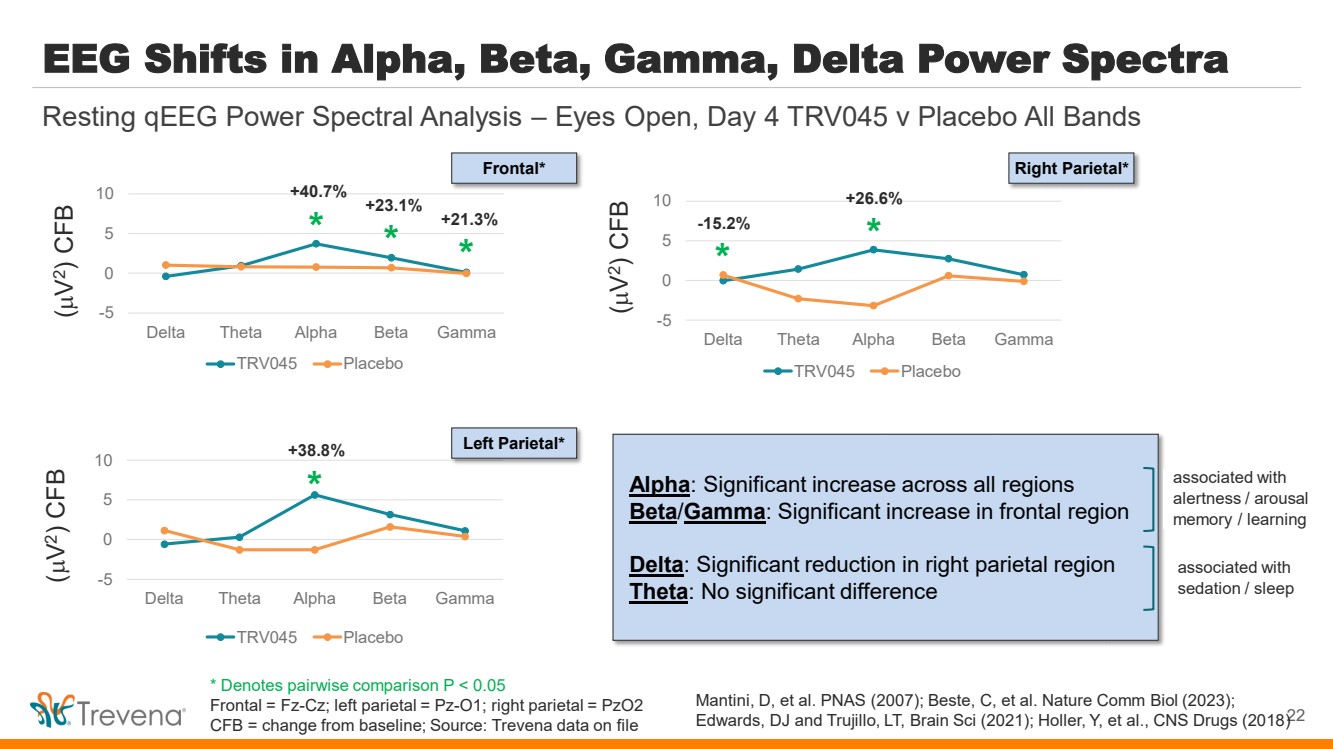
| Alpha、Beta、Gamma、Delta Power Spectra -5 0 5 10 Delta Theta Alpha Beta Gamma TRV045 安慰劑 22 靜息 qeeg 功率譜分析 — 睜開眼睛,第 4 天 TRV045 v 安慰劑所有波段 -5 0 5 10 Delta Theta Beta Beta Gamma TRV045 安慰劑 -5 0 5 10 Delta Theta Beta Beta Gamma TRV045 安慰劑 * * * * * +21.3% -15.2% +23.1% +40.7% +38.8% +26.6% ( V 2) CFB ( V 2) CFB ( V 2) CFB ( V 2) CFB ( V 2) CFB ( V 2) CFB {bbr} 2) CFB 正面* 左側翼* 右側翼* Alpha:所有區域均大幅增加 beta/Gamma:額葉區域顯著增加 Delta:右頂葉區顯著減少 Theta:與 鎮靜/睡眠 相關的 警覺/覺醒 記憶/學習 沒有顯著差異 與 鎮靜/睡眠 Mantini、D 等有關。PNAS(2007);Beste,C 等。Nature Comm Biol(2023); 愛德華茲,DJ 和特魯希略,LT,Brain Sci(2021);Holler,Y 等人,中樞神經系統藥物(2018) * 表示成對比較 P |
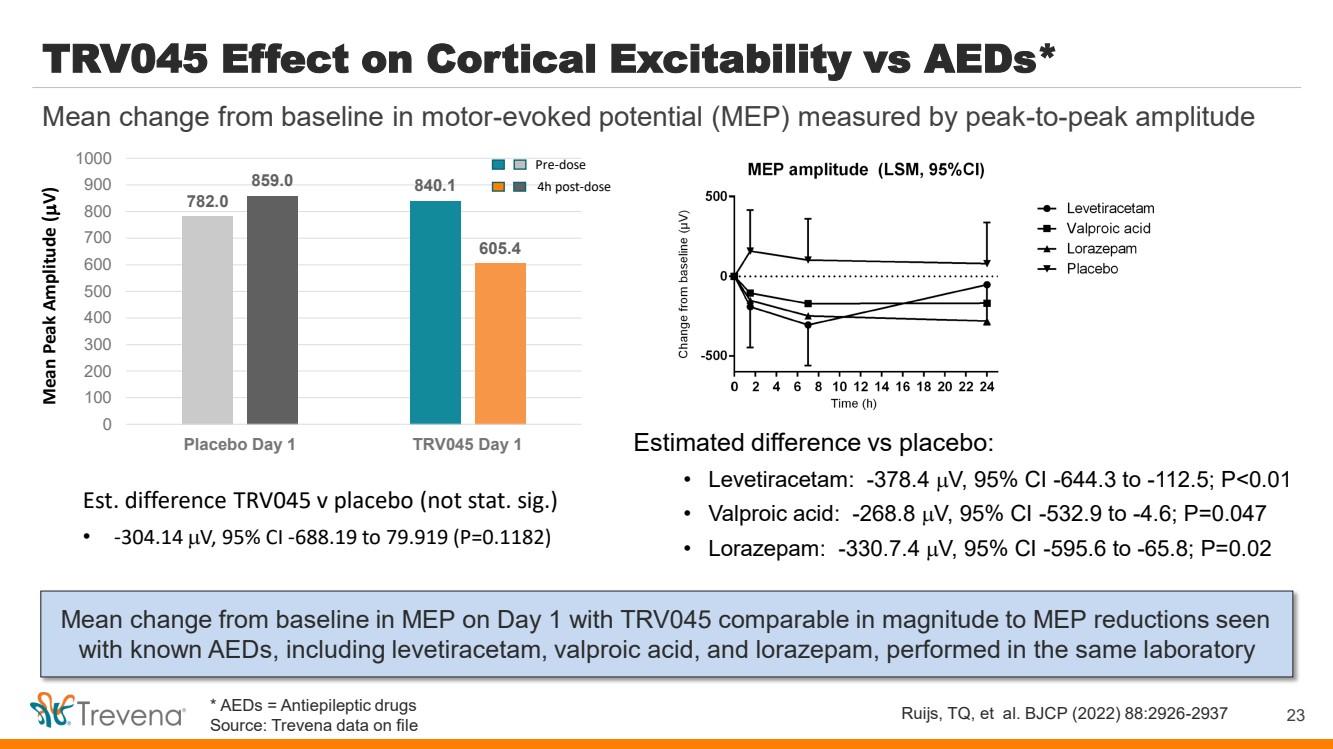
| TRV045 對皮質興奮性的影響與 AED 的影響* 第 1 天 MEP 與基線相比的平均變化幅度與 在同一實驗室進行的已知 AED(包括左乙拉西坦、丙戊酸和****)的降幅相當 23 以峯值振幅測得的電機誘發電位 (MEP) 與基線相比的平均變化 Ruijs、TQ 等。TRV045BJCP (2022) 88:2926-2937 與安慰劑的估計差異: • 左乙拉西坦:-378.4 V,95% 置信區間 -644.3 至 -112.5;P |
| 安全性和耐受性摘要 • 沒有任何不良反應被評估為可能/肯定與研究藥物有關;沒有報告任何不良反應為嚴重;PainCart® 研究中 98% 的 AE(104 箇中的 102 個)報告為輕度 -TMS 研究中 99% 的 AE(80 箇中的 79 個)報告為輕度 • 篩查/後續體格檢查(包括眼科檢查),沒有臨牀顯著發現 • 實驗室結果顯示與藥物無關:淋巴細胞總數減少 心率或血壓變化 心電圖間隔測量值的變化 (PR 或 qtCF 未延長間隔) 24 POC 數據與 FIH 研究基本一致 |
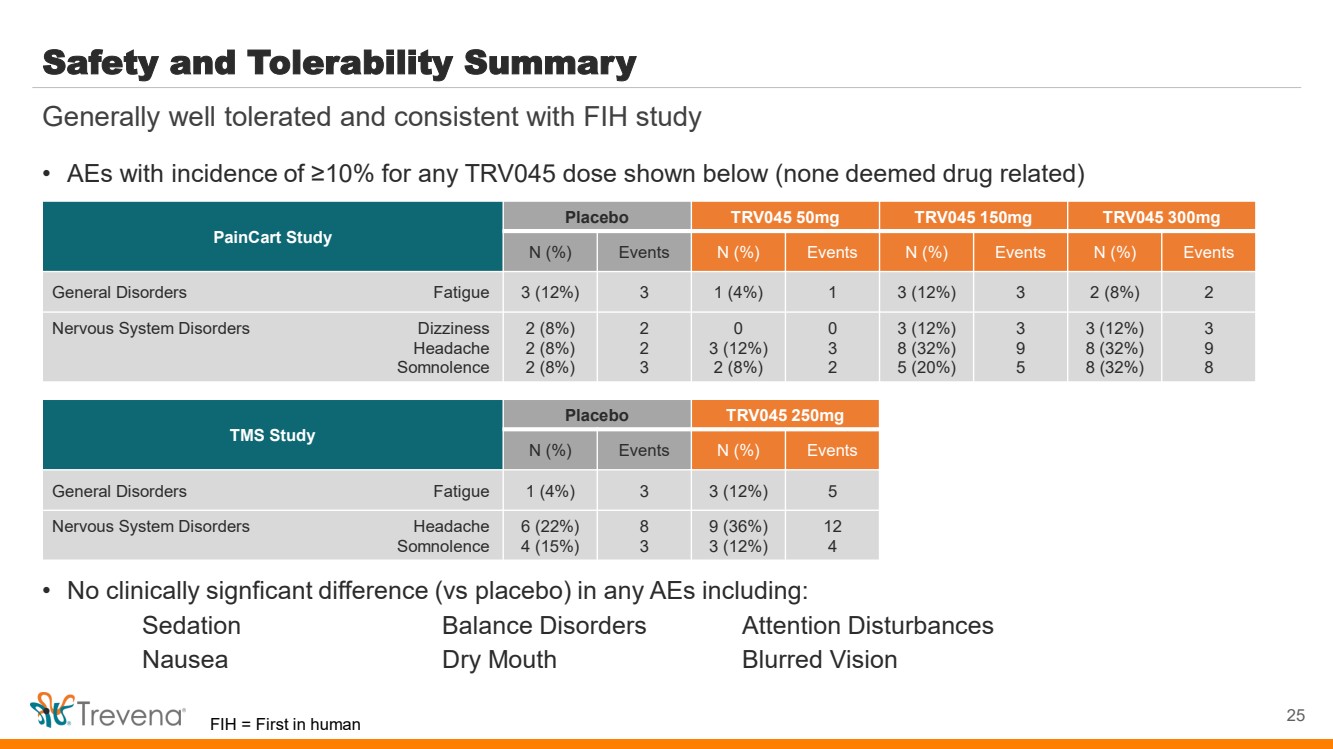
| 安全性和耐受性摘要 • 下圖所示任何 TRV045 劑量的發生率均為 ≥ 10% 的AE(無藥物相關性) • 在任何 AE 中均無臨牀顯著差異(與安慰劑)包括: 鎮靜平衡障礙注意力障礙 噁心口乾視力模糊 。• 25 總體耐受性良好,與 FIH 研究 PainCart Study 安慰劑 安慰劑 50mg TRV045 150mg TRV045 300mg N (%) 事件 N (%) 事件 N (%) 事件 N (%) 事件 一般疾病疲勞 3 (12%) 3 1 (4%) 1 3 (12%) 3 2 (8%) 2 神經系統疾病 TRV045頭暈 頭痛 嗜睡 2 (8%) 2 (8%) 2 (8%) 2 2 3 (12%) 2 (8%) 0 3 2 3 (12%) 8 (32%) 5 (20%) 3 9 5 3 (12%) 8 (32%) 8 (32%) 8 (32%) 5 (20%) 3 (12%) 8 (32%) 3 9 8 TMS 研究 安慰劑 TRV045 250mg N (%) 事件 N (%) 事件 全身疾病疲勞 1 (4%) 3 3 (12%) 5 神經系統疾病頭痛 6 (22%) 4 (15%) 8 9 (36%) 3 (36%) 3 (36%) 3 (36%) 3 (36%) 3 (36%) 3 (36%) 3 (3%) 3 (36%) 3 (36%) 3 (3%) {) 12 4 FIH = 人類第一 |
| 總體結論 • 目標參與度。表現出中樞神經系統穿透力和靶向參與度 • 神經性疼痛。經驗證的神經病理性疼痛模型具有統計學意義的劑量依賴性效應 • 癲癇。皮質興奮性早期降低的令人鼓舞的證據 與覺醒、警覺、認知處理、學習和記憶有關的 腦電波(α、β、gamma)在統計學上顯著增加 腦電波在統計學上顯著降低,並且 theta brain 波沒有顯著變化,兩者都與鎮靜/睡眠有關 • 差異化概況。新的 MOA;預計每天口服一次劑量;可能有效,具有良好的安全性/耐受性 TRV045 概念驗證研究計劃 這兩項 POC 研究合在一起,為 TRV045 的未來發展提供了 有力的支持和指導。研究是在美國境外進行的,沒有在 TRV045 26 的 IND 下進行 |
| TRV045:廣泛的潛在適用性 潛在的開發領域可能包括:癲癇發作治療(抗驚厥藥) 預防發作(癲癇發生) 疼痛(DPN、CIPN) 自身免疫(MS、RA、UC、克羅恩氏病) 神經精神/神經退行性(MDD、精神分裂症、AD、PD) 強效和選擇性的 S1P1R 靶點接合 抗炎和傷害感受作用 無淋巴細胞減少(在 FIH 研究中) 可能會限制其他 S1PR 調節劑 可以避免與批准的 S1PR 藥物相關的不良反應 心臟/肺部/眼科 27獨特的 MOA 可產生引人注目的概況 潛在的疾病緩解性 MOA DPN:糖尿病神經病理性疼痛;CIPN:化療誘發的周圍神經病變;MS:多發性硬化;RA:類風濕性關節炎;MDD: 重度抑鬱症;AD:阿爾茨海默氏病;PD:帕金森氏病 |
| *OLINVYK 適用於治療急性疼痛,嚴重到需要靜脈注射阿片類鎮痛藥以及 替代療法不足的成人。請在演示文稿結尾處查看重要安全信息,包括方框警告。 完整處方信息請訪問 www.olinvyk.com NCE = 新化學實體;PoC = 概念驗證 Trevena:創新型中樞神經系統公司 28 IV OLINVYK: 差異化概況 TRV045: 選擇性 S1PR 調節劑 新型 中樞神經系統管道 TRV045: 引人注目的 PoC 數據 財務狀況 br} NCE 獲準用於治療成人急性疼痛* 批准後的 “現實世界” 研究顯示出顯著的成本節省/差異化 S1PR:大片(芬戈莫德/西波尼莫德/ozanimod/ponesimod/ponesimod)的有效靶標 TRV045:獨特的概況(可能無淋巴細胞減少)出現新適應症 急性/神經性疼痛、癲癇、急性偏頭痛、阿片類藥物使用障礙的新機制 nCE 針對嚴重未滿足的需求 經驗證的神經病理性疼痛模型具有統計學意義的劑量依賴性影響 具有統計學意義的腦電圖變化和皮質興奮性早期降低的證據 3500萬美元現金/ 等價物/有價證券 @ 23 年第三季度最近的融資將現金流延伸至 24 年第四季度 |
| 29 條重要的安全信息 |
| 警告:成癮、濫用和濫用;危及生命的呼吸系統 抑鬱症;新生兒阿片類藥物戒斷綜合徵;以及 與苯二氮卓類藥物或其他中樞神經 系統 (CNS) 抑制劑同時使用的風險 成癮、濫用和濫用 OLINVYK 使患者和其他使用者面臨阿片類藥物成癮、濫用和 濫用的風險,這可能導致服藥過量和死亡。在 開出 OLINVYK 處方之前評估每位患者的風險,並定期監測所有患者 行為或狀況的發展。 危及生命的呼吸抑鬱症 使用 OLINVYK 可能會出現嚴重、危及生命或致命的呼吸抑制。 監測呼吸抑制,尤其是在開始服用 OLINVYK 期間或增加劑量 之後。 新生兒阿片類藥物戒斷綜合症 在懷孕期間長期使用 OLINVYK 會導致新生兒阿片類藥物戒斷 綜合徵,如果得不到識別和治療,可能會危及生命,並且需要根據新生兒學專家制定的方案進行 管理。如果孕婦需要長期使用阿片類藥物 ,請告知患者新生兒阿片類藥物 戒斷綜合徵的風險,並確保提供適當的治療。 與苯二氮卓類藥物或其他中樞神經系統抑制劑同時使用的風險 阿片類藥物與苯二氮卓類藥物或其他中樞神經系統抑制劑(包括酒精)同時使用可能會導致嚴重的鎮靜作用、呼吸抑制、昏迷和死亡。保留伴隨的 處方,用於替代治療方案不足的患者;將 劑量和持續時間限制在所需的最低限度;並跟蹤患者是否有 呼吸抑制和鎮靜的體徵和症狀。 使用限制 由於存在成癮、濫用和濫用阿片類藥物的風險,即使是推薦劑量,也要預留 OLINVYK 供有替代治療選擇的患者使用 [例如,非阿片類鎮痛藥或阿片類藥物組合 產品]: • 未被耐受或預計不會耐受 • 沒有提供足夠的鎮痛,或者預計不會提供足夠的鎮痛。 每日累計總劑量不應超過 27 mg,因為每日總劑量大於 27 mg 可能會增加 延長 qtC 間隔的風險。 禁忌症 OLINVYK 禁用於以下患者: • 嚴重呼吸抑制 • 在不受監測的環境中或沒有復甦設備的情況下出現急性或重度支氣管哮喘 • 已知或疑似的胃腸道梗阻,包括麻痺性腸梗阻 • 已知對奧利塞利丁過敏(例如過敏反應) } 警告和注意事項 • OLINVYK 含有附表二管制藥物奧利西丁,使用者面臨成癮、 濫用和濫用的風險。儘管任何人成癮的風險尚不清楚,但處方恰當 OLINVYK 的患者可能會出現這種風險。評估風險、諮詢和監測所有接受阿片類藥物的患者。 • 據報道,阿片類藥物的使用會導致嚴重的、危及生命的呼吸抑制,即使按照 的建議使用也是如此,尤其是在慢性肺病患者或年老、緩慢和虛弱的 患者中。在開始OLINVYK治療期間、增加劑量後或與其他抑制呼吸的藥物一起使用時,風險最大。OLINVYK 的正確劑量至關重要,尤其是在將 患者從其他阿片類藥物轉化為避免過量服用時。呼吸抑制的治療可能包括 密切觀察、支持措施和阿片類藥物拮抗劑的使用,具體取決於患者的臨牀 狀態。 • 阿片類藥物可導致與睡眠相關的呼吸障礙,包括中樞性睡眠呼吸暫停 (CSA) 和睡眠相關的 低氧血癥,風險以劑量依賴的方式增加。對於出現CSA的患者,可以考慮 使用阿片類藥物減少最佳實踐來減少阿片類藥物的劑量。 適應症和用法 OLINVYK 是一種新的化學物質,適用於治療嚴重到足夠 需要靜脈注射阿片類鎮痛藥且替代療法不足的成年人。 30 |
| WARNINGS AND PRECAUTIONS • Prolonged use of opioids during pregnancy can result in withdrawal in the neonate that may be life-threatening. Observe newborns for signs of neonatal opioid withdrawal syndrome and manage accordingly. Advise pregnant women using OLINVYK for a prolonged period of the risk of neonatal opioid withdrawal syndrome and ensure that appropriate treatment will be available. • Profound sedation, respiratory depression, coma, and death may result from the concomitant use of OLINVYK with benzodiazepines or other CNS depressants (e.g., non-benzodiazepine sedatives/hypnotics, anxiolytics, tranquilizers, muscle relaxants, general anesthetics, antipsychotics, other opioids, or alcohol). Because of these risks, reserve concomitant prescribing of these drugs for use in patients for whom alternative treatment options are inadequate, prescribe the lowest effective dose, and minimize the duration. • OLINVYK was shown to have mild QTc interval prolongation in thorough QT studies where patients were dosed up to 27 mg. Total cumulative daily doses exceeding 27 mg per day were not studied and may increase the risk for QTc interval prolongation. Therefore, the cumulative total daily dose of OLINVYK should not exceed 27 mg. • Increased plasma concentrations of OLINVYK may occur in patients with decreased Cytochrome P450 (CYP) 2D6 function or normal metabolizers taking moderate or strong CYP2D6 inhibitors; also in patients taking a moderate or strong CYP3A4 inhibitor, in patients with decreased CYP2D6 function who are also receiving a moderate or strong CYP3A4 inhibitor, or with discontinuation of a CYP3A4 inducer. These patients may require less frequent dosing and should be closely monitored for respiratory depression and sedation at frequent intervals. Concomitant use of OLINVYK with CYP3A4 inducers or discontinuation of a moderate or strong CYP3A4 inhibitor can lower the expected concentration, which may decrease efficacy, and may require supplemental doses. • Cases of adrenal insufficiency have been reported with opioid use (usually greater than one month). Presentation and symptoms may be nonspecific and include nausea, vomiting, anorexia, fatigue, weakness, dizziness, and low blood pressure. If confirmed, treat with physiologic replacement doses of corticosteroids and wean patient from the opioid. • OLINVYK may cause severe hypotension, including orthostatic hypotension and syncope in ambulatory patients. • There is increased risk in patients whose ability to maintain blood pressure has already been compromised by a reduced blood volume or concurrent administrationof certain CNS depressant drugs (e.g., phenothiazines or general anesthetics). Monitor these patientsfor signs of hypotension. In patients with circulatory shock, avoid the use of OLINVYK as it may cause vasodilation that can further reduce cardiac output and blood pressure. • Avoid the use of OLINVYK in patients with impaired consciousness or coma. OLINVYK should be used with caution in patients who may be susceptible to the intracranial effects of CO2 retention,such as those with evidence of increased intracranial pressure or brain tumors, as a reduction in respiratory drive and the resultantCO2 retention can further increase intracranial pressure. Monitor such patientsfor signs of sedation and respiratory depression, particularlywhen initiating therapy. • As with all opioids, OLINVYK may cause spasm of the sphincter of Oddi, and may cause increases in serum amylase. Monitor patients with biliary tract disease, including acute pancreatitis,for worsening symptoms. • There is increased risk in patients whose ability to maintain blood pressure has already been compromised by a reduced blood volume or concurrent administrationof certain CNS depressant drugs (e.g., phenothiazines or general anesthetics). Monitor these patientsfor signs of hypotension. In patients with circulatory shock, avoid the use of OLINVYK as it may cause vasodilation that can further reduce cardiac output and blood pressure. • Avoid the use of OLINVYK in patients with impaired consciousness or coma. OLINVYK should be used with caution in patients who may be susceptible to the intracranial effects of CO2 retention,such as those with evidence of increased intracranial pressure or brain tumors, as a reduction in respiratory drive and the resultantCO2 retention can further increase intracranial pressure. Monitor such patientsfor signs of sedation and respiratory depression, particularlywhen initiating therapy. • As with all opioids, OLINVYK may cause spasm of the sphincter of Oddi, and may cause increases in serum amylase. Monitor patients with biliary tract disease, including acute pancreatitis,for worsening symptoms. • OLINVYK may increase the frequency of seizures in patients with seizure disorders and may increase the risk of seizuresin vulnerable patients. Monitor patients with a history of seizure disorders for worsened seizure control. • Do not abruptly discontinue OLINVYK in a patient physically dependent on opioids. Gradually taper the dosage to avoid a withdrawal syndrome and return of pain. Avoid the use of mixed agonist/antagonist (e.g., pentazocine, nalbuphine, and butorphanol) or partial agonist (e.g., buprenorphine) analgesics in patients who are receiving OLINVYK, as they may reduce the analgesic effect and/or precipitate withdrawal symptoms. • OLINVYK may impair the mental or physical abilities needed to perform potentially hazardous activities such as driving a car or operating machinery. • Although self-administration of opioids by patient-controlled analgesia (PCA) may allow each patient to individually titrate to an acceptable level of analgesia, PCA administration has resulted in adverse outcomes and episodes of respiratory depression. Health care providers and family members monitoring patients receiving PCA analgesia should be instructed in the need for appropriate monitoring for excessive sedation, respiratory depression, or other adverse effects of opioid medications. ADVERSE REACTIONS Adverse reactions are described in greater detail in the Prescribing Information. The most common (incidence ≥10%) adverse reactions in Phase 3 controlled clinical trials were nausea, vomiting, dizziness, headache, constipation, pruritus, and hypoxia. PLEASE see www.OLNVYK.com for full prescribing information including BOXED warning and important safety information 31 |