這份初步招股説明書中的信息不完整,可能會被更改。在提交給美國證券交易委員會的註冊聲明生效之前,我們不能 出售這些證券。本初步招股説明書不是出售這些證券的要約,我們也不是在 任何不允許要約或出售的州或其他司法管轄區徵求購買這些證券的要約。
完成日期為2023年11月6日
初步招股説明書
18,750,000股

普通股
這是Cargo Treeutics,Inc.普通股的首次公開發行。我們將提供18750,000股我們的普通股,將在此次發行中出售。預計首次公開募股價格將在每股15.00美元至17.00美元之間。
在此次發行之前,我們的普通股還沒有公開市場。我們已申請將我們的普通股在納斯達克全球精選市場上市,代碼為CRGX,此次發行取決於獲得批准。
根據聯邦證券法的定義,我們是一家新興的成長型公司和一家規模較小的報告公司,因此,我們選擇遵守某些降低的上市公司報告要求。
| 每股 | 總計 | |||||||
| 首次公開募股價格 |
$ | $ | ||||||
| 承保折扣和佣金(1) |
$ | $ | ||||||
| 扣除費用前支付給Cargo Treeutics,Inc.的收益 |
$ | $ | ||||||
| (1) | 有關向承保人支付的賠償的説明,請參閲標題為承保的章節。 |
我們已授予承銷商為期30天的選擇權,最多可額外購買2,812,500股我們的普通股。
投資我們的普通股涉及高度風險。請參閲第16頁開始的“風險因素”一節。
證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券或通過本招股説明書的 準確性或充分性。任何與此相反的陳述都是刑事犯罪。
承銷商預計將於 或大約 向購買者交付股票 ,2023年。
| 摩根大通 | 傑富瑞 | TD Cowen | Truist證券 |
, 2023
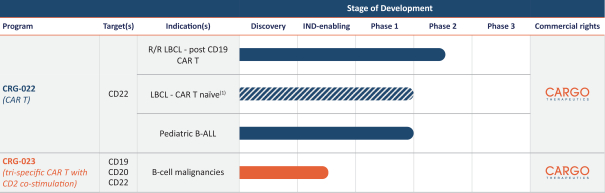



 。第三方研究表明,共刺激結構域的選擇影響CAR T細胞的持久性和記憶表型。包含4-1BB
共刺激結構域與腫瘤模型中嚴重不良事件的頻率降低和臨牀結局改善相關。用於產生CRG-022的CD 22 CAR含有4-1BB共刺激結構域。
。第三方研究表明,共刺激結構域的選擇影響CAR T細胞的持久性和記憶表型。包含4-1BB
共刺激結構域與腫瘤模型中嚴重不良事件的頻率降低和臨牀結局改善相關。用於產生CRG-022的CD 22 CAR含有4-1BB共刺激結構域。 








