

2024 年 1 月公司演示附錄 99.2

前瞻性陳述本 演示文稿包含1995年《私人證券訴訟改革法》中定義的前瞻性陳述,內容涉及替比培南HBr的潛在監管路徑以及 美國食品藥品監督管理局(FDA)可能批准替比培南HBr及其未來價值、可能獲得的里程碑付款和特許權使用費根據葛蘭素史克知識產權 tebipenem HBr 的未來銷售 (No.3) Limited(GSK)許可協議;公司的現金跑道;SPR206 和 SPR720 的未來開發和商業化;可以接受替比培南 HBr 和 SPR720 治療的潛在患者數量以及市場對替比培南 HBr 和 SPR720 的總體需求;替比培南 HBr 的有效性及其對醫療資源利用的潛在影響;預計替比培南可通過付款人渠道獲得廣泛的准入 HBr;預期的 患者治療從靜脈注射轉向口服;開始、時機、進展和結果公司的臨牀前研究和臨牀試驗及其研發計劃,包括管理層對此類結果的 評估;公司臨牀試驗數據可用時間;公司向監管機構申報的時間;產品候選的好處;競爭地位;業務 戰略;管理目標;潛在的增長機會;潛在的市場規模;報銷事項;可能或假設的未來經營業績;預計成本和可用性的額外除任何最初資助的獎勵外,來自 政府機構的非稀釋性資金。在某些情況下,前瞻性陳述可以通過諸如 “可能”、“將”、“應該”、“預期”、“計劃”、 “目標”、“預期”、“可能”、“意圖”、“目標”、“項目”、“考慮”、“相信”、“估計”、“預測”、 “潛力” 或 “繼續” 等術語來識別,或者這些條款或其他術語的否定值類似的表情。本演示文稿中除歷史事實陳述以外的所有陳述均為前瞻性陳述。 公司可能無法實際實現這些前瞻性陳述中披露的計劃、意圖或預期。由於各種因素,實際結果或事件可能與這些 前瞻性陳述中披露的計劃、意圖和預期存在重大差異,包括 FDA 最終是否會批准替比培南 HBr,如果是,任何此類批准的時機;美國食品和藥物管理局是否要求任何額外的臨牀數據或對替比培南氫溴酸的使用施加標籤 限制,這將增加公司成本、推遲批准和/或降低商業用途 tebipenem HBr 的前景;公司對額外資金的需求;漫長的 臨牀藥物開發過程昂貴且不確定;如果獲得批准,公司依賴第三方製造、開發和商業化其候選產品;如果獲得批准,公司候選產品的開發和商業化的能力; COVID-19 疫情的潛在影響;公司留住關鍵人員的能力;臨牀前研究和臨牀試驗中獲得的結果是否表示未來臨牀試驗取得的結果,以及是否 來自公司臨牀試驗的初步數據將預測此類試驗的最終結果;公司對籌集資金的依賴,以及公司的候選產品是否會及時推進 臨牀前開發和臨牀試驗流程,或根本沒有考慮到可能的監管延誤的影響、患者入組慢於預期、製造挑戰、臨牀試驗 設計、臨牀數據要求和臨牀結果等因素;此類臨牀試驗的結果是否值得提交批准來自 FDA或同等外國監管機構;美國食品和藥物管理局和 同等外國監管機構就公司候選產品的開發和商業化做出的決定;公司候選產品的商業潛力;公司 為其候選產品獲得足夠的第三方補償的能力;公司是否將滿足根據其各種許可和合作協議獲得里程碑付款的所有先決條件;BARDA是否選擇行使 這是第二個公司與BARDA協議下的期權;公司實施其戰略計劃的能力;公司為其候選產品獲得、維護和執行知識產權和其他專有權利的能力 ;與市場狀況相關的風險和不確定性;公司的現金資源是否足以為預期時期和/或試驗的持續經營提供資金;以及公司提交的定期報告 “風險因素” 部分中討論的其他因素 與美國證券交易所合作委員會(SEC),以及公司未來可能向美國證券交易委員會提交的其他文件中描述的風險。本演示文稿中包含的 前瞻性陳述代表公司截至本演示文稿之日的觀點。該公司預計,隨後的事件和事態發展將導致其觀點發生變化。但是,儘管 公司可能會選擇在未來的某個時候更新這些前瞻性陳述,但它明確表示不承擔任何更新這些前瞻性陳述的義務。不應依賴這些前瞻性陳述來代表本演示之日後任何日期 的公司觀點。

多元化的臨牀階段產品組合 開發罕見和耐多藥傳染病的療法 SPR720,為短期轉折做好準備。夥伴關係里程碑和現金等價物預計將持續到2025年底 NTM: 非結核分枝桿菌;NTM-PD:非結核分枝桿菌肺病;Tebipenem HBr:氫溴酸替比培南(前身為 SPR994);QIDP: 合格的傳染病產品 1.Winthrop KL 等Ann Am Thorac Soc 2020; 17:178-85。後期開發管線側重於口服、小分子藥物在可解決的患者羣體中需求量高的適應症孤兒藥和/或 QIDP 名稱強大的全球知識產權潛力 非結核分枝桿菌肺病 (NTM-PD) 新型口服一線療法發達市場約有24.5萬名確診患者1 預計在 2024 年下半年未獲批准的一線療法概念驗證收入數據由世界級合作伙伴支持
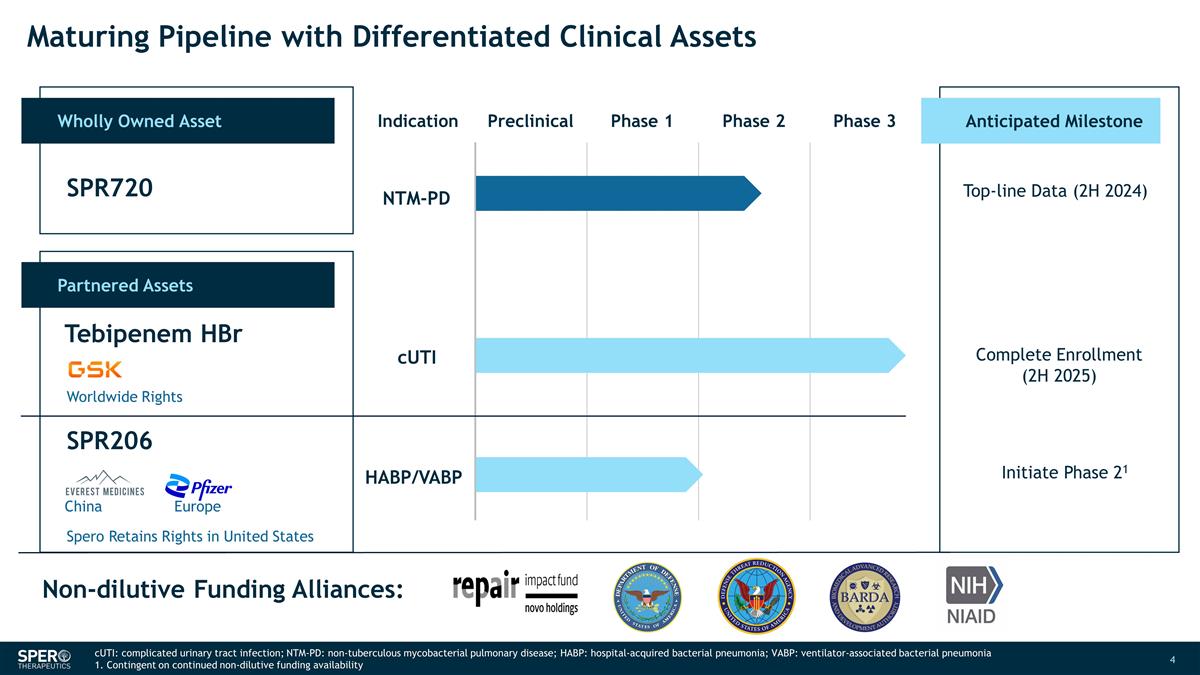
具有差異化 臨牀資產的成熟管道全資資產適應症臨牀前第一階段第二階段第三階段合作資產 SPR720 替比培南 HBR SPR206 預期里程碑 NTM-PD 收入數據(2024 年下半年)完成註冊(2025 年下半年)啟動第 21 階段非稀釋性融資 聯盟:全球權利 Spero 保留在美國的權利 CUTi HABP/VABP 中國歐洲 CUTi:複雜尿路感染;NTM-PD:非結核性分枝桿菌肺病;HABP:醫院獲得性細菌性肺炎;VABP: 呼吸機相關細菌性肺炎 1.視持續的非攤薄資金供應情況而定
SPR720
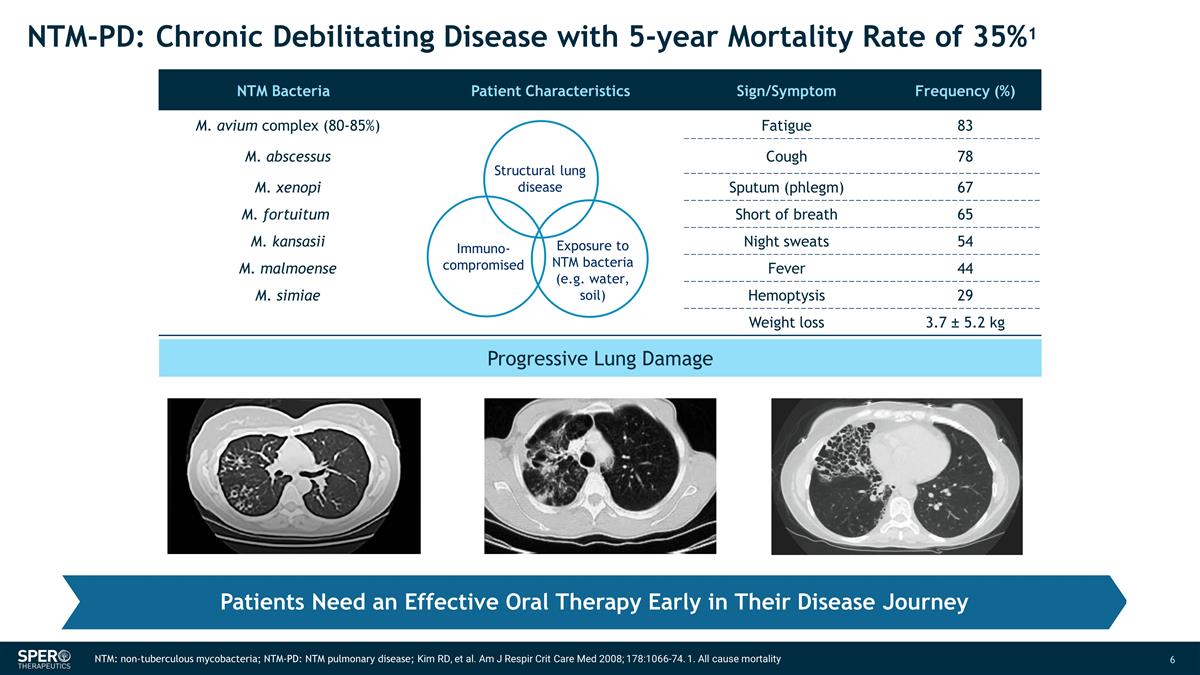
進行性肺損傷 NTM: 非結核分枝桿菌;NTM-PD:NTM 肺部疾病;Kim RD 等人Am J Respir Crit Care Med 2008;178:1066-74。1.所有原因死亡患者在疾病旅程的早期都需要有效的口服治療 NTM-PD:慢性衰弱 疾病,5 年死亡率為 35% 1 NTM 細菌患者特徵體徵/症狀頻率 (%) m. avium complex (80-85%) 疲勞 83 M. 膿腫咳嗽 78 M. xenopi 痰(痰)67 M. fortuitum 呼吸急促 65 M. kansasii 夜間盜汗 54 M. malmoense Fever 44 M. simiae Heoptysis 29 減肥 3.7 ± 5.2 kg 結構性肺部疾病暴露於 NTM 細菌(例如水、土壤)免疫受損
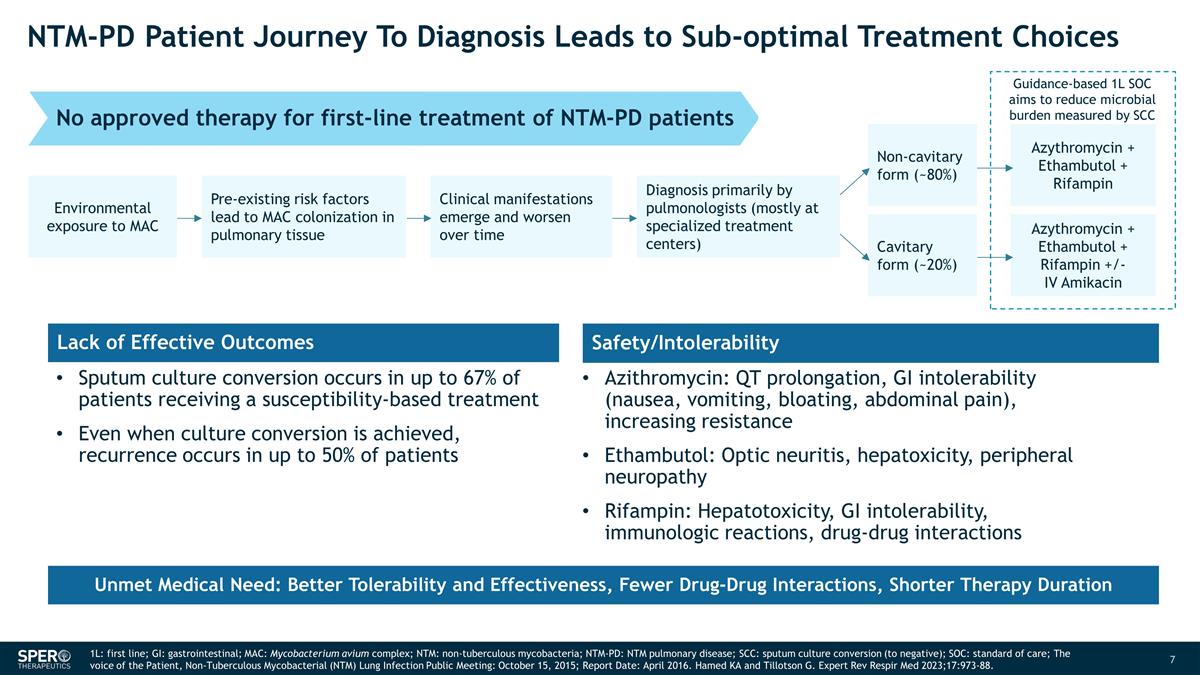
NTM-PD 患者的診斷之旅 導致次優治療選擇基於指南的 1L SOC 旨在減輕微生物負擔 MAC 的環境暴露會導致 MAC 在肺組織中定植臨牀表現和 隨着時間的推移而惡化主要由肺科醫生(主要在專業治療中心)非空洞形式(約 80%)空腔形式(約 20%)阿齊黴素 + 乙胺素丁醇 + 利福平阿齊黴素 + 乙胺丁醇 + 利福平 +/-IV 阿米卡星痰液培養 轉化率高達 67%接受敏感性治療的患者中,即使實現培養轉化,仍有高達 50% 的患者會復發。缺乏有效療效安全性/不耐受性阿奇黴素:QT 延長、胃腸道不耐受(噁心、嘔吐、腹脹、腹痛)、耐藥性增強 Ethambutol:視神經炎、肝毒性、周圍神經病變利福平:肝毒性、胃腸道不耐受可行性、免疫學反應、藥物 相互作用未獲批准用於一線治療 NTM-PD 患者未獲批准的療法未滿足的醫療需求:更好的耐受性和有效性,更少的藥物相互作用,更短的治療時間 1L:一線;GI:胃腸道;MAC: 鳥分枝桿菌複合物;NTM:非結核分枝桿菌;NTM-PD:NTM 肺部疾病;SCC:痰培養轉換(陰性);SOC:護理標準;患者的聲音,非結核分枝桿菌(NTM)肺部感染 公開會議:2015 年 10 月 15 日;報告日期:2016 年 4 月。Hamed KA 和 Tillotson G. Expert Rev Respir Med 2023;17:973-88。
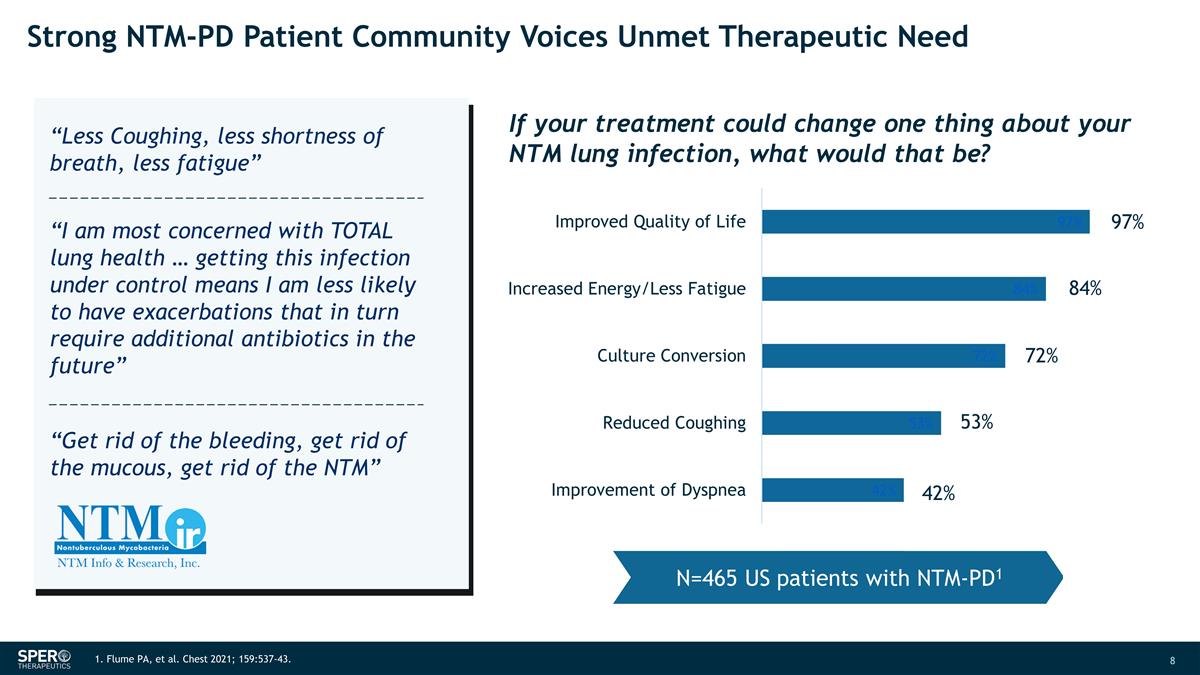
NTM-PD 患者社區的強烈聲音 未滿足的治療需求 97% 84% 72% 53% 42% 42% 1.Flume PA 等人胸部 2021;159:537-43。N=465 名 NTM-PD1 美國患者如果你的治療可以改變你的 NTM 肺部感染的一件事,那會是什麼?“減少咳嗽,減少 呼吸急促,減少疲勞” “我最關心的是肺部的整體健康... 控制這種感染意味着我將來不太可能出現需要額外抗生素的發作” “擺脱 出血,清除粘液,清除 NTM”
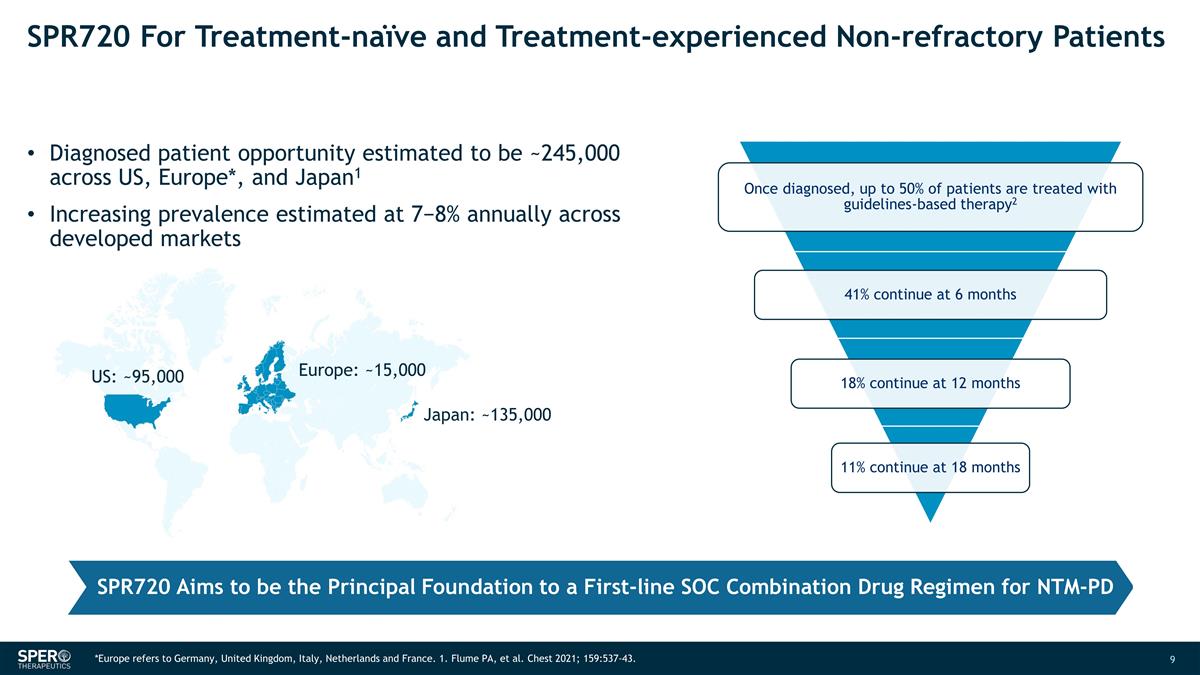
SPR720 適用於未接受治療和 經歷過治療的非難治性患者在美國、歐洲*和日本確診的患者機會約為24.5萬人1 發達市場的患病率估計每年增長 7−8% 歐洲:~15,000 日本:~135,000 美國: ~95,000 SPR720 旨在成為 NTM-PD 一線 SOC 聯合藥物方案的主要基礎 *歐洲是指德國、英國、意大利,荷蘭和法國。1.Flume PA 等人胸部 2021;159:537-43。

SPR720 在一線環境中完全有能力滿足未得到滿足的 患者需求 M.:分枝桿菌;MAC:M. avium 複合物;NTM:非結核分枝桿菌;SOC:護理標準;QIDP:合格的傳染病產品;1.Brown-Elliott BA 等Antimicrob Agents Chemother。2018 62: e01503-18. 2.同上,3。Aragaw WW 等人Microbiol Spectr 2022;10:e0132121。改善一線 SOC 方案對多種 NTM 病原體(包括 MAC 和 M. abscessuss)的效力1 新的作用機制有證據表明對 上市的抗生素有交叉耐藥性2且選擇耐藥性的傾向低3 迄今為止的數據支持療效、巨噬細胞滲透率和安全性/耐受性的潛在支持可通過 2033 授予的孤兒藥與食物成分專利一起使用稱號和 QIDP 名稱
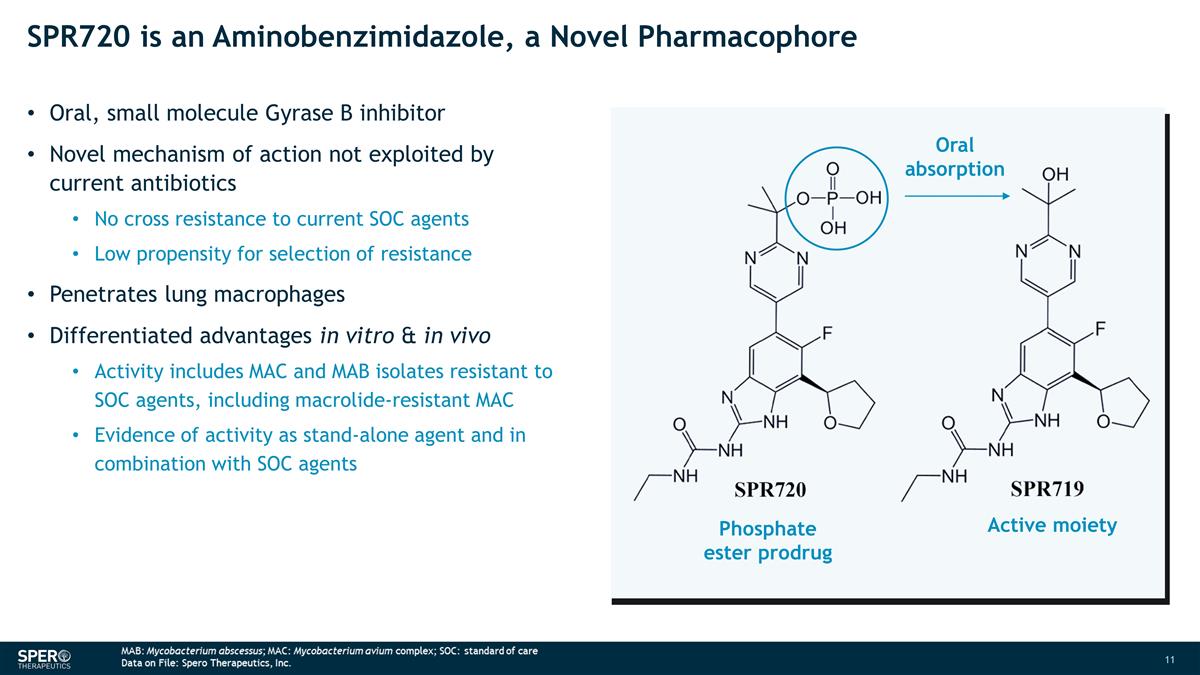
SPR720 是一種氨基苯並咪唑,一種 新型藥效團口服、小分子 Gyrase B 抑制劑當前抗生素未利用的新作用機制對當前 SOC 藥物沒有交叉耐藥性低選擇耐藥傾向低穿透肺巨噬細胞 體外和體內的差異化優勢活性包括 MAC 和 MAB 分離物對大環內酯類藥物具有耐藥性,包括耐大環內酯的 MAC 和 MAB 分離物作為獨立藥物的活性證據與 SOC 藥物聯合使用磷酸酯 前藥活性部分口服吸收
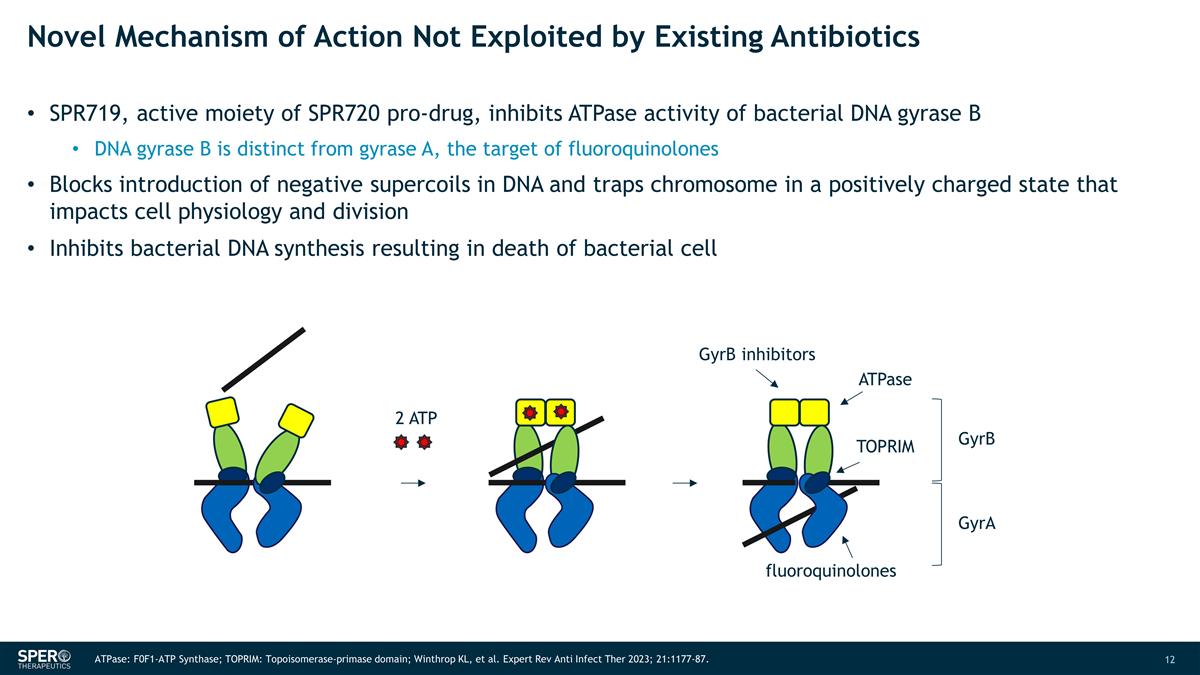
未被現有抗生素利用的新作用機制 SPR719 是 SPR720 前藥的活性部分,可抑制細菌 DNA 迴旋酶 B 的 ATPase 活性 DNA 迴旋酶 B 與迴旋酶 A 不同,氟喹諾酮類藥物的靶標阻止 DNA 中負超線圈的引入,將染色體困在正電荷狀態,從而影響細胞生理和分裂抑制細菌 DNA 合成導致細菌死亡細胞 2 ATP GyrB 抑制劑 ATPase TOPRIM 氟喹諾酮類 gyrB gyrA ATPase:F0F1-ATP 合成酶;TOPRIM:拓撲異構酶-primase primase域;Winthrop KL 等Expert Rev Anti Infect Ther 2023;21:1177-87。
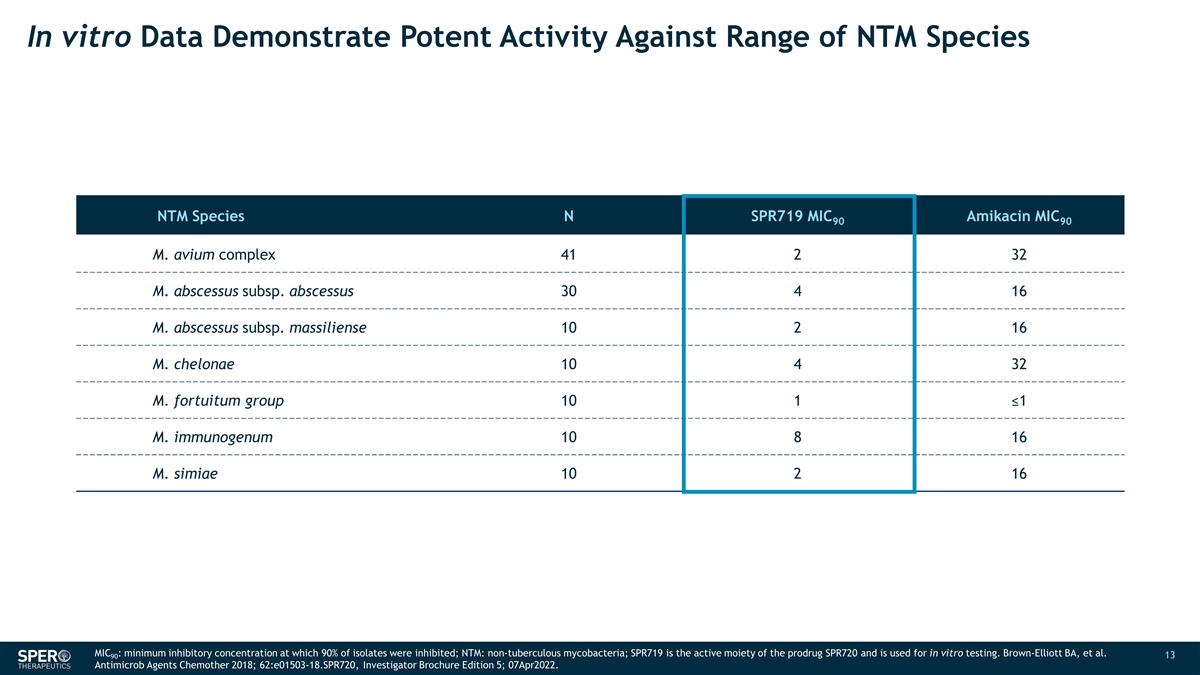
體外數據顯示 對一系列 NTM 物種 N SPR719 MIC90 Amikacin MIC90 M. avium 複合體 41 2 32 M. abscessus subsps. abscessus subscessus subsps。massiliense 10 2 16 M. chelonae 10 4 32 M. fortuitum 組 10 1 ≤1 M. 免疫原 10 8 16 M. simiae 10 2 16 M. chelonae 10 4 32 M. 2 16 MIC90:最低抑制濃度,90% 的分離物受到抑制;NTM:非結核分枝桿菌;SPR719 是前藥 SPR720 的活性部分,用於體外試驗。 Brown-Elliott BA,等Antimicrob Agents Chemother 2018;62:e01503-18.spr720,研究者手冊第 5 版;2022年4月7日。
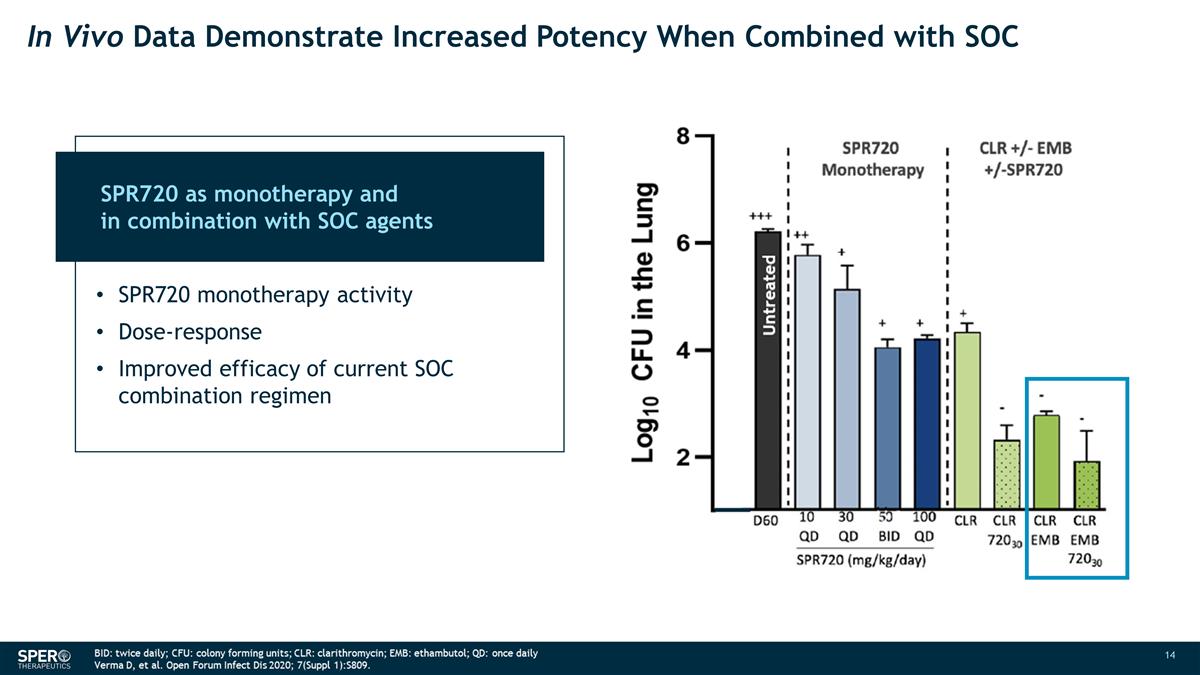
體內數據表明,與 SOC 聯合使用未經治療的 SPR720 作為單一療法以及與 SOC 藥物聯合使用時, 效力會提高 SPR720 單一療法活性劑量反應當前 SOC 組合方案的療效得到改善
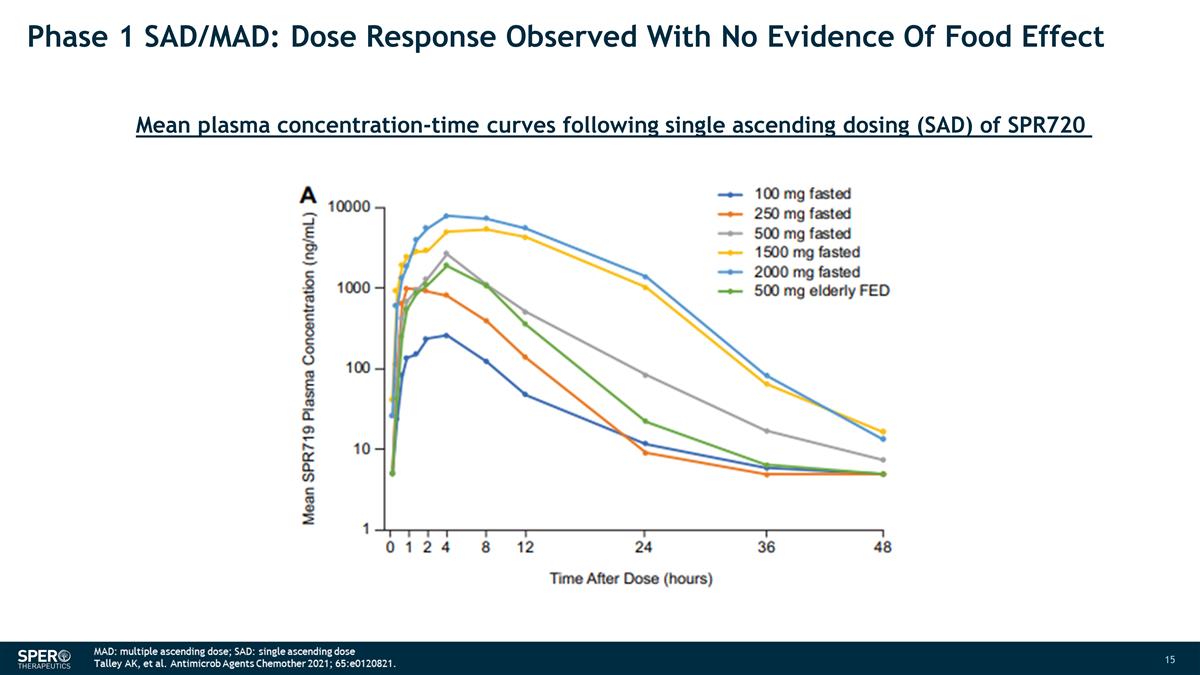
第 1 階段 SAD/MAD:在沒有食物效應證據的情況下觀察到劑量反應 SPR720 單次上升劑量 (SAD) 後的平均血漿濃度時間曲線

第 1 階段 SAD/MAD:良好的 安全性/耐受性概況 500 mg 和 1000 mg 劑量在 7 天和 14 天內進行了評估。血漿暴露的劑量依賴性增加未報告 SAE;劑量 ≥ 1500 mg 時出現輕度胃腸道症狀一次停藥:無症狀、可監測和可逆的 2 級胰腺酶 升高 1 期結果顯示 SPR720 耐受性良好,暴露量高於預期的治療水平
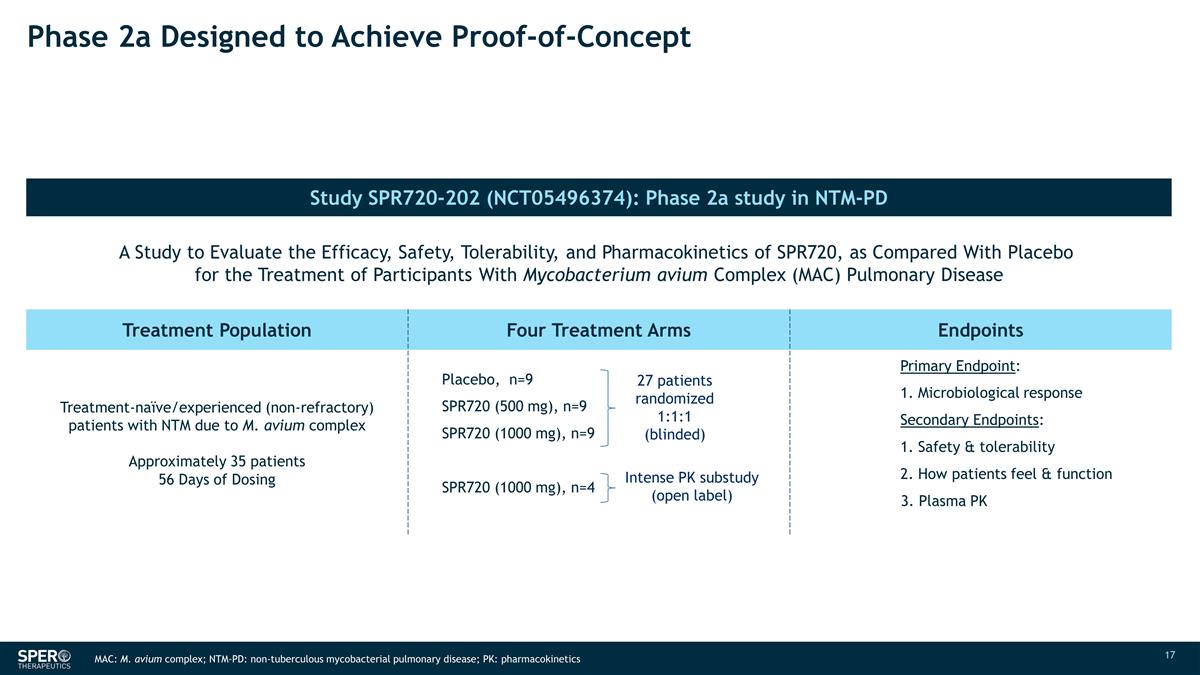
2a 期旨在實現 概念驗證研究 SPR720-202 (NCT05496374):NTM-PD N SPR719 MIC50 的 2a 期研究旨在評估 SPR720 與安慰劑相比,用於治療 航空分枝桿菌複合物 (MAC) 肺部疾病參與者的療效、安全性、耐受性和藥代動力學 30 2 治療羣體四個治療組終點治療——天真/有經驗(非難治性)患者大約 35 名患者服用 安慰劑量 56 天,n=9 SPR720(500 mg),n=9(500 mg),n=9 SPR720(1000 mg),n=9(1000 mg),n=9 SPR720 (1000 mg),n=4 主要終點:1。微生物反應次要終點:1. 安全性和耐受性 2.患者的感覺和功能 3.血漿 PK 27 名患者隨機 1:1:1(失明)強度 PK 子研究(開放標籤)MAC:M. avium 複合物;NTM-PD:非結核分枝桿菌肺部疾病;PK: 藥代動力學

預計將在 2024 年下半年推出綜合數據集 我們預計將有一個強大的數據集為 SPR720 作為 NTM-PD 微生物反應一線療法的註冊路徑提供信息,以證明患者報告的結局具有抗 NTM 活性,為 後期試驗中的主要終點提供信息 患者藥代動力學來自支氣管肺泡灌洗 (BAL) 研究的肺內 PK,健康志願者確定共同給藥 SPR720 的 PK,azithromythromythromythromy{ br} 健康志願者體內的素和乙胺丁醇確認了先前研究中證實的安全性/耐受性MAC:M. avium 複合物;NTM-PD:非結核分枝桿菌肺部疾病;PK:藥代動力學
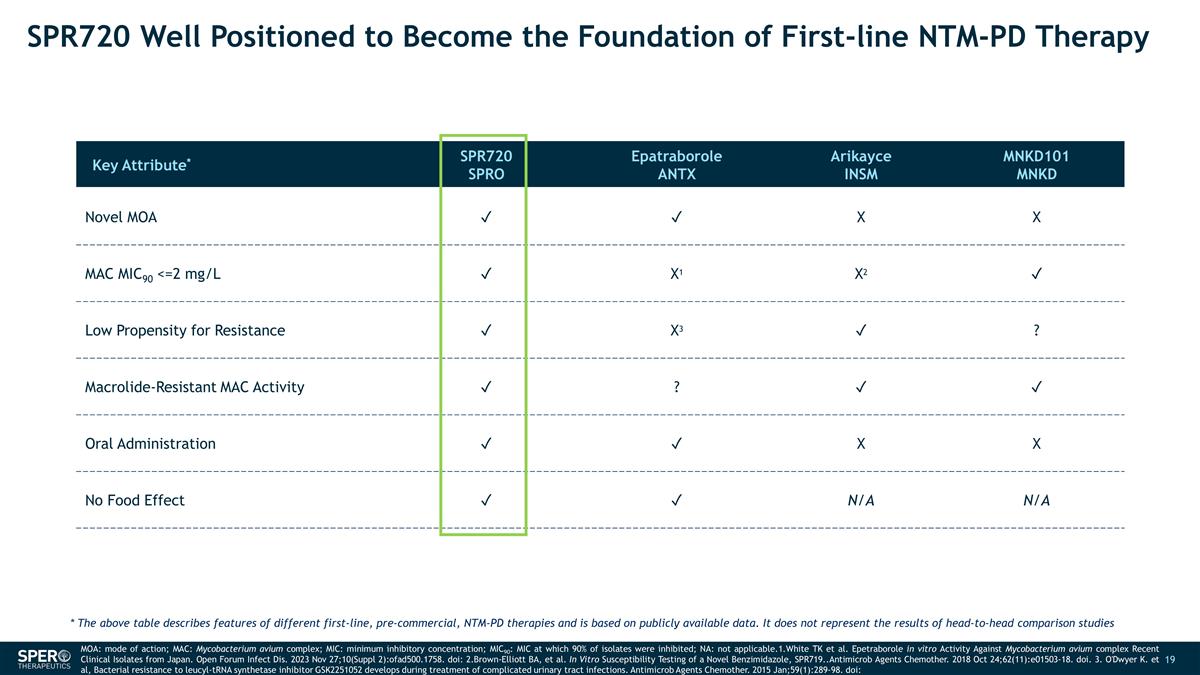
SPR720 完全有能力成為 一線 NTM-PD 療法的基礎關鍵屬性* SPR720 SPRO Epatraborole ANTX Arikayce INSM MNKD101 MNKD Novel MOA ✓ ✓ X X MAC MIC90
替比培南 HBr 口服 碳青黴烯
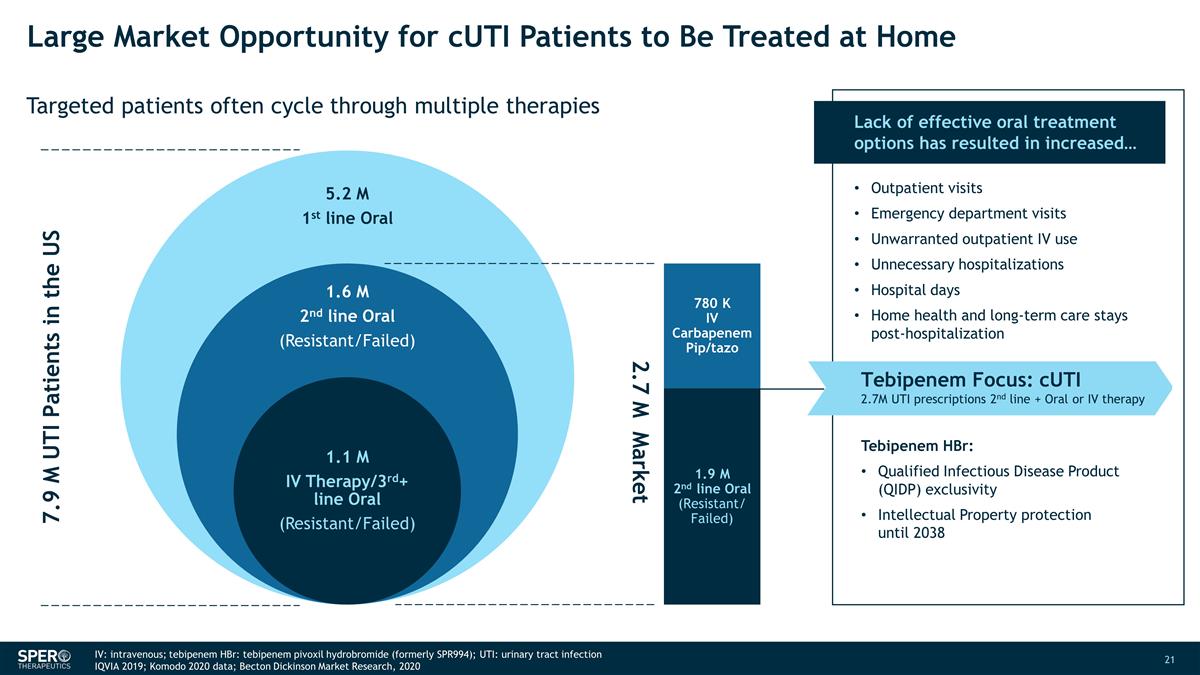
CUTi 患者在家接受治療的巨大市場機會靶向患者經常循環使用多種療法 790 萬名美國尿路感染患者 270 萬市場 780 K IV Carbapenem pip/Tazo 190 萬二線口服(耐藥/失敗)缺乏有效的口服治療選擇 導致... 門診就診急診室就診不必要的門診靜脈注射不必要的住院天數家庭健康和長期住院住院後繼續護理 Tebipenem Focus:CUTi 270 萬 UTI 處方二線 + 口服或靜脈注射療法替比培南 HBr:合格傳染病產品(QIDP)專屬權2038年前的知識產權保護 IV:靜脈注射;替比培南 HBr:氫溴酸替比培南(前身為 SPR994); UTI:尿路感染 IQVIA 2019;Komodo 2020 年數據;Becton Dickinson 市場研究,2020

Tebipenem HBr:如果獲得批准,可能有 CUTi的差異化口服療法潛在的首次上市口服碳青黴烯第三期註冊全球商業合作伙伴關係門診環境中複雜尿路感染的潛在治療除了傳染性 疾病專家以外的廣泛處方者基礎廣泛的處方者基礎廣泛的處方者基礎 2038 年 QIDP 認證獲美國食品藥品管理局特別協議評估 (SPA) 註冊批准的 PIVOT-PO 試驗方案始於 2023 年第四季度的 “第一位患者,第一劑量” 將全球商業權 外包給葛蘭素史克穩健的財務條款,包括潛力開發、監管和商業里程碑以及分級銷售特許權使用費 CUTi:複雜尿路感染;IP:知識產權;tebipenem HBr:tebipenem pivoxil 氫溴酸替比培南 (前身為 SPR994);QIDP:合格的傳染病產品
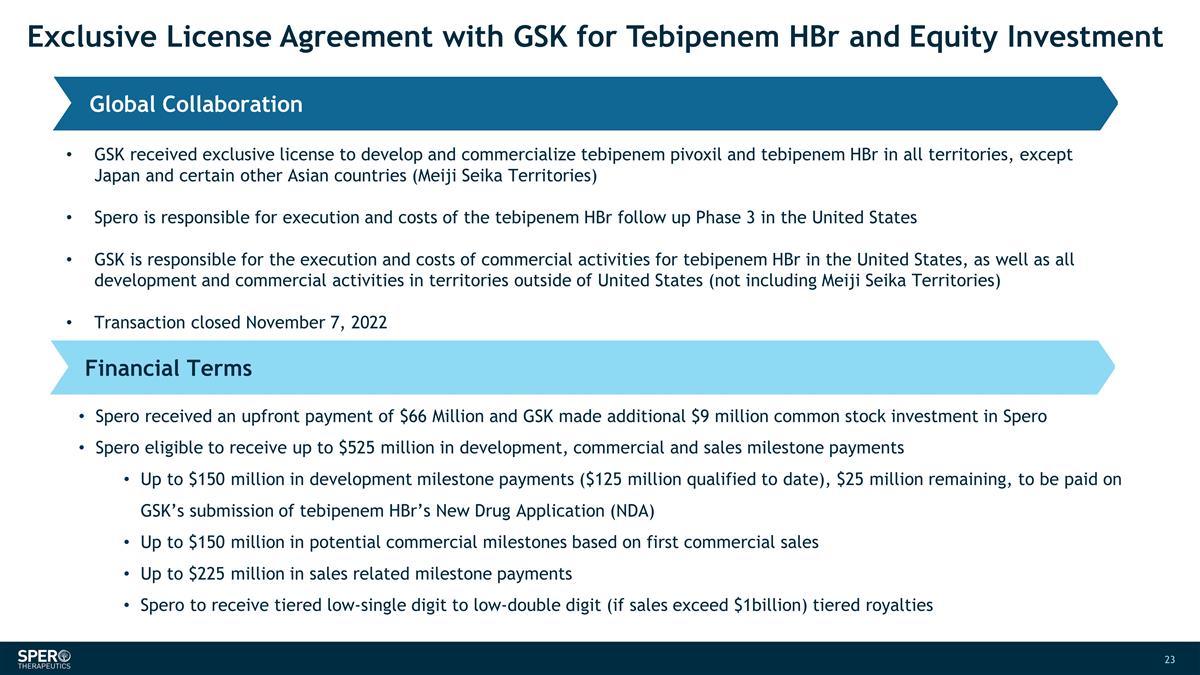
與 葛蘭素史克簽訂的 Tebipenem HBr 和股權投資獨家許可協議全球合作財務條款葛蘭素史克獲得了在除日本和某些其他亞洲國家以外的所有地區開發和商業化替比培南 pivoxil 和 tebipenem HBr 的獨家許可協議 (明治精工地區)Spero 負責美國替比培南 HBr 後續第 3 階段的執行和費用葛蘭素史克是負責 tebipenem HBr 在美國的商業活動的執行和成本,以及 以及所有開發和商業活動在美國以外地區(不包括明治精工領地)的活動交易於2022年11月7日結束 Spero收到了6600萬美元的預付款,葛蘭素史克向Spero額外投資了900萬美元 普通股,有資格獲得高達5.25億美元的開發、商業和銷售里程碑款項(迄今為止符合條件的1.25億美元),剩餘2500萬美元,將是 根據葛蘭素史克提交替比培南 HBr 的新藥申請 (NDA) 付費。潛在投資額高達1.5億美元基於首次商業銷售的商業里程碑高達2.25億美元的銷售相關里程碑付款 Spero 將獲得分級 從低個位數到低兩位數(如果銷售額超過10億美元)的分層特許權使用費

三期臨牀試驗 PIVOT-PO: 關鍵設計經美國食品藥品管理局談判達成特別協議評估協議(SPA):美國食品藥品管理局表示,PIVOT-PO的積極和有説服力的結果以及先前完成的研究,可能足以支持批准替比培南 HBr 作為 CUTi(包括腎盂腎炎)的治療藥物,用於有限用途適應症研究 Tebipenem HBr(NCT06059846):3期臨牀試驗 CUTi N SPR719 MIC50 A 3 期試驗,旨在評估口服 療效和安全性的隨機、雙盲、雙假人、多中心研究與靜脈注射亞胺培南-西拉斯汀相比,在複雜尿路感染 (CUTi) 或急性腎盂腎炎 (AP) 的患者中給藥 Tebipenem Pivoxil (tbp-PI-HBR) 30 2 治療 人羣兩個治療組終點被診斷為 cUTi 或 AP 的患者大約 2648 名患者(按年齡、基線診斷等分層)7-10 天劑量 1.TBP-PI-HBR(600 mg)口服和 “虛擬” 靜脈輸液,每 6 小時一次,第 1-10 天(n=1324)2。亞胺培南-西拉斯汀(500 mg)靜脈注射和相應的 “假人” 片劑,每 6 小時口服一次,第 1-10 天,(n=1324)主要終點:1。微型 ITT 人羣中 TOC 的總體反應初步分析:1. 評估微型ITT人羣的非劣勢(NI),基於10%的NI利潤率 AP:急性腎盂腎炎;cUTi:複雜尿路感染;tbp-pi-HBR/Tebipenem HBR:氫溴酸替比培南(前身為 SPR994)
SPR206 直動式 IV 增壓器

SPR206:正在進行的臨牀 開發有可能解決尚未滿足的重大需求 SAD/MAD 1 期試驗在預測的治療劑量水平下沒有腎毒性的證據支氣管肺泡灌洗 1 期試驗耐受性良好評估和實現的肺部暴露量與預測的治療水平一致臨牀前 研究支持提高療效除了傳統抗生素和潛在的單一藥物活性之外,腎功能損害 1 期試驗在後續試驗中支持對受腎功能差異影響的患者進行腎臟劑量 ✓ ✓ ✓ ✓ 2 期 HABP/VABP 概念驗證研究:IND 於 2023 年第四季度提交 ✓ SPR206 有可能滿足對耐碳青黴烯類病原體耐受性良好、有效的單藥治療未得到滿足的需求 當前的護理標準涉及以下藥物組合:通常與腎毒性有關 HABP: 醫院獲得性細菌性肺炎;MAD:多次遞增劑量;SAD:單次遞增劑量;VABP:呼吸機相關細菌性肺炎 1。Bruss J 等人。Antimicrob Agents Chemother 2021;65: e0073921. 2.Rodvold KA 等。Antimicrob Agents Chemother 2023;67:e0042623。3.Bruss JB 等Antimicrob Agents Chemother 2023;67:e0050523。

領導團隊 Timothy Keutzer 首席運營官此前是 Spero 的首席開發官,前任項目和投資組合管理副總裁,Cubist 擁有豐富的抗生素開發經驗,從臨牀前到獲批在製藥 行業工作超過 30 年 James Brady 首席人力資源官曾在 UniQure Therapeutics 任首席人力資源官;Intarcia Therapeutics 人力資源副總裁 30 多年的高級人力資源領導經驗,在生命科學領域工作超過 17 年 Sath Shukla 總裁兼首席執行官前首席財務官在 Spero Therapeutics 任職;Ziopharm Oncology 前首席財務官;Vertex 副總裁兼全球企業融資主管 20 多年的財務領導經驗,曾在商業和臨牀 公司任職 Tamara Joseph,JD,LLM 首席法務官在生物技術領域擁有 20 多年的領導和法律經驗,包括美倫多療法、Enzyvant Therapeutics、Invivo Therapeutics 和 Cubist 等多家生物技術公司的總法律顧問 Kamal Hamed,醫學博士、公共衞生碩士、工商管理碩士首席醫學官前首席營銷官(Lysovant Sciences)、開發與醫療主管事務(巴西利亞)治療領域負責人(諾華)領導了抗菌藥、抗病毒藥物、抗瘧藥和抗真菌藥物的各種抗感染臨牀 開發項目 Esther Rajavelu 在製藥行業工作超過 20 年,首席財務官首席商務官在生命科學領域擁有二十多年的經驗, 將股票研究、投資銀行、戰略諮詢和併購相結合。曾任過 Fulcrcr首席財務官療法。瑞銀、奧本海默和德意志銀行的高級股票研究分析師。美國銀行的醫療保健投資銀行家。 *商標是其各自所有者的財產

謝謝