

正在進行的paltusotine類癌綜合徵開放標籤2期研究的初步結果一項評估類癌綜合徵受試者帕圖索汀治療的安全性、藥代動力學和劑量反應的隨機平行小組研究表現為99.2

安全港聲明本演示文稿包含前瞻性陳述。Crinetics Pharmicals, Inc.(“Crinetics”、“公司”、“我們” 或 “我們的”)提醒您,本陳述中包含的有關非歷史事實事項的陳述是前瞻性陳述。這些陳述基於公司當前的信念和期望。此類前瞻性陳述包括但不限於以下方面的陳述:帕圖西汀和 CRN04894 的臨牀開發計劃和時間表,包括其治療潛力和臨牀益處或安全性;正在進行的肢端肥大症帕圖西汀第 3 期臨牀研究和類癌綜合徵帕圖西汀第 2 期研究的預期發佈時間;提交新藥申請的預期時間 paltusotine 用於治療肢端肥大症及相關的開放標籤延長研究;帕曲索汀治療類癌綜合徵第二階段研究全部結果的計劃和時機,並與美國食品藥品管理局共享結果,以協調和設計第三期計劃;進一步開發類癌綜合徵中的帕圖索汀或對類癌綜合徵中的帕圖索汀進行3期研究的計劃和時機;我們正在進行的任何臨牀研究都可能顯示出安全性或有效性;以及我們確定和開發新候選藥物的計劃用於其他疾病。在某些情況下,您可以用 “可能”、“相信”、“預期”、“可能”、“應該”、“估計”、“預期”、“打算”、“計劃”、“項目”、“將”、“考慮”、“繼續”、“預測”、“抱負”、“目標”、“潛力”、“目標” 或負面因素等術語來識別前瞻性陳述其他類似的術語。這些陳述僅代表截至本陳述之日,涉及已知和未知的風險、不確定性、假設和其他重要因素,這些因素可能導致我們的實際業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異,包括但不限於:在對與臨牀研究相關的數據進行更全面的審查後,我們報告的標題和初始數據可能會發生變化,此類數據可能無法準確反映完整情況臨牀研究的結果以及美國食品藥品管理局和其他監管機構可能不同意我們對此類結果的解釋;臨牀前研究或臨牀研究的初步結果不一定能預測最終結果,在對數據進行更全面的審查之後,隨着患者入組的繼續,以及隨着更多患者數據的出現,可能出現不利的新臨牀數據和對現有臨牀數據的進一步分析,一項或多項臨牀結果可能會發生重大變化;開始、註冊和完成臨牀研究並報告相關數據;在批准新藥申請或適用的外國監管批准之前,美國食品藥品管理局或其他監管機構可能要求對帕曲索汀進行額外的臨牀研究,或者建議修改我們計劃中的3期臨牀研究;國際衝突可能會干擾我們以及我們所依賴的第三方的業務,包括延遲或以其他方式擾亂我們的臨牀研究和臨牀前研究、生產和供應連鎖或削弱員工的工作效率;我們在產品製造、研究、臨牀前和臨牀測試方面對第三方的依賴;我們對帕曲西汀的臨牀研究、非臨牀研究和臨牀前研究的成功;美國和國外的監管發展或價格限制;我們的候選產品的意外不良副作用或療效不足,可能會限制其開發、監管批准和/或商業化;我們獲得和維護知識產權的能力保護我們的候選產品;我們可能比預期更快地使用我們的資本資源;以及我們不時向美國證券交易委員會(“SEC”)提交的文件中在 “風險因素” 標題下描述的其他風險。由於前瞻性陳述本質上會受到風險和不確定性的影響,其中一些無法預測或量化,有些則超出了我們的控制範圍,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中的預測存在重大差異。本警示聲明根據1995年《私人證券訴訟改革法》的安全港條款對所有前瞻性陳述進行了全面限定,除非適用法律要求,否則我們不打算公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化還是其他原因。本演示文稿還包含獨立各方和我們對潛在患者和潛在市場規模的估計。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。

當每日口服帕圖索汀在類癌綜合徵患者中顯示出強勁的初步結果安全性帕圖索汀耐受性良好,沒有嚴重或嚴重的治療相關不良事件,與先前的研究一致。總體PK總體上與健康志願者的預期一致,40mg和80mg藥代動力學藥代動力學療效安全性概況和療效已進入類癌綜合徵的3期研究(待獲得完整數據,預計 2024 年上半年)✓ ✓ ✓

類癌綜合徵是一種嚴重的疾病,患者需要更好的治療選擇肺胰腺神經內分泌腺腫瘤 5-HT + 其他因素類癌綜合徵 ~33,000 名被診斷患有類癌綜合徵的患者(美國)類癌綜合徵患者面部潮紅由醫學博士斯蒂芬·戈德芬格提供,排便過多(>3 天)會造成嚴重的破壞性目標:減少頻率和緊迫性(正常值為 ≤3 天)嚴重的潮紅髮作可能使人衰弱並具有潛在危險目標:降低頻率和嚴重性(正常值為

隨機治療階段 (RTP) 篩查基線長期延長 40 或 80 或 120 mg 帕圖索汀 80 mg 帕圖西汀 40 mg 帕圖索汀 R 隨機分配至 40 mg 或 80 mg/d 0d w2 w4 w8 +/-40 mg 劑量調整必要時不改變劑量 w58 EoT 關鍵資格標準:治療天真或目前未接受治療且症狀活躍 — 或者 — 受 SRL 治療和症狀控制洗完治療後會惡化。SSTR 陽性 1 級或 2 級 NET 2 期研究設計:評估帕圖索汀在類癌綜合徵患者中的安全性、PK 和療效方案:8 周、開放標籤、平行、隨機 2 劑量研究,然後長期延長 40、80 和 120 mg 劑量帕圖西汀次要終點藥代動力學探索性終點排便和沖洗頻率、奧曲肽救援用量、生物標誌物、糞便稠度、腹痛,PRO 測量 1 2 SSTR = 生長抑素受體;SRL = 生長抑素受體配體 EoT = 治療結束;PRO = 患者報告的預後 -7d 沖洗/惡化 SRL 未接受治療的參與者
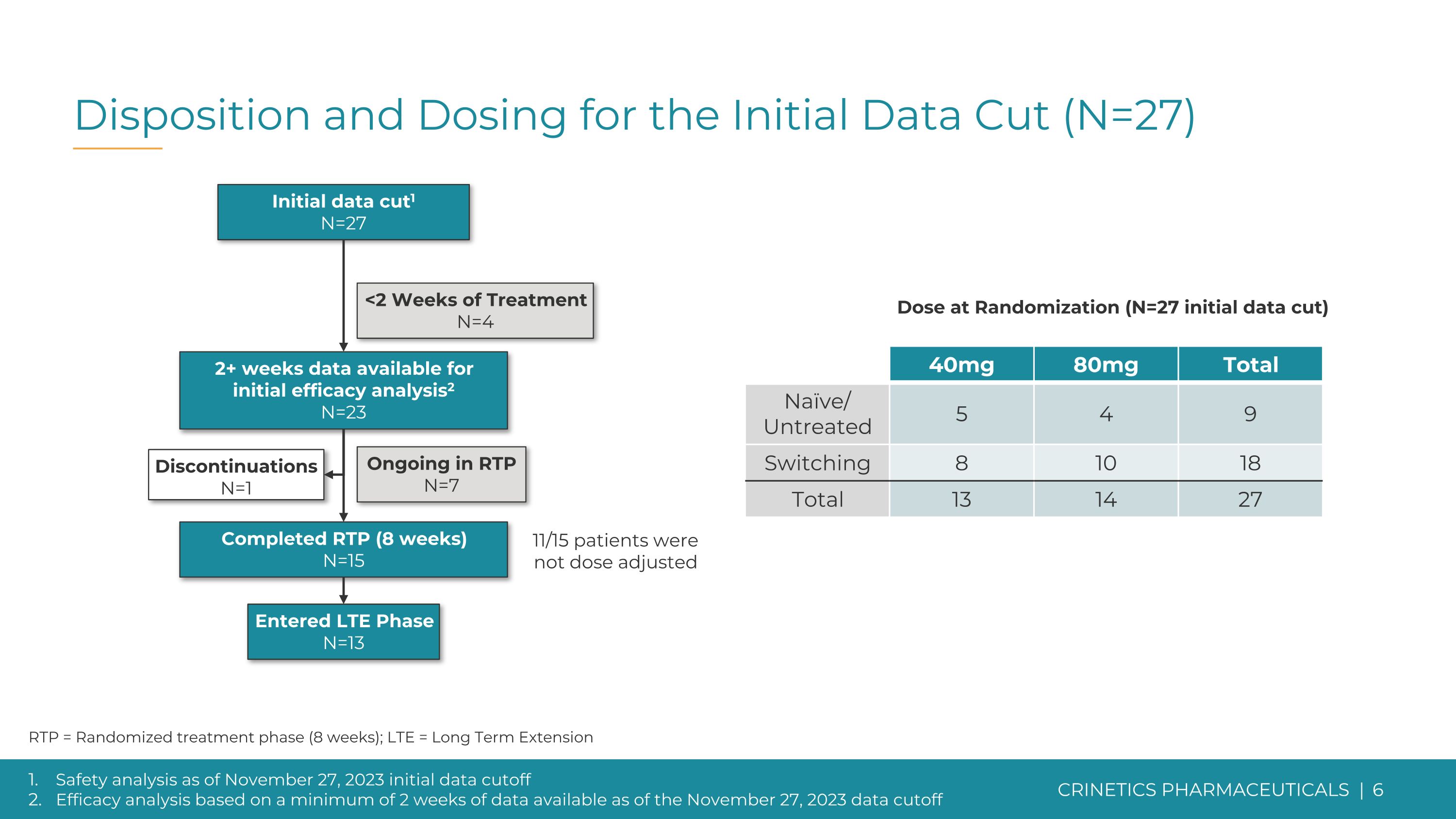
截至2023年11月27日初始數據截止的處置和劑量(N=27)安全性分析初始數據截止時間根據截至2023年11月27日至少2周的可用數據進行功效分析 RTP = 隨機治療階段(8 周);LTE = 長期延期中止 N=1 初始數據切斷1 N=27 已完成 RTP(8 周)N=15 已進入 LTE 階段 N=15 13 在 RTP 中持續 N=7 2 周以上的數據可供初始療效分析2 N=23 40mg 80mg 總計 Naive/未治療 5 4 9 切換 8 10 18 總計 13 14 27 隨機分組的劑量(N = 27初始數據剪切)
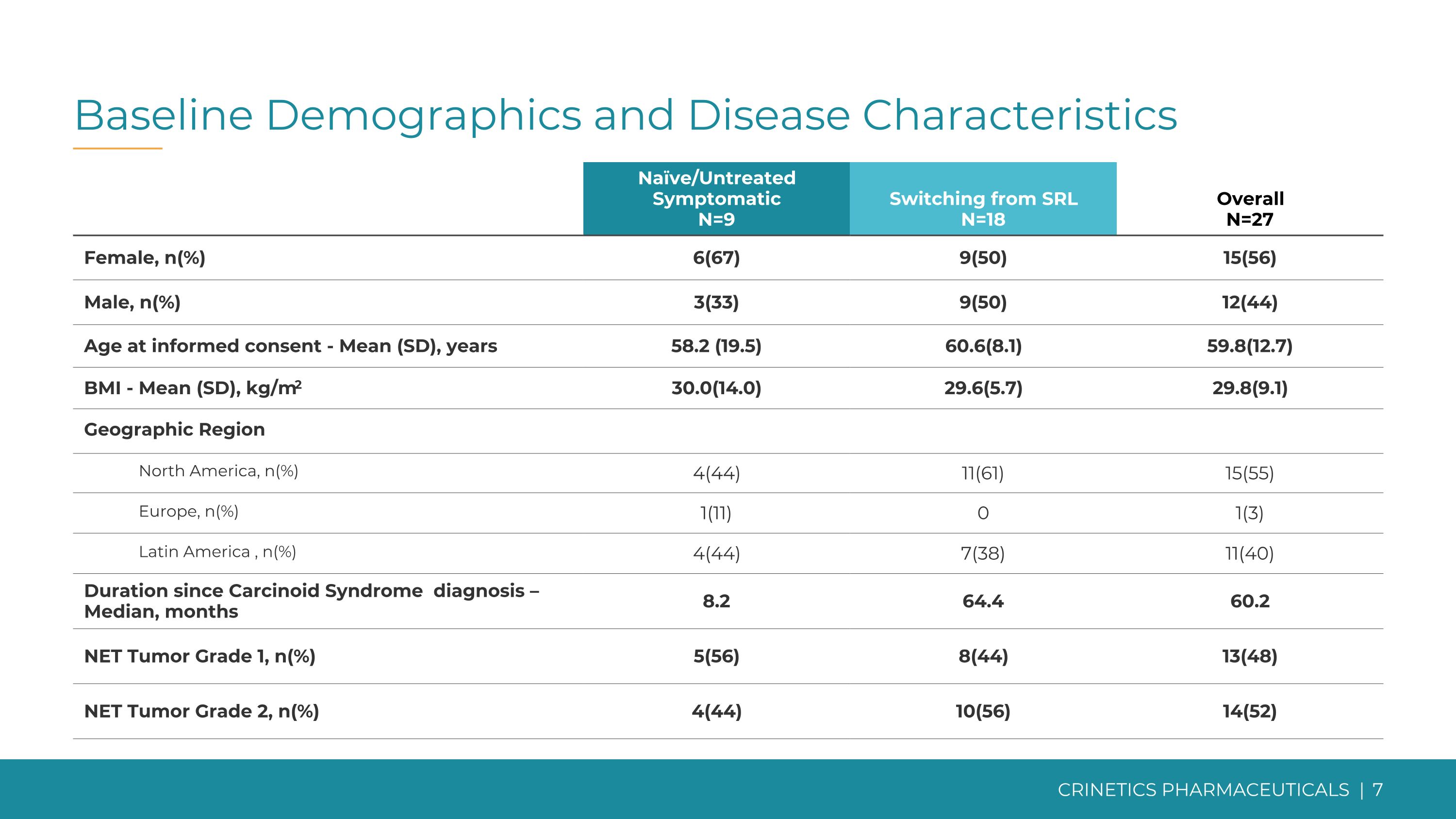
基線人口統計學和疾病特徵天真/未經治療的症狀 N=9 從 SRL 切換 N=18 總體 N=27 女性,n (67) 9 (50) 15 (56) 男性,n (%) 3 (33) 9 (50) 12 (44) 知情同意時的年齡——平均值 (SD),58.2 (19.5) 60.6 (8.1) 59.8 (12.7) 體重指數——平均值 (SD),kg/m2 30.0 (14.0) 29.6 (5.7) 29.8 (9.1) 地理區域北美,n (%) 4 (44) 11 (61) 15 (55) 歐洲,n (%) 1 (11) 0 1 (3) 拉丁美洲,n (%) 4 (44) 7 (38) 11 (40) 自類癌綜合徵診斷以來的持續時間 — 中位數,8.2 64.4 60.2 NET 腫瘤等級 1,n (%) 5 (56) 8 (44) 13 (48) NET 腫瘤等級 2,n (%) 4 (44) 10 (56) 14 (52)
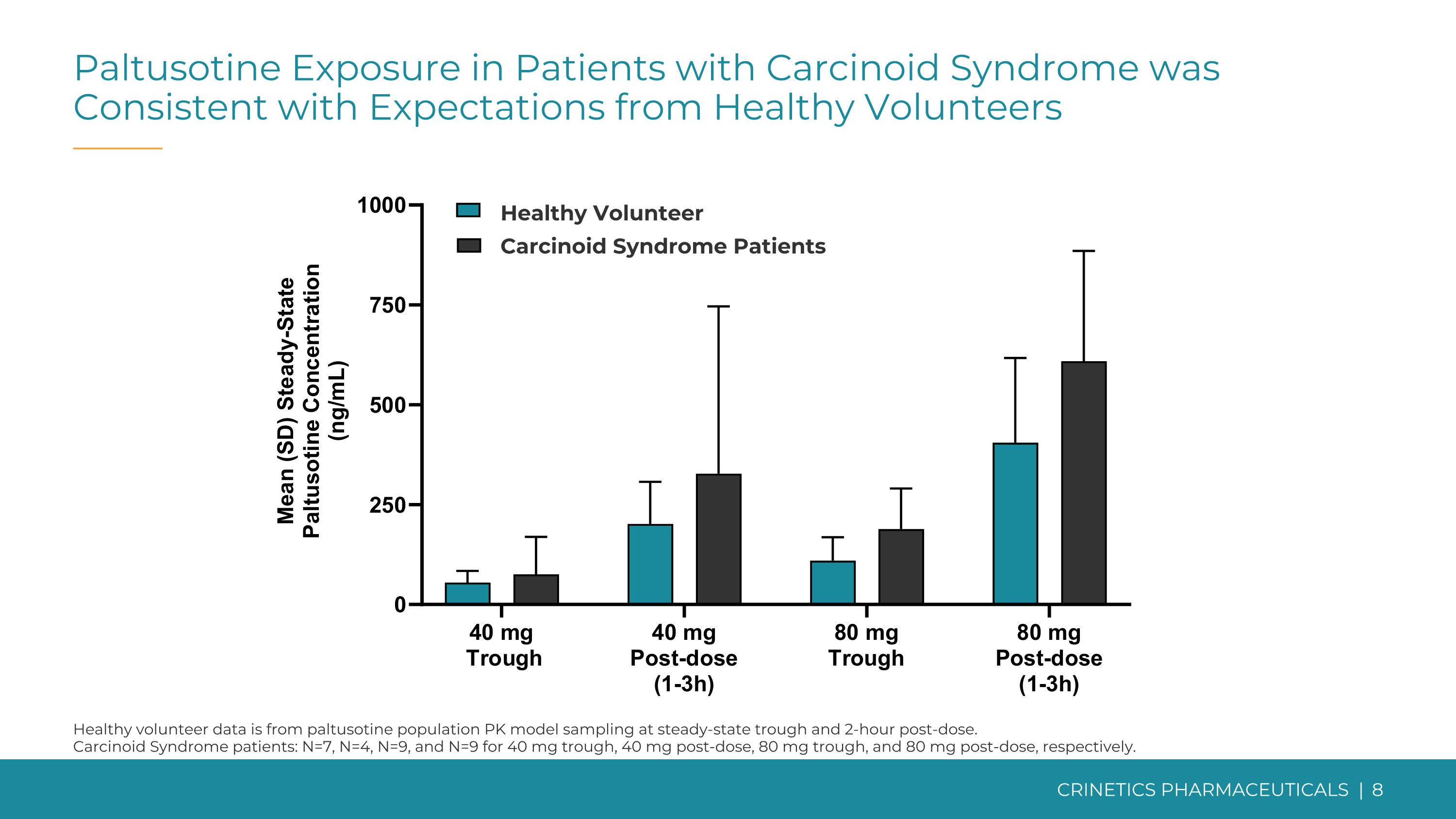
類癌綜合徵患者的帕圖西汀暴露量與健康志願者的期望一致健康志願者數據來自穩態低谷和給藥後2小時的帕圖西汀人羣 PK 模型採樣。類癌綜合徵患者:40 mg 低點、給藥後 40 mg、80mg 低點和給藥後 80 mg 分別為 N=7、N=4、N=9。健康的志願類癌綜合徵患者

帕曲索汀耐受性良好,沒有嚴重或嚴重的治療相關不良事件* 一種 SAE(心力衰竭,很可能是繼發於類癌心臟病)的致命後果發生在停藥 26 天后,並且與治療無關。治療緊急不良事件 paltusotine N = 27 任意 18 (66.7) 輕度 9 (33.3) 中度 7 (25.9) 嚴重 2 (7.4) 嚴重 3 (11.1) 死亡 1 (3.7) * 治療相關 15 (55.6) 輕度 9 (33.3) 中度 6 (22.2) 嚴重 0 嚴重 0 死亡 0 正在進行的類癌綜合徵 2 期研究的初步安全性摘要帕圖索汀耐受性良好,沒有與治療相關的嚴重或嚴重的治療相關不良事件最常報告的不良事件包括腹瀉、頭痛和腹痛帕圖西汀劑量 40% 和 80% 的不良事件發現相似mg 在研究監測生命體徵、心電圖或安全實驗室值期間未觀察到新的安全信號
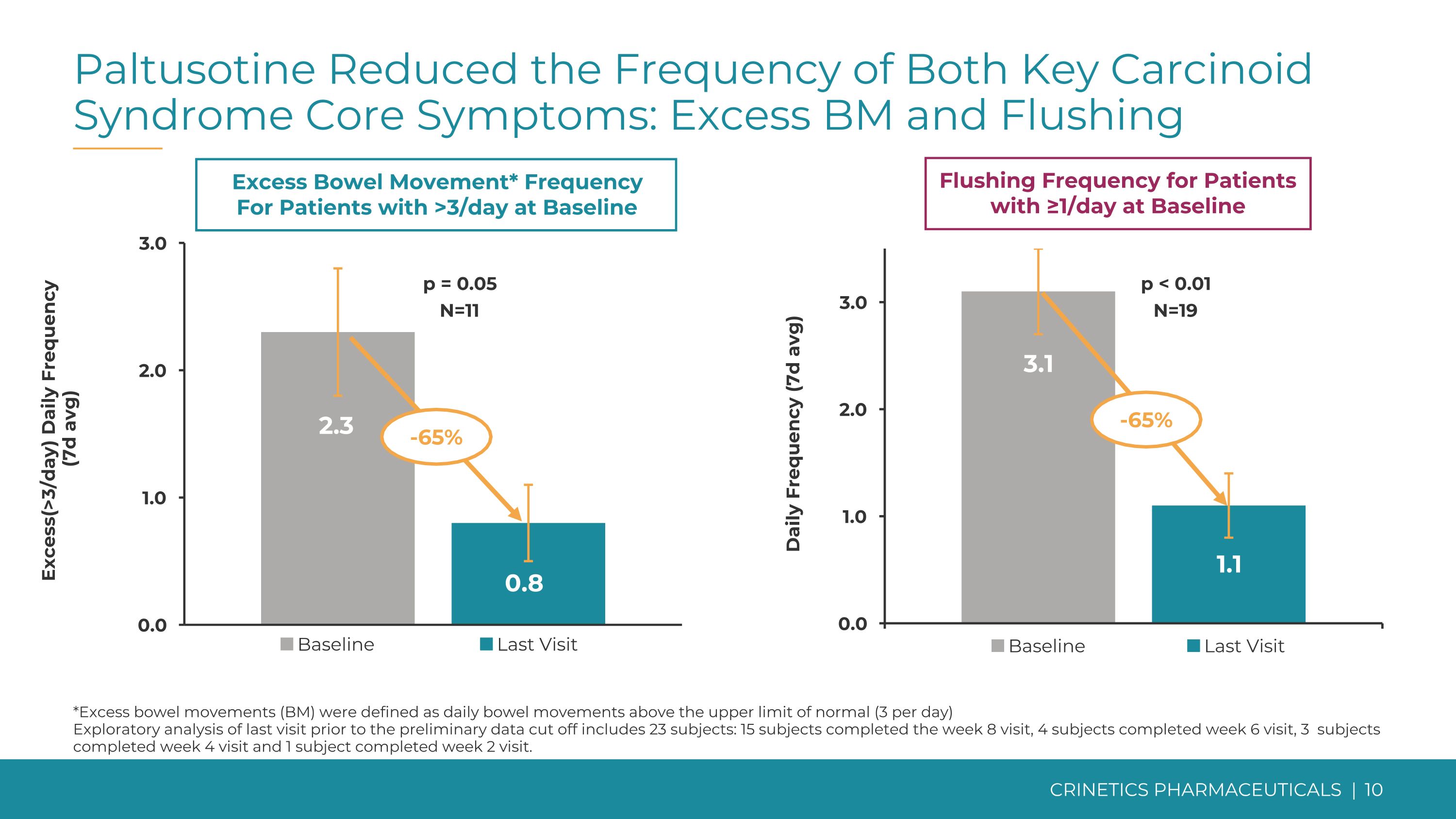
Paltusotine 降低了兩種關鍵類癌綜合徵核心症狀的發生頻率:血管過多和潮紅過多(>3 天)基線排便次數≥1 天的患者的每日沖洗頻率(7d 平均值)* 基線每日頻率 >3 次的患者(7d 平均值)p = 0.05 N=11 p

Paltusotine 對從治療基線到最後一週的排便頻率變化較高的受試者有明顯的益處(患者按基線值排序)每日排便頻率(從基線到最後一次就診)基線排便次數 >3 基線排便 =3 正常每週 BM 3 至每天 3 次上次就診基線 (1) 每個箭頭的末尾表示 23 名受試者中每人最後一週的可用治療數據。15 名受試者本週完成 8 個訪問,4 個科目完成第 6 周訪問,3 個科目完成第 4 周訪問和 1 個科目已完成第 2 周的訪問。每天超出 BM >3 平均變化 -1.9 bm/天 (N=11) 平均變化 -0.1 bm/天

Paltusotine 顯示大多數受試者的潮紅頻率有所改善,從基線到上週、基線和上週(患者按基線值排序)潮紅每日頻率(從基線到最後一次就診)基線沖洗頻率 =1 控制良好的上次就診基線(1)每個箭頭的末尾表示 23 名受試者中每人最後一週的治療數據。15 名受試者完成第 8 周就診,4 名受試者完成第 6 周就診,完成了第 4 周訪問的 3 個科目和 1 個科目完成了第 2 周的訪問。平均變化為 -2.0 次刷新事件/天 (N=19) 平均變化為 0.1 次刷新事件/天

在治療後 2 周內,觀察到所有參與者的排便頻率迅速改善(N=23)無論基線是否出現過多 BMs 6 8 篩查基線 4 2 研究周排便頻率/日排便頻率/第 6 天 8 基線(沖洗)4 2 研究周 8 8 8 8 7 5 15 15 15 15 14 12 10 未接受治療的參與者人數頻率測量基於 14 篩選期內的平均值和所有其他時間點基線前 7 天的平均值 SRL =生長抑素受體配體沖洗期從先前的 SRL 帕圖索汀帕圖西汀篩查轉到 SRL 訪問的參與者人數

所有參與者的潮紅頻率(N=23)無論是否在基線時出現潮紅研究周 6 8 4 2 沖洗頻率/日參與者從之前的 SRL 切換 6 8 篩查基線 4 2 研究周未接受治療的參與者潮紅頻率/第 8 天 8 8 8 7 5 15 15 15 14 12 10 在治療沖洗期後的 2 周內觀察到沖洗頻率迅速提高到達訪問帕勒索托的參與者人數 Paltusotine Paltusotine 基線(沖洗)篩查 SRL 頻率測量基於 14 天篩查期內的平均值和所有其他時間點基線前 7 天的平均值 SRL = 生長抑素受體配體

Paltusotine 還降低了關鍵類癌綜合徵症狀的嚴重程度 N=15 誰完成了隨機治療期 BM = 每日排便頻率(7d 平均值)潮紅嚴重程度 BM 急性發作 N = 23 N = 23 N = 23 N = 23 N = 23 N = 23 N = 23 嚴重程度(0-10 數字評分量表)p = 0.01 p = 0.001
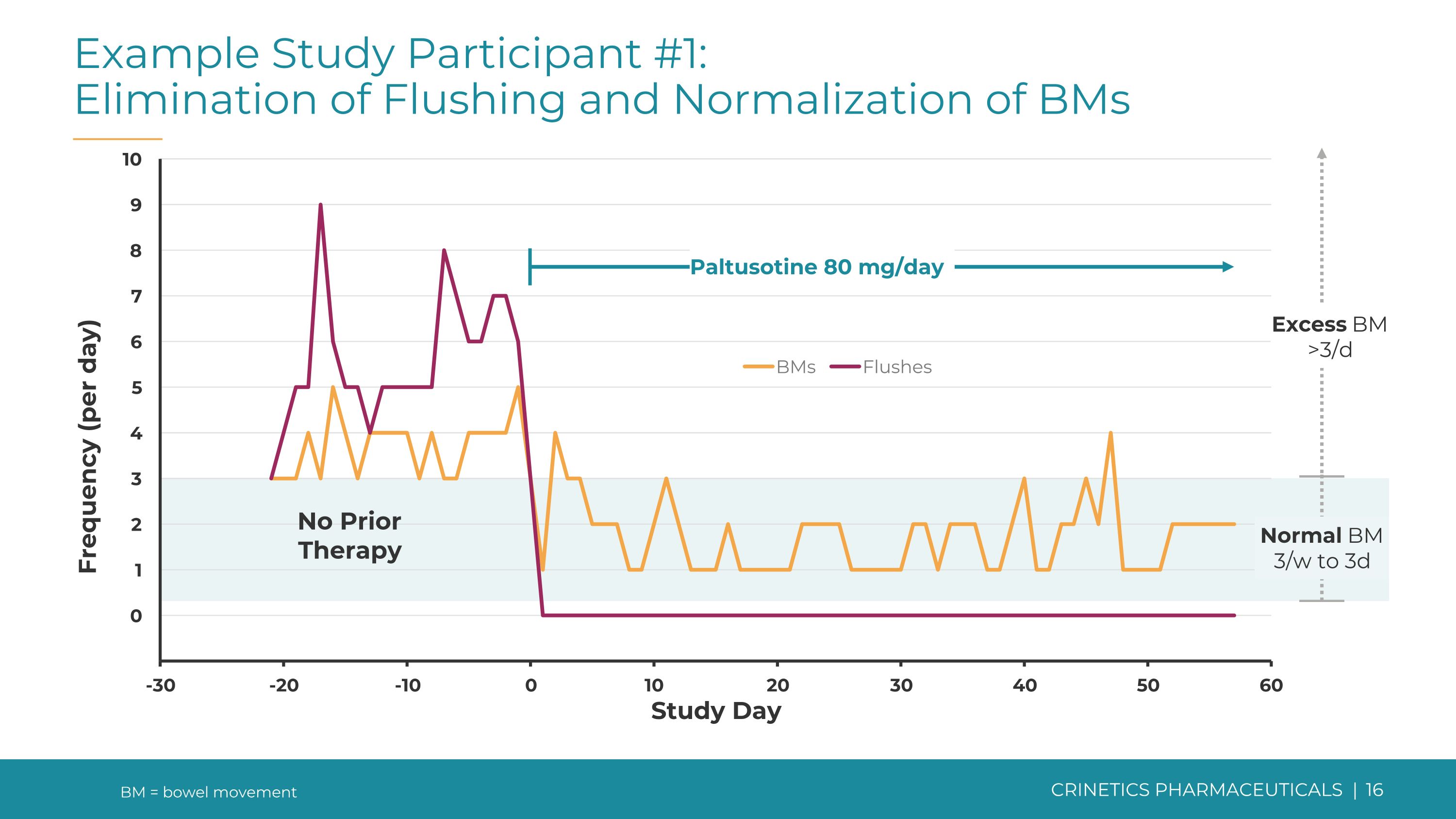
研究參與者示例 #1:消除潮紅並使基因正常化 bms Paltusotine 80 mg/天未接受治療正常 BM 3/w 到 3d 過量 BM >3/d BM = 排便

Paltusotine 40 mg/天 80 mg/天示例研究參與者 #2: 奧曲肽體重和沖洗頻率的顯著改善 Octreotide 正常 BM 3/w 到 3d 過量 BM >3/d BM = 排便

後續步驟:初始數據支持生物標誌物和患者報告的補充結果數據的3期分析準備該研究已完成入組(N=36),完整研究的標題數據預計將於2024年上半年提交完整的數據集並與FDA合作一旦每日口服帕圖西汀在類癌綜合徵患者中顯示出強勁的初步結果摘要:頻率和嚴重程度顯著降低使用 40 毫克和 80 毫克 Paltusotine 進行排便和潮紅效果很好-耐受性強,沒有嚴重或嚴重的治療相關不良事件。總體而言,PK 與健康志願者的期望一致

預期的帕圖索汀里程碑 1Q24 1H24 2H24 針對未經治療的肢端肥大症患者的 PATHFNDR-2 3 期研究結果類癌綜合徵 2 期研究的頭條結果 (N=36) 肢端肥大症 NDA 提交的類癌綜合徵 3 期開始等待與 FDA 一致正在進行的開放標籤延期研究 N > 175 名參與者,並且增加 26 名患者使用帕曲索汀治療時間超過 3 年,35 名患者大於 2 年

問答 Scott Struthers,博士創始人兼首席執行官 Dana Pizzuti,醫學博士首席醫學與發展官艾倫·克拉斯納,醫學博士首席內分泌學家