

前瞻性陳述和安全 harbor 本文件中非歷史事實的陳述是 “前瞻性陳述”,該術語在1995年《私人證券訴訟改革法》中定義。本文件中的前瞻性陳述包括 陳述,內容涉及:公司當前和計劃中的臨牀試驗的計劃設計、註冊、時機、開始、中期和完整數據讀出時間、範圍、監管途徑和結果,包括 enobosarm 與 GLP-1 激動劑聯合治療肥胖和相關肌肉萎縮的 2b 期研究、針對某些 COVID-19 患者的沙比扎布林的確認性 3 期研究 (如果進行),薩比扎布林對成人 住院的急性呼吸綜合徵患者的3期研究(如果已進行),enobosarm與abemaciclib聯合用於AR+ ER+ HER2轉移性乳腺癌二線治療的2b/3期研究,以及此類研究是否會達到其任何主要或 次要終點;是否以及何時向美國食品藥品管理局提交enoboSarm/GLP-1組合研究的IND,FDA是否需要任何其他研究或任何前提條件臨牀研究,如果該研究開始, 的目標患者羣體是否與本演示文稿中描述的相同,以及計劃是否和何時進行研究將開始註冊並讀出數據;顯示enobosarm對預防肌肉 萎縮、增加或維持肌肉質量和骨密度或幫助優先減脂的作用的歷史臨牀結果是否會在計劃中的2b期研究或任何未來的研究中得到顯著或完全複製,如果獲得批准,任何這樣的 結果是否會出現在商業臨牀應用中;是否以及何時會出現任何計劃中的中期分析計劃對某些 COVID 進行薩比扎布林的 3 期確認性研究患者或急性呼吸綜合徵患者或任何其他試驗中將出現以及任何此類中期分析的結果 ;任何此類中期分析或任何已完成的3期研究的結果或任何其他中期數據是否足以支持針對任何適應症的sabizabulin的保密協議;是否以及何時會批准任何 潛在的保密協議;公司是否和何時會就任何潛在的合作機會與BARDA會面,以及這些努力是否會取得成功,以及公司何時可以從任何潛在的結果中獲益與 BARDA 合作 努力;公司是否以及如何資助計劃中的沙比扎布林在 COVID-19 和 ARDS 或任何其他適應症中的第 3 期研究;公司當前和未來的臨牀開發工作,包括在 COVID-19、ARDS 或任何其他傳染病適應症中對 sabizabulin 的所有研究,或肥胖或腫瘤適應症中的enobosarm,以及它們的任何結果是否顯示出足夠的療效、安全性和潛在益處美國食品藥品管理局批准該公司任何 候選藥物;無論該藥物候選人將獲得靶向療法的批准;如果每種情況都獲得批准,政府和私人付款人是否會為enobosarm或公司的任何其他藥物 提供足夠的保險;開發和商業化 GLP-1 肥胖藥物的公司是否會接受將enobosarm與各自的產品結合使用; enobosarm 的知識產權組合是否足以保護公司在 enobosarm 中的利益肥胖、乳腺癌或任何其他適應症的影響以及是否將阻止競爭對手開發具有相同適應症的SARM,或者公司是否擁有 資源或成功維護其知識產權;肥胖市場上對可能有助於緩解肌肉萎縮的藥物和候選藥物的相對缺乏競爭是否會持續多長時間,以及任何此類競爭可能對公司在該領域的前景產生什麼影響;enobosarm是否會組合或單獨成為一種治療方法,用於肥胖或乳腺癌,以及沙比扎布林是否會成為廣泛急性呼吸綜合徵綜合徵 或 COVID-19 的治療方法;公司的 FC2 遠程醫療門户銷售是否會增長或取代之前來自美國 FC2 處方銷售的收入;公司是否會收回 The Pill Club 所欠的任何款項; 公司是否以及何時會收到藍水公司與出售 ENTADFI 相關的剩餘分期付款,或者將獲得與之相關的任何潛在銷售里程碑,以及公司是否會永遠能夠清算其在藍水擁有的優先股 ;無論如何,林肯公園資本基金股票額度下何時以及可以出售多少股票;未來任何股票發行籌集的現金是否足以支付公司計劃或預期的 業務;以及公司當前的現金是否足以為其計劃或預期的業務提供資金。這些前瞻性陳述基於公司當前的預期,受風險和不確定性影響 ,這些風險和不確定性可能導致實際結果存在重大差異,包括與以下方面相關的意外進展和風險:公司產品組合的開發和臨牀研究結果可能不成功或 不足以滿足適用的監管標準或保證持續發展;在臨牀研究中招收足夠數量的受試者的能力以及相應地招收受試者的能力附有計劃的時間表; 為公司的計劃臨牀開發和其他運營提供資金的能力;向美國食品藥品管理局或任何其他監管機構提交任何申請的時間以及美國食品和藥物管理局或任何其他監管機構做出的任何決定;公司 的現有產品、FC2和任何未來產品,如果獲得批准,可能無法在商業上取得成功;公司在需要時以可接受的條件獲得足夠融資以資助開發和運營的能力;需求、市場 的接受程度和競爭針對公司的任何產品或候選產品;具有更多資源和能力以及新的競爭產品批准和/或推出的新或現有競爭對手;監管做法或政策的變化或政府推動的醫療改革工作,包括定價壓力、保險範圍和報銷的變化;與公司開發自己的直接患者專用遠程醫療和 遠程藥房服務平臺相關的風險,包括公司缺乏開發此類平臺的經驗,潛在的監管複雜性和開發成本;公司保護和執行其知識產權的能力; 政府招標的訂單或發貨延遲或公司在美國的處方業務可能導致公司的經營業績出現顯著的季度差異,並對其 淨收入和毛利產生不利影響;公司對國際合作夥伴的依賴以及各國政府、全球捐助者和其他公共衞生組織在全球的支出水平公共部門;來自我們最大客户的應收賬款 的集中度以及這些應收賬款的收取情況;公司的生產能力、效率和供應限制和中斷,包括由於勞工動盪或罷工、勞動力短缺、原材料短缺、公司和第三方設施的物理損壞、產品 測試、運輸,可能導致公司和 第三方製造設施的生產中斷和/或公司及時供應產品的能力中斷延遲或監管行動;訴訟的成本和其他影響,包括產品責任索賠和證券訴訟;公司識別、成功談判和完成適當的 收購或其他戰略舉措的能力;公司成功整合收購的業務、技術或產品的能力;以及公司新聞稿、股東 通信和證券交易委員會文件,包括公司截至9月30日財年的10-K表中不時詳述的其他風險,2023 和隨後在表格10-Q上提交季度報告。這些文件可在我們網站www.verupharma.com/investors的 “SEC 申報” 部分查閲。公司否認任何更新這些前瞻性陳述的意圖或義務。附錄 99.1
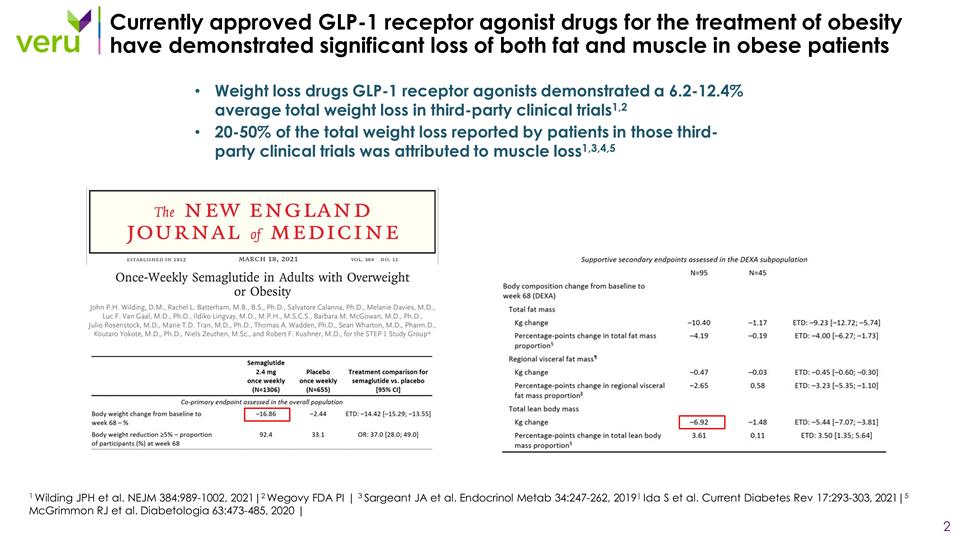
目前批准的用於治療肥胖的 GLP-1 受體 激動劑藥物已顯示肥胖患者的脂肪和肌肉均顯著流失減肥藥 GLP-1 受體激動劑在第三方臨牀試驗中顯示平均總體重減輕了 6.2-12.4% 1,2 在這些第三方臨牀試驗中患者報告的總減肥量中,有 20-50% 歸因於肌肉流失1,3,4,5 1 Wilding JPH 等人。NEJM 384:989-1002,2021|2 Wegovy FDA PI | 3 Sargeant JA 等人。Endrominol Metab 34:247-262,2019| Ida S 等人。Current Diabetes Rev 17:293-303,2021|5 McGrimmon RJ 等人。Diabetologia 63:473-485,2020 |
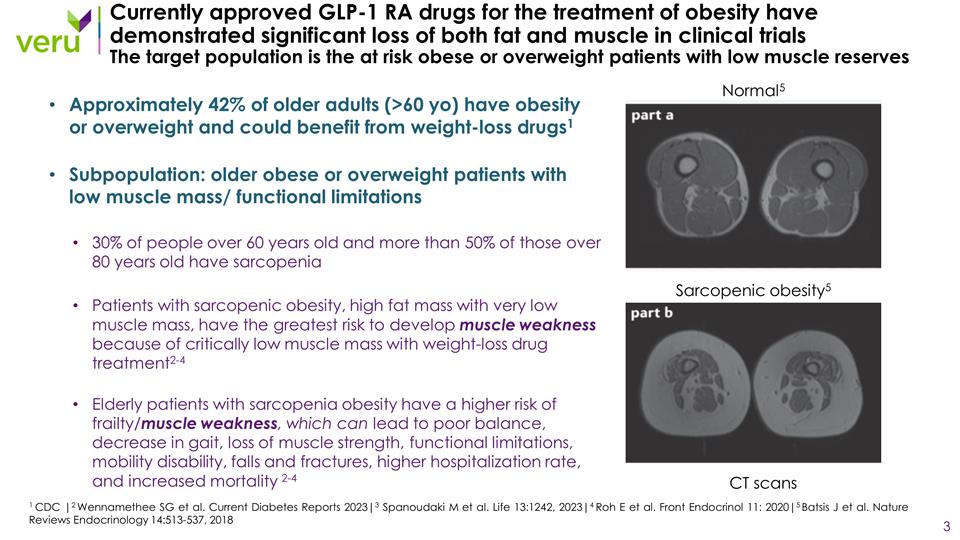
目前批准的用於治療肥胖的 GLP-1 RA藥物已在臨牀試驗中顯示脂肪和肌肉均顯著流失。目標人羣是肌肉儲備不足的高風險肥胖或超重患者。大約 42% 的老年人(>60 歲)患有 肥胖或超重,可以從減肥藥物中受益1 亞羣:肌肉質量低/功能受限的老年肥胖或超重患者佔60歲以上人羣的30% 在80歲以上的人羣中,有50%以上患有 肌肉減少症患有肌肉減少症的患者肥胖、高脂肪和極低的肌肉質量最低,發生肌肉無力的風險最大,因為使用減肥藥物治療時肌肉質量嚴重低2-4 患有肌肉減少症肥胖 的老年患者出現虛弱/肌肉無力的風險更高,這可能導致平衡不良、步態下降、肌肉力量喪失、功能受限、行動障礙、跌倒和骨折、住院率上升以及死亡率上升 2-4 1 CDC |2 Wennamethee SG 等人2023年最新糖尿病報告|3 Spanoudaki M等人。生活 13:1242,2023|4 Roh E 等人。Front Endrominol 11:2020|5 Batsis J 等人。《自然評論》內分泌學 14:513-537,2018 年 Normal5 肌肉減少性肥胖 5 次 CT 掃描

Enobosarm 是一種新型的口服選擇性 雄激素受體調節劑 (SARM),旨在減少脂肪量和增加精益質量(肌肉和骨骼)Enobosarm 是一種非甾體選擇性雄激素受體激動劑1,2 來自臨牀試驗和臨牀前研究的數據支持 enobosarm 的 潛力:每天一次口服劑量激活雄激素受體,這是一種成熟的組織選擇性機制改善肌肉質量和身體機能2,6 刺激脂肪分解、抑制脂肪生成並減少脂肪量7,8 增強和治癒 治療骨質流失的骨潛力/骨質疏鬆症3-5 安全性缺乏男性化作用沒有肝毒性 enobosarm 的化學結構 1 Narayanan R 等人。Mol Cell Endrominol 2017|2 Dalton JT 等人。Curr Opin Support Palliat Care 7:345-351, 2013|3Kamrakova M 等人 Calcif Tissupport Int 106:147-157 ,2020|4 Hoffman DB 等人。J Bone Metab 37:243-255,2019|5 Kearbey JD 等人 Pharm Res 26:2471-2477,2009| 6Dobs AS 等人。Lancet Oncol 14:335-45,2013|7Dalton JT 等人J Cachexia 肌肉減少症 2:153-161,2011| 8 Leciejewska N 等人。J Phys and Pharma 70:525-533,2019
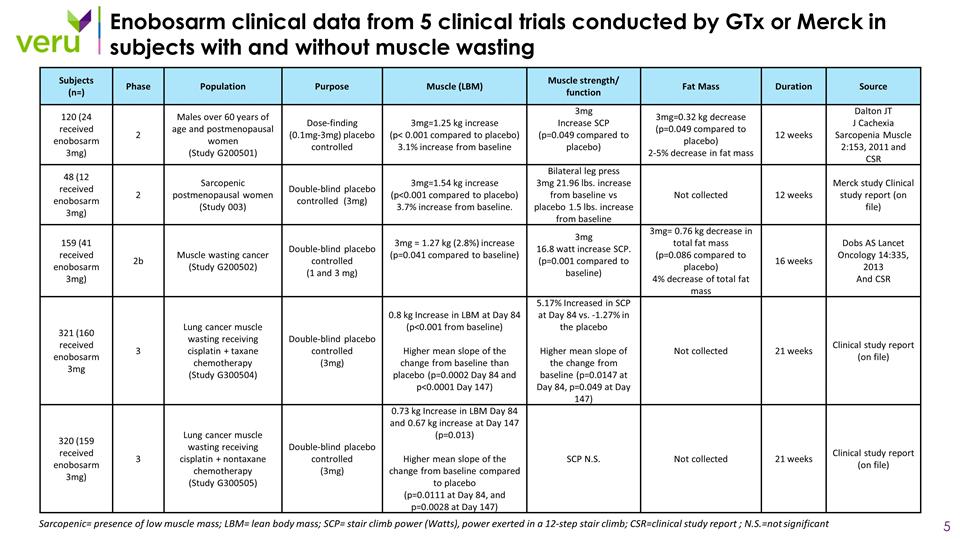
Enobosarm 臨牀數據來自 GtX 或默沙東在有或沒有肌肉萎縮的受試者中進行的 5 項臨牀試驗肌肉減少素 = 肌肉質量低;LBM = 瘦體重;SCP= 爬樓梯功率(瓦特),12 步爬樓梯時施加的力量;CSR=臨牀研究報告; n.s.=非重要受試者(n=)階段人羣目的肌肉(LBM)肌肉力量/功能脂肪質量持續時間來源 120(24 人接受了 enobosarm 3mg)2 60 歲以上的男性和絕經後女性(研究 G200501)劑量發現 (0.1mg-3mg)安慰劑對照 3mg=1.25 kg增加 (p
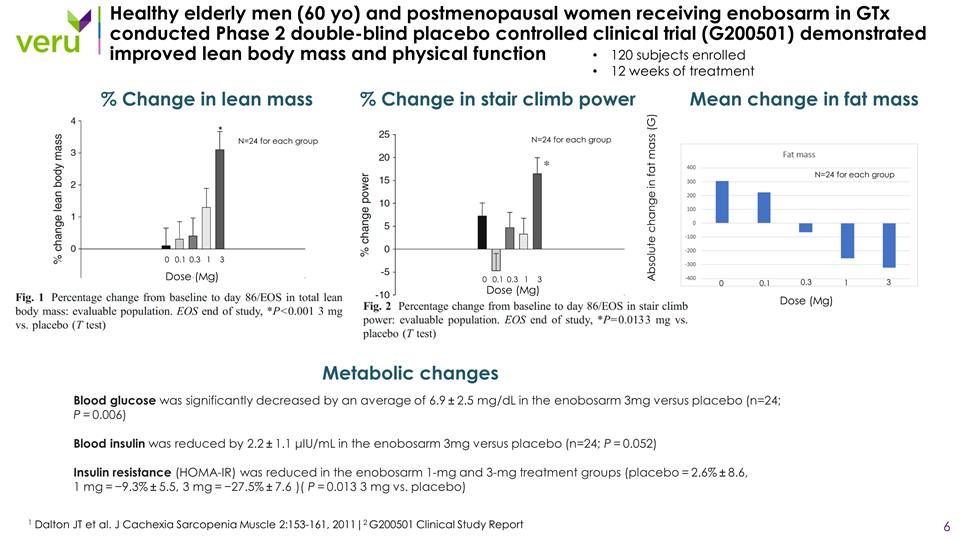
在GtX中接受enobosarm治療的健康老年男性(60歲)和 絕經後女性進行的 2 期雙盲安慰劑對照臨牀試驗(G200501)顯示,瘦體重和身體機能得到改善 1 Dalton JT 等人。J Cachexia 肌肉減少症 2:153-161,2011|2 G200501 臨牀研究報告 120 名受試者接受了 12 周的治療% 瘦體重變化百分比爬樓梯力變化在 enobosarm 3mg 中血糖平均降低 6.9 ± 2.5 mg/dL(n=24;P = 0.006)enoxarm 中的血胰島素減少了 2.2 ± 1.1 μiu/ml 對比安慰劑(n=24;P = 0.052)enobosarm 1-mg 和 3-mg 治療組,胰島素抵抗(HOMA-IR)降低(安慰劑 = 2.6% ± 8.6,1 mg = − 9.3% ± 5.5,3 mg = − 27.5% ± 7.6)(P = 0。013 3 mg 對比安慰劑) 代謝變化 0 0.1 0.3 1 3 0 0.3 1 3 每組劑量(Mg)劑量(Mg)N=24 每組脂肪質量的平均變化 0 0.1 1 3 劑量(Mg)0.3 N=24 脂肪量的絕對變化(G)
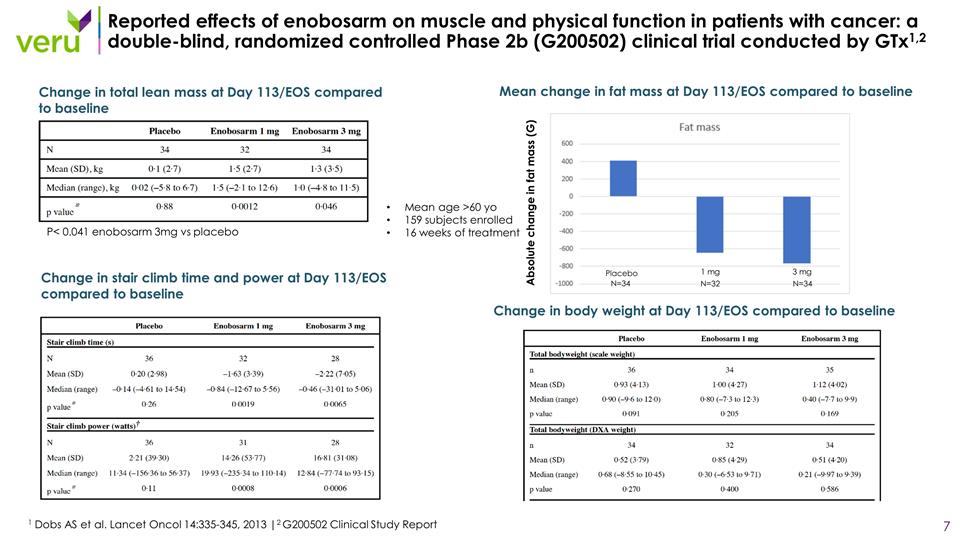
報道了enobosarm對癌症患者 肌肉和身體機能的影響:一項由Gtx1,2 1 Dobs AS等人進行的雙盲、隨機對照的2b期(G200502)臨牀試驗。Lancet Oncol 14:335-345,2013 |2 G200502 臨牀研究報告平均年齡 >60 至 159 名受試者接受了 16 周的治療,與基線相比,第 113/EOS 天總瘦體重的變化與基線相比,第 113/EOS 天爬樓梯的時間和力量與基線 P

第 3 期隨機、雙盲、 安慰劑對照的 504 項臨牀試驗,旨在評估一線鉑金加紫杉烷化療的非小細胞肺癌患者肌肉萎縮的影響 1 項研究 G300504 CSR 數據存檔 Veru 3mg enobosarm 治療 321 周截至第 84 天訪問精益體重(肌肉)第 84 天訪問直至第 147 天訪問爬樓梯的力量第 84 天訪問直至第 147 天訪問體重
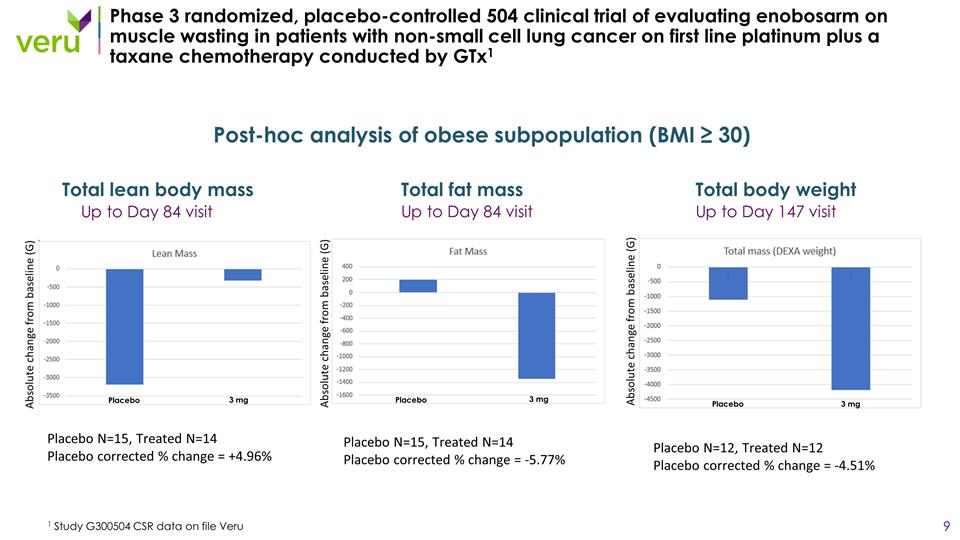
第 3 期隨機、安慰劑對照 504 期評估非小細胞肺癌患者肌肉萎縮情況的臨牀試驗由 Gtx1 進行 1 項研究 G300504 CSR 數據存檔 Veru 截至第 84 天訪問總脂肪量 mass 截至第 84 天訪問總脂肪量 147 天訪問肥胖亞羣 (BMI) 事後分析 ≥ 30) 安慰劑 N=15,治療後的 N=14 安慰劑校正百分比變化 = +4.96% 安慰劑 N=15,治療後的 N=14 安慰劑校正 % 變化 = -5.77% 安慰劑 N=12,已治療N=12 安慰劑校正後的變化百分比 = -4.51% 安慰劑安慰劑 3 mg 3 mg 3 mg 3 mg 與基線相比的絕對變化 (G) 與基線的絕對變化 (G) 與基線的絕對變化 (G)
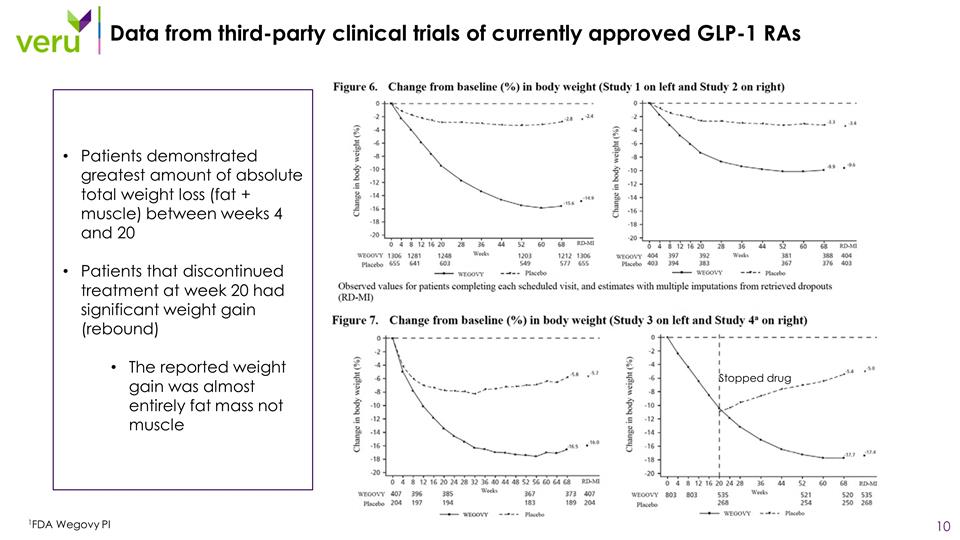
來自目前批准的 GLP-1 rA 1FDA Wegovy PI 停藥的第三方臨牀 試驗的數據患者在第 4 周至第 20 周之間顯示絕對總體重減輕(脂肪+肌肉)最大。第 20 周停止治療的患者體重明顯增加 (反彈)報告的體重增加幾乎完全是脂肪量,而不是肌肉
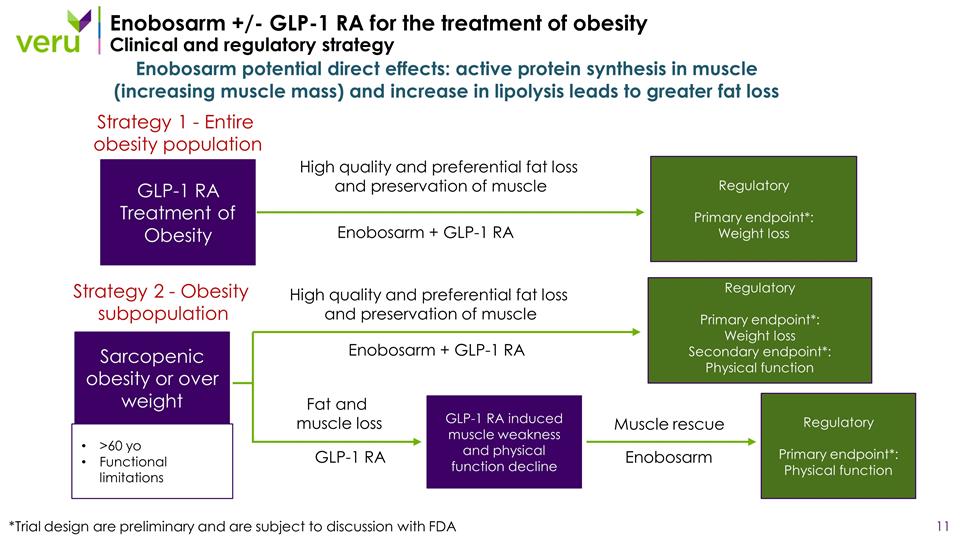
Enobosarm +/-GLP-1 用於治療肥胖 的RA臨牀和監管策略 Enobosarm 潛在的直接影響:肌肉中的活性蛋白合成(增加肌肉質量)和增加脂肪分解會增加脂肪流失 GLP-1 RA 肥胖症的治療肌肉減少量 肥胖或超重 >60 yo 功能限制 Enobosarm + GLP-1 RA 高品質和優惠脂肪減少並保存肌肉 Enobosarm + GLP-1 高品質和優惠脂肪肌肉流失和保存 GLP-1 RA GLP-1 RA 引起的肌肉無力和身體虛弱功能下降 Enobosarm 脂肪和肌肉流失肌肉救援調節主要終點*:減肥調節主要終點*:減肥次要終點*:身體功能調節主要 終點*:身體功能*試驗設計尚處於初步階段,有待與美國食品藥品管理局策略1——整個肥胖人羣策略2——肥胖亞羣進行討論
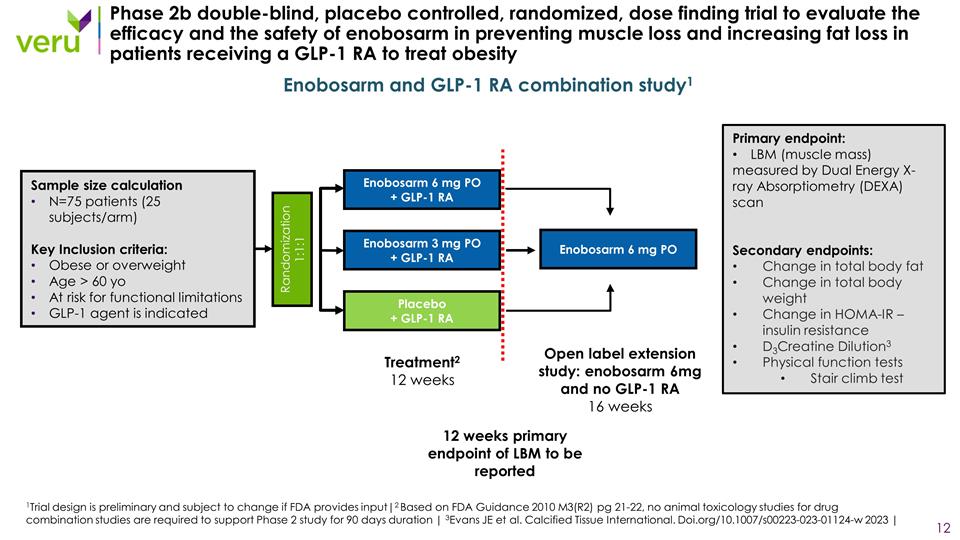
2b 期雙盲、安慰劑 對照、隨機、劑量發現試驗,旨在評估在接受 GLP-1 RA 治療肥胖的患者中 enobosarm 在防止肌肉流失和增加脂肪流失方面的療效和安全性隨機化 1:1:1 Enobosarm 3 mg PO + GLP-1 RA 安慰劑 + GLP-1 RA 治療2 12 周樣本量計算 N=75 名患者(25 名受試者/組)關鍵納入標準:肥胖或超重年齡 > 60 歲有功能限制風險 GLP-1 需服用藥物 Enobosarm 6 mg PO + GLP-1 RA Enobosarm 和 GLP-1 RA 組合研究1主要終點:通過雙能 X 射線吸收測量 (DEXA) 掃描測量的 LBM(肌肉質量)次要終點:體內總脂肪變化總體重變化 HOMA-IR — 胰島素 抵抗 D3肌酸稀釋3身體功能測試爬樓梯測試 Enobosarm 6 mg PO 開放標籤擴展研究:enobosarm 6mg 和 GLP-1 RA 16 周 12 周將報告 LBM 的主要終點 1試驗設計是初步的,如果美國食品藥品管理局提供意見,則 會有變更|2 根據美國食品藥品管理局指南 2010 年 M3 (R2) 第 21-22 頁,沒有藥物的動物毒理學研究需要聯合研究才能支持 90 天的 2 期研究 | 3Evans JE 等人。鈣化組織國際。 doi.org/10.1007/s00223-023-01124-W 2023 |

科學顧問委員會 Shalender Bhasin,MB,醫學學士學位教授,哈佛醫學院男性健康:衰老與新陳代謝研究項目主任 Claude D. Pepper 美國老年人獨立中心 Brigham T.Villareal,MD 貝勒醫學院內分泌、糖尿病和代謝學系教授 William J. Evans,醫學系兼職教授杜克大學醫學中心老年醫學部醫學系北卡羅來納州達勒姆兼職 人類學教授加州大學伯克利分校營養科學與毒理學系其他姓名待保密協議執行
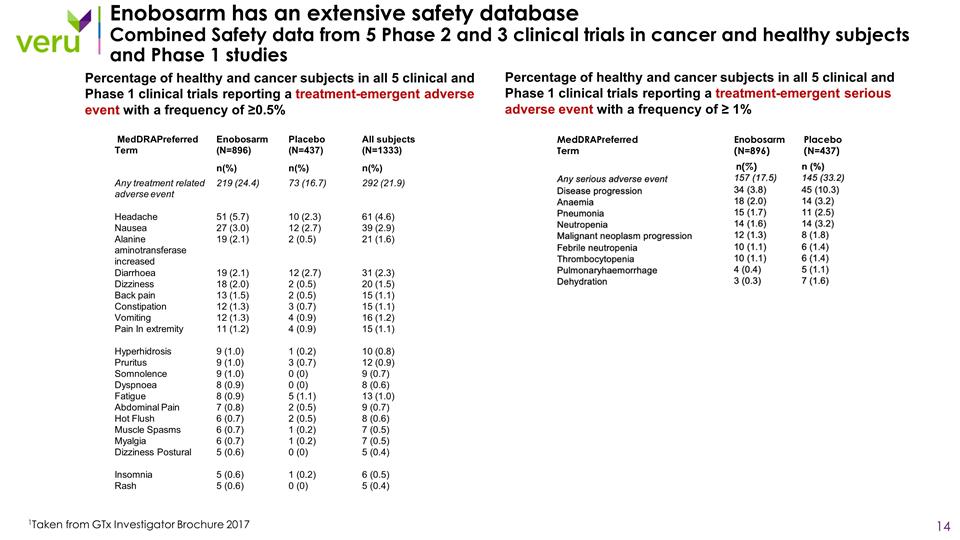
在所有 5 項臨牀和 1 期臨牀試驗中,報告出現頻率為 ≥ 1% 的嚴重不良事件的健康和癌症 受試者的百分比 Enobosarm 擁有廣泛的安全數據庫 5 項癌症和健康受試者的臨牀 試驗和 1 期研究的綜合安全性數據 1 摘自 GtX 研究者手冊 2017 年所有 5 項臨牀和 1 期臨牀試驗中報告治療緊急不良事件的健康和癌症受試者的百分比 頻率為 ≥ 0.5% MeddraPreferred Term Enobosarm (N=896)安慰劑 (N=437) n (%) meddraPreferred Term Enobosarm (N=896) 安慰劑 (N=437) 所有受試者 (N=1333) n (%) n (%) n (%) 任何與治療相關的不良反應 事件 219 (24.4) 73 (16.7) 292 (21.9) 頭痛 51 (5.7) 10 (2.3) 61 (4.6) 噁心 27 (3.0) 12 (2.7) 39 (2.9) 丙氨酸轉氨酶升高 19 (2.1) 2 (0.5) 21 (1.6) 腹瀉 19 (2.1) 12 (2.7) 31 (2.3) 眩暈 18 (2.0) 2 (0.5) 20 (1.5) 背痛 13 (1.5) 2 (0.5) 15 (1.1) 便祕 12 (1.3) 3 (0.7) 15 (1.1) 嘔吐 12 (1.3) 4 (0.9) 16 (1.2) 極端疼痛 11 (1.2) 4 (0.9) 15 (1.1) 多汗症 9 (1.0) 1(0.2) 10 (0.8) Pruritus 9 (1.0) 3 (0.7) 12 (0.9) Somnolence 9 (1.0) 0 (0) 9 (0.7) 呼吸困難 8 (0.9) 0 (0) 8 (0.6) 疲勞 8 (0.9) 5 (1.0) 13 (1.0) 腹痛 7 (0.8) 2 (0.5) 9 (0.7) Hot Flush 6 (0.7) 2 (0.5) 8 (0.6) 肌肉痙攣 6 (0.7) 1 (0.2) 7 (0.5) 肌痛 6 (0.7) 1 (0.2) 7 (0.5) 頭暈姿勢 5 (0.6) 0 (0) 5 (0.4) 失眠 5 (0.6) 1 (0.2) 6 (0.5) 皮疹 5 (0.6) 0 (0) 5 (0.4)
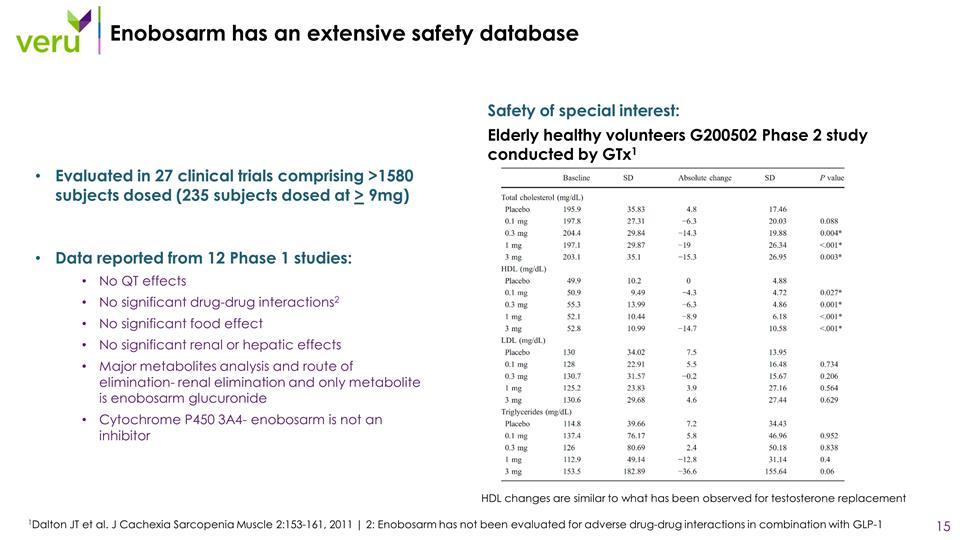
Enobosarm 擁有龐大的安全性 數據庫,在 27 項臨牀試驗中進行了評估,其中包括劑量 >1580 名受試者(235 名受試者的劑量大於 9 毫克)來自 12 項 1 期研究的數據:沒有 QT 效應沒有顯著的藥物相互作用2 沒有顯著的腎臟 或肝臟影響主要代謝物分析和消除途徑——腎臟消除,唯一的代謝產物是 enobosarm 葡萄糖苷細胞色素 P450 3A4-enobosarm 不是抑制劑 1Dalton JT 等人。J Cachexia 肌肉減少症 2:153-161, 2011 | 2:尚未對 Enobosarm 與 GLP-1 聯合使用的藥物不良相互作用進行評估安全性:老年健康志願者 Gtx1 進行的 G200502 2 期研究高密度脂蛋白變化與觀察到的睾丸激素替代研究相似

用於減肥的Enobosarm——IP 產品組合和監管保護為進入設置了重大壁壘 Enobosarm 是一種新型 SARM Enobosarm 頒發的物質特定分子成分專利,並已頒發物質的特定分子組成多態體專利 — 最近 到期專利期限(6 項專利)2028-2029 年(最新是針對 enobosarm 多態物質構成的7,968,603美元)Enobosarm 以及 SARMS 申請中的使用方法(與 GLP-1 受體激動劑聯合使用/用於慢性體重管理) — 最後一次專利到期(1美國臨時版)2044Enobosarm — USPTO/FDA — 可能有資格再延長 5 年專利期限日本-enobosarm 新化學實體 (NCE) 獨家經營權-可能有資格獲得註冊 7.5 年(NDA 批准)歐洲-enobosarm 作為新的化學實體-可能有資格獲得 10 年市場獨家權期限物質配方專利:新改性釋放片劑開發正在進行中
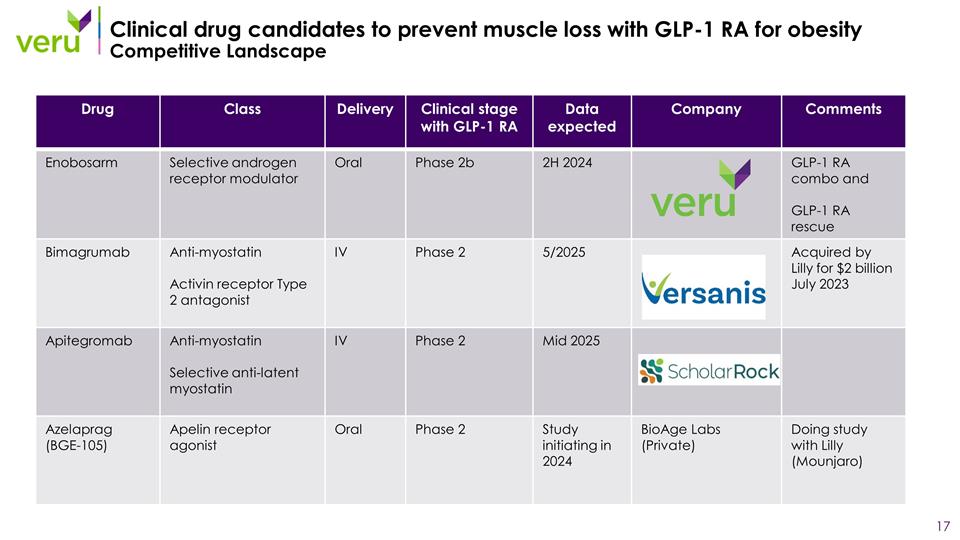
4_81 使用 GLP-1 RA預防肌肉流失的候選臨牀藥物 RA治療肥胖症競爭性格局藥物分級臨牀階段預計有 GLP-1 RA數據公司評論 Enobosarm 選擇性雄激素受體調節劑口服 2b 2H 2024 年 GLP-1 RA 組合和 GLP-1 RA 救援 Bimagrumab 抗肌抑制素激活素受體 2 型拮抗劑 IV 期 2 期 5/2025 被禮來公司以 20 億美元收購 2023 年 7 月 Apitegrotegromab 抗肌抑制素選擇性抗潛伏肌抑制素 IV 期 2 期 2025 年中期 Azelaprag (BGE-105) Apelin 受體 激動劑口服 2 期研究啟動2024 年 BioAge Labs(私人)和 Lilly(Mounjaro)一起學習

enobosarm 和 GLP-1 受體 激動劑目標產品簡介 Enobosarm 是一種靶向雄激素受體的非甾體選擇性雄激素受體激動劑,是一種成熟的作用機制1,2 來自臨牀試驗和臨牀前研究的數據支持 enobosarm 的潛力:給藥:每天一次口服劑量功效避免肌肉流失-改善肌肉質量和身體機能2,6 減少脂肪量-刺激脂肪分解並抑制脂質生成7,8 代謝作用- 降低葡萄糖、降低胰島素和減少胰島素阻力增強和治療骨質流失/骨質疏鬆症的潛力 3-5 安全性女性缺乏男性化作用無肝毒性胃腸道副作用微乎其微:噁心、 嘔吐和腹瀉的頻率與安慰劑相似9 enobosarm治療肥胖的潛在治療益處:與 GLP-1 RA-聯合使用可防止肌肉流失並增加接受 GLP-1 RA的患者的脂肪流失 停藥恢復肌肉質量和功能,避免脂肪反彈和體重增加 1 Narayanan R 等人。GLP-1Mol Cell Endrominol 2017|2 Dalton JT 等人。Curr Opin Support Palliat Care 7:345-351,2013|3Kamrakova M 等人 Calcif Tissupe Int 106:147-157 ,2020|4 Hoffman DB 等人。J Bone Metab 37:243-255,2019|5 Kearbey JD 等人 Pharm Res 26:2471-2477,2009| 6Dobs AS 等人。Lancet Oncol 14:335-45,2013|7Dalton JT 等人J Cachexia 肌肉減少症 2:153-161,2011| 8 Leciejewska N 等人。J Phys and Pharma 70:525-533,2019 年 | 9:摘自 2017 年 GtX 研究者手冊

防止接受肥胖治療的患者的肌肉流失 1CDC 2017-2020 | 2 Malenfant J J Glob Health Rep 3:e2019045,2019|3Lutski M 等人。上一頁慢性病 17:200167,2020 年美國肥胖市場1-3 45.9% 40-59 歲的成年男性中有 38.4% 在 60 歲以上的成年男性中有 42.8% 的 40-59 歲到 44.2 歲的成年女性同意 60 歲以上的 41.5% 成年女性也患有肌肉減少症