

LYFGENIA™ 美國食品藥品管理局於 2023 年 12 月 8 日批准納斯達克:藍色附錄 99.1

這些幻燈片和隨附的口頭 演示文稿包含某些前瞻性陳述,這些陳述符合經修訂的1933年《證券法》第27A條和經修訂的1934年《證券交易法》第21E條的含義,涉及風險和 不確定性,包括但不限於有關公司運營計劃和預期的陳述,包括與LYFGENIA的商業啟動和潛在潛在市場有關的陳述 LYFEGNIA; 完成出售該公司的優先審查代金券;我們對2023年創新支付示範的期望;以及公司QTC網絡的預期增長及其時機。使用 “期望”、 “預期”、“相信”、“可能”、“將” 等詞語和類似術語的陳述也是前瞻性陳述。此類報表存在許多風險和不確定性,包括但不限於公司 商業化和產品製造過程中的延誤和挑戰;正在進行和計劃中的活動所需的內部和外部成本以及由此產生的對現金支出和使用的影響已經高於預期,也可能在將來可能高於預期,這導致 導致公司使用現金的速度超出預期或修改或削減其部分計劃或兩者兼而有之;對此存在重大疑問公司繼續作為持續經營企業的能力; 公司對支出、現金使用量和現金需求的預期可能因其他原因而被證明不正確,例如計劃變化或實際事件與其假設不同; 公司先前和正在進行的臨牀試驗的療效和安全性結果可能無法持續或出現在更多使用候選產品治療的患者身上;插入致癌或其他再造的風險與慢病毒載體、藥物 產物或骨髓消融相關的便攜事件;公司任何一種或多種產品或候選產品(包括Skysona、Zynteglo或Lyfgenia)無法成功商業化的風險,以及 公司向美國證券交易委員會提交的10-K表年度報告和10-Q表季度報告以及其他報告中可能不時詳述的其他風險。除非法律要求,否則公司沒有義務對本演示文稿中包含的 前瞻性陳述進行任何修改,也沒有義務對其進行更新以反映本陳述之日之後發生的事件或情況,無論是由於新信息、未來發展還是其他原因造成的。前瞻性 陳述

歡迎辭和開幕詞 Andrew Obenshain,首席執行官臨牀數據和標籤亮點 Rich Colvin,醫學博士,首席醫學官 Rich Colvin 商業發佈計劃 Tom Klima 閉幕詞首席執行官 Andrew Obenshain 問答

LYFGENIA:現已獲得食品藥品管理局批准

LYFGENIA 臨牀數據與標籤 亮點 Rich Colvin,醫學博士,首席醫學官

的患有SCD的成年人有末端器官 損傷,儘管SCD患者的平均死亡年齡僅為45歲,但仍有24%的多器官受損1 1/4的直接醫療費用4 1。Chaturvedi S 等人Am J Hemool。2018 3;2.Kato GJ、Piel FB、Reid CD 等鐮狀細胞病。Nat Rev Dis Primers。2018;4:18010。3.Gallagher ME 等人,J Med Econ。2022 年 1 月至 12 月 4 日。Holdford 等人 2021 年 SCD 患者在 452 歲之前會出現中風。患者平均為 400 萬至 600 萬美元 ~ 65% 50% 到 60%
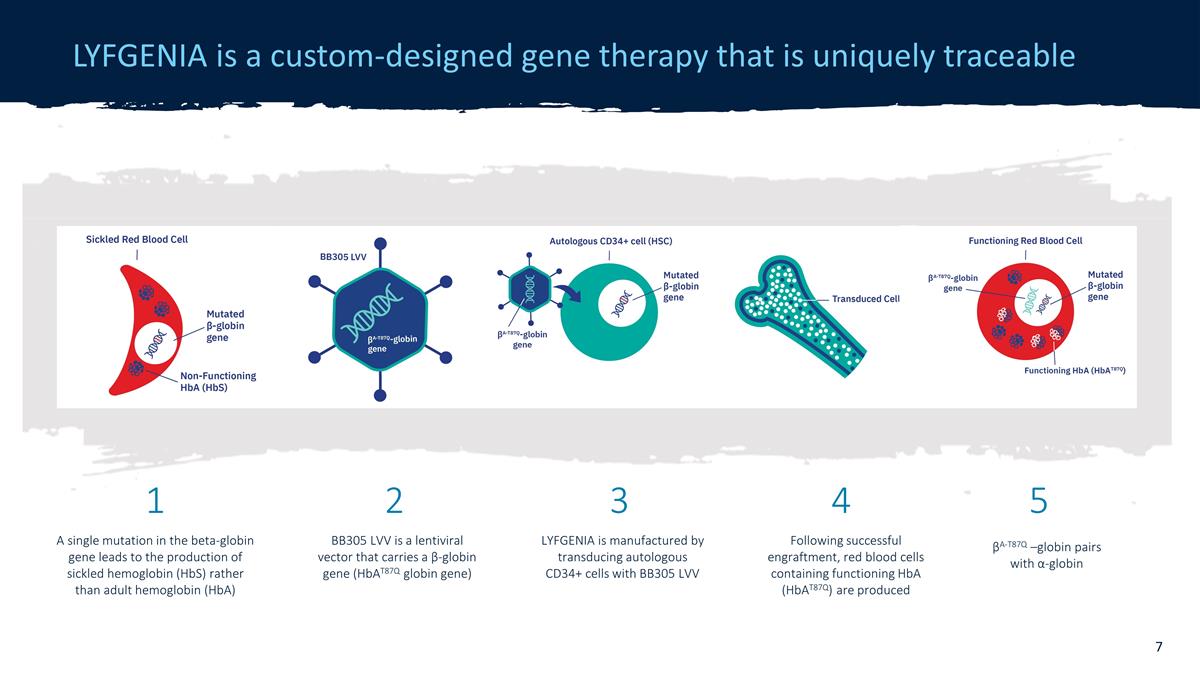
LYFGENIA 是一種定製設計的基因 療法,具有獨特的可追溯性 β-珠蛋白基因的單一突變會導致產生病態血紅蛋白 (HbA),而不是成人血紅蛋白 (HbA) LYFGENIA 是通過將自體 CD34+ 細胞與 α-珠蛋白配對轉導來製造的事實上,會產生含有功能性 HbA (hbat87q) 的紅細胞 BB305 LVV 是一種攜帶 β-珠蛋白基因(Hbat87q 珠蛋白基因)1 2 3 4 5 的慢病毒載體 BB305
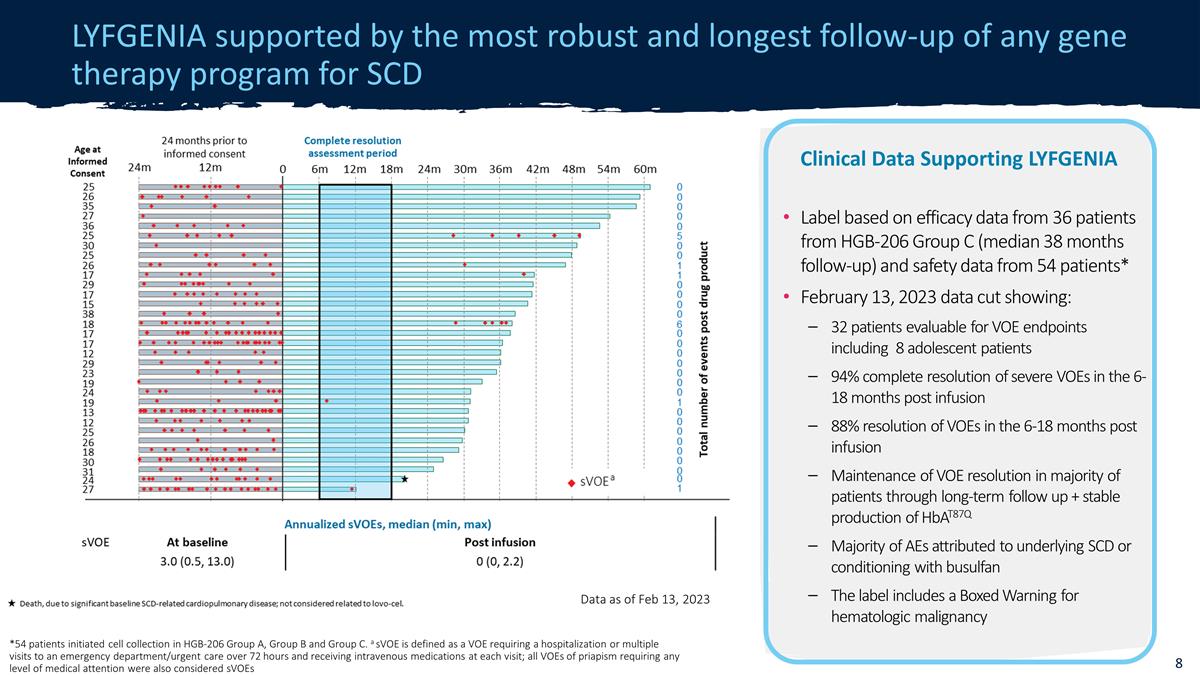
截至 2023 年 2 月 13 日,LYFGENIA 得到了所有 SCD 數據基因治療項目中最強大 和隨訪時間最長的 *54 名患者在 HGB-206 組 A、B 組和 C 組中開始了細胞採集。sVoE 被定義為需要住院或多次就診 急診室/急診室超過 72 小時且每次就診時接受靜脈注射藥物的 VOE;所有陰莖異常勃起的 VOE 都需要任何藥物根據來自 HGB-206 的 36 名患者的療效 數據,SVoE 的臨牀數據支持 LYFGENIA 標籤也被視為就醫水平C 組(平均隨訪 38 個月)和來自 54 名患者的安全性數據* 2023 年 2 月 13 日數據剪輯顯示:32 名患者 VOE 終點可評估,包括 8 名青少年患者,在輸液後 6-18 個月內,重度 VOE 完全消退 88% 通過長期隨訪維持大多數患者 VOE 分辨率 + 穩定產生 Hbat87q 大多數不良反應歸因於潛在的 SCD 或使用白消安進行調理標籤上有血液學惡性腫瘤的盒裝警告

商業啟動計劃 Tom Klima, 首席商務和運營官
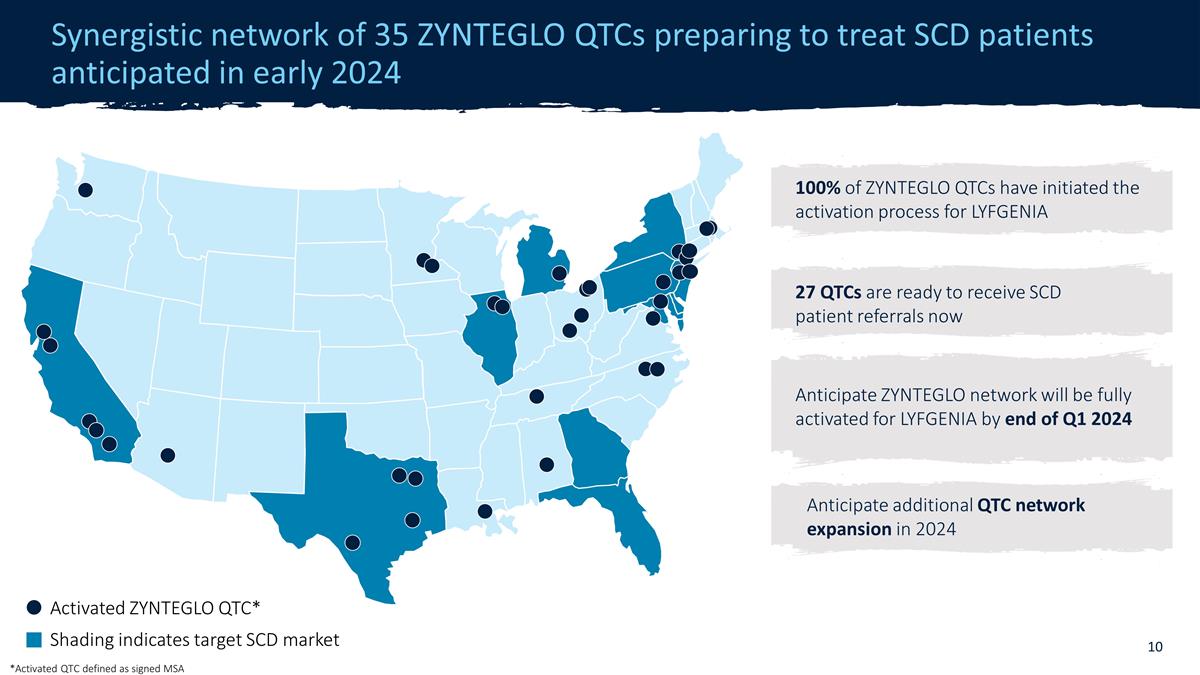
由 35 個 ZYNTEGLO QTC 組成的協同網絡預計於 2024 年初開始治療 SCD 患者 27 個 QTC 已準備好接受 SCD 患者轉診現已激活 ZYNTEGLO QTC* Shading 表示目標 SCD 市場預計 QTC 在 2024 年將進一步擴大 ZYNTEGLO QTC 的激活程序到 2024 年第一季度末,LYFGENIA 的 GLO 網絡將完全激活 *已激活 QTC 定義為簽名的 MSA
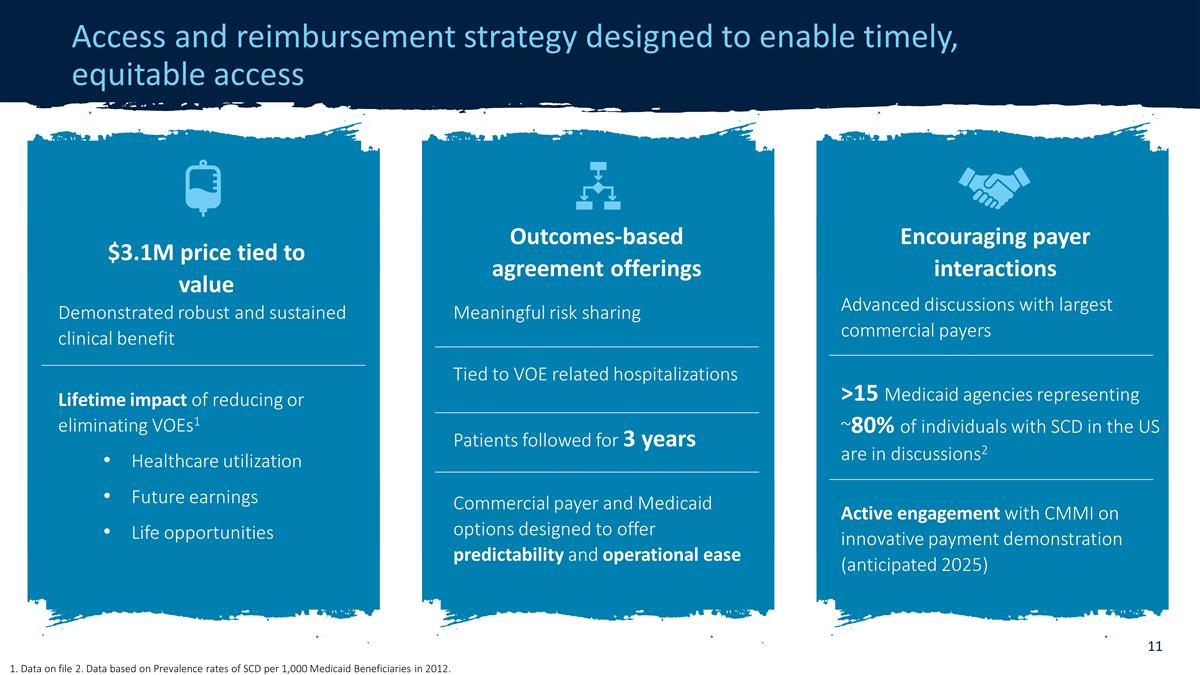
准入和報銷策略 旨在實現及時、公平的准入和補償策略 與佔美國SCD患者約80%的15家以上的最大商業支付機構進行高級討論2 積極參與CMMI的創新支付 演示(預計在2025年)鼓勵付款人互動顯示出穩健而持續的臨牀收益減少或取消VoeS1醫療保健利用率的終身影響未來收益生活機會310萬美元價格與價值掛鈎 與VOE相關的有意義的風險共擔相關住院患者關注了3年的商業付款人和醫療補助選項,旨在提供可預測性和操作便利性基於結果的協議產品 1.文件中的數據 2.數據基於 ,該數據基於2012年每1,000名醫療補助受益人中SCD的患病率。
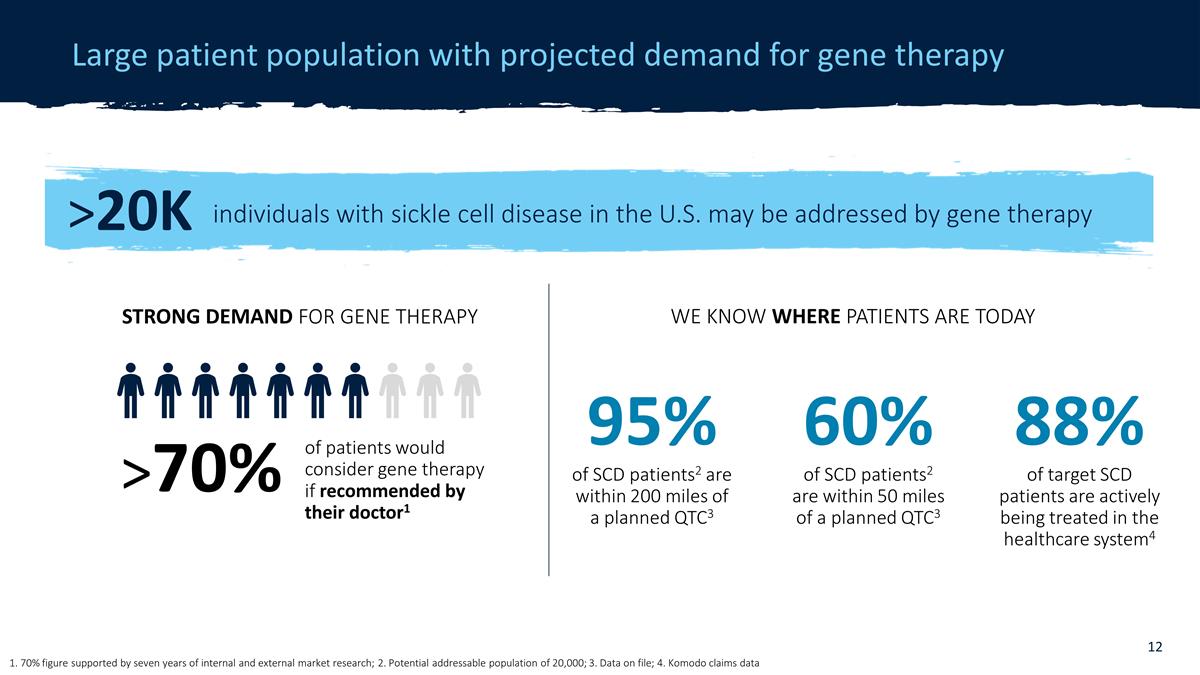
患者羣體龐大, 預計對基因療法的需求 1. 70% 的數字得到了七年的內部和外部市場研究的支持;2.潛在的可尋址人口為2萬人;3.存檔數據;4.科莫多聲稱數據 >2萬名 美國鐮狀細胞病患者可以接受基因療法治療,如果醫生推薦患者會考慮進行基因治療1 > 70% 對基因療法的強烈需求我們知道患者現在在哪裏 60% 的 SCD 患者2 距離 計劃的 QTC3 不到 50 英里 95% 的 SCD 患者2 距離計劃的 QTC3 在 200 英里以內 88% 的目標 SCD 患者正在醫療保健系統中積極接受治療4

2 潛在的數十億美元 機會在美國有 20,000 名可尋址患者強有力的商業戰略和預計的患者和醫生需求經驗豐富的商業基因治療團隊完全有條件推出 LYFGENIA™ 18 個月的商業先機 利用顯著的 ZYNTEGLO 發佈協同效應——預計會有同樣的治療醫生、相同的治療中心、相同的付款人 1 3 豐富的基因療法專業知識,包括製造經驗和成熟的商業 基礎設施
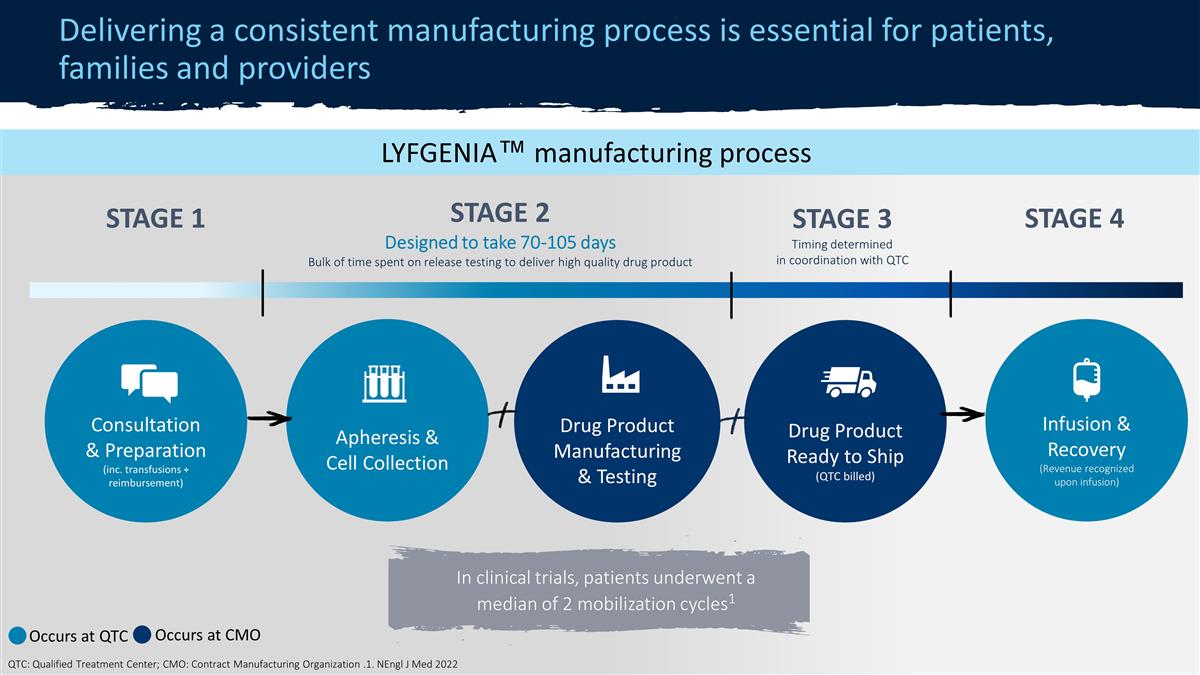
ZYNTEGLO® 製造 流程提供一致的生產流程對患者、家屬和提供者至關重要 STAGE 2◇ 70-90 天用於交付高質量藥品血液分離和細胞收集藥物 產品製造和測試藥物產品準備發貨(QTC 計費)輸液和恢復(輸液時確認收入)諮詢和準備(包括超級輸血 + 報銷確認)階段 1* 第 3* 階段 *發生在 QTC ◇ 發生在 CMO QTC:合格治療中心;CMO:合同製造組織在臨牀試驗中,大約有20%的病例進行了回憶。在商業環境中,所有患者都有 [已完成]回憶後的 治療過程。LYFGENIA™ 製造過程第 2 階段設計為耗時 70-105 天用於交付高質量藥物的釋放測試的大部分時間血液分離和細胞採集藥物產品 生產和測試藥物產品準備發貨(QTC 計費)輸液和恢復(輸液時確認收入)諮詢和準備(包括輸血+報銷)第 1 階段 4 在臨牀試驗中,患者經歷的動員週期中位數為 2 1 發生在 QTC 發生在 CMO QTC:合格治療中心;CMO:合同製造組織。1.NenGL J Med 2022 第 3 階段時機由 QTC 協調確定

知名基因療法領導者 有望釋放股東價值建立臨牀領導地位 10 多年的基因療法研究 180 多名患者治療 8 項臨牀試驗經驗豐富的團隊 100% 專注於在美國成功實現基因療法商業化 在監管方面取得成功建立了良好的記錄 3 美國食品藥品管理局批准的基因療法商業化基因療法領導者 3 商業發佈移植和細胞療法基礎設施久經考驗的報銷

致使這一里程碑成為可能的SCD戰士、護理人員、 倡導者、醫療保健提供者、調查人員、HCP和我們的藍鳥團隊。

Rich Colvin,醫學博士,首席醫學 官安德魯·奧本沙因首席執行官湯姆·克利馬首席商務和運營官