

附錄 99.1 Mecbotamab Vedotin (BA3011)、CAB-AXL-ADC、 單獨或與 Nivolumab 聯合用於非鱗狀非小細胞肺癌 BA3011 AXL NSCLC 患者的 2 期試驗 2023 年 12 月 4 日 BioAtla | 概述 1 機密

重要聲明和免責聲明本演示文稿( “演示文稿”)由 BioAtla, Inc.(“我們”、“我們的”、“BioAtla” 或 “公司”)包含 1995 年《私人證券 訴訟改革法》所指的與我們的業務、運營和財務狀況有關的 “前瞻性陳述”,包括但不限於有關業務計劃和前景以及我們的臨牀試驗是否會進行的陳述支持註冊; 里程碑的實現;我們的研發計劃的結果、實施、進展和時機,以及臨牀試驗;對我們臨牀試驗的註冊和劑量的預期,有關未來數據更新、臨牀 試驗、監管會議和監管機構申報的計劃和預期;針對特定資產形成合作或其他戰略夥伴關係的計劃;我們候選產品的潛在監管批准途徑;對我們 現金和現金等價物充足性的期望,以及優先考慮和重點開發選定資產和適應症的計劃。諸如但不限於 “預期”、“相信”、“可以”、“估計”、 “預期”、“打算”、“可能”、“計劃”、“潛力”、“預測”、“項目”、“應該”、“將” 或這些術語的否定詞, 以及傳達未來事件或結果不確定性的類似表達方式,用於識別前瞻性陳述。這些前瞻性陳述反映了管理層對未來事件的信念和看法,基於截至本演示文稿發佈之日的估計 和假設,受風險和不確定性的影響,包括公司向美國證券交易委員會提交的文件中描述的風險和不確定性,包括但不限於公司最新的10-Q表季度報告。 此外,公司在競爭激烈且瞬息萬變的環境中運營。新的風險不時出現。管理層無法預測所有風險,公司也無法評估所有因素對其業務的影響 ,也無法評估任何因素或因素組合可能導致實際業績與我們可能做出的任何前瞻性陳述中包含的結果存在重大差異的程度。鑑於這些不確定性,您不應過分依賴這些 前瞻性陳述。公司通過這些警示性陳述對本演示文稿中的所有前瞻性陳述進行限定。除非法律要求,否則公司沒有義務公開更新任何前瞻性 陳述,無論是由於新信息、未來事件還是其他原因。除非另有説明,否則此處包含的陳述均自本演示文稿之日起作出,在任何情況下,本演示文稿均不得暗示此處包含的信息在該日期之後的任何時候都是正確的,也不得對信息進行更新或重新審視以反映隨後可用的信息或在此日期之後發生的變化。 本演示文稿中包含的某些信息涉及或基於從獨立行業出版物以及獨立第三方進行的研究、調查和研究中獲得的統計和其他行業和市場數據,例如 ,以及公司自己對某些疾病和病症患病率的估計。本演示文稿中使用的市場數據涉及許多假設和限制,提醒您不要過分重視此類數據。 行業出版物和第三方研究、調查和研究通常表明,他們的信息是從被認為可靠的來源獲得的,儘管它們不保證此類信息的準確性或完整性。 該公司對有可能從使用公司可能開發的任何候選產品的治療中受益的患者羣體的估計包括基於其行業知識、行業出版物和 第三方研究的幾個關鍵假設,這些假設可能基於較小的樣本量,可能無法準確反映可尋址的患者羣體。儘管該公司認為其內部假設是合理的,但沒有任何獨立消息來源證實了這些 假設。本演示文稿可能包含屬於其他實體的商標、商品名稱或服務標記。公司無意使用或顯示其他方的商品名稱、商標或服務標識來暗示與這些其他方的關係,或由這些第三方的認可或贊助。公司或其任何董事、高級職員、員工、承包商、代理人、顧問、顧問或其他代表均未就本演示文稿中包含的信息的準確性或完整性作出任何明示或 暗示的陳述或保證。
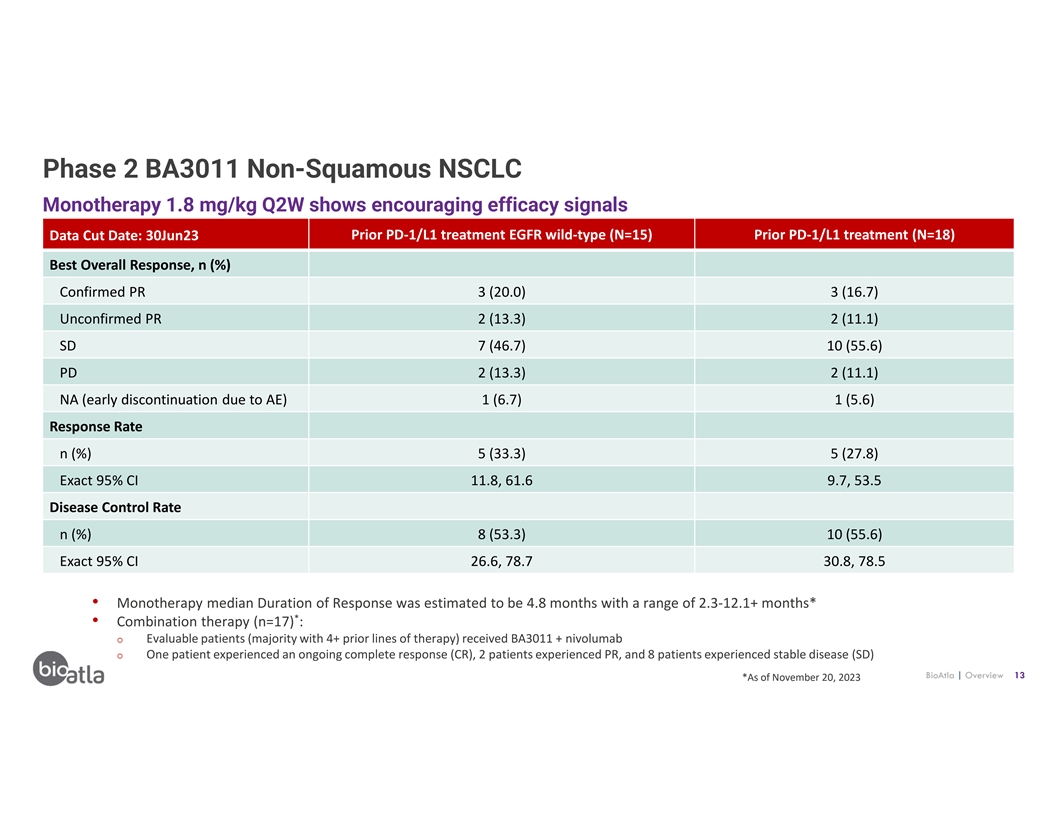
第 2 階段 BA3011 非鱗狀非小細胞肺癌單一療法 1.8 mg/kg Q2W 顯示 令人鼓舞的療效信號數據截止日期:6 月 30 日之前 PD-1/L1 治療 EGFR 野生型 (N=15) 先前 PD-1/L1 治療 (N=18) 最佳總體反應,n (%) 已確認 PR 3 (20.0) 3 (16.7) 未經證實 PR 2 (13.3) 2 (11.1) SD 7 (46.7) 10 (55.6) PD 2 (13.3) 2 (11.1) NA(由於 AE 提前停藥)1 (6.7) 1 (5.6) 迴應率 n (%) 5 (33.3) 5 (27.8) 精確 95% 置信區間 11.8、61.6 9.7、53.5 疾病控制率 n (%) 8 (53.3) 10 (55.6) 精確 95% 置信區間 26.6、78.7 30.8, 78.5 • 單一療法中位數 緩解持續時間估計為 4.8 個月,範圍為 2.3-12.1 個月以上* • 聯合療法(n=17):o 可評估患者(大多數已有 4 種以上療程)接受 BA3011 + nivolumab o 一名患者經歷 持續完全反應 (CR),2 名患者經歷 PR,8 名患者出現穩定性疾病 (SD) BioAtla | 概述 13 *截至 2023 年 11 月 20 日
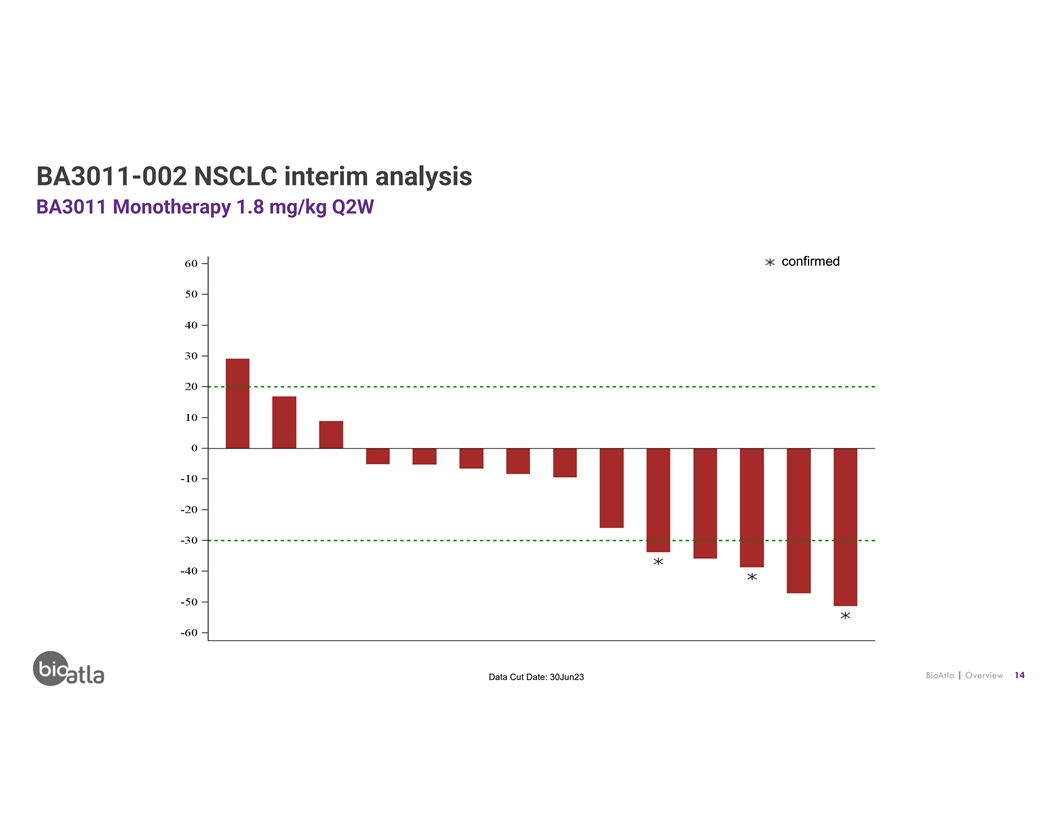
BA3011-002 NSCLC 中期分析 BA3011 單一療法 1.8 mg/kg Q2W 已確認 BioAtla | 概述 14 數據截止日期:23 年 6 月 30 日

BA3011-002 NSCLC 中期分析 BA3011 單一療法 1.8 mg/kg Q2W BioAtla | 概述 15 數據截止日期:23 年 6 月 30 日
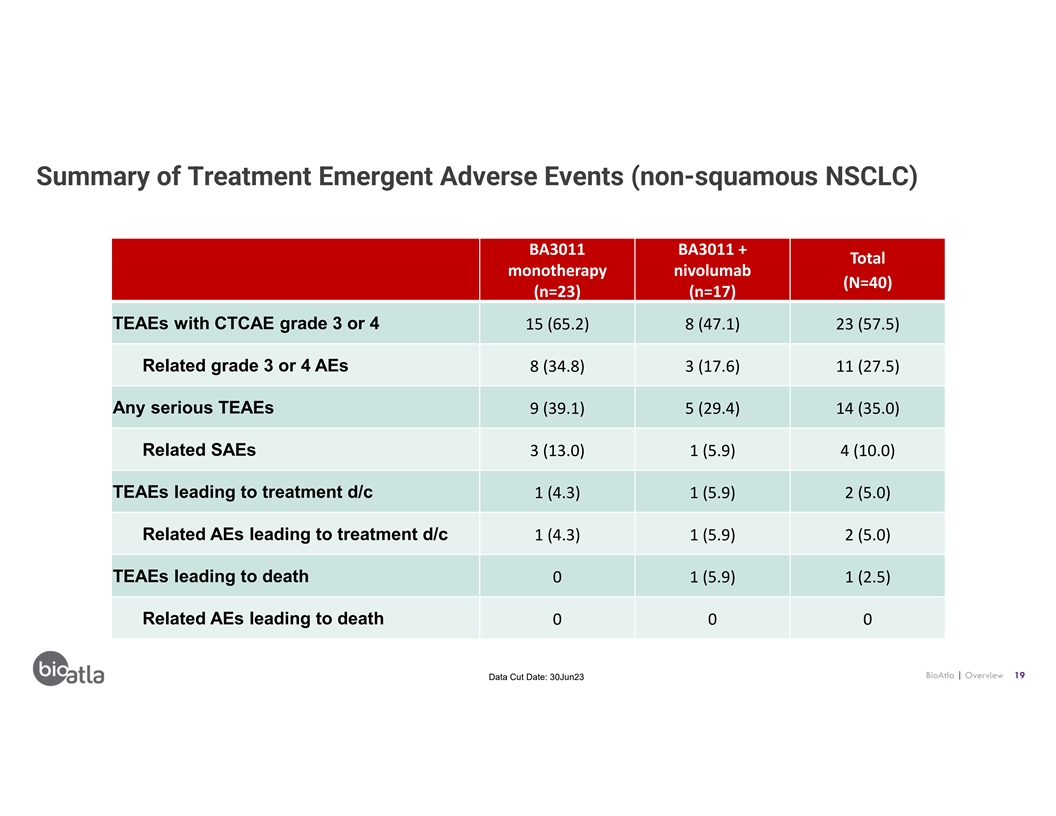
治療緊急不良事件(非鱗狀非小細胞肺癌)摘要 BA3011 BA3011 + 總單一療法 nivolumab (N=40) (n=23) (n=17) CTCAE 等級 3 或 4 的 TeaE 15 (65.2) 8 (47.5) 23 (57.5) 相關等級 3 或 4 AE 8 (34.8) 3 (17.6) 11 (27.5) 任何嚴重的 TeaE 9 (39.1)) 5 (29.4) 14 (35.0) 相關 SAE 3 (13.0) 1 (5.9) 4 (10.0) TeaE 導致治療 d/c 1 (4.3) 1 (5.9) 2 (5.0) 導致治療的相關不良反應 d/c 1 (4.3) 1 (5.0) 導致死亡 0 0 0 0 BioaTLA | 概述 19 數據截止日期: 23 年 6 月 30 日

治療緊急不良事件(非鱗狀非小細胞肺癌)* 研究人羣中任何等級 (≥ 15% 的患者)或 ≥3 級(≥ 3% 的患者)首選術語 TeaE 任何等級,n (%) 3 級 TeaE,n (%) 疲勞 14 (35.0) 1 (2.5) 腹瀉 10 (25.0) 1 (2.5) 便祕 9 (22.5) 0 {br 食慾下降} 9 (22.5) 1 (2.5) 貧血 8 (20.0) 2 (5.0) 噁心 8 (20.0) 0 周圍神經病變 7 (17.5) 1 (2.5) AST 增高 7 (17.5) 3 (7.5) 呼吸困難 6 (15.0) 2 (5.0) 中性粒細胞減少 6 (15.0) 2 (5.0) ALT 5 (12.5) 3 (7.5) * {br 中沒有 4+ 級 TeaE} 最常見。BioAtla | 概述 20 數據截止日期:23 年 6 月 30 日

BA3011 NSCLC 隨機註冊研究設計兩條可能 種註冊途徑通過 FDA C 型會議和 2 線 + • 開放標籤;對照:多西他賽 • 之前接受過至少一線轉移性疾病治療的非小細胞肺癌患者 • 雙 主要終點:無進展存活率和總存活率 rd 3 線 + • 失明;對照:化療單一療法 • 非小細胞肺癌患者之前接受過至少兩線轉移性疾病治療的 C • 主要終點:總體生存 BioAtla | 概述 23