
附錄 99.2

管理層對財務狀況和經營業績的討論和分析
導言
這份 管理層的討論與分析(“MD&A”)回顧了Aeterna Zentaris Inc.截至2023年9月30日的三個月和九個月期間的經營業績、財務狀況 和現金流。在本次MD&A中,“Aeterna Zentaris”、“Aeterna”、“公司”、“我們” 和 “我們的” 是指Aeterna Zentaris Inc. 及其子公司。本討論應與公司截至2023年9月30日以及截至2023年9月30日和2022年9月30日的三個月和九個月 期的 未經審計的簡明中期合併財務報表及其附註中包含的信息一起閲讀。我們未經審計的簡明中期合併財務報表是根據國際會計準則理事會(“IASB”)發佈的國際財務報告準則(“IFRS”) 編制的,該準則適用於編制中期財務報表,包括 IAS 34 中期財務報告.
公司的普通股在納斯達克資本市場(“納斯達克”)和多倫多證券交易所(“TSX”) 上市,股票代碼為 “AEZS”。本 MD&A 中的所有金額均以千美元(“美元”)列報,除股票和每股數據或另有説明外, 。本MD&A於2023年11月8日獲得公司董事會( “董事會”)的批准。本MD&A的日期為2023年11月8日。
關於 前瞻性陳述
本 文件包含可能構成美國和加拿大證券立法 和法規所指的前瞻性陳述的陳述,此類陳述是根據1995年《美國私人證券訴訟改革法 法》的安全港條款作出的。在某些情況下,這些前瞻性陳述可以用諸如 “預測”、“可能”、 “將”、“期望”、“預期”、“估計”、“打算”、“計劃”、“表明”、 “相信”、“直接” 或 “可能” 之類的詞語或短語來識別,或者這些術語的負面或其他旨在識別前瞻性陳述的類似表達 。此外,任何提及對未來事件或情況的預期、意圖、預測和其他描述的陳述都包含前瞻性信息。
前瞻性 陳述基於公司截至本次MD&A發佈之日的觀點和估計,它們受已知和 未知的風險、不確定性、假設和其他因素的影響,這些因素可能導致實際業績、活動水平、業績或成就 與此類前瞻性陳述所表達或暗示的實際業績、活動水平、業績或成就存在重大差異,包括但不限於下述因素 第 3 項,D. — “風險因素”在我們最近的 份表格20-F年度報告以及與以下內容相關的報告中:Aeterna對檢測試驗(定義見下文)的期望 (包括Detect試驗的受試者的招生、macimorelin生長激素刺激測試的應用以及 試驗的完成);Aeterna對進行臨牀前研究以鑑定和表徵 的期望 AIM 基於生物學的候選開發,用於治療視神經脊髓炎譜系障礙(“NMOSD”),如 和帕金森氏病(“PD”),併為選定的候選藥物制定生產工藝;Aeterna 對相關PD模型進行評估的期望;昆士蘭大學的後續研究人員 啟動了臨牀試驗,評估馬西莫瑞林作為治療肌萎縮性側索硬化症(“ALS”)( 也稱為盧·格里格氏病)的潛在治療方法,以及Aeterna的預製劑同樣的臨牀開發計劃; 開始 Aeterna 對 AEZS-150 的正式臨牀前開發(有潛力)慢性甲狀旁腺功能減退症的治療(定義見下文) ,為申請進行首次人體臨牀研究 AEZS-150 的潛在研究性新藥(“IND”)做準備;以及與Novo Nordisk Healthcare AG(“Novo Nordisk” 或 “Novo”)終止許可協議相關的影響,如下所述。
| 1 |
前瞻性 陳述涉及已知和未知的風險和不確定性以及其他因素,這些因素可能導致本文所述的實際業績、業績或成就 與前瞻性 信息所表達或暗示的任何未來業績、業績或成就存在重大差異。除其他外,此類風險和不確定性包括:我們依賴於Macrilen在歐洲 歐盟和美國成功進行的兒科臨牀試驗® (macimorelin);與完成 detect-trial 相關的潛在延遲;我們可能 無法在 detect-Trial 中招收預期數量的受試者,而且 detect-trial 的結果可能不支持獲得 對兒童發作生長激素缺乏症(“CGHD”)的監管批准;美國大學正在或計劃中的macimorelin臨牀前研究 的結果昆士蘭州或我們正在開發的其他產品可能無法成功或可能不支持將 產品推向人體臨牀試驗;我們的籌集能力資本並獲得融資以繼續我們目前計劃的運營; 我們對Macrilen成功的依賴®(macimorelin)和相關的對外許可安排,包括 繼續提供資金和資源來成功實現產品商業化;我們有能力與其他製藥公司簽訂額外的外部許可、開發、 製造、營銷和分銷協議並維持此類協議的生效;以及我們 繼續在納斯達克或多倫多證券交易所上市普通股的能力。這些風險因素並不代表可能影響公司的風險因素的完整清單 。但是,應仔細考慮這些因素和假設。有關這些因素和其他因素的更多詳細信息 信息包含在 第 3 項,D. — “風險 因素”在我們最新的20-F表年度報告中。
儘管 公司試圖確定可能導致實際業績與 前瞻性陳述中包含的業績存在重大差異的重要因素,但可能還有其他因素導致業績不如預期、估計或預期。這些 因素中有許多是我們無法控制的。無法保證此類陳述會被證明是準確的,因為實際結果和未來 事件可能與此類陳述中的預期存在重大差異。因此,讀者不應過分依賴前瞻性陳述 。除非適用的 證券法要求,否則公司不承諾更新此處包含的任何前瞻性陳述。新的因素不時出現,公司無法預測所有這些因素,也無法事先評估每個此類因素對公司業務的影響,也無法預先評估任何因素或 因素組合在多大程度上可能導致實際業績與任何前瞻性陳述中包含的業績存在重大差異。
此處包含的關於預期經營業績、財務狀況或現金流的某些 前瞻性陳述可能構成 財務前景。此類陳述基於對未來事件的假設,截至本文發佈之日給出,基於經濟 條件、擬議的行動方針和管理層對當前可用相關信息的評估。截至本文發佈之日,公司 管理層已批准財務展望。提醒讀者,此處 中包含的此類財務展望信息不應用於本文披露的目的以外的目的。
關於 材料信息
這份 MD&A 包含了在考慮所有情況後我們認為對投資者具有重要意義的信息。如果信息 和披露會導致或合理預期會導致我們證券的市場價格 或價值發生重大變化,或者理智的投資者可能會認為這些信息和披露在做出投資決策時很重要 ,我們認為這些信息和披露是重要的。
我們 是加拿大所有省份證券立法規定的申報發行人,我們的證券已在 美國證券交易委員會(“SEC”)註冊。因此,我們必須向相應的證券監管機構提交或提供持續披露信息, ,例如中期和年度財務報表、管理層的討論和分析、委託書或信息通告、20-F表年度報告 、重大變更報告和新聞稿。有關公司的更多信息 以及這些文件的副本可應我們的公司祕書要求免費獲取,也可以在互聯網 上通過以下地址獲取:www.zentaris.com、www.sedarplus.ca 和 www.sec.gov。
| 2 |
公司 概述
Aeterna Zentaris是一家專業生物製藥公司,致力於商業化和開發療法和診斷測試。該公司的 主打產品 Macrilen®(macimorelin)是美國食品藥品監督管理局(“FDA”)和 歐洲藥品管理局(“EMA”)批准的第一項也是唯一一項用於診斷成人生長激素缺乏症 (“AGHD”)患者的口服試驗。通過與Pharmanovia簽訂的獨家許可 協議,Macimorelin目前在歐洲經濟區以商品名Ghryvelin™ 上市,在英國以 的商品名銷售 “用於口服懸浮液袋裝的馬西莫瑞林60毫克顆粒”。該公司的其他幾個許可和商業化合作夥伴也在尋求批准在以色列和巴勒斯坦權力機構、大韓民國、土耳其和幾個非歐盟巴爾幹國家將馬西莫瑞林商業化 。 該公司正在北美、亞洲和 世界其他地區積極尋求馬西莫瑞林的商業化業務發展機會。我們還利用馬西莫瑞林的臨牀成功和令人信服的安全性來開發用於診斷CGHD的化合物 ,該領域的需求尚未得到滿足。
公司還致力於開發治療資產,並已建立臨牀前開發渠道,有望解決 在許多適應症中未得到滿足的醫療需求,重點是罕見和/或孤兒適應症,包括神經脊髓炎 視光譜障礙(NMOSD)、帕金森氏病(PD)、慢性甲狀旁腺功能減退症和肌萎縮性側索硬化症(盧·格里格氏病)。
主要運營進展

| 3 |
macimorelin 商業化計劃
2023 年 3 月 15 日,經公司同意,Consilient Health Limited(“Consilient” 或 “CH”)與 Atnahs Pharma UK Ltd.(Pharmanovia)簽訂了 份轉讓協議,將目前在歐洲經濟區和英國的馬西莫瑞林商業化 的許可協議以及當前的許可協議轉讓給 Pharmanovia 規定的供應協議,公司同意根據該協議提供許可產品。同樣在2023年3月15日,公司與Pharmanovia簽訂了一項修正協議 ,根據該協議,公司對轉讓協議表示了確認和同意,並同意了某些修訂後的 條款,這些條款與之前與CH的許可和供應協議沒有實質性區別。迄今為止,我們已經收到來自CH的50萬美元(50萬歐元)的總定價 里程碑付款,這筆款項涉及英國、德國和西班牙 批准的Ghryvelin™ /Macimorelin 60 mg標價。我們在 2022 年第一季度向 Consilient 運送了第一批馬西莫瑞林(Ghryvelin™ /Macimorelin 60 mg)。同時,Consilient在英國、瑞典、丹麥、芬蘭、德國和奧地利推出了該產品。 更多歐盟國家將關注待定的補償談判。2022 年 4 月 19 日,我們宣佈,歐洲專利局已經 頒發了一項專利,為歐盟內的 27 個國家以及其他 個歐洲非歐盟國家(例如英國和土耳其)提供馬西莫瑞林的知識產權保護,用於診斷成人 GHD 的馬西莫瑞林。同時,相關的 PCT 專利申請已在加拿大、日本、韓國、歐亞大陸和新西蘭獲得批准。
2023年5月9日,美國專利商標局向該公司頒發了11,644,474美元的專利,保護在兒科使用macimorelin診斷GHD。
自 2020 年 11 月 以來,Novo 以 Macrilen 的商品名銷售 macimorelin®通過許可協議和修訂後的許可 協議(統稱為 “Novo 修正案”)來診斷 AGHD。2022年8月26日,公司宣佈Novo 已行使終止Novo修正案的權利。經過270天的通知期,Aeterna重新獲得了對Macrilen的全部版權® 2023年5月23日在美國和加拿大,以及麥克利倫的銷售®在美國商業 市場暫時停產用於AGHD的診斷,直到預計將有其他商業化合作夥伴重新上市。公司繼續 積極制定戰略,為Macrilen尋找其他開發和商業化合作夥伴®在美國和其他 領土。暫時停止銷售麥克裏倫的決定®在美國, 對英國和歐洲經濟區的銷售和商業化工作沒有任何影響。
2020年6月25日,我們宣佈,我們與總部位於以色列的領先生物製藥公司MegaHarm Ltd. 簽訂了獨家分銷和相關質量協議,在以色列和巴勒斯坦權力機構實現macimorelin的商業化,用於 患者診斷和CGHD診斷的臨牀開發。根據協議條款,MegaPharm Ltd.將負責在以色列和巴勒斯坦權力機構註冊銷售macimorelin,而公司 將負責生產、產品供應、質量保證和控制、監管支持以及相關 知識產權的維護。2021年6月,MegaPharm Ltd.向以色列衞生部提交了申請,要求監管部門批准macimorelin在以色列 ,該申請於2022年11月獲得批准。
我們 與PharmBio Korea的子公司NK Meditech Ltd.(“NK”)簽訂了許可和供應協議,自2021年11月30日起生效,並與ER Kim Pharmicals Bulgaria Eood(“er-Kim”)簽訂了分銷和商業化協議,自2022年2月1日起生效。與NK的協議涉及大韓民國用於診斷AGHD 和CGHD的macimorelin的開發和商業化,而與er-Kim的協議則涉及用於診斷土耳其和一些非歐盟巴爾幹國家兒童和成人生長激素缺乏症的macimorelin的商業化。
| 4 |
macimorelin 臨牀項目
2020年1月28日,我們宣佈成功完成了第一項關於macimorelin作為評估兒童生長激素的生長 激素刺激試驗的兒科研究的患者招募工作。這項名為 AEZS-130-P01(“Study P01”)的研究是 在我們的兒科調查計劃(“PIP”)中與EMA商定的兩項研究中的第一項,該計劃將macimorelin作為GHD診斷方法。macimorelin, 一種生長素釋放肽激動劑,是一種口服活性小分子,可刺激生長激素從腦垂體分泌到 循環系統。P01研究的目標是確定一種既可以安全地給兒科患者服用的劑量,又可以導致 最終被診斷為沒有生長激素的受試者的生長激素濃度明顯上升。來自研究 P01的推薦劑量正在關於診斷療效和安全性的第二項關鍵研究,即研究P02中進行評估(“Detect-Trial”)。Study P01 是一項國際多中心研究,在匈牙利、波蘭、烏克蘭、塞爾維亞、白俄羅斯和俄羅斯進行。研究 P01 是 是一項開放標籤、組比較、劑量遞增試驗,旨在調查 2 至 18 歲以下的兒科患者,醋酸馬西莫瑞林的單次口服劑量上升至每千克 0.25、0.5 和 1.0 毫克 後醋酸馬西莫瑞林的安全性、耐受性和藥代動力學/藥效學 疑似冠狀動脈炎。在這項研究的三個隊列中,我們共招收了24名兒科患者 。根據研究方案,所有入組患者在成功完成篩查期 後完成了四次研究就診。在訪問1和訪問3中,根據研究地點 的當地做法進行了挑釁性的生長激素刺激測試。在訪問2中,進行了macimorelin測試,口服macimorelin溶液後,在預定義的時間採集了血液 樣本進行PK/PD評估。訪問4是研究結束時的安全隨訪訪問。
研究P01的 最終研究結果於2020年第二季度發佈,表明在CGHD中使用 macimorelin的安全性和耐受性數據是積極的,並且在成人研究預期的範圍內觀察到的PK/PD數據。
2020年4月7日,我們宣佈EMA決定接受我們對PIP的修改請求,該請求最初於2017年3月獲得批准, 涵蓋了兩項兒科研究的進行,並在這些研究的大綱中定義了相關的關鍵要素。我們認為 EMA的這一決定支持制定一項全球統一的測試驗證研究方案,特別是研究P02,我們 預計該協議將在歐洲和美國被接受。
2020年底,我們進入了臨牀安全性和有效性研究(AEZS-130-P02(“Detect-Trial”)的啟動階段, 評估馬西莫瑞林用於CGHD的診斷。Detect-Trial是一項開放標籤、單劑量、多中心和跨國研究 ,預計將在全球範圍內招收約100名受試者(包括美國和歐盟的受試者),其中至少有40名青春期前受試者和40名青春期受試者。 如果成功,預計研究設計將適合支持潛在的獨立測試的説法。2021 年 4 月 22 日,與該臨牀試驗相關的美國 FDA 在研新藥申請開始生效(參見:https://clinicaltrials.gov/ct2/show/NCT04786873), and 2021 年 5 月 13 日,我們宣佈根據諾沃修正案在美國開設第一個臨牀研究中心,在 Novo 發出 終止 Novo 修正案的通知後,Novo 已資助高達 1,010 萬美元(940 萬歐元)的檢測試驗費用。任何超過1,010萬美元(940萬歐元)的額外試用 費用將由Aeterna支付。
2022 年 1 月 26 日, ,我們宣佈,由於 COVID-19 疫情中 Omicron 變體的興起,Detect-試驗在中心啟動和患者入組方面遇到了不可避免的延遲。此外,2022年2月,由於俄羅斯入侵烏克蘭,計劃在俄羅斯和烏克蘭進行的 臨牀試驗活動暫停,因此,迄今為止,這兩個國家的 臨牀試驗中心均未招收任何患者。2023 年 1 月 17 日,我們提供了業務最新情況,強調通過增加一個臨牀研究組織 (CRO),以及用三個新國家(亞美尼亞、斯洛伐克和土耳其)以及美國的其他站點取代不活躍的國家和站點 ,有望提高 的註冊人數。2023 年 3 月,我們獲得批准並激活了我們在斯洛伐克的第一個基地,預計亞美尼亞的研究中心將獲得批准和激活土耳其將在2023年第四季度緊隨其後。 我們預計我們的檢測試驗的註冊將在2023年底左右完成。
| 5 |
Pipeline 擴展機會
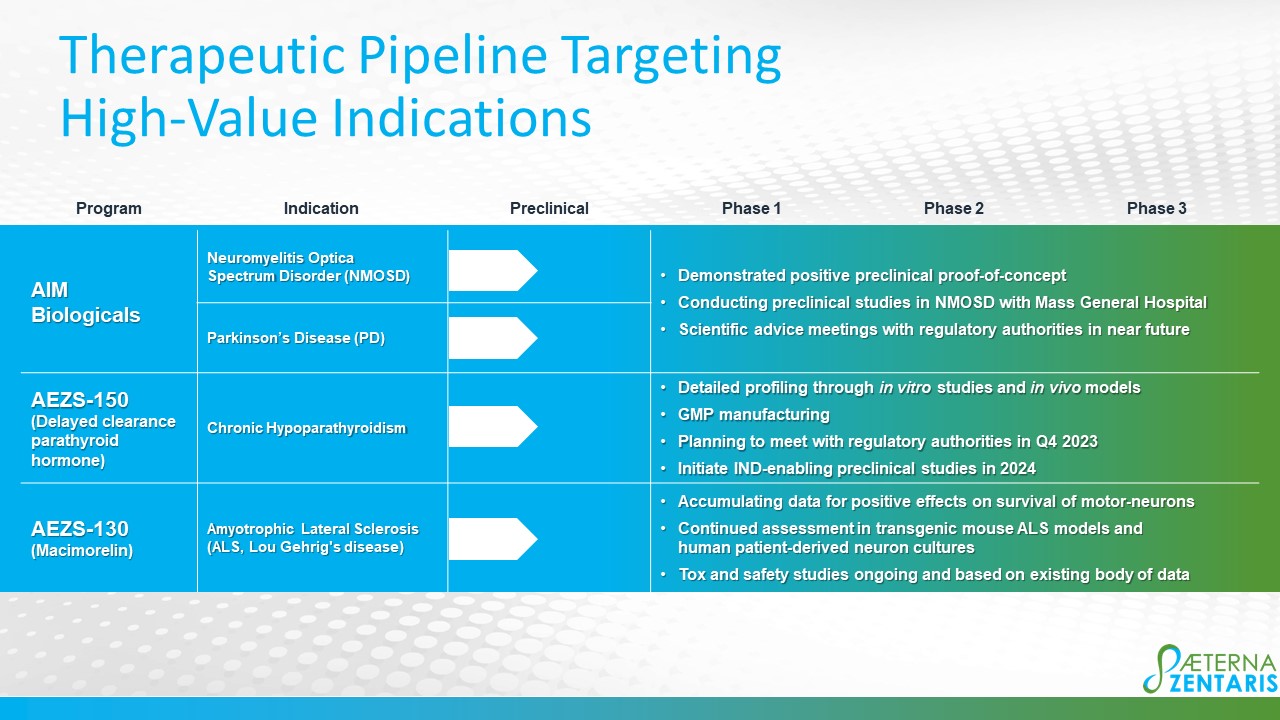
AIM Biologicals:用於潛在治療視神經脊髓炎譜系 疾病 (NMOSD) 和帕金森氏病的靶向、高度特異性的自身免疫修飾療法
AIM Biologicals 以懷孕期間的自然過程為基礎,可誘導母體免疫系統對 部分外來胎兒抗原產生免疫原耐受性。胎兒蛋白經過加工並呈現在某些具有免疫抑制作用的主要組織相容性複合物 I 類分子上,以誘發這種耐受性。在自身免疫性疾病中,免疫系統被誤導並靶向人體自身的 蛋白。通過AIM Biologicals,我們的目標是恢復對此類蛋白質的耐受性,以治療自身免疫性疾病。我們的 AIM Biologics 項目側重於罕見和孤兒適應症 NMOSD 以及第二常見的神經退行性疾病,即帕金森氏病 病。
2021 年 1 月 ,我們與德國維爾茨堡大學簽訂了獨家專利許可和研究協議,授予全球 開發、製造和商業化用於潛在治療NMOSD的AIM Biologicals的權利。此外,我們還聘請了維爾茨堡大學醫院的 Joerg Wischhusen 教授以及波士頓馬薩諸塞州 綜合醫院的神經免疫學家邁克爾·利維博士擔任炎症性中樞神經系統 “CNS” 疾病、神經系統自身免疫性疾病和 NMOSD 領域的科學支持和建議的顧問。2021 年 9 月,我們與維爾茨堡大學 簽訂了額外的獨家許可,用於帕金森氏病潛在治療的早期臨牀前開發。 2022年5月12日,我們宣佈了帕金森氏病創新小鼠模型的臨牀前積極結果,其中α-synuclein 特異性AIM Biologicals的治療顯示出運動功能改善的趨勢,調節性T細胞的顯著誘導和 對黑質神經元的救援。這些數據在 2022 年 5 月 6 日至 10 日在俄勒岡州波特蘭舉行的美國 免疫學家協會年度活動 IMMUNOLOGY2022™ 上公佈。2022 年 6 月 13 日,我們宣佈,我們已經實現了兩個 NMOSD 的 治療的概念驗證 體外 在鼠標模型中。這些發現於2022年6月10日至13日在希臘雅典舉行的第十三屆國際自身免疫大會 上發表。2022 年 10 月,我們與波士頓的馬薩諸塞州綜合醫院 醫院 (MGH) 和邁克爾·利維博士簽訂了研發協議,進行臨牀前研究 活體前和 活體在 NMOSD 中進行研究。
| 6 |
NMOSD 是一種自身免疫性疾病,靶向水通道蛋白4,主要存在於視神經和脊髓中。導致 導致失明和癱瘓的疾病的患病率為每10萬人中有0.7-10,與歐洲祖先相比,在亞洲或非洲人中更為常見, ,女性患病率是男性的九倍。NMOSD 通常以危及生命的復發為進展,使用大劑量類固醇和血漿置換術積極治療 。目前的治療選擇包括使用具有嚴重感染風險的免疫抑制性單克隆抗體 進行治療。我們的臨牀前計劃包括在兩者中擴展 治療NMOSD的現有概念驗證數據 體外和 活體評估以選擇基於 AIM Biologicals 的候選開發對象;以及為所選候選人開發 製造工藝。
帕金森氏病 病是一種神經系統疾病,通常與運動問題有關,進展緩慢而快。它是 種第二常見的神經退行性疾病,影響着全球1000萬人。PD 的特點是主要包含與產生多巴胺的細胞死亡相關的α-突觸核蛋白 蛋白 (αSyn) 的神經元包含。多巴胺能藥物是 PD 症狀的主要治療方法。 到目前為止,還沒有可用於預防或延緩疾病進展的藥物療法。正在研究其他治療方法,例如通過短暫的電脈衝刺激腦部 來治療症狀。為了開發AIM Biologicals 作為潛在的PD治療藥物,Aeterna除其他外利用了維爾茨堡大學研究人員最近發表的關於α-突觸核蛋白特異性 T細胞在AAV-A53T-α-突觸核蛋白帕金森氏病小鼠體內神經變性的創新動物模型。 我們正在繼續 體外和 活體測試抗原特異性 AIM Biologics 候選分子,用於潛在治療帕金森氏病 。
AEZS-150-延遲清除 (“DC”) 甲狀旁腺激素 (“PTH”) (“DC-PTH”) 融合多肽:慢性甲狀旁腺功能減退的潛在 治療慢性甲狀旁腺功能減退症
2021年3月11日,我們與英國謝菲爾德大學簽訂了與PTH融合多肽相關的知識產權 的獨家許可協議,該協議最初將由Aeterna研究,用於慢性甲狀旁腺功能減退(“HypoPT”)的潛在治療方法。根據與謝菲爾德大學簽訂的獨家專利和專有技術許可 協議的條款,我們獲得了開發、製造和商業化 PTH fusion 多肽的全球權利,用於所有人類用途,用於預付現金,並在實現某些開發、監管和銷售里程碑後支付 淨銷售額的低個位數特許權使用費這些產品以及與再許可有關的某些應付費用。我們將負責許可產品的進一步開發、 製造、批准和商業化。我們還根據研究 合同聘請了謝菲爾德大學,以開展某些由Aeterna資助的研究活動,其結果將包含在授予Aeterna的 許可證的範圍內。
謝菲爾德大學的 研究人員開發了一種延長肽血清清除時間的方法,該公司 正在將其應用於開發HypoPT的治療方法。HypoPT是一種孤兒病,其中PTH水平異常低或不存在, 在美國每10萬人的患病率為37例,丹麥為22例,挪威為9.4例,意大利為5.3至27。標準治療方法是補充鈣 和維生素 D。經與謝菲爾德大學協商,Aeterna 已選擇 AEZS-150 作為其 DC-PTH 項目的主要候選人 。AEZS-150 的開發旨在為成人提供每週一次的慢性甲狀旁腺功能減退症的治療選擇。最近的 進展包括成功驗證和複製謝菲爾德大學先前在甲狀旁腺功能減退的大鼠模型 中的體內數據,以及與公司的合同開發 和製造組織一起持續開發 AEZS-150 的製造工藝,為表達 AEZS-150 的細胞系建立主細胞庫,以及開發適用於更大規模良好生產實踐的生產 工藝。我們的下一步行動包括與謝菲爾德大學合作,繼續 對開發候選人進行深入描述 (體外和 活體);與監管機構會面, 正式確定 AEZS-150 的臨牀前開發,為可能提交首次人體內臨牀 研究的IND申請做準備。
AEZS-130-Macimorelin 臨牀前項目
2021年1月13日,我們與昆士蘭大學簽訂了材料轉讓協議,提供macimorelin,用於進行 臨牀前和臨牀研究,評估macimorelin作為治療肌萎縮性側索硬化症的治療藥物。肌萎縮性側索硬化症是一種罕見的進行性神經系統 疾病,主要影響控制自願運動的神經元,導致無法控制行走、 説話和咀嚼等運動。大多數肌萎縮性側索硬化症患者死於呼吸衰竭,通常在診斷後3-5年。目前 無法治癒肌萎縮性側索硬化症,也沒有有效的治療方法可以阻止或逆轉疾病的進展。生長素釋放肽是一種具有廣泛 生物學作用的激素,最出名的是刺激生長激素的釋放,這表明有新的證據可以治療肌萎縮性側索硬化症。 作為生長素釋放肽激動劑,macimorelin有可能作為肌萎縮性側索硬化症的治療藥物,本次研究合作對此進行了評估。
| 7 |
昆士蘭大學的研究人員已申請支持補助金,以進行此類臨牀研究。2022年7月,我們與澳大利亞布里斯班昆士蘭大學(UQ)的商業化公司UniqueSt Pty Ltd. 簽訂了一項研究 和選擇許可協議,以推進macimorelin作為治療肌萎縮性側索硬化症的潛在療法的開發。我們已經開發了一種適用於肌萎縮性側索硬化症患者的替代方案 配方,並且正在積累 AEZS-130 治療對運動神經元存活率的積極影響的數據。 我們將繼續在轉基因小鼠 ALS 模型以及人類患者衍生的神經元培養物中評估 AEZS-130,以證明 macimorelin 在該適應症中的治療潛力。我們的下一步行動包括完成正在進行的毒理學和安全性研究 以支持長期治療,並在可能實現概念驗證之後,向監管機構 提供科學建議,討論首先支持人體研究的項目開發。
簡明的 中期合併虧損表和綜合虧損數據
| (以千美元計,每股虧損除外) | 三個月已結束 | 九個月已結束 | ||||||||||||||
| 9月30日 | 9月30日 | |||||||||||||||
| 2023 | 2022 | 2023 | 2022 | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 收入 | 3 | 1,860 | 4,377 | 3,155 | ||||||||||||
| 開支 | ||||||||||||||||
| 銷售成本 | 11 | 14 | 167 | 106 | ||||||||||||
| 研究和開發 | 2,751 | 3,293 | 9,692 | 8,081 | ||||||||||||
| 銷售、一般和管理 | 1,791 | 2,274 | 6,130 | 6,218 | ||||||||||||
| 支出總額 | 4,553 | 5,581 | 15,989 | 14,405 | ||||||||||||
| 運營損失 | (4,550 | ) | (3,721 | ) | (11,612 | ) | (11,250 | ) | ||||||||
| 因外幣匯率變動而產生的收益(虧損) | (12 | ) | 301 | (44 | ) | 977 | ||||||||||
| 利息收入 | 419 | - | 739 | - | ||||||||||||
| 其他財務費用 | (2 | ) | - | - | (3 | ) | ||||||||||
| 淨財務收入 | 405 | 301 | 695 | 974 | ||||||||||||
| 所得税前虧損 | (4,145 | ) | (3,420 | ) | (10,917 | ) | (10,276 | ) | ||||||||
| 追回所得税 | - | - | - | |||||||||||||
| 淨虧損 | (4,145 | ) | (3,420 | ) | (10,917 | ) | (10,276 | ) | ||||||||
| 其他綜合損失: | ||||||||||||||||
| 外幣折算調整 | 323 | (105 | ) | 156 | (26 | ) | ||||||||||
| 固定福利計劃的精算收益(虧損) | 993 | (1,794 | ) | 913 | 6,231 | |||||||||||
| 綜合(虧損)收入 | (2,829 | ) | (5,319 | ) | (9,848 | ) | (4,071 | ) | ||||||||
| 每股基本虧損和攤薄後虧損 | (0.85 | ) | (0.70 | ) | (2.25 | ) | (2.12 | ) | ||||||||
| 8 |
中期合併財務狀況報表數據彙總
| (以千美元計) | 2023年9月30日 | 2022年12月31日 | ||||||
| $ | $ | |||||||
| 現金和現金等價物 | 38,756 | 50,611 | ||||||
| 貿易和其他應收賬款以及其他流動資產 | 3,064 | 4,648 | ||||||
| 庫存 | 91 | 229 | ||||||
| 限制性現金等價物 | 320 | 322 | ||||||
| 財產和設備 | 255 | 216 | ||||||
| 總資產 | 42,486 | 56,026 | ||||||
| 應付賬款和應計負債以及應付所得税 | 3,406 | 3,936 | ||||||
| 目前撥備的部分 | 56 | 45 | ||||||
| 遞延收入的當期部分 | 90 | 2,949 | ||||||
| 遞延收益的當期部分 | 529 | - | ||||||
| 租賃負債 | 147 | 114 | ||||||
| 非金融非流動負債 (1) | 11,980 | 13,206 | ||||||
| 負債總額 | 16,208 | 20,250 | ||||||
| 股東權益 | 26,278 | 35,776 | ||||||
| 負債和股東權益總額 | 42,486 | 56,026 | ||||||
| (1) | 主要包括員工的未來福利、準備金和遞延收入的非流動部分。 |
關鍵 會計政策、估算和判斷
根據國際財務報告準則編制簡明中期合併財務報表要求管理層做出判斷、估計 和假設,以影響公司報告的資產、負債、收入、支出和相關披露金額。 判斷、估計和假設基於歷史經驗、預期、當前趨勢以及管理層 在編制公司簡明中期合併財務報表時認為相關的其他因素。
管理層 定期審查公司的會計政策、假設、估計和判斷,以確保 合併財務報表公允列報,並符合適用於中期財務報表的國際財務報告準則。對會計估計數的修訂 在修訂估算的期間和未來任何受影響的時期內予以確認。
關鍵 會計估計和假設,以及在編制公司 簡明中期合併財務報表時應用會計政策時使用的關鍵判斷與適用於公司截至2022年12月31日止年度的年度合併財務 報表的判斷相同。
金融 風險因素和其他金融工具
公司截至2022年12月31日止年度經審計的合併財務報表附註24描述了 我們面臨的金融工具風險敞口的性質和程度,包括信用風險、流動性風險和市場風險 以及我們如何管理這些風險。與 與2022年12月31日的披露相比,截至2023年9月30日的三個月和九個月期間沒有重大變化。
| 9 |
收入
我們 的收入來自與客户的許可和合作協議(許可費、里程碑收入、特許權使用費)、提供 開發服務、某些活性藥物成分(“API”)、半成品和成品 的銷售,以及某些供應鏈活動,這些活動主要包括與 穩定性研究或基礎原料藥批量生產相關的開發活動相關的監督或監督支持服務與 客户簽訂合同。
| (以千美元計,百分比除外) | 截至9月30日的三個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 收入 | ||||||||||||||||
| 許可費 | - | 605 | (605 | ) | -100 | % | ||||||||||
| 開發服務 | - | 1,202 | (1,202 | ) | -100 | % | ||||||||||
| 特許權使用費 | 3 | 14 | (11 | ) | -79 | % | ||||||||||
| 供應鏈 | - | 39 | (39 | ) | -100 | % | ||||||||||
| 總收入 | 3 | 1,860 | (1,857 | ) | -100 | % | ||||||||||
在截至2023年9月30日的三個月期間,我們 的總收入減少了190萬美元。下降是由於公司與諾和諾德醫療的修訂協議於2023年5月終止 ,因此,2023年第三季度沒有確認許可費或開發服務 收入。
| (以千美元計,百分比除外) | 截至9月30日的九個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 收入 | ||||||||||||||||
| 許可費 | 1,554 | 831 | 723 | 87 | % | |||||||||||
| 開發服務 | 2,741 | 2,091 | 650 | 31 | % | |||||||||||
| 產品銷售 | 29 | 57 | (28 | ) | -49 | % | ||||||||||
| 特許權使用費 | 53 | 57 | (4 | ) | -7 | % | ||||||||||
| 供應鏈 | - | 119 | (119 | ) | -100 | % | ||||||||||
| 總收入 | 4,377 | 3,155 | 1,222 | 39 | % | |||||||||||
截至2023年9月30日的九個月期間,我們 的總收入為440萬美元,而 2022年同期為320萬美元,增長了120萬美元。增長是由於與Novo Nordisk Healthcare的修訂協議相關的許可費收入增加了70萬美元 和開發服務收入增加了70萬美元,但所有其他收入合計減少了20萬美元,抵消了 。
| 10 |
研究 和開發費用
下表彙總了我們在指定時期內產生的研發費用:
| (以千美元計,百分比除外) | 截至9月30日的三個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 直接研發費用: | ||||||||||||||||
| Macimorelin 兒科檢測試驗 | 1,179 | 974 | 205 | 21 | % | |||||||||||
| AEZS-130 — Macimorelin ALS | 318 | 757 | (439 | ) | -58 | % | ||||||||||
| AEZS-150 — DC-PTH | 374 | 587 | (213 | ) | -36 | % | ||||||||||
| Aim Biologics-帕金森氏病 | 160 | 152 | 8 | 5 | % | |||||||||||
| Aim Biologics-NMOSD | 255 | 113 | 142 | 126 | % | |||||||||||
| 細菌疫苗平臺-Covid-19 | - | 111 | (111 | ) | -100 | % | ||||||||||
| 細菌疫苗平臺-衣原體 | - | 103 | (103 | ) | -100 | % | ||||||||||
| 其他節目 | 77 | 145 | (68 | ) | -47 | % | ||||||||||
| 直接研發費用總額 | 2,363 | 2,942 | (579 | ) | -20 | % | ||||||||||
| 與員工相關的費用 | 314 | 270 | 44 | 16 | % | |||||||||||
| 設施、折舊和其他費用 | 74 | 81 | (7 | ) | -9 | % | ||||||||||
| 研發費用總額 | 2,751 | 3,293 | (542 | ) | -16 | % | ||||||||||
截至2023年9月30日的三個月,研究 和開發費用與截至2022年9月30日的三個月相比減少了50萬美元,這主要是由於直接研發費用減少了60萬美元。直接研究和開發 費用包括根據與第三方的安排產生的費用,例如合同研究機構、合同製造商、 和顧問。Detect試驗的費用增加了20萬美元,這是同期以來開設的檢測點 數量增加以及為Detect試驗招募患者的結果。
在 中,除了Detect-Trial外,該公司還積極與其大學研究合作伙伴合作開展指定的臨牀前項目。 與上一年相比,這些項目的支出波動主要是由於 這些項目的各種臨牀前活動的時間安排所致,尤其是2021年獲得許可的ALS和DC-PTH項目。
最後, 該公司在2023年第一季度停止開發 COVID-19 和衣原體疫苗試驗,導致截至2023年9月30日的三個月中,這兩個項目的支出 與截至2022年9月30日的三個月相比有所減少。
| 11 |
下表彙總了我們在指定時期內產生的研發費用:
| (以千美元計,百分比除外) | 截至9月30日的九個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 直接研發費用: | ||||||||||||||||
| Macimorelin 兒科檢測試驗 | 3,456 | 2,521 | 935 | 37 | % | |||||||||||
| AEZS-130 — Macimorelin ALS | 1,966 | 1,453 | 513 | 35 | % | |||||||||||
| AEZS-150 — DC-PTH | 1,339 | 1,302 | 37 | 3 | % | |||||||||||
| Aim Biologics-帕金森氏病 | 519 | 502 | 17 | 3 | % | |||||||||||
| Aim Biologics-NMOSD | 722 | 317 | 405 | 128 | % | |||||||||||
| 細菌疫苗平臺-Covid-19 | 113 | 305 | (192 | ) | -63 | % | ||||||||||
| 細菌疫苗平臺-衣原體 | 221 | 328 | (107 | ) | -33 | % | ||||||||||
| 其他節目 | 164 | 292 | (128 | ) | -44 | % | ||||||||||
| 直接研發費用總額 | 8,500 | 7,020 | 1,480 | 21 | % | |||||||||||
| 與員工相關的費用 | 953 | 888 | 65 | 7 | % | |||||||||||
| 設施、折舊和其他費用 | 239 | 173 | 66 | 38 | % | |||||||||||
| 研發費用總額 | 9,692 | 8,081 | 1,611 | 20 | % | |||||||||||
在截至2023年9月30日的九個月中,研究 和開發費用與截至2022年9月30日的九個月相比增加了160萬美元,這主要是受直接研發費用增加150萬美元的推動。在截至2023年9月30日的九個月中, 直接研發費用總額增加了150萬美元,這主要是由於Detect-試驗的 成本增加了90萬美元。與去年相比,該公司開設的檢測點數量有所增加, detect試驗招募的患者也有所增加,這導致成本比去年增加,當時該公司主要專注於建立用於患者入組的檢測 場所。
除Detect試驗外,該公司還積極與其大學研究合作伙伴合作開展指定的臨牀前項目。 截至2023年9月30日的九個月期間,AEZS-130(ALS)項目支出與截至2022年9月30日的期間相比增加了50萬美元,這與公司臨牀前活動的增加有關,主要是正在進行的毒理學 和安全性研究。與去年相比,DC-PTH和兩個Aim Biologic項目的支出波動主要是由各種臨牀前活動的時間和這些項目的進展所驅動的。
最後, 該公司在2023年第一季度停止開發 COVID-19 和衣原體疫苗試驗,導致截至2023年9月30日的九個月中,這兩個項目的支出 與截至2022年9月30日的九個月相比有所減少。
| 12 |
銷售、 一般和管理費用
下表彙總了我們在指定時段內產生的銷售、一般和管理費用:
| (以千美元計,百分比除外) | 截至9月30日的三個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 銷售、一般和管理費用: | ||||||||||||||||
| 工資和福利 | 717 | 1,059 | (342 | ) | -32 | % | ||||||||||
| 保險 | 247 | 416 | (169 | ) | -41 | % | ||||||||||
| 專業費用 | 474 | 124 | 350 | 282 | % | |||||||||||
| 其他辦公和一般開支 | 353 | 675 | (322 | ) | -48 | % | ||||||||||
| 銷售、一般和管理費用總額 | 1,791 | 2,274 | (483 | ) | 162 | % | ||||||||||
在截至2023年9月30日的三個月期間,我們 的銷售、一般和管理費用總額為180萬美元,而 在2022年同期為230萬美元,減少了50萬美元。減少的主要原因是工資和福利減少了30萬美元 ,保險費用減少了20萬美元,其他辦公和一般 費用減少了30萬美元,但被專業費用增加的40萬美元所抵消。工資和福利支出的減少主要與 向公司董事會發行30萬美元遞延股票單位的時間有關, 於2023年6月發行本年度權益,而去年8月發行的遞延股票單位為40萬美元。
下表彙總了我們在指定時段內產生的銷售、一般和管理費用:
| (以千美元計,百分比除外) | 截至9月30日的九個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 銷售、一般和管理費用: | ||||||||||||||||
| 工資和福利 | 2,478 | 2,097 | 381 | 18 | % | |||||||||||
| 保險 | 925 | 1,258 | (333 | ) | -26 | % | ||||||||||
| 專業費用 | 1,657 | 1,642 | 15 | 1 | % | |||||||||||
| 其他辦公和一般開支 | 1,070 | 1,221 | (151 | ) | -12 | % | ||||||||||
| 銷售、一般和管理費用總額 | 6,130 | 6,218 | (88 | ) | 10 | % | ||||||||||
在截至2023年9月30日的九個月期間,我們 的銷售、一般和管理費用總額為610萬美元,而 在2022年同期為620萬美元,減少了10萬美元。減少的主要原因是保險費用減少了30萬美元 ,其他辦公和一般費用減少了20萬美元,但被 工資和福利增加40萬美元所抵消,這主要是由於安排了3名新的全職員工。
| 13 |
淨財務收入
| (以千美元計,百分比除外) | 截至9月30日的三個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 因外幣匯率變動而產生的收益(虧損) | (12 | ) | 301 | (313 | ) | -104 | % | |||||||||
| 利息收入 | 419 | - | 419 | 100 | % | |||||||||||
| 其他財務收入(成本) | (2 | ) | - | (2 | ) | -100 | % | |||||||||
| 淨財務收入 | 405 | 301 | 104 | -104 | % | |||||||||||
在截至2023年9月30日的三個月期間, ,我們的淨融資成本為40萬美元,而截至2022年9月30日的三個月期間,淨融資收入為30萬美元 。這主要是由於我們的收益(虧損)減少了30萬美元,這是由於外幣變動 被銀行存款利息增加的40萬美元所抵消。
| (以千美元計,百分比除外) | 截至9月30日的九個月 | |||||||||||||||
| 2023 | 2022 | 改變 | 改變 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 因外幣匯率變動而產生的收益(虧損) | (44 | ) | 977 | (1,021 | ) | -105 | % | |||||||||
| 利息收入 | 739 | - | 739 | 100 | % | |||||||||||
| 其他財務收入(成本) | - | (3 | ) | 3 | -100 | % | ||||||||||
| 淨財務收入 | 695 | 974 | (279 | ) | -29 | % | ||||||||||
截至2023年9月30日的九個月期間,我們 的淨財務收入為70萬美元,而2022年同期為100萬美元 ,減少了30萬美元。這主要是由於外幣 貨幣變動導致的收益(虧損)減少了100萬美元,但銀行存款利息增加了70萬美元。
淨虧損
在截至2023年9月30日的三個月期間, ,我們報告的合併淨虧損為410萬美元,合每股普通股虧損0.85美元(基本),而截至2022年9月30日的三個月期間, 的合併淨虧損為340萬美元,合每股普通股(基本)虧損0.70美元。淨虧損增加70萬美元主要是由於收入減少了190萬美元,被 減少的110萬美元支出和10萬美元的財務收入增加所抵消。
在截至2023年9月30日的九個月期間 ,我們報告的合併淨虧損為1,090萬美元,合每股普通股虧損2.25美元(基本),而截至2022年9月30日的九個月期間, 的合併淨虧損為1,030萬美元,合每股普通股(基本)虧損2.12美元。淨虧損增加60萬美元的主要原因是總支出增加了160萬美元,淨財務收入減少了30萬美元,但收入增長了120萬美元。
| 14 |
精選 季度財務數據
| 三個月已結束 | ||||||||||||||||
| (以千美元計,每股數據除外) | 9月30日 2023 | 6月30日 2023 | 3月31日 2023 | 十二月三十一日 2022 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 收入 | 3 | 2,246 | 2,128 | 2,485 | ||||||||||||
| 淨虧損 | (4,145 | ) | (2,518 | ) | (4,255 | ) | (12,451 | ) | ||||||||
| 每股淨虧損(基本虧損和攤薄後) (1) | (0.85 | ) | (0.52 | ) | (0.88 | ) | (2.56 | ) | ||||||||
| 三個月已結束 | ||||||||||||||||
| (以千美元計,每股數據除外) | 9月30日 2022 | 6月30日 2022 | 3月31日 2022 | 十二月三十一日 2021 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 收入 | 1,860 | (222 | ) | 1,517 | 956 | |||||||||||
| 淨虧損 | (3,420 | ) | (4,216 | ) | (2,640 | ) | (2,894 | ) | ||||||||
| 每股淨虧損(基本虧損和攤薄後) (1) | (0.70 | ) | (0.87 | ) | (0.54 | ) | (0.63 | ) | ||||||||
| (1) | 每股淨虧損 基於每個報告期內已發行股票的加權平均數, 個季度之間可能有所不同。因此,季度每股淨虧損金額的總和可能不等於全年每股淨虧損。 |
不能將歷史 季度經營業績和淨虧損視為可預測趨勢的經常性收入或支出模式的反映,這在很大程度上是考慮到我們歷史收入中某些組成部分的非經常性質、與 在2021年啟動許多重要的臨牀前研發計劃相關的成本以及外匯損益的影響。 此外,我們無法預測許可協議將從特許權使用費中獲得多少收入。
2023 年第三季度收入減少 是由於公司與 Novo Nordisk Healthcare 的修訂協議於 2023 年 5 月終止,因此,2023 年第三季度未確認許可費或開發服務收入。
截至2022年12月31日的三個月期間, 的淨虧損增加是由於公司 商譽和無形資產的減值費用分別為7,642美元和372美元。
在截至2022年6月30日的三個月中, 收入減少和淨虧損增加是由管理層對Detect-Trial相關額外成本的最佳估計變更導致2022年第二季度40萬美元 的許可費和80萬美元的開發服務收入逆轉所致。
現金 流量
下表彙總了我們在所示期間的合併現金流:
| (以千美元計) | 三個月已結束 | 九個月已結束 | ||||||||||||||
| 9月30日 | 9月30日 | |||||||||||||||
| 2023 | 2022 | 2023 | 2022 | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 現金和現金等價物—期初 | 42,186 | 58,157 | 50,611 | 65,300 | ||||||||||||
| 用於經營活動的淨現金 | (3,384 | ) | (3,945 | ) | (11,738 | ) | (10,256 | ) | ||||||||
| 用於融資活動的淨現金 | (33 | ) | (33 | ) | (113 | ) | (101 | ) | ||||||||
| 用於投資活動的淨現金 | (10 | ) | (5 | ) | (15 | ) | (53 | ) | ||||||||
| 匯率變動對現金和現金等價物的影響 | (3 | ) | (358 | ) | 11 | (1,074 | ) | |||||||||
| 現金和現金等價物-期末 | 38,756 | 53,816 | 38,756 | 53,816 | ||||||||||||
| 15 |
經營 活動
截至2023年9月30日的三個月期間,用於經營活動的現金 總額為340萬美元,而 在2022年同期為390萬美元。運營現金流出減少50萬美元的主要原因是獲得了70萬美元的收入 退税,以及50萬美元其他非現金流出的減少,但被淨虧損增加的70萬美元所抵消。
截至2023年9月30日的九個月期間,用於經營活動的現金 總額為1170萬美元,而 在2022年同期為1,030萬美元。運營現金流出增加140萬美元,主要歸因於 淨虧損增加60萬美元,其他非現金流出增加130萬美元,但被所得税退税增加50萬美元所抵消。
流動性 和資本資源
公司管理資本的目標是確保有足夠的流動性來為研發成本、銷售費用、一般和管理費用 以及營運資金需求提供資金,包括股東權益,現金和現金等價物。在過去的幾年中,我們通過公開和私募股權發行和發行籌集了資金 ,並已進入許可階段 合作安排,其對價加上股票發行的收益 一直是我們的主要流動性來源。公司的資本管理目標與前幾期相同 。分紅政策是保留現金以保持可用資金,為 推進公司產品開發組合所需的活動提供資金,並在可能出現的適當商業機會時尋求適當的商業機會。 公司不受任何監管機構或任何其他外部來源施加的任何資本要求的約束。
資金充足
自 成立以來,公司在開發和共同推廣產品方面花費了大量開支。我們目前的業務重點 是:調查Macrilen™ 的進一步治療用途,擴大產品線開發活動,進一步擴大macimorelin在可用地區的商業化 ,併為正在進行的臨牀試驗費用提供資金。因此,公司在過去幾年中每年都蒙受了營業虧損 併產生了負的運營現金流,但截至2018年12月31日的年度除外, 當時公司通過在美國和加拿大出售成人適應症Macrilen™ 的許可證而獲得收入。該公司 預計在可預見的將來將產生鉅額支出和營業損失,因為它通過臨牀前 和臨牀開發推進其候選產品,尋求監管部門的批准,並尋求任何批准的候選產品的商業化。我們預計 我們的研發成本將因我們計劃的研發活動而增加。
截至2023年9月30日 ,該公司的累計赤字為3.621億美元。截至2023年9月30日的九個月期間,該公司的淨虧損也為1,090萬美元, 的運營現金流為負1170萬美元。我們認為,我們現有的 手頭現金將足以為至少未來12個月的預期運營和資本支出需求提供資金。 我們計劃主要通過手頭現金為未來的運營和資本支出提供資金。我們還相信,我們現有的手頭現金 將足以為我們在未來 12 個月之後和 2025 年的預期運營和資本支出需求提供資金。我們的估計是基於可能被證明是錯誤的假設,我們可能會比 預期的更快地耗盡資本資源。我們可能還需要額外的資金來獲得許可或收購其他候選產品。
| 16 |
我們 對財務資源將足以支持我們運營的時期的預測是一份前瞻性陳述 ,涉及風險和不確定性,由於多種因素,實際業績可能會有重大差異。我們未來的資本 需求很難預測,將取決於許多因素,包括:
| ● | 我們可能建立的任何其他合作、許可和其他安排的 條款和時間; | |
| ● | 針對我們當前和未來的潛在產品 候選產品的臨牀前研究和臨牀試驗的啟動、進展、時間和完成情況; | |
| ● | 我們 在監管批准要求上與 FDA 保持一致; | |
| ● | 我們追求的候選產品的 數量和特徵; | |
| ● | 監管批准的結果、時間和成本; | |
| ● | 可能由監管要求變化引起的延遲 ; | |
| ● | 僱用新員工以支持我們的持續增長的成本和時機; | |
| ● | 管理通貨膨脹的能力,包括利率上升以及與吸引和留住員工相關的勞動力成本增加; | |
| ● | 提交和起訴專利申請以及執行和辯護專利索賠所涉及的 費用; | |
| ● | 提出和起訴知識產權以及執行和辯護任何與知識產權相關的索賠的 成本; | |
| ● | 迴應投訴和潛在訴訟併為自己辯護的費用; | |
| ● | 為我們的候選產品採購臨牀和商業用品的 成本和時間;以及 | |
| ● | 我們在多大程度上收購或許可其他候選產品和技術。 |
截至 2023 年 9 月 30 日的合同 義務和承諾
報告期末簽訂合同但未確認為負債的大量 支出如下:
| (以千美元計) | 總計 | |||
| $ | ||||
| 少於 1 年 | 6,857 | |||
| 1-3 年 | 131 | |||
| 4-5 年 | 36 | |||
| 超過 5 年 | - | |||
| 7,024 | ||||
在 2021 年,公司與開發合作伙伴簽訂了各種協議,包括許可協議和類似協議。此類協議 可能要求公司在達到開發階段、發佈階段或收入里程碑時付款,儘管公司 通常有權終止這些協議而不收取任何罰款。在實現與特定產品相關的某些 銷售量、監管或其他里程碑後,公司可能需要支付高達38,127美元的費用。
突發事件
在 的正常運營過程中,公司可能會參與與合同 終止、員工相關和其他事項有關的各種索賠和法律訴訟。
相關的 交易方交易和資產負債表外安排
除僱傭協議和與我們的管理層簽訂的賠償協議外 ,沒有關聯方交易。
正如2023年9月30日的 一樣,我們在特殊目的實體或任何其他資產負債表外安排中沒有任何權益。
風險 因素和不確定性
對我們證券的投資涉及很高的風險。除了本MD&A和 相關合並財務報表中包含的其他信息外,我們敦促投資者仔細考慮我們最新的截至2022年12月31日止年度的20-F表年度報告中 “風險 因素” 標題下描述的風險,以討論可能對我們業務產生重大影響的各種風險 。我們目前不知道或我們目前認為無關緊要的風險和不確定性也可能 對我們的業務、經營業績和財務狀況造成重大損害,並可能導致您的投資完全損失。
| 17 |
我們 最新的20-F表年度報告已通過www.sedarplus.com 向加拿大和美國證券監管機構提交,並通過www.sec.gov向美國證券交易委員會提交。敦促投資者查閲這些文件中的風險因素。
披露 控制和程序
公司首席執行官和首席財務官負責建立和維護我們的披露 控制和程序(該術語的定義見《交易法》第13a-15(e)條和第15d-15(e)條以及加拿大證券法)。 我們的披露控制和程序旨在確保在 證券交易委員會規則和表格規定的時限內,記錄、處理、彙總和報告根據美國和加拿大證券立法提交或提交的報告中要求披露的信息,並確保我們在 根據《交易法》提交或提交的報告中需要披露的信息得到收集並傳達給我們的管理層,包括首席執行官 官和首席執行官財務官員,以便及時就所需的披露做出決定。
任何 控制和程序,無論設計和操作多麼完善,都只能為實現預期的控制 目標提供合理的保證,管理層在評估可能的控制和程序的成本效益關係時都必須運用其判斷力。 在截至2023年9月30日的九個月期間,我們的披露控制和程序沒有重大變化, 對披露控制和程序產生重大影響或有理由可能對披露控制和程序產生重大影響。
對財務報告的內部 控制
我們的 管理層負責建立和維持對財務報告的充分內部控制(如《交易法》和加拿大證券法第13a-15(f)條和第15d-15(f)條對 的定義)。我們對財務報告的內部控制 是一個流程,旨在根據國際會計準則理事會發布的國際財務報告準則,為財務報告的可靠性以及為外部目的編制財務 報表提供合理的保證。
我們 對財務報告的內部控制包括以下政策和程序:(i) 與保存記錄有關的政策和程序, 這些記錄應以合理的細節準確和公平地反映Aeterna Zentaris的交易和資產處置;(ii) 提供 合理的保證,確保根據國際會計準則理事會發布的國際財務報告準則 編制財務報表而且公司的支出只能根據管理層的授權支付 和發行人的董事;以及(iii)就防止或及時發現可能對財務報表產生重大影響的未經授權的收購、 使用或處置公司資產提供合理的保證。
由於 的固有侷限性,財務報告的內部控制可能無法防止或發現錯誤陳述。此外, 對未來時期任何有效性評估的預測都可能面臨這樣的風險,即由於條件的變化,控制可能變得不足, 或者遵守政策或程序的程度可能會惡化。
財務報告內部控制的變化
在截至2023年9月30日的三個月期間, 我們的財務報告內部控制措施沒有重大變化, 對財務報告的內部控制產生了重大影響或有理由可能對財務報告的內部控制產生重大影響。
| 18 |