
推進藥物發展。解決問題。改善生活。推進藥物發展。解決問題。改善生活。2023 年 11 月公司簡報

推進藥物發展。解決問題。改善生活。免責聲明本演示文稿及隨附的口頭評論由Aquestive Therapeutics, Inc.(“公司”、“我們的” 或 “我們”)編寫,包含1995年《私人證券訴訟改革法》所指的前瞻性陳述。諸如 “相信”、“預期”、“計劃”、“預期”、“估計”、“打算”、“可能”、“將” 或這些術語的否定詞語以及類似的表達方式旨在識別前瞻性陳述。這些前瞻性陳述包括但不限於有關我們的候選產品 Anaphylm™(腎上腺素)通過臨牀開發和美國食品藥品監督管理局(FDA)批准,用於緊急治療包括過敏反應在內的嚴重過敏反應的候選產品Anaphylm(腎上腺素)的進展和相關時機的陳述,包括提交我們的關鍵藥代動力學(PK)臨牀試驗和其他支持性臨牀研究;關於臨牀開發和批准的進展和相關時機美國食品藥品管理局對公司候選產品Libervant™(地西泮)Buccal Film的新藥申請(NDA),用於急性治療間歇性、陳規定型的頻繁發作發作(即發作集羣、急性反覆發作),這些發作與2至5歲癲癇患者通常的發作模式不同;關於批准Libervant向這些癲癇患者提供美國市場準入年齡在12歲及以上,並且克服了美國食品藥品管理局批准的鼻噴霧劑在孤兒藥市場的排他性另一家公司針對該年齡組患者羣體的產品延期至2027年1月;關於我們的產品和候選產品可能為患者帶來的潛在益處;關於向第三方許可我們的候選產品Anaphylm(美國以外的Anaphylm)以及在美國和世界各地的Libervant的潛在可能性;關於將我們的候選產品(包括Anaphylm和Libervant)推向市場並獲得市場接受的能力;關於比率以及市場對我們的接受程度和需求程度許可產品;關於擴大公司製造能力、支持美國和其他國家對現有和潛在未來許可產品的需求增長以及此類活動收入增長的潛在和相關時機;關於公司2023年財務前景及其增長以及未來的財務和經營業績及財務狀況;以及其他非歷史事實的陳述。這些前瞻性陳述受全球商業和宏觀經濟狀況的不確定影響,包括通貨膨脹、利率上升、全球銀行體系不穩定和地緣政治衝突(包括烏克蘭和以色列戰爭)所產生的影響,以及 COVID-19 全球疫情對公司業務的影響,包括臨牀試驗的啟動、註冊以及臨牀試驗的時間和充足性;對監管機構提交和監管審查以及批准 Anaphylm 和Libervant、藥物原料和其他原材料的供應鏈、製造和分銷;以及合適的勞動力和熟練專業人員的持續供應。這些前瞻性陳述基於公司當前的預期和信念,存在許多風險和不確定性,這些風險和不確定性可能導致實際業績與前瞻性陳述中描述的結果存在重大差異。此類風險和不確定性包括但不限於與公司開發工作相關的風險,包括我們的產品開發活動以及Anaphylm、Libervant和其他候選產品的臨牀試驗的時間延遲或變化;公司能夠在針對2至5歲癲癇患者的Anaphylm和Libervant的臨牀試驗中生成足夠數據的風險;風險該公司迴應美國食品藥品管理局對公司關鍵PK研究的評論的能力FDA Anaphylm 第 2 階段終了會議上確定的方案和其他問題;FDA 可能需要額外的臨牀研究才能批准 Anaphylm 和 Libervant 用於2至5歲癲癇患者的風險;Anaphylm、Libervant和我們的其他候選產品延遲或未能獲得美國食品藥品管理局批准的風險;美國食品藥品管理局不批准任何年齡組患者Libervant進入美國市場的風險通過克服美國食品藥品管理局批准的鼻腔噴霧劑產品長達七年的孤兒藥市場排他性2027年1月,無法保證公司成功獲得美國食品藥品管理局對Anaphylm和Libervant的任何批准,包括任何年齡組患者的Libervant的美國市場準入;在公司收到美國食品藥品管理局對這些2至5歲癲癇患者的Libervant保密協議的批准之前,Libervant的競爭性兒科癲癇產品有可能獲得美國食品藥品管理局的批准;風險相關美國食品藥品管理局關於孤兒藥獨家經營的決定的不可預測性;提起訴訟的風險如果美國食品藥品管理局批准Libervant向該癲癇患者羣體中的任何年齡組提供美國市場準入,則第三方與克服其孤兒藥獨家經營權有關;出於其他原因獲得Libervant市場準入的風險;與公司開發工作相關的風險,包括公司產品開發活動的時間、成本和成功發生的任何延遲或變化;任何競爭產品成功的風險;商業化所固有的風險新產品(包括技術風險,財務風險、市場風險和實施風險以及監管限制);我們的候選產品(包括Anaphylm和Libervant)以及我們在美國和國外的許可產品的接受率和程度的風險;資本和現金資源不足的風險,包括無法獲得可用的債務和股權融資以及運營收入,以滿足公司當時和現在的所有短期和長期流動性和現金需求以及其他現金需求所需的金額,包括為未來提供資金Anaphylm、Libervant 和其他候選產品的臨牀開發活動;我們的製造能力足以支持美國和其他國家對現有和潛在未來許可產品的需求的風險;基礎業務實現增長的風險;我們能夠與第三方進行其他商業交易以支持我們的業務增長和關鍵計劃的執行的風險;任何競爭產品成功的風險;Supe市場份額被侵蝕的風險 boxone® 和風險即是日落產品,佔我們當前營業收入的很大一部分;產品市場規模和增長的風險;遵守美國食品和藥物管理局以及其他政府和客户對我們生產設施的所有要求的風險;與公司產品相關的知識產權和侵權索賠的風險;意外專利發展的風險;與總體經濟、政治(包括戰爭和恐怖主義行為)、商業、工業、監管、金融和市場狀況相關的不確定性以及其他異常項目;以及 “風險因素” 部分以及公司向美國證券交易委員會提交的2022年10-K表年度報告、10-Q表季度報告和8-K表最新報告中包含的其他章節中描述的影響公司的其他風險和不確定性。鑑於這些不確定性,您不應過分依賴這些前瞻性陳述,這些陳述僅代表截至發表之日。本警示聲明明確對歸因於公司或任何代表公司行事的人的所有後續前瞻性陳述進行了全面限定。除非適用法律要求,否則公司沒有義務在本陳述之日之後更新前瞻性陳述、展望或指導,無論是由於新信息、未來事件還是其他原因。PharmFilm® 和 Aquestive 徽標是 Aquestive Therapeutics, Inc. 的註冊商標。AQST-109 “Anaphylm” 的商品名已獲得美國食品藥品管理局的有條件批准。Anaphylm™ 專有名稱的最終批准取決於美國食品藥品管理局對候選產品 AQST-109 的批准。此處提及的所有其他註冊商標均為其各自所有者的財產。© 2023 Aquestive Therapeutics, Inc. 的財產 2

推進藥物發展。解決問題。改善生活。我們的使命 Aquestive 是一家制藥公司,致力於開發藥物,通過創新的科學和給藥技術為患者的生活帶來有意義的改善 3

推進藥物發展。解決問題。改善生活。在未來五年中,我們的目標是:• 增加現有和美國以外的合作收入 • 獲得美國食品藥品管理局對Anaphylm™ 的批准 • 在2027年或之前在美國推出Libervant™ • 利用Adrenaverse™ 平臺(腎上腺素前藥平臺)推廣候選產品我們對建立公司有着強烈的願景 4 1。估計值基於美國食品藥品管理局批准的鼻噴劑產品在2027年1月之前對孤兒藥市場的獨家經營權。

推進藥物發展。解決問題。改善生活。Aquestive 是一個擁有多種資產的成長故事 5 現有合作的創收基礎 • 5 種經美國食品藥品管理局批准的產品 • 8 項合作 • 在 6 大洲 10 年以上的產品銷售 • 自 2018 年以來推出了多款產品 • 全球有 150 多項專利 • Adrenaverse™ 腎上腺素前藥平臺有可能在未來進行多次產品線迭代和適應症 2027 年或之前可能舉辦商業化活動 • Anaphylm™ (epinephrine)舌下膠片——首款也是唯一一款基於非器械的過敏反應候選口服產品 •預計將於2024年申請美國食品藥品管理局批准 • 用於治療12歲及以上癲癇患者發作集羣的Libervant™(地西泮)脣膜——預計將於2027年上市 • 適用於2-5歲患者的Libervant 新藥上市已獲美國食品藥品管理局接受;PDUFA 的目標行動日期為 2024 年 4 月 28 日

推進藥物發展。解決問題。改善生活。6 我們的核心技術被命名為 PharmFilm®
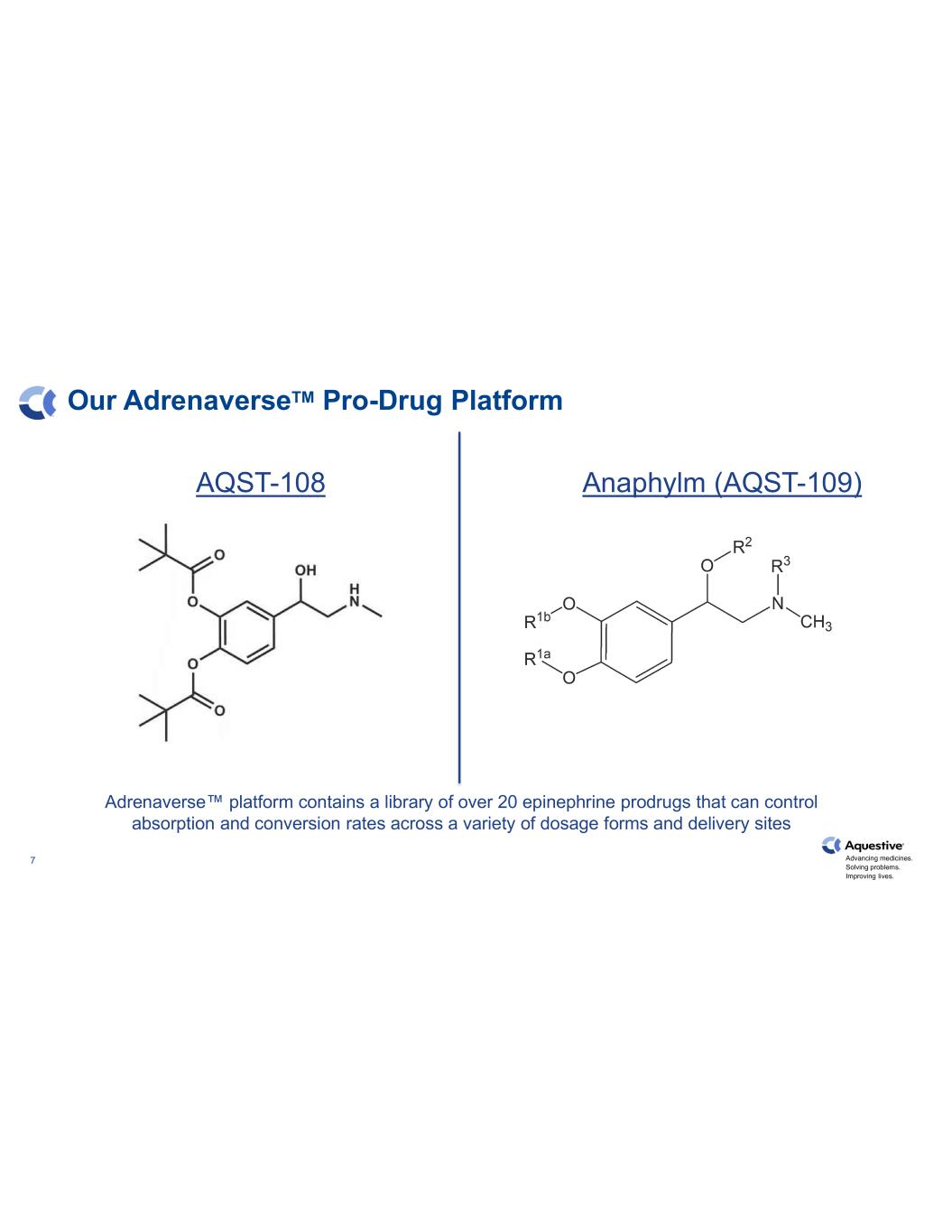
推進藥物發展。解決問題。改善生活。7 我們的 AdrenaverseTM Pro-Drug Platform AQST-108 Anaphylm (AQST-109) Adrenaverse™ 平臺包含一個包含 20 多種腎上腺素前藥的庫,可以控制各種劑型和給藥地點的吸收和轉化率

推進藥物發展。解決問題。改善生活。2023 年和 2024 年的產品組合和許可機會 AQST-108 配方(腎上腺素)(替代適應症)專有增長驅動力臨牀前臨牀領域已上市 8 Hypera — 巴西 Hypera — China Libervant™(地西泮)頰膜(發作集羣)Libervant™(地西泮)脣膜美國亞洲南美 Anaphylm™(腎上腺素)舌下膠片美國出售。權利斷言 Therapeutics Indivior Kempharm Zevra Tanabe — 美國 Hypera — 巴西 Zambon — EU Hyparmanovia 許可機會區域許可協議 IP 許可(僅限版税)全球許可協議(利魯唑)口服片(開發階段)Anaphylm™(腎上腺素)舌下電影(過敏反應)

推進藥物發展。解決問題。改善生活。強大的領導團隊 Daniel Barber 總裁、首席執行官兼董事 Lori J. Braender 高級副總裁、總法律顧問肯·馬歇爾首席商務官 Mark Schobel 首席創新和技術官 Ernie Toth 首席財務官 9 Cassie Jung 高級副總裁 Steve Wargacki 研發高級副總裁 Carl Kraus 強大運營與合作團隊經驗豐富的科學/知識產權/開發團隊信息技術、人力資源和傳播高級副總裁 Peter Boyd

推進藥物發展。解決問題。改善生活。我們現在正專注於下一章 • 在 2023 年第四季度開始對 Anaphylm™ 進行關鍵研究 • 繼續加強資產負債表 • 繼續為 Libervant™ 和 Anaphylm™ 尋求向外許可的機會 • 繼續發展我們的許可和供應業務 10

推進藥物發展。解決問題。改善生活。Anaphylm™(腎上腺素)舌下電影 11

推進藥物發展。解決問題。改善生活。過敏反應:一種嚴重的全身性超敏反應,通常起病迅速,可能致命 12 1。Turner PJ 等人世界過敏組織 J. 2019;12100066。2.票價,2022 年;https://www.foodallergy.org/resources/facts-and-statistics。3.Fromer L.《美國醫學雜誌》(2016);129、1244-1250。在美國,多達3,200萬人有急性過敏發作的慢性風險。在一項全國患者調查中,有52%以前經歷過過敏反應的患者從未接受過腎上腺素自動注射器處方,過敏反應的直接費用估計為每年12億美元。在同一項患者調查中,60%的受訪者目前沒有自動腎上腺素注射器 1 2 3 3 3

推進藥物發展。解決問題。改善生活。13 過敏反應的治療 — 腎上腺素 • 腎上腺素是過敏反應的第一線治療方法 • 腎上腺素是唯一被證明可以阻止危及生命的過敏反應的藥物 • 腎上腺素劑量(目前的藥物給藥系統):• 肌肉注射(IM)或皮下注射 0.3-0.5mg • 兒童劑量以體重計:1. 0.100 mg(適用於 16.5 至 33 磅的兒童)— AUVI-Q® 品牌僅限 2. 0.15 毫克(適用於 66 磅以下的兒童)3. 0.3 毫克(適用於 66 磅以上的兒童和成人)• 可以根據需要給予第二劑腎上腺素 1 1。腎上腺素在過敏反應管理中的作用。Brown JC、Simons E、Rudders SA。J Allergy Clin Immunol Pract。2020 年 4 月;8 (4): 1186-1195。doi:10.1016/j.jaip.2019.12.015 PMID:32276687。2.EpiPen® 包裝説明書。2 2

推進藥物發展。解決問題。改善生活。14 腎上腺素市場在 2023 年趨向 >460 萬 tRx 1.交響樂健康 2023 年 9 月,所有市場數據僅限於美國和地區 2022 年腎上腺素市場在 2022 年超過 400 萬 tRx,並在仿製藥和 Covid-19 疫情導致低迷後反彈至歷史新高。2023 年的 tRx 數量已連續 9 個月超過上年。1

推進藥物發展。解決問題。改善生活。15 個不滿意度高且需求未得到滿足的仿製藥市場 1.KOL 反饋;Aquestive 市場研究。2.Fromer L.《美國醫學雜誌》(2016);129,1244-1250。3.沃倫等Ann Allergy 哮喘 Immunol(2018)。4.布魯克斯等Ann Allergy 哮喘 Immunol(2017)。5.美國哮喘和過敏基金會患者調查報告(2019)。6.El Turki 等人EmergMed J (2017)。當前的護理標準 = 大型針頭式注射器大量研究和患者調查表明瞭對當前產品的嚴重不滿 • 正確的地點、正確的時間 •
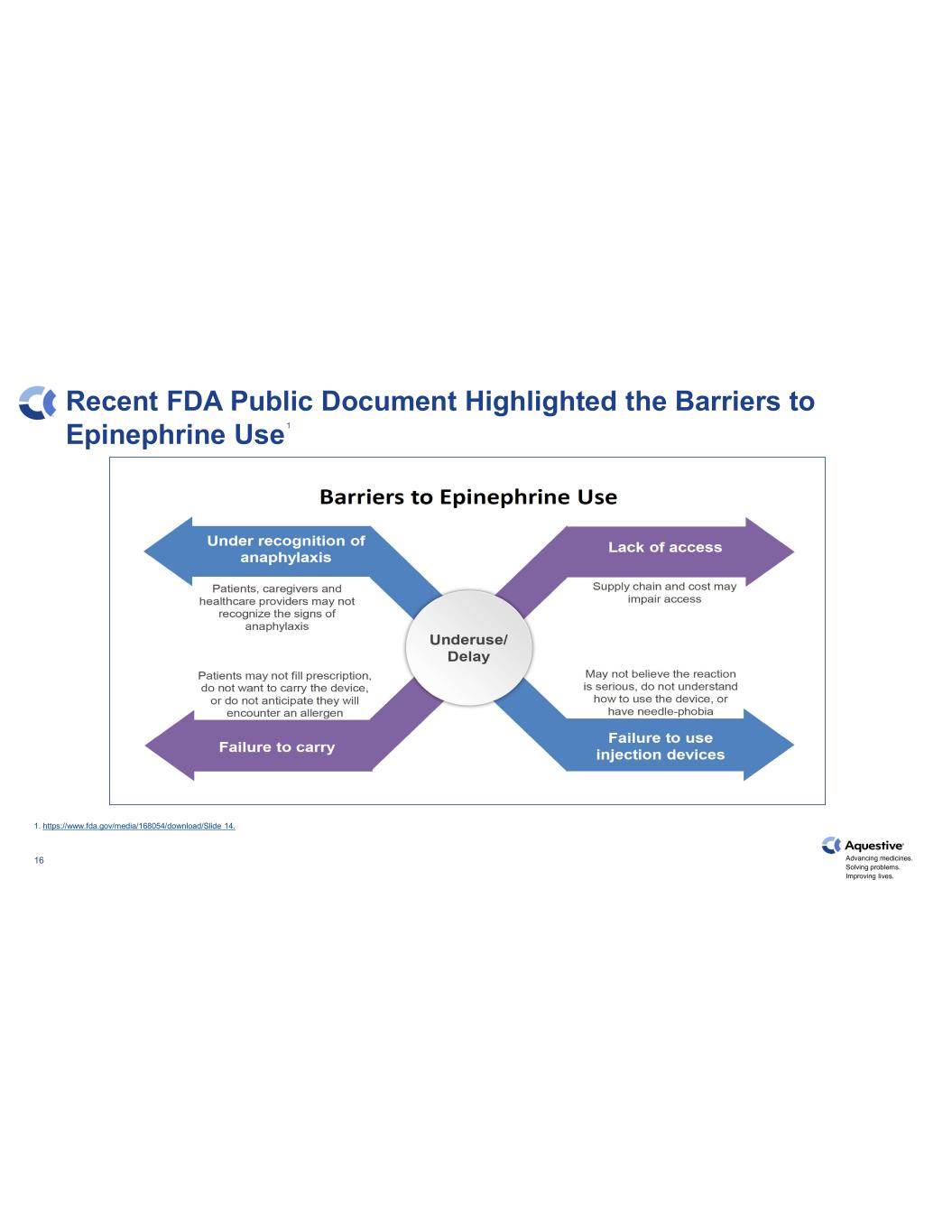
推進藥物發展。解決問題。改善生活。美國食品藥品管理局最近的16份公開文件強調了使用腎上腺素的障礙 1 1. https://www.fda.gov/media/168054/download/Slide 14.
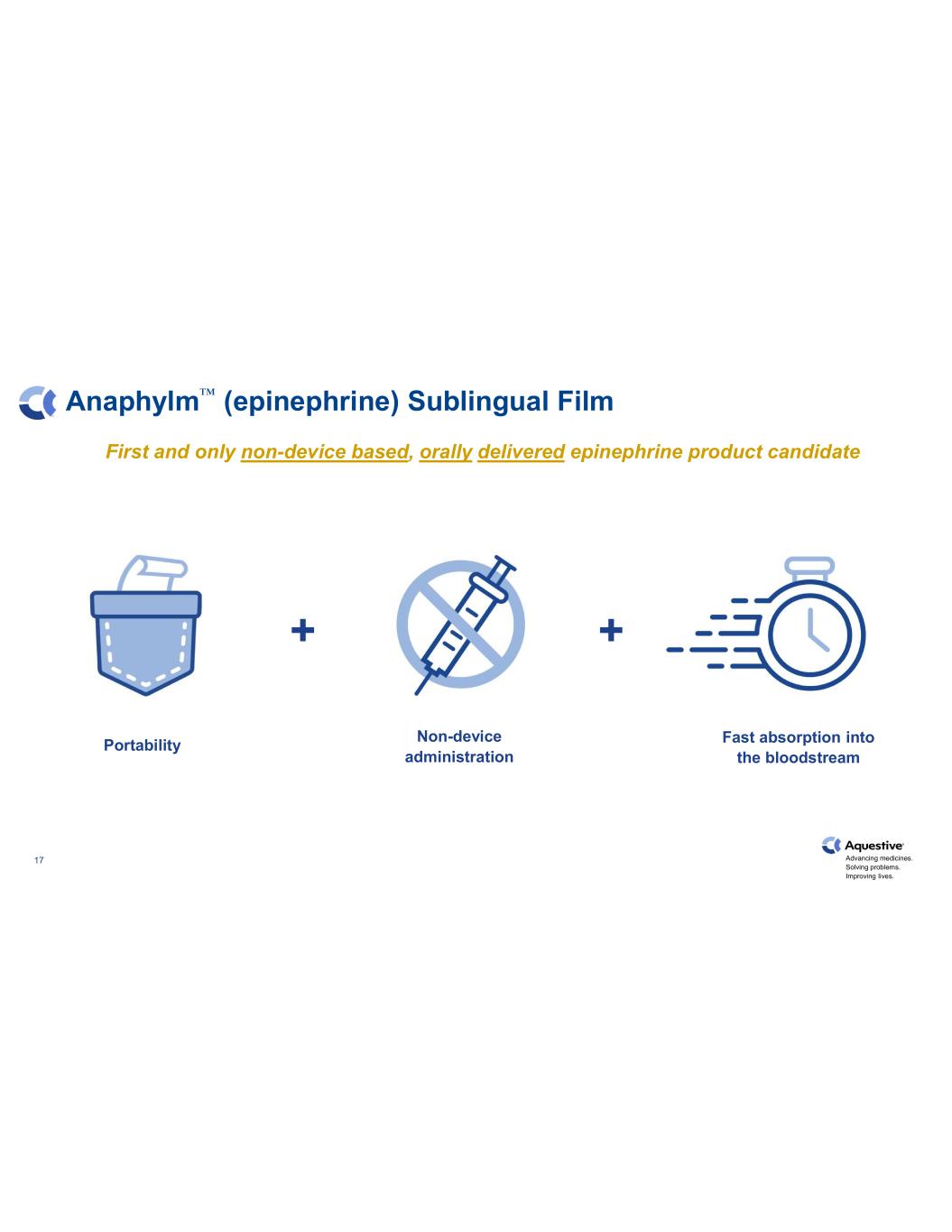
推進藥物發展。解決問題。改善生活。CONFIDENTIAL17 Anaphylm™(腎上腺素)舌下膠片首款也是唯一一款非器械類口服腎上腺素候選產品快速被血液吸收非設備給藥便攜性 +

推進藥物發展。解決問題。改善生活。18 競爭產品摘要口服自動注射器鼻內公司品牌 Anaphylm epipen/Generic Adrenaclick® Auvi-Q® Symjepi® neffy® Utuly™ N/A 管理舌下自動注射器自動注射器注射器鼻腔噴霧劑量(成人/Jr)待定 0.3/0.15 mg 0.3/0.15/0.10 mg 0.3/0.15 mg 2 mg 6.6 mg 未報告市場排名第一且僅口服 90% + 份額可以忽略不計

推進藥物發展。解決問題。改善生活。19 科學顧問委員會大衞·伯恩斯坦、辛辛那提大學卡洛斯·卡馬戈醫學博士、哈佛醫學院大衞·弗萊舍醫學博士、醫學博士科羅拉多州大衞·戈爾登兒童醫院、巴爾的摩馬修·格林霍特、醫學博士科羅拉多州魯奇·古普塔、醫學博士科羅拉多州魯奇·古普塔醫學博士、MPH 西北大學傑伊·利伯曼、田納西大學約翰·奧本海默醫學博士、新澤西州羅格斯醫科大學牙科羅拉多醫學博士
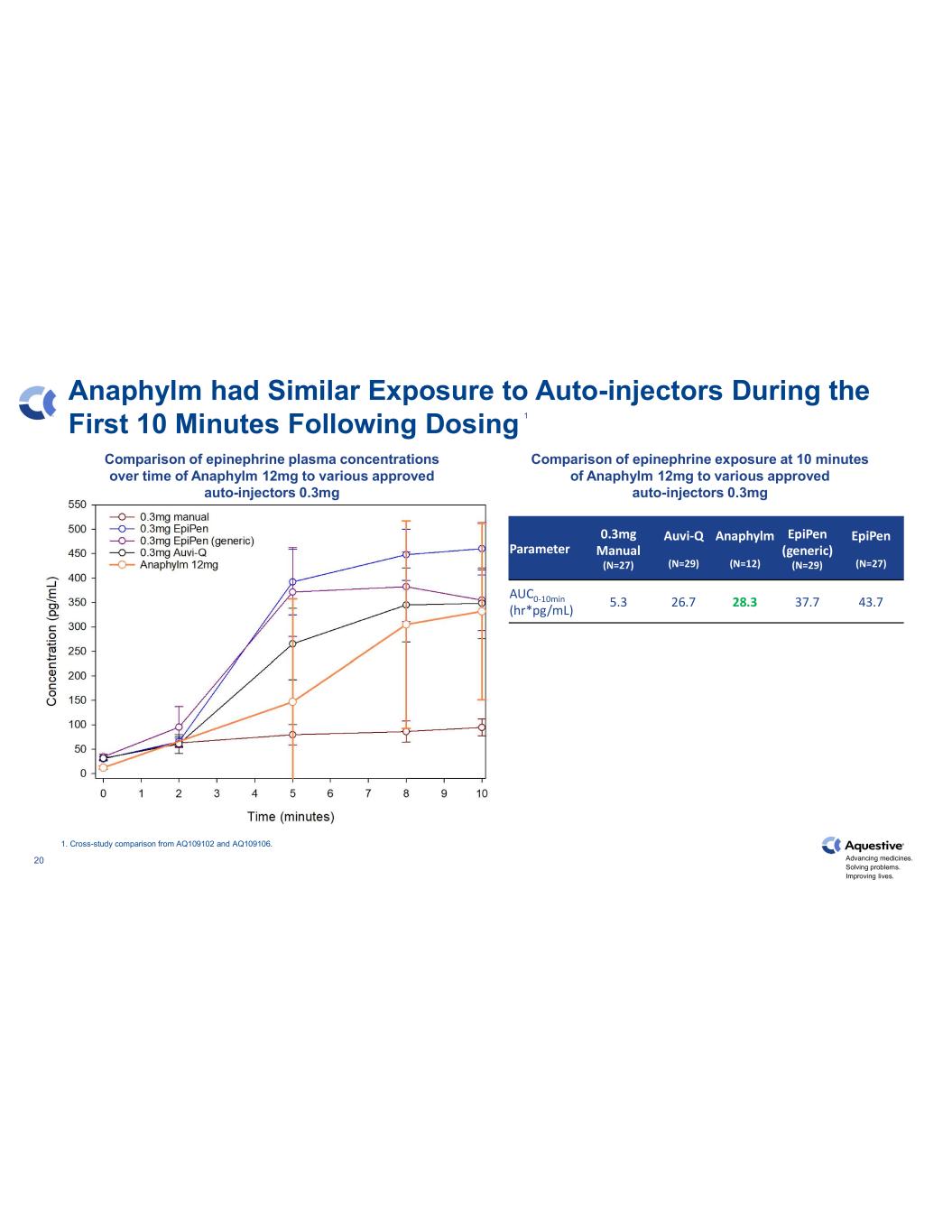
推進藥物發展。解決問題。改善生活。20 Anaphylm 在給藥參數後的前 10 分鐘內與自動注射器相似(N=27)Auvi-Q(N=29)Anaphylm(N=12)EpiPen(通用)(N=29)epiPen(N=27)auc0-10min(Hr*pg/ml)5.3 26.7 28.3 37.7 43.7 1。來自 AQ109102 和 AQ109106 的交叉研究比較。一段時間內腎上腺素血漿濃度的比較 Anaphylm 12mg 與各種批准的自動注射器 0.3mg Anaphylm 12mg 10分鐘時腎上腺素暴露量與各種批准的自動注射器 0.3mg 1
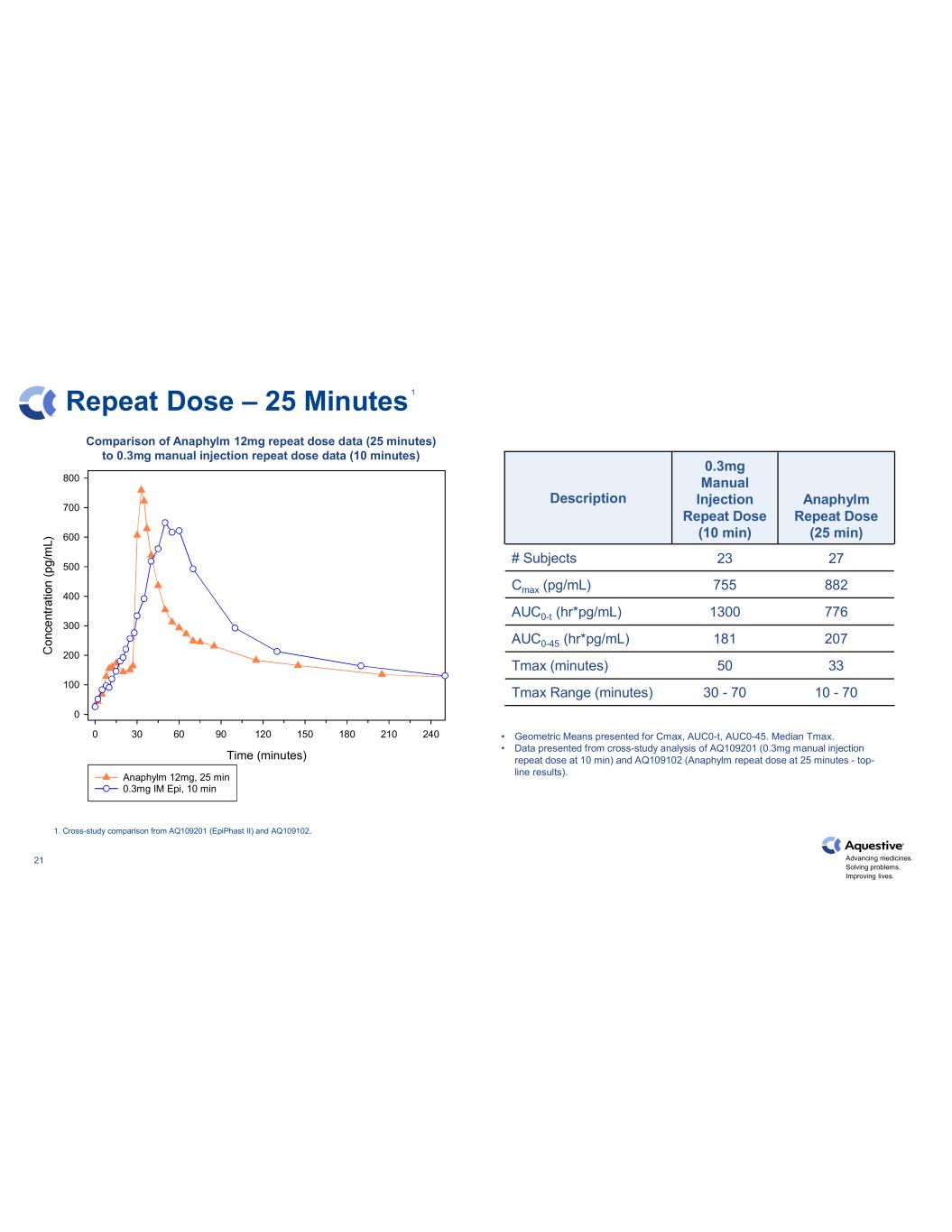
推進藥物發展。解決問題。改善生活。21 重複劑量 — 25 分鐘描述 0.3mg 手動注射重複劑量(10 分鐘)過敏重複劑量(25 分鐘)# 受試者 23 27 Cmax(pg/mL)755 882 auc0-T(hr*pg/mL)1300 776 AUC0-45(hr*pg/mL)181 207 Tmax(分鐘)50 33 Tmax 範圍(分鐘)30-70 10-70 • 呈現的幾何均值 max、auc0-T、AUC0-45。Tmax 中位數。• 數據來自對 AQ109201(10 分鐘手動重複注射 0.3 毫克)和 AQ109102(25 分鐘後重復給藥 Anaphylm ——頭線結果)的交叉研究分析。1.來自 AQ109201(Epiphast II)和 AQ109102 的交叉研究比較。時間(分鐘)0 30 60 90 120 150 210 240 0 100 200 400 500 600 700 800 800 Anaphylm 12mg,25 分 0.3mg IM Epi,10 分鐘比較 Anaphylm 12mg 重複劑量數據(25 分鐘)與 0.3mg 手動注射重複劑量數據(10 分鐘)1
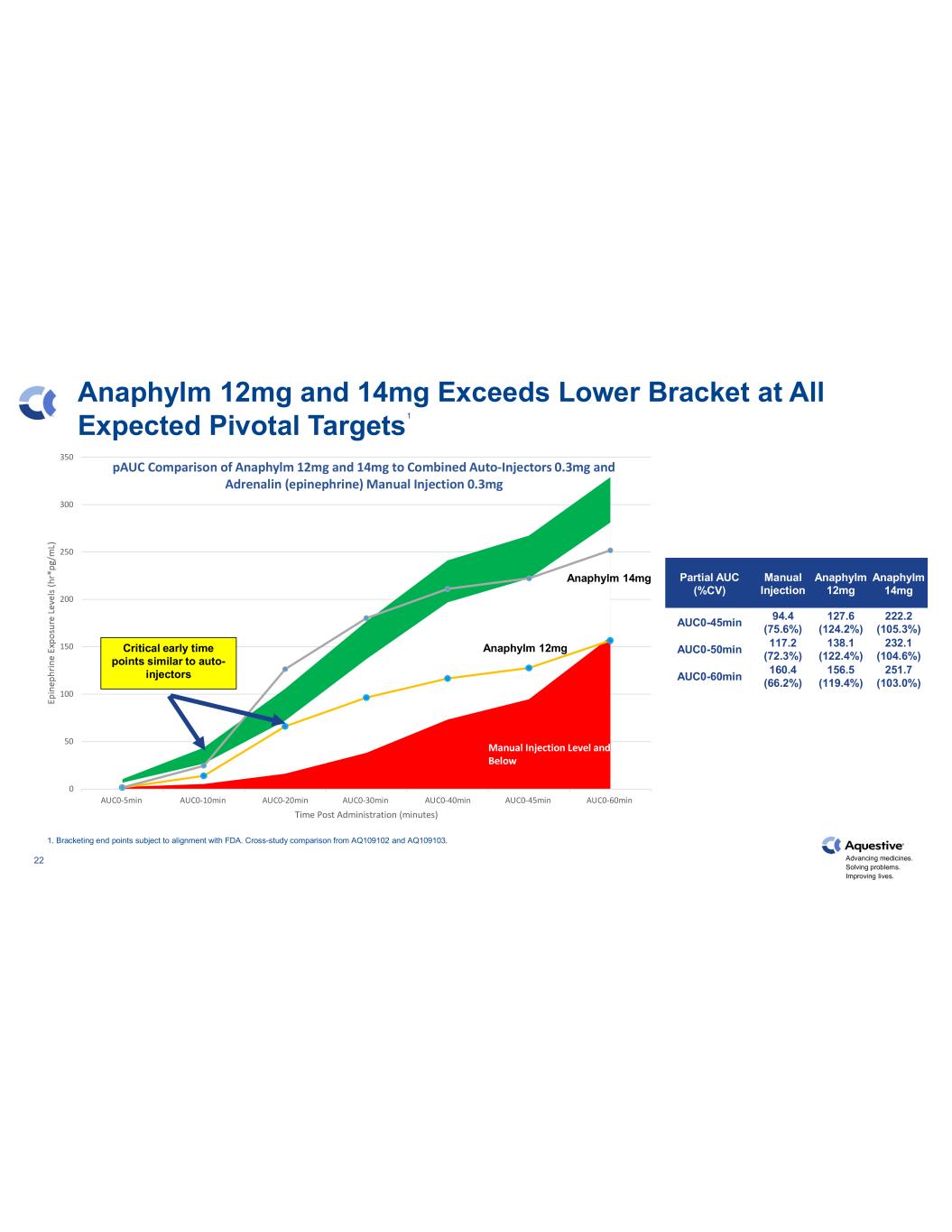
推進藥物發展。解決問題。改善生活。22 0 50 100 150 250 300 350 auc0-5min auc0-10min auc0-30min auc0-40min auc0-45min auc0-60min auc0-60min 給藥後時間(分鐘)Pauc 對比 Anaphylm 12mg 和 14mg 所有預期的關鍵目標手動注射水平及低於 Anaphylm 12mgCritical 早期時間點與自動注射器類似 AUC (%CV) 手動注射 Anaphylm 12mg Anaphylm 14mg auc0-45min 94.4 (75.6%) 127.6 (124.2%) 222.2(105.3%) auc0-50min 117.2 (72.3%) 138.1 (122.4%) 232.1 (104.6%) auc0-60min 160.4 (66.2%) 156.5 (119.4%) 251.7 (103.0%) 1 1。包圍端點須符合美國食品藥品管理局的要求。來自 AQ109102 和 AQ109103 的交叉研究比較。Anaphylm 14mg
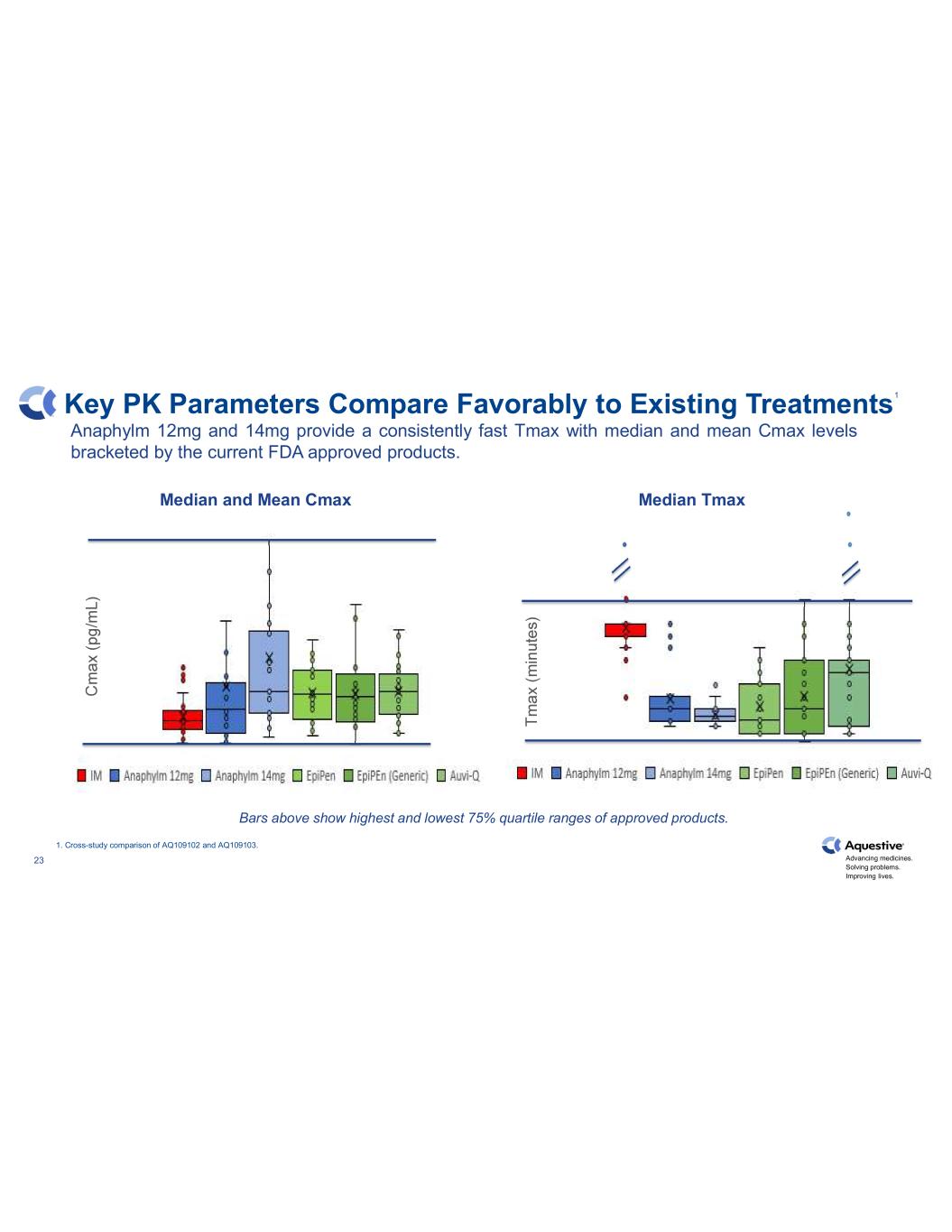
推進藥物發展。解決問題。改善生活。上面的23個關鍵PK參數與現有治療相比顯示了批准產品的最高和最低 75% 四分位數範圍。1.AQ109102 和 AQ109103 的交叉研究比較。Anaphylm 12mg 和 14mg 提供持續快速的 Tmax,中位數和平均值 Cmax 水平由當前 FDA 批准的產品列出。中位數和平均值 Cmax 中位數 Tmax 1

推進藥物發展。解決問題。改善生活。24 12mg 和 14mg Anaphylm 均產生臨牀上良好的藥效學 (PD) 效應 Anaphylm 顯示收縮壓 (SBP)、脈搏和舒張壓 (DBP) 在 2 分鐘內迅速升高。Anaphylm 14mg 提供的暴露量增加對 PD 的影響最小。給藥後經基線調整後的平均收縮壓變化平均值給藥後經基線調整後的脈搏變化 1.AQ109102 和 AQ109103 的交叉研究比較。1 1

推進藥物發展。解決問題。改善生活。25 過敏反應安全性和耐受性 • 在迄今為止的臨牀計劃中,治療緊急不良事件 (TEAE) 是根據發生率和嚴重程度來評估的 o 絕大多數報告的TEAE的嚴重程度為輕度或中度 o 大多數 TeaE 均符合一般疾病和管理部位條件的護理標準 (SOC) o 未報告嚴重不良事件 (SAE),大多數 TEAE 無需額外幹預即可解決 • 心血管不良事件 (AE) Anaphylm 的配置文件看起來與批准的 AE 配置文件相似比較器 o 給藥 Anaphylm 後未觀察到嚴重心臟事件,所有 TeaE 都不需要或最少的幹預,或者血壓升高程度通常為最低至中度;未觀察到惡性高血壓(sbp>180mmHg)發作 o 心率升高程度通常為最低至中度;經常有短暫心搏和心動過速的報道,但心室心動過速沒有觀察到 thmias

推進藥物發展。解決問題。改善生活。26 Anaphylm 2023-2024 關鍵路徑 2023 年第 1 季度第 2 季度第 3 季度第 4 季度 Q2 Q4 一月二月三月四月五月六月七月八月十月十一月十二月三月四月五月七月八月九月十月十月十二月試點研究關鍵研究兒科研究保密協議會議前提交

推進藥物發展。解決問題。改善生活。Libervant™(地西泮)Buccal Film 27

推進藥物發展。解決問題。改善生活. 28 1.Laxer,Ketal,難治性癲癇的後果及其治療;《癲癇與行為》,第 37 卷,2014 年 8 月,Pgs 59—70;https://doi.org/10.1016/j.yebeh.2014.05.031,2。三角洞察小組(2017)。癲癇綜合(ARS)初級研究。內部問卷報告:未發表,3.癲癇數據和統計數據 | CDC-1.2% 的美國人口患有活動性癲癇(95% 置信區間* = 1.1-1.4)。這相當於全國約有340萬癲癇患者:300萬成人和47萬名兒童。4.突破性發作:原因、治療和預防(healthline.com)——大約三分之一的癲癇患者會出現突破性發作。5. 2022 年 Symphony 數據顯示,如果患者每年填充 2.5 次,則為 16.8 萬名患者。6.緝獲急診室就診:ht t p s://www.ncbi.nlm.nih.gov/pmc/articles/pmc2657249。難治性發作中未得到滿足的需求... ~1M 患有無法控制的難治性發作癲癇患者1 癲癇發作佔急診室每年就診次數6 的難治性發作患者不會與歷史上可用的治療相互作用2,3,4,5 ~ 85% ~100萬

推進藥物發展。解決問題。改善生活。目前有29種治療方法有直腸或鼻內療法
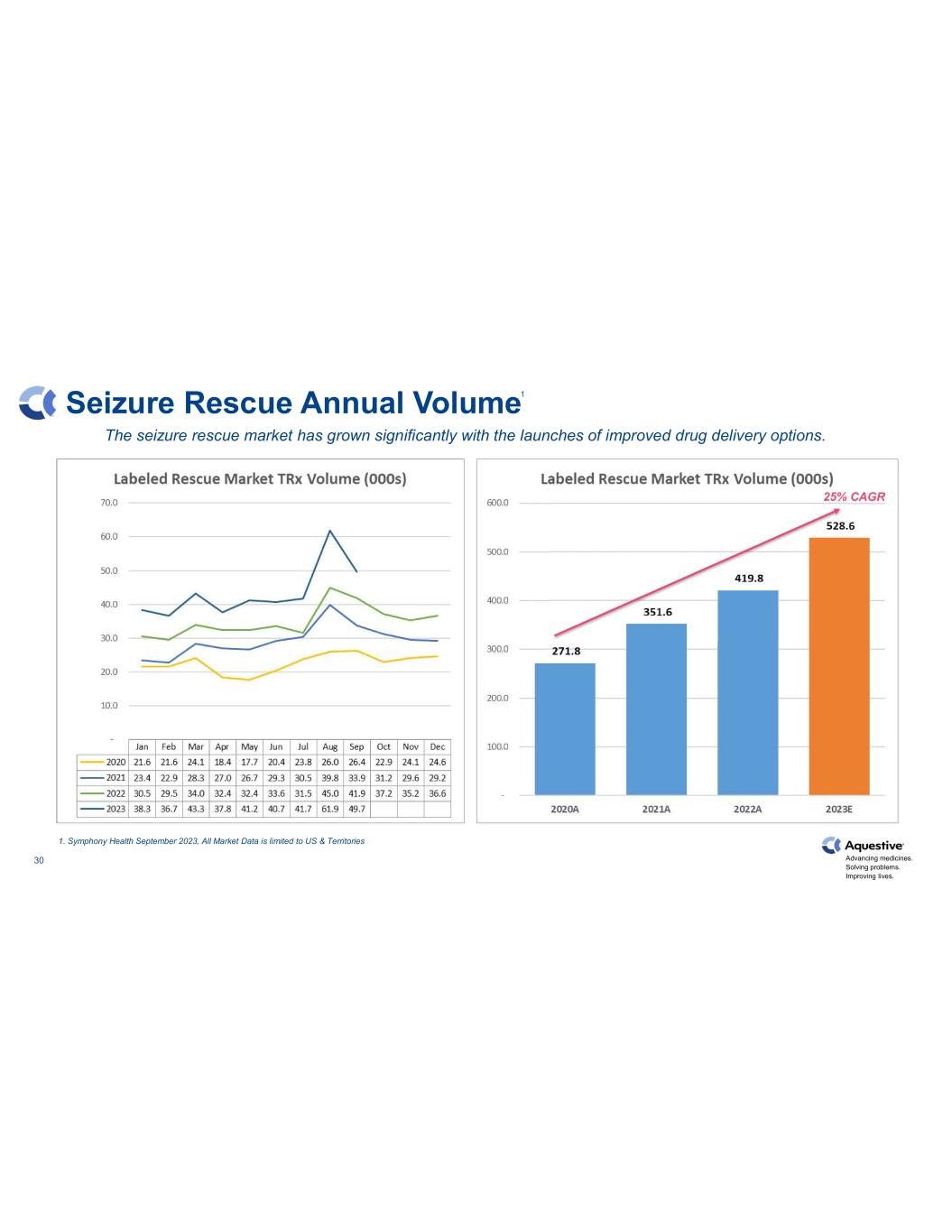
推進藥物發展。解決問題。改善生活。30 緝獲救援年度卷隨着改進藥物輸送選項的推出,緝獲救援市場顯著增長。1.交響樂健康 2023 年 9 月,所有市場數據僅限於美國和地區 25% 的複合年增長率 1
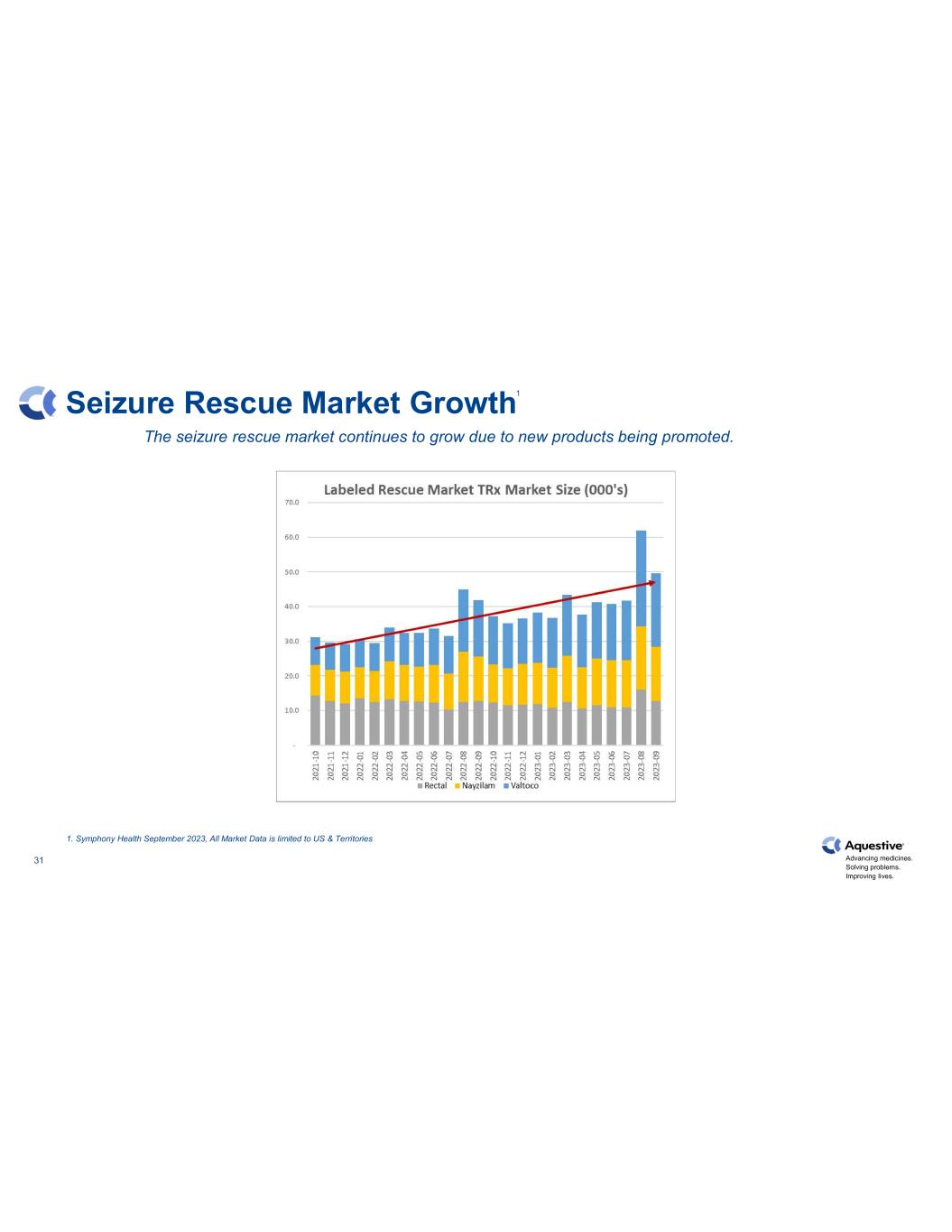
推進藥物發展。解決問題。改善生活。31 緝獲救援市場的增長由於新產品的推廣,緝獲救援市場持續增長。1.交響樂健康 2023 年 9 月,所有市場數據僅限於美國和地區 1
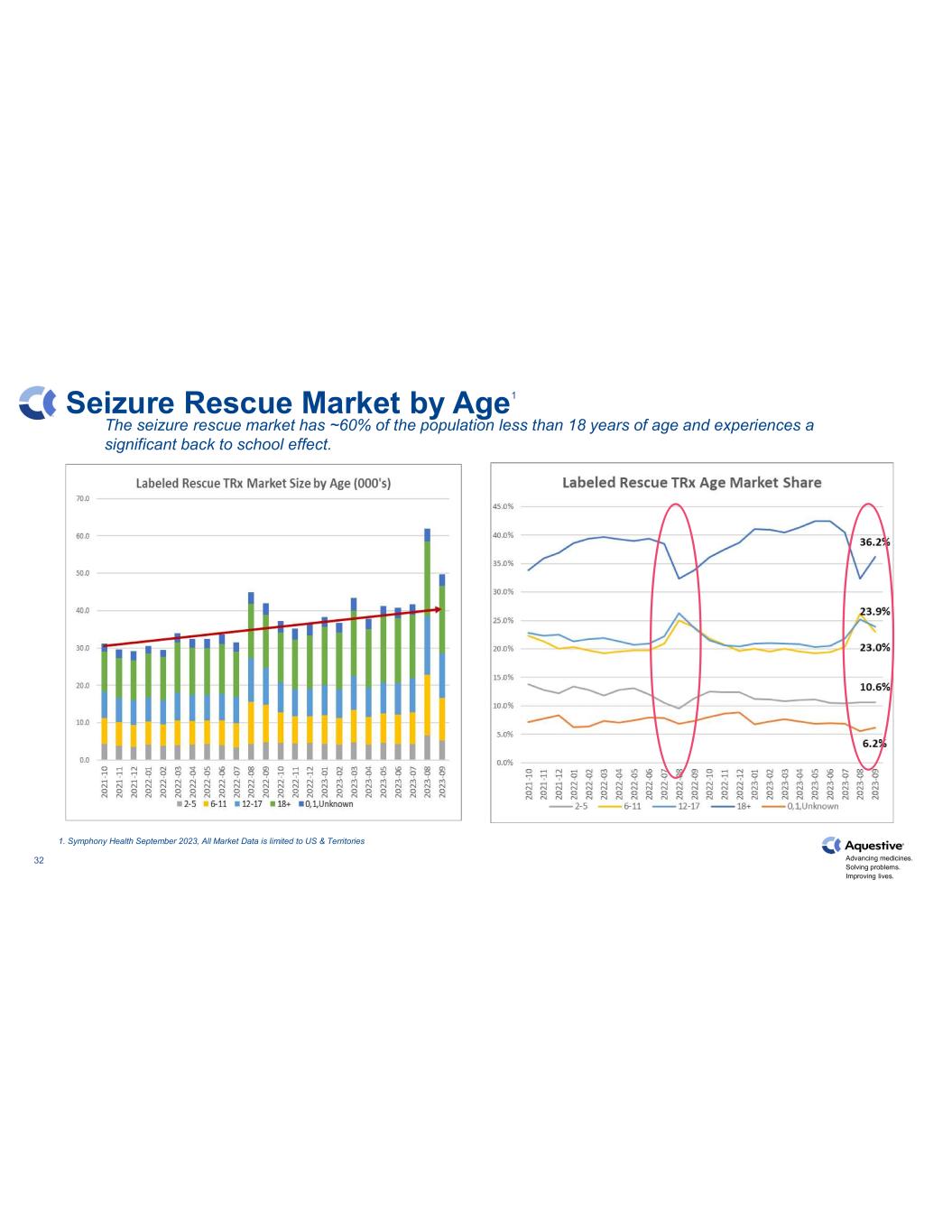
推進藥物發展。解決問題。改善生活。32 按年齡劃分的癲癇救援市場癲癇發作救援市場約有 60% 的人口年齡小於 18 歲,並且會產生顯著的返校效應。1.交響樂健康 2023 年 9 月,所有市場數據僅限於美國和領地 1

推進藥物發展。解決問題。改善生活。33 強烈的患者偏好 — 患者想要什麼% 表示 1:一點都不重要 2 3:有點重要 4 5:非常重要的 2 箱子能夠隨時隨身攜帶反覆發作藥物 3% 7% 20% 26% 45% 71% 在我需要的時候儘快服藥 3% 4% 14% 28% 51% 79% 能夠以一種對我來説簡單的方式服藥 2% 2% 13% 23% 60% 83% 無論我身在何處、在做什麼,都能服藥 3% 2% 14% 23% 58% 81% 我自己服藥的能力,而不是別人得把它交給我 5% 3% 22% 28% 43% 71% 1。Aquestive Therapeutics 贊助的偏好研究(N=101 名患者),數據已存檔。1
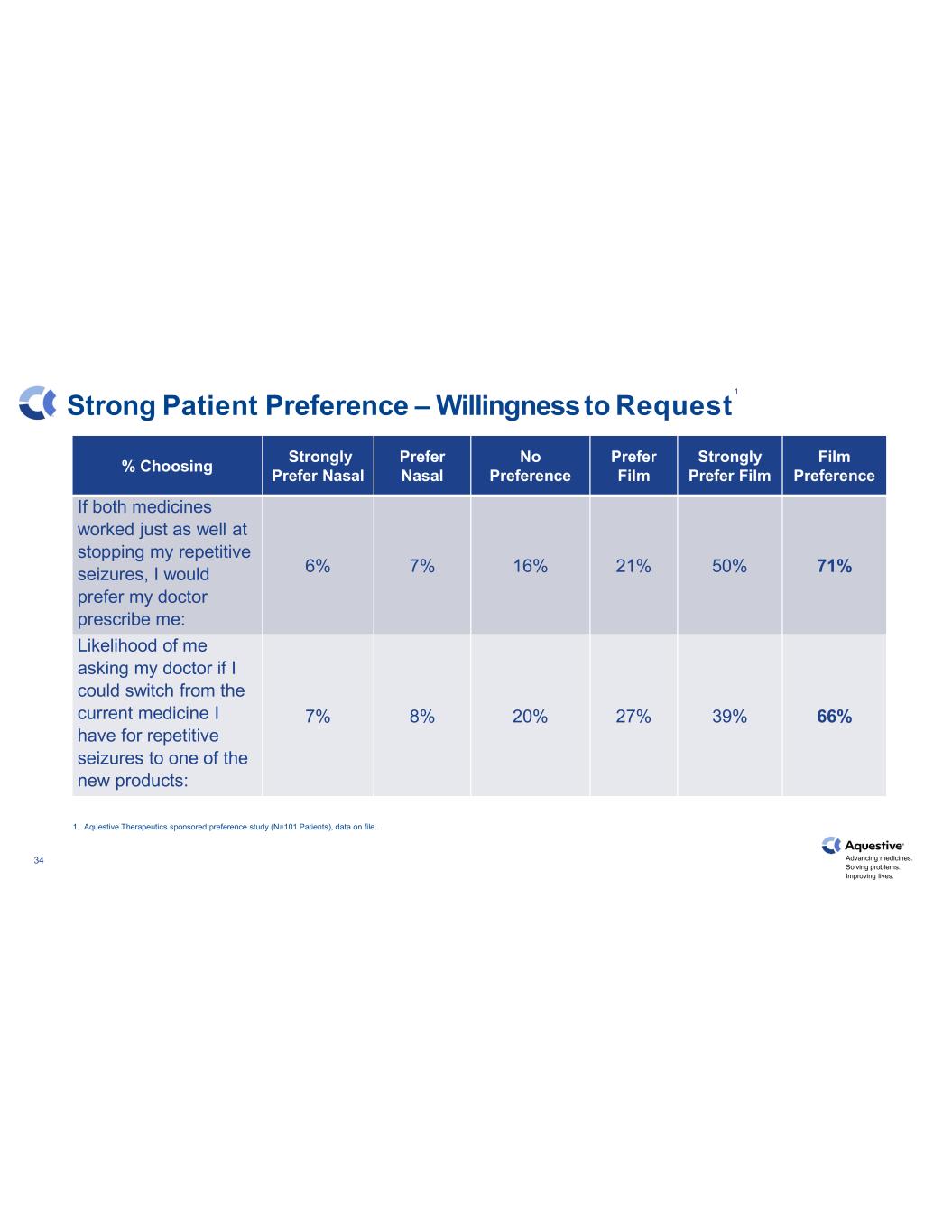
推進藥物發展。解決問題。改善生活。34 強烈的患者偏好 — 願意請求% 選擇強烈偏愛鼻腔不偏愛膠片偏愛電影如果這兩種藥物在阻止我的反覆發作方面同樣有效,我希望醫生給我開處方:6% 7% 16% 21% 50% 71% 我可能會問醫生我能否從目前的治療重複性癲癇的藥物改用其中一種新產品:7% 8% 20% 27% 39% 66% 1。Aquestive Therapeutics 贊助的偏好研究(N=101 名患者),數據已存檔。1
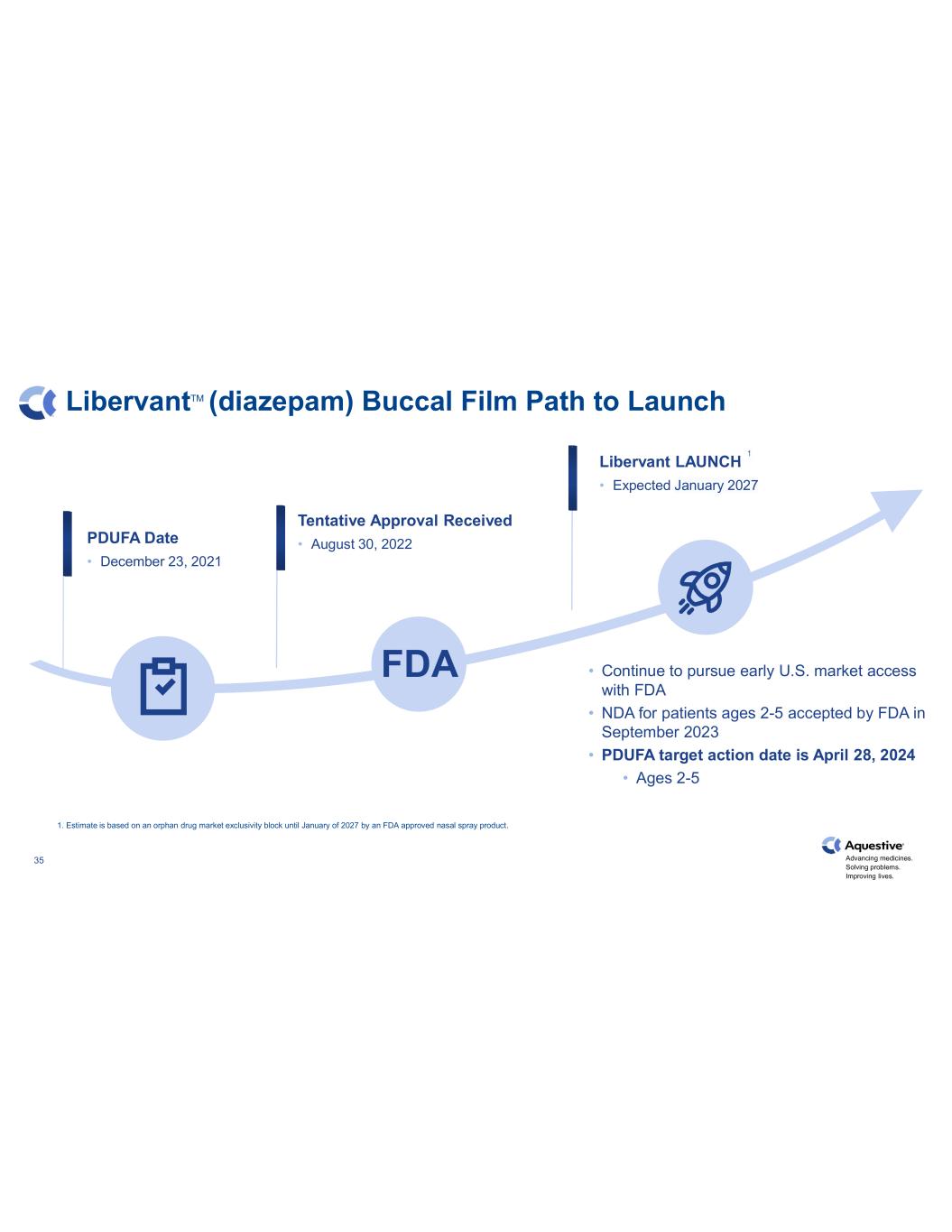
推進藥物發展。解決問題。改善生活。35 LibervantTM(地西泮)脣膜上市路徑 Libervant 上市 • 預計於 2027 年 1 月 PDUFA 日期 • 2021 年 12 月 23 日獲得暫定批准 • 2022 年 8 月 30 日 • 繼續向美國食品藥品管理局尋求早期進入美國市場 • 2023 年 9 月 2-5 歲患者的保密協議已於 2023 年 9 月被美國食品藥品管理局接受 • PDUFA 的目標行動日期為 2024 年 4 月 28 日 • 適合 2-5 歲 1.估計值基於美國食品藥品管理局批准的鼻噴劑產品在2027年1月之前對孤兒藥市場的獨家經營權。食品藥品管理局

推進藥物發展。解決問題。改善生活。現有合作 36
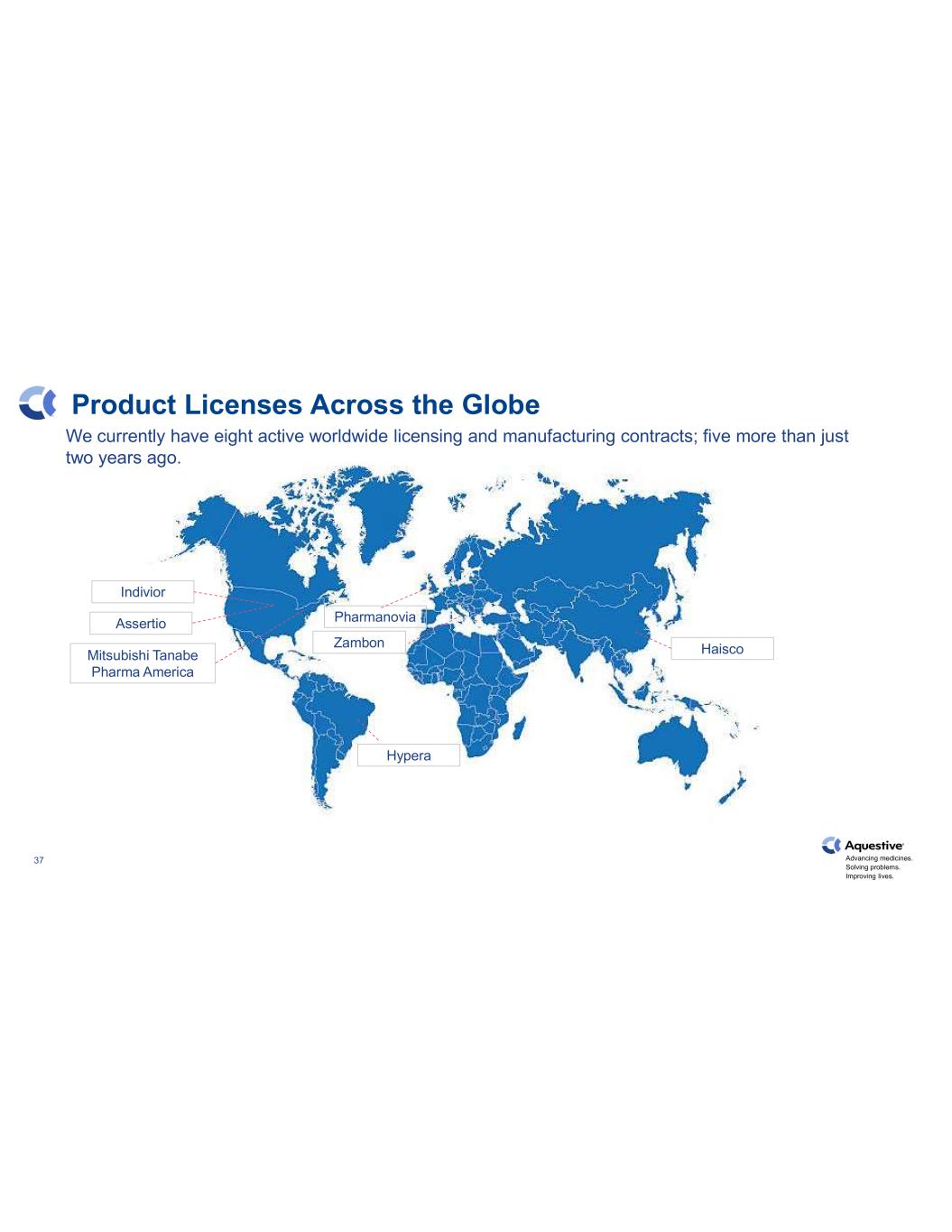
推進藥物發展。解決問題。改善生活。全球共有 37 份產品許可證 Indivior Assertio Hypera Haisco Pharmanovia Zambon Tanabe Pharmanovia America 我們目前有八份有效的全球許可和製造合同;比兩年前多了五份。

推進藥物發展。解決問題。改善生活。38 個現有產品組合創造了超過 5 億美元的收入 Pharmanovia(美國除外)待定(美國)利魯唑 FDA 批准 2019 年 Diazepam FDA 批准 2022 年海斯科(中國)贊邦(歐盟)待定(中國)Clobazam FDA 批准 2018 年 Ondansetron FDA 批准 2010 年丁丙諾啡/納洛酮 FDA 2010 年三菱田邊(美國)預計 2025 年上市 Indivior Suboxone(2010 年上市)Hypera(SAM)待定(美國)Ondif(2022 年上市)Assertio(全球)Sympazan(2018 年上市)產品開發合作商業製造 1.估計值基於美國食品藥品管理局批准的鼻噴劑產品在2027年1月之前對孤兒藥市場的獨家經營權。Exservan(2021 年發佈)Emylif(2023 年上市)預計 2024 年上線預計 2027 年發佈1
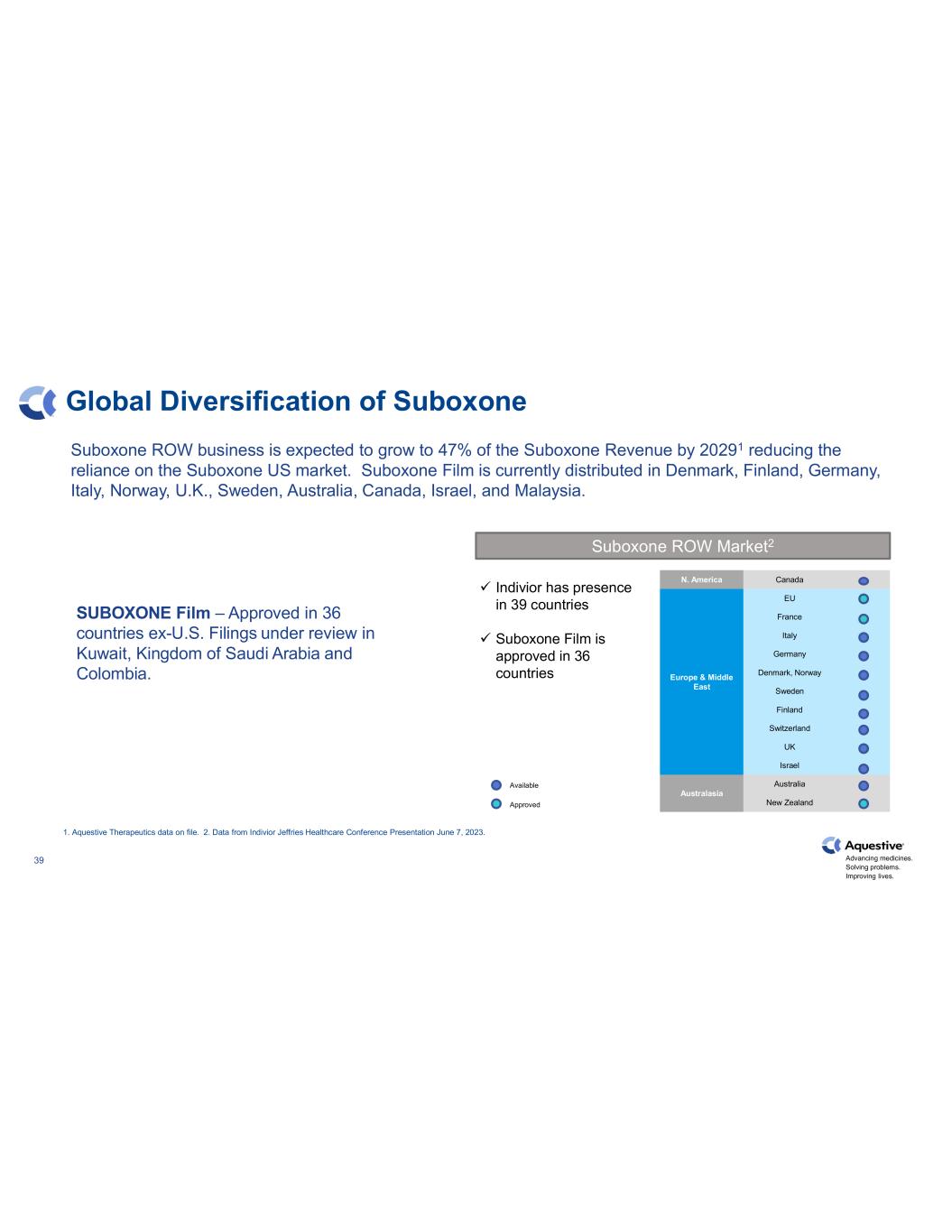
推進藥物發展。解決問題。改善生活. 39 Suboxone 的全球多元化 1.存檔的 Aquestive Therapeutics 數據。2.數據來自 Indivior Jeffries 醫療保健會議演講,2023 年 6 月 7 日。Suboxone ROW Market2 北美加拿大歐洲和中東歐盟法國意大利德國丹麥、挪威瑞典芬蘭瑞士英國以色列大洋洲澳大利亞新西蘭可用 Indivior 在 39 個國家開展業務 Suboxone Film 在 36 個國家獲得批准 Suboxone ROW 業務預計將增長到 20291 年的 47%,從而減少對Suboxone美國市場的依賴。Suboxone Film 目前在丹麥、芬蘭、德國、意大利、挪威、英國、瑞典、澳大利亞、加拿大、以色列和馬來西亞發行。SUBOXONE Film — 已在除美國以外的 36 個國家獲得批准科威特、沙特阿拉伯王國和哥倫比亞的申請正在審查中。
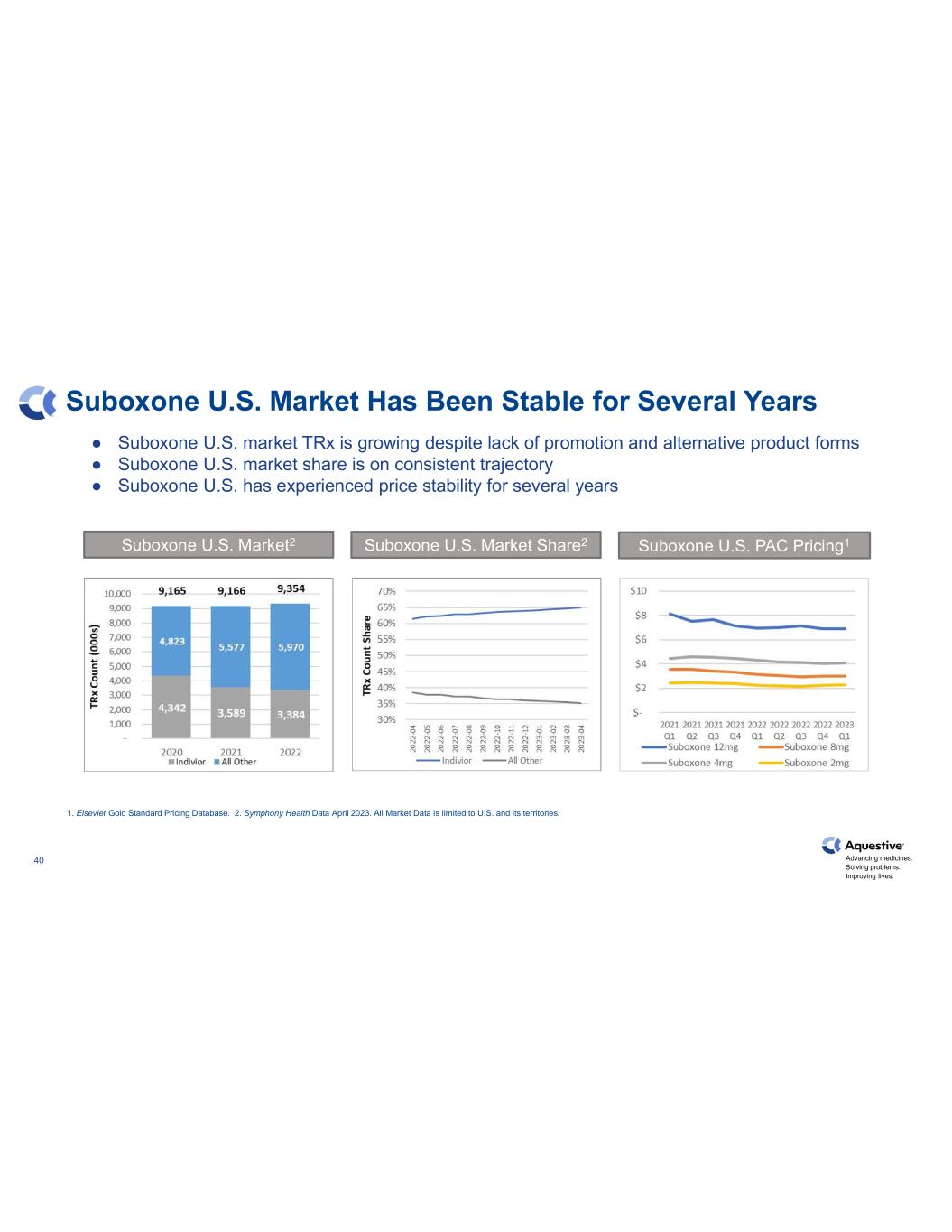
推進藥物發展。解決問題。改善生活。40 Suboxone 美國市場多年來一直保持穩定 Suboxone 美國市場 tRx 儘管缺乏促銷和替代產品形式,但仍在增長 Suboxone 美國的市場份額一直保持穩定 Suboxone 美國市場份額多年來一直處於穩定狀態 1.愛思唯爾黃金標準定價數據庫。2.2023 年 4 月交響樂團健康數據。所有市場數據僅限於美國及其領土。Suboxone 美國市場2 Suboxone 美國市場份額2 Suboxone 美國 PAC 定價1

推進藥物發展。解決問題。改善生活。更新的指南 41
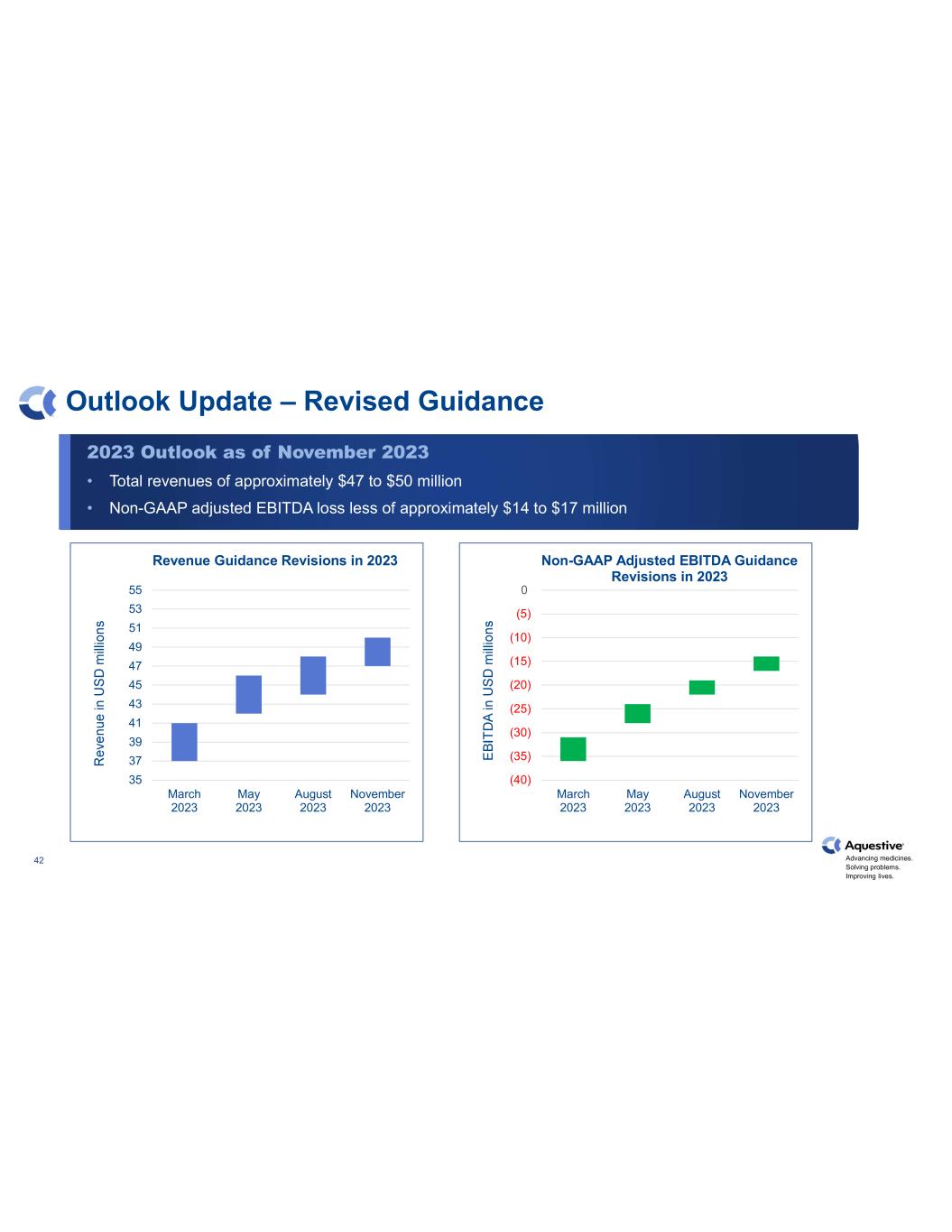
推進藥物發展。解決問題。改善生活。42 展望更新 — 修訂後的指南 35 39 41 43 45 47 49 53 53 35 2023 年 5 月 2023 年 5 月 2023 年 8 月 2023 年 8 月 2023 年 11 月收入指導修訂 (40) (35) (30) (20) (15) (5) 0 2023 年 3 月 2023 年 5 月 2023 年 11 月 2023 年 11 月非公認會計準則調整後的息税折舊攤銷前利潤指導意見修訂截至 2023 年 11 月 • 總收入約為 4,700 萬美元至 5,000 萬美元調整後的息税折舊攤銷前利潤虧損減去約1400萬美元至1,700萬美元

推進藥物發展。解決問題。改善生活。謝謝 43