
勇敢的創新致力於將改變遊戲規則的基因和細胞療法及疫苗推向市場,並更加努力地為全球患者提供准入 2023 年 11 月 NASDAQ:OCGN

前瞻性陳述 2 本演示文稿包含1995年《私人證券訴訟改革法》所指的前瞻性陳述,這些陳述存在風險和不確定性。在某些情況下,我們可能會使用 “預測”、“相信”、“潛力”、“提議”、“繼續”、“估計”、“預期”、“預期”、“計劃”、“打算”、“可能”、“可能”、“可能”、“將”、“應該” 等術語來識別這些前瞻性陳述。此類聲明包括但不限於有關我們的臨牀開發活動和相關預期時間表的聲明。此類陳述受許多重要因素、風險和不確定性的影響,這些因素可能導致實際事件或結果與我們當前的預期存在重大差異。我們在向美國證券交易委員會(SEC)提交的定期文件中更全面地描述了這些風險以及其他風險和不確定性,包括我們向美國證券交易委員會提交的季度和年度報告中標題為 “風險因素” 的部分中描述的風險因素。我們在本演示文稿中發表的任何前瞻性陳述僅代表截至本演講之日。除非法律要求,否則在本演示文稿發佈之日之後,無論是由於新信息、未來事件還是其他原因,我們都沒有義務更新本演示文稿中包含的前瞻性陳述。

通過 Courageous Innovation,我們正在利用我們的一流平臺來解決嚴重的未得到滿足的醫療需求調節劑基因療法平臺一流 • 治療重點:遺傳性視網膜疾病和需求未得到滿足的大型失明疾病 • 分化因素:“主基因調節劑”;基因不可知的方法 • 管道:o OCU400(Ph1/2):RP* 和 LCA**;FDA/EMA 的孤兒藥稱號 Ph3 目標:2024 年初 o OCU410(Ph1/2):幹型 AMD o OCU410ST(Ph1/2):Stargardt;獲得 FDA 吸入疫苗平臺的孤兒藥稱號同類首創 •治療重點:流感和 COVID-19 • 差異化因素:吸入以提高耐久性和傳播控制 • 管道:o OCU500(Preclin):COVID-19 疫苗(NIH/NIAID Nextgen Collaboration-Ph1 計劃於 2024 年初推出)o OCU510(Preclin):四價流感 o OCU520(Preclin):COVID-19 + 流感組合再生細胞療法平臺同類首創 • 治療重點:關節軟骨病變 • 分化因素:三維支架 • 管道:o NeoCart (Ph3):膝關節軟骨缺陷 o Ph3 目標:2H2024 o RMAT 獲得 FDA 認證 *RP,視網膜炎色素沉着症 **LCA,Leber 先天性黑蒙症

4 管道概述當前狀態指示資產/計劃 • 1/2 期 • 已完成 RP 和 LCA 患者的給藥 • 治療 RP 的 3 期試驗預計將於 2024 年初啟動色素性視網膜炎 (RP)--NR2E3 mutationocu400 * aav-hnr2e3 基因突變相關視網膜變性基因療法 RP—RHO 突變萊伯先天性黑蒙症 (LBER) CA) —CEP290 突變 • 1/2 期乾性年齡相關性黃斑變性(乾性 AMD)OCU410 aav-Hrora • 1/2 期 Stargardt 病(孤兒病)OCU410ST AAV-Hrora • 繼續研究公司對這種疾病的應對美國食品藥品管理局關於臨牀試驗申請的通知 • 預計將在2024年上半年啟動1期臨牀試驗,但前提是美國食品藥品管理局解除對糖尿病黃斑的控制以及資金是否充足 — tumstatinBiologics • ind-readyDiabetic 視網膜病變 • Ind-readyWet 年齡相關性黃斑變性(濕性AMD)• 計劃於2024年下半年進行3期臨牀試驗 KneeneoCart®(自體軟骨細胞衍生的新軟骨)中的軟骨缺陷 RMAT** 細胞療法(再生醫學)OCU500 系列疫苗 • OCU500IND 計劃於 2024 年初與 NIAIDFor 合作預防由 COVID-19 引起的疾病 OCU500:COVID-19(雙價)用於預防 Fluocu510 引起的疾病:用於預防流感引起的疾病的流感(四價)和 COVID-19 OCU520:流感 + COVID-19 **再生醫學高級療法稱號 *來自美國食品藥品管理局和歐洲藥品管理局的 RP/LCA 的廣泛、基因無知、孤兒藥物名稱

5 Modifier Gene Therapy Platform 突破性技術旨在治療許多罕見疾病以及影響數百萬人的複雜疾病

6 修飾基因療法:更廣泛的基因修飾劑療法有可能利用基因不可知的方法,通過單一產品解決多種遺傳缺陷。對於 IRD 患者來説,這可能意味着:改善視覺效果和生活質量 GENE X GENE M 細胞 NR2E3 傳送健康和生存基因網絡的 “分子重置” 細胞功能正常的細胞恢復視網膜細胞動態平衡 O N L onl/感光受器存活基因 X 細胞基因 M O D I F I E R G E N E M 除了修飾基因 M O D I F E R G E N E M https://www.nature.com/articles/s41434-020-0134-z

美國食品藥品管理局批准擴大所有色素性視網膜炎(RP)和萊伯先天性黑蒙症(LCA)突變的孤兒藥名稱儘管很普遍,但RP和LCA患者的治療選擇有限 • 美國:RP和LCA分別影響11萬和15,000人 • 全球:疾病影響約160萬人目前批准和正在開發的基因療法側重於單個基因 • 超過125個與RP相關的突變基因 LCA • 開發一種治療每種突變的單一療法是不可行的 OCU400 解決了當前基因的缺點治療方法 • 針對遺傳多樣性遺傳性視網膜疾病的廣譜、基因無關方法 • 使用 NR2E3 單次視網膜下注射進行潛在的一次性治療治療研究摘要:• 已完成 RP 患者和包括一名兒科患者在內的三名 LCA 患者的劑量 • 在 FDA 同意研究設計後,將於 2024 年初啟動 RP 的 3 期成人試驗 • 擴大針對 LCA 患者的 OCU400 3 期臨牀試驗 2024 年下半年基於 lcaPatients 和校準的 1/2 期研究結果隨着 FDA 7 OCU400:1/2 期臨牀試驗按計劃進行,在需求量大的眼科領域開發一種新型基因療法

OCU400 臨牀項目 A 1/2 期研究,旨在評估 OCU400 治療與 NR2E3 和 RHO 突變相關的色素性視網膜炎以及伴有 CEP290 基因突變的萊伯先天性黑蒙病的安全性和有效性 Clinical Trials.gov 標識符:NCT05203939 視網膜下給藥 OCU400 免疫反應的安全性系統分佈最佳校正視力 (BCVA) 多亮度活動度測試 (MLMT) 低亮度視力 (LLVA) 初級:安全性探索:功效 48

Ocu400 的安全性摘要——臨牀研究更新 • 1/2 期臨牀試驗表明,在不同突變和劑量水平的受試者中,OCU400 總體上仍然是安全的,耐受性良好 • 在低劑量和中劑量隊列中沒有與研究產品相關的嚴重不良事件 (SAE) • 在高劑量和開放註冊隊列中,有兩名受試者報告了 SAE。它們都與研究藥物無關。• 不良事件主要被認為與外科手術有關,並在幾天到幾周內消失 79

RP 和 LCA——未得到滿足的需求和治療益處目標 8 • RP 和 LCA 等 IRD 是一組影響視網膜(眼後光敏組織)的異源性遺傳疾病 • 隨着時間的推移,它們通常會導致視力逐漸喪失,最終可能導致失明 • 視力穩定對於 RP 和 LCA 患者至關重要,因為這些疾病具有進行性和退化性 • 保留剩餘的視力視力、減緩疾病進展或改善視力會顯著影響患者的生活質量。這樣的結果不僅可以提高受影響個體的生活質量,還可以為未來的治療最終實現視力恢復帶來希望。• 全面護理、早期診斷和獲得新興療法是穩定 RP 和 LCA 患者視力的策略的重要組成部分 10
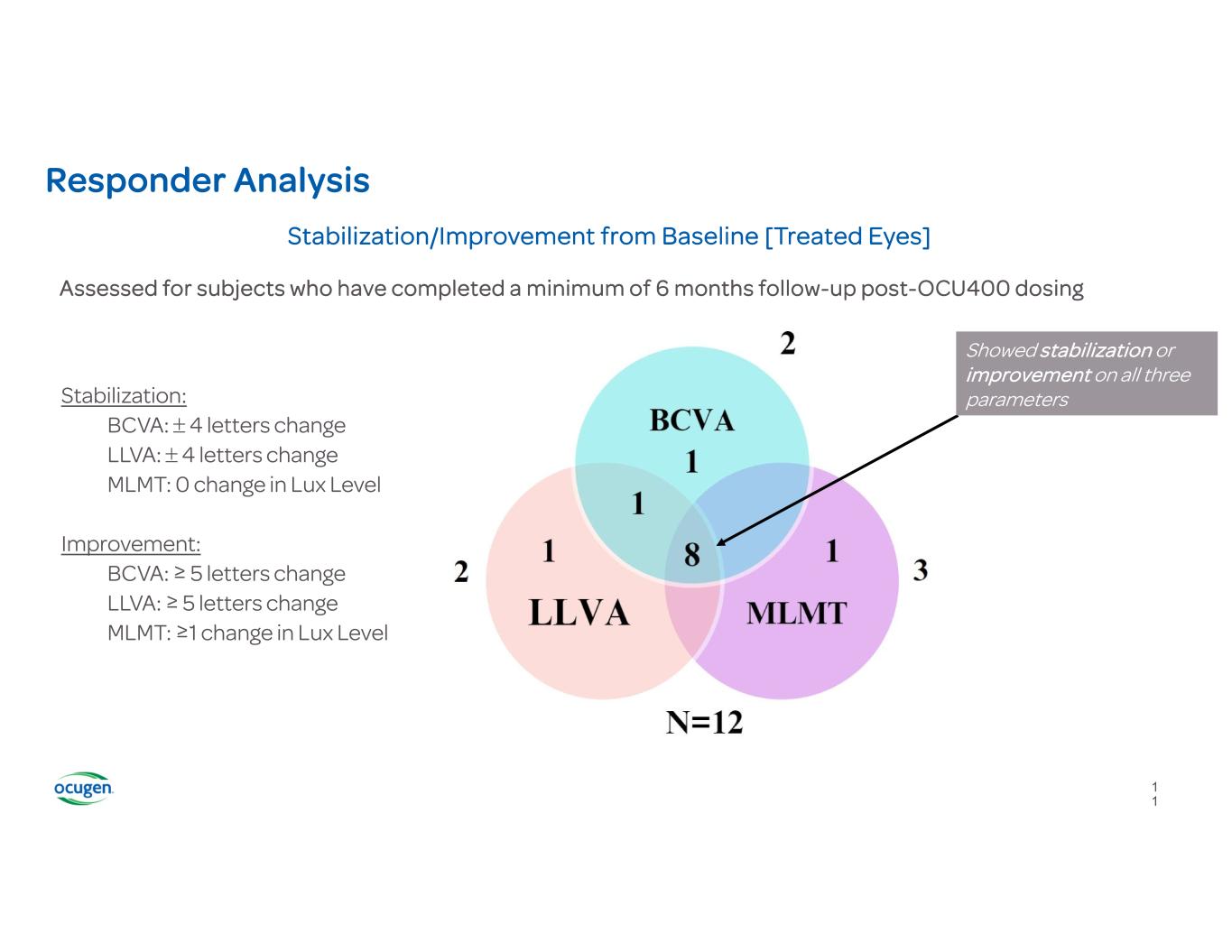
響應者分析從基線穩定/改進 [經過治療的眼睛]所有三個參數均顯示穩定或改善穩定性:BCVA:4 個字母變化 LLVA:4 個字母變化 MLMT:0 勒克斯等級變化改善:BCVA:≥ 5 個字母變化 LLVA:≥ 5 個字母變化 MLMT:對於 Ocu400 劑量後已完成至少 6 個月隨訪的受試者進行了評估 1 1

最新臨牀研究結果的結論 • OCU400 繼續顯示出良好的安全性和耐受性 • 臨牀研究更新表明,最佳校正視力 (BCVA) 和多亮度活動度測試 (MLMT) 持續呈積極趨勢,接受治療的眼睛的低亮度視力 (LLVA) 呈積極趨勢 • 83%(10/12)的受試者在 BCVA、LLVA 或 MLMT 上表現出治療後的眼睛穩定或改善來自基線的分數 • 75%(9/12)的受試者在治療中表現出穩定或改善眼睛 MLMT 評分與基線相比• 86% (6/7) 的 RHO 突變受試者的MLMT分數與基線相比有所穩定或改善,其中 29% (2/7) 的亮度水平改善了 3 Lux • RHO 患者的治療效果支持 OCU400 12 12 的基因無關作用機制
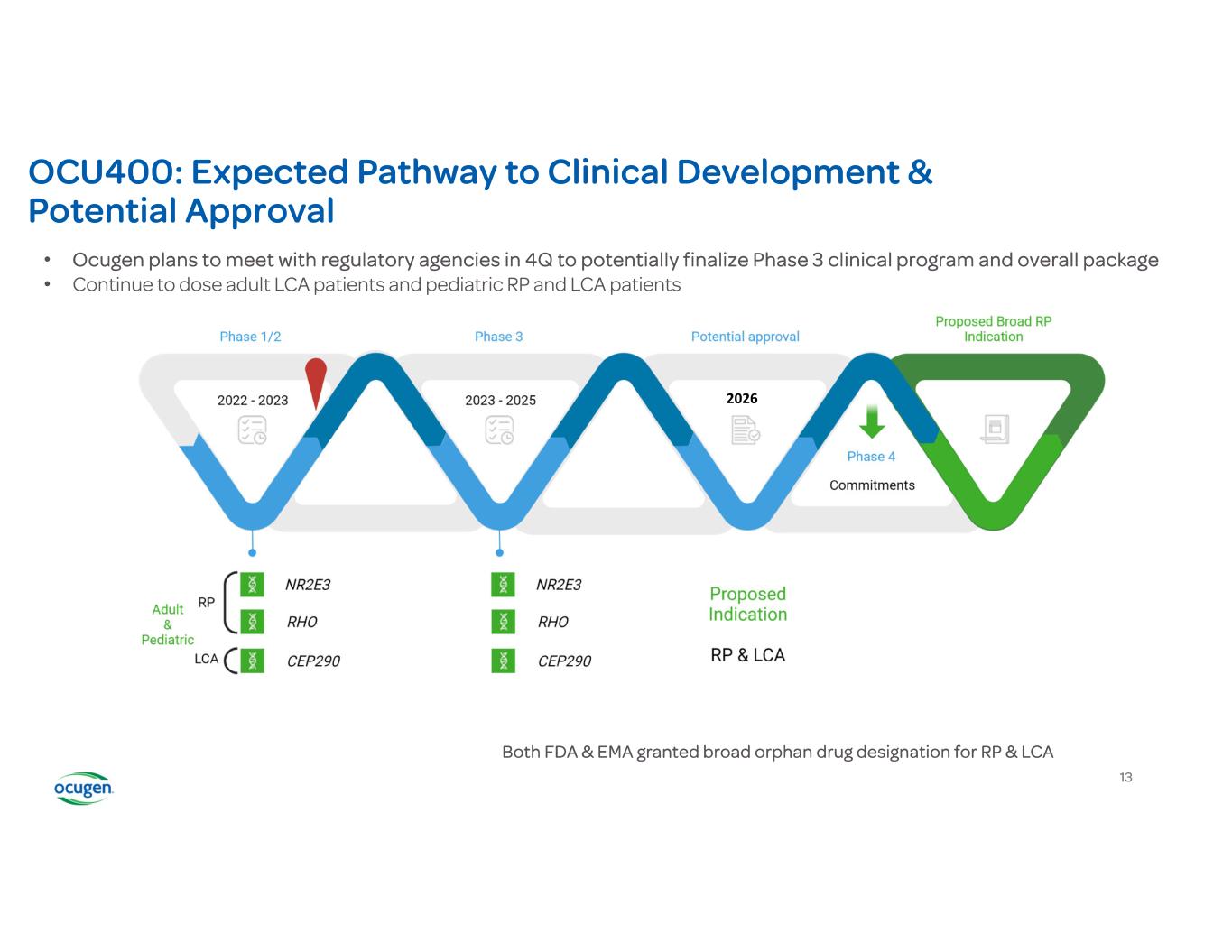
OCU400:預期的臨牀開發途徑和潛在的批准美國食品藥品管理局和歐洲藥品管理局都批准了RP和LCA的廣泛孤兒藥稱號 • Ocugen計劃在第四季度與監管機構會面,以可能最終確定3期臨牀計劃和整體套餐 • 繼續給成人 LCA 患者和兒科 RP 和 LCA 患者給藥 13 2026

* 如 Peak scootopic B 波振幅所示。N≥5 生物學複製了最近批准的 GA 療法的 14 項進展:有可能解決最近批准的僅針對補體系統的侷限性,包括:患者依從性 • 頻繁玻璃體內注射(每年約 6-12 劑)觀察到的結構性影響 • GA 病變生長速度的影響有限安全注意事項 • 連續兩年每月給藥 12% 的患者出現了 naMD(Syfovre®)OCU410 1/2 期研究選項有限 for damD,演示大量未得到滿足的醫療需求 • 美國:10M(GA:1M)• 全球:266M 不同的 4 向 MOA:解決與該疾病相關的多種調節途徑,包括:• 脂質代謝 • 炎症調節 • 氧化應激 • 膜攻擊複合物(補體)最佳輸送和耐久性:• 單次視網膜下注射旨在消除患者依從性問題和與多次注射相關的治療負擔改善視網膜功能:• 改善光學功能所有劑量 OCU410 治療眼睛的受體功能* 有潛力一種單次視網膜下注射的一次性治療療法,可解決 damD OCU410 (RORA) 患者未得到滿足的需求和治療負擔:一種在補體系統之外滿足 damD 需求的單注射方法

50 60 70 80 90 1e61e51e41e31e2Cells N 或 m al iz ed c el l s ur vi va l RORA NR2E3 NR1D1 抗氧化:提高 ARPE19 細胞存活率抗補體:增加抗補體 (Cd59) 蛋白抗炎:抑制 HMC3 細胞的炎症抗德魯森活性並改善視網膜功能 0 50 100 150 200 個月 1 7 1 7 7 7 Control Abcaca4-/-未注射 Abca4-/-OCU410 ✱✱ ✱✱✱ 黃斑變性模型降低 Drusen 15 OCU410 (RORA):一種治療乾性AMD和STGD的潛在調節劑
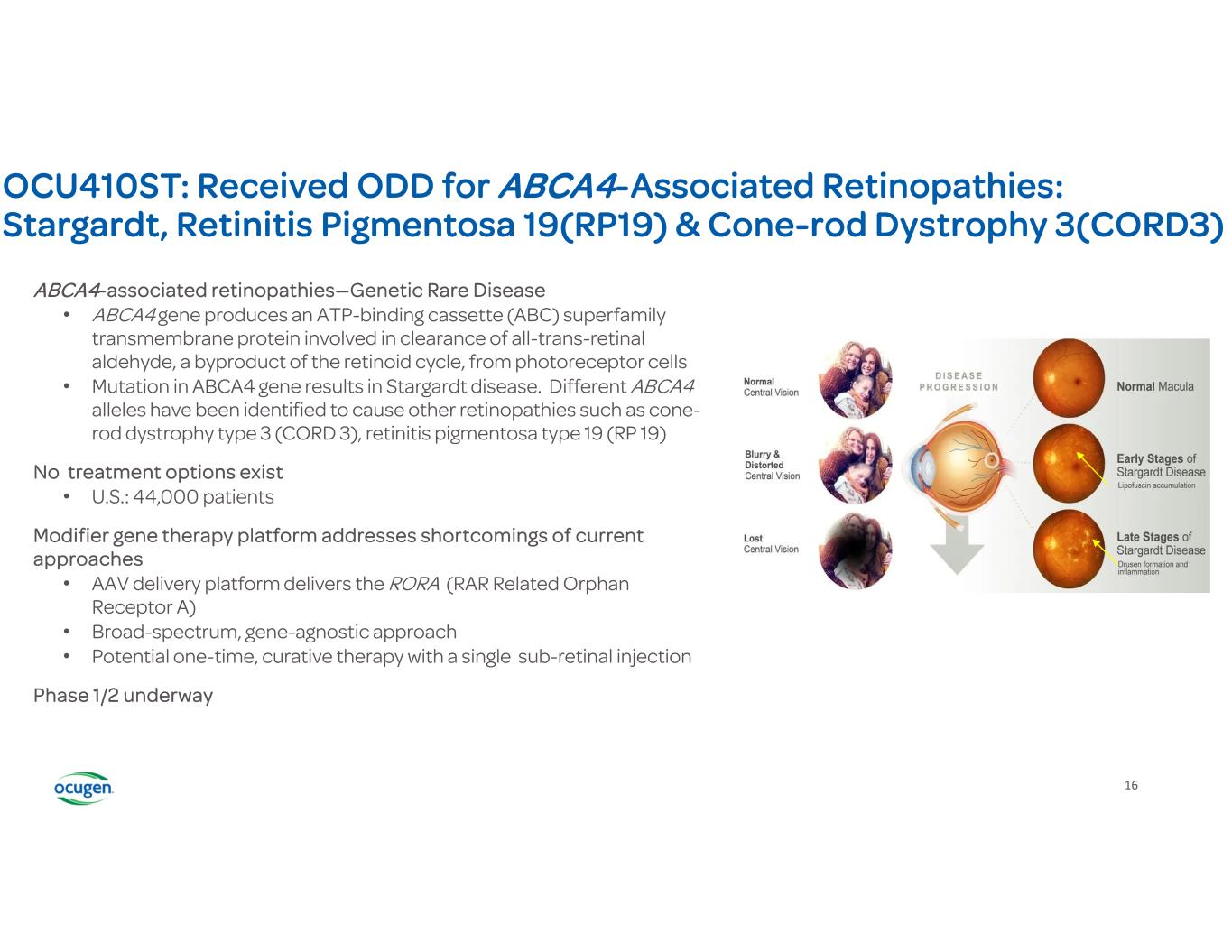
16 OCU410ST:Abca4 相關視網膜病變獲得 ODD:Stargardt、色素性視網膜炎 19 (RP19) 和 cone-rod Dystrophy 3 (CORD3) ABCA4 相關視網膜病變——遺傳性罕見病 • ABCA4 基因產生參與清除全反式視網膜醛的超家族跨膜蛋白,來自感光細胞 • ABCA4 基因突變會導致 Stargardt 病。已發現不同的 ABCA4 等位基因可導致其他視網膜病變,例如 3 型錐棒營養不良(CORD 3)、色素性視網膜炎 19 型(RP 19)沒有治療選擇 • 美國:44,000 名患者修飾基因治療平臺解決了當前方法的缺點 • AAV 交付平臺提供 RORA(RAR 相關孤兒受體 A)• 廣譜、基因無關的方法 • 潛力單次視網膜下注射的一次性治療正在進行中 1/2 期

17 OCU200 用於治療糖尿病性黃斑水腫 (DME)、糖尿病視網膜病變 (DR) 和濕性年齡相關性黃斑變性 (濕性 AMD) 的新型生物製劑

18 OCU200 是我們治療視力威脅疾病的新型候選生物製劑 • 轉鐵蛋白和妥姆他汀的重組融合蛋白 • 有可能解決糖尿病黃斑水腫 (DME)、糖尿病視網膜病變 (DR)、濕性 AMD 患者的高患病率 DME、DR:全球範圍 21000 萬 • 濕性 AMD:全球範圍內可用的治療選擇有限 • 目前的療法僅針對一種途徑,即血管生成或炎症 • 多達 50% 的患者羣體對當前的治療沒有反應 OCU200有可能彌補當前治療的缺陷 • 旨在靶向多種病因途徑,例如血管生成、氧化、炎症 • 有可能為所有患者提供更好的治療選擇公司提交了 IND 申請* • 最初針對 DME 糖尿病黃斑水腫:隆起從血管中伸出,導致液體和血液泄漏到視網膜;滲漏導致腫脹(或 “水腫”),促進視力喪失。OCU200:向美國食品藥品管理局提交了IND,以啟動針對糖尿病性黃斑水腫(DME)的1期臨牀試驗* 繼續研究公司就IND申請對FDA的迴應,並有望在2024年上半年啟動1期臨牀試驗,前提是FDA解除對糖尿病黃斑水腫(DME)的限制,並有足夠的資金可用。

19 NeoCart®(自體軟骨細胞衍生的新軟骨)

20 *骨與關節外科雜誌:2011 年 6 月 1 日——第 93 卷——第 11 期——第 994-1000 頁 ** https://www.biospace.com/article/cell-therapy-market-size-cagr-trends-forecast-report-2022-2030/ NeoCart 是一種再生細胞療法 • 獲得 RMAT 稱號 • 結合生物工程和細胞處理以增強自體軟骨修復 • 有可能通過重建受損的膝軟骨加速癒合和減輕疼痛膝蓋軟骨損傷的發生率高,演變為骨關節炎 (OA) • 關節鏡膝關節手術:每年超過 100 萬次* •OA:全球確診5.28億例 • 細胞療法全球收入預測:450億美元以上,預計北美將佔有最大份額** 目前治療膝蓋軟骨損傷的療法不理想 • 由於細胞反應變化而結果各不相同 • 當前的護理標準存在以下一種或多種問題:疼痛、膝蓋功能減退、軟骨損傷未得到解決、供體組織可用性、開腹手術 NeoCart 有可能解決當前治療的不足之處 • 治療疼痛,改善功能並防止發展為 OA • 有潛力療效提高,長期受益計劃在多個方面取得進展 • 獲得美國食品藥品管理局對第 3 期確認性試驗設計的同意(於 2024 年下半年啟動)• cGMP 生產設施的建設將於 2023 年底前完成。隨訪關節鏡檢查表明 NeoCart® 的進展和整合** 初始病變時間零植入 8 周 6 個月 NeoCart®:美國食品藥品管理局同意第 3 期試驗的控制和總體設計

21 OCU500 系列:OCU500:COVID-19 粘膜疫苗 OCU510:流感 OCU520:COVID-19/Flu

22 OCU500 系列:下一代疫苗技術基於 ChaD 載體 OCU500 的吸入粘膜疫苗平臺 A 雙價 COVID-19 疫苗 OCU510 季節性四價流感疫苗 OCU520 四價流感和雙價 COVID19 疫苗聯合吸入技術作為差異化因素 • 多項使用 Ocugen 載體的臨牀前研究顯示出疫苗誘發的高中和效應反應 • 使用通過吸入平臺給藥的類似載體的臨牀研究顯示粘膜抗體、系統性抗體,和持久的免疫力與通過肌肉注射給藥的相同疫苗相比,劑量為1/5的劑量可長達1年 • 吸入法有可能廣泛而持久地保護人們免受嚴重疾病和減少傳播符合美國疫情防範計劃,通過以下方式轉變美國快速有效地應對現有和新出現的傳染病的能力:• 下一代粘膜疫苗開發的立法宣傳 • OCU500 被美國國立衞生研究院/NIAID NextGen項目選中納入臨牀試驗。NIAID計劃在2024年初啟動1期臨牀試驗。

23 Ocugen™ Vision 完全整合、以患者為中心的生物技術公司專注於支持公共衞生的疫苗以及通過 Courageous Innovation 針對未得到滿足的醫療需求的基因和細胞療法