| 中期報告 2023 年 1 月至 9 月 第三季度 |
| 2 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 284 130% 787 2023 年 7 月至 9 月(與 2022 年 7 月至 9 月相比) 2023 年 1 月至 9 月(與 2022 年 1 月至 9 月相比) “我們期待 TARPEYO 可能獲得全面批准,用於 治療我們的 IgA 腎病 PDUFA 的日期為 2023 年 12 月 20 日。” 2023 年 7 月 — 9 月 MSEK TARPEYO 淨銷售額 Renee Aguiar-Lucander /首席執行官 TARPEYO 淨銷售額 增長(與 2022 年第三季度相比) msek 2023 年 9 月 30 日中期報告 2023 年 1 月至 9 月 • 淨銷售額為2.946 億瑞典克朗,其中 TARPEYO® 淨銷售額截至2023年9月30日的三個月中,金額為2.836億瑞典克朗, 。 截至2022年9月30日的三個月中, 的淨銷售額 為2.601億瑞典克朗,其中TARPEYO 的淨銷售額為1.234億瑞典克朗。 • 截至2023年9月30日和2022年9月30日的三個月,營業虧損分別為1.596億瑞典克朗和3620萬瑞典克朗。 • 截至2023年9月30日和2022年9月30日的三個月,攤薄前後的每股虧損分別為3.14瑞典克朗和0.17瑞典克朗。 • 截至2023年9月30日和2022年9月30日,現金總額分別為7.869億瑞典克朗和7.362億瑞典克朗。 • 8月,美國食品藥品管理局批准了全面批准用於 治療IgA腎病的TARPEYO (布地奈德)延遲釋放膠囊的 申請的優先審查。 • 8月,Nefecon®(TARPEYO® /Kinpeygo®)的3期NefiGard 研究的完整數據發表在《柳葉刀》上。 • 9月,STADA和Calliditas宣佈 已提交Kinpeygo在歐盟的全面上市許可申請 。 • PDUFA 的日期定為 2023 年 12 月 20 日:TARPEYO 有可能在針對 iGaN 患者的完整研究 人羣中獲得全面批准。 • 中國關於Nefecon的市場 授權的監管決定。 • 歐盟關於Kinpeygo的完全 上市許可的監管決定。 • setanixib 治療頭頸癌的 2 期概念驗證研究 的完整數據,預計於 2024 年上半年發佈。 • 截至2023年9月30日的九個月中, 的淨銷售額為7.553億瑞典克朗,其中 TARPEYO的淨銷售額為7.285億瑞典克朗。在截至2022年9月30日的九個月 個月中,淨銷售額為 3.738億瑞典克朗,其中TARPEYO的淨銷售額為 至2.05億瑞典克朗。 • 截至2023年9月30日和2022年9月30日的九個月中,營業虧損分別為4.148億瑞典克朗和4.544億瑞典克朗。 • 截至2023年9月30日和2022年9月30日的九個月中,攤薄前後的每股虧損分別為8.34瑞典克朗和7.72瑞典克朗。 即將到來 6 個月的預期關鍵事件 |
| 3 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 Calliditas — 開創性的 罕見 疾病新療法 我們的價值觀 Calliditas Therapeutics 利用科學專業知識和特定疾病見解來改善患者的生活。我們是一家商業階段的生物製藥公司,致力於研究、開發和 商業化新療法,以解決罕見病中未得到滿足的 需求。我們致力於擴大治療 的選擇,為 罕見病患者制定新的護理標準,這體現在我們針對未得到滿足的醫療需求的創新藥物 產品線上。 我們的主要產品提供了一種治療方案,我們 認為這種治療方案可以緩解IgA腎病 (iGaN)(也稱為 )的疾病。伯傑氏病是一種進行性自身免疫性腎臟疾病 ,對許多患者來説,會導致終末期腎臟 病 (ESRD),需要透析或器官移植。這款 藥物產品以 Nefecon® 的名義開發,於 2021 年獲得 FDA 的 加速批准,如今以 TARPEYO® 品牌在美國上市 。 它還獲得了歐洲 委員會以Kinpeygo® 品牌在歐洲 經濟區(EEA)和英國的有條件上市許可。TARPEYO和Kinpeygo 目前正在接受美國食品藥品管理局和歐洲藥品管理局的審查以獲得全面批准, 美國PDUFA的日期定為2023年12月20日。 Nefecon也已在澳門獲得批准,正在接受中國、新加坡和韓國監管機構的審查 ,Calliditas 最近建立了合作關係,在日本開發Nefecon並將其商業化。 AGILITY 我們非常靈活,能夠快速調整和適應 不斷變化的情況和要求。 EXPERTIENCE 我們利用強大的內部經驗和能力,同時通過 需要的知識共享和外部合作來補充我們的優勢。 INTEGRITY 我們對自己的行為負責,並要求自己 遵守最高的道德標準,在我們的道德 原則的指導下,做出正確的決定。 PIONEER 我們探索新方法,互相賦能 以合規、創新 和務實的方式尋找新的運營方式。 IgA 腎病是腎小球腎炎 疾病中最大的疾病,因此 Nefecon 的市場潛力巨大, 的對外許可協議就證明瞭這一點,潛在付款 超過3億美元,包括預付款和 預定義的里程碑以及持續的特許權使用費義務。 我們的後期產品線基於同類首創的氮氧化物抑制劑平臺 。我們的主要化合物setanaxib可抑制參與炎症和纖維化途徑的 酶 ,是該類別中第一個進入臨牀階段的藥物。 Setanaxib 目前正在進行鍼對以炎症和纖維化為特徵的罕見 疾病的臨牀試驗,包括 IPF 和 PBC,Calliditas還計劃啟動一項用於 setanaxib 治療阿爾波特綜合徵的試驗。此外,基於令人鼓舞的 臨牀前發現,我們正在對 頭頸癌進行概念驗證試驗,以進一步支持 類藥物的作用模式。 雖然我們的總部設在瑞典的斯德哥爾摩,但我們在美國仍佔有重要地位,在紐約 和新澤西設有辦事處。我們還在法國和瑞士設有辦事處, 是我們的發現團隊所在地。Calliditas Therapeutics普通股於2018年在納斯達克斯德哥爾摩上市(CALTX) ,隨後,代表我們 普通股的美國存托股份於2020年在美國納斯達克全球精選市場 上市(CALT)。 |
| 4 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月關鍵數據 投資亮點 2023 年 7 月至 9 月 1 月至 9 月 1 月至 12 月 (以千瑞典克朗計,每股金額除外或另有説明)2023 2023 2022 2022 淨銷售額 294,592 755,327 373,837 802,879 其中 TARPEYO 產品銷售額 283,591 123,400 728,879 522 204,989 372,247 營業利潤/(虧損)(159,573)(36,227)(414,819)(454,438)(421,943) 該期間的所得税前利潤/(虧損)(164,082)(15,958)(419,483)(409,417) 收益之前的每股虧損/(虧損)和攤薄後(瑞典克朗)(3.14)(0.17)(8.34)(7.72)(7.78) 用於經營活動的現金流(62,529)(124,725)(457,500)(541,383)(311,354) 截至 (千瑞典克朗,每股金額或其他説明除外)30.09.2023 30.09 9.2022 31.12.2022 期末包括卡利達斯持有的股份在內的註冊股份總數 59,580,087 59,157,587 59,580,087 期末歸屬於母公司股東的權益 352,435 725,936 766,264 期末權益比率為% 22% 48% 39% 在此期間 786,883 736,161 1,249,094 近期和預期的價值驅動因素 NEFECON setanaxib 正面讀數 頭部和頸部 poc 試驗的生物標誌物數據 在 啟動試驗} Alport syndrome 頭部和 頸癌 Ph2 試驗的最終數據讀出 Ph2 IPF 試驗的數據讀出 ph2b PBC 試驗 申請全面批准 在美國 iGaN 和 歐洲 DUFA 日期 12 月 20 日: 可能獲得美國 iGaN 的全面批准 TARPEYO 在 的商業坡道 Nefecon 在中國的商業坡道 由 Everest Medicines H1 2023 H2 2024 H2 2024 STADA Kinpeygo 的商業坡道 } 在歐盟 iGaN 獲得批准 |
| 5 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月首席執行官聲明 8 月,我們很高興看到我們發表在《柳葉刀》上的全球 隨機、安慰劑對照、雙盲三期臨牀 試驗NefiGard的完整數據集。如先前報道的那樣, 該試驗成功達到了其主要終點,提供了證據 表明,在原發性IgA腎病(iGaN)成人患者中,使用Nefecon 16 mg/天的治療9個月後, (衡量腎臟 功能的指標)的下降幅度在2年內顯著降低。此外,在整個期間, 觀察到蛋白尿 持續降低,Nefecon 對egFR的積極作用與基線蛋白尿無關,導致 與安慰劑相比 ,在2年內,eGFR的降幅降低了約50%。我們認為,這些結果 支持這樣的論點,即該藥物有可能延遲 次的透析或移植需求,具有臨牀意義。我們期待 TARPEYO 有可能在 2023 年 12 月 20 日的 PDUFA 日期獲得全面批准。 9月,我們有機會參加了每年兩次的iiGann會議,該會議於今年在日本東京舉行。 在峯會上,我們展示了5張海報,包括確認性的 生物標誌物分析,顯示Gd-Iga1顯著減少,以及支持該藥物 疾病調節機制的循環免疫複合物(Iga-iC)。我們還做了兩次口服 陳述,其中一次研究種族差異,一次 表明,使用Nefecon進行治療可使無微血尿的 患者數量從34%增加到60%,而安慰劑中 的患者數量從32%增加到39%,這具有統計學意義(p=0.0001)。 正如預期的那樣,第三季度受到夏季的影響,銷售團隊也出現了一些人員流動,導致 儘管新處方者持續增長,但新註冊人數略有下降。但是,從第四季度早期的趨勢來看, 入學率的顯著增長令我們感到非常鼓舞。第三季度總收入為2.95億瑞典克朗,其中 來自TARPEYO的淨收入為2.84億瑞典克朗( 2630萬美元)。本季度的營業虧損為1.6億瑞典克朗 ,其中包括5.2億瑞典克朗的一次性研發成本 ,主要源於TRANSFORM試驗的變化以及 研究項目的停止。本季度 的現金淨減少7300萬瑞典克朗,我們的現金狀況仍然強勁 ,資產負債表上有7.87億瑞典克朗,根據對TARPEYO的收入預測,我們認為這足以使我們實現現金流收支平衡。我們還開始看到 市場準入統計數據有所改善,新患者開始平均需要 15-20 天才能填補,這反映了我們為持續 改善患者獲得渠道所做的努力。 繼多次美國顧問委員會會議以及在最近的會議上與腎臟科醫生的數十次 面對面互動獲得積極反饋後, 《柳葉刀》發佈了 完整的第三階段數據集 ,我們決定啟動一項有針對性的美國重點投資 計劃,以適當支持和鞏固我們的 類別領導地位。這將涉及在相關商業職能部門增加資源 ,以便充分利用 在 2023 年底獲得全面批准的可能性。我們相信, 這將最大限度地提高我們在2024年推動收入顯著增長的能力 ,而在2023年對成本的影響有限。在接下來的幾個月中,我們計劃有選擇地用 補充現有團隊,目標是繼續加強我們的醫學教育、患者 支持和市場準入活動,以促進患者准入 ,並繼續基於 NefiGard 試驗數據集建立領先的特許經營權。這種增長是有針對性的、漸進的, 預計不會在2024年大幅增加商業成本基礎。 在本季度我還有機會拜訪了我們在中國的合作伙伴 Everest Medicines,詳細瞭解他們在 之前的商業活動和準備工作,有望在今年晚些時候獲批 ,以及在 4月啟動的非常成功的搶先體驗患者(EAP)計劃。數百名患者報名參加該項目, 使其成為 在中國啟動的最成功的EAP項目之一。我們希望Nefecon在今年 年晚些時候在中國獲得批准。在中國,腎小球腎炎 的高患病率導致許多年輕人最終接受透析,因此 對患者進行有效治療的需求至關重要。 季度後的活動包括在費城舉行的美國腎臟病學會腎臟週會議,這為我們提供了 許多與全國各地的腎臟科醫生 會面和互動的機會。總體情緒以及 與腎臟科醫生的多次會面都非常積極, 進一步鞏固了我們的信念,即我們 3期試驗的強勁長期數據加上已發佈的註冊數據,例如Radar出版物 ,已在 腎病學界開始了一場關於需要儘早幹預和治療IgAn的重要對話。更多信息請見我的第四季度報告。 我們保持2023年的指導方針,期待TARPEYO有可能在第四季度獲得全面批准,並期待2024年激動人心。 *慢性腎臟病臨牀試驗中基於斜率的終點的線性樣條混合效應模型。Renée Aguiar-Lucander,首席執行官 |
| 6 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月業務概述 我們的產品線 激動人心的未來旅程 Calliditas 的主要產品以 Nefecon 的名義開發,已在美國和 歐洲獲得批准,正在等待中國的批准。我們的產品線包括基於 一流氮氧化物抑制劑平臺的開發項目。先導化合物setanaxib是第一種進入臨牀階段的氮氧化物抑制劑,是一種選擇性氮氧化物1和氮氧化物4抑制劑。Calliditas目前正在試用setanaxib治療原發性膽管炎(PBC)和頭部和 頸部鱗狀細胞癌(SCCHN)。還有一項由研究者主導的特發性肺纖維化(IPF) 的試驗正在進行中,我們正計劃啟動一項針對Alport綜合徵的2期試驗。 2023 年 12 月 20 日 PDUFA 日期;美國食品藥品管理局決定全面批准 TAPREYO 用於 有進展風險患者 原發性 IgA 腎病 中國的監管決定 Kinpeygo 可能於 2024 年上半年在歐盟獲得全面批准 23:靶向啟動 Alport 綜合徵臨牀試驗 H 24:來自頭頸部 癌症 2 期研究的完整數據 NEFECON* Setanaxib 臨牀前階段 1 期 2 期上市權商業區即將到來的里程碑 * 在美國加速獲得批准tradename TARPEYO® 可減少原發性 IgAn 有疾病快速進展風險的成年人的蛋白尿,通常尿蛋白與肌酐比 (UPCR) ≥ 1.5 g/g,並以商品名 Kinpeygo® 在歐洲經濟區和英國獲得有條件上市許可,用於治療有尿蛋白與肌酐比率快速疾病進展風險的成年人中的原發性 IgAn (UPCR) ≥1.5 g/g。 商業正在進行的試驗計劃中的試驗研究員主導的試驗 iGaN 日本 ROW 前合作伙伴 PDUFA 可能獲得全面批准的日期:2023 年 12 月 20 日 iGaN 中國、香港、澳門、 臺灣、新加坡、 韓國 接受保密協議,中國收到 FTD 。 預計將在2023年第四季度做出決定,等待EMA審查 的全面營銷 授權申請。iGan KINPEYGO 4 mg 改性釋放硬膠囊 布地奈德 歐洲、英國、瑞士 全球 SCCHN Global IPF Global Alport Global PBC |
| 7 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月業務概述 我們的商業產品 Calliditas 的主導產品是 有史以來第一種 批准的藥物,是 批准的藥物,是 有史以來第一種 批准的藥物,是唯一專為靶向自身免疫性腎病 起源 IgA 腎病 (IgAn) 而設計的 治療藥物,可改善疾病。 iGaN 是一種嚴重的進行性疾病,其中,多達 50% 的 患者最終面臨在十到二十年內患上終末期腎臟疾病 (ESRD) 的風險。該產品 以 Nefecon® 的名義開發,在美國獲準使用 品牌名稱 TARPEYO®,在歐洲獲準使用 品牌名稱 Kinpeygo®。 疾病背景 儘管 iGaN 出現在腎臟中,但有證據表明 它是一種起源於腸道遠端的疾病, 具體地説是迴腸。Peyer 斑塊集中在迴腸的腸道相關淋巴組織中, 已被確定為粘膜型 IgA 抗體的主要來源。IgA 腎病患者 粘膜型 IgA 水平升高,與血液中的大多數 IgA 相比,粘膜型 IgA 主要是二聚體或聚合物, 缺乏半乳糖。在iGaN患者中, 遺傳易感性與環境、細菌和飲食 因素相結合會導致這些 缺乏 半乳糖的IgA抗體的產量增加。產量的增加, 可能與腸道通透性增加相結合, 會導致這些分泌抗體出現在血液中。 來自完整的3期試驗讀數的強大數據 NefiGard 是第一項專為 IgA 腎病設計的 3 期試驗,以 egFR 測量,顯示出具有統計學意義且與臨牀相關的腎臟保護作用。Calliditas向FDA提交的 補充新藥申請是基於 該試驗的數據,而Calliditas在強勁的eGFR數據讀取的基礎上以 申請全面批准。 完整的3期NefiGard試驗共包括364名患者,其中包括來自中期分析的200名患者, 在此基礎上,Calliditas成功地分別向FDA和EMA申請了加速 和有條件的批准。 完整試驗包括所有研究參與者的9個月治療和15個月的 治療後觀察期 ,以確認長期的腎臟保護。完整的 3期試驗的終點評估了接受治療的 患者與安慰劑患者之間的腎功能差異(以eGFR測量),自每位患者開始給藥之日起,在 兩年內。 的數據讀取於2023年3月進行,並於2023年8月發表在《柳葉刀》上。 3期試驗的主要終點是兩年內每個時間點觀察到的eGFR的時間加權 平均值。 成功滿足了主端點,其高度統計的 p 值為 |
| 8 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 IgA 腎病 ——巨大的市場機會 我們的商業合作伙伴關係 • iGaN 是一種罕見的疾病,但它是最常見的 原發性腎小球腎炎。據估計, 在美國的患病率在13萬至15萬名患者之間, 在歐洲約為20萬名患者,在中國高達500萬名患者。 • 在美國,我們估計大約有 12,000 名腎臟科醫生,其中多達三分之二使用 iGaN 治療 患者。大約 4,000 到 5,000 名專科醫生 為大多數患者看病。大約 40% 的患者在學術環境中接受治療 ,其餘患者在社區接受治療。1 業務概述 歐盟 Nefecon® 於 2022 年 7 月獲得 歐盟委員會的有條件上市許可 (CMA), 隨後於 2 月獲得英國藥品和 保健產品監管局 (MHRA)} 2023,品牌名稱為 Kinpeygo® ,用於治療有快速疾病進展風險的成年人 iGaN,尿液 蛋白質與肌酐比 (UPCR) ≥1.5 g/ 克,成為歐盟第一個也是唯一一個獲準的 IgAn 治療藥物。如果獲得該司法管轄區的批准, Kinpeygo 將在歐洲 經濟區 (EEA)、英國和 瑞士上市,僅由STADA Arzneimittel AG 上市。Calliditas於2021年7月與該公司簽訂了 許可協議,在歐洲註冊 並將Kinpeygo商業化。 STADA 於 2022 年 9 月 在德國推出了Kinpeygo,隨後還將推出更多歐洲國家。在德國, 據估計,每年每10萬人中有3.1人患上iGaN。 繼從完整的NefiGard試驗中讀出積極數據並向美國食品藥品管理局提交了 snDa之後,Calliditas正在與STADA合作評級,尋求歐盟委員會對 Kinpeygo的全面批准,並在整個研究人羣中尋求對MHRA的全面批准。 大中華區 Calliditas於 與 Everest Medicines(香港交易所 1952.HK)簽訂了許可協議 ,在大中華區和新加坡為 iGaN 開發和商業化Nefecon。2022 年 3 月,該協議 擴大到包括韓國。 珠穆朗瑪對Nefecon的新藥申請(NDA) 於2022年11月被中國 監管機構國家藥品監督管理局(NMPA)接受,12月,NMPA 的 藥物評估中心(CDE)建議優先審評。監管部門 預計將在2023年第四季度做出決定。 2023 年 4 月,珠穆朗瑪峯在中國 海南博鰲試驗區推出了 Nefecon,作為首創的 IgA 腎病緩解療法。該計劃允許創新 • 根據KDIGO指南的定義,美國面臨疾病進展風險的iGaN患者羣體 約為45,000至60,000名患者。2 • 如今,這些患者中的大多數主要接受支持性治療,例如用於控制血壓的仿製ACE和/或 抗逆轉錄病毒藥物,以及其他 廣泛使用的有氧和腎臟保護藥物。 • 隨着特別適用和批准用於iGaN的獲批藥物 的供應量和知名度的增加 ,以及醫生考慮採取更積極的幹預措施來保護腎臟功能,我們估計全球iGaN 市場規模將達到50億至80億美元。 在 獲得國家藥品監督管理局監管批准之前, 已在其他地區 獲準在海南省實際臨牀環境中銷售和使用的海外藥品和醫療器械。數百名患者報名參加這個 搶先體驗計劃,使其成為 中國推出的 最成功的 EAP 項目之一。 2023 年 10 月,珠穆朗瑪峯獲得澳門 特別行政區藥品管理局的批准 將 Nefecon 用於處於 疾病進展風險的 iGaN 患者, 成為珠穆朗瑪峯地區首個 獲得 Nefecon 批准的地區。 日本 2022年底,Calliditas與Viatris Inc.(納斯達克股票代碼:VTRS)的子公司Viatris Pharmicals日本公司 建立了合作伙伴關係,在日本 實現Nefecon的商業化。 Viatris 是一家全球醫療保健公司, 總部位於美國, 業務遍及超過 165 個國家和 個地區,還經營大約 40 個製造工廠。 1Veeva OpenData 2023 年,包括所有主要專長為腎臟病的活躍 HCP 2Spherix RealWorld Dynamix |
| 9 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 Nefecon 有潛力 在 iGaN 中建立新的護理標準 業務概述 專為局部靶向疾病 起源而設計的靶向免疫調節劑 與 優化的 rasI 療法結合使用;可選擇間歇治療,而不是 耐用 eGaN iGaN 有益 有益處 有持續的促茶尿病改良作用 活性成分和 安全概況 作用機制患者關注療效安全 Nefecon® 是美國食品藥品管理局和歐盟委員會批准的第一款用於 iGaN 的藥物,也是唯一一種專為靶向 IgA 腎病 (iGaN) 起源而設計的能夠改善疾病的治療藥物。 • 需要遺傳易感性 但還不夠;大多數患者 在20多歲和30多歲時被診斷出來 • 超過 50% 的患者有 在10-20年內發生ESRD的風險,從而導致腎臟移植 • 治療目標是保持 — 腎功能 • 蛋白尿水平 > 1g/24h 表示存在患病風險進展 和更糟糕的前景 iGaN 患者: |
| 10 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 TARPEYO 銷售額持續增長 業務概述 在 2023 年第三季度,Calliditas 的商業團隊繼續在上一季度取得的成就的基礎上再接再厲,進一步鞏固了 TARPEYO 作為 IgA 腎病 (iGaN) 變革性治療選擇的地位。值得注意的是,本季度 FDA 批准了對我們的補充新藥申請的優先審查,以全面批准 TARPEYO,PDUFA 的日期定為2023年12月20日。該團隊正在為新的 適應症的發佈做準備,預計美國食品藥品管理局將批准在NefiGard試驗中研究的全部iGaN患者 人羣中使用TARPEYO。 Actinest Journey Ahead 接受了 7 份摘要,用於 ASN 的 演講。 有機會在 2023 年 11 月 1-4 日在費城 ASN 上交流 P2P 教育和科學數據 。 2023 年 12 月 20 日 PDUFA 日期 有可能獲得 的全面批准。 新適應症促銷活動 發佈——基於腎功能減緩的證據 減緩*,為全部 NefiGard 3 期試驗人羣發佈了新標籤。 2023 年第三季度註冊的新患者年初至今註冊患者:2023 年第三季度有 1,198 名新處方者 LTD 處方者:1,338 *不包括仍在等待最終保險決定的患者 *尚待美國食品藥品管理局審查和批准 TARPEYO Touchpoints 的患者獲得 Tarpeyo* YTD 在 nefiGard Pahse 3 試驗 人羣中審查 TARPEYO 的全面批准 — PDUFA 2023 年 12 月 20 日。 來自 《柳葉刀》上發表的 NefiGard 3 期試驗的完整結果。 在 igA Nephropathy 基金會主辦的 SPARK 2023 研討會上與 iGaN 社區互動 >200 名患者參加。 在 iiGann 會議上發表了 7 次演講, 報告了 NeflGard 3 期試驗的結果 和生物標誌物數據。 季度亮點 第三季度關鍵指標 367 197 86% 2630 萬美元 |
| 11 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月業務概述 Calliditas 的產品線包括基於同類首創氮氧化物抑制劑平臺的開發 項目。Calliditas目前正在頭部鱗狀細胞癌和 頸部鱗狀細胞癌(SCCHN)以及原發性膽汁性膽管炎 (PBC)中使用先導化合物setanaxib 進行臨牀試驗,該試驗於7月公佈了中期數據。我們還計劃在2023年第四季度啟動一項針對 Alport 綜合徵的臨牀試驗。 氮氧化酶抑制劑 NOX 酶抑制劑是一組具有前景的新型實驗性藥物 ,屬於新的治療類別,自 2019 年批准 “naxib” 作為新藥幹以來,世衞組織就開始認可。煙酰胺 腺嘌呤二核苷酸磷酸鹽 (NADPH) 氧化酶,也稱為 酶,是唯一已知的 專門用於產生活性氧 (ROS) 的酶,因為其主要功能是 。它們是跨膜酶, 將細胞質中 NADPH 中的電子轉移到細胞 膜上,從而形成 ROS。 在適當的濃度下,活性氧在細胞信號傳導過程中具有基本功能 ,但是氧化還原 動態平衡的破壞與多種疾病途徑有關。 當細胞受傷時,會觸發過多的氮氧化物活性, 氧化還原動態平衡變得不平衡,導致 促纖維化通路的激活。 腫瘤微環境中的癌症相關成纖維細胞也表達氮氧化物酶,這可能 導致腫瘤免疫活性低下,對免疫腫瘤藥物(例如 檢查點抑制劑)的作用具有相對抗性。 Setanaxib 是第一種進入臨牀 階段的氮氧化物抑制劑,可抑制 NOX1 和 NOX4,這兩種酶與 纖維化和炎症途徑有關,是潛在的治療靶標。 Alport Syndrome Alport 綜合徵是一種遺傳性疾病,源於編碼 4 型膠原蛋白的基因 的突變。4 型膠原蛋白 α鏈主要位於腎臟、眼睛和 耳蝸中,因此該病的特徵是腎臟 疾病、聽力喪失和眼部異常。最終, 患者出現蛋白尿、高血壓、進行性腎功能喪失 (GFR 逐漸下降)和終末期腎臟 病(ESRD)。 管道:氮氧化物抑制劑平臺 據估計,美國有3萬至6萬人患有這種疾病,它是慢性 腎臟病 (CKD) 的重要病因,導致青少年和年輕 成年人出現ESRD,佔歐盟和美國接受腎臟 替代療法的兒童的 1.5% 至 3.0%。1 基於臨牀前顯著的支持性體內支持工作中,Callid-itas計劃在Alport綜合徵中啟動一項隨機、安慰劑對照的臨牀試驗 ,涉及約20名患者,同時評估 的總體安全性作為對蛋白尿的影響。我們預計這項研究 將在2023年第四季度啟動,並根據所讀的數據, 決定在阿爾波特制定一項全面的監管計劃。2023年9月,Calliditas被美國食品藥品管理局授予 孤兒藥稱號,用於使用setanaxib治療Alport 綜合徵,2023年10月,EMA孤兒藥品委員會(COMP) 對該公司在歐盟申請阿爾波特綜合徵中setanaxib的孤兒 藥物認定發表了積極的看法。 原發性膽汁性膽管炎 PBC 是一種進行性慢性肝臟自身免疫性疾病 ,可導致膽道上皮細胞循環免疫損傷, 導致膽汁淤積和纖維化。它是一種孤兒病, 根據其已知的患病率,我們估計 在美國大約有 140,000 名患者,其中 的年發病率介於 0.3 至 5.8 例之間。Calliditas 於 2021 年 8 月 在 PBC 中獲得了 setanaxib 的 FDA 快速通道稱號。 熊去氧膽酸(一種仿製藥物,也稱為熊二醇 或UDCA)和奧貝膽酸(稱為奧卡利瓦)是美國食品藥品管理局和歐洲 委員會批准的唯一 治療PBC的方法。但是,儘管有這些治療選擇,但PBC患者的醫療需求仍未得到滿足,尤其是在重要的生活質量結果方面, 。 在PBC中對111名患者進行setanaxib試驗的2期數據 表明,對於估計肝纖維化階段為F3或更高的患者,setanaxib對 肝纖維化和 ALP 減少(鹼性磷酸酶,一種廣泛確立的PBC預後獨立預測指標)的影響更為明顯。 肝硬度升高的患者患病的風險更大。 Calliditas正在對肝硬度升高的PBC患者進行一項隨機、安慰劑對照、雙盲2b期試驗。 我們已經向FDA提交了協議修正案,以調整 該試驗的設計,並預計將在2024年中期 公佈數據。 1。Watson S、Padala SA、Hashmi MF 等阿爾波特綜合症。 [2023 年 8 月 14 日更新]。在:StatPearls [因特網]。金銀島(佛羅裏達州):StatPearls 出版社;2023 年 1 月- 可從以下地址獲得:https://www.ncbi.nlm.nih.gov/books/NBK470419/ |
| 12 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月業務概述 第 2 階段概念驗證研究:中期數據 Readout 2023 年 7 月,Calliditas 宣讀了該試驗的中期數據, 反映了鼓勵早期臨牀無進展存活率 的結果,也支持了 setanaxib 假定的抗纖維化模式。分析的基礎包括20名復發或轉移性SCCHN患者的數據 ,其中 16名患者的腫瘤大小和全氟辛烷磺酸相關結果是可評估的。 十二名患者在治療前後接受了腫瘤活檢 ,這些活檢在生物標誌物分析中是可評估的,該分析包括 轉錄組學分析,並評估了 SMA、Foxp3 調節性 T 細胞和 PDL-1 CPS 等 等病理標誌物。 轉錄組分析顯示,受治療影響的兩種主要途徑 是纖維化相關信號通路 (特發性肺纖維化信號通路和肝 纖維化/肝星狀細胞激活途徑),為 活化癌 Setanaxib 在鱗狀細胞癌中的假定作用模式提供支持 Head 和 Neck Calliditas 正在評估 setanaxib 在頭頸癌中的作用,並在 的有前景的體內臨牀前數據基礎上建立 ,這些數據表明 setanaxib 可以顯著增強免疫腫瘤療法的作用。我們正在進行一項雙盲、隨機、安慰劑對照、概念驗證的2期研究,該研究正在研究 setanaxib 800mg 與 pembrolizumab 200mg 靜脈注射對至少 50名復發或轉移性SCCHN患者以及 中度或高水平癌症腫瘤的作用相關成纖維細胞。 管道:氮氧化物抑制劑平臺 28 天 無治療 篩查治療隨訪 ~50 名患者 ≤ 28 天 可接受腫瘤 組織活檢 陽性 CAF 水平 (定義為腫瘤中的 CafS 水平 不進行治療 所有入組患者 br} 腫瘤活檢 9 周 (±1 周) Pembrolizumab 200 mg 靜脈注射,每 3 週一次 Setanaxib 800mg PO,每日兩次 CAF = 靜脈注射 A 腫瘤活檢 會的在隨機分組之前服用,大約 9 周後再次服用 。根據 腫瘤學試驗的標準慣例,治療將繼續 直到出現不可接受的毒性或疾病進展。Calliditas於2023年7月宣讀了該研究的臨時數據 ,並預計將在2024年上半年讀出最終的試驗數據 。 這項研究的更多細節可以在www.clinicaltrials.gov上找到,參考文獻是 NCT05323656。 頭頸癌中存在相關成纖維細胞,以及Calliditas其他正在進行的臨牀項目中潛在的抗纖維化作用。 病理學分析顯示,初步證據表明,使用 setanaxib 治療的患者腫瘤內的免疫活性增加,Foxp3 和 PDL-1 CPS 發生了有利的變化。由於兩組之間 基線時的SMA水平不平衡, 和腫瘤活檢樣本通常很少, 無法就setanaxib對減少SMA 的影響得出任何結論。 在PFS方面,16例可評估的患者中有7例無進展,病情穩定或部分反應,其中 6例屬於setanaxib組,1例在安慰劑組。 在讀出數據 時,7名患者中有6名仍在服用該研究藥物,報告的最長服藥時間為21周,與患者有關在 setanaxib 手臂裏。 |
| 13 Calliditas Therapeutics | 第三季度中期報告:2023年1月至9月採訪首席營銷官理查德·菲利普森 Calliditas 首席醫學官 理查德·菲利普森 頭頸癌 研究的中期讀數意味着我們現在已經看到了Calliditas生成的第一批關於setanaxib的數據。在這些數據中,你 最突出的是什麼? 來自 腫瘤組織的轉錄組數據確實讓我們感到鼓舞,這些數據顯示有證據表明 setanaxib 正在調節 纖維化途徑,這與該藥物 的作用機制非常吻合。我們還發現無進展存活率存在有趣的數字差異 ,有利於接受seta-naxib(在pembrolizumab之上)治療的患者,並指出在這次中期數據綜述中,我們沒有進行任何 正式的統計測試。 這些數據為2024年上半年數據 的最終分析奠定了良好的基礎,我們希望 看到,與 pembrolizumab 一起使用時,setanaxib 會減緩 腫瘤的生長並提高無進展存活率,而 與單獨使用pembrolizumab 相比,setanaxib 會減緩 的生長並提高無進展存活率。 NefiGard 的完整數據最近發佈在 《柳葉刀》上。你認為這對駕駛 iGaN 領域的 腎臟科醫生有多重要? NefiGard研究最終分析的發佈對Nefecon來説是一個里程碑,更籠統地説,對於igA 腎病領域來説,也是一個里程碑。我們知道腎臟科醫生非常希望看到 高質量的科學和臨牀數據支持 Nefecon 的使用;《柳葉刀》上的這篇文章通過 快速審查程序獲得認可,對這項為期兩年的腎功能結果進行了清晰而全面的描述。 在研究結果時,給我留下特別深刻印象的是 Nefecon 對腎臟功能(估計的腎小球濾過率)具有明顯的有益作用 [eGFR]) 在 9 個月的治療中達到, 在隨後的治療後的 15 個月中一直保持不變。伴隨着蛋白尿的持續和持久改善,這種改善在非治療期間也得以維持。 Nefecon 的開放標籤延期研究目前正在進行中 ,預計將在2024年中期公佈結果。你將在這個數據集中尋找什麼 ? 這是一項非常有趣且重要的研究,它將幫助我們 瞭解使用Nefecon進行再治療的影響。在 開放標籤延伸研究(OLE)中,所有入組患者都將接受為期 9個月的Nefecon治療。在主要的NefiGard研究中,其中一些患者 已經接受了 Nefecon 的9個月療程(隨後是15個月 的非治療觀察),而其餘患者 將首次接受Nefecon(因為他們在主要研究中接受了 安慰劑)。我們將能夠觀察 第二療程如何影響蛋白尿和 eGFR,因此 可以更好地瞭解使用 Nefecon 進行再治療的潛在益處。我們希望在研究的最終分析完成後不久 公佈這些結果。 你在 2020 年中期加入了 Calliditas。自從你加入公司以來, 醫療方面最令人興奮的事態發展是什麼 ? 在我加入公司以來的三年中,Calliditas 取得了長足的發展,與我在2020年7月加入的 相比,這是一家截然不同的公司。在醫學方面,我們在臨牀運營、生物統計學、科學 傳播和藥物警戒方面積累了 內部專業知識,尤其令我興奮的是,我們能夠在頭頸癌和Alport 綜合徵等疾病中獲得令人信服的臨牀前數據,並將這些數據轉化為臨牀研究,使 我們能夠評估setanaxib的安全性和臨牀效果這些 種疾病。我們絕對致力於開發能為罕見病患者帶來改變的藥物 , 為我們在腎臟病學、肝病和頭頸部 癌症領域建立的與專家 的良好關係網絡感到非常自豪。 |
| 14 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 Calliditas 開展可持續發展工作 ,其目標是CSRD報告 14 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 Calliditas 致力於關注 可持續發展,並期待 在可持續性問題上變得越來越透明。在歐盟,企業 可持續發展報告指令 (CSRD) 將 引入新的報告要求, 為我們的可持續發展工作提供方向和方法 。 重要性評估是第一步 作為Calliditas加強可持續發展目標的第一步, 我們已經開始了雙重重要性評估 。該評估將有助於定義與Calliditas最相關的可持續發展 問題。根據CSRD, 這些問題是基於兩個角度定義的。影響 視角基於Calliditas運營如何影響人和環境,而財務視角 基於外部 因素對Calliditas的財務影響。 然後,定義的重大主題將構成Calliditas 可持續發展戰略、目標和運營的基礎。它們也將 構成Calliditas未來符合CSRD標準的可持續性報告的基礎 。 可持續發展 我們將目光投向了 2025 年年度和可持續發展報告 Calliditas 將從 2025 財年 年度起受到 CSRD 的約束,該報告將於 2026 年發佈。為了確保 及時開展Calliditas的實際可持續發展工作 “我們在 可持續發展方面的工作取得了長足的進步。對於Calliditas來説,重要的是要以社會和環境 合乎道德和負責任的方式開展工作, 遵守新的CSRD指令。” åsa Hillsten 投資者關係與可持續發展主管 説實話,在 Calliditas的可持續發展工作中實施CSRD的工作已經開始。作為第一步, 董事會和管理團隊接受了有關該主題的 培訓。本次培訓概述了 新的規章制度,描述了 將如何影響Calliditas,並強調了 董事會和管理團隊的責任越來越大。 對於Callid-itas來説,可持續發展問題一直非常重要。通過我們的商業模式,我們為改善 醫療需求未得到滿足的罕見病患者 的生活做出了貢獻。考慮到Calliditas經營的行業, 道德和負責任的商業行為至關重要。在Calliditas,為我們的 員工提供一個安全、健康和充滿活力的工作場所也是當務之急。這 包括非歧視和為所有人提供 平等機會的工作場所文化。Calliditas在其價值鏈中還承擔着重要的上游 和下游責任,因此 的目標是減少公司的環境影響 和資源使用。 CSRD 對可持續發展報告的 質量和數量提出了更嚴格的要求 CSRD 是歐盟促進 公平透明的可持續發展報告的一攬子措施的一部分。這是歐盟雄心壯志的一部分,即確保融資和資本 覆蓋面企業擁有可持續的投資和業務 模式,從而使歐盟符合《巴黎 協議》的要求和17個可持續發展目標。 CSRD 中的要求比 先前的可持續發展報告要求更為全面,涵蓋了 大量與環境、社會和治理 (ESG) 問題相關的披露。其他披露涉及總體可持續發展治理報告 以及 年度可持續發展報告的制定。Calliditas期待着開展必要的工作以滿足CSRD的要求, 在成為一家更具可持續性的企業方面取得長足的進步。 |
| 15 Calliditas Therapeutics | 中期報告第三季度:2023年1月至9月2023年1月至9月財務概覽 截至2023年9月30日和2022年9月30日的三個月,淨銷售額分別為2.946億瑞典克朗和2.601億瑞典克朗 , 。截至2023年9月30日的九個月中, 和2022年9月30日的淨銷售額分別為7.553億瑞典克朗和3.738億瑞典克朗。該期間的淨銷售額主要來自TARPEYO® 在美國的淨銷售額,在截至2023年9月30日和2022年9月30日的三個月 中,淨銷售額分別為 2.836億瑞典克朗和1.234億瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月 個月中, TARPEYO的淨銷售額分別為7.285億瑞典克朗和2.05億瑞典克朗, 。就2022年的 比較期而言,我們在歐洲合作的特許權使用費收入在2023年第三季度為960萬瑞典克朗, 2023年前九個月為2,280萬瑞典克朗,未確認特許權使用費收入。 在截至2023年9月30日的三個月和九個月中, 沒有發現任何里程碑。在截至2022年9月30日 的三個月中,淨銷售額為1.35億瑞典克朗 ,其中包括 Kinpeygo® 在歐洲商業化產生的里程碑費用。此外,在截至2022年9月30日 的九個月中,里程碑費用為1.638億瑞典克朗,其中包括有關Everst Medicines的里程碑費用。 有關更多信息,請參閲註釋 4。 銷售成本 截至2023年9月30日和2022年9月30日的三個月,銷售成本分別為1,490萬瑞典克朗和430萬瑞典克朗 , 。在截至2023年9月30日和 2022年9月30日的九個月中,銷售成本分別為3,820萬瑞典克朗和730萬瑞典克朗。2023 年期間的增長 與產品銷售量的增加有關。 總運營費用 截至2023年9月30日和2022年9月30日的三個月,總運營支出分別為4.392億瑞典克朗和2.920億瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中,總運營支出分別為11.320億瑞典克朗和8.210億瑞典克朗。 研發費用 截至2023年9月30日和2022年9月30日的三個月,研發費用分別為1.799億瑞典克朗和1.029億瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中, 的研發費用分別為3.955億瑞典克朗和3.125億瑞典克朗, 。在截至2023年9月30日的三個月中, 增加了7700萬瑞典克朗,在截至2023年9月30日的九個月中增加了8,300萬瑞典克朗, ,這主要是由於nox平臺的臨牀活動增加, 包括正在進行的setanaxib試驗,以及Budenofalk減值3,210萬瑞典克朗產生的一次性影響, 與上一年 的相應期相比,於2019年確立的許可。 營銷和銷售費用 截至2023年9月30日和2022年9月30日的三個月,營銷和銷售費用分別為1.705億瑞典克朗 和1.161億瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中, 的營銷和銷售費用 分別為5.292億瑞典克朗和3.233億瑞典克朗。 截至2023年9月30日的三個月中增加了5,440萬瑞典克朗,在截至2023年9月30日的九個月中, 增加了2.059億瑞典克朗,這主要與TARPEYO在美國的銷售和營銷成本 有關,與去年同期相比,美國的營銷 活動得到加強,銷售隊伍也增加了 。 管理費用 在截至2023年9月30日和 2022年9月30日的三個月中,管理費用分別為8,860萬瑞典克朗和7,100萬瑞典克朗。在截至2023年9月30日的九個月中, 和2022年9月30日,管理費用分別為2.384億瑞典克朗和1.784億瑞典克朗。截至2023年9月30日的三個月, 1760萬瑞典克朗的增長, 在截至2023年9月30日的九個月中增加5,990萬瑞典克朗, 主要與組織規模擴大和 監管要求提高所導致的增長有關。 截至2023年9月30日和2022年9月30日的三個月中, 其他營業收入/支出,淨額 其他營業收入/(支出),分別為(20萬瑞典克朗)和(190萬瑞典克朗)。在截至2023年9月30日和2022年9月30日的九個月中, 其他營業收入/ (支出),淨額分別為3,110萬瑞典克朗和(670萬瑞典克朗), 。這兩個時期的增長主要歸因於 與經營應收賬款 和負債相關的匯率變動。 截至2023年9月30日和2022年9月30日的三個月,淨財務收入/(支出)分別為(450萬瑞典克朗) 和2,030萬瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中, 淨財務收入/ (支出)分別為(2,790萬瑞典克朗)和3,500萬瑞典克朗, 。在截至2023年9月30日的三個月中, 減少了2480萬瑞典克朗, 在截至2023年9月30日的九個月中減少了6,290萬瑞典克朗,這主要源於 與借款相關的利息支出和 貨幣影響。 |
| 16 Calliditas Therapeutics | 第三季度中期報告:2023年1月至9月財務概覽 税收 截至2023年9月30日和2022年9月30日的三個月,總税收收入/(支出)分別為(430萬瑞典克朗)和 690萬瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中,總税收收入/(支出)分別為 至(510萬瑞典克朗)和1,090萬瑞典克朗。 這兩個時期的税收支出增加的主要原因是 美國子公司的應納税利潤。集團結轉的税收損失 未被確認為遞延所得税資產, 除非此類税收損失可用於抵消 臨時差額。 期內業績 在截至2023年9月30日和2022年9月30日的三個月中, 的虧損分別為1.684億瑞典克朗和910萬瑞典克朗, 攤薄前後的相應每股虧損分別為3.14瑞典克朗和0.17瑞典克朗。 截至2023年9月30日和2022年9月30日的九個月中,虧損 為4.478億瑞典克朗和4.086億瑞典克朗, 攤薄前後的相應每股虧損分別為8.34瑞典克朗和7.72瑞典克朗。 現金流和現金狀況 截至2023年9月30日和2022年9月30日的三個月,用於經營活動的現金流分別為6,250萬瑞典克朗和1.247億瑞典克朗,與上年相比的改善是由於 營運資金增加所解釋的。在截至2023年9月30日和2022年9月30日的九個月中,用於經營活動的現金流分別為 4.575億瑞典克朗和5.414億瑞典克朗, 的改善主要是由美國TARPEYO® 銷售增長推動的經營 業績增長所致,而 強勁的營運資金產生了積極影響。 截至2023年9月30日和2022年9月30日的三個月,用於投資活動的現金流分別為740萬瑞典克朗和90萬瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月 個月中, 用於投資活動的現金流分別為1140萬瑞典克朗和370萬瑞典克朗。 這兩個時期的增長主要是由購置設備來解釋的。 截至2023年9月30日和2022年9月30日的三個月,用於融資活動的現金流分別為290萬瑞典克朗和260萬瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月 個月中,來自 融資活動的現金流分別為(890萬瑞典克朗)和2.934億瑞典克朗。同期的下降主要是 歸因於前幾年使用了2.365億瑞典克朗的外部貸款 工具。 截至2023年9月30日和2022年9月30日的三個月, 現金淨減少分別為7,280萬瑞典克朗和 1.282億瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中,現金淨減少分別為4.778億瑞典克朗和2.517億瑞典克朗。截至2023年9月30日和2022年9月30日,現金 分別為7.869億瑞典克朗和7.362億瑞典克朗。 人員 在截至2023年9月30日和2022年9月30日的 三個月中,平均員工人數分別為179人和92人,在截至2023年9月30日和2022年9月30日的九個月中,平均員工人數分別為174和81人。 截至2023年9月30日和2022年9月30日,股東 權益和股票數量的變化 歸屬於母公司股東的權益 分別為3.524億瑞典克朗和7.259億瑞典克朗。截至2023年9月30日和2022年9月30日的 , 的註冊股票數量分別為59,580,087股和59,157,587股。 國庫股 截至2023年9月30日,Calliditas擁有母公司作為庫存股持有的5,908,018股普通 股。在2023年的 年度股東大會上, Calliditas獲得授權,可以轉讓(出售)這些普通股,用於 收購業務、獲得 資本來資助項目開發、償還 貸款或將Calliditas的產品商業化。有關 的更多信息,請參見注釋 7。 激勵計劃 在截至2023年9月30日的三個月中,已為2023年ESOP計劃分配了96.5萬份期權。有關 有關激勵計劃的更多信息,請參閲註釋 9。 2023年展望 Calliditas預計2023年美國的收入將增長,其中: 截至2023年12月31日的財年,TARPEYO的淨銷售額估計為1億至1.2億美元(按瑞典克朗/美元的平均匯率10.47瑞典克朗/美元匯率計算, 約為10.47億瑞典克朗)。 母公司 截至2023年9月30日和2022年9月30日的三個月,母公司Calliditas Therapeutics AB的淨銷售額分別為1.944億瑞典克朗和2.196億瑞典克朗 , 。在截至2023年9月30日和2022年9月30日的九個月中,淨銷售額分別為4.684億瑞典克朗和2.518億瑞典克朗。截至2023年9月30日的三個月 與去年同期相比, 的下降是指Kinpeygo在歐洲商業化 產生的里程碑費用,總額為1.35億瑞典克朗。 此外,在截至2022年9月30日的九個月中, 里程碑費用為1.638億瑞典克朗。 截至2023年9月 30日的九個月中,淨銷售額的增長主要來自於TARPEYO與去年同期相比 的銷售額。截至2023年9月30日和2022年9月30日的三個 個月中,營業虧損 分別為1.041億瑞典克朗和4,740萬瑞典克朗。 截至2023年9月30日和2022年9月30日的九個月營業虧損分別為2.689億瑞典克朗和3.021億瑞典克朗, 。 |
| 17 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月重大事件 財務評論 2023 年 7 月 1 日至 9 月 30 日期間的重大事件 • 7 月 13 日,Calliditas 公佈了 使用先導氮氧化物抑制劑 候選體 setanaxib 的 頭頸癌試驗的支持性中期數據。 • 8月15日,Calliditas公佈了發表在《柳葉刀》上的NefiGard 3期試驗的完整結果。 • 8月18日,美國食品藥品管理局批准對用於治療IgA腎病的 TARPEYO® 進行優先審查。 • 9月27日,Calliditas授予美國食品藥品管理局 頒發的孤兒藥稱號,用於使用setanaxib治療阿爾波特綜合症。 • 9月28日,STADA和Calliditas宣佈申請Kinpeygo® 在歐盟的 全面上市許可。 • 9月29日,Calliditas在2023年東京第17屆IgA 腎病國際研討會(iiGann)上公佈了來自NefiGard 3期試驗的數據。 期後的重大事件 • 10月3日,Calliditas宣佈向英國衞生和健康管理局申請治療IgA腎病的 Kinpeygo。 • 10月5日,歐洲藥品管理局孤兒藥品委員會 對 Calliditas在阿爾波特綜合徵中申請setanaxib給予了積極評價。 • 10月23日,卡利迪塔斯宣佈任命2024年股東周年大會提名委員會 。提名委員會 由Stiftelsen Industri-Fonden任命的帕特里克·索博基、由Linc AB任命的卡爾·託比森、由BVF任命的 任命的斯派克·洛伊和埃爾瑪·施內(董事會主席)組成。 • 10月27日 Calliditas宣佈,其商業合作伙伴 Everest Medicines 已獲得中國澳門特別行政區 地區藥品 管理局的批准。 執行管理層 Calliditas Therapeutics AB的執行管理層包括:首席執行官蕾妮·阿吉亞爾-盧坎德、首席財務官弗雷德裏克 約翰遜、首席營銷官理查德·菲利普森、集團總法律顧問 喬納森·舒爾、北美總裁安德魯·烏德爾、監管事務副總裁弗蘭克·布林斯特魯普和 人力資源主管桑德拉·弗裏西奧夫。 股息 未來的任何股息及其規模將根據Calliditas的長期增長、收益趨勢和資本要求確定 。在公司產生長期 可持續利潤和正現金流之前,董事會不打算 提議任何股息。 在2022財年沒有支付股息。 |
| 18 Calliditas Therapeutics | 第三季度中期報告:2023 年 1 月至 9 月財務評論 評論 這份中期報告未經該 公司審計師的審查。 斯德哥爾摩 2023 年 11 月 7 日 Renée Aguiar-Lucander 截至 2023 年 9 月,十大股東% BVF Partners LP 10.51 Linc Ab 10.01 Stiftelsen Industrifonden 5.28 Avanza Pension 3.81 Handelsbanken Fonder 3.19 Unionen 3.02 Polar Capital 2.94 Sofinnova Partners 2.36 Invus Group 1.79 Sub-十大股東共計 46.38 股國庫股 9.92 其他股東 43.70 合計 100.00 年年度股東大會 2024 年年度股東大會 2024 年年度股東大會將於 2024 年 5 月在瑞典斯德哥爾摩 舉行。前幾屆股東周年大會 的所有文件均發佈在公司網站上,網址為 https://www.callid-itas.se/en/governance/general-meeting/general-meetings/ Nomination 委員會2024年股東大會任命 2023年10月,Calliditas宣佈,該公司的 主要所有者已任命了2024年 年度股東大會的提名委員會。提名委員會根據 2017 年 股東特別大會通過的原則在 任命,包括:Stiftelsen Industrifonden 任命的 Patrick Sobocki、Linc AB 任命的卡爾·託比森、BVF 任命的 Spike Loy 和埃爾瑪·施內(董事會主席 )。希望向2024年年度股東大會 提名委員會提交 提案的股東可以通過發送電子郵件至 finance@calliditas.com 提交。 提案應在2024年3月15日之前提交給提名委員會 。 The Share 截至2023年9月30日,普通股數量為 59,580,087股,其中5,908,018股作為 庫存股由母公司持有。截至2023年9月29日, ,Calliditas Therapeutics股票 CALTX的收盤價為97.5瑞典克朗。截至2023年9月30日 ,股東總數約為15,000人。 股東結構 |
| 19 Calliditas Therapeutics | 中期報告第三季度:2023年1月至9月向投資者、分析師和媒體介紹情況 欲瞭解更多信息 請聯繫 即將舉行的活動 • Calliditas邀請投資者、分析師和媒體於11月7日下午14點30分參加 2023年季度報告的發佈會。該報告將在當天上午 7:00 發佈。 • Calliditas首席執行官蕾妮·阿吉亞爾-盧坎德將與首席財務官弗雷德裏克·約翰遜、首席營銷官理查德·菲利普森和北美總裁 安德魯·烏德爾一起提交報告。演講將以 英語進行。 • 時間:美國中部時間11月7日星期二下午 14:30。 • 網絡直播鏈接 https://financialhearings.com/event/46414 • 要通過此鏈接通過電話會議註冊參與會議: https://conference.financialhearings.com/teleconference/?id=2001082 註冊後,您將收到一個電話號碼和一個用於登錄電話會議的會議 ID。通過電話會議, 有機會提出口頭問題。 2024 年 2 月 22 日年終報告,2023 年第四季度 2023 年 1 月至 12 月 2023 年年度報告將於 2024 年 4 月以數字形式發佈 2024 年 5 月 16 日中期報告,2024 年 1 月至 3 月 Renée Aguiar-Lucander /首席執行官 +46 (0) 764 03 35 43 asa.hillsten@calliditas.com 補充信息 本中期報告未經公司審計師審查或審計。renee.lucander@calliditas.com 根據 《歐盟市場濫用條例》,臨時報告中的信息是Calliditas有義務公開的信息。該信息已於歐洲中部時間 2023 年 11 月 7 日上午 7:00 通過上述 聯繫人機構發送以供發佈。 註冊辦公室 Calliditas Therapeutics AB Kungsbron 1 SE 111 22 瑞典斯德哥爾摩 calliditas.com/ ir@calliditas.com 前瞻性陳述 本中期報告包含經修訂的1995年《私人證券訴訟改革法》所指的前瞻性陳述,包括但不限於有關Calliditas戰略、業務計劃、收入和其他財務預測的陳述,以及焦點。“可能”、 “將”、“可能”、“將”、“應該”、“期望”、“計劃”、“預期”、“打算”、“相信”、“估計”、“預測”、“項目”、“潛力”、“繼續”、“目標” 等詞語旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別性詞語。 本中期報告中的任何前瞻性陳述均基於管理層當前的預期和信念,受許多風險、 不確定性和重要因素的影響,這些因素可能導致實際事件或結果與本中期報告中包含的任何前瞻性 陳述所表達或暗示的存在重大差異,包括但不限於與Calliditas的業務、運營、TARPEYO 和Kinpeygo臨牀商業化有關的任何前瞻性陳述,試驗、供應鏈、戰略、目標和預期時間表開發和潛在批准、來自其他 家生物製藥公司的競爭、收入和產品銷售預測或預測,包括TARPEYO指南和現金跑道的2023年淨銷售額,以及 Calliditas向美國證券交易委員會提交的報告中標題為 “風險因素” 的部分中確定的其他風險。 Calliditas提醒您不要過分依賴任何前瞻性陳述,這些陳述僅代表其發表之日。Calliditas聲明, 沒有義務公開更新或修改任何此類陳述,以反映 任何此類陳述所依據的預期或事件、條件或情況的任何變化,或者可能影響實際結果與前瞻性陳述中列出的結果不同的可能性的任何變化。 本中期報告中包含的任何前瞻性陳述僅代表Calliditas截至本文件發佈之日的觀點,不應將其視為 代表其在隨後任何日期的觀點。 本中期報告以瑞典語原件編寫,並已翻譯成英文。如果兩者之間存在差異,則應適用瑞典語 版本。 |
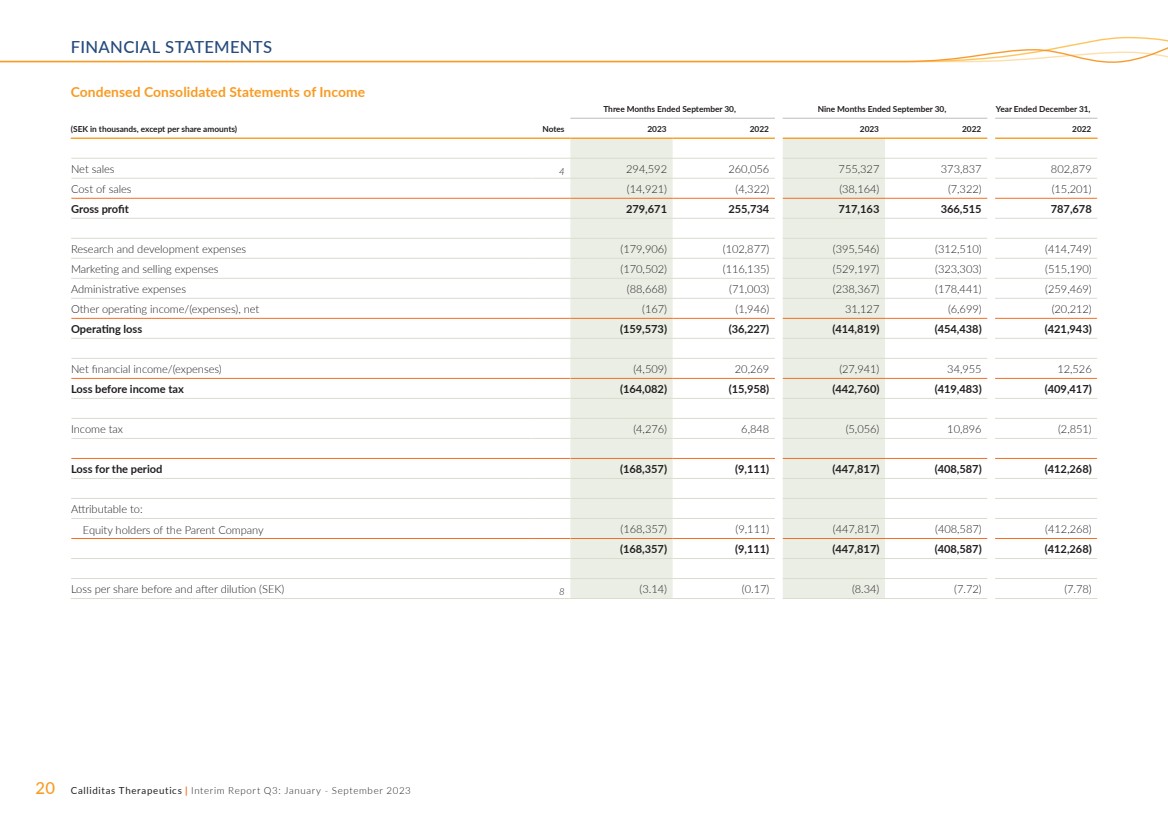
| 20 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月財務報表 截至9月30日的三個月,截至9月30日的九個月, (以千瑞典克朗計,每股金額除外)票據 2023 2023 2022 2022 年淨銷售額 4 294,592 260,056 755,327 373,837 802,879 銷售成本 (142,879 921) (4,322) (38,164) (7,322) (15,201) 毛利 279,671 255,734 717,163 366,515 787,678 研發費用 (179,906) (102,877) (395,546) (312,510) (414,749) 營銷和銷售費用 (170,502) (116,135) (529,197) (323,303) (515,190) 管理費用 (88,668) (71,003) (238,367) (178,441) (259,469) 其他營業收入/(支出),淨額(167)(1,946)31,127 (6,699) (20,212) 營業虧損 (159,573) (36,227) (414,819) (454,438) (421,943) 淨財務收入/(支出)(4,509) 20,269 (27,941) 34,955 12,526 所得税前虧損 (164,082) (15,958) (442,958) (442,958) 760) (419,483) (409,417) 所得税 (4,276) 6,848 (5,056) 10,896 (2,851) 該期間的虧損 (168,357) (9,111) (447,817) (408,587) (412,268) 歸屬於: 母公司股權持有人(168,357)(9,111)(447,817)(408,587)(412,268) (168,357)(9,111)(447,817)(408,587)(412,268) 攤薄前後的每股虧損(瑞典克朗)8(3.14) (0.17) (8.34) (7.72) (7.78) |
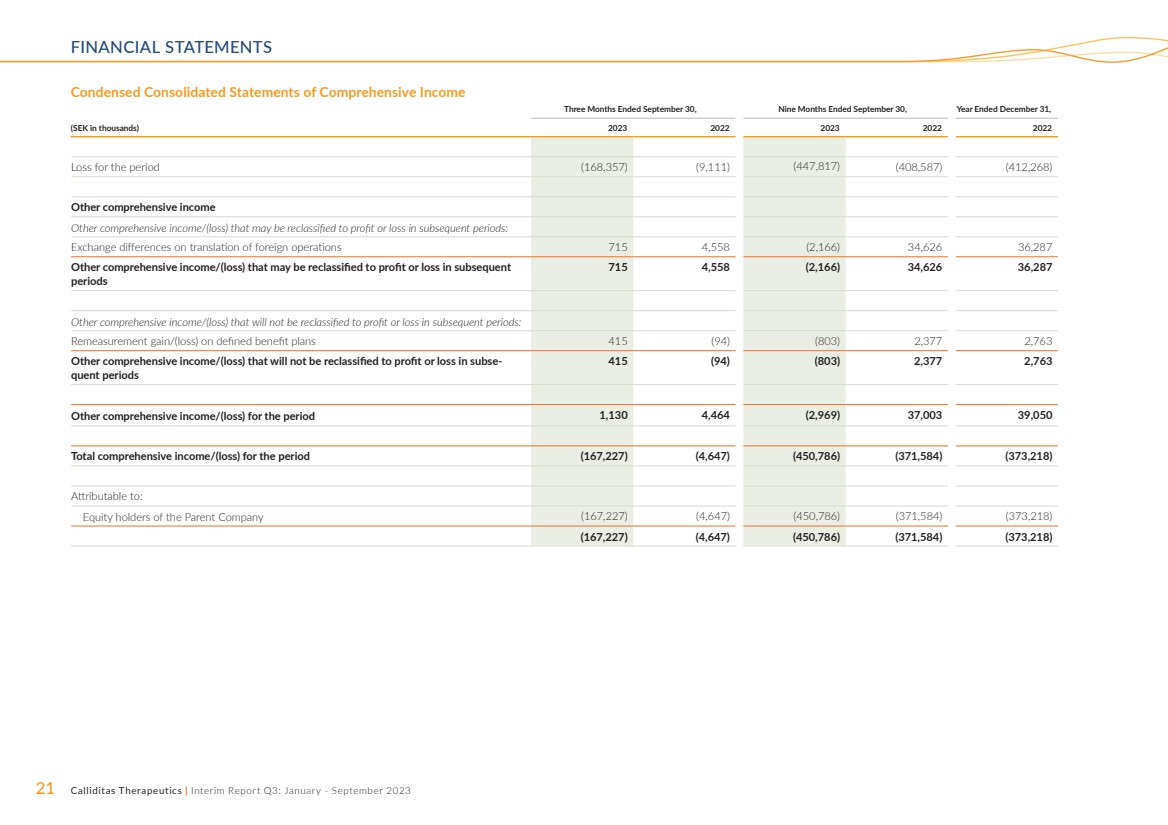
| 21 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月財務報表 截至9月30日的三個月,截至9月30日的九個月, (千瑞典克朗)2023 2023 2022 年期間虧損(168,357)(9,111)(447,817)(408,587)(412,268) 其他綜合收益 其他可能在後續時期重新歸類為損益的綜合收益/(虧損): 國外業務折算匯兑差額 715 4,558 (2,166) 34,626 36,287 可能在隨後 期內重新歸類為損益的其他綜合收益/(虧損) 715 4,558(2,166)34,626 36,287 其他不會在後續時期重新歸類為損益的綜合收益/(虧損): 重新計量固定福利計劃的收益/(虧損)415 (94) (803) 2,377 2,763 在後續時期內不會重新歸類為損益的其他綜合收益/(虧損) 415 (94) (803) 2,377 2,763 期間其他綜合收益/(虧損)1,130 4,464(2,969)37,003 39,050 合計該期間的綜合收益/(虧損)(167,227)(4,647)(450,786)(371,584)(373,218) 歸屬於於: 母公司股權持有人(167,227)(4,647)(450,786)(371,584) (167,227)(4,647)(45047)786) (371,584) (373,218) |
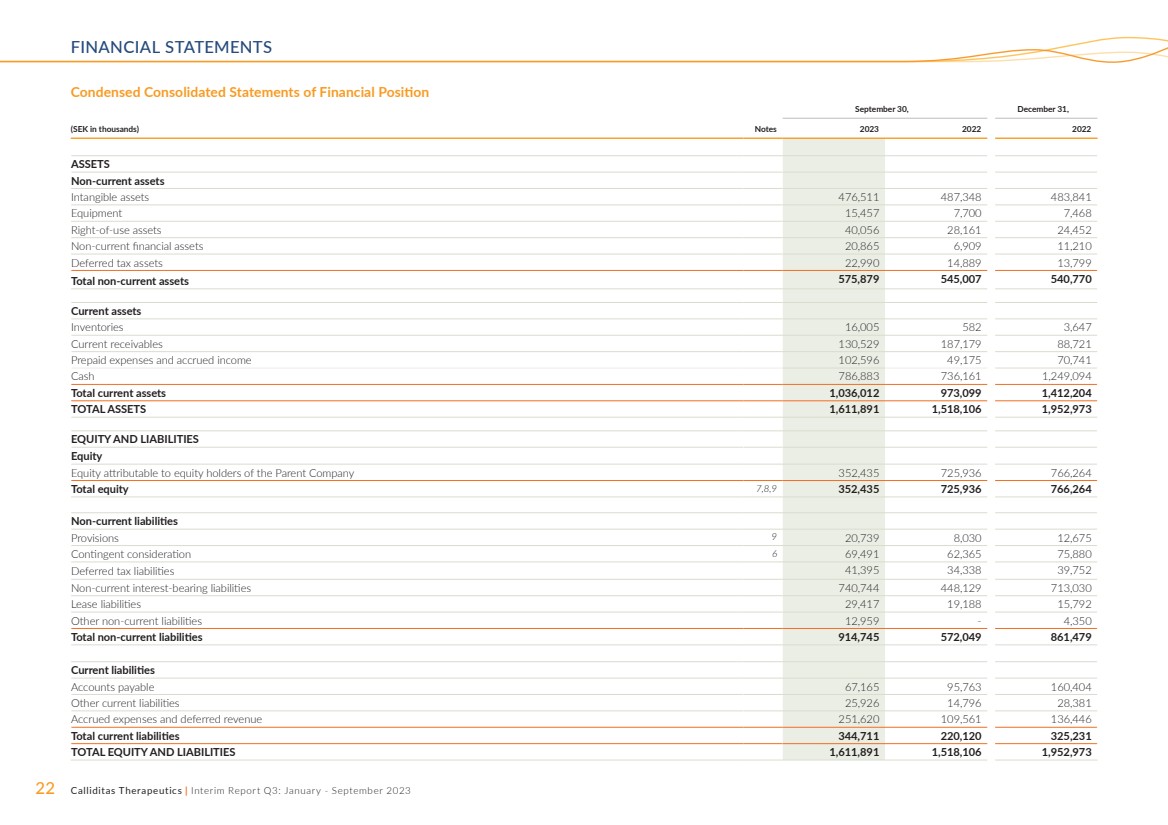
| 22 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月財務報表 ,12 月 31 日, (以千瑞典克朗計)票據 2023 2022 年資產 非流動資產 無形資產 47,511 483,841 設備 15,457 7,700 7,468 使用權資產 40,056 28,161 24,852 非流動金融資產 20,8452 65 6,909 11,210 遞延所得税資產 22,990 14,889 13,799 非流動資產總額 575,879 545,007 540,770 流動資產 庫存 16,005 582 3,647 當前應收賬款 130,529 187,179 88,721 預付費用和應計費用收入 102,596 49,175 70,741 現金 786,883 736,161 1,249,094 流動資產總額 1,036,012 973,099 1,412,204 總資產 1,611,891 1,518,106 1,952,973 權益和負債 權益 歸屬於母公司股東的權益 352,435 725,936 766,264 總權益 7,8,9 352,435 725,936 766,264 非流動負債 準備金 9 20,739 8,030 12,675 或有對價 6 69,491 62,365 75,880 遞延所得税負債 41,395 34,338 39,752 非流動計息負債 740,744 448,030 租賃負債 29,417 19,188 15,792 其他非流動負債 12,959-4,350 非流動負債總額 914,745 572,049 861,479 流動負債 應付賬款 67,165 95,763 160,404 其他流動負債 25,926 14,796 28,381 應計費用和遞延收入 251,620 109,561 136,446 流動負債總額 344,711 220,120 325,231 總權益和負債 1,611,891 1,518,106 1,952,973 簡明合併財務狀況表 |
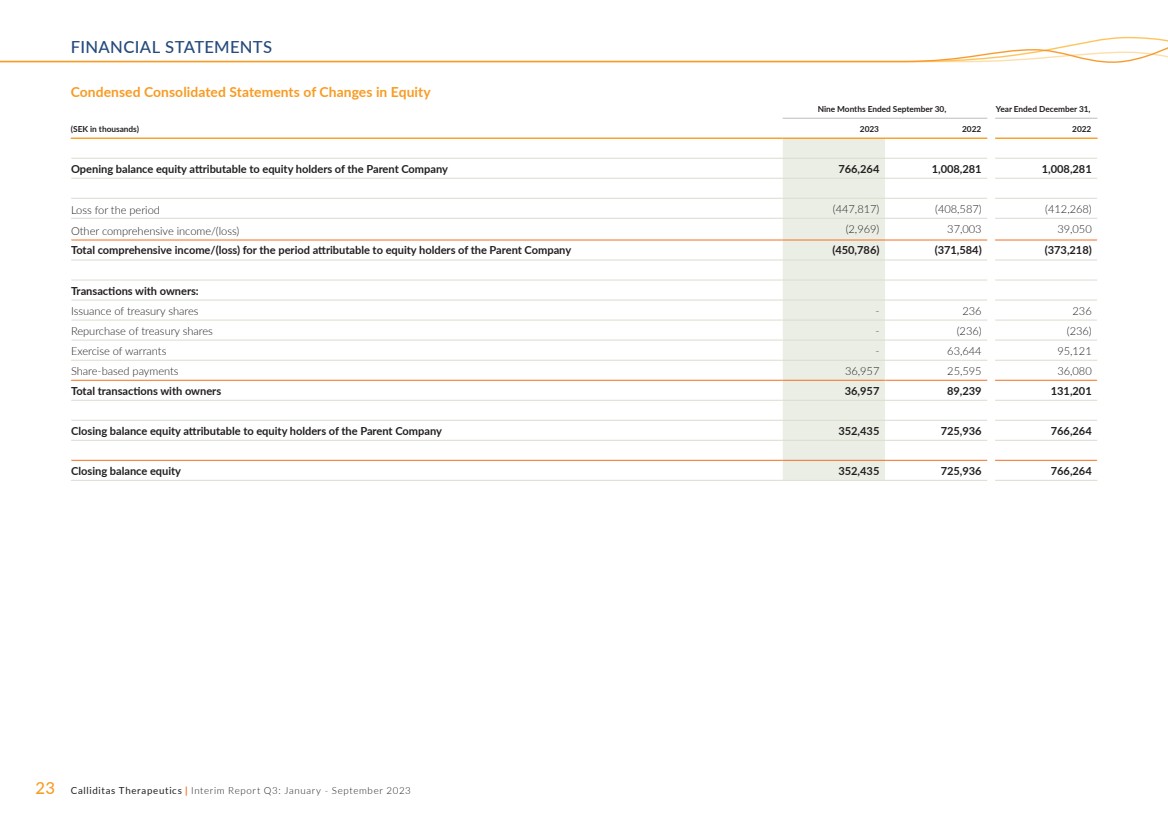
| 23 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月財務報表 簡明合併權益變動表 截至9月30日的九個月, (千瑞典克朗)2022 年期初餘額歸屬於母公司股東的權益 766,264 1,008,281 1,008,281 期內虧損(447,817)(408,587)(412,268) 其他綜合收益/(虧損)(2,969)37,003 39,050 本期歸屬於母公司股東的綜合收益/(虧損)總額(450,786) (371,584) (373,218) 與所有者的交易: 發行庫存股-236 236 回購庫存股-(236) (236) 行使認股權證-63,644 95,121 基於股份的支付 36,957 25,595 36,080 與所有者的交易總額 36,957 89,239 131,201 期末餘額權益歸屬於權益母公司持有人 352,435 725,936 766,264 期末餘額權益 352,435 725,936 766,264 |
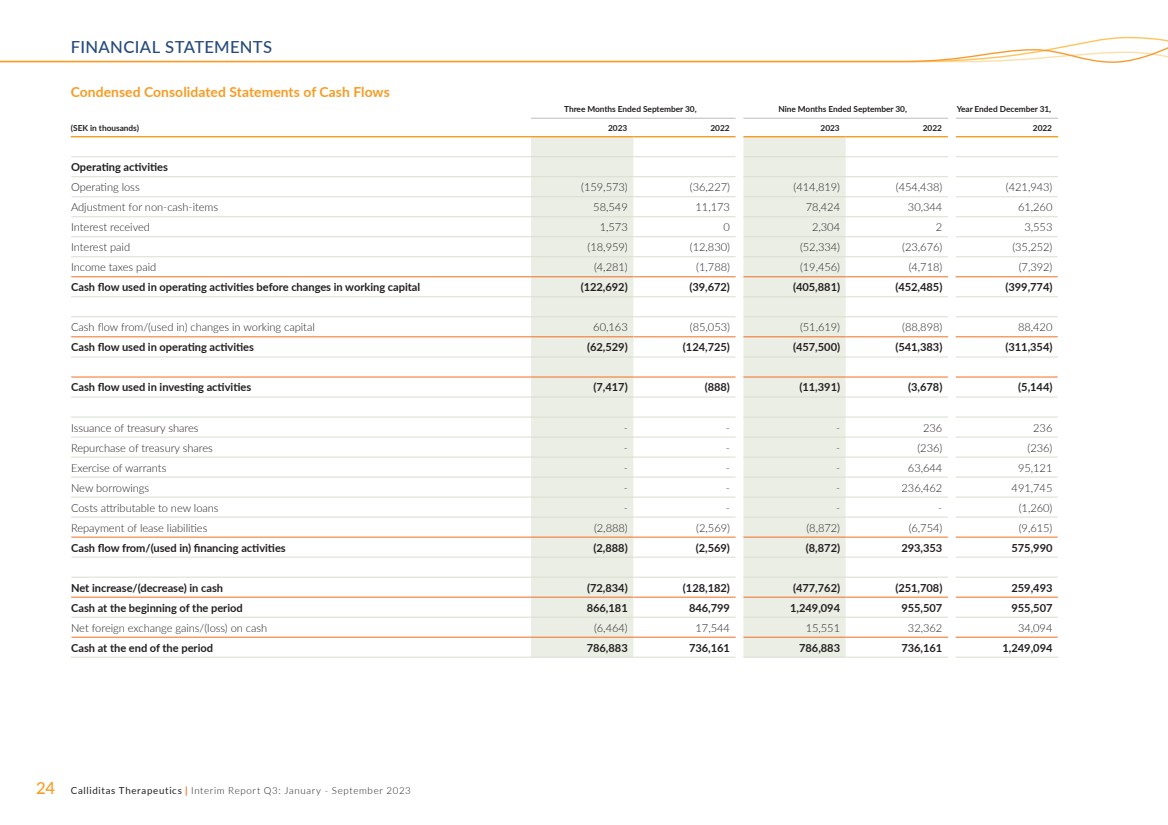
| 24 Calliditas Therapeutics | 中期報告第三季度:2023年1月至9月財務報表 截至9月30日的三個月,截至9月30日的九個月, (千瑞典克朗)2023 2023 2022 2022 年經營活動 營業虧損 (159,573) (36,227) (414,819) (454,438) (421,943) 非現金調整 h-items 58,549 11,173 78,424 30,344 61,260 已收利息 1,573 0 2,304 2 3,553 已付利息 (18,959) (12,830) (52,334) (23,676) (35,252) 已繳所得税 (4,281) (1,788) (19,456) (4,718) (7,392) 現金流用於營運資金變動前的經營活動 (122,692) (39,672) (405,881) (452,485) (399,774) 來自/(用於)營運資金變動的現金流 60,163(85,053)(51,619)(88,898)88,420 用於經營活動的現金流(62,529)(124,725)(457,500) (541,383) (311,354) 用於投資活動的現金流 (7,417) (888) (11,391) (3,678) (5,144) 發行庫存股---236 236 回購庫存股---(236) (236) 行使認股權證---63,644 95,121 新借款--236,462 491,745 可歸於新借款的成本貸款----(1,260) 償還租賃負債(2,888)(2,569)(8,872)(6,754)(9,615) 來自/(用於)融資活動的現金流(2,888)(2,569)(8,872)293,353 575,990 現金淨增加/(減少)(72,834)(128,1834)(128,1834)(128,1834)82) (477,762) (251,708) 259,493 期初現金 866,181 846,799 1,249,094 955,507 955,507 現金淨外匯收益/(虧損)(6,464)17,544 15,551 32,362 34,094 期末現金 786,883 736,161 786,886,888 3 736,161 1,249,094 簡明合併現金流量表 |
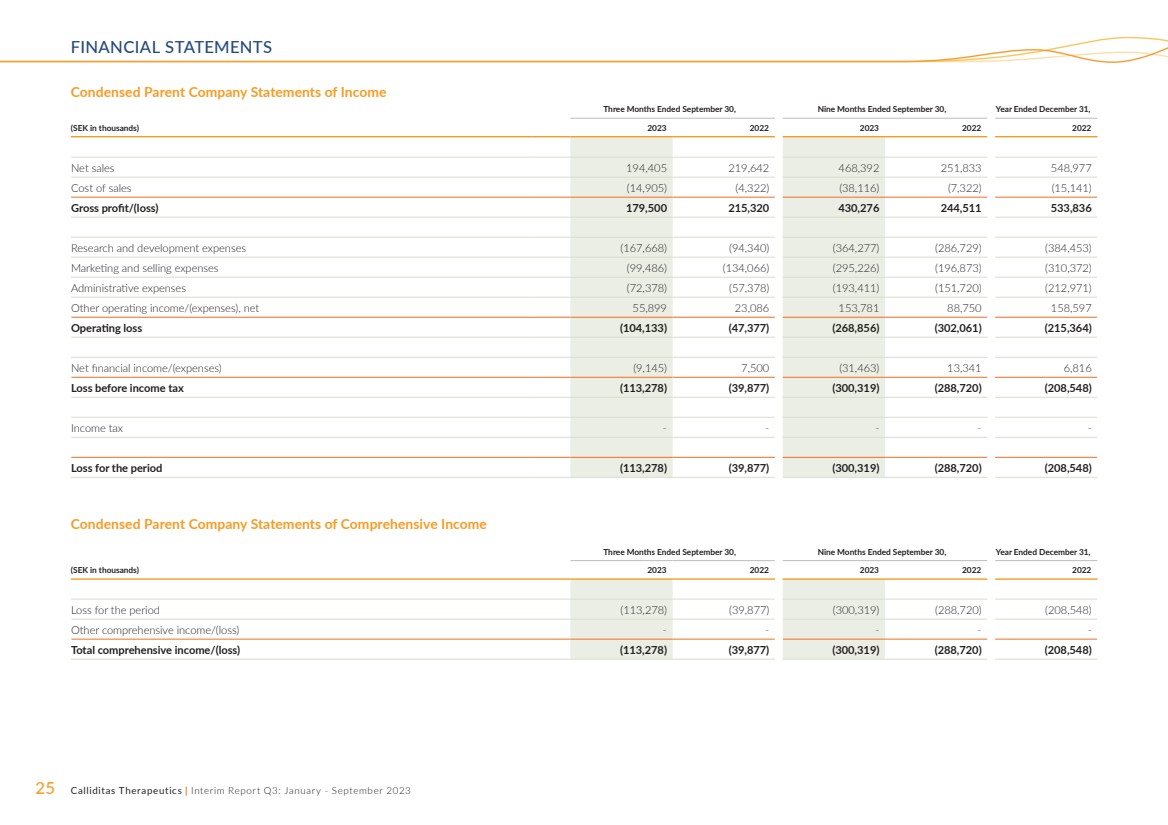
| 25 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月簡明母公司損益表 截至9月30日的三個月,截至9月30日的九個月, (千瑞典克朗)2023 2023 2022 年淨銷售額 194,405 219,642 468,392 251,833 548,977 銷售成本 (14,905) (4,905) (4,905) 322) (38,116) (7,322) (15,141) 毛利潤/(虧損)179,500 215,320 430,276 244,511 533,836 研發費用(167,668)(94,340)(364,277)(286,729)(384,453) 營銷和銷售費用 (99,486) (134,066) (295,226) (196,873) (310,372) 管理費用 (72,378) (57,378) (193,411) (151,720) (212,971) 其他營業收入/(支出),淨額 55,899 23,086 153,781 88,597 營業虧損 (104,133) (47,377) (268,856) (302,061) (215,364) 淨財務收入/(支出)(9,145) 7,500 (31,463) 13,341 6,816 所得税前虧損 (113,278) (39,877) (300,319) (288,720) (208,720) (20 8,548) 所得税---- 該期間的虧損 (113,278) (39,877) (300,319) (288,720) (208,548) 截至9月30日的三個月,截至9月的九個月30,截至12月31日的財年, (千瑞典克朗)2023 年 2022 年 2022 年 2022 年期間虧損(113,278)(39,877)(300,319)(288,720)(208,548) 其他綜合收益/(虧損)---- 總綜合收益/(虧損)(113,278)(39,877)(300,319) (288,720) (208,548) 簡明母公司綜合收益表 |
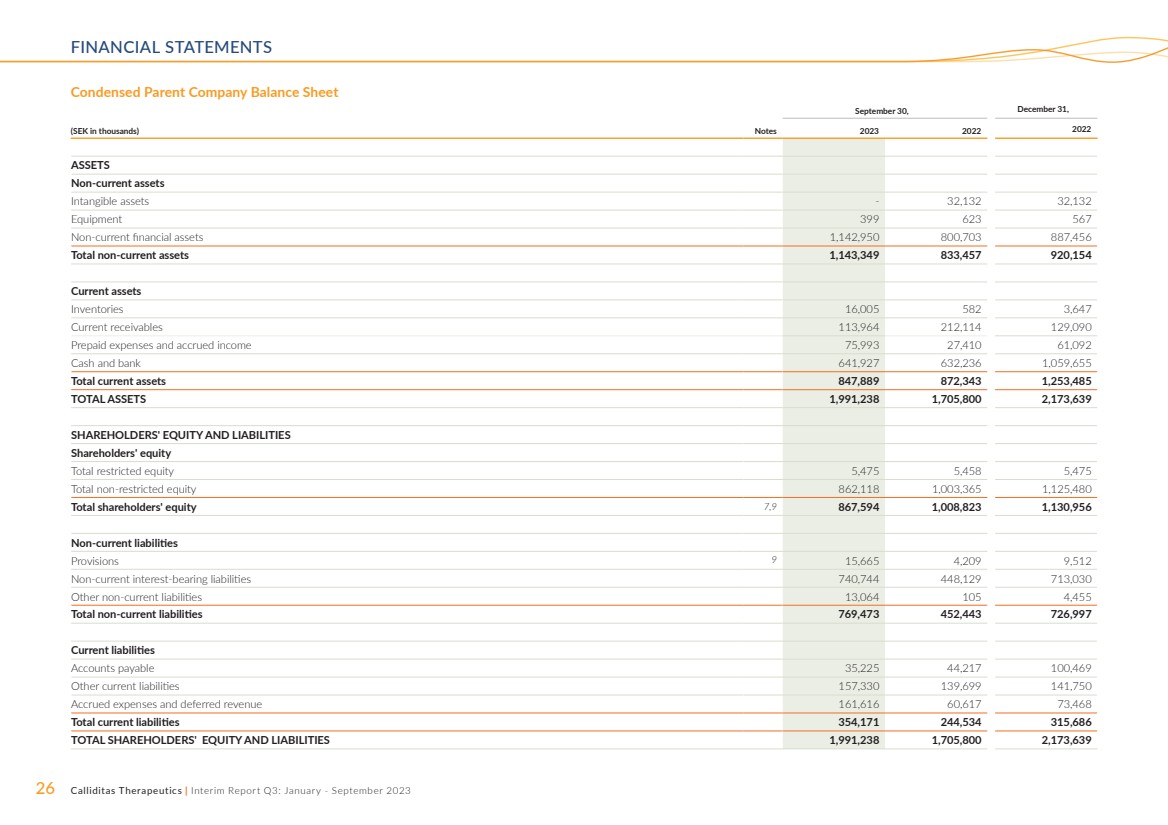
| 26 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月財務報表 簡明母公司資產負債表 ,12 月 31 日, (千瑞典克朗)票據 2023 2022 年資產 非流動資產 無形資產-32,132 32,132 設備 399 623 567 非流動金融資產 1,142,950 800,703 887,456 非流動資產總額 1,143,349 833,457 920,154 流動資產 庫存 16,005 582 3,647 當前應收賬款 113,964 212,114 129,090 預付費用和應計收入 75,993 27,410 61,092 現金和銀行 64,927 632,236 1,059,655 流動資產總額 847,889 872,343 1,253,485 總資產 1,991,238 1,705,800 2,173,639 股東權益和負債 限制性權益總額 5,475 5,458 5,475 非限制性權益總額 862,118 1,003,365 1,125,480 股東權益總額 7,480 9 867,594 1,008,823 1,130,956 非流動負債 準備金 9 15,665 4,209 9,512 非流動計息負債 740,744 448,029 713,030 其他非流動負債 13,064 105 4,455 非流動負債總額 769,473 452,443 726,997 當前負債 應付賬款 35,225 44,217 100,469 其他流動負債 157,330 139,699 141,750 應計費用和遞延收入 161,616 60,617 73,468 流動負債總額 354,173,4639 244,534 315,686 股東權益和負債總額 1,991,238 1,705,639 |
| 27 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 NOTES 註釋1-業務描述 Calliditas Therapeutics AB(publ)(“Calliditas” 或 “母公司”),公司註冊號 556659-9766,及其子公司(統稱 “集團”)在藥品領域開展商業和 開發活動。這些中期簡明合併財務報表涵蓋了截至2023年9月30日和2022年9月30日的九 個月的集團及其子公司,總部設在瑞典斯德哥爾摩。 Calliditas 是一家瑞典公共有限公司,註冊於 斯德哥爾摩,註冊辦事處位於 。公司總部的註冊地址為瑞典斯德哥爾摩 Kungsbron 1, D5。Calliditas在美國納斯達克的中型股板塊上市,股票代碼為 “CALTX”, 以ADS的形式在美國納斯達克全球精選市場上市,股票代碼為 “CALT”。 這些中期簡明合併財務報表已經 董事會(“董事會”)批准,將於2023年11月7日發佈。 該報告可能包含前瞻性陳述。實際結果可能與 所説的有所不同。研究項目的成功管理和知識產權 等內部因素可能會影響未來的結果。還有一些外部條件(例如經濟 氣候、政治變化和競爭性研究項目)可能會影響集團的業績。 附註2-會計政策 這些中期簡明合併財務報表根據 《國際會計準則》第34號(IAS 34)“中期財務報告” 編制。母公司 公司對法人實體適用瑞典財務報告委員會建議RFR2(會計 )。在編制中期簡明財務報表時採用的會計政策與編制2022年 年度報告時遵循的會計政策一致。自 2023 年 1 月 1 日起生效的新準則或經修訂的準則和解釋均未對集團的財務報告產生重大影響。 重要的會計原則可以在2022年年度報告的第49-54頁上找到。 適用ESMA(歐洲證券和市場管理局)關於替代關鍵績效比率的指導方針,這意味着對於 未按照《國際財務報告準則》定義的財務指標的披露要求。有關國際財務報告準則未定義的關鍵比率,請參閲第31頁的定義 和替代績效衡量標準的對賬。 注3-集團和母公司的風險和不確定性 運營風險 獲批註冊之前的研發和藥物開發面臨相當大的風險, 是一個資本密集型過程。由於技術風險,例如未能證明有效性或有利的風險/ 收益狀況或製造問題,所有已啟動的項目中的大多數將永遠無法進入市場註冊。競爭藥品可以佔據市場份額 或更快地進入市場,或者如果競爭研究項目獲得更好的產品概況,則產品組合的 未來價值可能低於預期。這些運營也可能受到監管決策的負面影響,例如缺乏批准和價格變動。 Calliditas擁有一款商業化產品,該產品已在美國 獲得加速批准,品牌名為TARPEYO,並已在歐盟和英國以Kinpeygo品牌獲得有條件的上市許可 。存在的風險是,商業化 無法按計劃進行,或者處方醫生的吸收率會比計劃差,或者 該藥物不會產生足夠的效果或出現不良副作用,這可能會對 的銷售產生負面影響。 “研發費用” 部分的 “財務概覽” 中描述了對財務報表的影響。 Financial Risks Calliditas 管理金融風險管理的財務政策由 董事會設計,代表了指導方針和規則框架,形式為風險 的規定和金融活動限制。集團主要受到外匯 風險的影響,因為Nefecon和setanaxib的開發成本主要以美元和歐元支付。 此外,集團持有以美元計的應收賬款以及以美元和歐元為單位的現金,以支付未來 與TARPEYO在美國的商業化以及 臨牀開發項目相關的預期成本(以美元和歐元計)。關於集團和母公司的財務風險 管理,與2022年年度 報告中的描述相比,風險基本保持不變。 有關運營和財務風險的更多信息和全面披露,請參閲 於 2023 年 4 月向美國證券交易委員會 提交的 2022 年年度報告和 20-F 表年度報告。 簡明合併財務報表附註 |
| 28 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 NOTES 附註 4-與客户簽訂合同的收入 9 月 30 日止三個月, 截止九個月 12 月 31 日, (以千瑞典克朗計)2023 2023 2022 年商品或服務類型 產品銷售額 284,992 125,045 2,563 206,634 375,515 產品外許可-135,011-163,816 421,689 特許權使用費收入 9,600-22,764-2,287 某些監管 服務的業績 --3,387 3,387 共計 294,592 260,056 755,327 373,837 802,879地理市場 美國 283,591 123,400 728,522 204,989 372,247 歐洲 11,001 136,656 26,805 140,044 143,955 亞洲--28,804 286,677 總計 294,592 260,056 755,327 373,837 802,879 該期間的淨銷售額主要來自塔佩約的淨銷售額在美國,截至2023年9月30日和 2022年9月30日的三個月中,金額分別為2.836億瑞典克朗和1.234億瑞典克朗。在截至2023年9月30日和2022年9月30日的九個月中, TARPEYO的淨銷售額分別為7.285億瑞典克朗和2.05億瑞典克朗。 我們在歐洲合作的特許權使用費收入在2023年第三季度為960萬瑞典克朗(-)萬瑞典克朗,2023年前九個月為2,280萬瑞典克朗。在截至2023年9月30日的三個月和九個月中,沒有發現任何里程碑。在截至2022年9月30日 的三個月中,淨銷售額為1.35億瑞典克朗,其中包括Kinpeygo在歐洲商業化產生的里程碑費用 。此外,在截至2022年9月 30日的九個月中,里程碑費用為1.638億瑞典克朗,其中包括有關 Everst Medicines 的里程碑費。 截至2023年9月30日和2022年9月30日,預期回報和回扣的總負債分別為4,410萬瑞典克朗和1,720萬瑞典克朗,在其他當前 負債以及應計費用和遞延收入中確認。 注5-關聯方交易 在本報告所述期間,沒有發生任何重大的關聯方交易。 有關激勵計劃的信息,請參閲註釋 9。 附註6——金融工具 集團的金融資產包括非流動金融資產、流動應收賬款和現金, 按攤餘成本確認。集團的金融負債包括或有 對價、非流動計息負債、其他非流動負債、租賃負債、 應付賬款、其他流動負債和應計費用,除或有 對價外,均按攤餘成本確認。賬面金額是 公允價值的近似值。 或有對價按公允價值確認,按國際財務報告準則價值層次結構的第三級衡量。或有對價是根據現值 方法計算的,並考慮了各種里程碑是否以及何時發生 的概率。計算基於 12.0% 的折扣率。影響或有對價估值的最重要輸入 是集團對實現里程碑概率 的估計。在截至2023年9月30日和2022年9月30日的三個月中, 的利潤/(虧損)分別為(180萬瑞典克朗)和(140萬瑞典克朗), 在截至2023年9月30日和2022年9月30日的九個月中, 的影響利潤/(虧損)分別為880萬瑞典克朗和(410萬瑞典克朗),計入其他 營業收入/(費用),淨額。這歸因於setanaxib平臺內PBC 項目的研究設計發生了變化。欲瞭解更多信息,請參閲 2022 年年度報告。 注7——國庫股 截至2023年9月30日,母公司 持有5,908,018股普通股作為庫存股。在2023年年度股東大會上,授權Calliditas 可以轉讓(出售)這些普通股,用於為收購業務提供資金, 籌集資金以資助項目開發、償還貸款或將 Calliditas的產品商業化。截至2023年9月30日,尚未發生庫存股的轉讓(出售)。 截至2023年9月30日的已發行股票總數列於附註8。 |
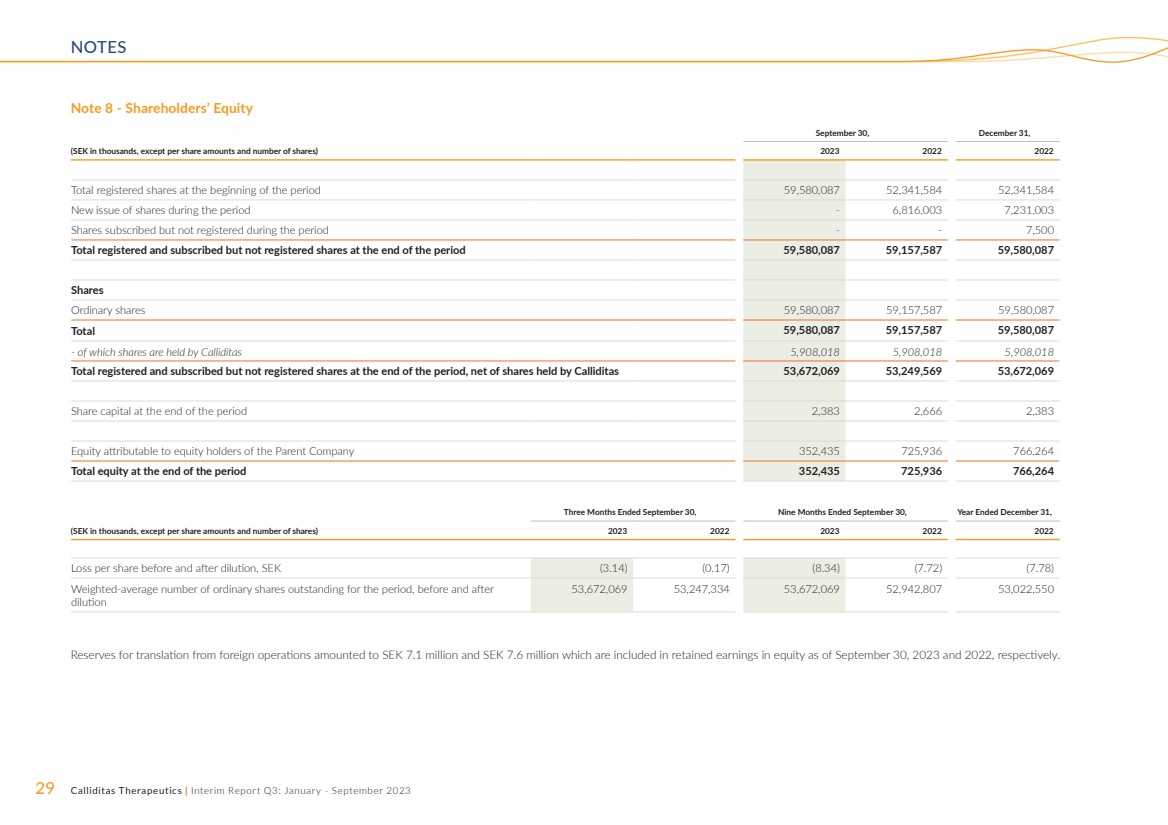
| 29 Calliditas Therapeutics | 中期報告第三季度:2023 年 1 月至 9 月 NOTES 注 8 — 股東權益 9 月 30 日,12 月 31 日, (以千瑞典克朗計,每股金額和股票數量除外)2023 2022 年期初註冊股票總數 59,580,087 52,341,584 股本期內新發行的股票——6,816161 在此期間已認購但未註冊的7,231,003股股票--7,500 股本期末已註冊和認購但未註冊的股票總數 59,580,087 59,157,587 59,580,087 股 普通股 59,580,087 59,157,587 59,580,087 共計 59,580,087 59,157,587 59,580,087-其中股份由卡利迪塔斯持有 5,908,018 5,908,018 期末已註冊和認購但未註冊的股份總數,扣除卡利迪塔斯持有的股份 53,67,67,087 2,069 53,249,569 53,672,069 期末股本 2,383 2,666 2,383 歸屬於母公司股東的權益 352,435 725,936 766,264 期末的總權益 352,435 725,936 766,264 截至9月30日的三個月,截至九個月9月30日,截至12月31日的財年, (以千瑞典克朗計,每股金額和股票數量除外)2023 2023 2022 2022 攤薄前後的每股虧損,瑞典克朗(3.14)(0.17)(8.34)(7.72)(7.78) 稀釋前後該期間已發行普通股的加權平均數 53,672,069 53,2469 7,334 53,672,069 52,942,807 53,022,550 來自國外業務的折算儲備金為710萬瑞典克朗和760萬瑞典克朗,分別包含在截至2023年9月30日和2022年9月30日的權益留存收益中。 |
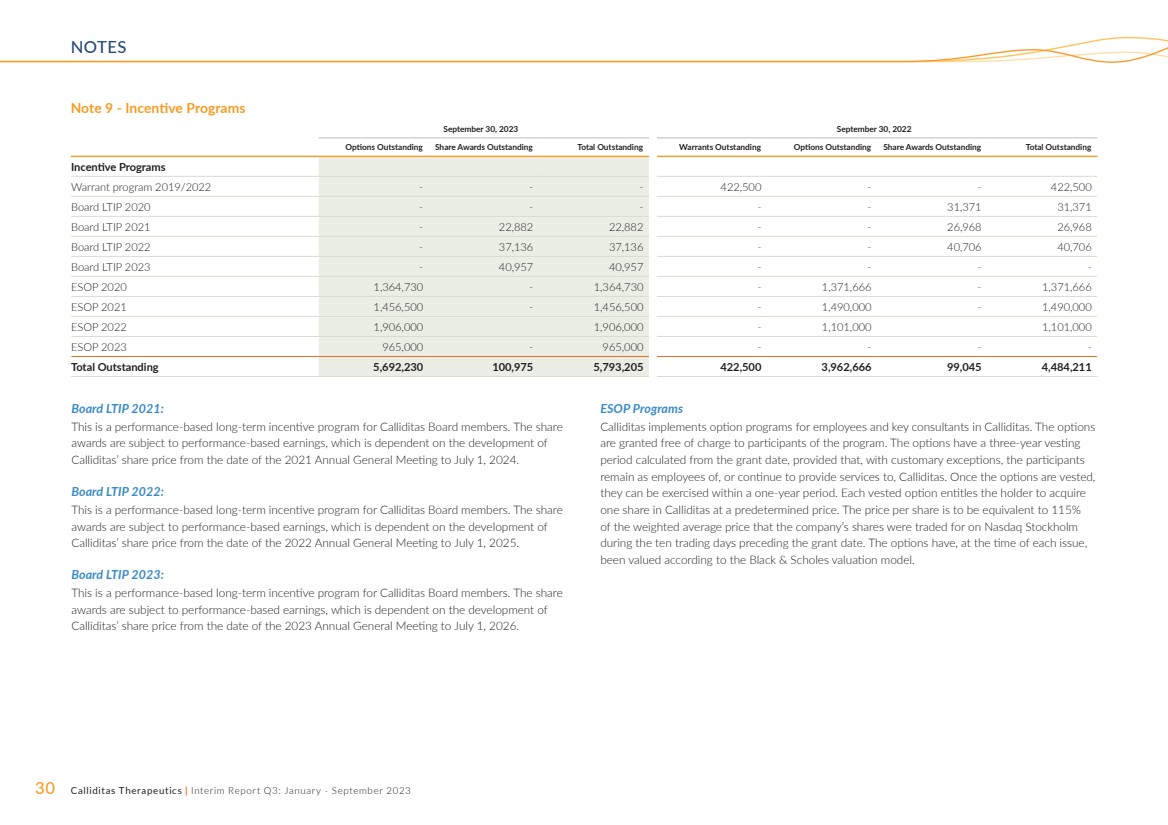
| 30 Calliditas Therapeutics | Interim Report Q3: January - September 2023 NOTES Note 9 - Incentive Programs Board LTIP 2021: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to performance-based earnings, which is dependent on the development of Calliditas’ share price from the date of the 2021 Annual General Meeting to July 1, 2024. Board LTIP 2022: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to performance-based earnings, which is dependent on the development of Calliditas’ share price from the date of the 2022 Annual General Meeting to July 1, 2025. Board LTIP 2023: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to performance-based earnings, which is dependent on the development of Calliditas’ share price from the date of the 2023 Annual General Meeting to July 1, 2026. ESOP Programs Calliditas implements option programs for employees and key consultants in Calliditas. The options are granted free of charge to participants of the program. The options have a three-year vesting period calculated from the grant date, provided that, with customary exceptions, the participants remain as employees of, or continue to provide services to, Calliditas. Once the options are vested, they can be exercised within a one-year period. Each vested option entitles the holder to acquire one share in Calliditas at a predetermined price. The price per share is to be equivalent to 115% of the weighted average price that the company’s shares were traded for on Nasdaq Stockholm during the ten trading days preceding the grant date. The options have, at the time of each issue, been valued according to the Black & Scholes valuation model. September 30, 2023 September 30, 2022 Options Outstanding Share Awards Outstanding Total Outstanding Warrants Outstanding Options Outstanding Share Awards Outstanding Total Outstanding Incentive Programs Warrant program 2019/2022 - - - 422,500 - - 422,500 Board LTIP 2020 - - - - - 31,371 31,371 Board LTIP 2021 - 22,882 22,882 - - 26,968 26,968 Board LTIP 2022 - 37,136 37,136 - - 40,706 40,706 Board LTIP 2023 - 40,957 40,957 - - - - ESOP 2020 1,364,730 - 1,364,730 - 1,371,666 - 1,371,666 ESOP 2021 1,456,500 - 1,456,500 - 1,490,000 - 1,490,000 ESOP 2022 1,906,000 1,906,000 - 1,101,000 1,101,000 ESOP 2023 965,000 - 965,000 - - - - Total Outstanding 5,692,230 100,975 5,793,205 422,500 3,962,666 99,045 4,484,211 |
| 31 Calliditas Therapeutics | Interim Report Q3: January - September 2023 NOTES Definitions and Reconciliations of Alternative Performance Measures Definitions of Alternative Performance Measures Alternative Key Performance Indicator Definitions Reason for Inclusion Equity ratio at the end of the period in % The ratio at the end of respective period is calculated by dividing total shareholders’ equity by total assets. The equity ratio measures the proportion of the total assets that are financed by shareholders. Reconciliations of Alternative Performance Measures September 30, December 31, (SEK in thousands or otherwise indicated) 2023 2022 2022 Equity ratio at the end of the period in % Total shareholders' equity at the end of the period 352,435 725,936 766,264 Total assets at the end of the period 1,611,891 1,518,106 1,952,973 Equity ratio at the end of the period in % 22% 48% 39% |