

第 2b 階段 AHFIRM 標題業績 2023 年 11 月附錄 99.2

免責聲明本演示文稿以及我們在本演講中發表的各種言論包含了DURECT Corporation(“DURECT”、“公司”、“我們” 或 “我們”)及其合作伙伴在適用證券法律和法規的含義範圍內的前瞻性陳述,這些陳述受1995年《私人證券訴訟改革法》的安全港條款約束,包括與larsucosterol有可能證明死亡率降低或肝移植相關的陳述酒精相關性肝炎(“AH”)患者和為了挽救生命,DURECT計劃與美國食品藥品管理局和其他監管機構會面,審查AHFIRM試驗的結果,larsucosterol的3期試驗可能顯示AH的治療與標準護理相比有統計學上的顯著改善,用於治療AH的larsucosterol可能獲得FDA或其他監管機構的批准,larsucosterol的預期產品收益和其他潛在用途,預期的產品市場和潛在銷售,以及臨牀試驗結果和計劃。實際結果可能與本演示文稿中包含的前瞻性陳述中包含的結果存在重大差異,因此報告的結果不應被視為未來表現的指標。這些前瞻性陳述涉及風險和不確定性,可能導致實際結果與此類前瞻性陳述中的結果存在重大差異。潛在的風險和不確定性包括但不限於larsucosterol的未來臨牀試驗無法證實AHFIRM試驗(包括地理或其他細分)或早期臨牀或臨牀前試驗的子集分析結果,或無法以具有統計學意義的方式證明larsucosterol的安全性或有效性的風險,FDA或其他政府機構可能要求對larsucosterol進行額外的臨牀試驗的風險在批准用於治療 AH 之前,以及與之相關的風險我們的現金資源充足、預期的資本需求和資本支出、我們對額外融資的需求或願望、我們獲得資本為運營和支出提供資金的能力以及我們繼續作為持續經營企業經營的能力。有關這些風險和其他風險的更多信息包含在DURECT最新的美國證券交易委員會(“SEC”)文件中,包括分別向美國證券交易委員會提交的10-K表或10-Q表年度和季度報告,標題為 “風險因素”。除非法律要求,否則DIRECT沒有義務在本陳述發佈之日之後更新任何這些前瞻性陳述,以使這些陳述符合實際業績或修訂後的預期。提醒現有和潛在投資者不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本文發佈之日。隨後的事件和發展可能會導致DURECT的期望和信念發生變化。本陳述不構成出售要約或招攬購買公司任何證券的要約。任何證券要約只能根據向美國證券交易委員會提交的註冊聲明(包括基本招股説明書)和招股説明書補充文件進行,其副本可在我們的網站www.durect.com的 “投資者” 選項卡下免費獲得,也可以訪問美國證券交易委員會網站www.sec.gov上的EDGAR免費獲得。本演示文稿中提供的所有信息均基於截至2023年11月7日DURECT可用的信息,除非法律要求,否則DURECT沒有義務根據未來事件或事態發展更新這些信息。

進入以 90 天死亡率為主要終點的註冊性 3 期試驗的充分理由 AHFIRM 試驗的關鍵要點 90 天死亡率降低 90 mg 劑量減少 41% 劑量 90 mg 劑量減少 35% 的數字改善未達到統計學意義美國人羣 90 天死亡率明顯降低 57% 劑量減少 30 mg 劑量降低 58% 90 mg 劑量兩劑量勞索固醇耐受性良好
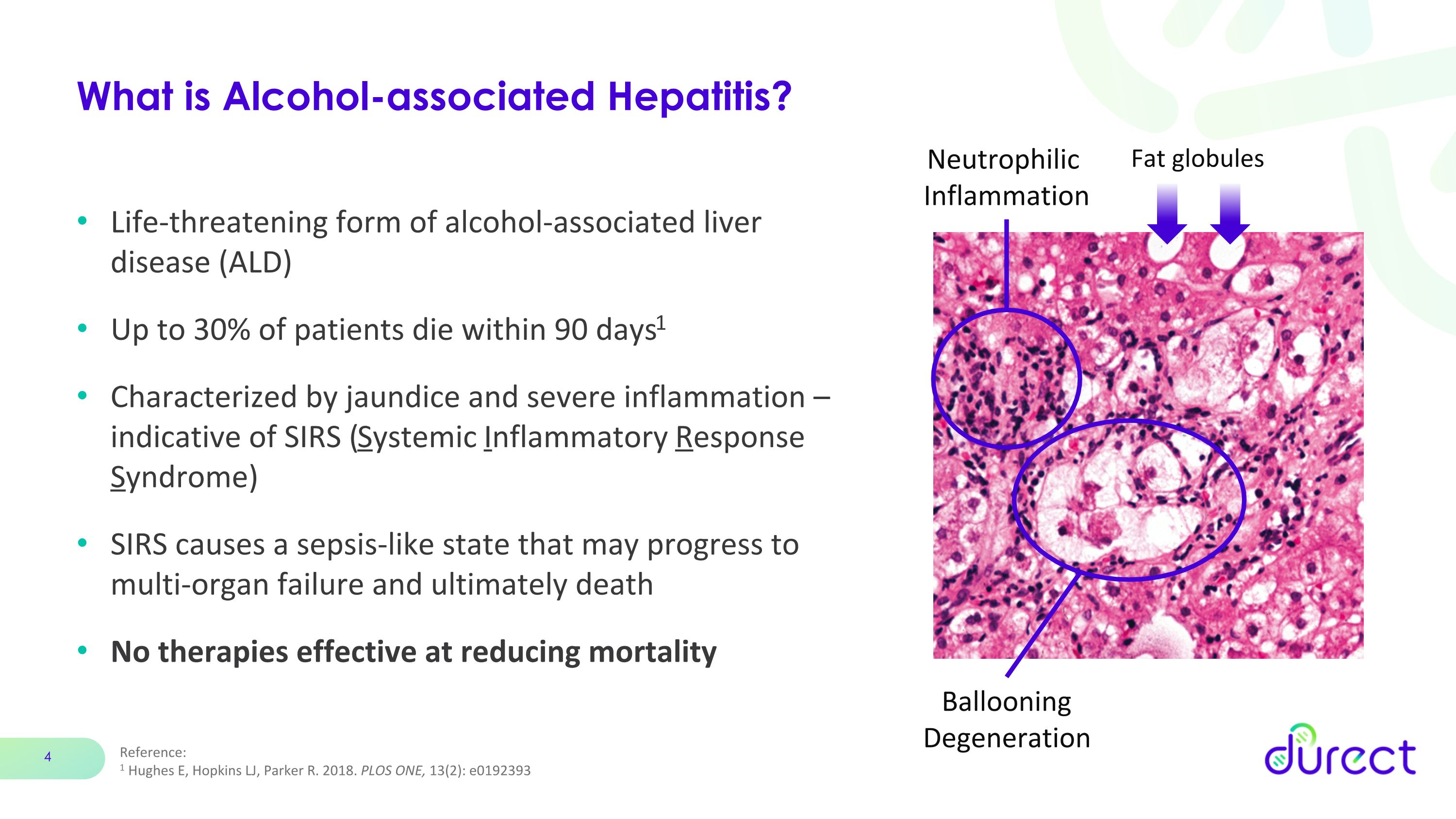
參考:1 Hughes E、Hopkins LJ、Parker R. 2018。PLOS ONE,13 (2):e0192393 什麼是酒精相關性肝炎?危及生命的酒精相關性肝病 (ALD) 多達 30% 的患者在 90 天內死亡1 以黃疸和嚴重炎症為特徵——提示着 SIRS(全身性炎症反應綜合徵)SIRS 會導致敗血癥樣狀態,可能發展為多器官衰竭並最終死亡。沒有有效降低死亡率的療法脂球氣球變性中性粒細胞炎症
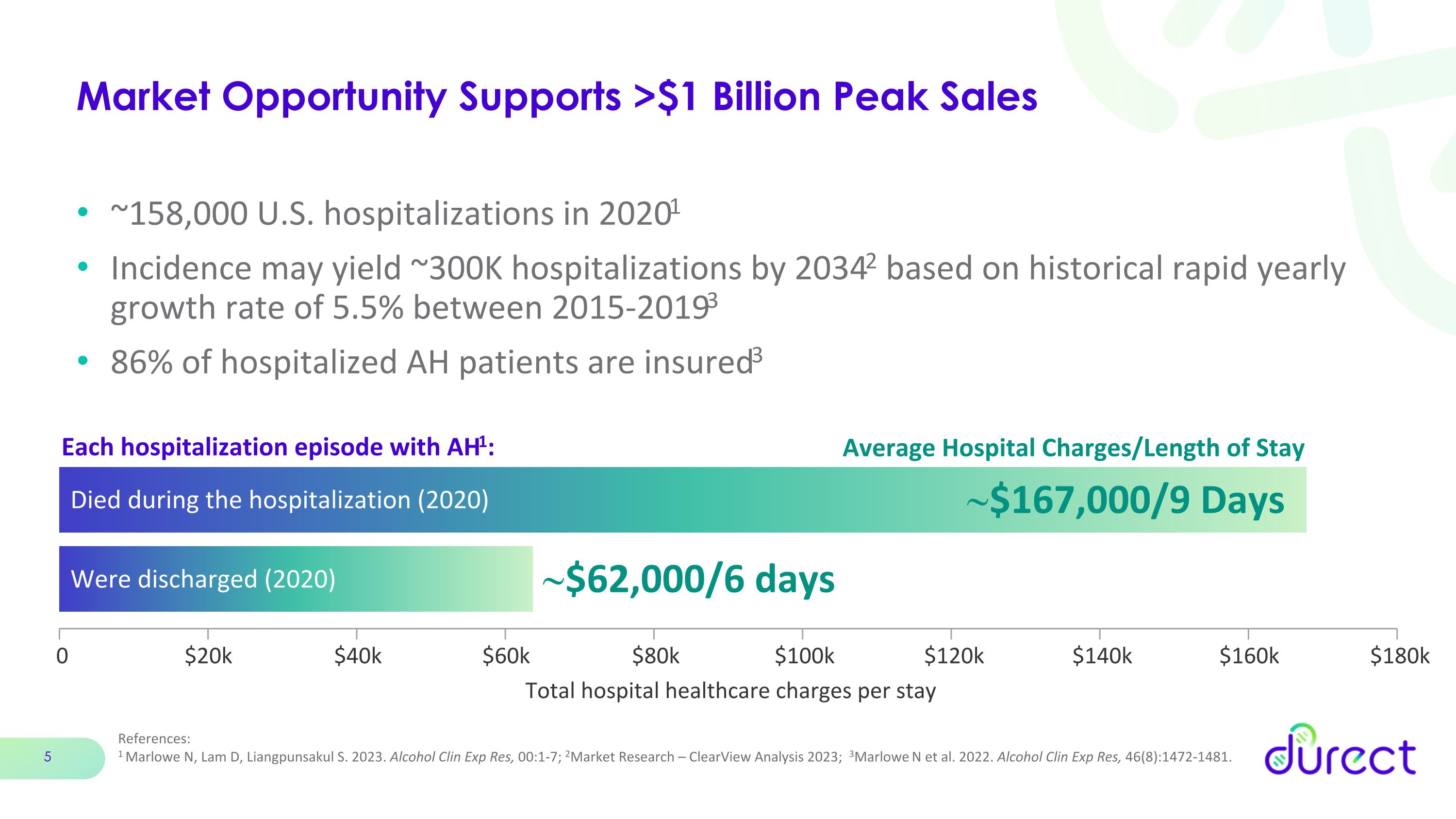
市場機會支持超過10億美元的峯值銷售額,2020年美國住院人數約為15.8萬人1 根據2015-2019年間5.5%的歷史快速年增長率,到20342年,發病率可能導致約30萬人住院。86%的住院AH患者獲得了保險3 AH1的每次住院發作:在住院期間死亡(2020年)每次住院的總住院費用約為16.7萬美元/9天約為62,000美元 4 萬美元 6 萬美元 8 萬美元 10 萬美元 12 萬美元 14 萬美元 16 萬美元 18 萬美元參考文獻:1 Marlowe N、Lam D、Lam D、Liangpunsakul S. 2023。Alcohol Clin Exp Res,00:1-7;2市場研究 — ClearView Analysis 2023;3Marlowe N 等人,2022 年。Alcohol Clin Exp Res,46 (8): 1472-1481。平均住院費用/出院時長(2020)

2b 期 AHFIRM 試驗設計研究設計篩選期 30 mg larsucosterol 90 mg larsucosterol 標準護理標準 (SOC) 2 MDF1 分數 ≥ 32,MELD1 分數為 21-30 的重度 AH 患者 307 名受試者按照 1:1:1 的比例隨機分為三組。在美國、歐盟、澳大利亞和英國進行的全球試驗劑量 1 試驗概述隨訪期第 90 天死亡率或肝移植 1 Maddrey's Discentistent 功能(MDF);終末期肝病模型(MELD)2所有患者均接受支持性護理,標準護理(SOC)患者可能包括甲基潑尼鬆龍膠囊由調查人員自行決定。為了維持失明,如果研究者開出類固醇處方,則兩個組的患者將獲得相應的安慰劑膠囊。72 小時劑量 2(如果仍在住院)
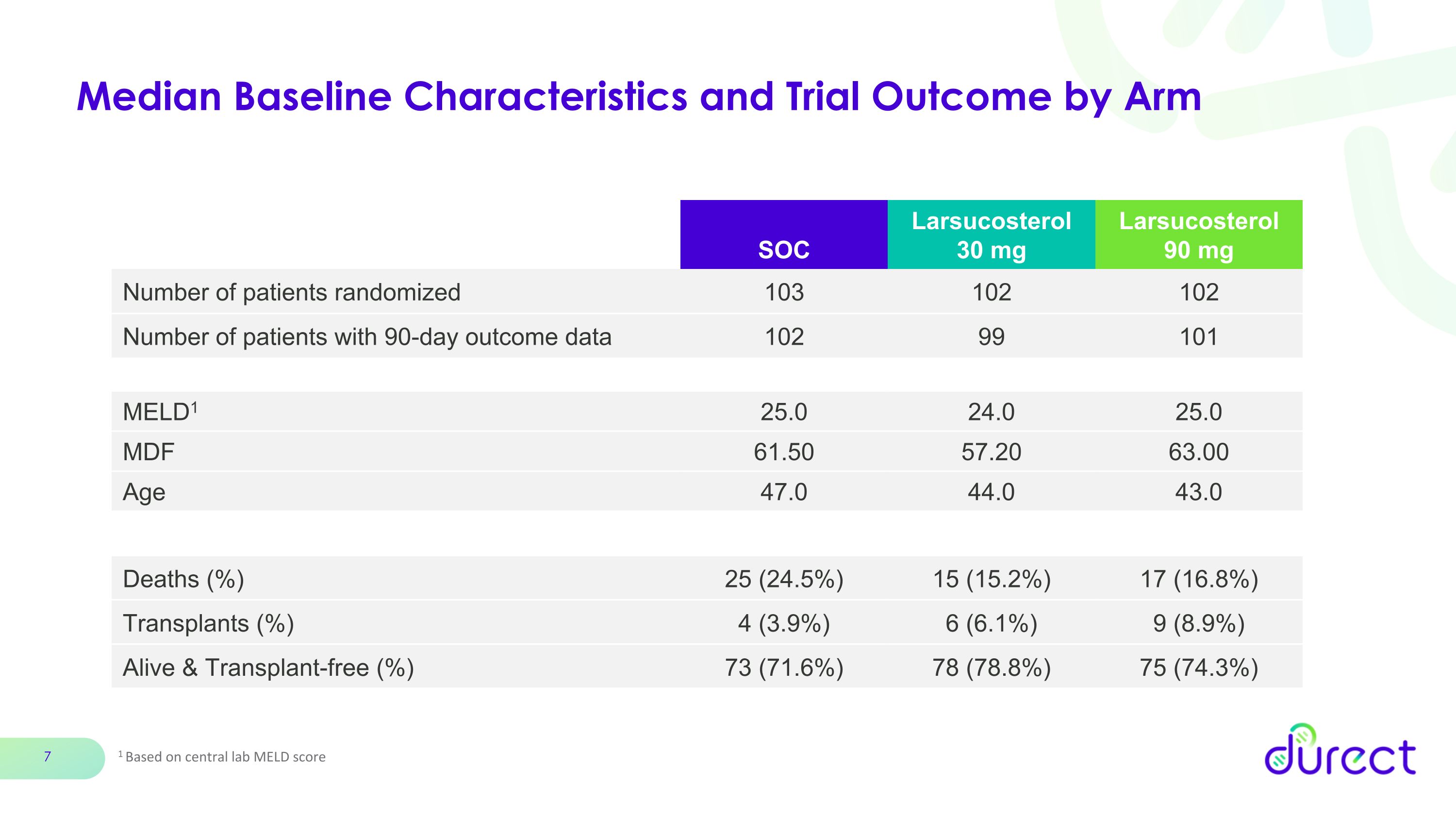
基線特徵和試驗結果中位數 1 基於中央實驗室 MELD 評分 SOC Larsucosterol 30 mg larsucosterol 90 mg 患者人數 103 102 有 90 天預後數據的患者人數 102 99 101 MELD1 25.0 25.0 25.0 57.20 63.0 年齡 47.0 44.0 死亡 (%) 25 (24.2%) 17 (16.8%)) 移植 (%) 4 (3.9%) 6 (6.1%) 9 (8.9%) 活着且無需移植 (%) 73 (71.6%) 78 (78.8%) 75 (74.3%)
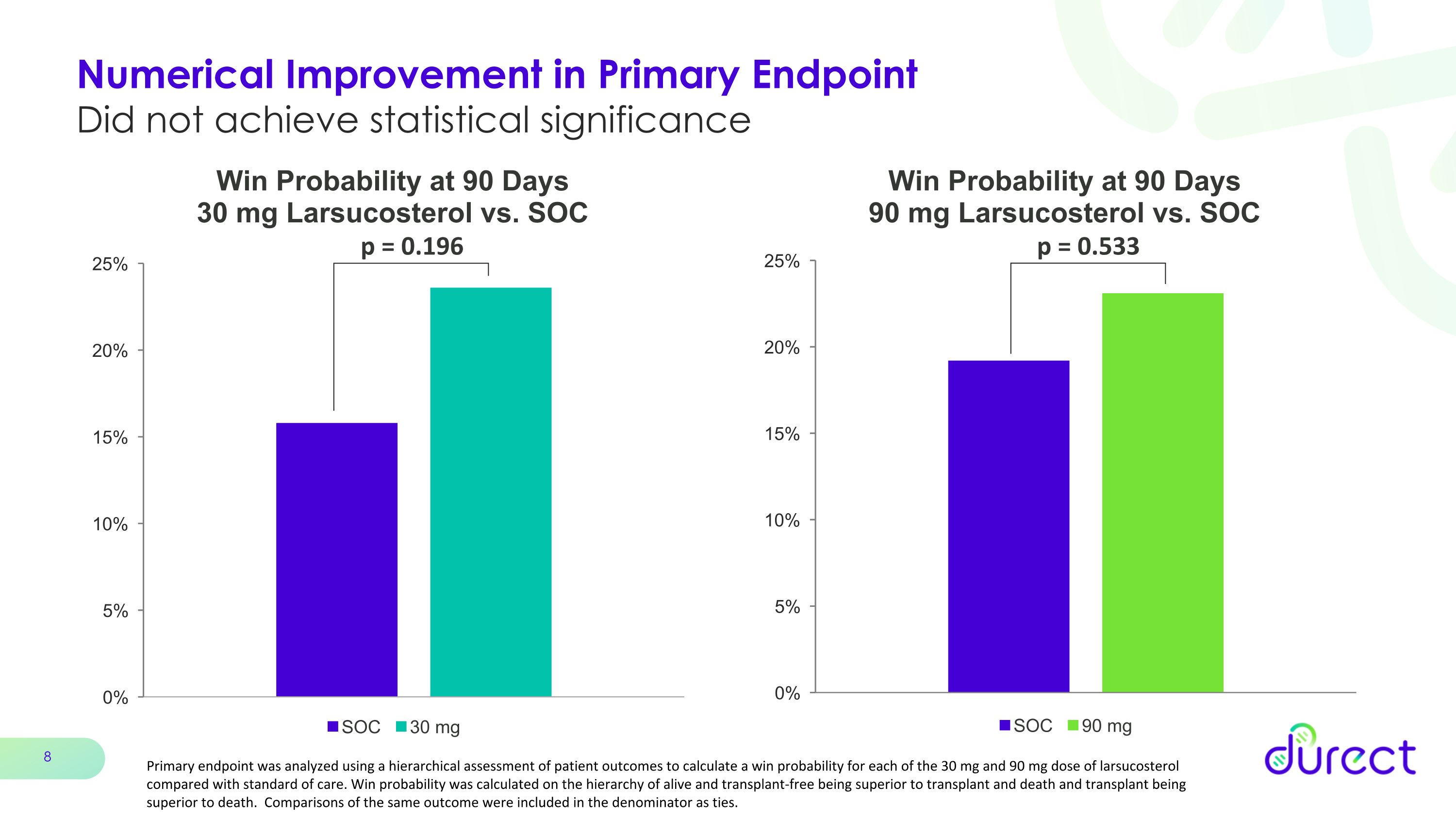
主要終點的數值改善未達到統計學意義 p = 0.533 p = 0.196 使用對患者預後的分層評估來分析主要終點,計算出 30 mg 和 90 mg 劑量larsucosterol中每種劑量與標準治療相比的獲勝概率。獲勝概率是根據存活和免移植優於移植和死亡以及移植優於死亡的等級計算得出的。將相同結果的比較作為平局包含在分母中。
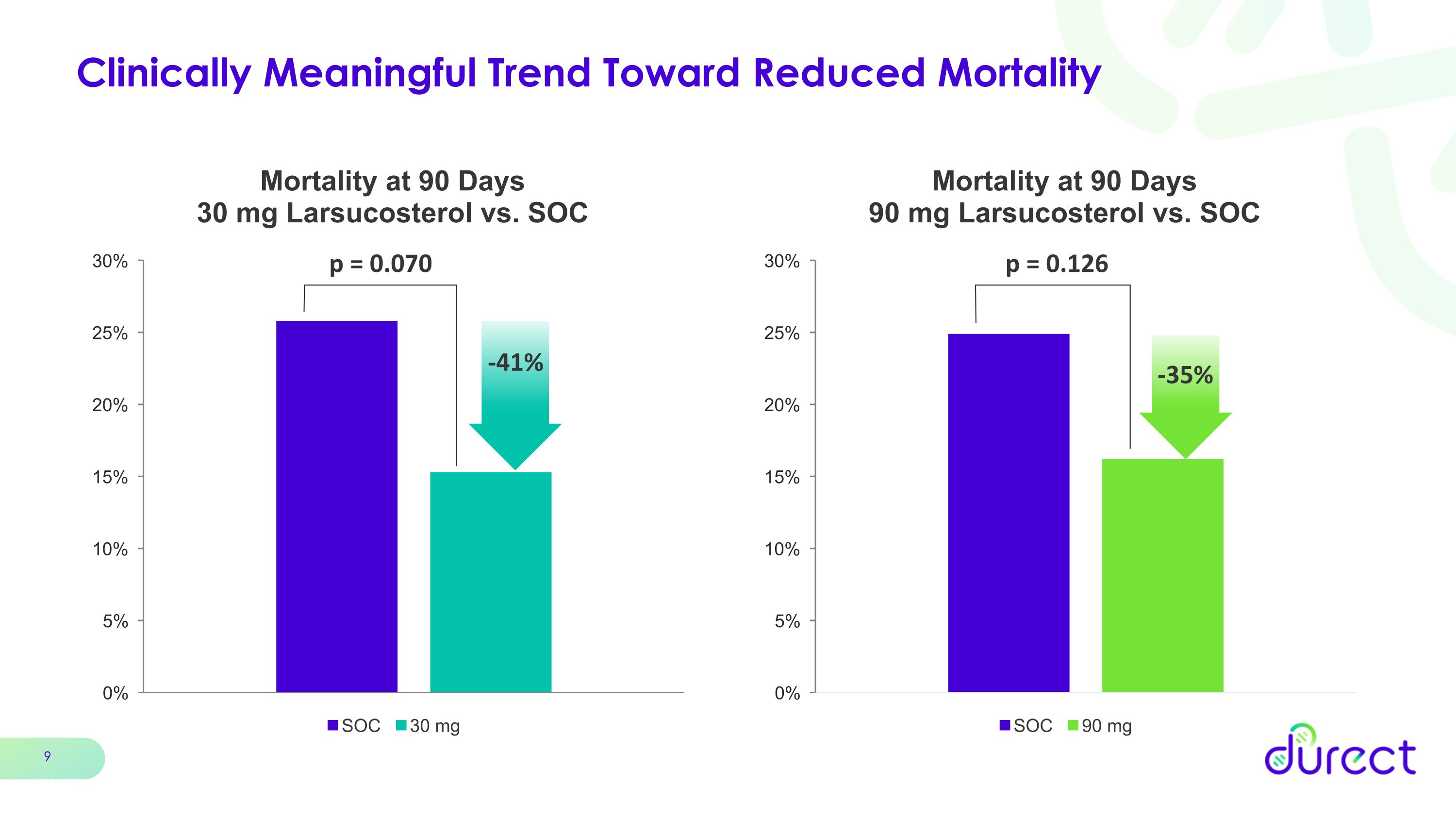
具有臨牀意義的降低死亡率的趨勢 p = 0.126 p = 0.070 -41% -35%
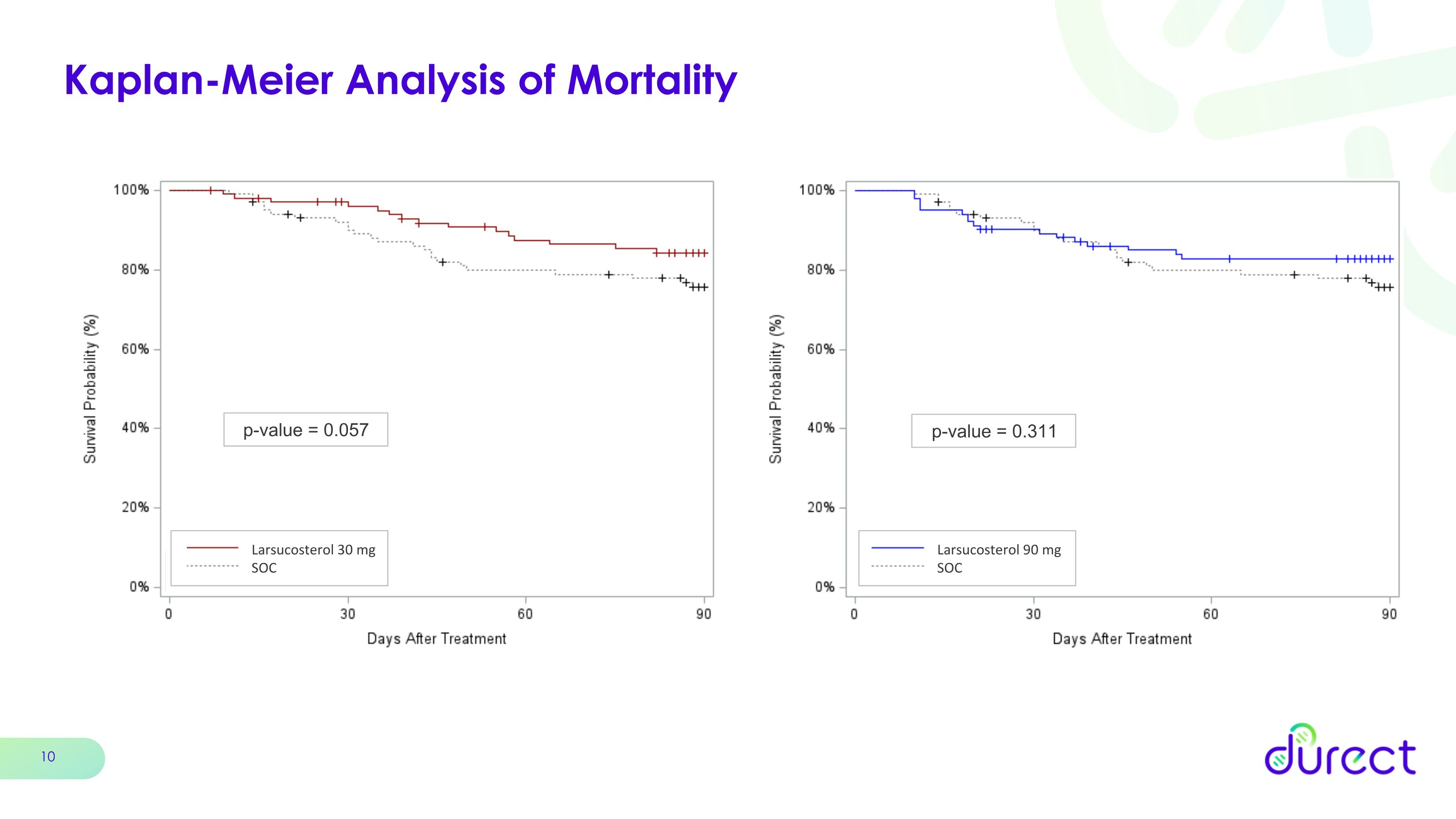
Kaplan-Meier 死亡率分析 p 值 = 0.057 Larsucosterol 30 mg SOC p 值 = 0.311 Larsucosterol 90 mg SOC
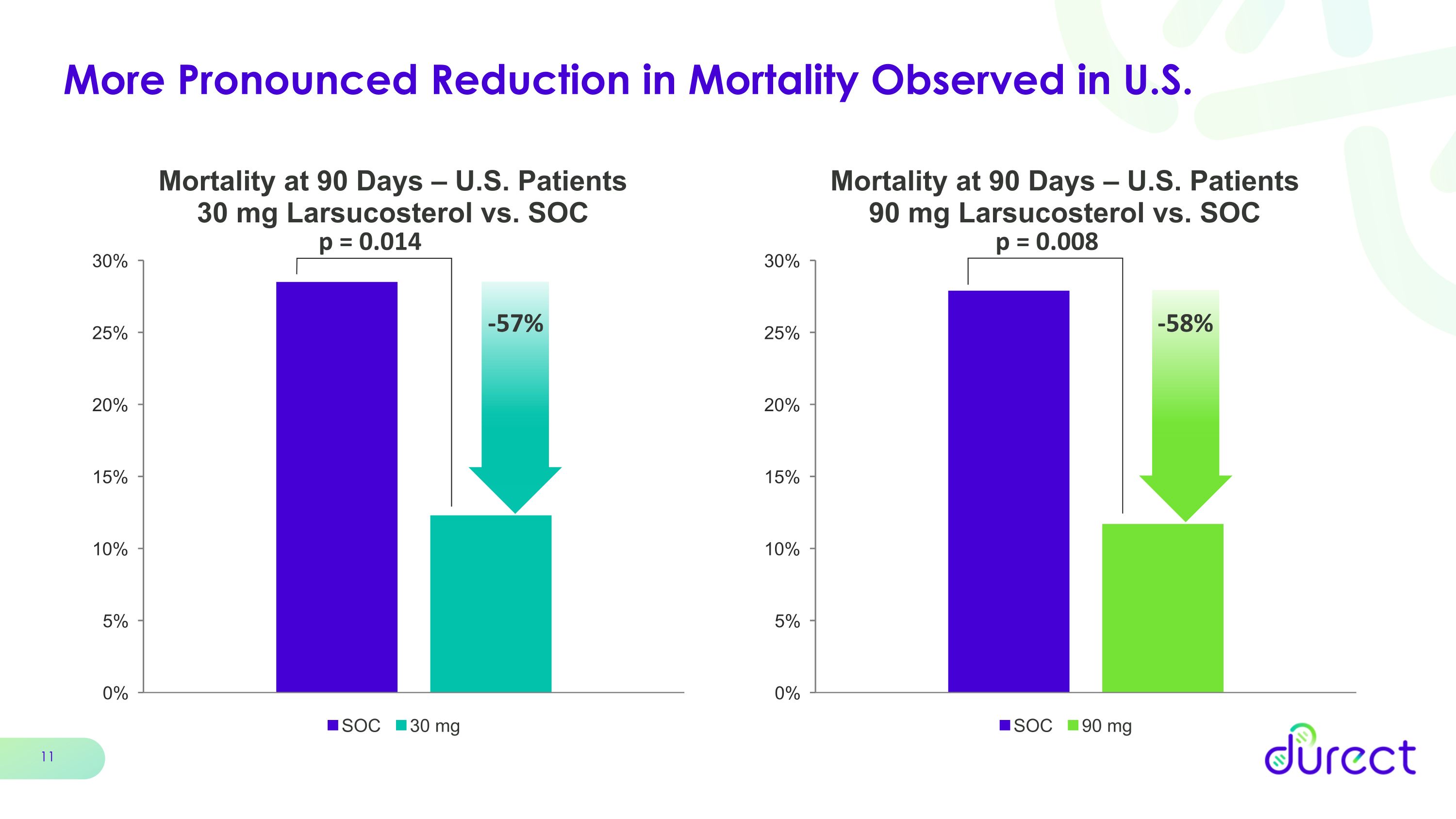
在美國觀察到的死亡率下降幅度更大 p = 0.008 p = 0.014 -57% -58%
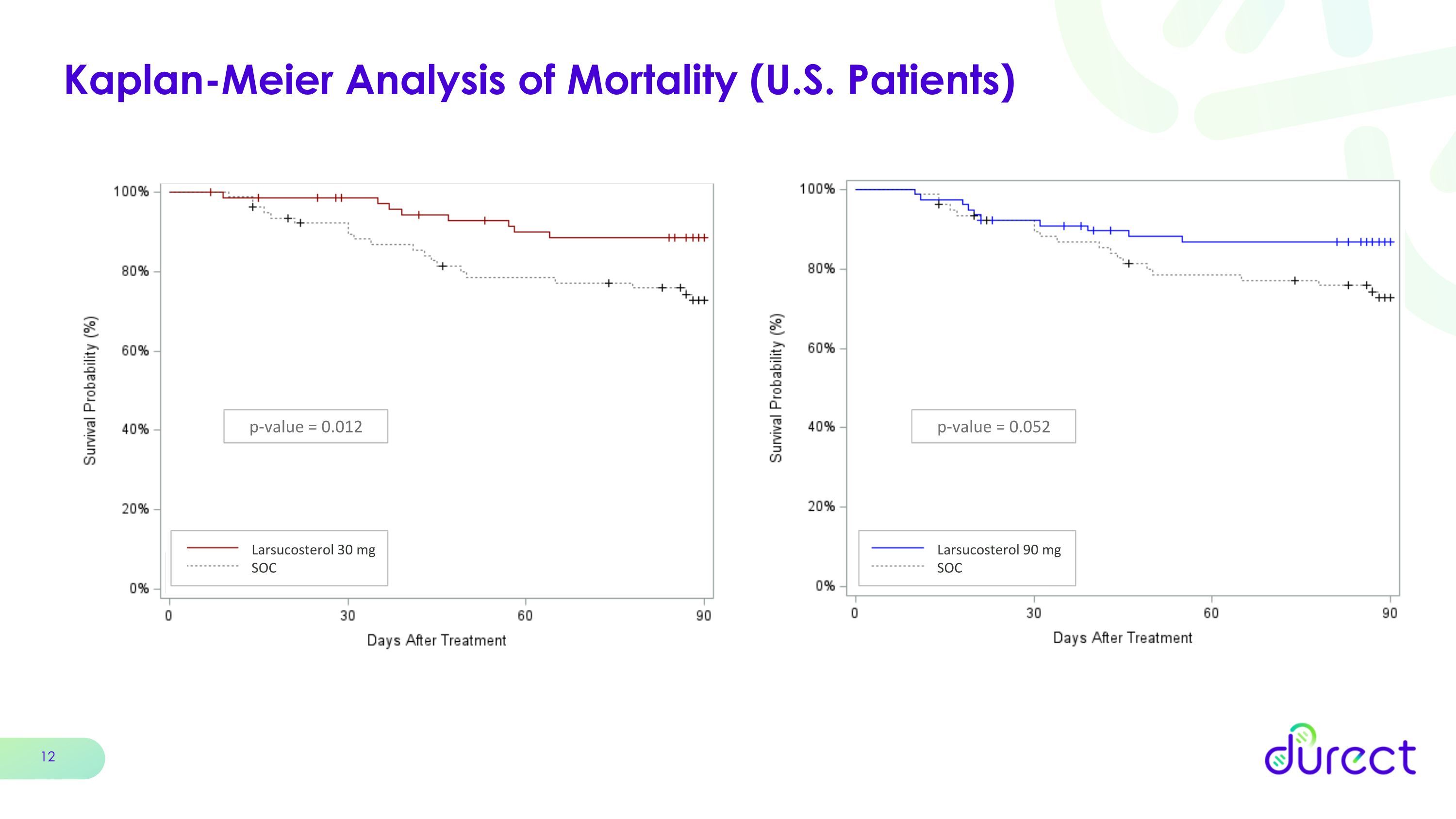
Kaplan-Meier 死亡率分析(美國患者)p 值 = 0.012 Larsucosterol 30 mg SOC p 值 = 0.052 Larsucosterol 90 mg SOC
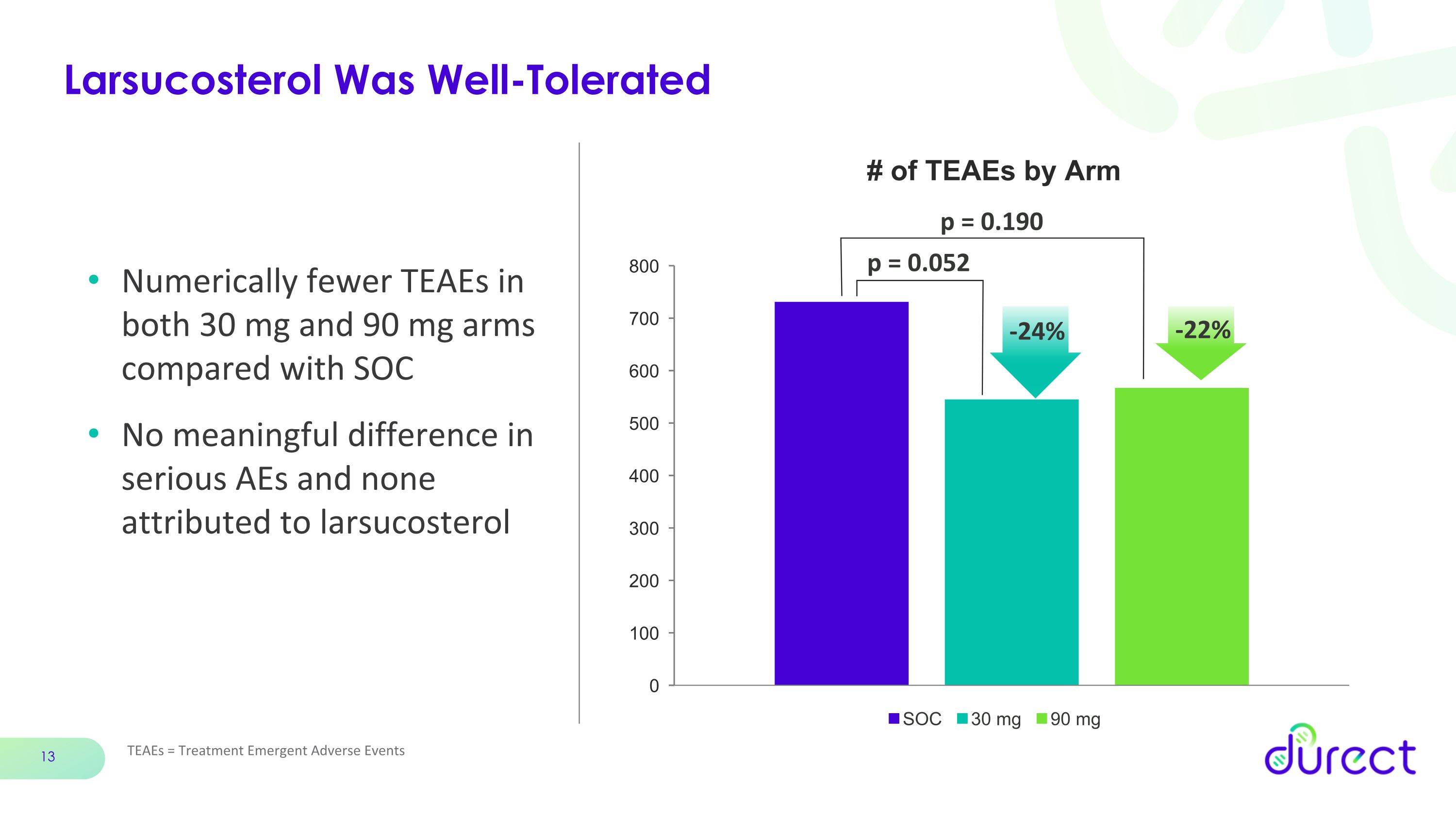
Larsucosterol 耐受性良好 TeaEs = 治療緊急不良事件與 SOC 相比,30 mg 和 90 mg 組中 TEAE 的數值較少,嚴重的不良反應沒有明顯差異 p = 0.052 p = 0.190 -22% -24%

結論 AH中Larsucosterol的後續措施令人信服的療效信號表明,在降低90天死亡率這一關鍵次要終點中使用larsucosterol;與SOC相比,30mg劑量為41%,90mg劑量為35%。在美國患者,larsucosterol治療可將30mg劑量的死亡率降低57%(p=0.014),90 mg劑量的死亡率降低58%(p=0.008)與 SOC 相比,Larsucosterol 的耐受性良好;兩個劑量組的不良事件都少於標準治療下一步:在 2024 年第一季度與 FDA 討論 AHFIRM 數據有充分的理由將larsucosterol推進到以90天死亡率為主要終點的註冊性3期試驗 AHFIRM數據將在即將舉行的科學會議上公佈

問與答