
2023 年創新系列 2023 年 11 月 7 日美國東部時間上午 9:00 至下午 1:00

1 歡迎辭和介紹性發言瑞安·理查森首席戰略官

本幻燈片演示文稿包括前瞻性陳述 3 本演示文稿包含經修訂的 1995 年《私人證券訴訟改革法》所指的前瞻性陳述,包括但不限於與在 BioNTech 合作伙伴控制的地區銷售 BioNTech 的 COVID-19 疫苗(簡稱 COMIRNATY®)相關的預期收入和淨利潤,特別是那些得出的數字來自BioNTech 合作伙伴提供的初步估計;市場對 BioNTech 的 COVID-19 疫苗以及 BioNTech 在研藥物(如果獲得批准)的接受率和程度;對 COVID-19 疫苗需求預期變化的預期,包括訂購環境、季節性和調整疫苗以應對新變種或亞系的預期監管建議的變化;BioNTech研發計劃的啟動、時機、進展、結果和成本,包括相關項目到其他配方BioNTech 的 COVID-19 疫苗以及 BioNTech 當前和未來的臨牀前研究和臨牀試驗,包括有關開始和完成研究或試驗的時間以及相關準備工作和結果可得性的聲明;我們對知識產權的期望;公司合作和許可協議的影響;可持續疫苗生產和供應解決方案的開發以及這些解決方案的性質和可行性;以及 BioNTech 對商業和其他收入的估計,銷售成本、研發費用、銷售和營銷費用、一般和管理費用、資本支出、所得税、淨利潤、現金、現金等價物和證券投資、已發行股份和現金流出以及股份對價。在某些情況下,前瞻性陳述可以通過諸如 “將”、“可能”、“應該”、“期望”、“打算”、“計劃”、“目標”、“預期”、“相信”、“估計”、“預測”、“潛力”、“繼續” 之類的術語來識別,儘管並非所有前瞻性陳述都包含這些詞語。本演示文稿中的前瞻性陳述既不是承諾也不是保證,您不應過分依賴這些前瞻性陳述,因為它們涉及已知和未知的風險、不確定性和其他因素,其中許多是BioNTech無法控制的,並且可能導致實際結果與這些前瞻性陳述所表達或暗示的結果存在重大差異。這些風險和不確定性包括但不限於:在 BioNTech 首次向國家政府銷售後,BioNTech 與政府當局、私人健康保險公司和其他第三方付款人的定價和承保範圍談判;COVID-19 疫苗初始劑量或加強劑量的未來商業需求和醫療需求;來自其他 COVID-19 疫苗或與 BioNTech 的其他候選產品(包括具有不同作用機制和不同生產和分銷限制的產品)的競爭其中其他方面,功效、成本、儲存和分銷的便利性、批准用途的廣度、副作用特徵和免疫反應的持續性;BioNTech 候選產品獲得和維持監管部門批准的時間和能力;BioNTech 的 COVID-19 疫苗預防由新出現的病毒變種引起的 COVID-19 的能力;BioNTech 及其交易對手管理和獲取必要能源的能力;BioNTech 識別研究的能力機會,發現和開發在研藥物;BioNTech 的第三方合作者繼續開展與 BioNTech 開發候選藥物和在研藥物相關的研發活動的能力和意願;COVID-19 疫情對 BioNTech 開發計劃、供應鏈、合作者和財務業績的影響;因使用 BioNTech 開發或製造的 COVID-19 疫苗和其他產品和候選產品而產生的不可預見的安全問題和潛在人身傷害或死亡索賠;以及其合作者的能力商業化和銷售 BioNTech 的 COVID-19 疫苗及其候選產品(如果獲得批准);BioNTech 管理其開發和擴張的能力;美國和其他國家的監管發展;BioNTech 有效擴展 BioNTech 生產能力和製造 BioNTech 產品的能力,包括 BioNTech 的目標 COVID-19 疫苗生產水平和 BioNTech 的候選產品;與全球金融體系和市場相關的風險;以及其他因素 BioNTech 目前不知道。您應該查看BioNTech截至2023年9月30日的6-K表報告以及BioNTech隨後向美國證券交易委員會提交的文件中 “風險因素” 標題下描述的風險和不確定性,這些文件可在美國證券交易委員會的網站 https://www.sec.gov/ 上查閲。除非法律要求,否則如果出現新信息、未來發展或其他情況,BioNTech不打算也不負責更新或修改本演示文稿中包含的任何前瞻性陳述。這些前瞻性陳述基於BioNTech當前的預期,僅代表截至本文發佈之日。

2023 年創新系列議程 1 歡迎辭和介紹性發言上午 9:05 2 BioNTech 的創新方法上午 9:05 3 人工智能能力和項目上午 9:25 4 我們的多平臺腫瘤學戰略上午 9:35 我們的增長戰略上午 10:30 休息時間(10 分鐘)6 新骨幹:下一代 ADC 和免疫調節劑上午 12:35 7 實體瘤細胞療法上午 12:15 點創造價值之路下午 12:30 10閉幕詞和問答下午 12:40

2023 年創新系列 — BioNTech Team 5 Ugur Sahin 教授,醫學博士首席執行官、聯合創始人 Karim Beguir 首席執行官、InstaDeep 伊爾汗·塞利克教授、醫學博士副總裁、臨牀開發副總裁 Ozlem Türeci 教授

2 BioNTech 的創新方法醫學博士首席執行官兼聯合創始人 Ugur Sahin 教授

我們創造了歷史 7 1.自然 589、16-18 (2021);2.以單一產品在一年內的銷售額來衡量(輝瑞或BioNTech在2021年和2022年兩年的直接銷售總額超過400億美元);3.2021 年和 2022 年累計出貨劑量。4.COVID-19 超額死亡率合作者。估計 COVID-19 疫情導致的超額死亡率:2020-21年度與COVID-19相關的死亡率的系統分析。《柳葉刀》。2022。>40億劑bnt162b2出貨量>170個國家和地區3 數百萬例嚴重疾病或死亡病例可能避免了數萬億美元的全球經濟影響4 醫學史上最快的疫苗開發1所有藥品最強勁的推出2拯救了生命並影響了全球經濟

大規模創新全球免疫療法領導者 1.截至 2023 年 10 月 1 日;2.截至2023年10月24日。醫療保健和社會責任創新和多元化產品線在 COVID-19 疫苗開發領域處於領先地位建立和擴大長期成功的 COVID-19 特許經營權開發專注於腫瘤學和傳染病的創新產品線旨在建立一家專門的多產品腫瘤學公司為全球新藥普及化做出貢獻 8 > 60% 1 市場份額 112 項正在進行的第 2 和 3 期試驗 2023 年向低收入和中等收入國家交付的劑量 40% >5,7001 名員工

今日生物科技 1.截至2023年10月31日。研發 = 研發;總部 = 總部英國倫敦盧旺達 Kigali BioNTainer(在建)奧地利維也納德國(總部+ 6 個地點)商業和臨牀規模 mRNA 臨牀規模細胞療法新加坡 mRNA 商業製造美國劍橋蓋瑟斯堡臨牀規模細胞療法中國上海土耳其伊斯坦布爾 BioNTech 地點 9 個澳大利亞維多利亞州 BionTainer(計劃中)>80 個不同國籍 36 個平均年齡 >50% 是女性全球 >5,7001 名專業人士成立於 2008 年 InstaDeep 辦公室

細胞類型利用免疫系統的全部力量對抗人類疾病 10 巨噬細胞 NK 細胞樹突狀細胞遷移移去除患病細胞治療細胞通信 B 細胞-細胞功能癌症自身免疫性疾病神經退行性疾病心血管疾病傳染病炎性疾病人類免疫系統在超過 80% 的人類疾病中起着核心作用能夠高精度殺死靶細胞或病原體數千億個細胞影響每種細胞的功能體內器官系統長期記憶的潛力 NK 細胞 = 自然殺傷細胞

聚焦五大創新支柱 11 對免疫系統的深入理解多平臺創新引擎製造和自動化目標發現和特徵數字和 AI/ML AI = 人工智能;ML = 機器學習。

多技術創新引擎 12 1. mRNA 編碼的癌症靶向抗體和細胞因子。CAR = 嵌合抗原受體;TLR = toll 樣受體;TCR = T 細胞受體;Abs = 抗體;STING = 幹擾素基因刺激劑。個性化療法支持技術 ADC * 選擇性 TLR-7 激動作靶向癌症療法 RIBOLYSIN 精準抗菌藥物現貨 mRNA 癌症疫苗 FixVac 傳染病疫苗預防和治療疫苗個體化 mRNA 癌症疫苗 iNest 個性化體外 T 細胞療法實體瘤 CAR-T 細胞靶向多靶點 TCR carvac mRNA 疫苗增強型 CAR-T-C 細胞 STING 激動劑脂質製劑免疫療法靶點發現小分子下一代免疫調節劑單特異性和雙特異性 Abs RIBO-LOGICALS1 核細胞因子 RiboCytokines mRNA 編碼人體蛋白質療法細胞和基因療法 mRNA 技術多技術驅動的方法植根於對生物學、免疫學和醫療需求的深刻基礎理解構建能夠生產多種候選產品的新平臺開闢利用協同作用模式的新組合機會支持和加速治療的個性化利用人工智能驅動的藥物發現、設計和開發核心原則我們的技術策略藥物類項目人工智能、機器學習和計算醫學內部能力包括 InstaDeep 2023 年新增候選產品

mRNA 2023:廣泛的技術工具箱 13 Holtkamp 等人。Blood 2006;Kuhn 等人2010 年基因療法;Sahin、Türeci & Kariko Nat 2014 年藥物發現;Vogel 等人。2018 年 Mol Therapy;Beissert 等人。Mol Therapy 2020。mRNA 格式化局部組織特異性系統性 Lipoplex 納米粒子脂質納米顆粒聚合物納米粒子尿苷 mRNA 偽尿素 mRNA 自擴增 mRNA 納米粒子疫苗(例如癌症、感染性疾病、自身免疫)抗體(例如受體阻滯劑)信號分子(例如細胞因子)酶(例如 CRISPR/CAS)轉錄因子(例如 CRISPR/CAS)山中因子)編碼藥物 A30-L-A70Cap UTRORFUTR A30-L-A70Cap UTRORFUTR vUTR A30-L-A70Cap AntigensgporfVutr A30-L-A70Cap utrReplicaseutr vutr環狀 RNA,化學合成的 mRNA 數十年來 mRNA 效力和性能的多模態優化(> 10,000 倍)

我們應對製造挑戰的創新方法 14 GMP = 良好生產規範 BioNTech 年產量達 16 億劑的 mRNA 藥物成分大規模交付量身定製和定製普及新技術的普及個性化 mRNA 疫苗的數字化生產週轉時間 4-6 周 BioNTainer:移動 GMP 製造單位

人工智能對科學和醫學的空前影響 15《新英格蘭醫學雜誌》第 388,13 卷(2023 年):1201-1208。自然 605、551—560 (2022)。自然 596、583—589 (2021)。AI,人工智能;ML,機器學習;LLM,大型語言模型;AGI,人工通用智能。AlphaFold2在50年內處理數據能力的提高,使機器學習得以發展,並有望持續改善蛋白質結構的預測,接近實驗精度。引入的從頭蛋白質設計解決方案AGI預計將影響公共衞生和醫院運營以外的醫學教育和臨牀研究,通過更有效地招募和匹配研究參與者以及對數據進行更全面的分析來加快臨牀試驗的速度通過將歷史數據與靶向試驗註冊標準進行匹配來創建合成對照組加速藥物發現,包括從頭分子設計和優化以及基於結構的藥物設計 AlphaFold2-結構預測 Rosetta-de novo 蛋白質設計增加存儲容量提高速度計算能力和算法的進步 AGI 預計將於 2024 年至 2029 年問世生物應用由 LLMs/強化學習中的 Data Explosition Leap 提供支持

我們的 AI 目標 16 AI = 人工智能;ML = 機器學習;mRNA = 信使核糖核酸;TCR = T 細胞受體設計;SARS-CoV-2 = 嚴重急性呼吸綜合徵冠狀病毒 2。優化 mRNA 結構和功能 SARS-CoV-2 變異監測和免疫原設計用於傳染病的定製和合成內溶素髮現 TCR 發現和優化抗體設計完全可擴展、自動化工程核細胞因子和 RiboMabs 蛋白質設計先導結構超快基因組分析個性化突變組分析新抗原預測自動化和數字化製造由數據和尖端人工智能和機器學習技術提供支持 1. 2. 3. 4。支持人工智能的藥物和靶點發現個性化藥物

加速和增強 BioNTech 的 AI Vision 17 AI = 人工智能;ML = 機器學習。充分利用計算科學和人工智能實施策略的力量 • 提供高質量的設計,開發具有更有效或更安全的下一代產品 • 加快開發新療法和疫苗候選產品的工作流程 • 通過貫穿整個藥物發現(例如高通量測序、靶標識別、候選藥物設計和優化、臨牀開發和製造以及過去三年的成功合作)的全數字化自動化來擴大我們的能力定義高優先級項目確保項目層面的緊密團隊合作保持 InstaDeep 的完整性

3 人工智能能力和項目 InstaDeep 首席執行官 Karim Beguir

我們的人工智能能力 19 從人工智能研究人員到機器學習工程師和機器學習運營專家,我們的團隊具有吸引歐洲、中東和非洲地區人才的臨界規模、深度和差異化能力。我們在英國的專有GPU集羣(預計2024年將達到500 petaflops)針對高性能計算進行了優化,並由我們的Aichor軟件平臺全面管理。主要人工智能會議(Neurips、ICLR 等)、研討會和期刊的強大撰稿人。2023 年,在 ML for Biology 和 AI 決策領域發表了 25 篇文章。專有的高效庫,用於高級大型語言模型 (LLM) 培訓,支持研發工作和以生物學為重點的生成式 AI。分佈式、可擴展的強化學習 (RL) 和組合優化算法。發佈了 5 個參考 JAX 框架。量子機器學習的先驅包括在《自然》期刊、合作(NPL、劍橋、IBM)和商業合作伙伴關係上發表的文章。將我們的人工智能創新驅動的技術轉換為與我們的計算基礎設施和雲集成的用户友好、可擴展的軟件產品。複雜環境的物理逼真表現,包括生物學中的 GPU 加速分子動力學。300 多位人工智能專家超級計算資產 AI 研究能力 Frontier LLM 大規模優化量子機器學習軟件產品化仿真專業知識 AI = 人工智能;ML = 機器學習;EMEA = 歐洲、中東、印度和非洲;GPU = 圖形處理單元;Neurips = 神經信息處理系統;ICLR = 學習表現形式國際會議;Neurips = 全國學習表象會議物理實驗室。

由 AI 20 提供支持的端到端治療平臺我們將人工智能能力應用於潛在癌症療法和傳染病疫苗設計的最前沿跨職能學習共享靶標識別 mRNA 優化基因合成功能驗證開發用於 RNA 翻譯預測的 LLM 寡核苷酸組裝成功率提高 36% 免疫反應檢測速度提高了 8 倍以上在陽性預測值方面增強新抗原選擇算法 (PPV)) BionDeep為 DNA AI 設計的疫苗開發最先進的基礎大型語言模型,可與人類專家設計競爭在序列和結構空間中進行免疫識別建模 Synergistic 方法旨在改進 BioNTech 的個性化免疫治療平臺 AI = 人工智能;LLM = 大型語言模型。

基因合成 21 1.2022 年 4 月內部評估的結果;數據已存檔。聚合酶鏈反應 = 聚合酶鏈反應;AI = 人工智能。DNA是生物學的語言,也是各種生物產品的起始材料。長DNA分子的產生很複雜。組裝 PCR 利用精心設計的碎片構建完整的分子。但是,失敗很常見且代價高昂。我們的人工智能優化算法使該過程的成功率比行業標準提高了36個絕對百分點。我們的創新已嵌入到軟件平臺中,該平臺可解鎖BioNTech進行大規模實驗的能力,與相同硬件相比,將故障率降低了約5倍,成功設計吞吐量提高了68個百分點。設計的 DNA DNA 片段設計了 DNA 腫瘤學免疫學蛋白質替代療法直觀的軟件平臺合成成功率1 BioNTech 行業標準

功能驗證 22 存檔數據。AI = 人工智能;EDA = 電子設計自動化。ELiSpot項目簡化了實驗結果的分類,將其分為三種不同的結果之一:沒有免疫反應的結果、表現出陽性免疫反應的結果和不可評估的結果。我們開發了一款人工智能產品,為傳統的手動標籤方法提供了一種卓越而可靠的替代方案,從而提高了ELiSpot評估的準確性和效率。整體流程優化:● 人工智能評估了 97% 的實驗,只剩下 3% 供專家審查效率改進:● 手動處理:在 eLiSpot 應用程序中加快 8 倍 ● 全人工智能自動化:人工智能分類精度提高 40 倍:● 我們的 AI 產品:98% ● 人類級性能:90% ● 之前的工具:73% 評估一批實驗的時間 [hr]用於 EliSpot 實驗分類精度的人工智能平臺

Nucleotide Transformer:DNA 最先進的 LLM 23 Dalla-Torre 等人 2023,https://doi.org/10.1101/2023.01.11.523679 LLM = 大型語言模型。Nucleotide Transformer 是我們與 TUM 和 Nvidia 合作開發的專為 DNA 量身定製的語言模型集。這些模型已針對來自850多個物種的參考基因組進行了大規模訓練,是目前最先進的基因組學LLM。他們已經在包括拼接位點預測、增強活性預測和表觀遺傳學標記預測在內的各種任務上與許多競爭對手進行了評估。與 DeepStarr Stark 實驗室的比較、《自然遺傳學》與其他基因組學 LLM 的比較 Enformer、DeepMind、Nature Methods、Stanford、Neurips 與 SpliceAI Illumina 的比較、從染色質可及性到剪接位點檢測和有害性預測的細胞景觀

4 我們的多平臺腫瘤學戰略 Ugur Sahin 教授,醫學博士首席執行官兼聯合創始人

個體內部變異性和腫瘤內異質性推動逃避和次級耐藥機制癌症治療失敗的根本原因癌細胞基因多樣性和適應性 5-20 年——多達 10,000 次突變 DNA 突變健康細胞突變突變突變個體患者 25

我們的腫瘤學策略 26 策略組合策略涵蓋具有協同作用機制的化合物類別 • 免疫調節劑 • 靶向療法 • 個性化 mRNA 疫苗項目涵蓋各種實體瘤和治療階段的項目具有一流和/或一流潛力的項目獨特的治療組合願景解決癌症治療的連續性為癌症患者提供新療法並建立新的治療模式開闢平臺和療法組合的新選擇

邁向癌症的潛在治療方法:多平臺資產的差異化組合治療方法空間免疫調節劑新型檢查點抑制劑、細胞因子、免疫激動劑 mRNA 疫苗靶向治療 ADC、CAR-T、TCR-T、小分子 SynergySynergy Synergy 免疫調節劑 • 我們建立了一個模式無關的武器庫,專注於最相關和最關鍵的 IO 路徑 • 針對複合體中不同但互補的參與者癌症免疫週期可促進徹底而持久的抗腫瘤作用 mRNA 癌症疫苗• 使用個性化疫苗消除多克隆殘留疾病,以獲得潛在的長期影響 • 通過同時靶向多種抗原進行多特異活性靶向治療 • 快速減少腫瘤負擔的有效而精確的療法 • 包括晚期抗原在內的整個疾病的療效 27 CAR = 嵌合抗原受體;ADC = 抗體藥物偶聯物;IO = 免疫腫瘤學;TCR-T = 工程化的 T 細胞受體。

一種基於 HexaBody 技術的 CD27 抗體,經過專門設計,可在靶標與 T 細胞膜結合後形成抗體六聚體。BNT313/ GEN10531 臨牀狀態 • 多發性實體瘤中的 Ph1/2 單特異抗體具有優化 Fc 靶向 CTLA-4,由於 pH 驅動機制,有選擇地消耗 TME 中腫瘤浸潤 Treg,但不會消耗外周腫瘤浸潤 Treg。BNT316/ ONC-3922(gotistobart)臨牀狀態 • 多發性實體瘤中的 Ph1/2 • Proc 中的 Ph2 • 2L+ mnsCLC 雙特異性抗體中的 Ph3 可抑制 PD1 陽性細胞的增殖。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT311/ GEN10461 臨牀狀態 • 多發性實體瘤中的 Ph1/2 • mnsCLC 中的 Ph2 • 2L mec 中的 pH2 CD40 的參與會導致 APC 的激活和成熟。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT312/ GEN10421 臨牀狀態 • 多發實體瘤雙特異性抗體的 Ph1/2 試驗,旨在通過依賴 epcam 的 4-1BB 激動活性增強抗腫瘤免疫反應。BNT314/ GEN10591 臨牀狀態 • 計劃治療多發性實體瘤 Ph1/2 1。與 Genmab 合作;2.與 Oncoc4 合作;3.與 Biotheus 合作。CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;CD27、CD40、4-1BB = 腫瘤壞死因子受體超家族成員;PD-1 =程序性細胞死亡蛋白 1;HER2 = 人類表皮生長因子受體 2;ADCC = 抗體依賴細胞介導的細胞毒性;ADCP = 抗體依賴性細胞吞噬作用;PROC = 耐鉑卵巢癌;NSCLC = 非小細胞肺癌;EC = 子宮內膜癌 APC = 抗原呈遞細胞;VEGF = 血管內皮生長因子;TME = 腫瘤微環境;CtX = 化療;LALA = IgG1 變體L234A/L235A。腫瘤中 PD-L1 的表達或上調可能會將 VEGF 中和功能豐富到 TME 中,從而抑制血管新生。PM80023 臨牀狀態 • ph1b 劑量增加 • pH2A 可作為多種癌症的單一療法 • Ph2 與 ctX 聯合治療多種癌症在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物抗CD27Anti-ctla4 anti-1bbanti-pd-L1 Anti-4-1bbepcam Anti-4-1bbepcam Anti-pd-L1 Anti-pd-la Fc 28

ADC:腫瘤學的下一波轉型浪潮 29 ASCO 2022 曲妥珠單抗德魯克替康與化療,N Engl J Med 2022;387:9-20;Enfortumab Vedotin,+ Pembrolizumab 與化療;Powles TB 等。EV-302/KEYNOTE-A39:在先前未治療的局部晚期轉移性尿路上皮癌(La/muc)中,恩福單抗維多汀聯合pembrolizumab(EV+P)與化療(化療)的開放標籤隨機3期研究,2023年ESMO大會。ADC = 抗體藥物偶聯物;EV = enfortumab vedotin,IO = 免疫腫瘤學。ESMO 2023 起立鼓掌 EV-302、尿路上皮癌 ASCO 2022 起立鼓掌 T-Dxd(Destiny Breast-04)、乳腺癌 ADC 有望取代化療 ADC + IO 有望成為腫瘤學領域的新標準 ADC 開發正在改變腫瘤學領域的實踐總體生存率接受 EV + Pembrolizumab N mOS(95% CI)的患者的死亡風險降低 53%,月 Deruxtecan 373 23.4m (20.0-24.8) Physican's Choice 184 16.8 (14.5-20.0) 接受曲妥珠單抗治療的患者的總存活率死亡風險降低了 36%死亡危險比,0.64(95% 置信區間,0.49-0.84),p = 0.001)死亡危險比,0.47(95% 置信區間,0.38-0.58),p

30 個 ADC:創新週期才剛剛開始卓越的 ADC 連接器技術 • 提高穩定性 • 更高的療效 • 新的作用機制 • 腫瘤特異性激活 • 改進的新型有效載荷新靶點和新表位 • 靶向更廣泛的腫瘤 • 更高的特異性 BioNTech 計劃開發針對新靶標的 ADC 鏈接器 • 將有效載荷與抗體抗體結合• 與癌細胞表面的特定抗原有效載荷結合 • 高效的細胞毒性化合物 BioNTech 正在推動開發下一代 ADC 的 ADC = 抗體藥物偶聯物。我們對ADC靶點和免疫學的深刻理解使我們能夠鞏固和最大限度地利用下一代ADC技術提供的巨大治療窗口

靶向 TROP2、可裂解連接劑和拓撲異構酶 I 抑制劑 (P1021) DAR:4 靶向 B7H3、可裂解連接劑和拓撲異構酶 I 抑制劑 (P1021) DAR:6 靶向 HER3,可裂解連接劑允許在細胞內和細胞外釋放拓撲異構酶 I 抑制劑 (YL0014) DAR:8 靶向 HER2,可裂解連接劑 (LAR) 101) 和拓撲異構酶 I 抑制劑 (P1003) DAR:8 個臨牀階段 ADC 項目 1.與 DualityBio 合作;2.與MediLink合作;協議的完成取決於慣例成交條件,包括哈特-斯科特-羅迪諾(“HSR”)反壟斷改善法案的許可。ADC = 抗體-藥物偶聯物;DAR = 藥物與抗體之比;HER2/3 = 人表皮生長因子受體 2/3;TROP2 = 滋養細胞表面抗原 2;mbc = 轉移性乳腺癌 BNT324/ DB-13111 BNT323/ DB-13031 BNT325/ DB-13051 BNT326/ 臨牀狀態 • HR+HER2-Low mbc 中的 Ph3 • Ph1/2 腫瘤臨牀狀態 • 多發性實體瘤中的 Ph1/2 臨牀狀態 • 多發性實體瘤的 Ph1/2 臨牀狀態 • 多發性實體瘤的 Ph1 HER2 B7H3 TROP2 HER3 31 YL2022

邁向癌症的潛在治療方法:多平臺資產的差異化組合治療方法空間免疫調節劑新型檢查點抑制劑、細胞因子、免疫激動劑 mRNA 疫苗靶向治療 ADC、CAR-T、TCR-T、小分子 SynergySynergy Synergy 免疫調節劑 • 我們建立了一個模式無關的武器庫,專注於最相關和最關鍵的 IO 路徑 • 針對複合體中不同但互補的參與者癌症免疫週期可促進徹底而持久的抗腫瘤作用 mRNA 癌症疫苗• 使用個性化疫苗消除多克隆殘留疾病,以獲得潛在的長期影響 • 通過同時靶向多種抗原進行多特異活性靶向治療 • 快速減少腫瘤負擔的有效而精確的療法 • 包括晚期抗原在內的整個疾病的療效 32 CAR = 嵌合抗原受體;ADC = 抗體藥物偶聯物;IO = 免疫腫瘤學;TCR-T = 工程化的 T 細胞受體。

mRNA 癌症疫苗可能成為腫瘤學領域的下一個有形轉變 33 個體患者樣本(血液和組織)人工智能驅動的新抗原預測按需定製 RNA 製造個性化免疫療法突變圖固定組合針對每種適應症量身定製的多抗原方法新抗原個性化療法多種共享抗原現成療法癌症疫苗平臺 inest1 FixVac 個性化新抗原特異性免疫療法固定抗原抗原疫苗 1 抗原 2 抗原 3ANTIGEN 4 1. iNest 是與羅氏集團成員基因泰克合作開發的。AI = 人工智能。

通過協同模式的組合有可能治療多種癌症類型 34 ADC = 抗體藥物偶聯物。多種組合機會技術工具包已披露的第二和第三期適應症細胞療法 ADC 多特異性免疫調節劑 mRNA 癌症疫苗非小肺癌黑色素瘤頭頸癌乳腺癌子宮內膜癌結直腸癌胰腺導管腺癌卵巢癌

朝着我們的願景前進。YE = 年底;IND = 在研新藥。傳染病全球上市的 COVID-19 疫苗特許經營權保持並深化 COVID-19 疫苗的領導地位從 2026 年起推出多種腫瘤學產品中期目標今天推動轉型長期願景推出下一代和組合 COVID-19 疫苗腫瘤和傳染病產品組合的批准產品心血管疾病神經退行性疾病自身免疫性疾病腫瘤學啟動額外的註冊導向試驗 YE24 千載難逢的醫學轉型機會 35 9 第 2 階段試驗 2 期 3 期試驗 9 個臨牀試驗 8 個項目 30 個臨牀試驗中的項目 20 個項目創新引擎每年產生多個 IND 潛在的新疾病領域

規劃未來個性化精準醫療的方向 36 AI = 人工智能。人工智能和數字整合靶點和藥物發現與開發可應對個體間變異性的個性化治療平臺利用患者數據利用深厚的基因組學和免疫學專業知識自動化生產為患者按時和全球提供服務量身定製的按需免疫療法現成藥物小分子免疫調節劑抗體免疫調節劑抗體藥物抗體藥物偶聯物

5 我們的增長戰略 Ryan Richardson 首席戰略官

我們為下一階段增長提供的多元化模式 1.與輝瑞合作。mRNA = 信使 RNA。COVID-191 免疫腫瘤學傳染病利用輝瑞的全球基礎設施推動 COVID-19 疫苗系列的領導地位建立完全整合的全球組織,以發現、開發和商業化多產品組合推進創新 mRNA 預防和治療候選疫苗的研發渠道戰略 38

xbb.1.5 適應疫苗有效對抗多種令人擔憂的變異5 長期健康後果積累的證據表明,COVID-19 疫苗接種可以減少長期 COVID4 持續進化 SARS-CoV-21,2 風險仍然很高脆弱人羣中重度 COVID-19 的風險仍然很高3 預計將長期需要每年改造的疫苗 39 1。世界衞生組織追蹤 SARS-CoV-2 變體 www.who.int/en/activities/tracking-SARS-CoV-2 變體已於 2023 年 10 月 30 日訪問;2.共享所有流感數據的全球倡議 https://gisaid.org/ 已於 2023 年 10 月 30 日訪問;3.美國食品藥品管理局簡報文件疫苗及相關生物製品諮詢委員會會議,2023年6月15日;4 布蘭諾克等人,《自然通訊》,2023;5.Stankov M.V. 等人,medrXiv 預印本,2023 年 10 月 5 日。預計在可預見的將來,每年和/或季節性疫苗接種變異適應疫苗

具有精益商業基礎設施的全球 COVID-19 疫苗特許經營權 40 利用合作伙伴的商業基礎設施在德國和土耳其推出 Comirnaty 精益商業組織約有 55 人駐德國實地部隊 ~4,500 萬歐元 S&M 成本 YTD1 復星商業區1 輝瑞商業領地 BioNTech 商業區域 1.截至 2023 年 9 月 30 日的九個月;2.Comirnaty 在中國大陸未獲批准。S&M = 銷售和市場營銷,YTD = 年初至今。DE = 德國。

保持較高的毛利率有限的銷售和營銷費用由於合作伙伴分攤成本,COVID-19 疫苗業務的精益固定成本基礎減少了研發費用 41。毛利率平均值是根據假設使用2023年全年的預測信息計算得出的。2.S&M 平均值使用基於假設的 2023 年全年的預測信息計算得出。3.每年 COVID-19 研發支出佔2021-2023年研發支出總額的百分比。YTD = 年初至今的研發 = 2021-20231 年研發平均毛利率 2021-2021 年平均銷售和營銷費用 2021 年、2022 年和 2023 年的大致範圍 YTD3 年度 COVID-19 研發支出佔總研發支出的百分比 > 80% ~6000萬歐元 ~ 25-45%

COVID-19 疫苗市場潛力和中期增長驅動力 42 • 重置生產基地以服務流行市場 • 在一些關鍵市場轉向商業化模式 • 預計將繼續轉向單劑量小瓶和預裝注射器 • 2024 年複方和下一代疫苗的疫苗吸收量有可能增加 2024 2025 年變異適應疫苗組合疫苗下一代疫苗 COVID-19 產品特許經營權預計將繼續產生現金

我們今天的多平臺免疫腫瘤學產品線 43 第 1 階段 1/2 期 2 期 3 期 BNT211 (CLDN6) 多發性實體瘤 BNT311/GEN10463 (pd-l1x4-1BB) 多發性實體瘤 BNT411 (TLR7) 多發性實體瘤 BNT312/GEN10423 * (cd40x4-1BB) 多發性實體瘤 BNT313/GEN10533 (CD27) 多發性實體瘤 BNT316/ONC-C-392 (gotistobart) 4 (CTLA-4) 多發性實體瘤 BNT1123 mcRPC 和高風險 LPC BNT151(IL-2 變體)多種實體瘤 BNT142 多個 cldn6-pos. adv. 實體瘤 bnt325/DB-13055 () 多發性實體瘤 BNT316/ONC-392 (gotistobart) 4 (TROP2CTLA-4) Anti-pd-1/pd-L1 經歷過非小細胞肺癌 BNT323/DB-13035 (HER2) 多發性實體瘤 BNT324/DB-13115 (B7H3) 多發性實體瘤 BNT323/DB-13035 (HER2) HR+、HER2-low met。乳腺癌全新 BNT116 Adv. NSCLC BNT152 + BNT153(IL-7、IL-2)多發性實體瘤 BNT221 難治性轉移黑色素瘤 BNT321 (sleA) 轉移 PDAC BNT322/GEN10564 多發性實體瘤 autogene cevumeran/bnt1221 多發性實體瘤全新 bnt314//GEN10593 (epcamx4-1BB) 多重實體瘤計劃 mRNA 抗體細胞療法傳奇小分子 ADC BNT326/YL2026 (HER3) 多重實體瘤實體瘤全新 BNT311/GEN10463 (pd-l1x4-1BB) R/R 已滿足。NSCLC,+/-pembrolizumab BNT1112 apD (L) 1-R/R 黑色素瘤,+ cemiplimab BNT113 1L rec/met。HPV16+ PDL1+ 頭頸癌,+ pembrolizumab Autogene cevumeran/bnt1221 1L adv. 黑色素瘤,+ pembrolizumab Autogene cevumeran/bnt1221 Adj. ctdna+ 二期或三期 CRC BNT1162 1L advPD-L1 50% NSCLC,+ cemiplimab Autogene cevumeran/bnt1221 Adj. PDAC,+ atezolizumab + mfolfirinox 全新 BNT316/ONC-392(gotistobart)4(CTLA-4)Plat。-R. 卵巢癌,+ pembrolizumab BNT316/ONC-392(gotistobart)4 mcRPC,+ 計劃中的放射治療 BNT311/GEN10463(pd-l1x4-1BB)2L 子宮內膜癌,+ pembrolizumab NEW 1。與羅氏集團成員基因泰克合作;2.與 Regeneron 合作;3.與 Genmab 合作;4.與 Oncoc4 合作;5.與 DualityBio 合作;6.與 MediLink Therapeutics 合作。*兩項針對實體瘤患者的1/2期臨牀試驗正在進行中,聯合免疫檢查點抑制劑+/-化療。NSCLC = 非小細胞肺癌;mcRPC = 抗轉移性去勢前列腺癌;LPC = 侷限性前列腺癌;HPV = 人乳頭瘤病毒;PDAC = 胰腺導管腺癌;CLDN = 克勞丁;IL = 白介素;1L = 第一線;R/R = 復發/難治性;HER2/HER3 = 人類表皮生長因子 2/3;sLeA = Sialyl-Lewis A 抗原;TROP2 = 腫瘤相關鈣轉換器 2。

我們的戰略利用了2023年簽署的44份合作伙伴組織和能力協議。1. 收購剩餘的InstaDeep股份(不包括BioNTech已經擁有的股份)的總對價約為5億歐元的現金、BioNTech股票和基於績效的未來里程碑付款;AI = 人工智能。收購研發資金和合作夥伴關係全球戰略合作伙伴關係資產許可和共同開發2023年獲得許可的七種臨牀階段候選產品BioNTech擁有全球商業權利(不包括大中華區),CEPI為應對未來疫情的mRNA候選疫苗提供了高達9000萬美元的資金。四個合作伙伴關係中的八個臨牀階段項目跨階段成本分攤和共同開發協議利用合作伙伴的商業基礎設施收購的領先人工智能公司300 多名生物信息學和數據科學員工,花費約 5 億歐元1

翻譯主動投資組合管理方法 45 獲取外部創新,以節約資本的方式加速管道成熟。在所有開發階段,優先考慮領先的後期項目,以加快進入市場的路徑。強調在關鍵試驗啟動之前證明單一藥物的活性。計劃在2024年底之前在10多項潛在的關鍵性試驗中至少有六個項目在今年獲得許可的七項臨牀階段資產,預付約5億歐元。我們的目標是獲得高額收入研發投資回報率 Key指導我們研發投資的原則 GO NO R&D = 研究與開發

選擇腫瘤學項目來推動我們的下一階段發展 46 1.與羅氏集團成員基因泰克合作;2.與 Oncoc4 合作;3.與 DualityBio 合作;4.與 Genmab 合作。moA = 作用模式;CTLA-4 = 細胞毒性 T 淋巴細胞相關蛋白 4;HER2 = 人表皮生長因子 2;PD1 = 程序性細胞死亡蛋白 1;CD = 分化羣;CLDN6 = 克勞丁 6;CRC = 結直腸癌;PDAC = 胰腺導管腺癌;非小細胞肺癌;R/R = 復發/復發;HR = 激素受體;adj. = 佐劑;adv. = 高級。候選產品 BNT122/ Autogene cevumeran1 BNT316/ ONC-3922(gotistobart)BNT323/ DB-13033 BNT311/ GEN10464 BNT312/ GEN10424 BNT211 靶向個體新抗原 CTLA-4 HER2 pd-l1x4-1BB cd40x4-1BB CLDN6 合作伙伴基因泰克 Oncoc4 dualityBio Genmab Genmab — 初始適應症 1L Melanbab Oma Adj. CRC Adj. PDAC apD (L) 1-R/R NSCLC 2L+ HR+/HER2-低乳腺癌 ApD (L) 1-R/R 非小細胞肺癌待定 Advd. CLDN6+ 癌症狀態多項潛在的關鍵試驗正在進行中 Ph3 正在啟動 Ph3 計劃中的關鍵試驗待定 Pivotal Ph2 計劃於 2024 年進行多重腫瘤學規劃從 2026 年起推出各種各樣的 MOA 每個項目都有多種適應症的潛力混合了合作項目和專有項目組合

我們的計劃是在主要市場建立一支專業的腫瘤學銷售隊伍 47 在北美、歐洲和其他關鍵市場建立商業影響力1 計劃利用商業合作伙伴進行聯合商業化計劃部署具有數字支持的精益商業運營目標在2025年底之前實現商業化準備1。未顯示其他市場。

是時候休息 10 分鐘了

6 種新支柱:下一代 ADC 和免疫調節劑 Ozlem Türeci 教授,醫學博士、首席營銷官兼聯合創始人 Ilhan Celik 教授,醫學博士,臨牀開發副總裁 Michael Wenger,醫學副總裁,臨牀開發

利用下一代 ADC 和 IO 代理實現變革性組合 50 Coleman n.et al. npj Precis。Onc. 2023 下一代 ADC:潛力尚未開發的靶向細胞毒性藥物 1.ADC 與抗原 2 結合。通過內吞作用將 ADC 複合物內化 3.鏈接器裂解後釋放的有效載荷靶抗原 ADC 4.細胞核中載荷產生的細胞毒性作用旁觀者細胞毒性靶向細胞毒性旁觀者殺傷作用 A. 內化前抗原結合後釋放藥物載荷 B. 由於藥物膜通透性高,藥物載荷釋放到細胞間空間 ADC 下一代 ADC 和 IO 組合代表了當前化療和檢查點抑制劑治療方案的模式轉變,這可能有助於治療方法下一代 IO 藥物:匯聚多種經過驗證的 MOA 轉化為一個分子 BNT311 PM8002 moA = 作用機理;ADC =抗體藥物偶聯物;IO = 免疫腫瘤學;iRAE = 免疫相關不良事件;CTLA-4 = 細胞毒性 T 淋巴細胞相關蛋白 4;PD-L1 = 程序性細胞死亡配體 1 BNT316

ADC 投資組合是在深思熟慮的基礎上構建的 1rnaSeq 數據來自 AACR Project GENIE;2.與DualityBio合作*與MediLink協議的完成取決於慣例成交條件,包括哈特-斯科特-羅迪諾反壟斷改善法案的許可。ADC = 抗體藥物偶聯物;IO = 免疫腫瘤學;moA = 作用模式;HER = 人類表皮生長因子受體;TROP2 = 滋養細胞表面抗原 .UC = 尿道癌 EC = 子宮內膜癌靶向計劃階段適應症合作伙伴 Ph1/2 Ph3 HER2 BNT323/DB1303 HR+/HER2-Low mbc DualityBio 具有 HER2 表達的實體瘤 TROP2 BNT325/DB1305 實體瘤 dualityBio B7H3 BNT324/DB1311 實體瘤 dualityBio HER3 BNT326/YL202 實體瘤 mediLink* 靶向非小細胞肺癌 SCLC HER2+ BC HR+ BC TNBC 胃卵巢 PDAC 前列腺其他高表達適應症 HER2 Gynesologic TROP2 B7-H3 UC、EC HER3 高中//低非常低/無表達 • 基於 ADC 組合的非重疊腫瘤抗原和不同的有效載荷 MOA • ADC + IO 可向(新)佐劑和一線環境推進 • 四個臨牀階段 ADC,重疊適應症機會廣泛但最少 • 開闢跨越式道路的創新試驗設計 • 大型適應症的快速追隨潛力 • BNT323/DB-1300 在多項關鍵研究中有 32 項按適應症劃分的表達水平1 註冊之路上的高級資產唯一適應症選擇策略更寬的治療窗口可能允許在早期系列中使用新的組合 51

我們的產品線具有協同藥物組合的潛力 IO = 免疫腫瘤學;ADC = 抗體藥物偶聯物;MoA = 作用機制。ADC 可快速解除腫瘤的體積,而癌症疫苗可顯著增強免疫系統以根除多克隆微轉移,從而提高長期存活曲線 52 免疫調節劑激活免疫系統,支持疫苗誘導的腫瘤特異性 T 細胞反應的免疫調節劑的補充和/或潛在的協同作用 MoA 可增強 T 細胞啟動並維持激活 +IO ADC +IO IO +ADC 癌症疫苗 ADC 可提供細胞毒性藥物直接進入癌細胞,而免疫調節劑則激活免疫系統以識別和消滅癌細胞聚合檢查點抑制並改善免疫細胞運送和 ADC 穿透力

靶向 TROP2、可裂解連接劑和拓撲異構酶 I 抑制劑 (P1021) DAR:4 靶向 B7H3、可裂解連接劑和拓撲異構酶 I 抑制劑 (P1021) DAR:6 靶向 HER3,可裂解連接劑允許在細胞內和細胞外釋放拓撲異構酶 I 抑制劑 (YL0014) DAR:8 靶向 HER2,可裂解連接劑 (LAR) 101) 和 topoiso-merase I 抑制劑 (P1003) DAR:8 在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物 1.與 DualityBio 合作;2.與MediLink合作;協議的完成取決於慣例成交條件,包括哈特-斯科特-羅迪諾(“HSR”)反壟斷改善法案的許可。ADC = 抗體-藥物偶聯物;DAR = 藥物與抗體之比;HER2/3 = 人表皮生長因子受體 2/3;TROP2 = 滋養細胞表面抗原 2;mbc = 轉移性乳腺癌 BNT324/ DB-13111 BNT323/ DB-13031 BNT325/ DB-13051 BNT326/ 臨牀狀態 • HR+HER2-Low mbc 中的 Ph3 • Ph1/2 腫瘤臨牀狀態 • 多發性實體瘤中的 Ph1/2 臨牀狀態 • 多發性實體瘤的 Ph1/2 臨牀狀態 • 多發性實體瘤的 Ph1 HER2 B7H3 TROP2 HER3 53 YL2022

54 BNT323/DB-13031:一款潛在的靶向 HER2 的 ADC 1。與 DualityBio 合作;2.與第一三共合作;3.與羅氏集團成員基因泰克合作。HER2 = 人表皮生長因子受體 2;DAR = 藥物與抗體之比;Dxd = deruxtecan;DM1 = 美坦辛 moA = 作用機制;PDX = 患者衍生的異種移植;Q3W = 每 3 週一次。BNT323/DB13031 與其他靶向 HER2 的療法相比的特點 bnt323/DB-13031 Enhertu(曲妥珠單抗德魯克替康,DS8201)®,2 Kadcyla(曲妥珠單抗 emtasine,TDM1)®,3 DAR ~8 ~3.5 Linker Cleavable Cleavable 不可裂解有效載荷 moA 拓撲異構酶 I 抑制劑 (P1003) 旁觀者效應 Topoisomerase I 抑制劑 (Dxd) 旁觀者效應微管蛋白抑制劑 (DM1) 非旁觀者效應最高非嚴重毒性劑量* 80 mg/kg,Q3W*3 30 mg/kg,Q3W*3 10 mg/kg,Q3W*4

55 Lin S. 等人摘要 #252.2022 年在 ORTC-NCI-AACR 上發表。人類血漿中卓越的體外血漿穩定性腫瘤攜帶小鼠持續釋放腫瘤選擇性藥物在腫瘤細胞系中高效殺死旁觀者對猴子進行快速全身清除 DB-1303 DS-8201* C h a r n g e o f d A R f ro m b a s e lin e 120 100 60 20 0 48 96 144 192 240 288 336 384 孵育時間 (hr) C e ll n u m b e r 1f x106 8x105 6x105 4x105 2x105 0 V e h ic l e d B -1 3 0 0 0 0 0.3 µg /m l t-D M 1 ** 0 µ.3 g /m l t-D M 1 ** 0 µg /m l D B -1 0 3 0 0 0.1 µg /m l HER2-HER2 + P a yl a d (n g /m l) 0 7 14 21 14 28 42352170 免費DS-8201 的有效載荷 DB-1303 C o n c e n tr a ti o n (n g /m l) 0 150100 時間 (hr) 50 DB-1303 在血清和腫瘤中釋放有效載荷 Cmax =22.3 ng/ml 血清中的有效載荷 Cmax =0.48 ng/ml 1 .1. 與 DualityBio 合作。ADC = 抗體藥物偶聯物;HER = 人表皮生長因子受體;cmax = 最大濃度;DAR = 藥物抗體比率。*DS-8201 是 DS-8201 Trastuzumab deruxtecan 的內部生產的模擬品;**Trastuzumab-Emtansin。有效載荷-血清有效載荷-腫瘤 BNT323/DB-13031:具有潛在差異化特徵的 HER2 ADC • 具有野生型 Fc 的人源化抗HER2 Igg1 單抗體 • 專有的 DNA 拓撲異構酶 I 抑制劑 (P1003) • 基於馬來酰亞胺四肽的腫瘤選擇性可切除連接劑 (L101) • 藥物抗體比率高:~8 人源化抗HER2 Igg1 mAb

BNT323/DB-13031:臨牀前數據顯示,在HER2陽性和HER2低腫瘤模型和毒性研究中具有抗腫瘤作用和良好的安全性 56 毒性抗腫瘤作用 Lin S. 等人。摘要 #252.2022 年在 EORTC-NCI-AACR 上發表。• BNT323/DB-1303 誘導劑量依賴性腫瘤生長抑制和腫瘤消退 • HER2 陽性腫瘤模型和 HER2 低腫瘤模型均具有強效抗腫瘤作用,治療窗口較寬 T u m o r v o lu e (m 3) HER2 陽性 (HER2 2+) PDX 腫瘤模型 1000 800 400 0 0 7 14 21 28 給藥後天數 T u m o r v o lu m e (m m 3) HER2 低 (HER2 1+) PDX 腫瘤模型 800 600 400 200 7 14 21 28 天后給藥 • 毒性研究2 顯示,與已發佈的 DS-8201 的概況相比,毒性特徵有所改善 • 最高的非毒性特徵-嚴重毒性劑量:80mg/kg • BNT323/DB-1303 與已公佈的 DS-8201 簡介相比,顯示肺部發炎的風險較低 • 穩定的連接劑和快速清除可能有助於改善 BNT323/DB-1303 車輛 T-DM1 的毒性特徵,7mg/kg,單劑量 DB-1303,7mg/kg,單劑量 DB-82013,7mg/kg,單劑量,7mg/kg。DB-1303 DB-82013與 DualityBio 合作。2. 在 cynomolgus monkey 3 中。DS-8201 是內部生產的 DS-8201 的類似物,曲妥珠單抗deruxtecan HER = 人類表皮生長因子受體;ILD = 間質性肺病;PDX = 患者衍生的異種移植物。具有更高安全性和有效性的第三代 ADC 可以增加癌症患者的生存益處

首次在晚期 HER2 表達實體瘤患者中使用 BNT323/DB-13031 進行人體試驗 57 期 1/2a 期試驗設計 (NCT05150691),多中心、非隨機、開放標籤 Hamilton E. 等人提示 #9504.在 2023 年 AACR 上發表 1.與 DualityBio 合作。IHC = 免疫組織化學;FIH = 人體首例;Q3W = 每三週一次;DLT = 劑量限制毒性;HER2 = 人表皮生長因子 2;HR = 激素受體;CRC = 結直腸癌;NSCLC = 非小細胞肺癌;MTD = 最大耐受劑量;RP2D = 推薦的第 2 階段劑量;ECOG = 東方合作腫瘤小組;FPI = 首例患者;LPI = 首例患者進入;LCL PO = 最後一位出院的患者;ISH = 原位雜交;NGS = 下一代測序。DB-1303 6 mg/kg Q3W DB-1303 7 mg/kg Q3W DB-1303 8 mg/kg Q3W DB-1303 10 mg/kg Q3W DB-1303 12 mg/kg Q3W DB-1303 4.4 mg/kg Q3W DB-1303 2.2 mg/kg Q3W 第 1 部分:劑量增加(n=88 名患者)第 2a 部分:劑量擴大(n=165 名患者)適應症 • HER2+ 胃、食管或胃食管交界處腺癌,結直腸癌 • HR+/HER2-低度乳腺癌 • HER2+ 乳腺癌 • HER2 過度表達和 HER2 低子宮內膜癌 • HER2 突變的非小細胞肺癌 3 周 DLT 窗口疾病進展、撤回同意、不可接受的毒性(HER2 IHC 3+、IHC 2+、IHC 1+ 或 ISH +,或NGS 擴增 HER2,或 NGS 對 HER2 進行突變)納入標準 • 預先治療的晚期或轉移性實體瘤 • 組織學證實的 HER2 陽性或 HER2 表達癌症 • 以前的全身治療 • ECOG PS 0-1 • 器官功能充足的關鍵終點選定 MTD/RP2D 狀態下的安全性、耐受性、藥代動力學、初步抗腫瘤活性 FPI:2022 年 1 月試驗正在進行中

BNT323/DB-13031 耐受性良好,關鍵不良反應發生率低 58 階段 1/2a (NCT05150691):Safety Moore K. 等人。在2023年ASCO上發表。摘要 #3023. • 在所有劑量水平中均未觀察到 DLT • 最常見的 TRAE 為 ≥3 級:噁心(2.4%)、血小板計數下降(3.5%)、貧血(5.9%)• 未有 5 級 TeaE • 2 名患者出現間質性肺病,無任何 ≥2 級患者 • 中性粒細胞減少症患者很少(10 [11.8%]; 等級 ≥三分之一 [1.2%]患者,)和脱髮(3) [3.5%],1 級)2.2 mg/kg(n = 1)4.4 mg/kg(n = 5)6.0 mg/kg(n = 15)7.0 mg/kg(n = 29)8.0 mg/kg(n = 32)10.0 mg/kg(n = 3)總計(n = 85)任何 TeaE 1(100.0%)5(100.0%)14(93.3%)26(89.7%)26(81.2%)2 (66.7%) 74 (87.1%) 與治療停藥有關 0 0 0 0 1 (3.4%) 0 0 1 (1.2%) 與減少治療劑量相關 0 0 0 2 (6.9%) 1 (3.1%) 0 3 (3.5%) 與治療劑量中斷有關 0 0 4 (26.7%) 8 (27.6%) 5 (15.6%) 0 17 (20.0%) 等級 ≥3 0 3 (60.0%) 3 (20.0%) 9 (31.0%) 2 (6.2%) 1 (33.3%) 18 (21.2%) Serious AE 0 3 (60.0%) 4 (26.7%) 4 (13.8%)2 (6.2%) 0 13 (15.3%) 治療相關的 TEAE 1 (100.0%) 3 (60.0%) 12 (80.0%) 26 (89.7%) 25 (78.1%) 2 (66.7%) 69 (81.2%) 等級 ≥3 0 1 (20.0%) 2 (13.3%) 6 (20.7%) 1 (33.3%) 11 (12.9%) Serious AE 0 0 2 (13.3%) 0 0 0 2 (2.4%) 1。與 DualityBio 合作。DLT = 劑量限制毒性。TeaE:治療緊急不良事件。TraE:與治療相關的不良事件;aE:不良事件。

BNT323/DB-13031 在表達 HER2 的患者中顯示出令人鼓舞的抗腫瘤活性 59 1.與 Duality Bio 合作。HER2 = 人表皮生長因子受體 2;ORR = 客觀反應率;DCR = 疾病控制率;IHC = 免疫組織化學;ISH = 原位雜交;GEJ = 胃食管交界癌;eSc = 食管癌;BC = 乳腺癌;CRC = 結直腸癌;EC = 子宮內膜癌;GC = 胃癌;OC = 卵巢癌;NSCLC = 非小細胞肺癌。大量預處理 HER2 表達患者的抗腫瘤活性 ORR,% DCR,% 所有患者(n=52)44.2 88.5 HER2+ 乳腺癌(n=26)50.0 96.2 HER2 低度乳腺癌(n=13)38.5 84.6 劑量水平:3+1+ 2+HER2 IHC 狀態:-100 -50 0 100 2.2 mg/kg 4.4 mg/kg 6 mg/kg 10 mg/kg B e s t C h a n g e f ro m B a s e li n e (%) IS H + IS H + IS H + IS H + IS H + IS H + IS H + G E J B C C C C C C C C C C C C B C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C B C C R C B C B C B C B C B C B C C C C C C B C B C B C B C B C B C B C B C B C B C B C B C C B C C C C C E CB C B C B C B C B C C B C B C C C O C B C C C C C C 期 1/2a (NCT05150691):臨牀療效 Moore K. 等人。在2023年ASCO上發表。摘要 #3023.

數據支持啟動一項關鍵的3期試驗,在表達HER2的患者中評估BNT323/DB-13031 60 1.與 DualityBio 合作。HER2 = 人表皮生長因子受體 2;ORR = 客觀反應率;DCR = 疾病控制率;FIH = 人體首例;ADC = 抗體-藥物偶聯物;IHC = 免疫組織化學;PD = 進展性疾病;PR = 部分反應;SD = 穩定疾病;DLT = 劑量限制毒性;RP2D = 推薦的 2 期劑量。使用不同劑量水平和 HER2 IHC 狀態進行大量預處理 HER2 表達患者的長期反應:劑量水平:2.2 mg/kg 4.4 mg/kg 6 mg/kg 7 mg/kg 8 mg/kg 10 mg/kg 繼續治療 S u b je c ts 100500 PR SD 反應 +1 +2 +3 HER2 IHC 狀態治療持續時間(天)1/2a 期(NCT05150691):臨牀療效 Moore K. 等人。在2023年ASCO上發表。摘要 #3023.

HR+/Her2neg(佔乳腺癌患者總數的 70% 5%)HR+/HER2 低(HR+/Her2neg 乳腺癌的 60% 6)早期階段(96% 4)第四階段(4% 4)(13K)晚期/不可切除、復發(95K)內分泌療法(ET)+/-CDK4/6 抑制劑(約 90%)約 60% 的 mBC 進展為 2L8 BN8 T323/DB-1303* 和 Trastuzumab-Deruxtecan 在 HR+HER2 中作為單一療法-低 mBc 化療天真患者 Trastuzumab-Deruxtecan 化療 ET 療法/化療美國、英國、歐盟 4 和日本確診的乳腺癌患者總數:~708K1-4 adv 患者的潛在未來治療算法。/met。HR+/HER2-低度乳腺癌 BNT323/DB-1303* 為治療選擇有限的化療天真、HR+/HER2-低水平的患者提供了建立新 SoC 的潛力 61 1.美國癌症協會 (ACS) 2023 年報告;2.Globocan — 明日巨蟹座;3.Cancer.net ASCO;4.seer*Stat 研究工具;5.Putnam Expertience、來自 SMARTANALYST 聯合洞察報告的意見領袖意見以及來自已發表文獻的三角分析;6.Burstein 等人,NEJM 2020;2557-2570 7.Modi 等人,NEJM 2022;Pg 10/12;8。市場研究,數據存檔。* 與 DualityBio 合作。SoC = 護理標準;HR = 激素受體;HER2 = 人表皮生長因子受體 2;BC = 乳腺癌;CDK4/6 = 細胞週期依賴性激酶 4/6;2L = 第二線;3 線 = 第三線 3L+ 1L 2L+ 轉移性復發5 受監管批准相關患者羣體

針對未接受化療的 HR+/HER2 低乳腺癌患者的 3 期試驗設計 BNT323/DB-13031 62 1.與 DualityBio 合作;2.Twelves C. 等人臨牀乳腺癌。2022。HR = 激素受體;HR = 人類表皮生長因子;ET = 內分泌療法;ECOG = 東方合作腫瘤組;IV = 靜脈注射;Q3W = 每 3 週一次;RECIST = 實體瘤反應評估標準;PFS = 無進展存活率;OR = 客觀反應率;DoR = 疾病控制率;TTR = 反應時間;PK = 藥代儲量動力學。* 在 neo-adj 或 adj. 環境中接受過化療的受試者只要有無病間隔(定義為完成),他們就符合資格從全身化療到確診 adv. 或 met 病)的療程大於 12 個月。納入標準 • 18 歲及以上的成人蔘與者 • 已記錄晚期或轉移性 HR+/HER2-低(IHC 1+ 或 IHC 2+/ISH-)乳腺癌 • 在先前 ET 的至少 2 行或轉移性環境中的一線 ET + CDK4/6 抑制劑後的 6 個月內取得進展 • 晚期或轉移性乳腺癌之前沒有化療* • 心電圖表現狀態 0 或 1 分層因子 • 之前使用 CDK4/6 抑制劑、HER2 IHC 表達、之前在非轉移環境中使用紫杉烷隨機治療直到:• RECIST 1.1 定義的疾病進展或 • 不可接受的毒性或 • 撤回同意或 • 符合任何其他停藥標準 n=532 R 1:1 實驗組:BNT323/DB-13031 8mg/kg 靜脈注射,Q3W 研究者選擇的單劑化療(紫杉醇或納布-紫杉醇或卡培他濱)關鍵終點主要終點:PFS 次要:OS、ORR、DoR、DCR、TTR、安全性、耐受性 bability、PK 和 PRO 開放標籤、多中心、隨機 3 期試驗 (NCT06018337) 狀態試驗已於 2023 年第三季度啟動 BC 患者化療的歷史療效:2 ORR = 11-36%;MPF = 3-8 個月;mOS = 9-16 個月

子宮內膜癌中未得到滿足的需求 63 1.Sung H 等人CA:面向臨牀醫生的癌症期刊。2021;2.seer*Explorer:提供仙工智能癌症統計數據的交互式網站 [因特網]。監測研究計劃,國家癌症研究所;2023年4月19日。 [更新時間:2023 年 6 月 8 日;2023 年 8 月 17 日引用]。可從以下網址獲得:https://seer.cancer.gov/statistics-network/explorer/。數據來源:SEER 發病率數據,2022 年 11 月提交(1975-2020 年);3.Makker V 等人N Engl J Med. 2022;4.Livasy C A 等人Gynesol Oncol。2005;5.Buza N 等人Arch Pathol Lab Med. 2021;6.Santin A D 等人Am J Obstert Gynesol。2005。EC = 子宮內膜癌;HER2 = 人表皮生長因子受體 2;MPF = 無進展存活率中位數;ORR = 客觀反應率;UC = 子宮癌肉瘤。據報道,遠處轉移的 EC 患者 5 年存活率為 18% 2 2020年,全球新增心肌病例 1:417,000 + 全球心臟病新增死亡人數 1:97,000+ 第六大最常被診斷的癌症... 也是女性癌症死亡的第四大原因1 僅次於鉑類化療3 • 其中大約 25%-30% 子宮漿液性癌(USC)5 • Lenvatinib plus pembrolizumab:ORR,31.9%;MPF,7.2 個月3 • 多柔比星或紫杉醇:ORR,14.7%;MPF,3.8 個月3 HER2 蛋白過度表達和/或基因擴增出現在大約 17%-38% 的 EC4 中 • 在大約 14%-56% 的子宮癌中 4 在美國南加州大學患者中,黑人女性(90%,9/10)明顯高於白人女性(48%,8/17)6

BNT323/DB-13031 的療效為大量預處理 HER2 的子宮內膜癌患者提供了明確的註冊途徑 64 1。與 DualityBio 合作。HER2 = 人表皮生長因子受體 2;ORR = 客觀反應率;DCR = 疾病控制率;FIH = 人類首例;ADC = 抗體-藥物偶聯物;IHC = 免疫組織化學測試;ISH = 原位雜交;PD = 進展性疾病;PR = 部分反應;SD = 穩定性疾病。1/2a 期 FIH 研究 (NCT05150691):臨牀療效 Moore K. 等人在 2023 年 ESGO 上發表。摘要 # 430 Responsea 劑量遞增劑量增加總量 (n=17) b 7 mg/kg (n=4) b 8 mg/kg (n=4) b 8 mg/kg (n=9) b 未經證實的 ORR,n (%) 2 (50.0) 4 (44.4) 10 (58.8) 確認 ORR,n (%) 1 (25.0) 3 (75.0) 0 4 (23.5)) 待確認 ORR,n (%) 1 (25.0) 1 (25.0) 4 (44.4) 6 (35.3) 未經證實的 DCR,n (%) 4 (100) 4 (100) 8 (88.9) 16 (94.1) a 由研究者提出。b 可迴應評估的受試者,其中包括基線後總體反應≥1的受試者。• 患者因轉移性疾病接受了中位數2線治療 • 大約 60% 的患者有之前接受過免疫治療,大約 38% 的患者之前接受過抗 HER2 抗體 • 在 IHC 1+ 患者中觀察到臨牀反應 • 34% 的患者患有漿液性癌,ORR 87.5% B e s t c h a n g e f ro m b a s e li n e e e n e e e e e e e n e e e (%) ISH+ ISH+ ISH+ ISH+ # 受試者 30 0 -30 -60 -90 劑量水平 7 mg/8 mg/kg 2+ + 3+HER2 免疫組化狀態

靶向 TROP2、可裂解連接劑和拓撲異構酶 I 抑制劑 (P1021) DAR:4 靶向 B7H3、可裂解連接劑和拓撲異構酶 I 抑制劑 (P1021) DAR:6 靶向 HER3,可裂解連接劑允許在細胞內和細胞外釋放拓撲異構酶 I 抑制劑 (YL0014) DAR:8 靶向 HER2,可裂解連接劑 (LAR) 101) 和 topoiso-merase I 抑制劑 (P1003) DAR:8 在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物 1.與 DualityBio 合作;2.與MediLink合作;協議的完成取決於慣例成交條件,包括哈特-斯科特-羅迪諾(“HSR”)反壟斷改善法案的許可。ADC = 抗體-藥物偶聯物;DAR = 藥物與抗體之比;HER2/3 = 人表皮生長因子受體 2/3;TROP2 = 滋養細胞表面抗原 2;mbc = 轉移性乳腺癌 BNT324/ DB-13111 BNT323/ DB-13031 BNT325/ DB-13051 BNT326/ 臨牀狀態 • HR+HER2-Low mbc 中的 Ph3 • Ph1/2 腫瘤臨牀狀態 • 多發性實體瘤中的 Ph1/2 臨牀狀態 • 多發性實體瘤的 Ph1/2 臨牀狀態 • 多發性實體瘤的 Ph1 HER2 B7H3 TROP2 HER3 65 YL2022

BNT325/DB-13051 被定位為各種實體瘤的關鍵支柱 ADC 66 1.與 DualityBio 合作;2.Oncotarget。2015;6:22496-22512 3.《國際病理學》。2020 年;1—8;4。Am J Clin Exp Urol。2021 年 2 月 15 日;9 (1): 73-87。5.癌症(巴塞爾)。2022年9月;14(17):4137 TROP-2 = 滋養細胞表面抗原-2;ADC 抗體藥物偶聯物;TNBC = 三陰性乳腺癌,NSCLC = 非小細胞肺癌;IgG = 免疫球蛋白 G;maB = 單克隆抗體。BNT325/DB-13051 的關鍵特性 • 優化的藥物抗體比:~4 • 連接劑在循環中高度穩定 • 有效載荷效高,全身半衰期短 • 旁觀者抗腫瘤效應 Interchain 半胱氨酸殘留物 Linker-Payload TROP-2 作為 ADC 靶標 BNT325/DB-13051 及其三種成分:• 人源化抗體 Igg1 單抗,含活性 Fc • 專有的 DNA 拓撲異構酶 I 抑制劑 (P1021) • Cleavable linker Humanized Anti-trop2 Igg1 maB TNBC2 NSCLC3 TROP2 在多種適應症中均具有高度表達前列腺癌4 結直腸癌5

BNT325/DB13051-潛在的同類最佳瞄準 trop2 的 ADC 1。與 DualityBio 合作;2.張宇等在 EORTC-NCI-AACR 上發表。2022 年。4.吉利德;5.第一三經;5.Cheng Y 等人正面。Oncol. 2022;6.默沙東。TROP-2 = 滋養細胞表面抗原 2;ADC = 抗體藥物偶聯物;DAR = 藥物與抗體之比;HNSTD = 最高非嚴重毒性劑量;moa = 作用機制;pdx = 患者衍生的異種移植;Q3W = 每 3 週一次。Properties BNT325/DB-13051,2 Trodelvy(Sacituzumab-Govitecan)® ,3 dato-dxd4 SKB2645,6 DAR 4 ~8 ~4 7.4 Linker Cleavable 馬來酰亞胺四肽連接劑可水解 (CL2A) 基於四肽的連接劑磺酰基嘧啶-Cl2a-Caltane (TL033) Payload DNA 拓撲異構酶抑制劑 (P1021) DNA 拓撲異構酶 I 抑制劑 (SN-38) DNA 拓撲異構酶 I 抑制劑 (dxD) Belotecan 衍生物拓撲異構酶 I 抑制劑 (KL610023) 有效載荷 moA DNA 拓撲異構酶抑制劑/旁觀者效應 DNA 拓撲異構酶 I 抑制劑/旁觀者效應 DNA 拓撲異構酶 I 抑制劑/旁觀者效應 Monkey 體內 HNSTD 80 mg/kg 50 mg/kg 50 mg/kg 臨牀前比較 BNT325/DB-13051 與其他靶向 trop2 的 ADC Zhang Y. 等人在 EORTC-NCI-AACR.2022 上發表 67

BNT325/DB-13051:臨牀前數據顯示 TROP2 陽性和低腫瘤模型具有抗腫瘤作用,毒性特徵良好 68 毒性數據抗腫瘤作用 Zhang Y. 等人。在 EORTC-NCI-AACR.2022 上發表 • BNT325/DB-1305 可誘導劑量依賴性腫瘤生長抑制和腫瘤消退 • 在 TROP2 高位和低位腫瘤模型中具有強效抗腫瘤作用,治療窗口廣 • 食蟲猴的 BNT325/DB-1305 的 HNSTD 在 6 周的重複劑量毒性研究中為 80 mg/kg • 流通中游離載荷可能較低有助於提高 BNT325/DB-1305 800 600 400 200 0 7 14 21 28 天后 T u m o r v o lu m e (m m 3) 車輛,一次,i.v. DB-1305,3mpk,一次,i.v. DB-1305,10mpk,一次,i.v. ds-1062*,3mpk,一次,i.v. ds-1062*,10mpk,一次,i.v. TGI= 20.22% TGI= 37.77% TGI= 41.45% TGI= 79.89% trop2 陰性 CDX Colon-205(結腸癌)Colon205 腫瘤異種移植模型腫瘤體積平均值 ± SEM 1000400 200 0 0 0 0 7 14 21 治療開始 28 天后 T u m o r v o lu m e (m m 3) 車輛,一次,i.v. DB-1305,1mpk,一次,i.v. DB-1305,3mpk,一次,i.v. ds-1062*,1mpk,一次,i.v. tgi= 17,54% TGI= 22.11% TGI= 22.11% TGI% GI= 77.31% TGI= 92.09% trop2-High CDX MDA-MB-468(乳腺癌)MDA-MB-468 腫瘤異種移植模型腫瘤體積mean ± SEM *DS-1062 是內部生產的 Dato deruxtecan 1 的模擬物。與 DualityBio 合作。TROP-2 = 滋養細胞表面抗原 2;CDX = 細胞衍生異種移植。HNSTD = 非嚴重毒性的最高劑量;SEM = 平均值的標準誤差。

首次在晚期/轉移性實體瘤患者中使用BNT325/DB-13051進行人體試驗 1。與 DualityBio 合作。ECOG PS = 東方合作腫瘤組表現狀態;DL = 劑量水平;Q3W = 每三週一次;RP2D = 推薦的 2 期劑量;HR = 激素受體;HER2 = 人類表皮生長因子受體 2;非小細胞肺癌;TNBC = 三陰性乳腺癌;DLT = 劑量限制毒性;TEAE = 治療緊急不良事件;SAE = 嚴重不良事件;MSAE = 嚴重不良事件;TD = 最大耐受劑量;ORR = 客觀反應率。69 1/2 期試驗設計 (NCT05438329),多中心,非隨機,開放標籤,n=255 第 1 部分:劑量增加第 2 部分:劑量擴大適應症 • 具有可操作基因組改變的非小細胞肺癌 • 卵巢癌 • HR+/HER2-neg 乳腺癌 • 事先未接受薩西妥珠單抗 govitecan 治療的 TNBC • sacituzumab govitecan 治療失敗的 TNBC RP2D Q3W 疾病進展、撤回同意、不可接受的毒性 DB-1305 DL3 Q3W DB-1305 DL4 Q3W W DB-1305 DL2 Q3W DB-1305 DL5 Q3W DB-1305 DL1 Q3W 納入標準 • 晚期/不可切除、復發或轉移性實體瘤 • 標準系統性實體瘤當天或之後復發或進展治療 • ECOG PS 0-1 • 器官功能充足關鍵終點主要:第 1 部分:DLT、TEAE、SAE、MTD、RP2D 的評估。第 2a 階段:TeaE、SaeS、ORR 次要階段:藥代動力學措施試驗正在進行中

BNT325/DB-13051 顯示了可管理的安全配置文件 1。與 DualityBio 合作。DLT = 劑量限制毒性;MTD = 最大耐受劑量;TRAE = 與治療相關的不良事件;AE = 不良事件;FIH = 首次出現人體。ILD = 間質性肺病。總體安全性 • DB-1305 可耐受,所有 TRAE 在 2 mg/kg 和 4 mg/kg 的劑量水平下均可控制 • 三名劑量為 6 mg/kg 的患者出現了劑量限制毒性(即口腔炎、發熱性中性粒細胞減少和白細胞減少)• 最大耐受劑量確定為 5 mg/kg • 出現了 1 個 ILD • 沒有 TRAE 導致死亡 70 期 1/2a FIH 研究 (NCT05150691):安全 Marathe O. 等人。在 2023 年 ESMO 上發表。海報 #689P. 2 mg/kg (n=1) n (%) 4 mg/kg (n=20) n (%) 5 mg/kg (n=17) n (%) 6 mg/kg (n=6) n (%) 總計 (n=44) n (%) 任何 traE 0 19 (95.0) 15 (88.2) 6 (100) 41 (93.2) 等級 ≥3 1 (100) 13 (65) 6 (35.3) 5 (83.3) 25 (56.8) Serious TraE 0 3 (15.0) 4 (23.5) 3 (50.0) 10 (22.7) 導致劑量減少 0 1 (5.0) 2 (11.8) 3 (50.0) 6 (13.6) 導致劑量中斷 0 6 (30.0) 5 (29.4) 4 (66.7) 15 (34.1) 導致劑量中斷停藥 0 1 (5.0) 0 0 1 (2.3) 一名患者在首次給藥後的第 18 天死於自殺,一名患者在第 49 天出現雙重肺炎相關的 AE。

1。與 DualityBio 合作。FIH = 人類第一;ORR = 客觀反應率;DCR = 疾病控制率;NSCLC = 非小細胞肺癌;CRC = 結直腸癌;TNBC = 三陰性乳腺癌;GC = 胃癌;GEJC = 胃食管交界癌。未經證實的 ORR,% 未確診的 DCR,% 所有患者 (n=23) 30.4 87.0 非小細胞肺癌(n=13)46.2 92.3 所有接受過基線後掃描的患者的最佳腫瘤反應(n=23)大量預先接受過治療的患者的抗腫瘤活性 71 劑量水平 2 mg/kg 4 mg/kg 6 mg/kg B e s t c h a s e lin e (%) 主題名稱或標識符 50 0 -50 N S C L C F a llo p ia n t u b e a m p u lla ry N S C L C N S C L C C N S C L C L C N S C L C C N S C L C L C C N S C L C C C C L C C C L C C C L C C C L C C L C C C L C C L C C L C C L C C L C C C D U O D E N A L A P P E N DIC E A L N S C L C T N B C N S C L C C R C N S C L C C R C N S C L C C R C BNT325/DB-13051 在非小細胞肺癌和其他實體瘤 FIH 第 1/2 期研究(NCT05438329)中顯示出具有前景的抗腫瘤活性:臨牀療效 Marathe O. 等人在 2023 年 ESMO 上發表。海報 #689P.

ADC 關鍵要點 BNT323/DB13031 • 計劃進行多項關鍵研究 BNT324/DB-13111 I BNT325/DB-13051 I BNT326/YL2022 • 正在進行的研究將為多個擴張隊列的潛在活動提供信息並推動未來的開發決策 • 研究單一療法或聯合療法 1.與 DualityBio 2 合作。MediLink。ADC = 抗體藥物偶聯物。有針對性的里程碑策略 • 利用 ADC 作為減少腫瘤腫塊的工具,釋放難以治療的癌症類型的潛力 • 探索各種適應症選擇策略 • 利用 ADC 廣泛的治療窗口,在早期的治療系列中啟用新的組合 73

一種基於 HexaBody 技術的 CD27 抗體,經過專門設計,可在靶標與 T 細胞膜結合後形成抗體六聚體。BNT313/ GEN10532 臨牀狀態 • 多發性實體瘤中的 Ph1/2 單特異抗體具有優化 Fc 靶向 CTLA-4,由於 pH 驅動機制,有選擇地消耗 TME 中腫瘤浸潤 Treg,但不會消耗外周腫瘤浸潤 Treg。BNT316/ ONC-3921(gotistobart)臨牀狀態 • 多發性實體瘤中的 Ph1/2 • Proc 中的 Ph2 • 2L+ mnsCLC 雙特異性抗體中的 Ph3 可抑制 PD1 陽性細胞的增殖。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT311/ GEN10462 臨牀狀態 • 多發性實體瘤中的 Ph1/2 • mnsCLC 中的 Ph2 • 2L mec 中的 pH2 CD40 的參與會導致 APC 的激活和成熟。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT312/ GEN10422 臨牀狀態 • 多發實體瘤雙特異性抗體的 Ph1/2 試驗,旨在通過依賴 epcam 的 4-1BB 激動活性增強抗腫瘤免疫反應。BNT314/ GEN10592 臨牀狀態 • 計劃治療多發性實體瘤 Ph1/2 1。與 Oncoc4 合作;2.與 Genmab 合作;3.與 Biotheus 合作。CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;CD27、CD40、4-1BB = 腫瘤壞死因子受體超家族成員;PD-1 =程序性細胞死亡蛋白 1;HER2 = 人類表皮生長因子受體 2;ADCC = 抗體依賴細胞介導的細胞毒性;ADCP = 抗體依賴性細胞吞噬作用;PROC = 耐鉑卵巢癌;NSCLC = 非小細胞肺癌;EC = 子宮內膜癌 APC = 抗原呈遞細胞;VEGF = 血管內皮生長因子;TME = 腫瘤微環境;CtX = 化療;LALA = IgG1 變體L234A/L235A。腫瘤中 PD-L1 的表達或上調可能會將 VEGF 中和功能豐富到 TME 中,從而抑制血管新生。PM80023 臨牀狀態 • ph1b 劑量增加 • pH2A 可作為多種癌症的單一療法 • Ph2 與 ctX 聯合治療多種癌症在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物抗CD27Anti-ctla4 anti-1bbanti-pd-L1 Anti-4-1bbepcam Anti-4-1bbepcam Anti-pd-L1 Anti-pd-la Fc 74

一種基於 HexaBody 技術的 CD27 抗體,經過專門設計,可在靶標與 T 細胞膜結合後形成抗體六聚體。BNT313/ GEN10532 臨牀狀態 • 多發性實體瘤中的 Ph1/2 單特異抗體具有優化 Fc 靶向 CTLA-4,由於 pH 驅動機制,有選擇地消耗 TME 中腫瘤浸潤 Treg,但不會消耗外周腫瘤浸潤 Treg。BNT316/ ONC-3921(gotistobart)臨牀狀態 • 多發性實體瘤中的 Ph1/2 • Proc 中的 Ph2 • 2L+ mnsCLC 雙特異性抗體中的 Ph3 可抑制 PD1 陽性細胞的增殖。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT311/ GEN10462 臨牀狀態 • 多發性實體瘤中的 Ph1/2 • mnsCLC 中的 Ph2 • 2L mec 中的 pH2 CD40 的參與會導致 APC 的激活和成熟。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT312/ GEN10422 臨牀狀態 • 多發實體瘤雙特異性抗體的 Ph1/2 試驗,旨在通過依賴 epcam 的 4-1BB 激動活性增強抗腫瘤免疫反應。BNT314/ GEN10592 臨牀狀態 • 計劃治療多發性實體瘤 Ph1/2 1。與 Oncoc4 合作;2.與 Genmab 合作;3.與 Biotheus 合作。CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;CD27、CD40、4-1BB = 腫瘤壞死因子受體超家族成員;PD-1 =程序性細胞死亡蛋白 1;HER2 = 人類表皮生長因子受體 2;ADCC = 抗體依賴細胞介導的細胞毒性;ADCP = 抗體依賴性細胞吞噬作用;PROC = 耐鉑卵巢癌;NSCLC = 非小細胞肺癌;EC = 子宮內膜癌 APC = 抗原呈遞細胞;VEGF = 血管內皮生長因子;TME = 腫瘤微環境;CtX = 化療;LALA = IgG1 變體L234A/L235A。腫瘤中 PD-L1 的表達或上調可能會將 VEGF 中和功能豐富到 TME 中,從而抑制血管新生。PM80023 臨牀狀態 • ph1b 劑量增加 • pH2A 可作為多種癌症的單一療法 • Ph2 與 ctX 聯合治療多種癌症在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物抗CD27Anti-ctla4 anti-1bbanti-pd-L1 Anti-4-1bbepcam Anti-4-1bbepcam Anti-pd-L1 Anti-pd-la Fc 75

避免溶酶體降解 CTLA-4 以獲得更安全、更有效的免疫治療,可能會使癌症治療效果與免疫療法相關的不良反應分化機制有可能成為同類最佳的抗 CTLA-4 抗體 76 1. 與 Oncoc4 合作。FcR = 片段可結晶區,CTLA-4 = 細胞毒性 T 淋巴細胞相關蛋白 4,ADCC = 抗體依賴性細胞介導的細胞毒性,ADCP = 抗體依賴性細胞吞噬作用 BNT316/ONC-392(gotistobart)1 旨在:• 允許定期回收和富集抗體和 CTLA-4 分子 • 增強抗腫瘤免疫力 • 減少免疫相關不良事件內體 pH 值

C 部分:劑量擴大(Hu-Lieskovan 等人。海報 #594.在 SITC 2022 上發表)A部分和B部分:劑量測定(Li T. 等人海報 #949,在 SITC 2021 上發表)PRESERVE-001:1/2 期試驗設計和安全數據 77 1. 與 Oncoc4 合作。Q3W = 每三週一次;MTD = 最大耐受劑量;RP2D = 推薦的第 2 階段劑量;DLT = 劑量限制毒性;TRAE = 與治療相關的不良事件;HNSCC = 頭頸部鱗狀細胞癌;NSCLC = 非小細胞肺癌;irae = 免疫相關不良事件,IO = 免疫腫瘤學,R/R = 復發/難治性。A 部分:單一療法的 MTD 或 RP2D B 部分:與 pembrolizumab 聯合使用的 MTD 或 RP2D • 晚期或轉移性實體瘤伴有可測量或不可測量的疾病 • 儘管有標準的護理療法,但仍有進展 ONC-392 0.1 mg/kg ONC-392 0.3 mg/kg Q3W ONC-392 1.0 mg/kg Q3W ONC-392 3.0 mg/kg Q3W ONC-392 10.0 mg/kg Q3W 調查結果適應症:單一療法 • 胰腺癌 • 非小細胞肺癌 • IO R/R NSCLC • HNSCC • 三陰性乳腺癌 • 卵巢癌 • 其他多發性實體瘤 RP2D Q3W • IO naíve Nasclc • IO R/R非小細胞肺癌 • IO 天真黑色素瘤 • IO R/R 黑色素瘤適應症:與派姆博利珠單抗合用 >450 名患者使用 BNT316/ONC-392(gotistobart)1 作為單一療法,與彭博利珠單抗聯合使用耐受性良好 • TRAE 可管理,無 DLT,MTD 未達到 • 單一療法 RP2D:10 mg/kg,組合 RP2D:6 mg/kg 初步數據顯示,iRAE 率低於同類 IO 或 IO-IO 組合的觀測值。安全性特徵允許在單一療法和與 pembrolizumab 聯合治療中使用更高的劑量和更長的治療時間

BNT316/ONC-392(gotistobart)(3 或 6mg/kg)與 pembrolizumab Hu-Lieskovan 等人聯合使用。海報 #594.在 2022 年 SITC 上發表 BNT316/ONC-392(gotistobart)單一療法(10mg/kg),用於耐鉑卵巢癌患者 Hays J 等人。海報 #564.在 SITC 2022 上發表% C h a n g e f ro m b a s e lin t a rg e t l e s io n s 30% 20% 10% 0% -10% -20% -30% -40% -60% -70% * sdsdsdpd pd pd pd pd pd pd pd pd pd pd pd pd pd pd crprprprpr 60% 40% -80% 138% 的臨牀功效 BNT316/ONC-392(gotistobart)1 作為單一藥劑聯合用於多發性實體瘤患者 78 1. 與 Oncoc4 合作。CR = 完全緩解;PR = 部分反應;SD = 疾病穩定;PD = 進展性疾病;ORR = 客觀反應率;DCR = 疾病控制率,Ipi = 伊皮利木單抗,Nivo = nivolumab,Pem = 培美曲塞,Tx = 治療,T-VEC = talimogen laherparepvec,Atezo = 阿替珠單抗,R/R = 復發 /耐火材料。最佳總體反應 30% 20% 10% 0% -10% -20% -30% -40% -60% -70% -80% 最佳總體反應 14/28 pts。含臨牀活動 • CR/PR/SD/PD = 1/5/8/14 • ORR = 21%,DCR= 50% 8/10 pts。含臨牀活動 • 以 3 mg/kg(6 分):2 PR,3 SD • 以 6 mg/kg(4 分):1 PR,2 SD BNT316/ONC-392(gotistobart)(6mg/kg)與 r/R Melanoma Hu-Lieskovan 等人中的 pembrolizumab 合用,海報 #594.在 SITC 2022 上發表 6 pts.s. 有臨牀活動 • 5 PR,1 SD% C h a n g e f ro m b a s line e i n t a rg e t l e s io n s pd 最佳總體反應% C h a n g e f ro m b a s e line e i n t a rg e

PRESERVE-001:1/2a 期多中心、非隨機、開放標籤、多劑量、FIH 試驗 (NCT04140526) He K. 等人在 ASCO 2023 上發表,摘要 #9024.數據支持啟動關鍵3期試驗,評估耐CPI非小細胞肺癌的BNT316/ONC-392(gotistobart)1 靶病變最佳整體反應(N=27 可評估)劑量 10 mg/kg x 2,然後是 6 mg/kg,q3w(2 分:10 mg/kg x 4,q3w)目標病變百分比隨時間推移而變化(N = 27 可評估)給藥;10 mg/kg x 2,然後是 6 mg/kg,q3w(2 分:10 mg/kg x 4,q3w)從 c1D1 -100 -50 0 50 100 100 200 400 P e rc e n g e c h a n g e o f t o f t a rg e t l e s io n s f ro m b a s e line 在耐藥性非小細胞肺癌中觀察到抗腫瘤活性患者 (n=27) -100 -500 50 100 S D S D S D S D S D C R P R P P D P D P D P D P D P D S D P D P D S D P P R S D S D S D S D S D P P P P P P P P P R P P P P P R P D Subject p e e rc h a n g e o f t a rg e o f a rg e EventSorr:29.6%(22.2% 已確認,7.4% 未確認)DCR:70.4% 的非小細胞肺癌3期試驗正在進行中 1. 與 Oncoc4 合作。CPI = 檢查點抑制劑;非小細胞肺癌 = 非小細胞肺癌;FIH = 人類首例;IO = 免疫腫瘤學;ORR = 客觀反應率;DCR = 疾病控制率;pts = 患者;q3w = 3 周時間表;C1D1 = 週期第 1 天。

病例報告顯示了對 BNT316/ONC-392(gotistobart)的臨牀反應 1 80 1。與 Oncoc4 合作。PD-L1 = 程序性細胞死亡蛋白 L1;TMB = 腫瘤突變負擔;化學放射治療;PET/CT = 正電子發射成像/計算機斷層掃描 64 歲男性診斷 2021 年 8 月肺部鱗狀細胞癌,100 包年吸煙史(15 年前戒煙)腫瘤 PD-L1

非小細胞肺癌免疫治療後的 2L 治療選擇有限 81 1.凱度癌症影響治療架構;2.泰國 AA 等《柳葉刀》。2021;3.市場研究,存檔數據;4.與 Oncoc4 合作。NSCLC = 非小細胞肺癌;IO = 免疫腫瘤學;VegFi = 血管內皮生長因子抑制劑;TROP-2 = 滋養細胞表面抗原 2;CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;ORR = 客觀反應率;mOS = 總存活率中位數。約 50% 具有可操作驅動因子突變2 IO +/-鉑類化療約 60%,無驅動因素突變進展為 2L3 Docetaxel +/-VegFi IO/IO +/-鉑類化療 PRESERVE-003 BNT316/ONC-392(gotistobart)4 單一療法美國、英國、歐盟確診的轉移性非小細胞肺癌患者總數 4和日本:~375K1 潛在的未來治療算法 — 無驅動突變的轉移性非小細胞肺癌 1L 2L+ ~ 50% 沒有可操作的驅動突變(~190K)2 多西他賽單一療法的歷史功效(Garon 等人Lancet。2014):ORR ~ 10%;MPF = 3 個月;mOS = 9 個月 BNT316/ONC-392(gotistobart)可以為 2L 非小細胞肺癌患者提供額外的治療選擇 TROP2 ADC 視監管批准相關的患者羣體而定

評估耐藥性 CPI 非小細胞肺癌 82 中的 BNT316/ONC-392(gotistobart)1 的第 3 階段試驗 1 1。與 OnCOc4 合作;CPI = 檢查點抑制劑;NSCLC = 非小細胞肺癌;PD-1 = 程序性細胞死亡蛋白 1;IO = 免疫腫瘤學;RESCIST = 實體瘤反應評估標準;Q3W = 每三週一次;(中位數)OS =(中位數)總存活率;ORR = 無進展存活率(中位數);ECOG = 東方合作腫瘤小組;FPD = 第一位患者給藥。PRESERVE-003 (NCT05671510) 隨機、開放標籤、主動對照、多中心 3 期試驗 I 階段(劑量確認階段):評估兩種BNT316/ONC-392 給藥方案與多西他賽第二階段對比的療效和安全性:評估選定給藥方案中BNT316/ONC-392 與多西他賽單一療法的歷史療效(Garon 等人。Lancet。2014):ORR ~ 10%;mPF = 3 個月;mOS = 9 個月 R 1:1 N=480 納入標準 • ≥ 18 年 IV 期,轉移性非小細胞肺癌 • 以前 PD-(L) 1 +/-鉑類化療 • 允許事先使用 IO-IO • RECIST 1.1 可測量病變 R 1:1:1 N=120 BNT316/ONC-392 (gotistobart) 6kg 2 個裝載劑量為 10mg/kg,Q3W(N=40)BNT316/ONC-392(gotistobart)3mg/kg,Q3W(N=40)多西他賽 75 mg/kg,Q3W(N=40)Docetaxel 75 mg/kg,Q3W(N=240)待定:mg/kg,Q3W 主要終點:OS 次要:ORR、PFS、Safety BNT316/ONC-392(gotistobart)狀態試用正在進行中招聘

一種基於 HexaBody 技術的 CD27 抗體,經過專門設計,可在靶標與 T 細胞膜結合後形成抗體六聚體。BNT313/ GEN10532 臨牀狀態 • 多發性實體瘤中的 Ph1/2 單特異抗體具有優化 Fc 靶向 CTLA-4,由於 pH 驅動機制,有選擇地消耗 TME 中腫瘤浸潤 Treg,但不會消耗外周腫瘤浸潤 Treg。BNT316/ ONC-3921(gotistobart)臨牀狀態 • 多發性實體瘤中的 Ph1/2 • Proc 中的 Ph2 • 2L+ mnsCLC 雙特異性抗體中的 Ph3 可抑制 PD1 陽性細胞的增殖。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT311/ GEN10462 臨牀狀態 • 多發性實體瘤中的 Ph1/2 • mnsCLC 中的 Ph2 • 2L mec 中的 pH2 CD40 的參與會導致 APC 的激活和成熟。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT312/ GEN10422 臨牀狀態 • 多發實體瘤雙特異性抗體的 Ph1/2 試驗,旨在通過依賴 epcam 的 4-1BB 激動活性增強抗腫瘤免疫反應。BNT314/ GEN10592 臨牀狀態 • 計劃治療多發性實體瘤 Ph1/2 1。與 Oncoc4 合作;2.與 Genmab 合作;3.與 Biotheus 合作。CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;CD27、CD40、4-1BB = 腫瘤壞死因子受體超家族成員;PD-1 =程序性細胞死亡蛋白 1;HER2 = 人類表皮生長因子受體 2;ADCC = 抗體依賴細胞介導的細胞毒性;ADCP = 抗體依賴性細胞吞噬作用;PROC = 耐鉑卵巢癌;NSCLC = 非小細胞肺癌;EC = 子宮內膜癌 APC = 抗原呈遞細胞;VEGF = 血管內皮生長因子;TME = 腫瘤微環境;CtX = 化療;LALA = IgG1 變體L234A/L235A。腫瘤中 PD-L1 的表達或上調可能會將 VEGF 中和功能豐富到 TME 中,從而抑制血管新生。PM80023 臨牀狀態 • ph1b 劑量增加 • pH2A 可作為多種癌症的單一療法 • Ph2 與 ctX 聯合治療多種癌症在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物抗CD27Anti-ctla4 anti-1bbanti-pd-L1 Anti-4-1bbepcam Anti-4-1bbepcam Anti-pd-L1 Anti-pd-la Fc 83

BNT311/GEN1046 — 將檢查點封鎖和條件性 T 細胞共刺激相結合 84 1.與 Genmab 合作;Fc = 片段可結晶區域;PD —L1 = 程序性細胞死亡配體 1;PD-1 = 程序性細胞死亡蛋白 1;NK 細胞 = 自然殺傷細胞;。Inert Fc,以 PD-L1 結合為條件的雙靶向 4-1BB 共同刺激 BNT311/GEN1046 結合親和力:KD PD-L1:0.16 nmol/L,4-1BB:0.15 nmol/L 4-1BB 表達 T 細胞(例如 T 細胞)條件 4-1BB 激動劑活性 PD-1 PDL-1 4-1BB BNT311/ GEN1046 阻斷檢查點招募免疫細胞增強 NK 細胞活性浸潤免疫細胞重新激活衰竭 T 細胞增強 T 細胞激活 T 細胞增殖和分化增強效應器 T 細胞活性 PD-1 GEN 1046 PD-L1 4-1BB Perforin Granyme 趨化因子 PD-L1:在腫瘤細胞上表達的受體配體,可抑制 PD1 陽性細胞的增殖,並在免疫逃避中起作用。兩個經過驗證的靶標的條件雙特異性分子:4-1BB:在 T 和 NK 細胞上表達的共刺激性腫瘤壞死因子。激活 4-1BB 途徑可增強 T 細胞增殖、T 細胞效應器功能並防止 T 細胞死亡。Muik A 等人Cancer Discov 2022;12:1248 −1345。

BNT311/GEN10461 — 臨牀前數據 85 1.與 Genmab 合作。CPI = 檢查點抑制劑;PD-L1 = 程序性細胞死亡配體 1;ctrl = 對照。BNT311/GEN1046 的 4-1BB 激動劑活性嚴格以 PD-L1 結合 Muik A 等為條件。Cancer Discov 2022;12:1248 −1345。P D -1 /P D-L 1 b lo c k a d e(for ld i n c re a s e)8 6 4 2 0 0.001 0.01 1 1 10 100 抗體濃度 (µg/mL) bnt311/Gen1046 Anti—pd-L1 mab Atezolizumab 類似物 Isotype ctrl bnt311/Gen1046 在缺少的情況下阻塞 PD-1/PD-L1 軸 4-1BB 結合,表明其 PD-L1 特異性 Fab 組還具有經典免疫功能 CPI BNT311/GEN1046 在體內表現出抗腫瘤活性

首次在轉移性或不可切除的實體瘤患者中使用BNT311/GEN10461進行人體試驗 1。與 Genmab 合作。Q2W = 每三週一次;PD = 進行性疾病;NSCLC = 非小細胞肺癌;HNSCC = 頭頸部鱗狀細胞癌;TNBC = 三陰性乳腺癌;RECIST = 實體瘤的反應評估標準。擴展劑量 100 mg Q3W 關鍵終點安全性、藥代動力學、免疫原性、藥效學和抗腫瘤活性(RECIST v1.1)狀態招募 13 個擴展隊列 86 個第 2 期劑量擴展隊列:• NSCLC-1L,單一療法 • 非小細胞肺癌-1L,+ pembrolizumab 單抗和化療 • NSCLC(鱗狀)-1L、+ pembrolizumab 和化療 PD-(L) -1 抑制劑預處理隊列:• 宮頸癌 • 子宮內膜癌 • HNSCC • TNBC • 尿路上皮癌納入標準 • 轉移性或不可切除的實體瘤 • 患者不適合標準療法 1 期劑量增加 (N=61) BNT311/GEN1046 靜脈注射固定劑量 Q3W 直到 PD 或不可接受的毒性 1/2a 期試驗設計 (NCT03917381),多中心、非隨機、開放標籤

BNT311/GEN10461 單一療法在劑量遞增方面的初步結果顯示出可控的安全性和臨牀活性 1。與 Genmab 合作。DLT = 劑量限制毒性;MTD = 最大耐受劑量;TEAE = 治療出現的不良事件;TRAE = 與治療相關的不良事件,TNBC = 三陰性乳腺癌;NSCLC = 非小細胞肺癌;CPI = 檢查點抑制劑;AST = 天冬氨酸轉氨酶;ALT = 丙氨酸轉氨酶。劑量增加隊列 TEAE 發生在 ≥ 10% 的患者中,所有等級,n (%) 等級 ≥3,n (%) ≥ 10% 的患者中任何 TRAE 43 (70.5) 17 (27.9) TRAE,按首選術語提高 AST 增加 AST 增加甲狀腺功能減退疲勞 14 (23.0) 13 (21.3) 11 (13.0) 8 (13.1) 5 (8.2) 2 (3.3) 1 (1.6) 1 (1.6) 1/2a 期 FIH 試驗 (NCT03917381):安全性和有效性、劑量遞增單一療法 Garralda E. 等人在 SITC 2020 上發表,海報 #412. 87 在劑量遞增階段,BNT311/GEN10461 在劑量增加階段表現出可控的安全性和初步臨牀活性預先治療的晚期實體瘤人羣:• 65.6%(40/61)的患者在隨訪3個月的中位數中實現了疾病控制 • TNBC(1)、卵巢癌(1)和CPI預治療的非小細胞肺癌(2)患者有4種早期部分反應 • 大多數不良反應為輕度至中度:• 43名(70.5%)患者出現TRAE •17名患者(27.9%)患者 • 未達到 MTD • 6 名患者患有 DLT;所有 6 名患者均已康復,無後遺症數據截止日期:2020 年 8 月 31 日。

BNT311/GEN10461 單一療法對包括非小細胞肺癌88 1在內的PD-(L)1治療失敗的晚期實體瘤患者顯示出療效 1。與 Genmab 合作;PD-L1 = 程序性細胞死亡配體 1;NSCLC = 非小細胞肺癌;CPI = 檢查點抑制劑;。1/2a 期 FIH 試驗 (NCT03917381):臨牀療效,100 毫克 Q3W 單一療法 Ponce Aix S. 等人在 SITC 2021 上發表,海報 #516.b e s t re la ti v e c h a n g e i n s u m o f d ia m e rs f ro m b a s e li n e,% 40 20 0 -20 -40 PD-L1+ PD-L1-• BNT311/GEN1046 在先前 CPI 治療失敗的患者羣中獲得早期反應 • 根據腫瘤 PD-L1 狀態和抗PD-1組合療法進行患者選擇正在探索中,可通過 GEN1046 在 PD-L1+ 腫瘤中減少 7/11 腫瘤來提高臨牀療效。根據腫瘤 PD-L1 狀態*在 CPI 經歷的非小細胞肺癌患者的臨牀活性(n=25)數據截止日期:2021 年 9 月 21 日。*apd-L1 狀態基於對在先前最後一次治療進展後以及第一劑BNT311/GEN1046之前採集的新鮮腫瘤活檢標本的分析。

正在進行的 2 期試驗,將 BNT311/GEN10461 作為單一藥物以及與 Pembrolizumab 聯合治療非小細胞肺癌和子宮內膜癌 89 1.與 Genmab 合作;50:50 的盈虧合作。NSCLC = 非小細胞肺癌;PD-L1 = 程序性細胞死亡配體 1;FPD = 首例患者給藥;CPI = 檢查點抑制劑;TPS = 腫瘤比例評分;R/R = 復發/難治性。非小細胞肺癌子宮內膜癌納入標準 IV 期轉移 R/R NSCLC (2L+) PD-L1 TPS ≥ 1% 先前使用抗體 pD-(L) 1 治療經歷過晚期子宮內膜癌 (2L) 隊列 A:CPI 天真隊列 B:有CPI 經驗的治療組 • A:BNT311/GEN1046 單一療法 • B:BNT311/GEN1046 + pembromb46 Pembrolizumab (Q3W) • C: BNT311/GEN1046 + pembrolizumab (Q6W) • bnt311/Gen1046 + pembrolizumab 狀態 • 招聘 • FPD 預計於 2023 年 11 月進行 IO 後非生物學關鍵試驗的設計小細胞肺癌計劃在2024年的醫學會議上公佈數據下一步新增

一種基於 HexaBody 技術的 CD27 抗體,經過專門設計,可在靶標與 T 細胞膜結合後形成抗體六聚體。BNT313/ GEN10532 臨牀狀態 • 多發性實體瘤中的 Ph1/2 單特異抗體具有優化 Fc 靶向 CTLA-4,由於 pH 驅動機制,有選擇地消耗 TME 中腫瘤浸潤 Treg,但不會消耗外周腫瘤浸潤 Treg。BNT316/ ONC-3921(gotistobart)臨牀狀態 • 多發性實體瘤中的 Ph1/2 • Proc 中的 Ph2 • 2L+ mnsCLC 雙特異性抗體中的 Ph3 可抑制 PD1 陽性細胞的增殖。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT311/ GEN10462 臨牀狀態 • 多發性實體瘤中的 Ph1/2 • mnsCLC 中的 Ph2 • 2L mec 中的 pH2 CD40 的參與會導致 APC 的激活和成熟。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT312/ GEN10422 臨牀狀態 • 多發實體瘤雙特異性抗體的 Ph1/2 試驗,旨在通過依賴 epcam 的 4-1BB 激動活性增強抗腫瘤免疫反應。BNT314/ GEN10592 臨牀狀態 • 計劃治療多發性實體瘤 Ph1/2 1。與 Oncoc4 合作;2.與 Genmab 合作;3.與 Biotheus 合作。CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;CD27、CD40、4-1BB = 腫瘤壞死因子受體超家族成員;PD-1 =程序性細胞死亡蛋白 1;HER2 = 人類表皮生長因子受體 2;ADCC = 抗體依賴細胞介導的細胞毒性;ADCP = 抗體依賴性細胞吞噬作用;PROC = 耐鉑卵巢癌;NSCLC = 非小細胞肺癌;EC = 子宮內膜癌 APC = 抗原呈遞細胞;VEGF = 血管內皮生長因子;TME = 腫瘤微環境;CtX = 化療;LALA = IgG1 變體L234A/L235A。腫瘤中 PD-L1 的表達或上調可能會將 VEGF 中和功能豐富到 TME 中,從而抑制血管新生。PM80023 臨牀狀態 • ph1b 劑量增加 • pH2A 可作為多種癌症的單一療法 • Ph2 與 ctX 聯合治療多種癌症在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物抗CD27Anti-ctla4 anti-1bbanti-pd-L1 Anti-4-1bbepcam Anti-4-1bbepcam Anti-pd-L1 Anti-pd-la Fc 90

BNT312/GEN10421 — 旨在增強 T 細胞和 APC Synapse 91 的雙特異性抗體 1.與 Genmab 合作。APC = 抗原呈遞細胞;Fc = 片段可結晶區;CD = 分化羣;HLA = 人類白細胞抗原;TCR = T 細胞受體;MHC = 主要組織相容性複合體。Muik A 等人J Immunother Cancer 2022 CD40:主要在 APC 上表達的刺激性受體。CD40的參與會激活和成熟APC的 “雙條件” “雙激動劑” 分子,用於兩個經過臨牀前驗證的靶點:4-1BB:在T和NK-細胞上表達的共刺激性腫瘤壞死因子。激活 4-1BB 途徑可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡 Inert Fc 以避免有害免疫細胞交聯 4-1BB 表達細胞(例如 T 細胞)4-1BB GEN1042 GEN1042 CD40 表達 CD40 的 APC(例如,樹突狀細胞增強自然殺傷 (NK) 細胞活性共刺激分子的表達,例如 HLA-DR、CD86 CD86/HLA-DR GEN 1042 CD40 1BB Perforin Granyme TCR-MHC 受體細胞因子 CD28/CD80 受體 APC 成熟刺激性細胞因子產物腫瘤引流淋巴結 T 細胞增殖和分化增強效應 T 細胞活性 Inert Fc、雙條件、雙重 CD40×4-1BB 激動劑條件 CD40-刺激 APC 和條件性 4-1BB 介導刺激 T 細胞bnt312/gen1042 結合親和力:KD CD40 1.0 nmol/L,4-1BB:0.17 nmol/L

BNT312/GEN10421 — 雙條件雙激動劑分子 92 R e la ti v e l u m in e s c e n c e u n it s CD40 報告試驗 4-1BB 報告者測定在沒有 CD40+ 細胞的情況下,BNT312 不表現出任何 4-1BBB 活化在沒有 4-1BB+ 細胞的情況下,BNT312 不表現出任何 CD40 激活 Muik A 等人。J Immuno Ther Cancer 2022;10:e004322。1.與 Genmab 合作 APC = 抗原呈遞細胞;CD = 分化羣;bsAb = 雙特異性抗體。

BNT312/GEN10421 與單克隆抗體或其組合相比,促進直流成熟的能力更高 93 0 20 40 60 抗體濃度 (μg/mL)% H L A-D R + /C D 8 6 + o f to ta l d c p o p p p u la ti o n 同種型 ctrl bsab-cd40xctrll bsab-cd40ctrl*4BB bsab-cd40ctrl*ctrl l + bsab-ctrl×4-1BB Fc inert mitazalimab 模擬 Fc inert urelumab 模擬 duobody-cd40×4-1BB 1.與 Genmab 合作,通過流式細胞術進行測量。顯示來自一位捐贈者的數據。虛線顯示了在不進行治療的情況下 DC-T 細胞培養物中 HLA-DR+CD86+ DCs 的百分比。DC = 樹突狀細胞;HLA = 人類白細胞抗原;CD = 分化羣集;bsaB = 雙特異性抗體;Fc = 片段可結晶區 Muik A 等J Immuno Ther Cancer 2022;10:e004322。直流成熟

來自轉移性或不可切除的實體瘤患者中BNT312/GEN10421劑量增加的數據 94 1.與 Genmab 合作;a. 從加速滴定階段開始,包括單一患者隊列,然後是較大的隊列,由修改後的持續重新評估方法提供信息,然後通過藥物過量控制設計逐步升級;b. ctor MRI:每 6 周進行 50 周,之後每 12 周。CNS = 中樞神經系統;RECIST = 實體瘤反應評估標準;ECOG PS = 東方合作腫瘤小組的績效狀態;MTD = 最大耐受劑量;RP2D = 推薦的 2 期劑量;PK = 藥代動力學。1/2a 期試驗設計 (NCT04083599),多中心,非隨機,開放標籤:劑量升級 Johnson M 等人。J Immunother Cancer。2021;9(suppl2): A525。摘要 493。納入標準 • 年齡 ≥18歲 • 經組織學或細胞學證實、轉移性或不可切除的非中樞神經系統實體瘤 • 不適合標準治療 • 根據 RECIST v1.1b 可測量的疾病 • ECOG PS 0—1 • Aqeduate 腎、肝臟和血液學功能 Aqueduate IV 在 21 天週期內給藥 BNT312/GEN1042,直到疾病進展/不可接受的毒性關鍵終點:MTD,RP2D Secondary:安全性(耐受性),RECIST v1.1 的抗腫瘤活性;PK,免疫原性探索性:藥效學(安全生物標誌物),生物標誌物迴應,ireCist 的抗腫瘤活性數據截止時間:2021 年 8 月 27 日 0.1 mg (n=1) 0.3 mg (n=1) 1 mg (n=2) 3 mg (n=4) 10 mg (n=6) 30 mg (n=9) 60 mg (n=9) 100 mg (n=9) 400 mg (n=3) 擴張劑量

• 疾病控制率 50% • 2 名確診 PR(黑色素瘤、神經內分泌肺癌)100mg Q3W 的患者被確定為擴大劑量 BNT312/GEN10421 在大量預處理的異質患者羣體中表現出可控的安全性並鼓勵臨牀活動 95 1。與 Genmab 合作。DLT`= 劑量限制毒性;MTD = 最大耐受劑量;CRS = 細胞因子釋放綜合徵;PD = 進展性疾病;SD = 病情穩定;PR = 部分反應;NE = 不可評估;NA = 不適用。作為單一藥物的安全性:劑量增加(n=50)作為單一藥物的抗腫瘤活性:劑量增加(n=50)• 1 個 DLT(在 200 mg 時轉氨酶升高)使用皮質類固醇消失 • 未達到 MTD • 未達到藥物相關等級 ≥3 血小板減少症或 CRS • 無與治療相關的死亡 75 50 25 0 -25 -50 -75 -100 0 3 6 9 12 15 18 21 24 27 30 33 36 42 45 48 54 54 57 60 66 69 72 75C h a n g e i n g e i n s u m o f d ia m e rs f ro m b a s line e,% N=50 +20% -30% 最佳確認的總體反應總體迴應 NA/NE PD SD PR Johnson M 等。J Immunother Cancer。2021;9(suppl2): A525。摘要 493。學習周

96 BNT312/GEN10421對轉移性或不可切除的實體瘤患者的劑量擴大 1/2 期試驗設計(NCT04083599、NCT05491317)、開放標籤、多中心、開放標籤 Melero 等。在 2022 年 ESMO-IO 上發表。海報 #692.納入標準 • 精選的轉移性或不可切除的實體瘤 • 可測量的疾病(根據 RECIST v1.1)• ECOG PS 0—1 • 腎臟、肝臟和骨髓功能充足 • 沒有對轉移性疾病進行先前治療,也沒有先前的抗pD (L) 1 或其他檢查點抑制劑療法擴展隊列——組合兩項招募擴展隊列的試驗主要終點:DLT、ORR v1.1 次要:DOR,DCR、PFS、AE、PK/PD 狀態 1.與 Genmab 合作。5-FU、5-氟尿嘧啶;AE,不良事件;Carbo,卡鉑;Cis,順鉑;DCR,疾病控制率;DLT,劑量限制毒性;DOR,反應持續時間;ECOG PS,東方合作腫瘤小組績效狀態;GEM,吉西他濱;GR,等級;HNSCC,頭頸部鱗狀細胞癌;MTD,最大值耐受劑量;nab-pac、nab-paclitaxel;NSCLC,非小細胞肺癌;ORR,總體反應率;PD,進展性疾病;PD-1,程序性細胞死亡蛋白 1;PD-L1,程序性死亡配體 1;PEM,pembrolizumab;PFS,無進展存活率;PK/PD,藥代動力學/藥效學;Q3W,每 3 週一次;RECIST,實體瘤反應評估標準。bnt312/GEN1046 + pembrolizumab:1L 黑色素瘤 1L 非小細胞肺癌 PD-L1+ TPS 1— 49% 1L NSCLC PD-L1+ TPS ≥ 50% 1L HNSCC PD-L1+ CPS ≥1 bnt312/GEN1046 + pembrolizumab+ 化療:≥1L HNSCC PD-L1+ CPS 1 1L 非小細胞肺癌鱗狀 1L 非鱗狀腺癌 1L 胰腺導管腺癌擴張劑量 100 mg Q3W

BNT312/GEN10421 與 Pembrolizumab 和 SoC 化療聯合使用的安全磨合結果顯示出良好的安全概況數據截止日期:2022 年 10 月 2 日。1.與 Genmab 合作;50:50 的盈虧合作。DLT = 劑量限制毒性;MTD = 最大耐受劑量;AE = 不良事件。轉氨酶升高包括首選術語:丙氨酸氨基轉移酶升高,天冬氨酸氨基轉移酶增加。皮疹包括首選術語:皮疹和斑疹很受歡迎。疲勞包括虛弱和疲勞。97 • 與 pembrolizumab +/-SoC 化療聯合使用,BNT312/GEN1042 在各種劑量水平下都具有良好的耐受性 • 100mg 被選為劑量擴展階段 BNT312/GEN1042 (NCT04083599):Safety Melero 等人。在 2022 年 ESMO-IO 上發表。海報 #692.與治療相關的不良事件 ≥ 10% 在安全運行期間未觀察到 DLT 主要為預期的 1/2 級免疫相關不良事件,使用皮質類固醇 GEN1042 + pembro (n=24) GEN1042 + pembro + SoC ctX (n=26) 8.3 8.3 12.5 12.5 4.2 4.2 4.2 4.2 4.2 8.3 0 5 10 15 20 噁心發熱性皮疹疲勞轉氨酶升高瘙癢症 1 級 2 級 3 級 4 級 7.7 7.7 11.5 19.2 3.8 3.8 15.4 11.5 3.8 3.8 3.8 7.7 3.8 0 10 20 30 40 噁心發燒疲勞皮疹轉氨酶升高瘙癢症患者百分比患者百分比 16.7% 16.7% 16.7% 12.5% 12.5% 34.6% 23.1% 19.2% 15.4% 15.4% 11.5%

BNT312/GEN10421與Pembrolizumab和SoC化療聯合使用的安全性試用結果顯示,HNSCC 1患者具有初步活性。與 Genmab 合作。HNSCC = 頭頸部鱗狀細胞癌;PD-L1 = 程序性細胞死亡配體 1;PR = 部分反應;CR = 完全反應;HPV = 人乳頭瘤病毒。• 4/4 名可評估的晚期/轉移 HNSCC 患者出現深度反應 • 在 PD-L1 表達低和偏高的腫瘤中均出現反應;所有 4 名患者均為 HPV 陰性 BNT312/GEN1042 (NCT04083599):功效 Melero 等人。在 2022 年 ESMO-IO 上發表。海報 #692.b e s t c h a n g e f ro m b a s e li n e i n s u m o f le s io n d ia m e rs (%) 0 -20 -40 -60 -80 -100 PR PR CR 0 0 12 24 30 -25 -50 -75 -100 6 P e rc e rc h a n g e f ro m b a m o f le s io n d ia m e te rs 最佳確認總體反應 PR CR 98 研究周計劃於 2024 年進行的 1/2 期試驗擴展隊列數據讀出後續步驟數據截止日期:2022 年 10 月 3 日。

一種基於 HexaBody 技術的 CD27 抗體,經過專門設計,可在靶標與 T 細胞膜結合後形成抗體六聚體。BNT313/ GEN10531 臨牀狀態 • 多發性實體瘤中的 Ph1/2 單特異抗體具有優化 Fc 靶向 CTLA-4,由於 pH 驅動機制,有選擇地消耗 TME 中腫瘤浸潤 Treg,但不會消耗外周腫瘤浸潤 Treg。BNT316/ ONC-3922(gotistobart)臨牀狀態 • 多發性實體瘤中的 Ph1/2 • Proc 中的 Ph2 • 2L+ mnsCLC 雙特異性抗體中的 Ph3 可抑制 PD1 陽性細胞的增殖。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT311/ GEN10461 臨牀狀態 • 多發性實體瘤中的 Ph1/2 • mnsCLC 中的 Ph2 • 2L mec 中的 pH2 CD40 的參與會導致 APC 的激活和成熟。4-1BB 可增強 T 細胞增殖、T 細胞效應功能並防止 T 細胞死亡。BNT312/ GEN10421 臨牀狀態 • 多發實體瘤雙特異性抗體的 Ph1/2 試驗,旨在通過依賴 epcam 的 4-1BB 激動活性增強抗腫瘤免疫反應。BNT314/ GEN10591 臨牀狀態 • 計劃治療多發性實體瘤 Ph1/2 1。與 Genmab 合作;2.與 Oncoc4 合作;3.與 Biotheus 合作。CTLA4 = 細胞毒性 T 淋巴細胞相關蛋白 4;CD27、CD40、4-1BB = 腫瘤壞死因子受體超家族成員;PD-1 =程序性細胞死亡蛋白 1;HER2 = 人類表皮生長因子受體 2;ADCC = 抗體依賴細胞介導的細胞毒性;ADCP = 抗體依賴性細胞吞噬作用;PROC = 耐鉑卵巢癌;NSCLC = 非小細胞肺癌;EC = 子宮內膜癌 APC = 抗原呈遞細胞;VEGF = 血管內皮生長因子;TME = 腫瘤微環境;CtX = 化療;LALA = IgG1 變體L234A/L235A。腫瘤中 PD-L1 的表達或上調可能會將 VEGF 中和功能豐富到 TME 中,從而抑制血管新生。PM80023 臨牀狀態 • ph1b 劑量增加 • pH2A 可作為多種癌症的單一療法 • Ph2 與 ctX 聯合治療多種癌症在免疫腫瘤學領域處於有利地位,具有針對多種腫瘤的候選治療藥物抗CD27Anti-ctla4 anti-1bbanti-pd-L1 Anti-4-1bbepcam Anti-4-1bbepcam Anti-pd-L1 Anti-pd-la Fc 99

PM80021 — 下一代 IO 代理,結合了兩個經過臨牀驗證的 MoA 100 1。與 Biotheus 合作。MoA = 行動模式 TME = 腫瘤微環境 2.BioRender.com 生成的 MoA 與 ADC 的 “二合一” 協同作用圖 PD-L1 和 VEGF-A 的雙重封鎖已被證明具有協同作用 • 令人信服的概況迄今已有 500 多名患者接受了治療 • 早期臨牀研究中觀察到的單一療法活性和聯合療法的協同作用 • PDL1 + VEGF 抑制或單獨使用 PD1 人體蛋白結合活性 (KD) • PD-L1:5.5 nM • VEGF-FEGF 答:

VEGF 多級免疫抑制作用的逆轉腫瘤血管生成促進作用 VEGF 抗血管生長因子治療影響腫瘤血管系統和腫瘤微環境 101 來自 https://www.creativebiolabs.net/bevacizumab-overview.htm VEGF (R) = 血管內皮生長因子(受體);DC = 樹突狀細胞;Treg = 調節 T 細胞;CXCL = 趨化因子(C-X-C 基序)配體;IFN = 幹擾素;CD3 = 分化羣 3;MSDC = 髓系衍生抑制細胞。1.通過抑制直流成熟來下調T細胞的活化 2.減少 T 細胞腫瘤浸潤 3.增加腫瘤微環境中的抑制細胞,例如髓系衍生抑制細胞(mdSC)和調節性T細胞(Tregs)1 3 2 1 2 3 Hegde P. 等人。癌症生物學研討會。2018。

Anti-VEGF 是一種經驗證的機制,已在各種腫瘤中獲得批准或顯示出臨牀活性 102 1L OC/TFC/PPC 2L+ OC/FTC/PPC 鉑金抗性 2L OC/FTC/PPC 鉑金敏感型 1L nsQ NSCLC 驅動基因 WT 1L NSCLC driver Gynae-cology 2L+ nsqlc RCC 1L HCL C 2L CRC GBMBC HER2-1/2L CRC 乳腺胃蛋白檢測 genitouri nary 其他單一組合 + 5FU 化療 + FOLFIRI + FOLFOX 3L CRC + Tifluridine /Tipiracil + 幹擾素 alfaMaintenance + 紫杉醇 + Topotecan 維持劑 + Atezolizumab 宮頸癌 PD-L1+ 2L+ GC/GEJ + 紫杉醇 2L HCC Advanced BTC + Erlotinib(維護)NEN + Temsirolimus + FOLFOX 黑色素瘤 + 替莫唑胺 SCLC 未獲批准 + 卡鉑/紫杉醇/順鉑 + 紫杉醇/拓撲替康 +紫杉醇/卡鉑 + 紫杉醇/卡鉑 + 吉西他濱/卡鉑 + Pembrolizumab /基於紫杉醇的化療 + 厄洛替尼 + 多西他賽 + 卡培他濱 + 多西他賽 + 順鉑/伊立替康 RCC= 腎細胞癌;OC=卵巢癌;TFC = 輸卵管癌;PPC = 原發性腹膜癌癌症:nsclc=非小細胞肺癌;btc=膽道癌;sclc=小細胞肺癌;bc=乳腺癌;hcc=肝細胞癌;mpm=惡性胸膜間皮瘤;nen=神經內分泌腫瘤,GBM=膠質母細胞瘤,crc=結直腸癌,gc/gej=胃癌/胃癌食管交界癌;PLD:聚乙二醇化脂質體多柔比星,抗血管內皮生長因子包括貝伐珠單抗和拉姆西魯單抗。圖例:臨牀活性得到證實

PM8002 Mono and Combo 已在 500 多名患者的 10 多種適應症中進行了研究 103 個 2L+ 宮頸癌 nccRCC 2L+ ccrCC PROC 2L+ PSOC 2L+ NSCLC egfrm Advanced BTC 1L SCLC 1L TNBC 1L HCCL Combo Lung Brast Gynaectour ginary Axel) (+ FOLFOX4) (+ 培美曲塞/鉑金) 單組合 (+ 培美曲塞/卡鉑金) 1L SCLC (+ Etoposide/Platinum) 粘膜黑色素瘤 2L+ 子宮內膜癌 1L NSCLC 驅動基因 WT、PD-L1+ 2L NEN (+ FORFIRI) nccrcc=非透明細胞腎細胞癌;RCC= 腎臟細胞癌;proc=耐鉑卵巢癌;PSOC=鉑敏感性卵巢癌;nsclc=非小細胞肺癌;btc=膽道癌;sclc=小細胞肺癌;tnbc=三陰性乳腺癌;hcc=肝細胞癌;mpm=惡性胸膜間皮瘤;nen=神經內分泌腫瘤。圖例:正在進行的 PM8002 研究

PM80021 晚期實體瘤患者的單一療法 1.與 Biotheus 合作。試用版註冊:chictr2000040552。qxW = 每 x 週一次;RP2D = 推薦的 2 期劑量;ECOG PS = ORR = 客觀反應率;ECOG PS= 東方合作腫瘤學小組的表現狀態。1/2 期試驗設計,開放標籤,單一療法 104 第 1 部分:劑量增加第 2 部分:劑量擴大適應症 • 粘膜黑色素瘤 • 卵巢癌 • 子宮內膜癌 • 宮頸癌 • 腎細胞癌 • 非小細胞肺癌 • 肝細胞癌 • 小細胞肺癌 • 其他 RP2D 20 mg/kg Q2W 和 30 mg/kg Q3W 疾病進展、撤回同意、不可接受的毒性納入標準 • 高級或轉移性腫瘤 • 年齡 18-75 歲 • ECOG PS 0-1 • 器官功能充足 • 排除明顯出血和凝血的證據疾病或其他重大出血風險主要終點:根據CTCAE5.0和ORR根據RECIST1.1的不良事件次要終點:抗藥抗體(ADA)檢測關鍵終點:評估了310名患者的劑量水平從1 mg/kg Q2W到45 mg/kg Q3W

在一項1/2期試驗中,PM80021 單一療法在晚期實體瘤患者中顯示出令人鼓舞的抗腫瘤活性和安全性 105 1。與 Biotheus 合作。ORR = 客觀緩解率;DCR = 疾病控制率,DoR = 緩解持續時間;PFS = 無進展存活率;PD = 進展性疾病;SD = 疾病穩定;PR = 部分反應;CR = 完全緩解。Ph1/2 中的 PM8002:單一療法的臨牀活性 Ye Guo 等人。在2023年ASCO上發表。海報 #378 可評估患者的最佳腫瘤反應(n=254):• ECOG PS 1:~ 62% • 之前接受過 ≥1 種抗癌療法:~ 76% • 之前的 IO 治療:~ 5% -100 -80 -40 -20 0 20 40 60 80 100 PD SD PR CR 療效可評估患者,n 254 ORR,% 74.4 -100 -80 -40 -20 0 20 40 60 80 100 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 研究月 C h a n g e f ro m B a s e li n e (%) 療效可評估患者,n 254 中位數 dOR,月 7.4 PFS 中位數,5.6 個月

在 1/2 期試驗中,PM80021 單一療法對晚期實體瘤患者的耐受性良好 106 1。與 Biotheus 合作。TRAE = 與治療相關的不良事件,SAE = 嚴重不良事件。Ph1/2 中的 PM8002:單一療法的安全性 Ye Guo 等人在2023年ASCO上發表。海報 #378 所有 TRAE,n (%) 239 (77.1%) TRAE ≥3,n (%) 64 (20.6) SAE,n (%) 35 (11.3) TRAE 導致劑量停藥,n (%) 17 (5.5) • 1 個 4 級事件:貧血 • 腫瘤中無 5 級事件 PD-L1 的表達可能會豐富血管內皮生長因子中和,從而避免正常組織並導致全身性減少阻斷毒性 VEGF 抑制阻礙腫瘤生長的血管新生 ph1b/2 劑量擴展 ph1b/2 單一療法和 Ph2 化療組合試驗正在中國進行多種適應症 IND 獲準在美國進行進一步研究 TRAE≥ 10% 患者所有等級,n (%) 3 級,n (%) 天冬氨酸轉氨酶增加 42 (13.5) 2 (0.6) 丙氨酸轉氨酶增加 39 (12.6) 1 (0.3) 高膽固醇血癥 38 (12.3) 0 低白蛋白血癥 35 (11.3) 0 高甘油三酯血癥 31 (10) 2 (0.6) 蛋白尿 82 (26.5) 4 (1.3) 高血壓 60 (19.4) 20 (6.5) 甲狀腺功能減退 34 (11) 0 貧血 32 (10.3) 0

PM80021 與紫杉醇聯合用作 SCLC 107 的二線治療 1.與 Biotheus 合作;2.截至2023年9月8日。小細胞肺癌 = 小細胞肺癌 ECOG PS= 東方合作腫瘤小組的業績狀況。ORR = 總體緩解率;DCR = 疾病控制率;TRAE = 與治療相關的不良事件;dOR = 反應持續時間 PFS = 無進展生存率 OS = 總存活率 qxw = 每 X 週一次。納入標準 • 使用或不使用檢查點抑制劑進行鉑類化療後進展的晚期小細胞肺癌患者 • 年齡 ≥ 18 歲 • ECOG PS 0-1 • 器官功能充足 n=99 關鍵終點狀態 • 48 名患者入組2,正在招募初級患者:• RECIST1.1 的發病率和嚴重程度次要終點:DCR、doR、PFS 和 OS 2 期試驗,開放標籤,單組組合 (NCT05879068) PM8002 300 mg/kg + 紫杉醇 IV Q3W 持續 5 個週期 PM8002 30mg/kg 作為維持治療疾病進展,撤回同意,不可接受的毒性

反應功效評估人羣 ITT (n=36) io-naive (n=22) IO-naive (n=22) IO-traced (n=14) ORR,% 61.8 42.9 DCR,% 86.1 81.8 92.9 第二階段 (NCT05879068):PM8002 與紫杉醇聯合使用的臨牀活性 Ying Cheng 等人。在 2023 年 ESMO 上發表。海報 #1992P PM80021 聯合紫杉醇作為二線療法顯示出令人鼓舞的抗腫瘤活性 108 1.與 Biotheus 合作;SCLC = 小細胞肺癌;IO = 免疫腫瘤學;ORR = 客觀反應率;DCR = 疾病控制率,dOR = 緩解持續時間;PFS = 無進展存活期;CTFI = 無化療間隔;TTP = 進展時間;PD = 進展性疾病;SD = 穩定性疾病;PR = 完全反應 -90 -70 -30 -10 30 50 70 PD SD PR CR--+ +-+ ○ + √ ○ + ○-+ + + + +-√ ○---+----+-○--○-√-√-√-√-√-√-√-○--+----io-Naive + 經過離子處理的 ○ CTFI

PM8002 聯合紫杉醇作為二線療法在 SCLC 109 患者中顯示出可接受的毒性 1。與 Biotheus 合作。TRAE = 與治療相關的不良事件,SAE = 嚴重不良事件。第 2 階段,開放標籤,單臂,試驗 (NCT05879068) Ying Cheng 等在 2023 年 ESMO 上發表。海報 #1992P PD-L1 在腫瘤中的表達可以豐富血管內皮生長因子中和並將其聚集到 TME 中,從而保護正常組織並降低全身毒性。阻止 VEGF 抑制血管新生的發生阻礙腫瘤生長的研究周 2 期試驗正在進行近期計劃進入第 3 期試驗後續步驟 N=48 n (%) 所有 TRAE 45 (93.8) TRAE ≥3 30 (62.5) SAE 16 (33.3) TRAE 導致劑量停藥 1 (2.1) TRAE ≥ 10% 的患者所有等級,n (%) 3 級,n (%) 4 級,n (%) 5 級,n (%) 中性粒細胞減少症 23 (47.9) 15 (31.3) 7 (14.6) 0 白細胞減少症23 (47.9) 10 (20.8) 2 (4.2) 0 血小板計數減少 12 (25.0) 1 (2.1) 0 貧血 11 (22.9) 0 0 0 蛋白尿 9 (18.8) 2 (4.2) 0 0 肺炎 6 (12.5) 0 0 0 0 0 1 (2.1)

PM8002 作為單一療法和化療聯合治療的患者腫瘤明顯萎縮 110 個數據存檔。1L/1L = 第一線、第二線第 32 周病變直徑:0 mm 28.4 mm 0 mm 1L TNBC:PM8002 + nab-paclitaxel 2L SCLC:PM8002 + 紫杉醇基線病變直徑:44.5 毫米 EGFR-TKI 治療 NSCLC CLC:PM8002 單一療法基線病變直徑:16.8mm 第 19 周病變直徑:6.2mm 基線病變直徑:40.8mm 第 18 周病變直徑:5.0mm 基線病變直徑:30.9mm 第 18 周病變直徑:5.0mm IO-經過治療的基線病變直徑:28.4 mm L e s io n 1 L e s io n 2 io-Naive

PM8002 安全概況對與其兩個靶標相關的 AE 和 iRAE 表現良好 111 文獻研究,交叉試驗比較;存檔數據。抗PD-1包括pembrolizumab和nivolumab,Anti-pd-L1 包括阿替珠單抗,Anti-vegf 是貝伐珠單抗,VEGF TKI 包括倫伐替尼和阿西替尼。抗PD-1包括pembrolizumab和nivolumab,抗PD-L1包括泰唑珠單抗,抗VEGF是貝伐珠單抗,VEGF TKI包括lenvatinib和axitinib。

免疫調節劑:關鍵要點 BNT316/ONC-392(gotistobart)1 • 計劃在 2024 年公佈更多數據 • 計劃在 2024 年及以後進行潛在的註冊試驗 BNT311/GEN104062 • 與衞生當局合作設計後非小細胞肺癌的關鍵試驗 • 計劃在 2024 年的醫學會議上公佈數據 BNT312/GEN104212 • 明年提供臨牀數據和關鍵發展計劃更新 1.與 Oncoc4 合作。2.與 Genmab 有針對性的里程碑戰略合作 • 利用我們的下一代免疫調節劑來釋放新患者羣體的潛力 • 有可能成為新型組合的改進支柱 112

7 實體瘤細胞療法

實體癌對 CAR-T 細胞構成特殊挑戰 114 永久可訪問抗原血管 # C A R-T 時間閾值缺乏外周抗原腫瘤 # C A R-T 時間閾值 0 5 10 15 20 25 CAIX (12) CEA (21) EGFR (11) erbb2/Her2 (20) fr-a (14) GD2 (19) IL-13ra2 (3) L1-CAM (6) Mesothelium (2)) MUC1 (1) PSMA (5) VEGFR-2 (23) CR/PR SD PD/NR/NE 液體腫瘤實體瘤 CR/PR SD PD/NR/NR/NE 0 3020 100 120 140 180 200 220 240 靶向+ 細胞 CAR T 細胞接受治療的患者人數 A n ti g e n s o f s o li d t u m o rs 最佳臨牀結果,靶抗原 CD19(n=243)最佳臨牀結果 CR = 完全反應;NE = 不可評估;NR = 無反應;PD = 進展性疾病;PR = 部分反應;SD = 病情穩定。Hartmann 等人,EMBO MM. 2017。Hartmann 等人,EMBO MM. 2017。

CLDN6 在醫療需求高的癌症中的表達頻率 115 Reinhard、Rengstl 等人。Science 2020 子宮內膜肺部檢查健康組織腫瘤適應症 cldn6+ cldn6High 睾丸癌* 93% 90-93% 卵巢癌* 56% 25-30% 子宮癌* 23% 10-15% 肺癌** 11% 2-5% 胃癌*** 9% 2-5% * 大多數亞型 ** 主要是腺癌和大細胞癌 *** α-胎蛋白 + 亞型 cldn6High 50% 的腫瘤細胞表達 ≥2+ CLDN6 蛋白 (IHC)

具有高靈敏度和特異性的強效第二代 CAR Reinhard K 等人。Science 2020,367:446 —453 BNT211:一種 CLDN6 Car-T 細胞療法 + cldn6 編碼 carvac,可增強注入 CAR-T 細胞的擴張和持久性 ACT = 過繼細胞移植;APC = 抗原呈遞細胞;CARVac = CLAUDIN 6。αcldn6 scfV CD8 鉸鏈 4-1BB cd3L ys 是 CLDN6 [ % ]C L D N 3 C L D N 4 C L D N 6 C L D N 9 80 60 40 20 0 脂質體全長 CLDN6 RNA Carvac IV 結合 Carvac(CAR-T 細胞擴增 RNA 疫苗),靶向 APC、Reinhard K 等。2020 年《科學》,367:446 —453;Kranz LM 等。自然 2016;534:396 —401 CLDN6 CAR-T GFP T 細胞 0 500 1,000 1,500 -10 5 0 10 15 20 25 T u m o r v o lu m e [m m 3 ]ACT 之後的天數 ± 116

BNT211-01:R/R Advanced CLDN6+ 實體瘤的 1/2a 期、FIH、開放標籤、多中心、劑量遞增試驗 (NCT04503278) 117 數據截止時間:2023 年 9 月 10 日。* 未指明交叉到組合。CAR = 嵌合抗原受體;Carvac = CAR T 細胞擴增 RNA 疫苗;CLDN6 = 克勞丁-6;DCR = 疾病控制率;DL = 劑量限制毒性;DoR = 反應持續時間;ECOG PS = 東方合作腫瘤小組表現狀態;ORR = 客觀反應率;PFS = 無進展存活率;RECIST = 實體瘤反應評估標準;R/R = 復發 /耐火材料。dl2 n=9 + 固定的 Carvac DL1 n=4 + 固定的 Carvac DL2 n=6 1×108 CAR-T DL1 n=3 1×107 CAR-T 單一療法組合* DL2 n=13 1×108 CAR-T dl1 n=4 1×106 CAR-T 的劑量不斷增加 CAR-T 細胞 ± CLDN6 Carvac • 第 1 天 CAR-T 細胞輸注前的淋巴消耗(DLT 評估為 28 天)• CLDN6 Carvac 在 CAR T 移植後反覆固定劑量評估:療效評估 Q6W(RECIST v1.1)和腫瘤標誌物監測 I 期劑量增加(手動產品):已完成 I 期劑量增加 CLDN6使用(自動化產品):持續納入標準 ≥ 50% 的腫瘤細胞,CLDN6 陽性(免疫組織化學)根據 RECIST v1.1 可測量的疾病或腫瘤標誌物升高 ECOG PS 0—1 DL2 n=14 + 固定的 Carvac DL1 n=4 + 固定的 Carvac DL3 n=0 + 固定的 Carvac 關鍵終點主要:安全性和耐受性,DLT 次要的:免疫原性,ORR DCR、DoR、PFS 劑量:ESMO 2022 (n=22) ESMO 2023 (n=44) Mackensen 等人。《自然醫學》。2023。數據發表在麥肯森等人身上《自然醫學》。2023。

手工製造過程患者的臨牀益處 118 LD = 淋巴細胞消耗;CR = 完全緩解;PR = 部分反應;SD = 病情穩定;PD = 進展性疾病。FIH 第 1/2 期研究 (NCT04503278):BNT211 的臨牀活性 +/-Carvac Mackensen 等人Nat。Med. 2023。

病例報告顯示了對 BNT211 119 HDCT = 高劑量化療;ASCT = 自體造血幹細胞移植的臨牀反應。診斷混合生殖細胞腫瘤;80% 的腫瘤細胞,膜染色陽性 ≥2 +。CLDN6之前的治療 • 經過大量預處理(總共 5 行化療),包括順鉑類化療、HDCT/ASCT 吉西他濱/奧沙利鉑/紫杉醇、多次手術和放射治療 • 5 年後 HDCT 卡鉑/依託泊苷晚期疾病復發(畸胎瘤和蛋黃囊腫瘤)• 再次復發進入試驗前的 k-sac 腫瘤成分,首次出現多例肺轉移 • 累積時疾病進展迅速:篩查和 ACT 轉移部位肺基線 6 周之間的目標總和增加 37%澳大利亞首都直轄區案例報告後 Mackensen 等人自然醫學。2023。澳大利亞首都直轄區後 12 周澳大利亞首都直轄區後 18 周澳大利亞首都直轄區 52 周後

BNT211-01:CAR T 細胞劑量依賴性不良事件概況,正在進行劑量評估以確定 RP2D 數據截止時間:2023 年 9 月 10 日。1 個隊列包括 3 名未達到全劑量(2×107)的患者,以及 1 名淋巴消耗減少 50% 後接受全劑量治療的患者。3 其他適應症:4 名肺癌患者(不同亞型),3 名去甲狀腺癌患者塑性圓細胞腫瘤,2 例食管癌,1 例子宮內膜癌,1 例鼻竇癌。4 不建議患者交叉,因為該選項是由安全審查委員會在不影響療效的情況下對單一療法隊列進行劑量決定後作出的。5 大多數 TeaE ≥G3 歸因於 CAR-T IMP(27/30)。最常見的TEAE是實驗室檢查結果(43.2%),包括血細胞數減少、肝功能檢查升高以及膽紅素和鐵蛋白水平升高。因此,經常報告血細胞減少(25%)、免疫系統(7%)和肝膽管疾病(5%)。6例最常見的非相關性TESAE是感染。7例DLT包括2例全血細胞減少症、1例噬血細胞淋巴組織細胞增多症和1例肝毒性伴膿毒症。21/23患者有1例CRS僅限於G1-2 G3 和 1 次 G4 事件。9 神經毒性為輕度,2 例患者具有自限性。10 大多數患者死亡(11/12)與疾病進展有關,1 名患者死於敗血癥。以中位數(範圍)給出的值。CAR = 嵌合抗原受體;CLDN6 = claudin-6;CRS = 細胞因子釋放綜合徵;DL = 劑量水平;DLT = 劑量限制毒性;G = 等級;ICANS = 免疫效應細胞相關神經毒性綜合徵;IMP = 在研藥品;TESAE = 治療突發(嚴重)不良事件。FIH 第 1/2 階段研究(NCT04503278):基準特徵和安全性(自動化過程)Haanen J. 等人在 2023 年 ESMO 上發表。摘要 #LBA35.隊列 DL0 (n=2) DL1 (n=4) DL1 + Carvac (n=4) DL2 (n=13) 1 DL2 + Carvac (n=14) 2 DL3 (n=7) 總計 (n=44) 患者基線特徵年齡,年齡 55.5 (50—61) 54.5 (36—62) 51.0 (42—65) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 45.0 (30—69) 8.0 (26—60) 50.5 (29—63) 48.0 (26—69) 性別,男/女 1/1 3/1 2/2 7/6 8/6 4/3 25/19 適應症,n 上皮性卵巢癌 (EOC) 生殖細胞瘤 (GCT) 其他適應症3 1 1 0 1 0 0 3 2 2 2 2 6 3 3 2 17 11 CLDN6 2+/3+ 細胞,% 82.5 (80—85) 97.5 (80—100) 97.5 (50—100) 95.0 (80—100) 100 (70—100) 80.0 (50—100) 95 (50—100) 之前的治療熱線 3.0 (2—4) 4.0(3—7) 4.0 (2—9) 4.0 (2—7) 4.0 (2—9) 3.5 (2-6) 4.0 (2—9) 治療和安全結果隨訪時長,第 321.5 天 (242-401) 44.5 (22-87) 90.5 (13-189) 71.5 (30-317) 120.5 (9-199) 90 (44-121) 94.5 (9-401) Carvac 注射 s4,n na NA 3 (1-5) NA 4 (1-7) NA 4 (1-7) 與 imps5 相關 TeaE ≥G3 的患者,n 1 1 1 12 9 6 30 與 imps6 相關的 teSae 患者,n 1 0 0 4 4 5 14 患者 dlts7,n 0 0 0 1 2 1 1 1 4 4 患者,n 0 0 0 1 1 0 2 Deaths10,n 1 3 2 2 4 0 12 120 ICANS9

BNT211-01:所有劑量水平的活動信號數據截止時間:2023 年 9 月 10 日。瀑布圖顯示了接受 CLDN6 CAR-T 治療的患者的目標病變直徑總和與基線相比的最佳百分比變化(N = 38)。一名患者在首次評估之前死亡(NR = 未達到),BOR 被定義為 PD。* 根據 RECIST 1.1,患者患有不可估量的疾病,BOR 是根據腫瘤標誌物反應進行評估的。** 患者在手術切除腫瘤後獲得完全緩解。在數據截止時,有6名患者的反應數據尚待公佈。虛線顯示標準反應評估標準,用於根據RECIST 1.1確定靶病變的客觀腫瘤反應(CR = — 100%,PR = 30 至 — 100%,SD = —30% 至 20%,PD = 20% 或更高)。圖表包含來自5名患者的其他數據,這些數據是在數據截止日期之後手動輸入到數據庫的,而這些數據在正式輸出中不可用。BOR = 最佳總體反應;CR = 完全反應;DCR = 疾病控制率;DL = 劑量水平;EOC = 上皮性卵巢癌;GCT = 生殖細胞瘤;PD = 進展性疾病;ORR = 客觀反應率;PR = 部分反應;SD = 疾病穩定。CLDN6 CAR-T DL2 總體安全性可評估患者,n 10 27 7 44 療效可評估患者,n 9 22 7 38 PR/CR 患者,n 1 13 3 17 SD 患者,n 1 8 2 11 PD 患者,n 7 1 2 10 ORR,% 11.1 59.1 42.9 44.7 DCR,% 22.2 95.5 71.4 73.7 C h n g e n g e n t a rg e t s u m [ % ]60 30 0 -30 -60 -90 GCT EOC 其他 NR* * DL 1 1 0 3 2 1 1 3 2 1 0 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 Bor PD PD PD PD PD pd sd sd pd pd sd sd sd sd sd sd sd sd sd sd sd sd pr PR PR PR PR CR ** 最佳反應和目標總和變化(所有 dL ± CLDN6 Carvac)第 1/2 期 FIH 研究(NCT04503278):所有劑量水平的療效 Haanen J. 等人。在 2023 年 ESMO 上發表。摘要 #LBA35. 121

BNT211-01:劑量水平 2 的鼓勵活動信號 122 數據截止時間:2023 年 9 月 10 日。瀑布圖顯示了目標病變直徑總和與基線相比的最佳百分比變化,而蜘蛛圖顯示了在DL2(N = 22)處接受 CLDN6 CAR-T ± CLDN6 Carvac 治療的患者在一段時間內目標總和與基線相比的百分比變化。* 根據 RECIST 1.1,患者患有不可估量的疾病,通過腫瘤標誌物反應評估。** 患者在手術切除腫瘤後獲得了完全的反應。截至數據截止時,有5名患者的反應數據尚待公佈。虛線顯示標準反應評估標準,用於根據RECIST 1.1確定靶病變的客觀腫瘤反應(CR = — 100%,PR = 30 至 — 100%,SD = —30% 至 20%,PD = 20% 或更高)。圖表包含在數據截止日期之後手動輸入到數據庫中的其他數據,而這些數據在正式輸出中不可用。BOR = 最佳總體反應;CR = 完全反應;DCR = 疾病控制率;DL = 劑量水平;EOC = 上皮性卵巢癌;GCT = 生殖細胞瘤;PD = 進展性疾病;ORR = 客觀反應率;PR = 部分反應;SD = 疾病穩定。CLDN6 CAR-T DL2 總體安全性可評估患者,n 10 27 7 44 療效可評估患者,n 9 22 7 38 PR/CR 患者,n 1 13 3 17 SD 患者,n 1 8 2 11 PD 患者,n 7 1 2 10 ORR,% 11.1 59.1 42.9 44.7 DCR,% 22.2 95.5 71.4 73.7 天 EOC 其他 C h a n g e n a rg e t s u m [ % ]C h a n g e i n t a rg e t s u m [ % ]60 30 0 -30 -60 -90 *** 60 40 0 -20 -60 -100 20 -40 -80 0 50 100 150 200 最佳反應和目標總和變化(僅限 DL2 ± CLDN6 Carvac)第 1/2 期 FIH 研究(NCT04503278):所有劑量水平的療效 Haanen J. 等人在 2023 年 ESMO 上發表。摘要 #LBA35.
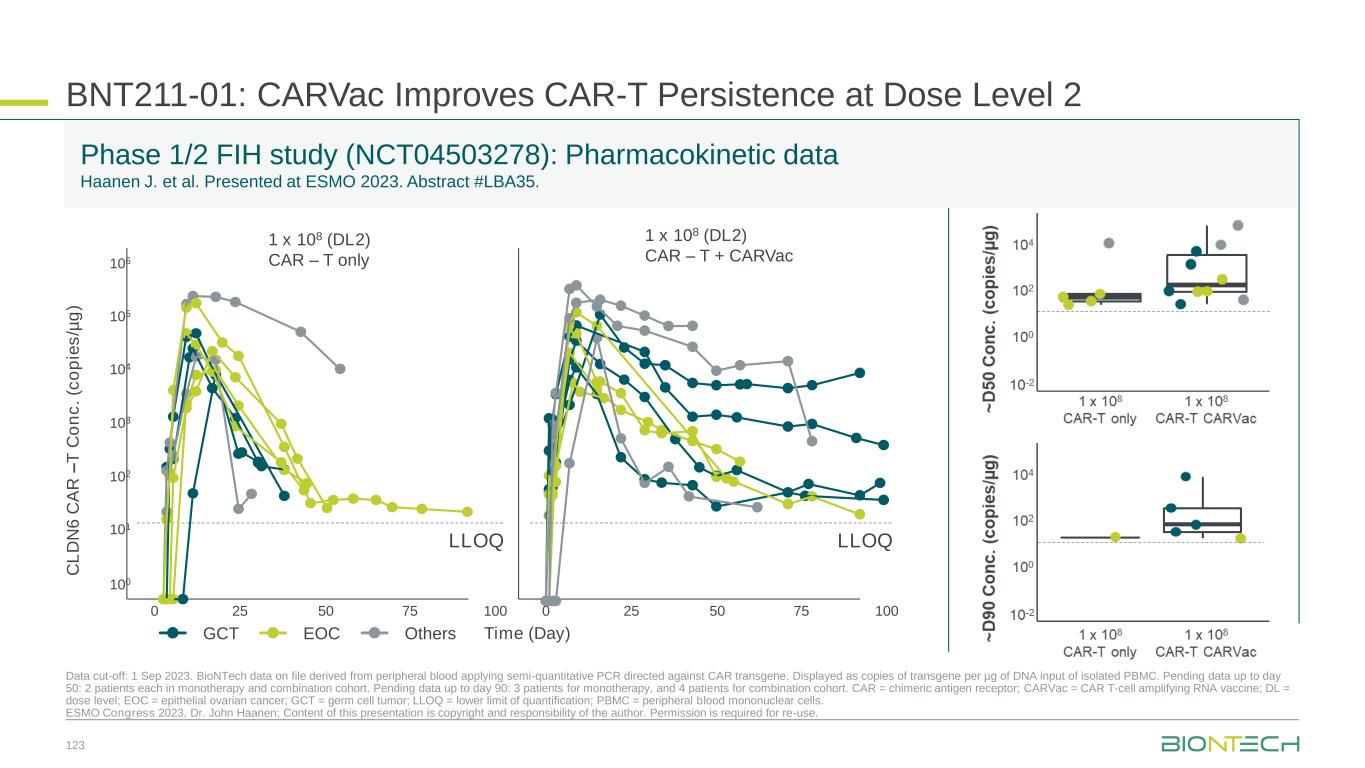
BNT211-01:CarVac 在劑量等級 2 時提高 CAR-T 的持久性數據截止時間:2023 年 9 月 1 日。檔案中的BioNTech數據來自外周血,應用針對CAR轉基因的半定量聚合酶鏈反應。每輸入一微克 PBMC 的 DNA,顯示為轉基因副本。截至第 50 天的待處理數據:單一療法和聯合隊列中各有 2 名患者。截至第90天的待處理數據:3名患者接受單一療法,4名患者接受聯合隊列。CAR = 嵌合抗原受體;Carvac = CAR T 細胞擴增 RNA 疫苗;DL = 劑量水平;EOC = 上皮卵巢癌;GCT = 生殖細胞瘤;LLOQ = 定量下限;PBMC = 外周血單核細胞。2023 年 ESMO 大會,約翰·哈寧博士;本演示文稿的內容版權和責任歸作者所有。重複使用需要許可。FIH 第 1/2 期研究 (NCT04503278):藥代動力學數據 Haanen J. 等人在 2023 年 ESMO 上發表。摘要 #LBA35. 1 x 108 (DL2) CAR — T 僅限 1 x 108 (DL2) CAR — T + Carvac C L D N 6 C A R — T C o n c。(c o p ie s /µg) 時間(天)GCT EOC 其他 106 105 104 103 102 101 100 0 25 50 75 100 0 25 50 75 100 lloqlloq 123

藥代動力學:CarVac 在 DL2 安全性:可管理的 AE 譜下對幾名患者進行了長達 100 天的持續檢測,從而改善了 CAR-T 的持續性。劑量依賴性 AE 譜通過回填多個隊列的劑量水平進一步評估安全性 BNT211 關鍵要點信息 124 CAR = 嵌合抗原受體;carvac = CAR T 細胞擴增 RNA 疫苗;CLDN6 = 克勞丁-6;DCR = 疾病控制率;DL = 劑量水平;GCT = 生殖細胞腫瘤;ORR = 客觀反應率;RPD2 = 推薦的 II 期劑量。✓ 功效:令人鼓舞的活性跡象在 DL2 時有 22 名可評估的患者,有 13 項反應(ORR 59%,DCR 95%)✓ 展望:正在測定 CLDN6 CAR-T 細胞 RP2D ✓ ✓

CAR T-Cells 展望 • 救助順鉑類化療方案後 R/R GCT 沒有治療選擇1 • 在過去幾十年中缺乏新的進展 • 檢查點抑制劑在這些患者中失效2 1。費爾德曼等人2012 年癌症;2.阿德拉,等。Ann Oncol 2018;3.麥肯森等人《自然醫學》。2023;4.Haanen 等人在 2023 年 ESMO(LBA35)上發表。PoC = 概念驗證;R/R 生殖細胞瘤 (GCT) CAR-T 細胞策略中未得到滿足的醫療需求成就:• 在 CLDN6+ 適應症中提供了 BNT211 的 PoC 數據:• 目標是將 CLDN6 確立為實體瘤的公認靶標 • 旨在建立首個 CAR T 細胞療法中長期策略:• 探索擴展到其他實體瘤適應症的關鍵試驗 RGCT計劃於2024年啟動睾丸癌的EMA PRIME稱號已公佈的數據顯示多種抗腫瘤療效CLDN6+ 腫瘤類型3,4 125

8 mRNA 癌症疫苗 Ozlem Türeci 教授,醫學博士、首席營銷官兼聯合創始人

基於尿苷的mrna-lpx疫苗,用於全身分泌和誘導對抗癌症的強效多特異性免疫反應 127 Kranz LM,等。《自然》2016;534:396 —401;Lopez J 等人2020 年 AACR 年會;口頭陳述 CT301。RNA-LPX = rna+Lipoplex;CD = 分化羣;TLR = toll 樣受體;NF = 壞死因子;MHC = 主要組織相容性複合體;TCR = T 細胞受體;TAP = 與抗原處理相關的轉運蛋白。

mRNA 癌症疫苗可以實現針對共享腫瘤抗原或個體新抗原的高特異性和強效激活免疫系統 128 個體患者樣本(血液和組織)人工智能驅動的新抗原預測按需定製 RNA 製造個性化免疫療法突變圖共享腫瘤抗原固定組合針對每種適應症量身定製的多抗原方法新抗原個性化療法多種共享抗原現成療法癌症疫苗平臺 inest1 FixVac 個體化療法新抗原特異性免疫療法固定抗原疫苗抗原 1 抗原 2 抗原 3 抗原 4 1. iNest 是與羅氏集團成員基因泰克合作開發的。mRNA = 信使 RNA;AI = 人工智能。

針對多種實體瘤的候選癌症疫苗產品組合不斷增加 129 1.與羅氏集團成員基因泰克合作;2.由 Regeneron 贊助。iNest = 個性化新抗原特異性免疫療法;1L = 一線;R/R = 復發/難治;CRC = 結直腸癌;PDAC = 胰腺導管腺癌;HPV = 人乳頭瘤病毒;HNSCC = 頭頸部鱗狀癌;NSCLC = 非小細胞肺癌;ADT = 雄激素剝奪療法;ctX = 化療。inest1 fixVac 多發性實體瘤 CRC 佐劑 PDAC 前列腺癌黑色素瘤 HPV16+ HNSCC nsclcMelanoma 1L R/R 1lneo-adj、mcrrr/R 1L、2L+ 六項正在進行的針對多種疾病的候選癌症疫苗的 2 期試驗settings Ph 2 研究正在進行中。數據來自研究者在 ASCO 2022 上發起並發表的 Ph 1 研究(Rojas 等人。Nature.2023) Ph 2 始於 2023 年第四季度 Ph 1 數據顯示 Ph 1/2 正在進行中 Ph 2 研究正在進行中 Ph 2 研究正在進行中來自 Ph1 的已發佈數據(Sahin 等人Nature.2020) Ph 1 籃子研究正在進行中 Ph 1 L NSCLC 於 2022 年第三季度開始的 Ph 2 註冊已完成 Pfs 作為主要終點的分析將基於事件觸發,並定義我們何時報告結果 Autogene cevumeran/ BNT122 + Atezolizumab Autogene cevumeran/ BNT122 單藥自基因 cevumeran/ BNT122 + 1x Monzolizumab BNT112 療法和 + Cemiplimab + ADT BNT111 +/-Cemiplimab Pembrolizumab +/-BNT113 BNT116 單一療法和 Cemiplimab 或 ctX Autogene cevumeran/ BNT122 + Pembrolizumab

我們的 mRNA 癌症疫苗潛在領導力戰略 130 旨在建立商業化製造能力目標是建立 BioNTech 商業製造設施旨在提高臨牀製造能力繼續縮短生產時間遷移到全自動平臺以進一步縮短週期繼續推進管道目標在輔助環境中啟動更多後期臨牀試驗繼續改進新抗原選擇進一步提高 AI/ML 能力,通過以下方式改善臨牀樣本分析高通量測序和基因組學技術開發 AI = 人工智能;ML = 機器學習。

首次使用我們的個性化mRNA新抗原疫苗的結內版本的人體1期研究 Sahin等人。自然。2017 年。13 名 IIIA-C 期患者(6 名患者)、靜脈注射(7 名患者)黑色素瘤患者 131 評估晚期黑色素瘤患者 NY-ESO-1/酪氨酸酶疫苗進行淋巴結內注射的個體化新抗原特異性 mRNA 疫苗的安全性、耐受性和免疫原性(NCT01684241)

靜脈注射後 CD8+ T 細胞 ELISPOT 使用裸體個體化 mRNA 基礎新抗原疫苗進行淋巴結內疫苗誘導的 T 細胞反應的長期持續性新抗原 T 細胞活體 Multimer 染色 0 100 200 300 400 0.0 0.2 0.3 1600 1700 治療開始後% m u lt im e r+ o f C D 8 + T c e 哈哈 UTP6 (H137Y) YSNKPALW /HLA-B*5701 CLINT1 (T472I) VSKILPSTW /HLA-B*5701 COX7A2 (A84V) GVADVLLYR /HLA*1101 治療開始多年後 4.5 COX7A2 (A84V) GVADVLLYR /HLA-A*1101 CLINT1 (T472I) VSKILPSTW /哈哈-B*5701 UTP6 (H137Y) YSNKPALW/HLA-B*5701 0.015 0.055 0.064 4.5 開始治療後 4.5 年 132 Türeci,在 CICON2023 上發表。

對結內疫苗接種後的患者進行為期6年的被動隨訪,使用基於mRNA的裸體個性化新抗原疫苗進行為期6年的被動隨訪 133 Sahin等人。自然。2017 年,Türeci,在 CICON23 上發表

利用體細胞癌突變開發基於 mrna-lpx 的新抗原疫苗 Vormehr 等人,Curr Opin Immunol 39:14-22(2016)。MSI = 微衞星不穩定性;msi-H = 微衞星不穩定性高;非同義單核苷酸變體。MSS = 微衞星穩定;LPX = 脂質體 134

三陰性乳腺癌胰腺導管腺癌早期癌症適應症中未得到滿足的醫療需求高 135 CPI = 檢查點抑制劑;聚合酶鏈反應 = 病理完全反應;CRC = 結直腸癌,TNBC = 三陰性乳腺癌;PDAC = 胰腺導管腺癌。1.Oettle,H. 等JAMA 2013;2.Neoptolemos、J.P. 等人NEJM 2004。結直腸癌輔助治療後 5 年內複發率 69− 75% • 到 2030 年將成為美國第二大癌症相關死亡原因 • 僅切除術後的 5 年存活率約為 10% 1,2 • 由於突變負擔低,突變衍生的新抗原連續很少,在輔助治療後 4 年內複發率 35-45% 在 4 年內複發率 20-35% 輔助療法 • 結合化療+ pembro的新輔助治療方案會增加達到聚合酶鏈反應的患者人數 • 未達到 pCR 的患者預後不佳新輔助治療後 • 局部區域性疾病的5年存活率約為70% • ctDNA是最小殘留疾病的標誌,因此可以識別疾病復發風險高的患者 • 在ctdna陽性、2期(高風險)和3期CRC中,無病1期試驗的持續時間已在調整後完成。PDAC 隨機化 2 期試驗開始了 1 期試驗,完成後(neo)佐劑 TNBC 隨機化 2 期試驗啟動並招募人員

BNT122 在(新)輔助治療後 TNBC 患者中進行的 1 期探索性試驗 136 TNBC = 三陰性乳腺癌;TAA = 腫瘤相關抗原;UTR = 未翻譯區域;ORF = 開放閲讀框架;MITD = MHC i 靶向域。試驗設計納入標準侵襲性腺癌 TNBC(pt1cb0m0-任意 tanyNM0)篩查 • > 5 種新抗原鑑定(新抗原疫苗)•(新)輔助化療(和放療)• 治療開始前乳腺癌沒有復發治療 • 可選:非突變 TAA 疫苗治療 • 新抗原疫苗治療篩查非突變 TAA 疫苗可選(最多 6 支)) 新抗原疫苗 T 細胞:疫苗接種日 1 15 29 50 64 1 15 29 50 64 可選

在後(新)輔助設置中對接受 BNT122 治療的 TNBC 患者誘導持續的新抗原特異性免疫反應 137 0 50 0 0 0 10 00 P01 P02 P05 P06 P07 P08 P09 P10 P12 P13 P14 2、00 0 3、00 0 5、00 0 0、00 0、00 0、0 0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0、0 0 0 0、0 0 0 幅度高且持續時間長達 600 天 CD8 H EA TR 2 (R 4 7 Q) H LA M u lt im er P P P 1 R 1 5 B (S 2 7 8 T) H LA M u lt im er Day -7 第 71 天 (+7) P01 0.10 0.16 5.66 10.34 0 100 200 0 0 10 15 300 600 治療開始後 P e r c e n t o f CD 8 + P01 HEATR2 (R47Q) Multimer+ IFN 和 TNF IFN + 0 100 200 0 0 2 4 6 300 600 治療開始後幾天 P e r c e n t o f C D 8 + P01 PPP1R15B (S278T) Multimer+ ifnand TNF IFN+ P01 HEATR2 (R47Q) PP1R15B 發佈於 CICON2023。S278TTNBC = 三陰性乳腺癌;HLA = 人類白細胞抗原;IFN = 幹擾素;TNF = 腫瘤壞死因子。

輔助胰腺導管腺癌中的 bnt122/autogene Cevumeran1 139 1.與羅氏集團成員基因泰克合作;2.羅哈斯等人自然。2023。mfolfirinox = 改良的 FOLFIRINOX;PDAC = 胰腺導管腺癌;q2w = 每 2 週一次。活躍、未招募研究者發起的單中心研究 (MSKCC) 數據發表在《自然》雜誌(Rojas 等人,2023 年)主要:安全性、免疫原性、可行性 18 個月無復發存活率 (RFS) BNT122 8 劑初始劑量 Atezolizumab 1 劑量 BNT122 1 次加強劑量 mfolfirinox 12 q2w 週期手術 0 周 6 周 9—17 周 21—43 周後續定製製造 BNT122;來自腫瘤樣本的最多 20 種新抗原納入標準可手術切除 PDAC • 無邊界切除術 • 無局部晚期或轉移 • 無新輔助治療 ≥5新抗原 StatusKey 終結點 1 期,開放標籤,研究者發起的試驗 (NCT04161755)

Autogene cevumeran/bnt1221 誘導輔助胰腺癌的免疫反應 140 1.與羅氏集團成員基因泰克合作。BNT122 誘導功能性新抗原特異性 T 細胞 Rojas 等人。自然。2023 在所有接種疫苗的患者中,有一半對至少一種疫苗產生了新抗原特異性從頭開始 T 細胞反應新抗原免疫原性無數據 N u m b e r o f e o a n ti g e n s i n ti g e n e c e v u m e ra n 20 15 10 5 0 患者反應者(n=8)非應答者(n=8)8) 10 29 25 25 5 6 14 1 3 19 4 20 9 18 23 28 R0/R1 R0 R0 R0 R0 R0 R0 R0 R0 R1 R0 R0 R0 R0 R0 R0 R0 R0 R0 R0 R0 R0 R0 儘管接受了 mfolfirinox 的治療,但疫苗擴增的 T 細胞仍然可以持續長達 2 年Autogene cevumeran mfolfirinox P e rc e n ta g e o f a ll b lo d c e ll s p e rc e n ta g e o f a ll b lo d c e ll s

Autogene cevumeran/bnt1221 在輔助胰腺癌中表現出臨牀活性 141 1。與羅氏集團成員基因泰克合作。PDAC = 胰腺導管腺癌;OS = 總存活率,RFS = 無復發存活率。O S (%) 10 0 50 0 0 6 12 面臨風險 19 18 18 9 24 30 0 月 R F S (%) 100 50 0 0 6 12 處於風險中 19 16 14 18 24 2 30 月 N=19 隨訪中位數:18.0 個月 BNT122 疫苗反應與 PDAC 延遲復發相關 Rojas 等人。自然。2023

bnt122/AutoGene Cevumeran1 在一項與 SoC 對比 Resected PDAC 142 1 的第 2 期隨機試驗中進行了研究。與羅氏集團成員基因泰克合作。SoC = 護理標準;PDAC = 胰腺導管腺癌;;CT = 計算機斷層掃描 ctX = 化療。關鍵終點主要:DFS 次要:DFS 費率、操作系統、操作系統費率和安全狀態 • 招募正在進行中 • FPD 2023 年 10 月納入標準 PDAC 切除術後沒有系統性抗癌治療的患者術後沒有疾病證據篩查 A 部分從血液和腫瘤樣本中確定 5 個新表位以定製製造 BNT122 篩查 B 部分根據/EX 標準 n=260 R 1:1 治療階段和給藥計劃在研究期間確定血液和腫瘤樣本中的 5 個新表位,在PDAC復發之前,定期對患者進行監測,新癌症的發生或不可接受的毒性,以先發生者為準。手術後 6-12 周隨機分組 Autogene cevumeran + atezolizumab + mfolfirinox Arm 2 mfolfirinox IMCODE003:第 2 期、開放標籤、多中心、隨機試驗 (NCT05968326) 切除餘量、節點受累分層因子

個性化 mRNA 癌症疫苗:關鍵要點 143 我們的目標是將個性化癌症疫苗引入多種癌症適應症的輔助治療環境中,包括低突變負擔的腫瘤和冷腫瘤類型腫瘤腫瘤質量低,有殘留的癌細胞腫瘤耐藥機制尚未完全建立更健康的免疫系統允許功能性 T 細胞反應低突變負擔高未得到滿足的需求,經批准的免疫療法無法解決已證明有能力生成持久的新抗原特異性多元抗原表位 T 細胞的反應多種感冒腫瘤類型輔助設置理由:

9 價值創造之路瑞安·理查森首席戰略官

145 戰略展望 1.與輝瑞合作。COVID-191 免疫腫瘤學傳染病戰略推進聯合疫苗和下一代疫苗的商業特許經營權從2026年起執行關鍵試驗並推出多種產品啟動首批後期開發計劃利用輝瑞的全球基礎設施推動 COVID-19 疫苗特許經營權的下一階段領導地位建立完全整合的全球組織,以發現、開發和商業化創新性 mRNA 預防和治療性候選疫苗的高級產品線

現金狀況1 COVID-19 疫苗特許經營腫瘤管道傳染病管道2030年戰略願景 146 1.截至2023年9月30日;2.數字為税前。170億歐元現金 20億歐元貿易應收賬款2 利息收入市場領先的疫苗擴建後期產品線擴張前期產品線強勁的資產負債表多疫苗投資組合多種商業產品和新型後期產品線今日首批獲批產品和後期管道今天 2030 年願景關鍵價值驅動因素多元化、產生現金流的多產品組合現金流產生

持續長期增長之路147 1.截至2023年9月30日。S&M = 銷售和營銷;BD = 業務發展;併購 = 兼併與收購。2025-20282023 年 • 如果實現 2023 年全年收入預期,則有望實現盈利 • 對BD/M&A的投資約10億歐元 • 增加對關鍵試驗的腫瘤學研發投資 • 保持精益的銷售和收購成本基礎 • 保持強勁的資產負債表可持續戰略增長目標:• 多種新產品批准 • 首批腫瘤學上市和組合疫苗帶來的收入增長 • 盈利且現金流為正 •保持強勁的資產負債表

價值創造之路 148 以關鍵試驗為重點增加研發投資繼續開展以協同資產為重點的BD和併購利用特定地區的合作伙伴增強腫瘤學商業能力將傳染病和腫瘤學領域的多種新產品商業化為股東、患者和社會創造價值

2023 年創新系列謝謝通過 investors@biontech.de 聯繫我們