
附錄 99.1

Belite Bio在AAO年會上公佈了Tinlarebant治療兒童發作Stargardt病的為期 24 個月 的 2 期研究結果
| · | Tinlarebant(a/k/a LBS-008)是 Belite Bio 的口服 片劑,旨在減緩晚期 乾性年齡相關黃斑變性(乾性 AMD)中受星加特病(STGD1)和地理萎縮(GA)影響的患者的疾病進展 | |
| · | 在 的 24 個月治療期內,Tinlarebant 對所有受試者都是安全的,耐受性良好 | |
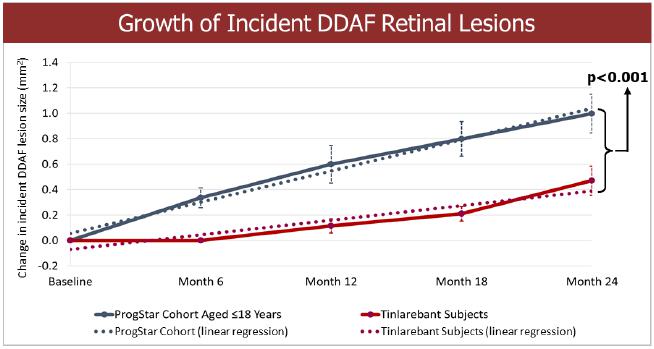
| · | 通過比較接受丁拉瑞班特治療的 受試者和具有相似基線特徵(年齡≤18 歲)的 ProgStar 參與者 24 個月的 DDAF 病變生長情況,結果顯示,在 24 個月的治療期內,接受丁拉瑞班特治療的受試者 DDAF 病變 的生長持續降低(p | |
| · | 42% 的 TinlaRebant 治療受試者(12 人中有 5 人)在 24 個月的治療期內沒有出現 萎縮性視網膜病變 | |
| · | 一項針對兒童期發作 STGD1 的 Tinlarebant (“DRAGON” 研究)為期兩年的全球 3 期研究(“DRAGON” 研究)的全面入組已經完成 |
聖地亞哥,2023 年 11 月 6 日-Belite Bio, Inc(納斯達克股票代碼:BLTE)是一家臨牀階段的生物製藥藥物開發公司,專注於開發針對醫療需求嚴重未得到滿足的 退行性視網膜疾病的新療法,該公司公佈了美國眼科學會為期 24 個月的青少年 STGD1(“LBS-008-CT02”)Tinlarebant 2期研究的最終數據 (AAO) 年會。
Belite Bio董事長兼首席執行官Tom Lin博士表示:“Tinlarebant的第二階段最終結果對Belite Bio來説是一個重要的里程碑,為我們正在進行的各項試驗提供了額外的基礎支持。”“最終的第二階段數據繼續證明瞭Tinlarebant的安全性,並顯示,與ProgStar參與者相比,在兩年的治療期內, 的DDAF病變生長持續降低。我們希望在正在進行的 3 期 DRAGON 研究中看到類似的數據 ,進一步支持 Tinlarebant 作為 STGD1 患者的有前途的口服治療藥物。”

該研究的首席研究員兼悉尼大學眼科專業 主任、韋斯特米德和悉尼眼科醫院悉尼兒童醫院網絡 的眼科顧問醫生約翰·格里格教授介紹了最終的研究數據。“這項2期研究令人鼓舞的是,為期24個月的治療 的最終結果令人鼓舞。兒童期發作 STGD1 的自然進展特徵是視力迅速下降, 快速疾病進展,導致在很小的時候就永久性視力喪失。我們很高興2期最終數據繼續 表明,研究隊列的疾病進展減緩,包括視力穩定在內的多個結構和功能參數趨於穩定。”
在Tinlarebant的2期研究中,共有12名年齡在12-18歲之間的青少年 STGD1 受試者完成了 24 個月的治療。
主要研究發現:
| · | Tinlarebant 安全且耐受性良好,沒有因不良事件而停藥。 | |
| · | 視網膜成像顯示,12名受試者中有5名在Tinlarebant治療24個月後仍未出現萎縮性視網膜病變(稱為自體熒光明顯降低 或 DDAF)。 | |
| · | 對接受丁拉瑞班特治療的受試者和具有相似 基線特徵(年齡≤18歲)的ProgStar參與者之間24個月的DDAF病變增長進行比較顯示,在24個月的 治療期內,接受丁拉瑞班特治療的受試者的DDAF病變生長持續降低(p | |
| · | 在研究期間,大多數受試者的視力保持穩定,經過24個月的治療,平均失去了五個字母 (損失為 | |
| · | 演示幻燈片的 副本可在此處獲得(鏈接)。 |

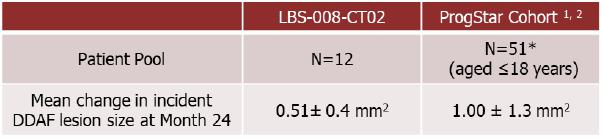
*由於一名受試者的篩查FAF數據不可分級,因此只有50名來自ProgStar隊列(年齡≤18) 的患者被納入分析。
| 1. | Strauss RW、Ho A、Munoz B 等。繼發於斯塔加特病的萎縮進展的自然史(progStar) 研究:設計和基線特徵:ProgStar第1號報告。眼科學。2016;123 (4): 817-28。 | |
| 2. | Strauss RW、Muñoz B、Ho A 等。在回顧性 Stargardt 病進展研究中,由眼底自發熒光確定的斯塔加特病的進展(ProgStar 第 9 號報告)。JAMA Othalmol。2017;135 (11): 1232-1241。 |
關於 DRAGON 研究
這項為期2年的3期研究(DRAGON)是一項多中心、隨機、 雙掩碼、安慰劑對照研究,旨在評估TinlaRebant治療青少年受試者StarGardt 病的安全性和有效性。該研究已完成招募(104名受試者),預計將在2024年中後期 發佈為期一年的中期數據。欲瞭解更多信息,請訪問 clinicaltrials.gov,網址為 https://www.clinicaltrials.gov/ct2/show/NCT05244304?term=belite+bio&draw=2&rank=1)。

關於 Tinlarebant (a/k/a LBS-008)
Tinlarebant 是一種新型的口服療法, 旨在減少維生素類毒素的積累(稱為 bisretinoids)在 STGD1 和 中導致視網膜疾病也會導致 GA 或晚期乾性 AMD 的疾病進展。Bisretinoids 是視覺週期的副產物, 依賴於眼睛的維生素 A(視黃醇)的供應。Tinlarebant 的工作原理是降低和維持血清視黃醇 結合蛋白 4(RBP4)的水平,視黃醇從肝臟輸送到眼睛的唯一載體蛋白。通過調節 視黃醇進入眼睛的量,Tinlarebant 可減少雙視黃醇的形成。Tinlarebant 在美國被授予快速通道稱號和 罕見兒科疾病稱號,在美國和歐洲被授予用於治療 STGD1 的孤兒藥稱號。
Stargardt 病 (STGD1)
STGD1 是成人和兒童中最常見的遺傳性視網膜營養不良症 (導致中心視力模糊或喪失)。這種疾病是由視網膜特異性基因 的突變引起的ABCA4),這會導致雙維甲酸的逐漸積累,導致視網膜細胞死亡和中央 視力逐漸喪失。雙維甲酸的熒光特性和視網膜成像系統的發展幫助眼科醫生識別 並監測疾病進展。目前,尚無美國食品藥品管理局批准的 STGD1 治療方法。
重要的是,STGD1 和 GA,或晚期 Dry AMD, 具有相似的病理生理學,其特徵是雙維甲酸過度積累、視網膜細胞死亡和進行性 視力喪失。儘管 “死視網膜” 出現外周擴張,但視力喪失的發生速度緩慢,直到疾病到達眼睛中心 (黃斑)。因此,Belite Bio打算在一項為期2年 3期研究(PHOENIX)中評估丁拉瑞班對喬治亞州患者的安全性和有效性。
晚期乾性年齡相關性黃斑變性 GA (乾性 AMD)
乾性 AMD 是年長 成年人視力下降的主要原因。Geography Atrophy(GA)是 Dry AMD 的高級階段。目前,沒有 FDA 批准的 GA 口服治療藥物 ,除了 GA 以外,也沒有 FDA 批准的乾性 AMD 其他階段的療法。據估計,美國 有2000萬AMD患者,全球有超過1.96億患者,估計全球直接醫療費用為2550億美元。
關於 Belite Bio
Belite Bio是一家臨牀階段的生物製藥 藥物開發公司,專注於開發針對嚴重未得到滿足的 醫療需求的退行性視網膜疾病的新療法,例如晚期乾性 AMD 中的 STGD1 和 GA,以及特定的代謝性疾病。欲瞭解更多信息,請在 Twitter、Instagram、LinkedIn、Facebook 上關注我們或訪問我們的 www.belitebio.com。

關於前瞻性陳述的重要注意事項
本新聞稿包含有關未來預期和計劃的前瞻性 陳述,以及有關非歷史事實事項的其他陳述。這些陳述 包括但不限於有關臨牀數據對患者的潛在影響、Belite Bio的進展 和預期的臨牀前活動、臨牀開發、監管里程碑和候選產品的商業化 的陳述,以及包含 “期望”、“希望” 和類似表達方式的任何其他陳述。由於各種重要因素,包括但不限於 Belite Bio證明其候選藥物安全性和有效性的能力;可能不支持進一步開發或監管批准的候選藥物的臨牀結果 ;相關監管機構 就Belite Bio候選藥物的監管批准做出的決策的內容和時間, ,實際結果可能與前瞻性陳述中顯示的結果存在重大差異;Tinlarebant 的潛在功效,以及那些 風險在Belite Bio向美國證券交易所 委員會提交的文件中的 “風險因素” 部分進行了更全面的討論。所有前瞻性陳述均基於Belite Bio目前獲得的信息,除非法律要求 ,否則Belite Bio沒有義務公開更新或修改任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。
媒體和投資者關係聯繫人:
詹妮弗·伍 ir@belitebio.com
Argot 合夥人 belitebio@argotpartners.com