sgmo-202311022023年11月2日0001001233假的00010012332023-11-022023-11-02 美國
證券交易委員會
華盛頓特區 20549
表單 8-K
當前報告
根據第 13 條或第 15 (d) 條
1934 年《證券交易法》
報告日期(最早報告事件的日期): 2023年11月2日
SANGAMO 治療公司
(註冊人的確切姓名如其章程所示)
| | | | | | | | | | | | | | |
| | | | |
| 特拉華 | | 000-30171 | | 68-0359556 |
(州或其他司法管轄區
公司) | | (委員會
文件號) | | (國税局僱主
證件號碼) |
7000 Marina Blvd。, 布里斯班, 加利福尼亞94005
(主要行政辦公室地址)(郵政編碼)
(510) 970-6000
(註冊人的電話號碼,包括區號)
不適用
(如果自上次報告以來發生了變化,則為以前的姓名或以前的地址)
如果提交8-K表格是為了同時履行註冊人根據以下任何條款承擔的申報義務,請勾選下面的相應方框:
| | | | | |
| ☐ | 根據《證券法》(17 CFR 230.425)第425條提交的書面通信 |
| | | | | |
| ☐ | 根據《交易法》(17 CFR 240.14a-12)第14a-12條徵集材料 |
| | | | | |
| ☐ | 根據《交易法》(17 CFR 240.14d-2 (b))第14d-2(b)條進行的啟動前通信 |
| | | | | |
| ☐ | 根據《交易法》(17 CFR 240.13e-4 (c))第13e-4(c)條進行的啟動前通信 |
根據該法第12(b)條註冊的證券: | | | | | | | | | | | | | | |
| | | | |
| 每個班級的標題 | | 交易品種 | | 註冊的每個交易所的名稱 |
| 普通股,每股面值0.01美元 | | SGMO | | 納斯達克全球精選市場 |
用複選標記表明註冊人是1933年《證券法》第405條(本章第230.405節)還是1934年《證券交易法》第12b-2條(本章第240.12b-2節)所定義的新興成長型公司。
新興成長型公司☐
如果是新興成長型公司,請用複選標記表明註冊人是否選擇不使用延長的過渡期來遵守根據《交易法》第13(a)條規定的任何新的或修訂後的財務會計準則。☐
項目 8.01 其他活動。
Giroctocogene fitelparvovec,也稱為 SB-525,是治療中度至重度 A 型血友病的候選基因療法產品,也是我們的 1/2 期 Alta 研究和註冊的 3 期 AFFINE 臨牀試驗的主題。我們正在與我們的合作者輝瑞公司(Pfizer Inc.)一起開發giroctogene fitelparvovec。我們和輝瑞計劃在65的平臺演示中提供來自Alta第1/2期研究的最新數據,其中已接受摘要的摘要摘要見下文第四美國血液學會年會和博覽會將於2023年12月11日舉行。輝瑞預計,評估giroctogene fitelparvovec的3期AFFINE試驗將在2024年中期獲得關鍵結果。
Giroctocogene Fitelparvovec 的 1/2 期 Alta 研究的最新初步結果摘要
•Alta 是一項 1/2 期單劑量多中心劑量範圍研究,旨在評估 giroctogene fitelparvovec 在成人重度 A 型血友病中的安全性和耐受性。
•在4個隊列中,向年齡≥18歲的成年人注射了四種遞增劑量的giroctogene fitelparvovec(9e11、2e12、1e13和3e13 vg/kg)。高劑量(3e13vg/kg)隊列擴大到5名參與者。
•關鍵終點包括安全性、循環因子VIII或FVIII、活性、FVIII 替代療法的使用以及出血事件的頻率。
•共有11名男性參與者參與了這項研究,其中5名參與者屬於3e13-vg/kg最高劑量隊列。截至2023年5月19日的截止日期,所有參與者都已被跟蹤了153至290周。第156周後,兩名參與者離開了研究。在其餘的參與者中,有1名參與者尚未完成4年(208周)。在高劑量隊列(n=5)中報告的最常見的治療相關不良事件(AE)是肝酶升高和輸液相關反應:丙氨酸氨基轉移酶(ALT;n=3)升高 [60.0%]),增加天冬氨酸氨基轉移酶(AST;n=2 [40.0%])、發熱 (n=3 [60.0%]) 和心動過速 (n=2 [40.0%]).
•在最高劑量隊列中,有一名受試者報告了與治療相關的嚴重不良事件,該參與者在giroctocogene fitelparvovec輸注大約六小時後出現低血壓和發熱;這些事件在治療後完全消退,第二天輸液後出院時間沒有延遲。
•在高劑量隊列的5名參與者中,有4名觀察到需要服用皮質類固醇≥7天的ALT增加的不良事件。ALT 升高是通過逐漸縮小皮質類固醇療程(中位持續時間:56 天;範圍:7—135 天),同時維持有效的 FVIII 活性水平來控制的。高劑量隊列的參與者自第65周以來沒有服用過類固醇,ALT值在正常範圍內(隨訪:156—208周),肝臟磁共振成像檢查結果正常(隨訪:104—208周)。
•截至2023年5月19日截止日期,沒有出現經證實的FVIII抑制劑開發,也沒有報告血栓形成事件或肝腫塊。
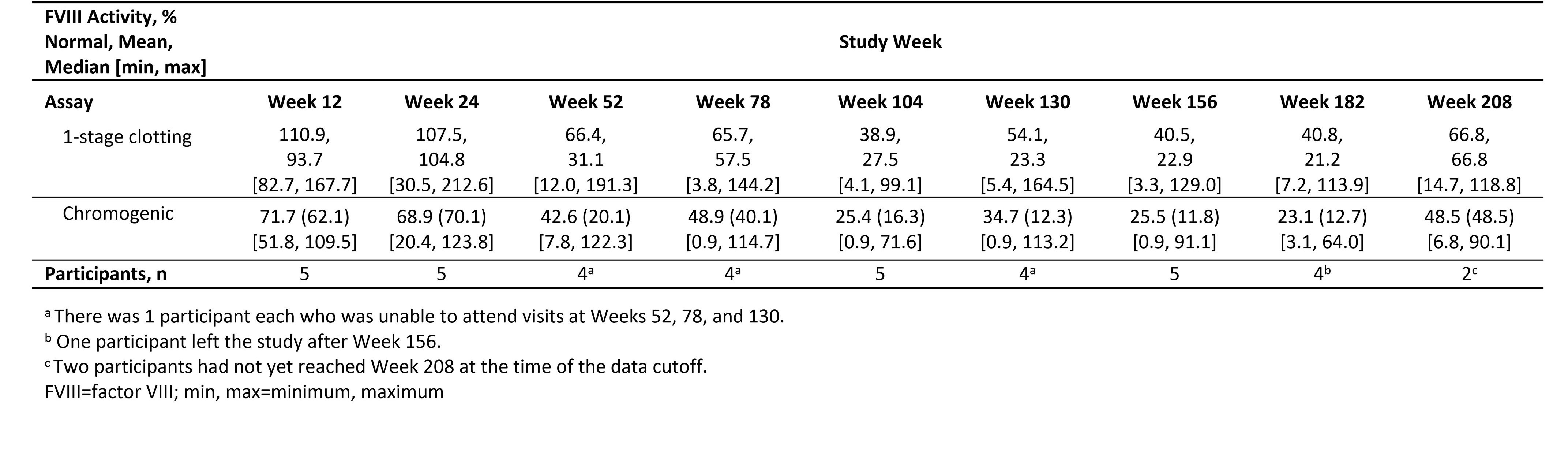
•在高劑量隊列的5名參與者中,有2人獲得了截至第208周的數據,FVIII活性保持在輕度至正常範圍內(見下表1),與第156周的結果一致。在沒有第208週數據的人中,有2人有截至第182周的數據。一名參與者的FVIII活性維持在温和的範圍內(分別為正常水平的14.1%和24.1%,通過顯色和1階段分析測量);另一名參與者的FVIII活性為3.1%和7.2%。其餘參與者在第156周後離開了研究,FVIII活性維持在温和區間(11.8%和22.9%)。
•在高劑量隊列中,平均年化總出血率 [(研究藥物輸注 3 周後開始的所有出血發作次數)/(觀察期(以年為單位)]輸液後的第一年為0,在整個隨訪時間內為1.2(SD 2.58)。在該隊列中,FVIII 活動水平最低的參與者共經歷了 22 次出血,其中 21 次需要治療(8 次創傷;7 次自發;6 次未知)。其他 4 名參與者沒有出血或極少出血,包括 1 名目標關節出血的受試者。截至截止日期,高劑量隊列中沒有參與者恢復預防。
•對患有嚴重血友病 A 的參與者進行單次輸注 giroctogene fitelparvovec 基因療法在輸注後近 4 年內通常仍能保持良好的耐受性,FVIII 水平相應升高在中度至正常範圍內,沒有持續的AE,自第 59 周以來沒有與肝功能檢查增加相關的不良反應。
表 1:Giroctogene Fitelparvovec 3e13-vg/kg 隊列的 1 階段和顯色測定法得出的因子 VIII 活性水平
簽名
根據1934年《證券交易法》的要求,註冊人已正式促使經正式授權的下列簽署人代表其簽署本報告。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | |
| | | | SANGAMO 治療公司 |
| | | |
| 日期:2023 年 11 月 3 日 | | | | 來自: | | /SCOTT B. WILLOUGHBY |
| | | | 姓名: | | 斯科特·B·威洛比 |
| | | | 標題: | | 高級副總裁、總法律顧問兼公司祕書 |