

1b 期試驗更新:評估 Tegoprubart 預防腎移植患者排斥反應的能力 2023 年 11 月 2 日展覽 99.2

前瞻性陳述本演示文稿包含涉及重大風險和不確定性的前瞻性陳述。關於公司未來預期、計劃和前景的任何陳述,包括有關其戰略、未來運營、候選產品開發的陳述,以及其他包含 “相信”、“預期”、“計劃”、“預期”、“估計”、“打算”、“預測”、“項目”、“目標”、“可能”、“可能” 和類似表述的陳述,均構成前瞻性陳述 1995年的《私人證券訴訟改革法》,儘管並非所有前瞻性陳述都包含此類識別性詞語。前瞻性陳述包括但不限於以下方面的陳述:對產品開發或臨牀試驗開始和完成時間的預期;公司產品的市場接受率和程度及臨牀效用;公司的商業化、營銷和製造能力和戰略;公司的知識產權地位和戰略;公司識別具有巨大商業潛力的其他產品或候選產品的能力;公司的估計涉及支出、未來收入、資本要求和額外融資需求;與公司競爭對手和行業相關的發展;以及政府法律和法規的影響。由於各種重要因素,實際結果可能與此類前瞻性陳述所顯示的結果存在重大差異,包括:開發商業上可行的產品配方的能力;公司現金資源的充足性;獲得必要的監管和倫理批准以啟動更多臨牀試驗的能力;早期臨牀試驗的數據是否能表明將從未來臨牀試驗中獲得的數據;臨牀試驗的結果是否值得提交監管機構任何研究產品的批准;任何此類提交的材料是否會獲得美國食品藥品監督管理局或同等外國監管機構的批准,以及如果我們能夠獲得研究產品的此類批准,該產品是否會成功分銷和上市。我們截至2022年12月31日止年度的10-K表年度報告以及向美國證券交易委員會提交的其他文件(可在www.sec.gov上查閲)中討論了這些風險和不確定性,以及可能導致公司的實際業績與其中包含的前瞻性陳述存在顯著差異的其他風險和不確定性。本演示文稿中包含的任何前瞻性陳述僅代表截至本文發佈之日,不代表未來的任何日期,並且該公司明確表示不打算更新任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。照片:Gertrude “Trudy” Elion,硫唑嘌呤的發明者,1988 年諾貝爾醫學獎獲得者。
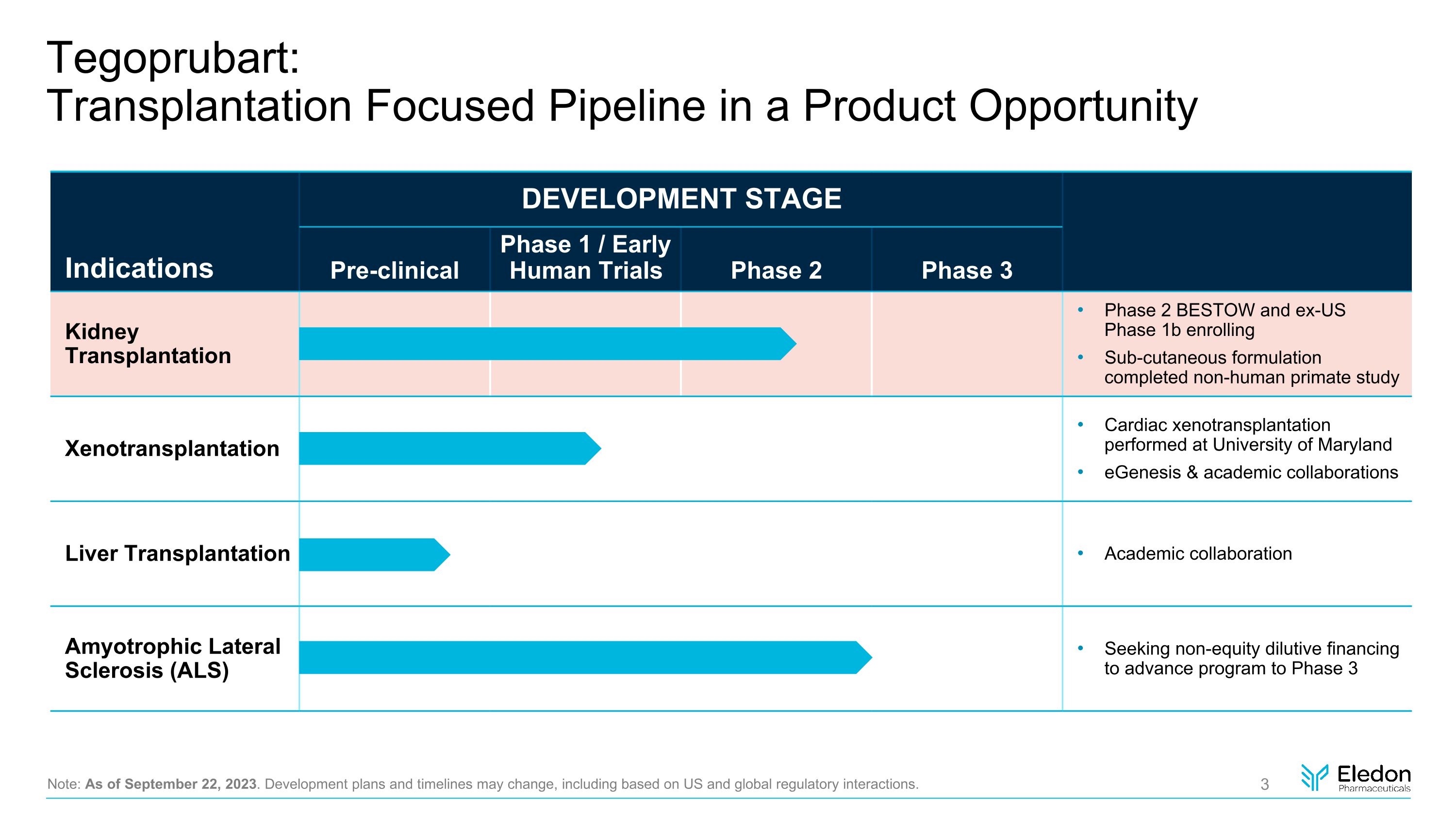
Tegoprubart:產品機會説明中以移植為重點的產品線:截至2023年9月22日。發展計劃和時間表可能會發生變化,包括基於美國和全球監管互動的變化。適應症開發階段臨牀前1期/早期人體試驗2期腎臟移植2期BESTOW和美國前1b期註冊皮下配方已完成非人靈長類動物研究異種移植在馬裏蘭大學進行的異種移植心臟異種移植肝移植肝移植學術合作肌萎縮性側索硬化症(ALS)尋求非股權稀釋融資以將項目推進到第三階段
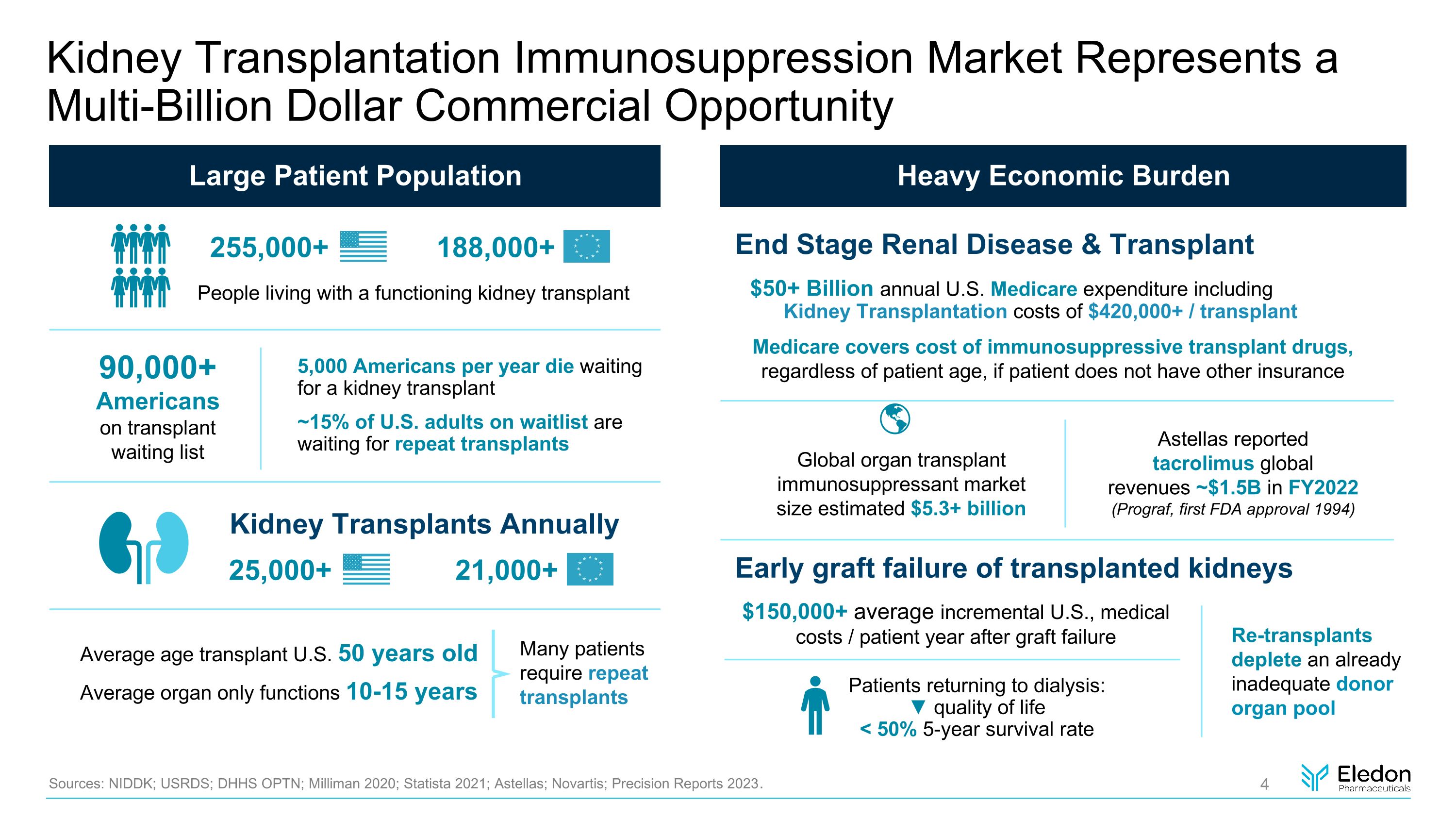
腎臟移植免疫抑制市場代表着數十億美元的商業機會龐大的患者羣體來源:NIDDK;USRDS;DHHS OPTN;Milliman 2020;Statista 2021;安斯泰來;諾華;2023 年精準報告。如果患者沒有其他保險,則末期腎臟疾病和移植醫療保險涵蓋免疫抑制移植藥物的費用,無論患者年齡大小,全球器官移植免疫抑制劑市場規模估計為53億美元安斯泰來報告稱,他克莫司在 FY2022 中全球收入約為15億美元(Prograf,1994 年首次獲得美國食品藥品管理局批准)沉重的經濟負擔移植腎臟早期移植失敗包括腎移植費用在內的美國醫療保險支出超過 500 億美元的 420,000 美元以上/移植患有功能性腎臟移植手術的人 255000+ 188,000+ 許多患者需要重複移植平均年齡移植美國 50 歲平均器官僅起作用 10-15 歲 150,000美元以上的平均增量美國,醫療費用/患者移植失敗後的一年再移植會耗盡已經不足的供體器官庫恢復透析的患者:▼ 生活質量
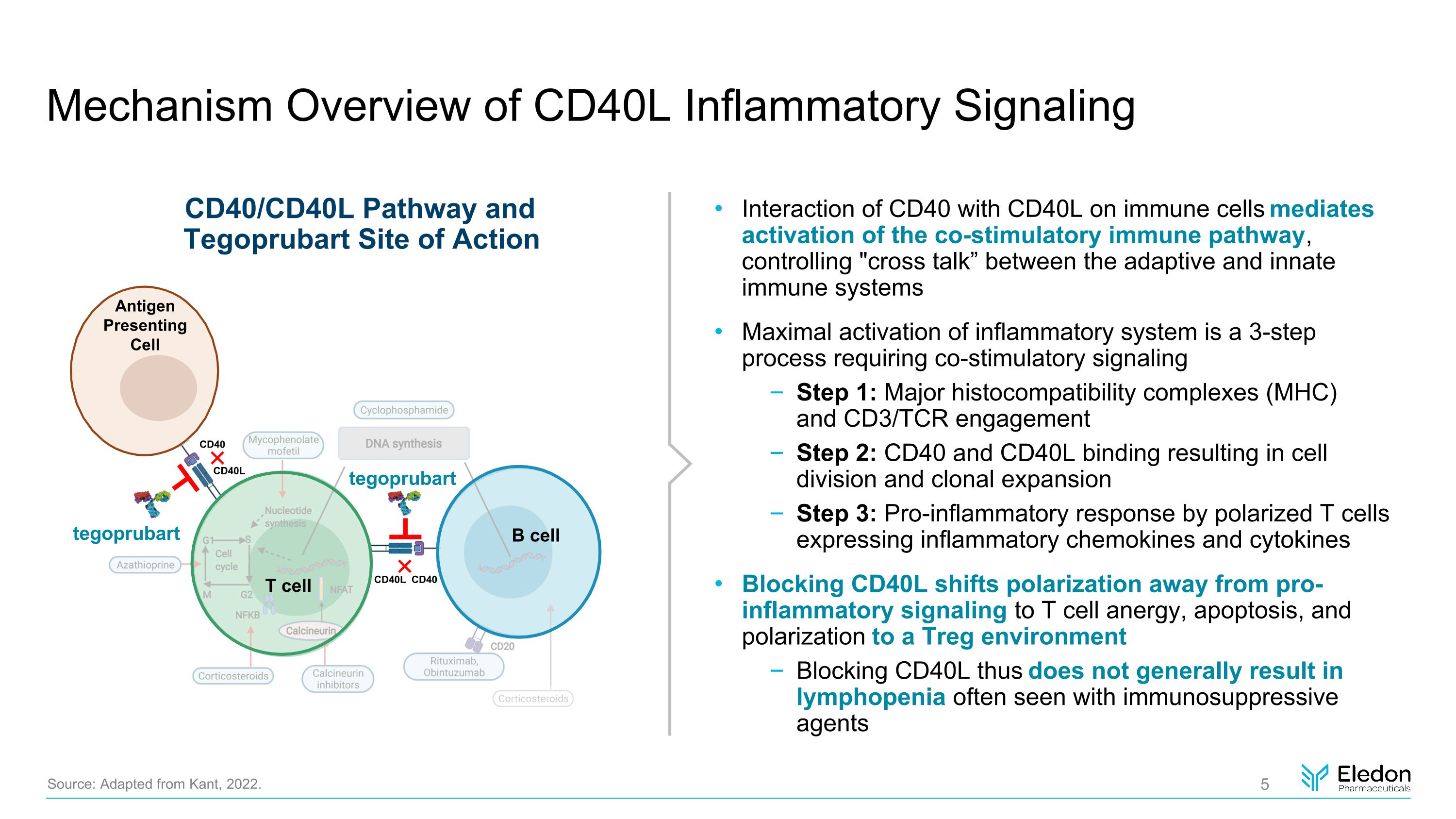
CD40L 炎症信號通路概述 CD40 與 CD40L 對免疫細胞的相互作用介導共刺激免疫途徑的激活,控制適應性免疫系統和先天免疫系統之間的 “串擾” 炎症系統最大激活是一個需要共同刺激信號傳導的 3 步過程:主要組織相容性複合物 (MHC) 和 CD3/TCR 參與步驟 2:CD40 和 CD40L 結合導致細胞分裂和克隆擴張第 3 步:Pro-TCR 表達炎症趨化因子的極化 T 細胞產生的炎症反應以及阻斷 CD40L 的細胞因子將兩極分化從促炎信號轉移到 T 細胞能量、細胞凋亡和極化轉向 Treg 環境因此阻斷 CD40L 通常不會導致免疫抑制劑經常出現的淋巴減少來源:改編自康德,2022 年。T 細胞 B 細胞 CD40L CD40 CD40L CD40 tegoprubart tegoprubart 抗原呈遞細胞 CD40/CD40L 途徑和 Tegoprubart 作用位點
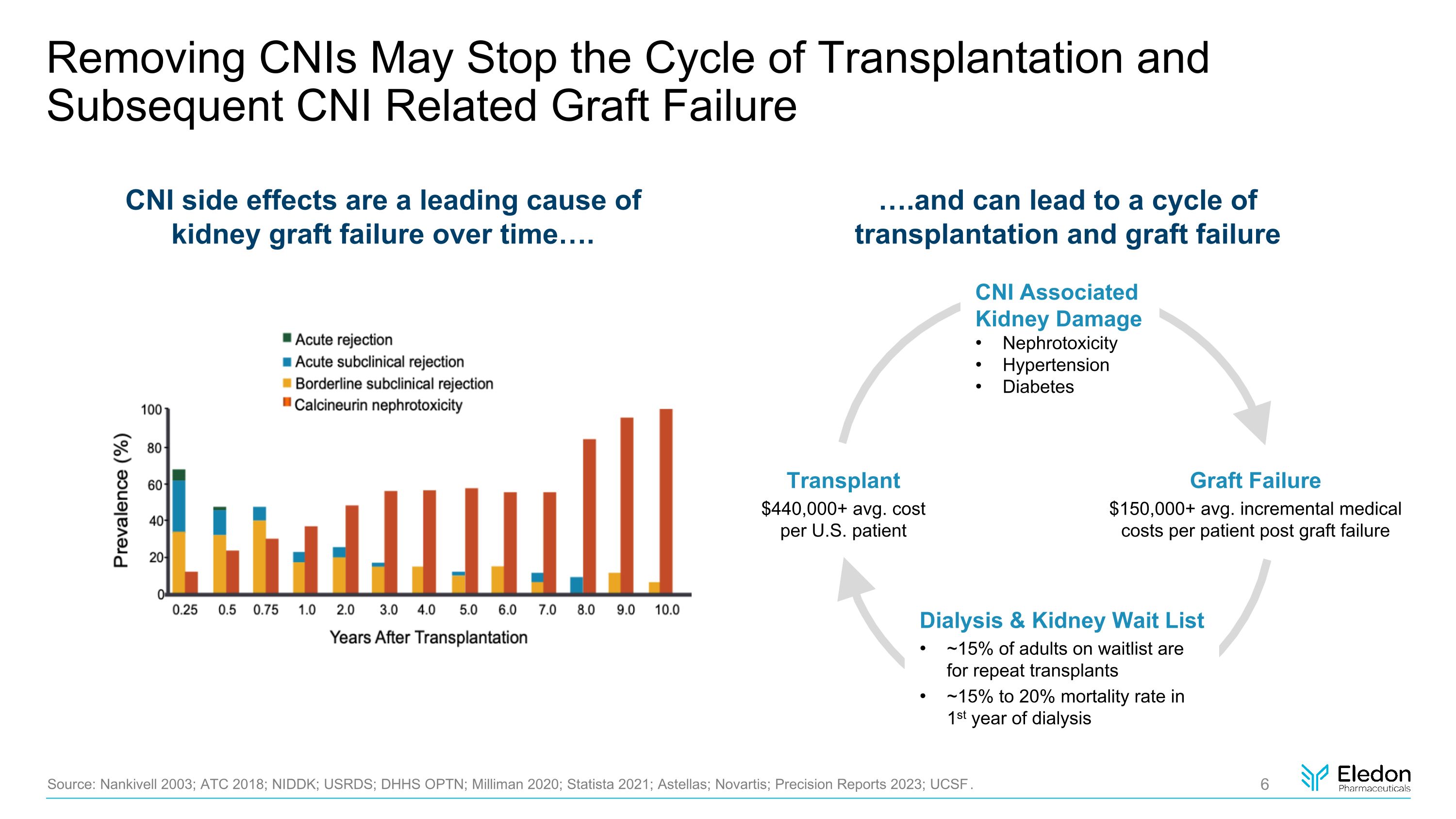
切除CNI可能會停止移植週期和隨後的CNI相關移植失敗來源:Nankivell 2003;ATC 2018;NIDDK;USRDS;DHHS OPTN;Milliman 2020;Statista 2021;安斯泰來;諾華;2023 年精準報告;加州大學舊金山分校。隨着時間的推移,CNI 副作用是腎移植失敗的主要原因 。 .and 可能導致移植和移植失敗的週期移植每位美國患者的平均費用超過 440,000 美元透析和腎臟等候名單 ~ 15% 的成年人重複移植 ~ 透析移植失敗第一年的死亡率平均為 150,000 美元以上。移植失敗後每位患者的增量醫療費用 CNI 相關腎損傷腎毒性高血壓糖尿病
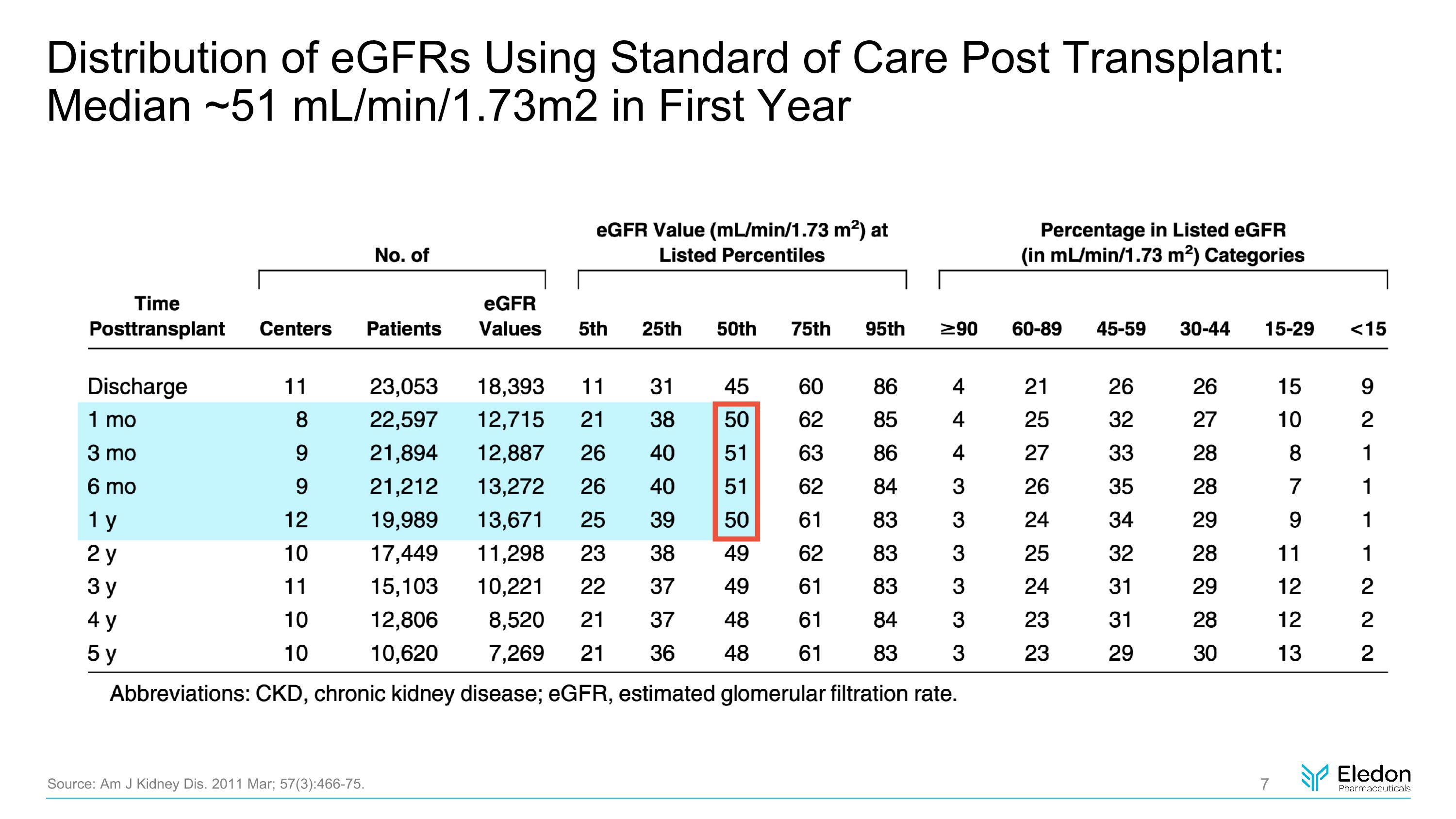
移植後使用護理標準的表皮生長因子分佈:第一年中位數約為 51 mL/min/1.73m2 來源:Am J Kidney Dis. 2011 年 3 月;57 (3): 466-75。
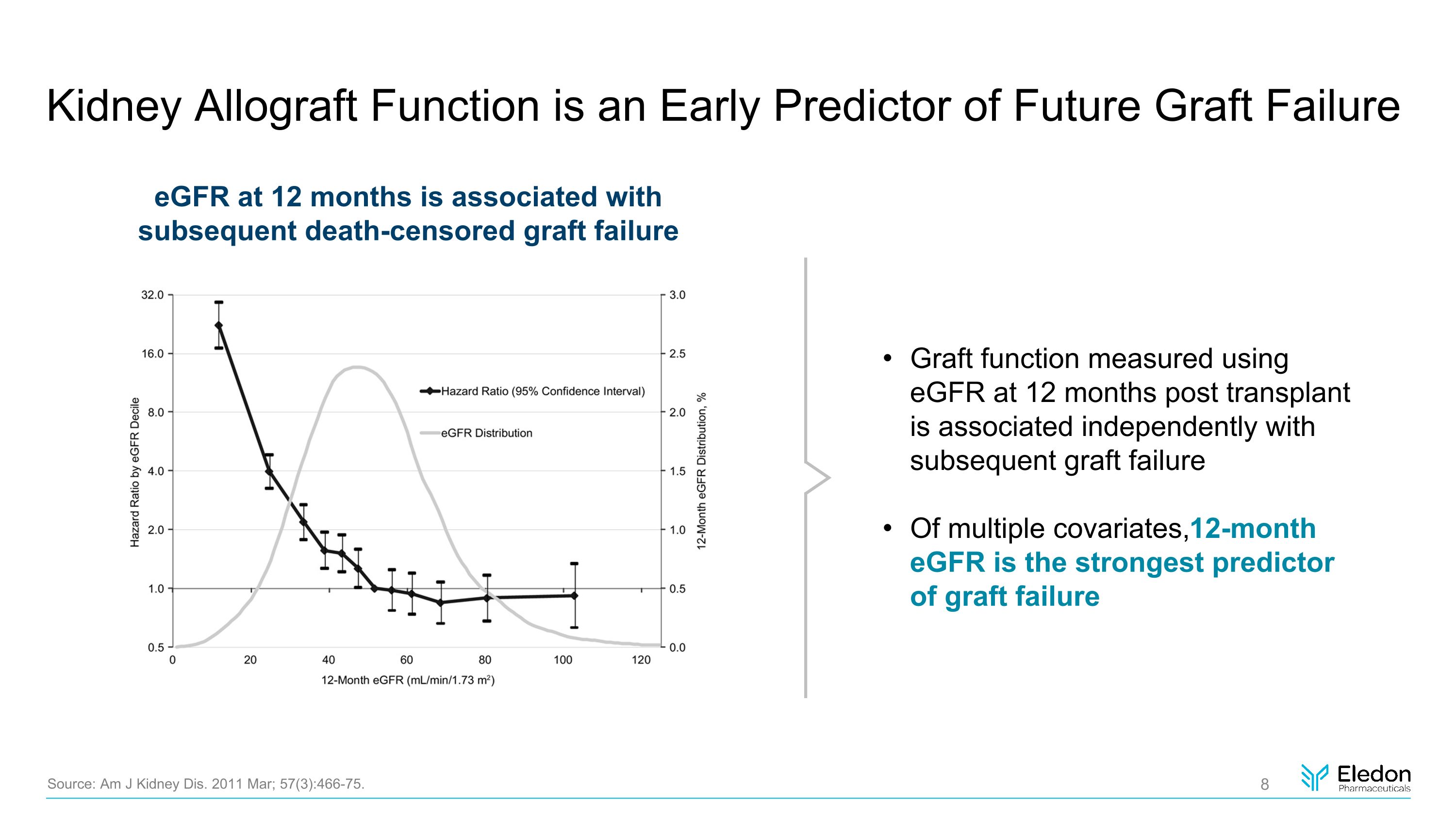
腎臟同種異體移植功能是未來移植失敗的早期預測指標 egFR 在 12 個月時與隨後的死亡審查移植失敗有關來源:Am J Kidney Dis. 2011 年 3 月;57 (3): 466-75。移植後 12 個月使用 egFR 測量的移植功能與隨後的移植失敗獨立相關。在多個協變量中,12 個月的 eGFR 是移植失敗的最強預測指標
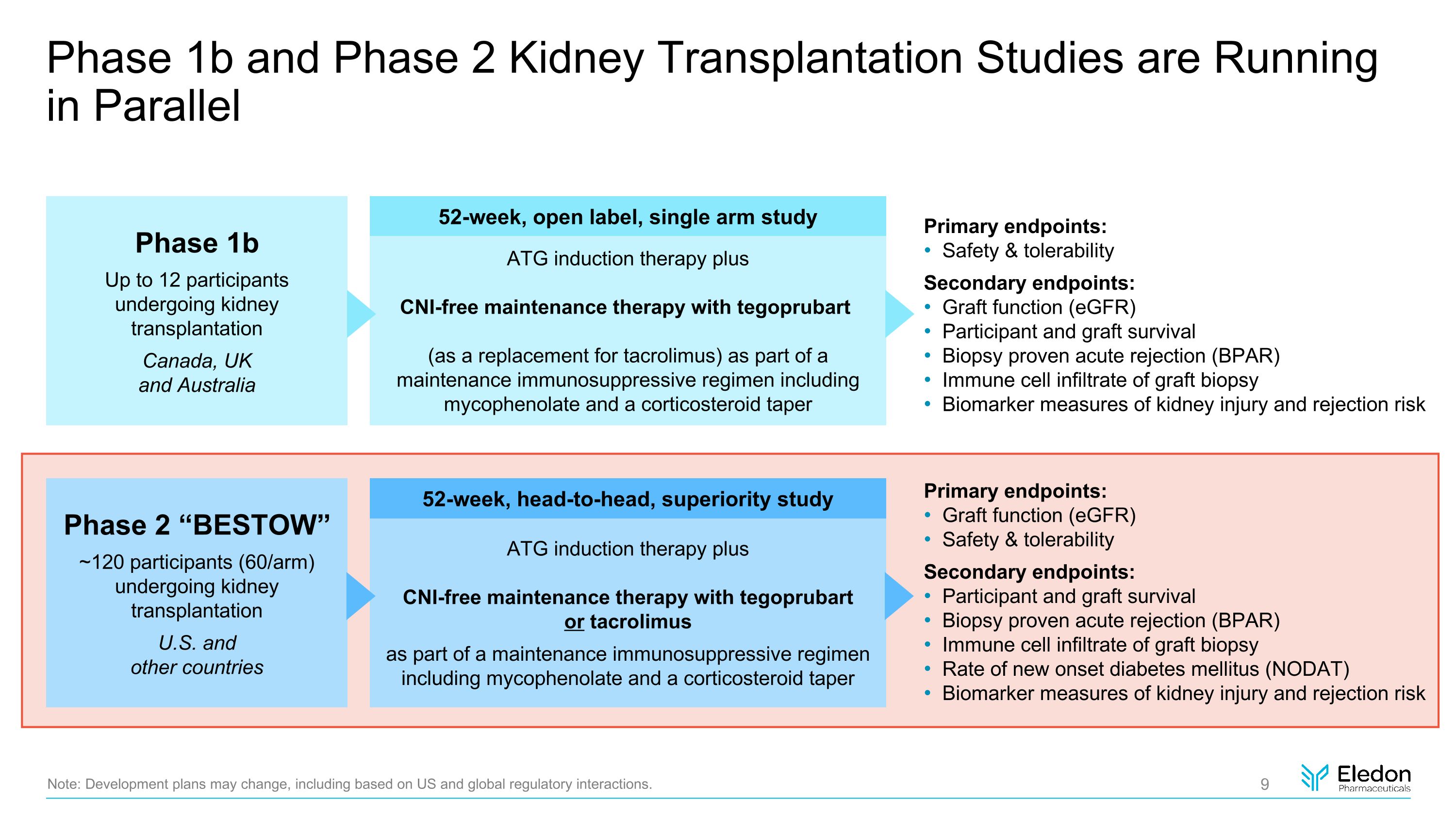
1b期和2期腎移植研究正在平行進行注意:發展計劃可能會發生變化,包括基於美國和全球監管相互作用的變化。1b 期最多 12 名參與者接受腎臟移植加拿大、英國和澳大利亞 52 周、開放標籤、單臂研究 2 期 “BESTOW” ~120 名參與者(60/組)正在接受腎臟移植美國和其他國家 ATG 誘導療法以及作為包括黴酚酯和皮質激素在內的維持性免疫抑制方案的一部分使用替戈普魯巴特(作為他克莫司的替代品)的無中介維持療法類固醇錐形ATG誘導療法加無CNI維持療法,使用替戈普魯巴託他克莫司作為維持性免疫抑制劑的一部分治療方案包括黴酚酸酯和皮質類固醇逐漸減量 52 周、正面交鋒、優越性研究主要終點:安全性和耐受性次要終點:移植物功能 (eGFR) 受試者和移植物存活活組織檢查經證實的急性排斥反應 (BPAR) 免疫細胞浸潤活檢腎損傷和排斥反應風險的生物標誌物測量主要終點:移植功能(eGFR)安全性和耐受性次要終點:受試者和移植物存活活組織檢查證實急性排斥反應 (BPAR) 移植物活檢免疫細胞浸潤新發糖尿病發生率mellitus (NODAT) 衡量腎損傷和排斥反應風險的生物標誌物
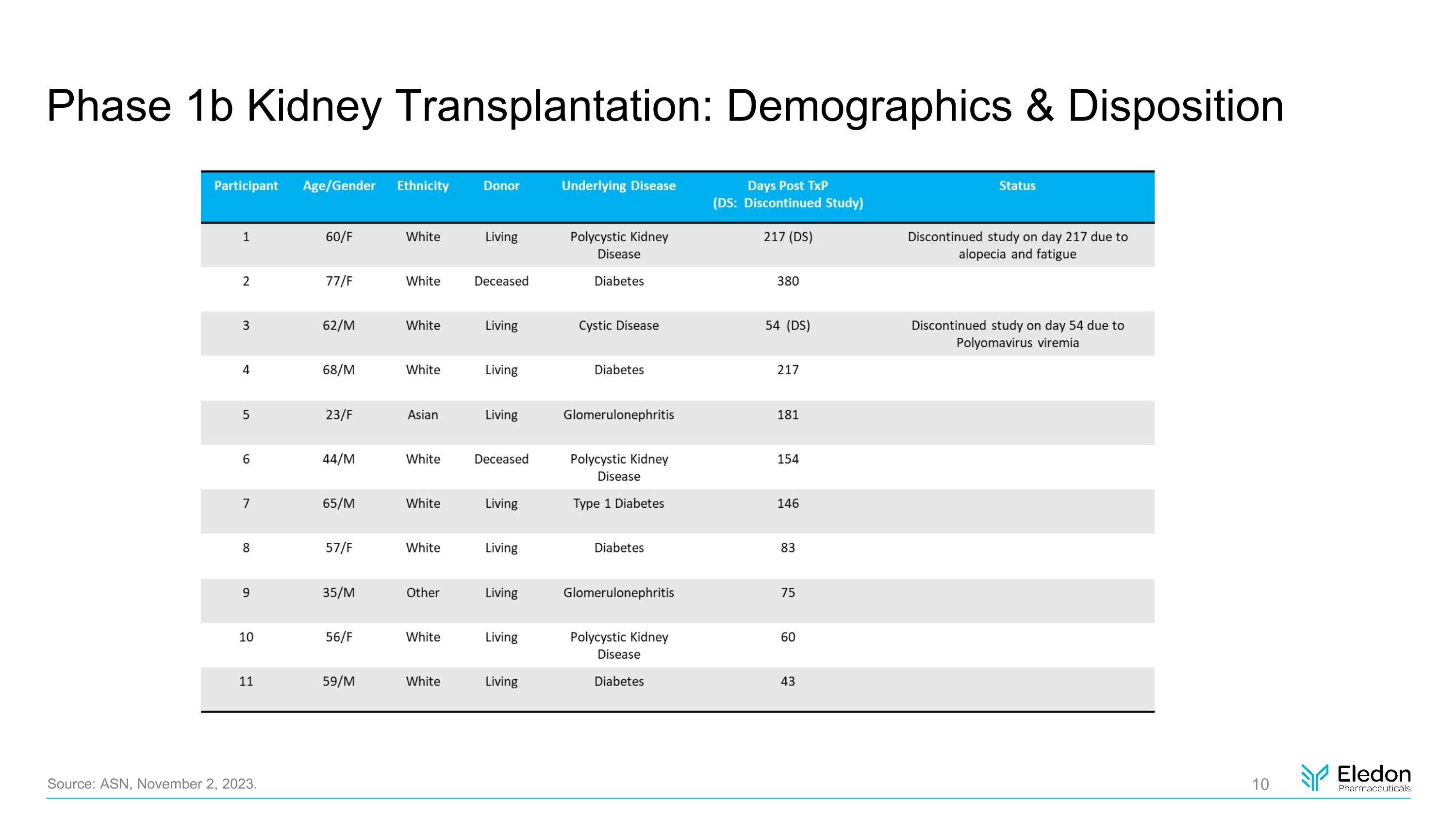
1b 期腎臟移植:人口統計學和性格來源:ASN,2023 年 11 月 2 日。
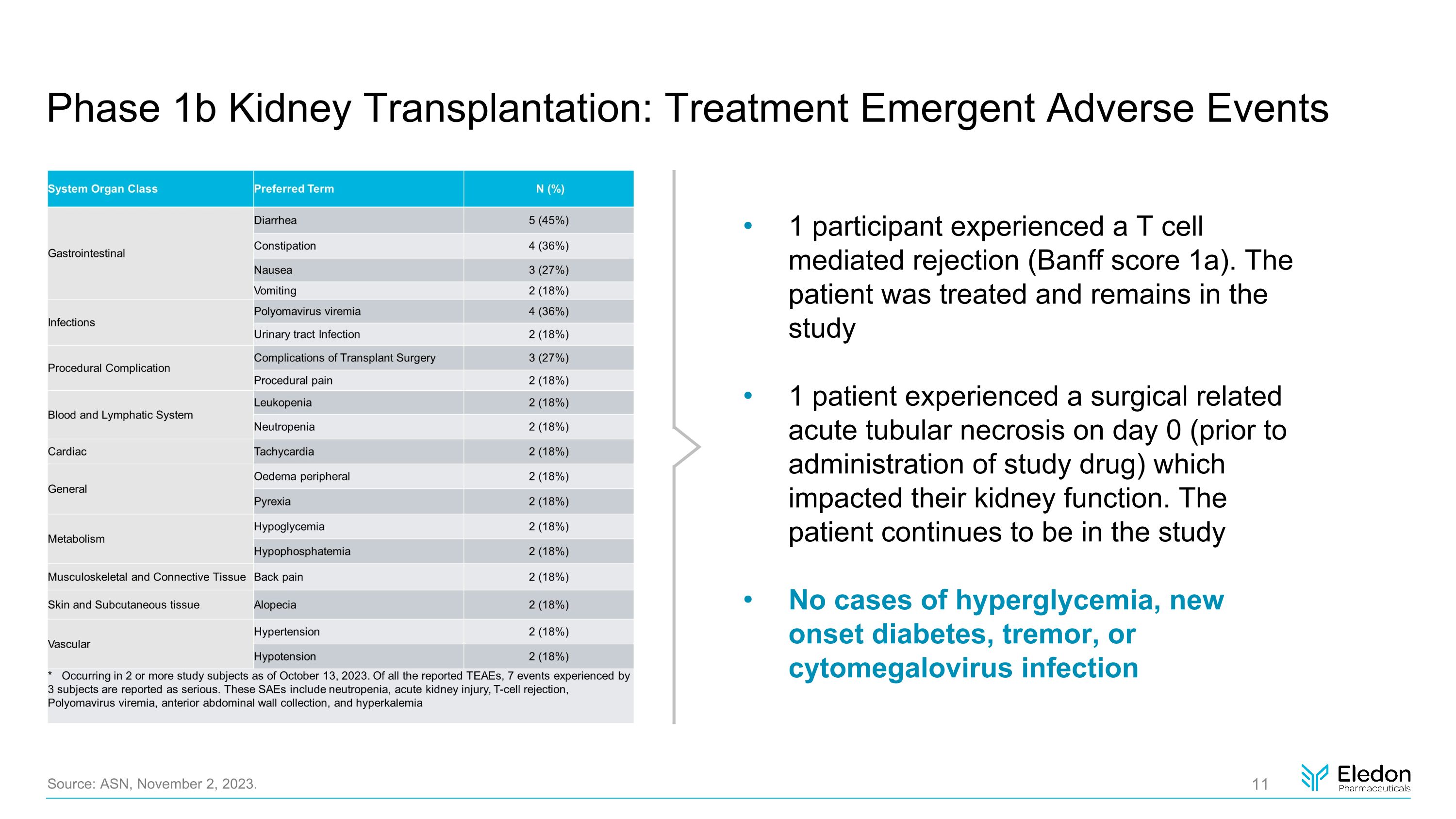
1b 期腎移植:治療緊急不良事件來源:ASN,2023 年 11 月 2 日。1 名參與者出現了 T 細胞介導的排斥反應(班夫分數 1a)。該患者接受了治療並仍在研究中,1名患者在第0天(給藥研究藥物之前)經歷了與手術相關的急性腎小管壞死,這影響了他們的腎臟功能。患者繼續參與研究無高血糖、新發糖尿病、震顫或鉅細胞病毒感染病例
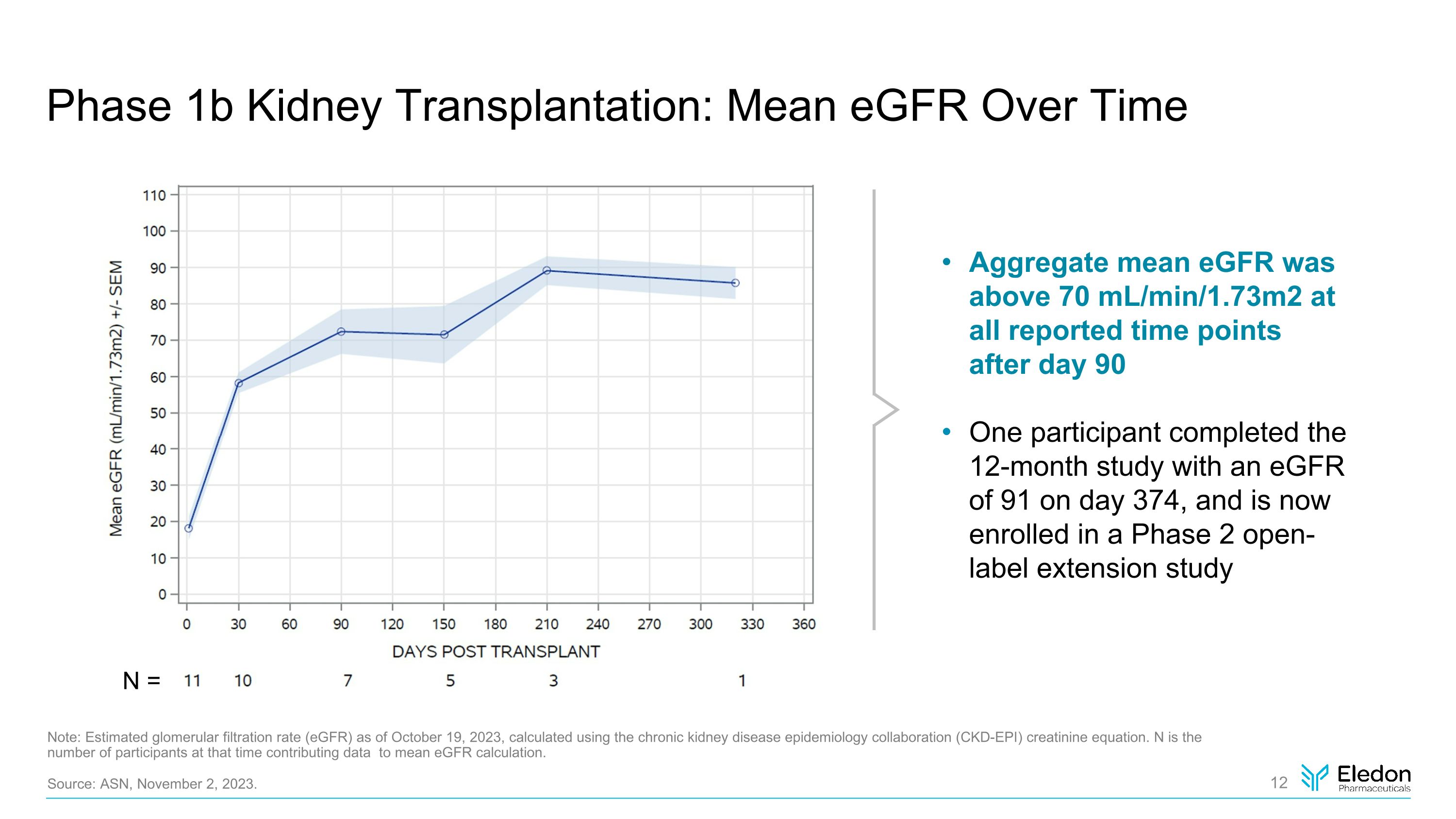
1b 期腎移植:一段時間內的平均表皮生長因子促炎 CD40L 靶點參與度注:截至 2023 年 10 月 19 日,使用慢性腎臟病流行病學合作 (CKD-EPI) 肌酐方程計算得出的估計腎小球濾過率 (eGFR)。N 是當時為均值 eGFR 計算貢獻數據的參與者人數。資料來源:ASN,2023年11月2日。在第 90 天之後,在所有報告的時間點的總平均表皮生長因子均高於 70 mL/min/1.73m2。一位參與者在第 374 天完成了這項為期 12 個月的研究,eGFR 為 91,現在正在參加第 2 期開放標籤擴展研究 N =

1b 期腎臟移植:摘要結論來自 11 名參與者的數據表明,tegoprubart 成功預防了腎臟移植排斥反應,總體安全且耐受性良好。在第 90 天之後,在所有報告的時間點上,egFR 均高於 70 mL/min/1.73m2,這表明泰戈魯巴特有可能比使用鈣調神經素抑制劑的方案更好地保護器官功能,當前的護理標準 Eledon 接下來計劃報告來自的最新數據 2024 年中期 1b 期試驗資料來源:美國國家統計局,2023 年 11 月 2 日。

問答環節 14

Eledon Pharmicals 19900 麥克阿瑟大道,550號套房,加利福尼亞州爾灣 92612,USAinfo@eledon.com +1 949-238-8090