Caribou Biosciences 宣佈美國食品藥品管理局批准了 CB-012 的IND申請,這是一種用於治療復發或難治性急性髓系白血病的異基因抗 CLL-1 CAR-T 細胞療法
— Amplify 1 期臨牀試驗,在 2024 年中期之前啟動患者入組 —
— CB-012 是第一種進入臨牀的同時具有檢查點幹擾和免疫隱身功能的異體 CAR-T 細胞療法 —
加利福尼亞州伯克利,2023 年 10 月 18 日——領先的臨牀階段 CRISPR 基因組編輯生物製藥公司 Caribou Biosciences, Inc.(納斯達克股票代碼:CRBU)今天宣佈,其針對異基因抗 C 型凝集素樣分子 1(Anti-CLL-1)CAR-T 細胞 CB-012 的研究性新藥 (IND) 申請已獲得美國食品藥品監督管理局 (FDA) 的批准療法。CB-012 將在針對復發或難治性急性髓細胞白血病(r/r AML)患者的多中心、開放標籤、Amplify 1 期臨牀試驗中進行評估。
Caribou總裁兼首席執行官雷切爾·豪爾維茨博士説:“我們的 CB-012 臨牀試驗申請獲得批准是Caribou的又一個重要里程碑,因為我們的第三種現成CAR-T細胞療法已進入臨牀階段。”“我們期待在2024年年中之前啟動AmpliFy 1期試驗的患者入組,以評估 CB-012 對急性髓細胞白血病患者的安全性和耐受性。”
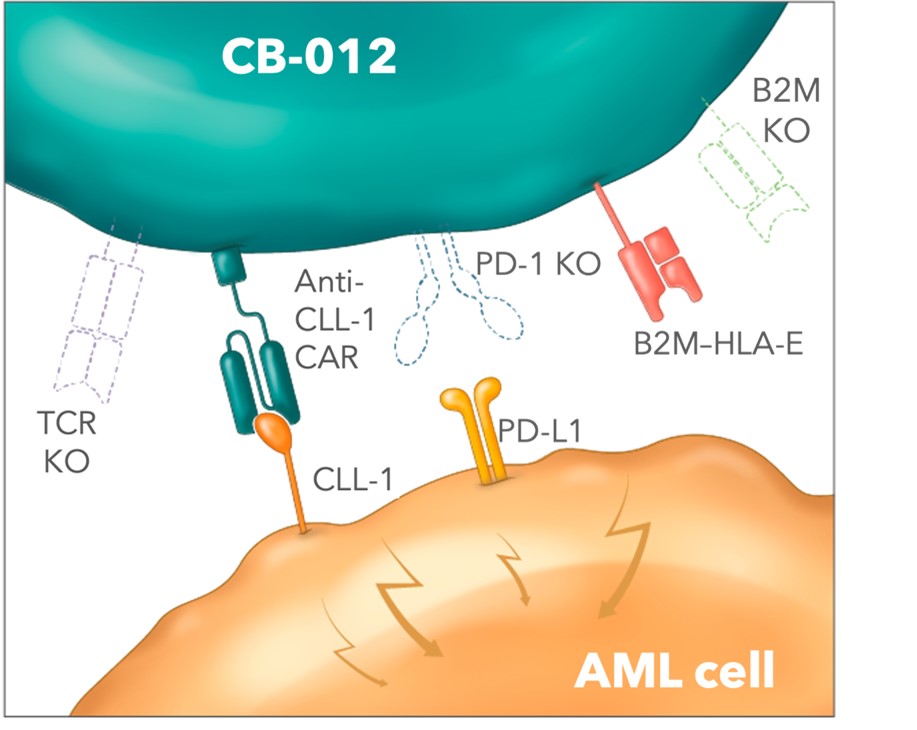
CLL-1 是一個引人注目的治療靶標,因為它在急性髓細胞白血病細胞和白血病幹細胞中高度表達,但不在造血幹細胞上表達。
德克薩斯大學醫學博士安德森癌症中心副教授兼白血病系主任納瓦爾·戴弗説:“迫切需要為復發或難治性急性髓細胞白血病患者開發新的治療方法,其治療選擇主要侷限於挽救化療方案。”“一種能夠安全有效地靶向急性髓細胞白血病細胞,同時保留健康造血幹細胞的異基因 CAR-T 細胞療法,可以為這些患者提供急需的現成選擇。”
Caribou獲得專利的下一代CRISPR Cas12a chrDNA基因組編輯技術平臺保持了很高的基因組完整性,並顯著提高了基因組編輯的特異性。
Caribou首席科學官史蒂夫·坎納博士説:“據我們所知,CB-012 是通過五次基因組編輯設計的,是第一種異體CAR-T細胞療法,它既可以通過PD-1基因敲除來破壞檢查點,又通過B2M基因敲除和B2M—HLA-E融合轉基因插入來掩蓋免疫效果。”“兩種裝甲策略都旨在提高 CB-012 的抗腫瘤活性,我們認為抗腫瘤活性對於靶向這種難以治療的適應症至關重要。”
CB-012,一種經過基因組編輯的同種異體抗 CLL-1 CAR-T 細胞療法,具有檢查點幹擾和免疫隱身功能
本公告附帶的照片可在
https://pr.globenewswire.com/FileDownloader/DownloadFile?source=pnr&fileGuid=54559479-fba4-4f88-a241-583814242f44
關於 Amplify 試用版
Amplify 1 期試驗是一項開放標籤的多中心臨牀試驗,旨在評估復發或難治性急性髓細胞白血病 (r/r AML) 成人患者的 CB-012。A 部分是 3+3 劑量遞增設計,將評估 CB-012 在劑量水平上升的安全性和耐受性,以確定最大耐受劑量和/或推薦的擴張劑量。B 部分是劑量擴展部分,其主要目標是確定單劑量 CB-012 後的抗腫瘤反應,通過總體反應率 (ORR) 進行評估。AmpliFy將包括標準治療後沒有反應或復發的患者,並將排除先前接受過3種以上療法治療的患者和增殖性疾病患者。Caribou 計劃在 2024 年中期之前啟動患者參加 Amplify 試驗,以單次給藥 CB-012(25x106 CAR-T 細胞)來治療患者。
關於急性髓系白血病
急性髓細胞白血病(AML)是一種血液和骨髓癌,是成人中最常見的急性白血病類型。據估計,到2023年,美國將有20,380例新的反洗錢病例。這些患者的五年存活率約為30%。AML 目前採用化療、靶向療法和/或異基因或自體幹細胞移植進行治療。對於復發或難治性急性髓細胞白血病患者,幾乎沒有治療選擇,總存活率中位數通常不到七個月。
關於 Caribou 的新型下一代 CRISPR 平臺
CRISPR 基因組編輯使用易於設計的模塊化生物學工具來改變活細胞中的 DNA。2 類 CRISPR 系統有兩個基本組成部分:切割 DNA 的核酸酶蛋白和引導核酸酶生成位點特異性雙鏈斷裂的 RNA 分子,從而在目標基因組位點進行編輯。CRISPR 系統能夠編輯意想不到的基因組位點,即脱靶編輯,這可能會對細胞功能和表型造成有害影響。為了應對這一挑戰,Caribou開發了CRISPR混合RNA-DNA指南(chrDNA;發音為 “霞多麗”),與全RNA指南相比,該指南指導的基因組編輯要精確得多。Caribou正在利用其Cas12a chrDNA技術的力量進行高效的多次編輯,包括多重基因插入,以開發經CRISPR編輯的療法。
關於 Caribou Biosciences, Inc.
Caribou Biosciences是一家臨牀階段的CRISPR基因組編輯生物製藥公司,致力於為患有毀滅性疾病的患者開發變革性療法。該公司的基因組編輯平臺,包括其cas12a chrDNA技術,能夠以卓越的精度開發細胞療法,這些療法具有潛在的抗腫瘤活性。Caribou正在推進其CAR-T和CAR-NK平臺上的現成細胞療法產品線,作為血液系統惡性腫瘤和實體瘤患者的現成治療方法。關注我們 @CaribouBio 然後訪問 www.cariboubio.com。
前瞻性陳述
本新聞稿包含1995年《私人證券訴訟改革法》所指的前瞻性陳述。這些前瞻性陳述包括但不限於與Caribou的戰略、計劃和目標以及對其臨牀和臨牀前開發計劃的期望相關的陳述,包括其對啟動患者加入 CB-012 Amplify 1 期臨牀試驗的時間的預期。管理層認為,這些前瞻性陳述在作出時是合理的。但是,此類前瞻性陳述受風險和不確定性的影響,實際結果可能與前瞻性陳述所表達或暗示的任何未來結果存在重大差異。風險和不確定性包括但不限於細胞療法產品開發中固有的風險;與Caribou當前和未來研發計劃、臨牀前研究和臨牀試驗的啟動、成本、時間、進展和結果相關的不確定性;以及初始、初步或中期臨牀試驗數據最終無法預測Caribou候選產品的安全性和有效性的風險,或者隨着患者入組的持續和患者越來越多,臨牀結果可能有所不同的風險數據變成可用;在收到更多數據並進行全面評估後,觀察到的臨牀前研究結果無法在人類患者中得到證實或得出不同的結論或考慮因素的風險;以及Caribou在向美國證券交易委員會提交的文件,包括其截至2022年12月31日止年度的10-K表年度報告和後續文件中不時描述的其他風險因素。鑑於這些前瞻性陳述中存在重大不確定性,您不應依賴前瞻性陳述作為對未來事件的預測。除非法律要求,否則Caribou沒有義務出於任何原因公開更新任何前瞻性陳述。
Caribou 生物科學公司聯繫方式:
投資者:
艾米·菲格羅亞,CFA
investor.relations@cariboubio.com
媒體:
Peggy Vorwald,博士
media@cariboubio.com
###