| GSBR-1290 第 1b 階段 MAD 業績 2023 年 9 月 29 日 |
| 與會者 • 雷蒙德·史蒂文斯博士,首席執行官 • Mark Bach,醫學博士,首席醫學官 • Blai Coll,醫學博士,臨牀開發副總裁 • Jun Yoon,首席財務官 • Danielle Keatley,投資者關係 |
| 前瞻性陳述 本演示文稿包含1995年《私人證券訴訟改革法》 法案 “安全港” 條款所指的 “前瞻性陳述”。除歷史事實陳述外,所有陳述均為可被視為前瞻性陳述,包括不限 限制的關於公司未來計劃和前景的陳述、Structure 針對 GSBR-1290 的 1b 期 MAD 研究的臨牀數據、Structure 2a 期研究的 期臨牀更新、針對 GSBR-1290 和其他正在開發的候選藥物的安全性、有效性 或耐受性的任何期望,GSBR-1290 治療 2 型的能力 GSBR-1290糖尿病、肥胖症或相關適應症, Structure 針對 2 型糖尿病和肥胖患者的 GSBR-1290 的 2b 期研究的計劃啟動和研究設計及其時機; 公司公佈數據結果的計劃時間以及繼續開發 GSBR-1290 和下一代組合 GLP-1R 候選藥以及 對靶向 GLP-1R 的口服開發候選藥物的預期。此外,在本演示文稿中使用了 “可能”、“可以”、 “應該”、“預期”、“相信”、“估計”、“預期”、“打算”、“計劃”、“預測” 等詞語以及與公司相關的類似表達方式及其變體 可以識別前瞻性陳述。前瞻性陳述既不是歷史事實,也不是對未來表現的保證。儘管 公司認為此類前瞻性陳述中反映的預期是合理的,但公司無法保證這種 預期會被證明是正確的。提醒讀者,由於存在各種風險和不確定性,包括但不限於 與公司前瞻性陳述中表達或暗示的結果、活動水平、安全性、績效或事件和情況可能存在重大差異,其中包括 但不限於與公司推進 GSBR-1290、LTSE-2578、ANPA-0073 和其他治療候選藥物、獲得監管部門批准並最終將公司候選藥物商業化相關的風險和不確定性,的時間和結果臨牀前和 臨牀試驗、公司為開發活動提供資金和實現發展目標的能力、任何全球疫情、通貨膨脹、供應 鏈問題、利率上升和未來銀行倒閉對公司業務的影響、其保護知識產權和其他風險的能力以及 公司向美國證券交易委員會(SEC)提交的文件中描述的不確定性,包括公司的10-K表年度報告 於 2023 年 3 月 30 日向美國證券交易委員會提交,10-Q 表季度報告提交給2023年8月10日的美國證券交易委員會,以及公司可能不時向美國證券交易委員會提交的未來報告。本演示文稿中包含的所有前瞻性陳述僅代表截至其發表之日, 基於管理層截至該日的假設和估計。除非法律要求,否則公司沒有義務更新此類聲明以反映在聲明發布之日之後發生的事件或存在的情況。 |
| 議程 • 開幕詞(Ray Stevens) • GSBR-1290 第 1b 階段 MAD Study Top Line Data(Blai Coll) • GSBR-1290 計劃更新和下一步行動(馬克·巴赫) • 結論(Ray Stevens) • 問答 |
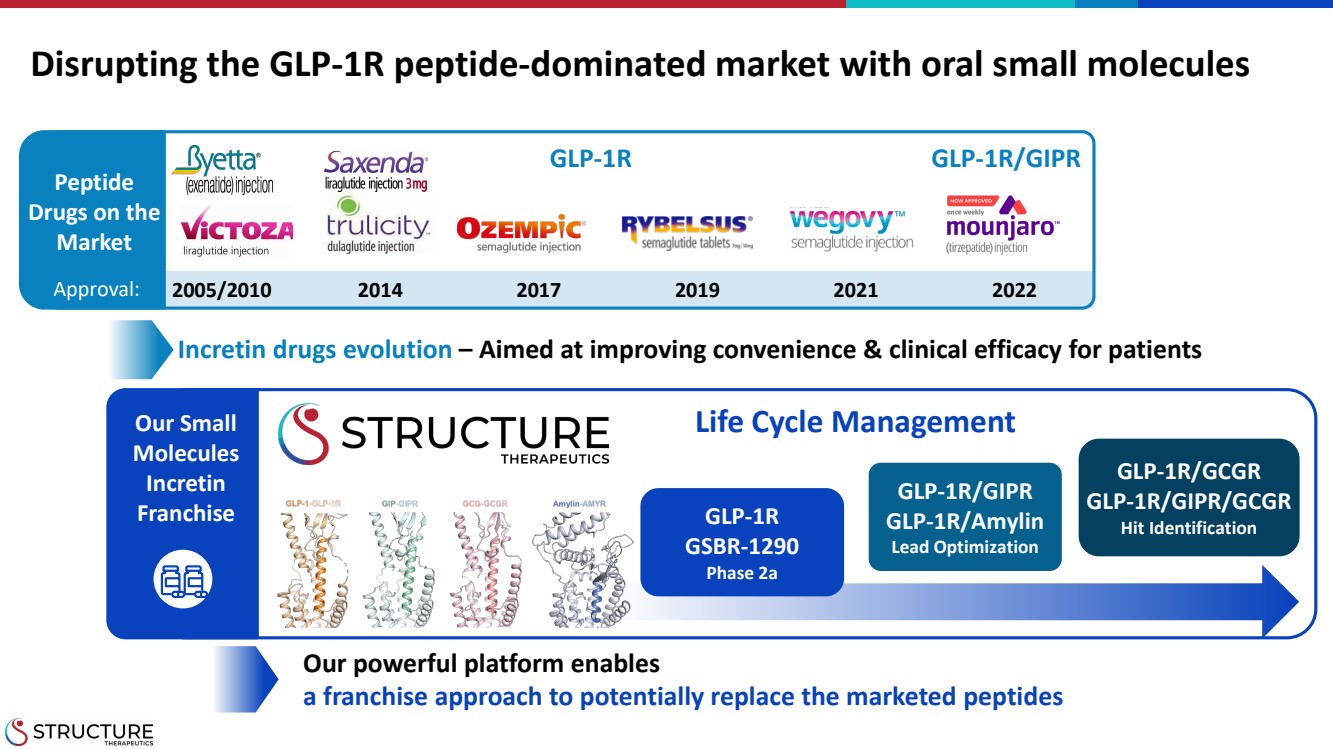
| 用口服小分子顛覆 GLP-1R 肽佔主導地位的市場 2005/2010 2017 2019 2022 我們強大的平臺使 提供了一種特許經營方法,有可能取代已上市的肽 GLP-1R GLP-1R/GIPR Peptide Peptide Incretin 藥物演變 — 旨在提高患者的便利性和臨牀療效 GLP-1R/GIPR br glp-1r/amylin 鉛優化 GLP-1R GSBR-1290 2a 階段 GLP-1R/GCGR GLP-1R/GCGR 命中識別 我們的小 分子 Incretin 特許經營 批准: 生命週期管理 |
| 1b 期 MAD 研究和項目更新的陽性結果 • GSBR-1290(口服小分子 GLP-1R 激動劑)表明每天給藥一次 • 來自 1b 期 MAD 研究(4 周)的頂線數據: -在 28 天內每天給藥一次,體重顯著減輕 -1b 期沒有與不良事件相關的 停藥,鼓勵安全性和耐受性多劑量遞增劑量研究 • 來自 2a 期研究(12 周)的 Topline 數據: -2 型糖尿病隊列預計在 2023 年第四季度下半年出現-肥胖人羣預計服用膠囊2024 年上半年的片劑 pk/配方研究 • 計劃於 2024 年下半年啟動 2 型糖尿病(約 26 周)和肥胖(約 36 周)的 2b 期研究 |
| GSBR-1290 1b 期 MAD 研究 Top Line Data (Blai Coll,醫學博士,博士,臨牀開發副總裁) |
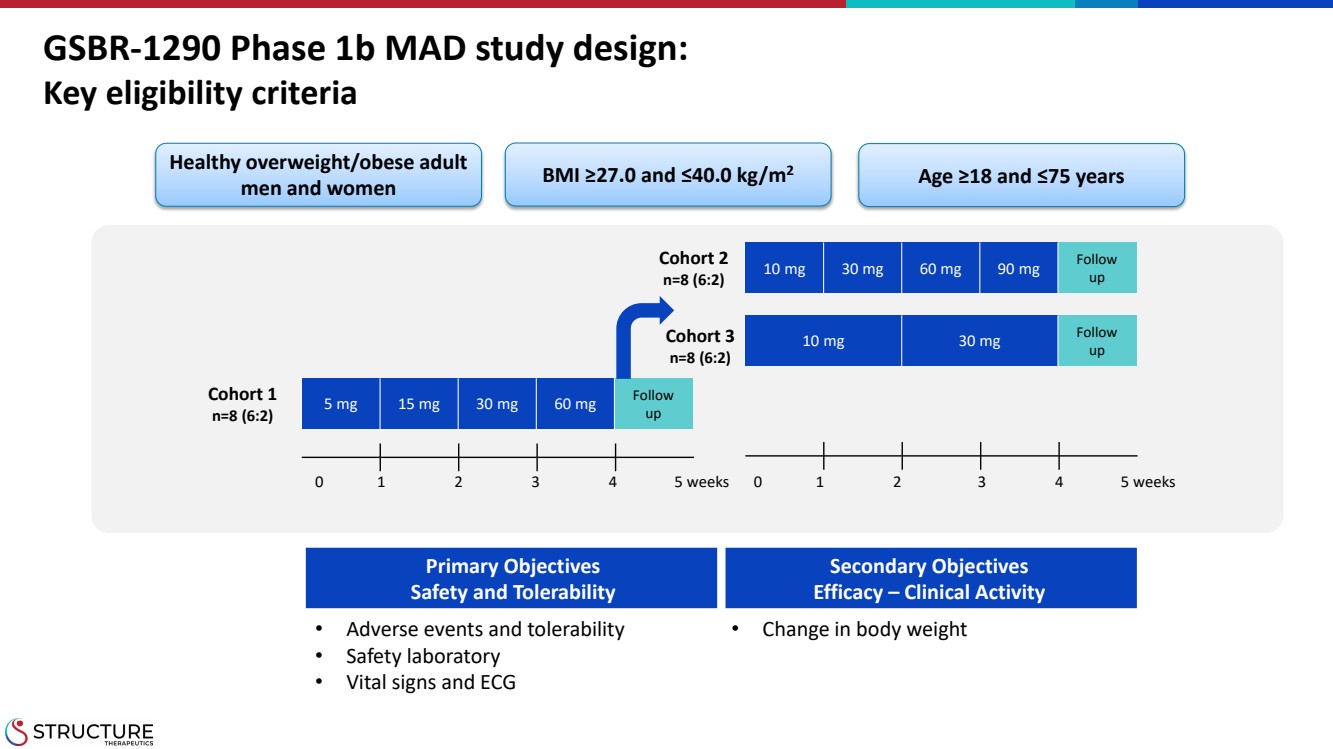
| GSBR-1290 1b 期 MAD 研究設計: 關鍵資格標準 隊列 1 n=8 (6:2) 5 mg 15 mg 30 mg 60 mg 關注 up 羣組 3 n=8 (6:2) 0 1 2 3 4 5 周 0 1 2 3 4 5 周 0 1 2 3 4 5 周 0 1 2 3 4 5 周 0 1 2 3 4 5 周 羣組 2 n=8 (6:2) 10 mg 30 mg 60 mg 90 mg 關注 up 健康超重/肥胖成人 男性和女性 BMI ≥ 27.0 和 ≤40.0 kg/m 年齡 ≥ 18 和 75 歲 2 主要目標 安全與耐受性 次要目標 功效 — 臨牀活動 • 不良事件和耐受性 • 安全實驗室 • 生命體徵和心電圖 •體重的變化 |
| GSBR-1290 1b 期 MAD 研究: 參與者性狀 GSBR-1290 1b 期 MAD 研究 隨機 (N=24) GSBR-1290 30 mg (N=6) 60 mg (N=6) GSBR-1290 90mg (N=6) (N=6) 停止研究 由於 AE 引起的藥物 0 0 0 0 向下滴定 或保持 0 0 0 0 已完成研究 6 (100%) 6 (100%) 5 (83.3%) * 5 (83.3%) * 沒有參與者因不良事件而停藥 *90 mg arm 中有一名參與者因個人旅行原因停藥 *90 mg arm 中一名參與者和一名安慰劑受試者因個人旅行原因停藥 GSBR-1290 |
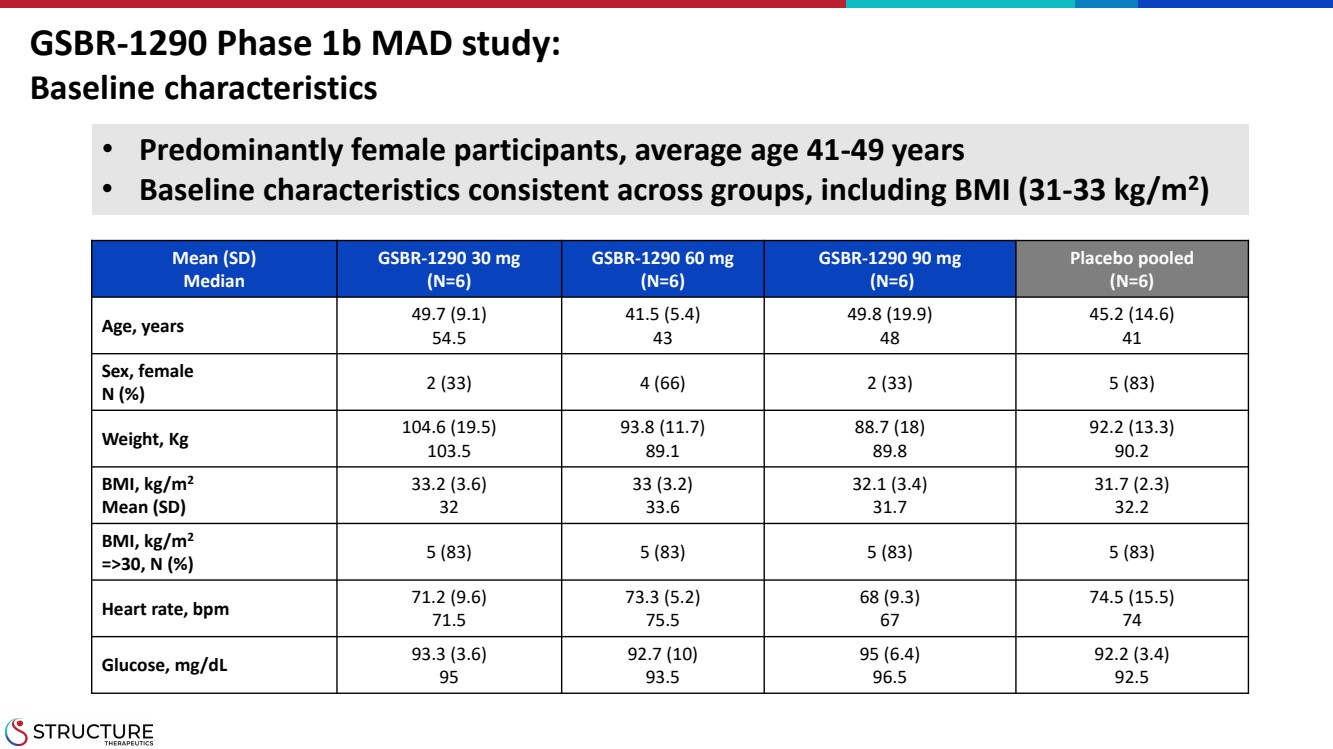
| 平均值 (SD) 中位數 GSBR-1290 30 mg (N=6) GSBR-1290 60 mg (N=6) GSBR-1290 90 mg (N=6) (N=6) (N=6) 年齡,49.7 (9.1) 54.5 41.5 (5.4) 43 49.8 (19.9) 48 45.2 (14.6) 41 性別,女 N (%) 2 (33) 4 (66) 2 (33) 5 (83) 體重,Kg 104.6 (19.5) 103.5 93.8 (11.7) 89.1 88.7 (18) 89.8 92.2 (13.3) 90.2 B0.2 MI,kg/m2 平均值 (SD) 33.2 (3.6) 32 33 (3.2) 33.6 32.1 (3.4) 31.7 31.7 (2.3) 32.2 體重指數,kg/m2 =>30,N (%) 5 (83) 5 (83) 心率,bp 71.2 (9.6) 71.5 73.3 (5.2) 75.5 68 (9).3) 67 74.5 (15.5) 74 葡萄糖,mg/dL 93.3 (3.6) 95 92.7 (10) 93.5 95 (6.4) 96.5 92.2 (3.4) 92.5 • 以女性為主,平均年齡為 41-49 歲 • 各組的基線特徵一致,包括體重指數(31-33 kg/m2) GSBR-1290 第 1階段 b MAD 研究: 基線特徵 |
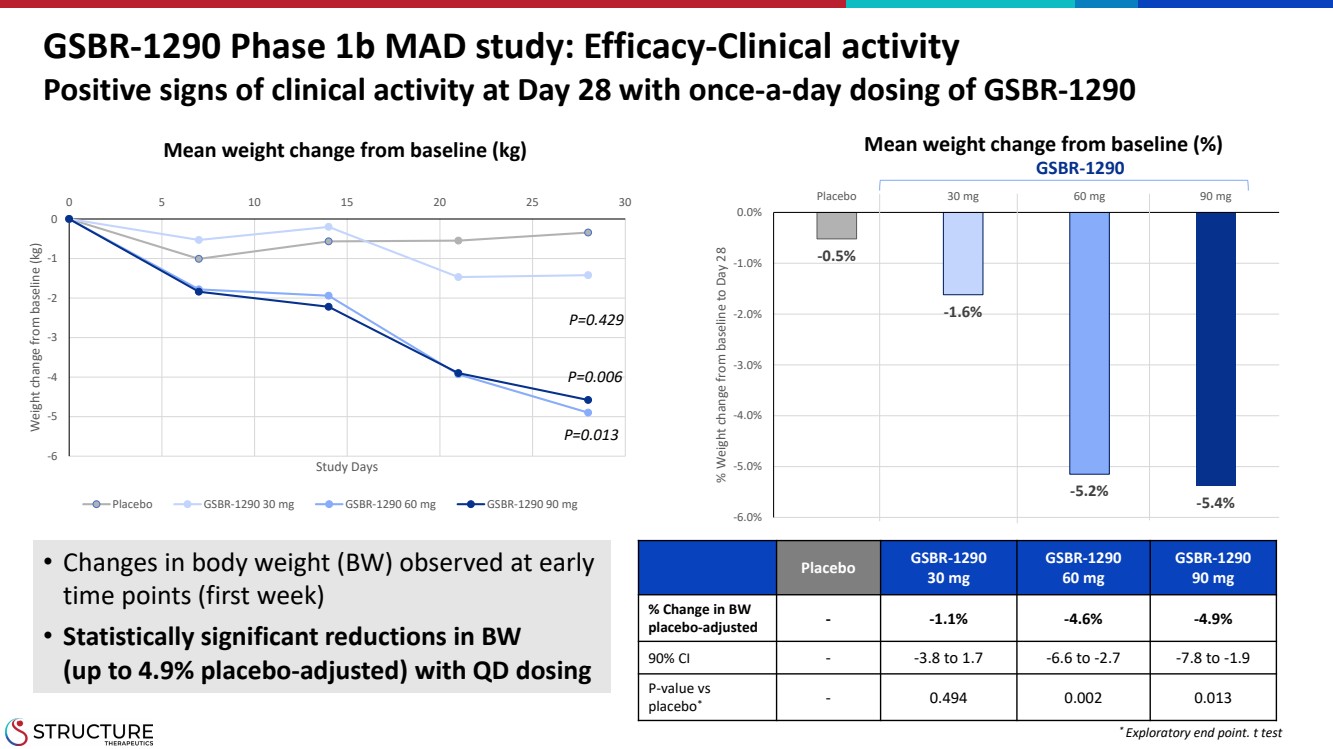
| -0.5% -1.6% -5.2% -5.4% -6.0% -5.0% -4.0% -3.0% -2.0% -1.0% 0.0% 安慰劑 30 mg 60 mg 90 mg % 從基線到第 28 天的體重變化 GSBR-1290 1b 期 MAD 研究:療效-臨牀活性 {} 第 28 天臨牀活動呈陽性跡象,每天給藥一次 GSBR-1290 • 在 早期(第一週)觀察到體重 (BW) 的變化 • 服用 QD 後,體重 (經安慰劑調整後最高可達 4.9%)降低 安慰劑 GSBR-1290 30 mg GSBR-1290 60 mg GSBR-1290 90 mg % 變化 }經安慰劑調整——-1.1% -4.6% -4.9% 90% 置信區間-3.8 至 1.7 -6.6 至 -2.7 -7.8 至 -1.9 P 值與 安慰劑*-0.494 0.002 0.013 * 探索性終點。t 測試 -6 -5 -2 -1 0 0 10 15 20 25 30 體重與基線相比的變化 (kg) 安慰劑 GSBR-1290 30 mg GSBR-1290 60 mg GSBR-1290 90 mg P=0.013 P=0.006 P=0.006 P=0.429 與基線相比的平均體重變化 (kg) 與基線相比的平均體重變化 (%) GSBR-1290 |
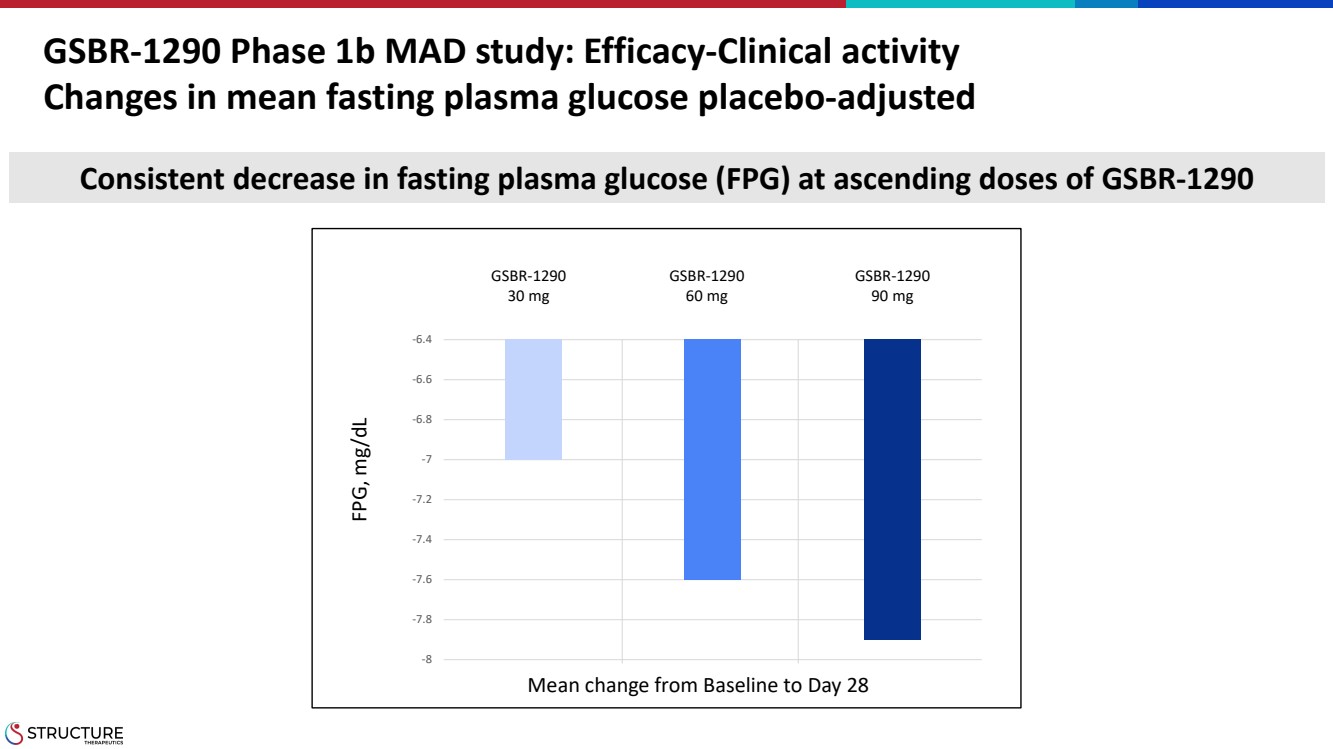
| GSBR-1290 1b 期 MAD 研究:療效-臨牀活性 平均空腹血糖變化安慰劑調整後 GSBR-1290 30 mg GSBR-1290 60 mg GSBR-1290 90 mg FPG、mg/dL fpg、mg/dL 在 GSBR-1290 -8 -7.8 -7.8 -7.6 -7.6 -7.6 -7.6 -7.6 -7 -6.8 -6.6 -6.4 上升劑量下空腹血糖 (FPG) 持續降低從基線到第 28 天 |
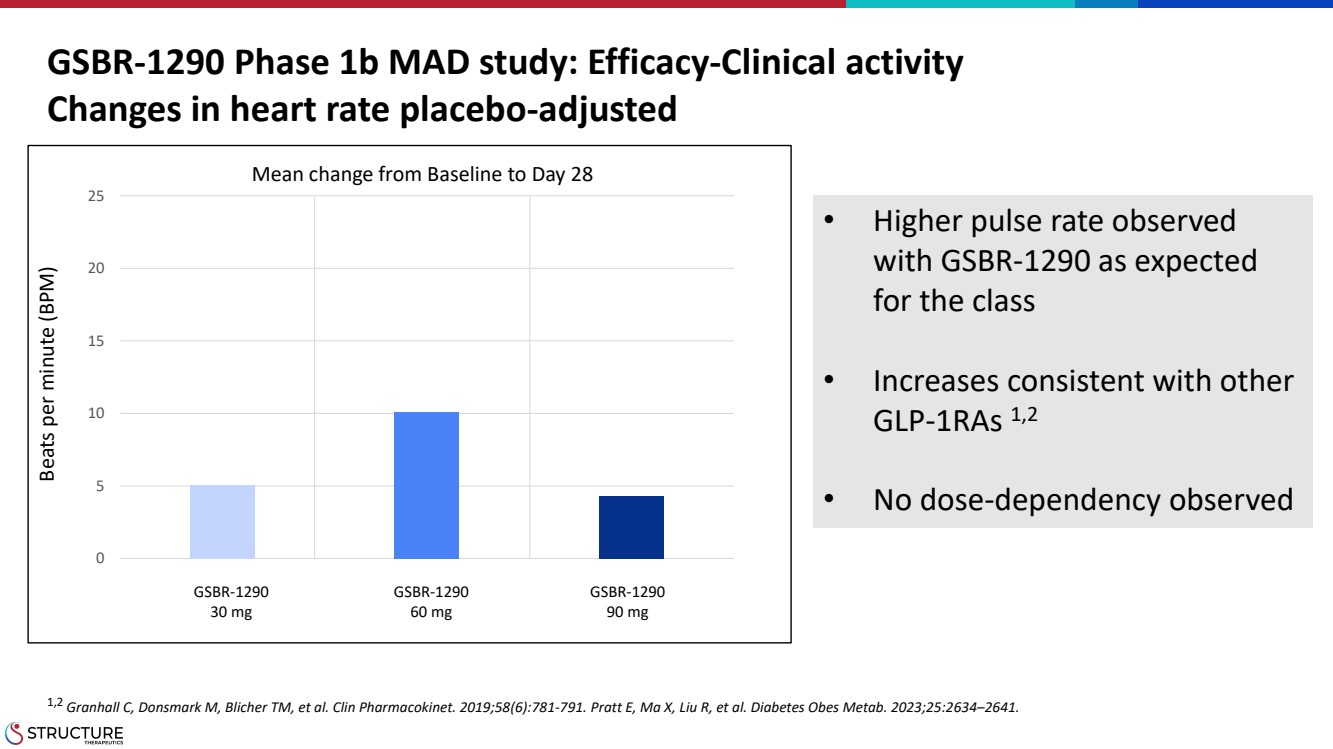
| GSBR-1290 1b 期 MAD 研究:療效-臨牀活性 經安慰劑調整後的心率變化 • 使用預期的 GSBR-1290 時觀察到更高的脈率 • 與其他 glp-1ras 一致 1,2 • 未觀察到劑量依賴性 1,2 Granhall C、Donsmark M、Blicher TM 等。Clin Pharmackinet。2019;58 (6): 781-791。Pratt E、Max、Liu R 等糖尿病 Obes Metab。2023;25:2634 —2641。每分鐘節拍數 (BPM) 0 5 10 15 20 25 從基線到第 28 天的平均變化 GSBR-1290 30 mg GSBR-1290 60 mg GSBR-1290 90 mg 90 mg |
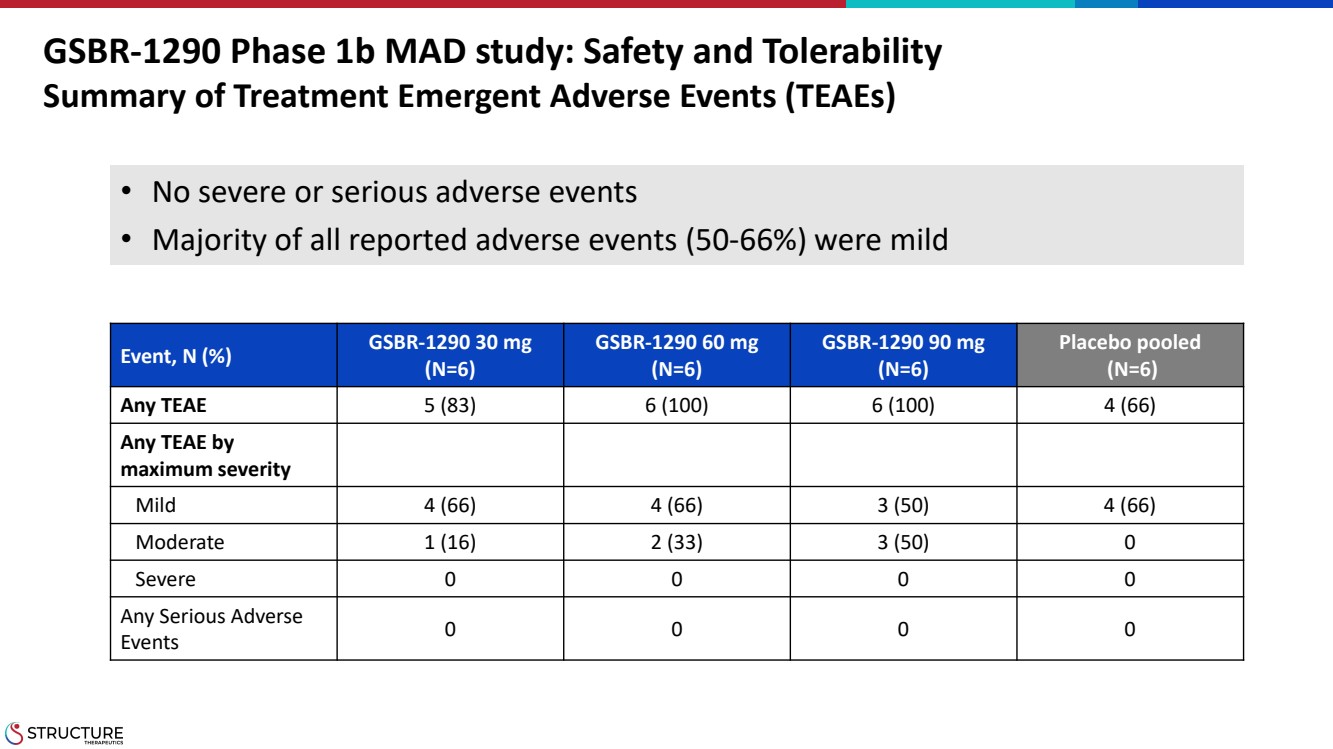
| GSBR-1290 1b 期 MAD 研究:安全性和耐受性 治療摘要緊急不良事件 (TEAE) 事件,N (%) GSBR-1290 30 mg (N=6) GSBR-1290 60 mg (N=6) GSBR-1290 90 mg (N=6) (N=6) any TEAE 5 (83) 6 (100) 6 (100) 4 (66) 任何 TEAE 按照 最大嚴重程度 輕度 4 (66) 4 (66) 3 (50) 4 (66) 中度 1 (16) 2 (33) 3 (50) 0 0 嚴重 0 0 0 0 0 任何嚴重不良事件 事件 0 0 0 • 沒有嚴重或嚴重不良事件 • 大多數報告了嚴重或嚴重的不良事件 不良事件(50-66%)為輕度 |
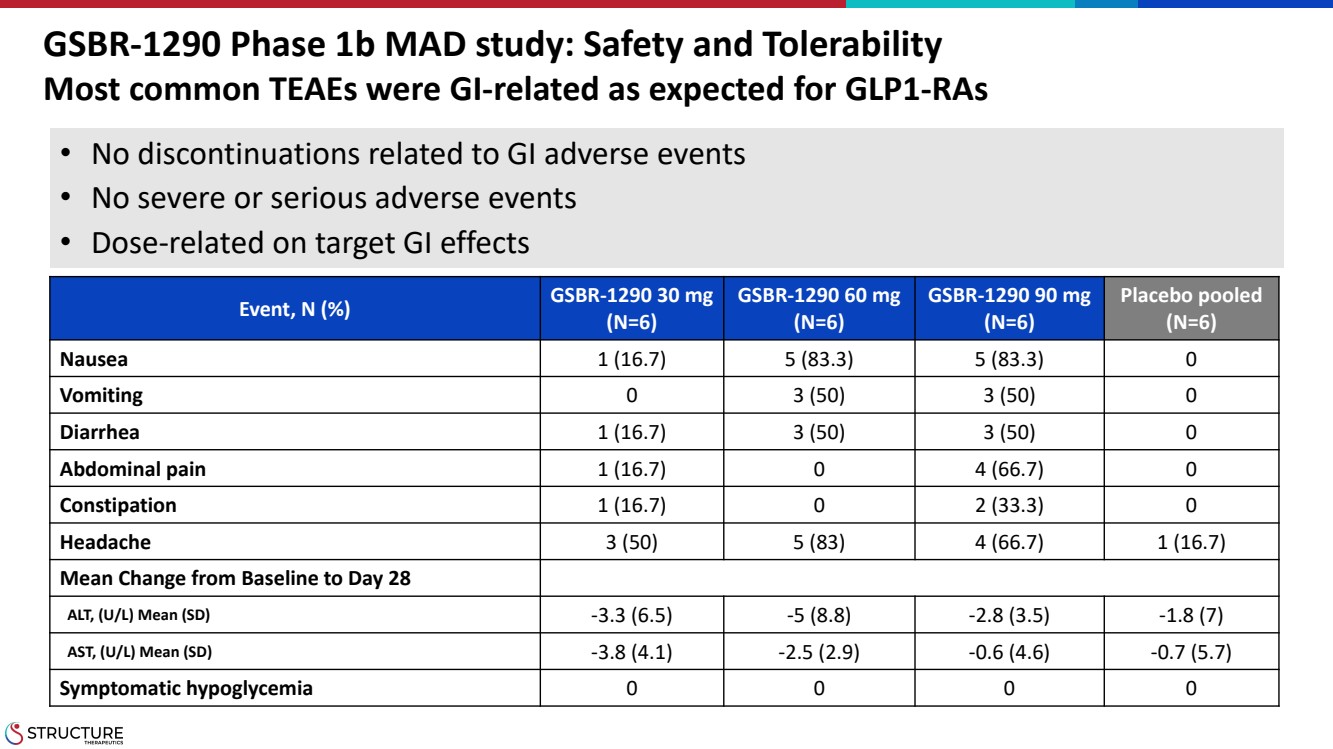
| GSBR-1290 1b 期 MAD 研究:安全性與耐受性 GLP1-ras 事件中最常見的 TEAE 與 GI 有關 事件,N (%) GSBR-1290 30 mg (N=6) GSBR-1290 60 mg (N=6) GSBR-1290 90 mg (N=6) (N=6) 安慰劑池 (N=6) 噁心 1 (16.7) 5 (83.3) 5 (83.3) 0 嘔吐 0 3 (50) 3 (50) 0 腹瀉 1 (16.7) 3 (50) 3 (50) 0 腹痛 1 (16.7) 0 4 (66.7) 0 便祕 1 (16.7) 0 便祕 1 (16.7) 0 2 (33.3) 0 頭痛 3 (50) 5 (83) 4 (66.7) 1 (16.7) 0 便祕 1 (16.7) 0 便祕 1 (16.7) 0 2 (33.3) 0 頭痛 3 (50) 5 (83) 4 (66.7) 1 (16.7) Mean 從基線改為第 28 天 ALT,(U/L) 平均值 (SD) -3.3 (6.5) -5 (8.8) -2.8 (3.5) -1.8 (7) AST,(U/L)平均值 (SD) -3.8 (4.1) -2.5 (2.9) -0.6 (4.6) -0.7 (5.7) 有症狀的低血糖 0 0 0 0 • 沒有與胃腸道不良事件相關的停藥 • 沒有嚴重或嚴重的不良事件 • 劑量與目標胃腸道影響有關 |
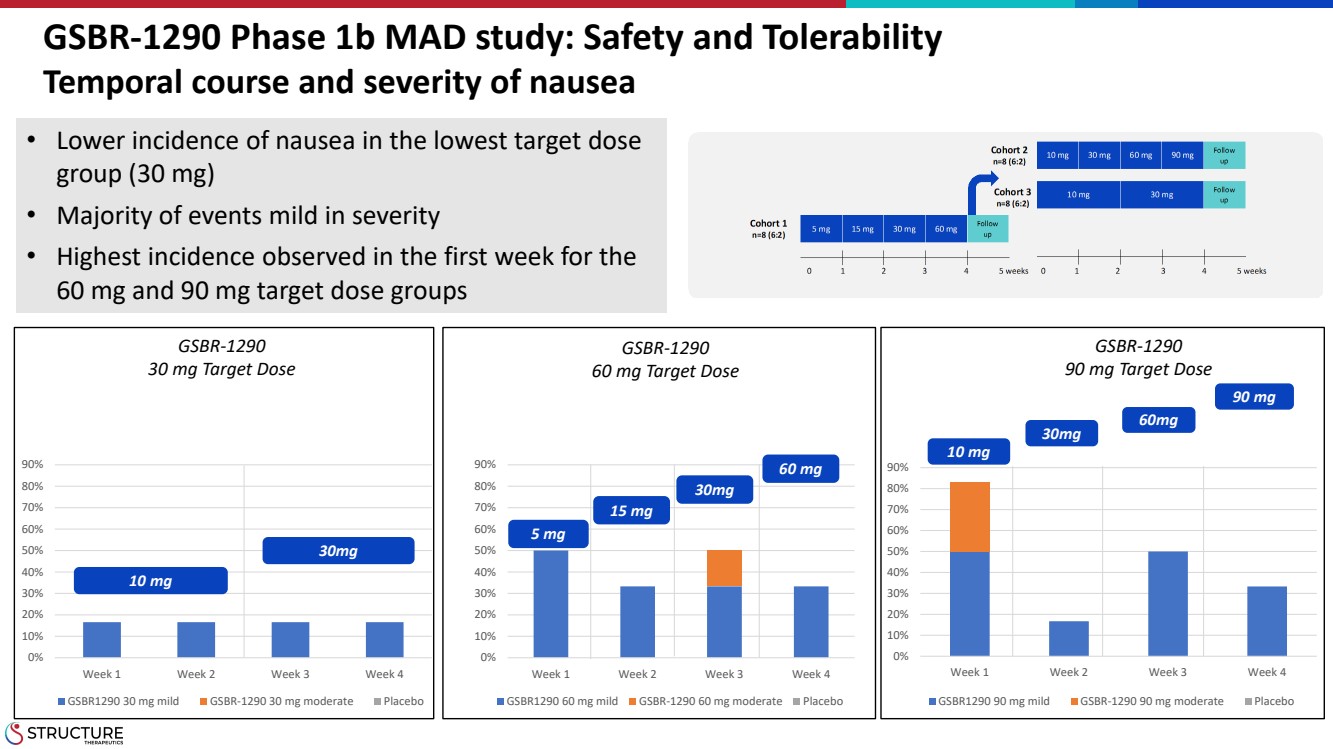
| GSBR-1290 1b 期 MAD 研究:安全性和耐受性 噁心的時間過程和嚴重程度 0% 10% 20% 30% 40% 50% 70% 80% 90% 第 1 周第 3 周 GSBR1290 90 mg 輕度 GSBR-1290 90 毫克中度安慰劑 0% 10% 20% } 30% 40% 50% 60% 70% 80% 90% 第 1 周第 3 周第 4 周 GSBR1290 60 毫克輕度 GSBR-1290 60 毫克中度安慰劑 0% 20% 30% 40% 50% 70% 70% 80% 80% 90% 第 1 周第 2 周 3 第 4 周 GSBR1290 30 毫克輕度 GSBR-1290 30 毫克中度安慰劑 10 mg 30mg 5 mg 15 mg 30mg 60 mg 10 mg 30mg 60mg 90 mg 90 mg 組(30 mg)的噁心發生率較低 • 大多數事件嚴重程度較輕 60 mg 和 90 mg 目標劑量組在第一週觀察到的發病率最高 60 mg 和 90 mg br} GSBR-1290 30 mg 目標劑量 GSBR-1290 60 mg 目標劑量 GSBR-1290 90 mg 目標劑量 |
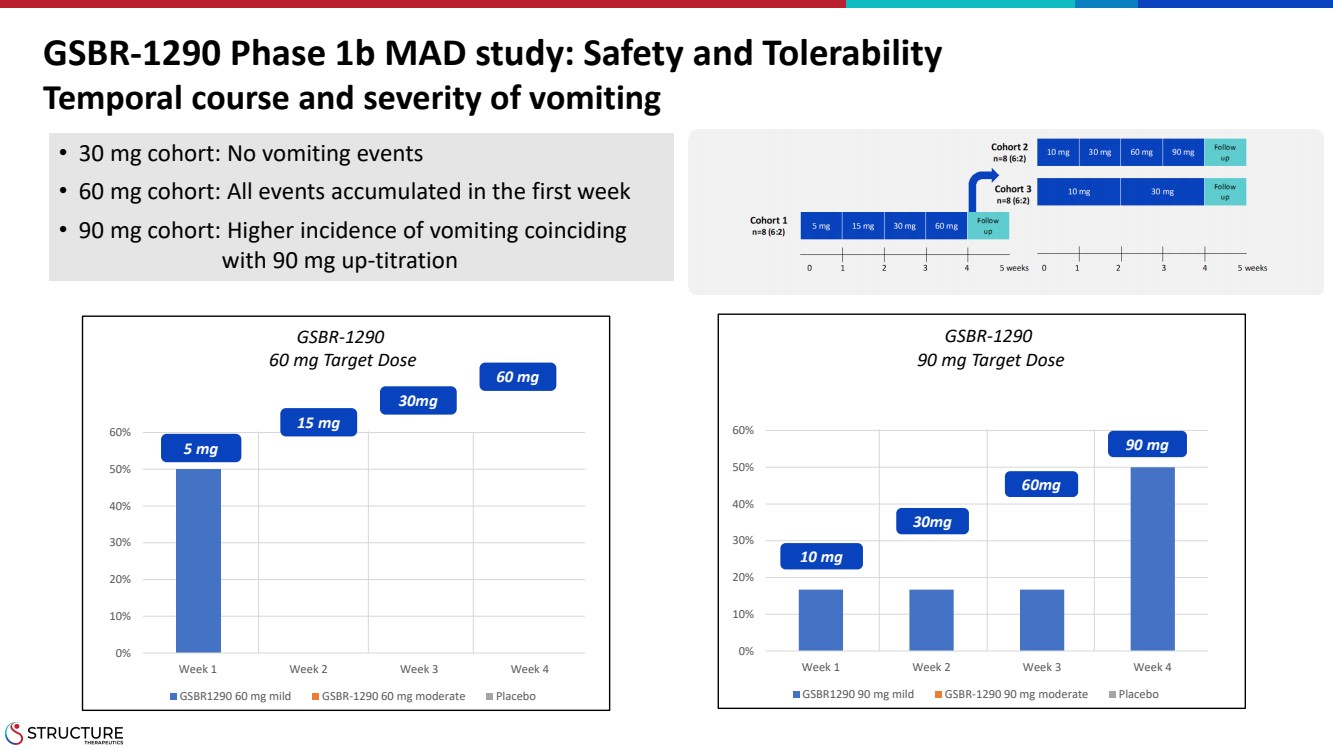
| GSBR-1290 1b 期 MAD 研究:安全性和耐受性 嘔吐的時間過程和嚴重程度 0% 10% 20% 30% 40% 50% 60% 第 1 周第 3 周 GSBR1290 60 毫克輕度 GSBR-1290 60 毫克中度安慰劑 0% 10% 20% 30% 40% 50% 50% 50% 50% } 60% 第 1 周第 2 周 3 周 GSBR1290 90 mg 輕度 GSBR-1290 90 毫克中度安慰劑 5 mg 15 mg 30mg 60 mg 10 mg 60mg 60mg 90 mg • 30 mg 隊列:沒有嘔吐事件 • 60 mg 隊列:所有事件在第一週累積 • 90 mg 隊列:發病率更高嘔吐同時發生 和 90 mg 上滴定 GSBR-1290 60 mg 目標劑量 GSBR-1290 90 mg 目標劑量 |
| GSBR-1290:有前途的口服小分子 GLP-1R 激動劑 有前途的安全性和 耐受性特徵 每天一次給藥 令人鼓舞 4 周時體重減輕 GSBR-1290 顯示出令人鼓舞的安全性和 耐受性特徵,4wk GSBR-1290 所有劑量均未出現與不良事件相關的停藥 的早期臨牀療效數據 每天一次 劑量,與食物一起服用 GSBR-1290 在統計學上顯示,在 60 和 90 毫克時體重明顯減輕(經安慰劑調整後高達 4.9%) |
| GSBR-1290 計劃更新和後續步驟 (Mark Bach,醫學博士,博士,首席醫學官) |
| GSBR-1290 在 12 周內對 T2DM 和超重/肥胖進行的 2a 期研究 隊列 5A (n=18) PBO PBO PBO PBO PBO PBO PBO 隨訪 隊列 5B (n=10) 5 mg 10 mg 20 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 30 mg 90 mg X 7 周隨訪 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 周 N=54 主要終點:安全性和耐受性 次要終點**:證明 Hba1c 降低 證明體重減輕 在 Hba1c 和體重減少中表現出劑量反應 主要終點:安全性和耐受性(N=~64) 次要終點**:證明體重減輕 (N=~40) N=40 + 24 名替補 參與者 隊列 4 5 mg 15 mg 30 mg 60 mg 90 mg 90 mg 120 mg 隨訪 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 周 PBO PBO PBO PBO PBO PBO PBO PBO PBO PBO PBO PBO PBO PBO 後續行動 } (n=24) (n=16) 入學已完成 預計2023年第四季度下半年將有12周的頂級研究結果招收24名新參與者 預計在2024年上半年公佈的為期12周的頂級研究結果 2型糖尿病 Healthy 超重/肥胖 |
| GSBR-1290:項目進展和即將到來的里程碑 2023 年 1b/MAD 數據(4 周) • N=24,健康的超重/肥胖參與者,不超過 90 mg • 沒有與不良事件相關的停藥不超過 90 mg • 60 和 90 mg 時體重明顯減輕 (經安慰劑調整後高達 4.9%) phase 22D TA 數據 (12 周) • N=54,T2D 參與者,最多 90 mg • 2023 年第四季度下半年日本 pk/Ethno-Bridgine 研究(4 周)預計會有結果 • N=18 名健康的成年日本人和非日本人 參與者,最多 60 mg • 結果預計在 2023 年第四季度下半年完成 2a 期肥胖數據(12 周) • N=40 名參與者,最多 120 mg • 招收了 24 名替代參與者 • 預計在 2024 年上半年完成膠囊到片劑 pk/配方研究(12 周) • 大約 45 名參與者,最多 120 mg • 計劃於 2023 年第四季度啟動 • 預計於 2024 年第二季度完成第 224 階段 b T2D 臨牀試驗(約 26 周) • 美國、歐洲和日本約有 500 名參與者 • 計劃於 2024 年下半年啟動 2b 期肥胖臨牀試驗(約 36 周) • 大約 275 名參與者在美國和歐洲 • 計劃於 2024 年下半年啟動 |
| 閉幕 (雷蒙德·史蒂文斯博士,首席執行官) |
| Next steps: Continue to execute on oral incretin franchise strategy GSBR-1290 (Oral GLP-1R) GLP-1R+ Combo (GLP-1R/GIPR) GLP-1R+ Combo (GLP-1R/Amylin) 2023 2024 Phase 1b/MAD data (4 wk) Phase 2a T2D data (12 wk) JP PK/ethno-bridging study (4 wk) Phase 2a Obesity data (12 wk) Capsule to tablet PK/bridging study (12 wk) Initiate Phase 2b T2D study (~26 wk) Initiate Phase 2b Obesity study (~36 wk) Small molecule dual GLP-1/GIPR hits identified and lead optimization underway Small molecule dual agonist GLP-1/GIPR Development Candidate Small molecule Amylin hits identified and lead optimization underway Small molecule Amylin receptor agonist Development Candidate |
| Thank you! CONTACT US FOR ADDITIONAL INFORMATION: Email: ir@structuretx.com http://www.structuretx.com |