| NeuroBo 製藥公司 納斯達克:NRBO 2023 年 9 月 |
| 0.66” 0.66” 2 前瞻性陳述 本演示文稿可能包含1995年《私人證券訴訟改革法》所指的前瞻性陳述。前瞻性 陳述包括所有不僅僅與歷史或當前事實相關的陳述,可以通過使用諸如 “可能、—將”、“預期”、“ ” 項目、“估計”、“預期”、“計劃”、“相信”、“潛在”、“應該、—繼續、—可以”、“打算”、“目標”、“預測” 或其負面版本之類的詞語來識別 詞語或其他類似的詞語或表達,儘管並非所有前瞻性陳述都包含這些識別詞語或表達。前瞻性陳述並不能保證未來的行為或表現。這些前瞻性陳述包括關於NeuroBo當前和未來候選產品的市場規模 和潛在增長機會、資本要求和收益用途、臨牀開發 活動、臨牀試驗的時間表和結果、監管部門提交以及其當前和 未來候選產品的潛在監管批准和商業化;執行我們的商業戰略,實現與東亞科技公司的許可協議的好處。Ltd.,包括 對NeuroBo未來財務和經營業績的影響;我們的合同製造商、臨牀研究合作伙伴以及參與我們當前和未來候選產品開發的其他人的合作;及時啟動和完成臨牀試驗;為我們的臨牀 試驗招募受試者;從我們的臨牀試驗中獲得與臨牀前和先前臨牀試驗結果一致的臨牀試驗結果;與許可 協議相關的成本,已知和未知,包括任何費用與許可協議和適用的法律或法規有關的訴訟或監管行動。 這些前瞻性陳述基於NeuroBo目前可用的信息及其當前的計劃或預期,並受到 許多已知和未知的不確定性、風險和其他重要因素的影響,這些因素可能導致我們的實際業績、業績或成就,這些因素可能導致我們在前瞻性陳述中表達或暗示的實際業績、業績或成就。NeuroBO截至2022年12月31日止年度的10-K表年度 報告的 “風險因素” 部分以及NeuroBO向美國證券交易委員會提交的其他文件中詳細描述了這些因素和其他重要因素。 儘管除非法律要求,否則我們可能會選擇在未來的某個時候更新此類前瞻性陳述,但即使隨後發生的事件導致我們的觀點發生變化,我們也不承擔任何這樣做的義務。儘管我們認為此類前瞻性陳述中反映的預期是合理的,但 我們無法保證這種預期會被證明是正確的。在本演講之後的任何日期,都不應依賴這些前瞻性陳述來代表我們 的觀點。 本演示文稿還可能包含獨立各方和我們做出的與市場規模相關的估計值和其他統計數據,以及有關 我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此外, 對我們未來業績以及我們運營所在市場的未來表現的預測、假設和估計必然會受到高度的不確定性和風險的影響。 |
| 0.66” 0.66” 3 公司重生 2022 年 11 月 • 已獲許可 DA-1241 (GPR119) 和 DA-1726 (GLP1R/GCGR) • 新焦點:NASH 和 肥胖 • 美國食品藥品管理局提交併批准了 DA-1241 第 2 期臨牀試驗 • Ind for DA-1726 價值 2023 年的驅動力 • 投資了 1500 萬美元 • 最大股東 • NeuroBo 可以獲得研發、 科學、CMC 專業知識 Dong-A 是一個強大的合作伙伴 轉型的公司:引人注目的 投資機會 ➢ 通過許可實現公司轉型 DA-1241下一代心臟代謝資產 瞄準大型NASH和肥胖市場 ➢ 2024 年資本充足(截至2023年6月30日為2,890萬美元) ➢ 多個短期價值創造里程碑以推動股東價值 |
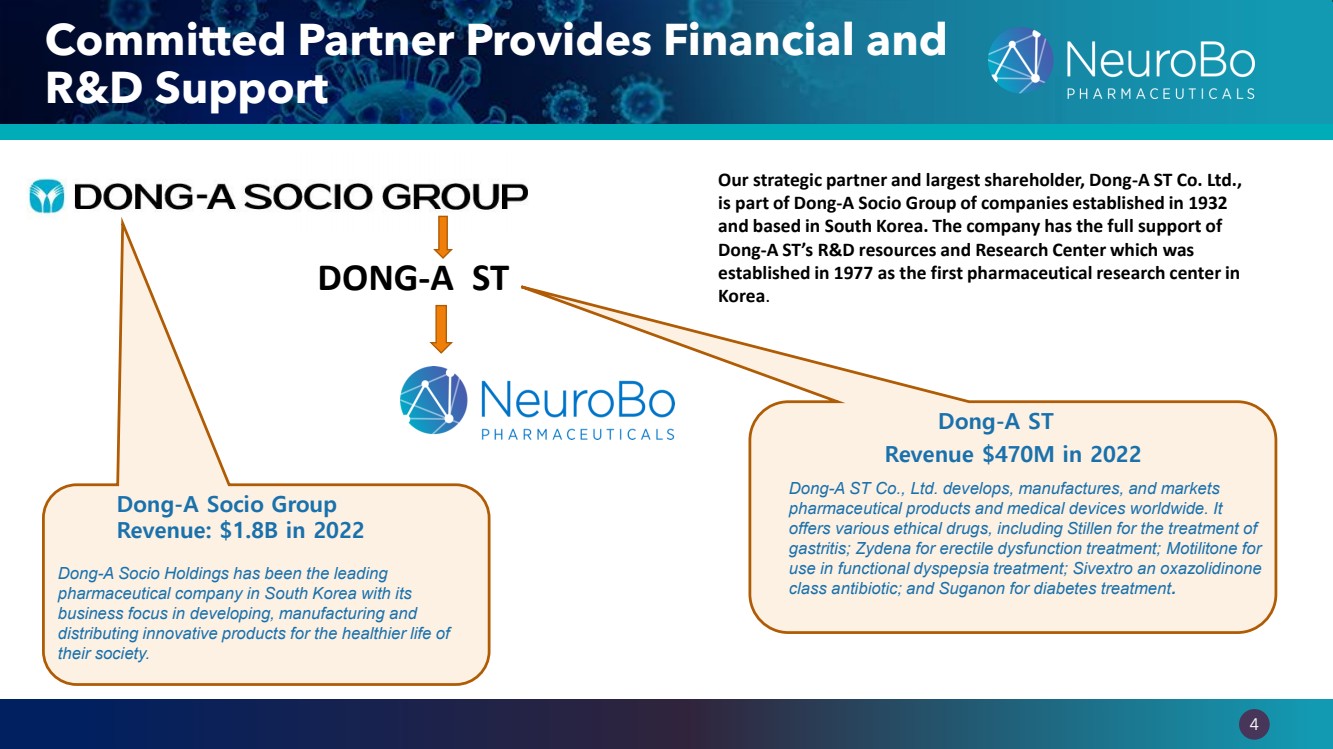
| 0.66” 0.66” 4 忠實合作伙伴提供財務和 研發支持 Dong-A Socio Group 收入:2022 年 18 億美元 2022 年收入 4.7 億美元我們的戰略合作伙伴兼最大股東東亞科技公司Ltd., 是東亞社會集團的一部分,該集團成立於1932年,總部設在韓國。該公司得到了 東亞意法半導體的研發資源和研究中心的全力支持,該中心成立於 1977 年,是 韓國的第一個藥物研究中心。 DONG-A ST Dong-A ST Dong-A ST., Ltd. 在全球開發、製造和銷售 藥品和醫療器械。它 提供各種倫理藥物,包括用於治療 胃炎的 Stillen;用於治療勃起功能障礙的 Zydena;用於功能性消化不良治療的 Motilitone;Sivextro 一種惡唑烷酮 類抗生素;以及用於治療糖尿病的 Suganon。 Dong-A Socio Holdings 一直是韓國領先的 製藥公司,其 業務重點是開發、製造和 分銷創新產品,以實現 社會的更健康生活。 |
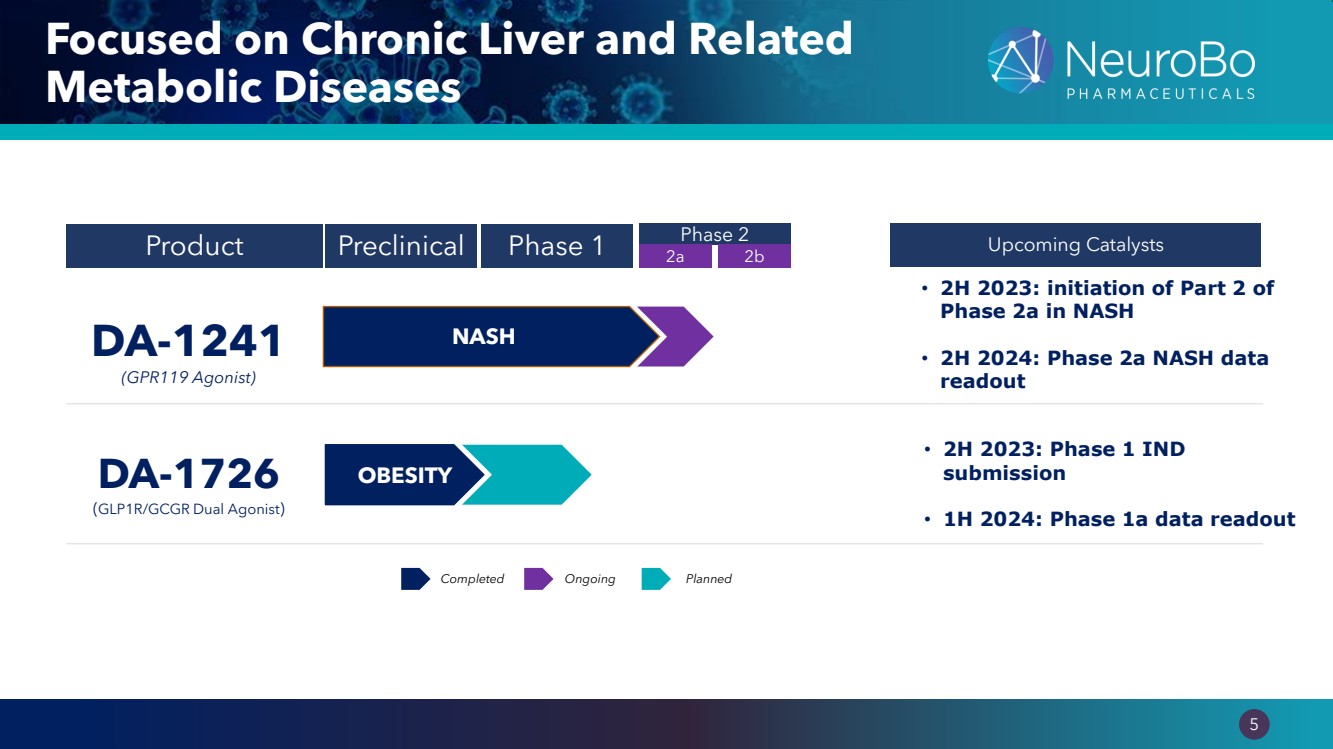
| 0.66” 0.66” 5 專注於慢性肝臟和相關的 代謝疾病 產品臨牀前 1 期 2 期即將推出的催化劑 DA-1241 (GPR119 激動劑) • 2023 年下半年:NASH 2a 期第 2 部分啟動 • 2024 年下半年:2a 期 NASH 數據 readout DA-1726 (GLP1R/GLPR/GRASH) CGR Dual Agonist) • 2023 年下半年:第 1 階段 IND 提交 • 2024 年上半年:1a 階段數據讀出 已完成計劃 2a 2b 肥胖 NASH 正在進行中 |
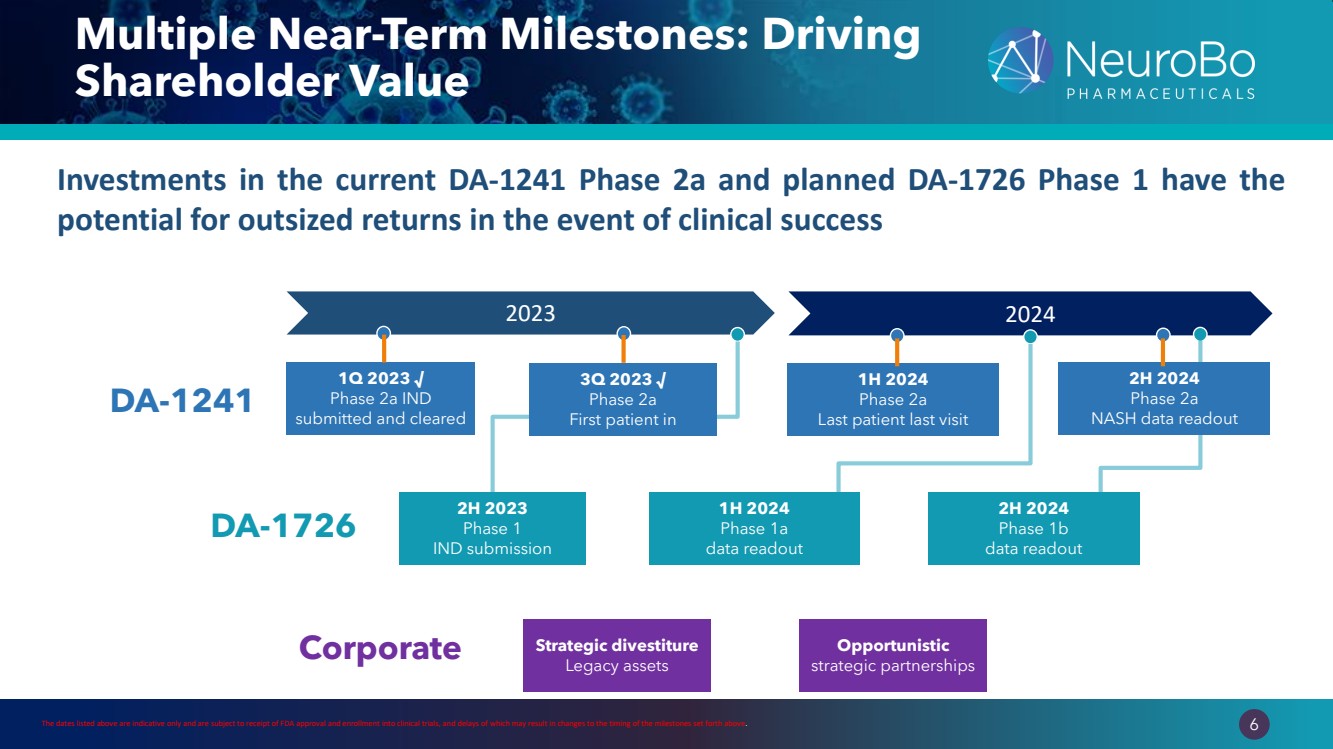
| 0.66” 0.66” 6 多個短期里程碑:推動 2023 年股東價值 2023 年第一季度 √ 第 2a 階段 IND 已提交併通過 2023 年下半年 IND 提交 2024 年下半年 1b 階段 NASH 數據讀出 DA-1726 DA-1241 1H 2024 年 2a 期 最後一次患者上次就診 2023 年第三季度 √ 2a 期 2024 年上半年 第一位患者 1a 期 數據讀出 企業機會主義 戰略剝離 傳統資產 上面列出的日期僅供參考,以收到美國食品藥品管理局為準批准和註冊臨牀試驗,其延遲可能會導致上述里程碑的時間發生變化。 如果臨牀成功,對當前 DA-1241 2a 期和計劃中的 DA-1726 第 1 階段的投資 有可能獲得豐厚的回報 |
| DA-1241 口服可用,潛在的同類首創 GPR119 激動劑 用於治療 NASH |
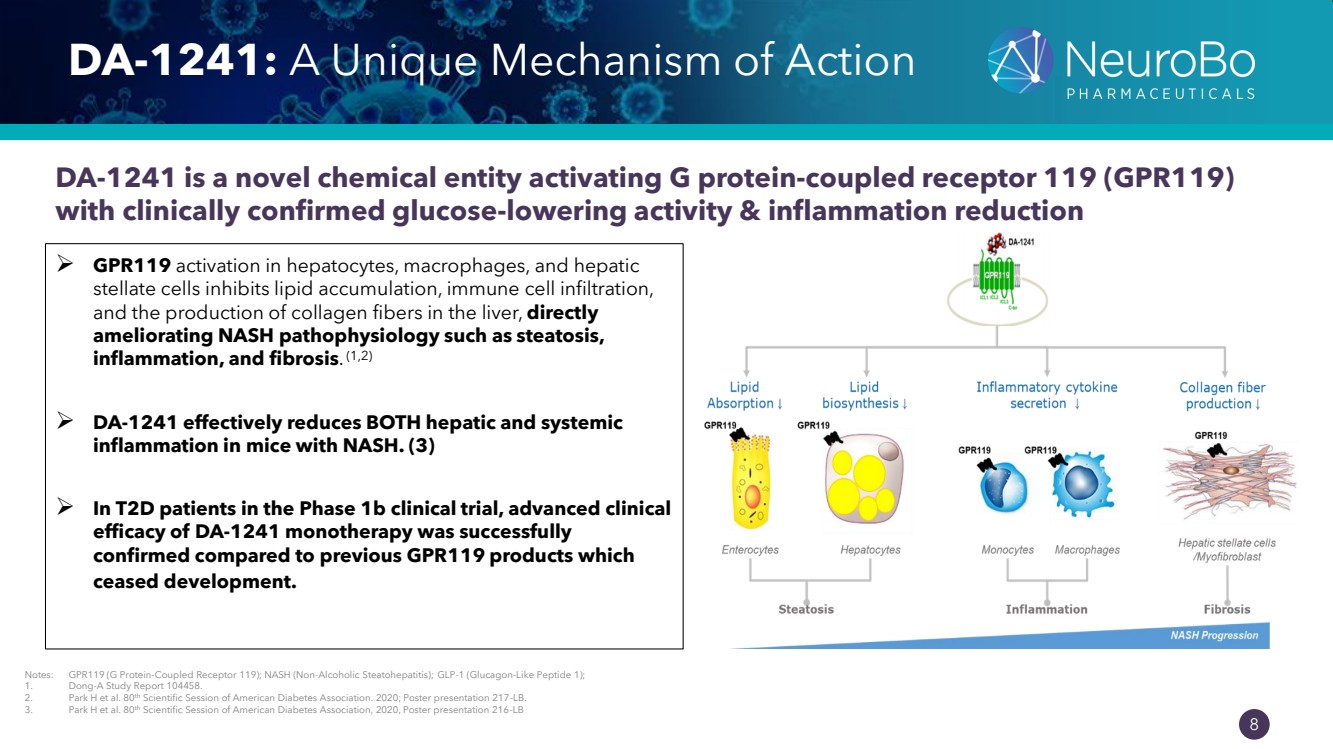
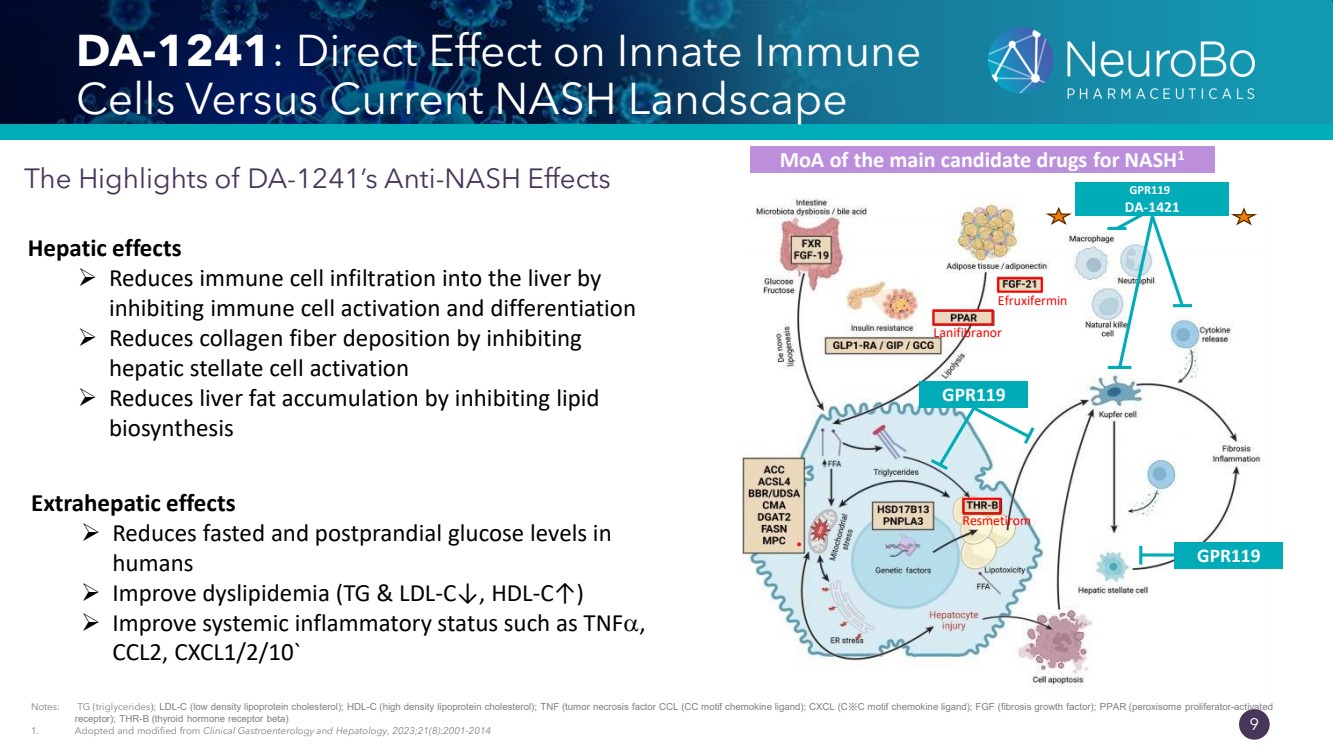
| 0.66” 0.66” 8 DA-1241:一種獨特的作用機制 DA-1241 是一種激活 G 蛋白偶聯受體 119 (GPR119) 的新型化學實體,具有臨牀證實的降糖活性和減少炎症 ➢ GPR119 肝細胞、巨噬細胞和肝星狀細胞的激活可抑制脂質積累、免疫細胞浸潤、 和 星狀細胞的產生肝臟中的膠原纖維,直接改善 NASH 的病理生理學,例如脂肪變性、 炎症和纖維化。 (1,2) ➢ DA-1241 可有效減少患有 NASH 的小鼠的肝臟和全身 炎症。(3) ➢ 在 1b 期臨牀試驗的 T2D 患者中,與 停止開發的 GPR119 產品相比,DA-1241 單一療法的高級臨牀 療效得到了成功證實 。 注意:GPR119(G 蛋白偶聯受體 119);NASH(非酒精性脂肪性肝炎);GLP-1(胰高血糖素樣肽 1); 1。東亞研究報告 104458。 2。Park H 等人。美國糖尿病協會第 80 屆科學會議。2020 年;海報展示 217-LB。 3。Park H 等人。美國糖尿病協會第 80 屆科學會議,2020 年,海報展示 216-LB |
| 0.66” 0.66” 9 DA-1241:與當前 NASH 格局對先天免疫 細胞的直接影響 DA-1241 抗 nash 作用的亮點 GPR119 GPR119 GPR119 DA-1421 Efruxifermin Lanifibranor Resmetirom 注意:TG(甘油三酯);LDL-C(低密度脂蛋白膽固醇);HDL-C(高)密度脂蛋白膽固醇);TNF(腫瘤壞死因子 CCL(CC 基序趨化因子配體);CXCL(C※C 基序趨化因子配體);FGF(纖維化生長因子);PPAR(過氧化物酶體增殖物激活的 受體);THR-B(甲狀腺激素受體 β) 1。採納並修改自《臨牀胃腸病學和肝病學》,2023 年;21 (8): 2001-2014 NASH1 肝臟效應的主要候選藥物 MoA ➢ 通過 抑制免疫細胞激活和分化來減少免疫細胞對肝臟的浸潤 ➢ 通過抑制 肝星狀細胞激活來減少肝臟脂肪的積累 bioa 合成 肝外效應 ➢ 降低 人禁食和餐後葡萄糖水平 ➢ 改善血脂異常(TG 和 LDL-C↓,HDL-C↑) ➢ 改善 ➢全身性炎症狀態,例如腫瘤壞死因子、 CCL2、cxcl1/2/10` |
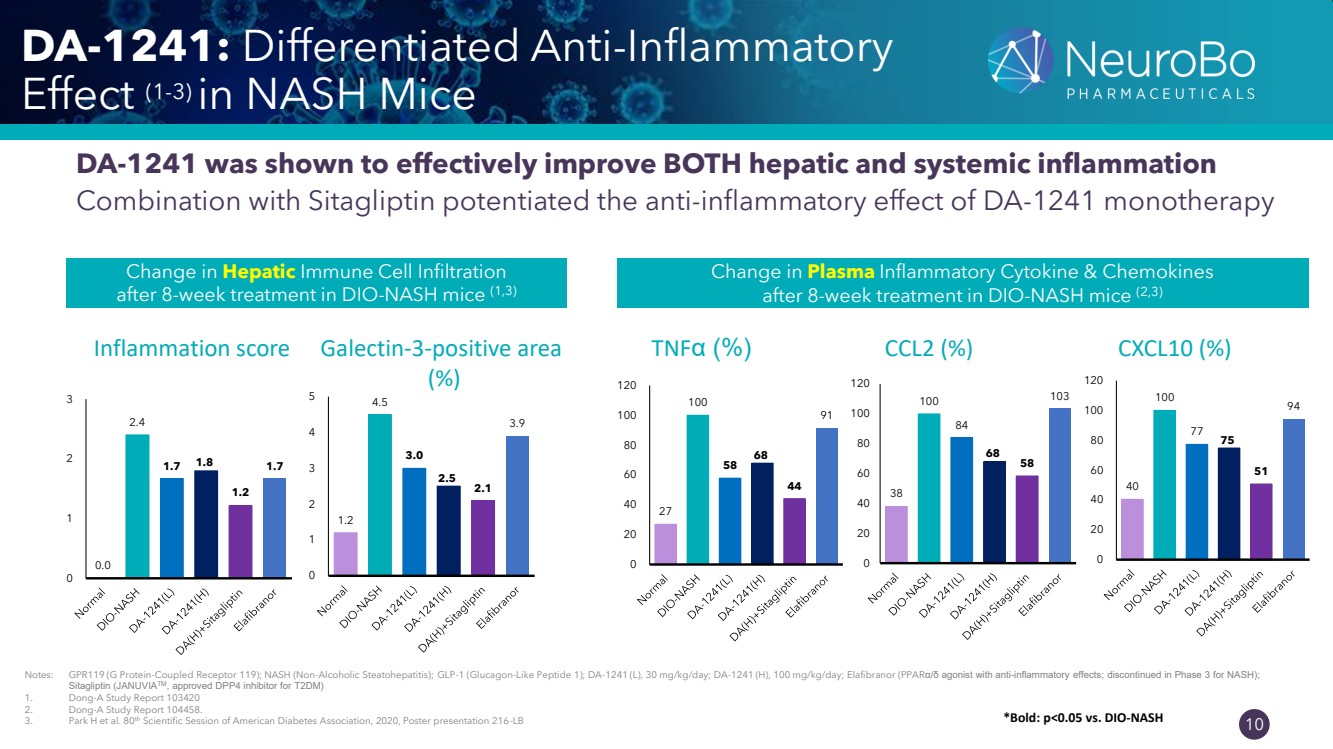
| 0.66” 0.66” 10 DA-1241:NASH 小鼠的分化抗炎 作用 (1-3) DA-1241 被證明可以有效改善肝臟和全身性炎症 與西格列汀聯合增強了 DA-1241 單一療法的抗炎作用 38 100 84 68 103 0 20 40 60 80 100 120 治療 8 周後血漿炎性細胞因子和趨化因子的變化 DIO-NASH 小鼠 (2,3) CCL2 (%) 27 100 58 68 44 91 0 20 40 60 80 100 120 tnfα (%) 40 77 75 51 94 0 20 40 60 80 100 120 CXCL10 (%) 1.2 4.5 3.0 2.1 1 2 3 45 半乳糖凝集素-3 陽性面積 (%) 注意:GPR119(G 蛋白偶聯受體 119);NASH(非酒精性脂肪性肝炎);GLP-1(胰高血糖素樣肽 1);DA-1241(L),30 mg/kg/天;DA-1241(H),100 mg/kg/天;Elafibranor(具有抗炎作用的pparα/Δ激動劑;3期停產 NASH); 西他列汀(JANUVIATM,經批准用於 T2DM 的 DPP4 抑制劑) 1.東亞研究報告 103420 2.東亞研究報告 104458。 3。Park H 等人。2020 年美國糖尿病協會第 80 屆科學會議,海報演示 216-LB DIO-NASH 小鼠治療 8 周後肝免疫細胞浸潤的變化 0.0 2.4 1.7 1.7 1.7 1.7 1.7 0 1 2 3 炎症評分 *粗體:p |
| 0.66” 0.66” 11 DA-1241:臨牀前亮點 DA-1241 令人鼓舞的臨牀前發現 ➢ DA-1241 與先前存在的 GPR119 激動劑 相比,具有更高的內在活性,可以觸發獨特的平衡信號通路。因此,DA-1241 顯示體內療效有所提高,具有持續的抗糖尿病作用 ➢ DA-1241 在各種 NASH 小鼠模型中改善了脂肪變性、炎症和纖維化 ➢ DA-1241 和 DPP4 抑制劑的聯合使用增強了抗 nash 作用和抗糖尿病作用 ➢ DA-1241 在安全藥理學和 毒理學研究中沒有明顯的安全問題老鼠和狗的慢性給藥 26 和 39 周 |
| 0.66” 0.66” 12 臨牀結果 ▪ 1a 期、人體首發、雙盲、安慰劑對照、隨機、單一上升劑量和 與二甲雙胍的相互作用研究 (n=60) ▪ Ib 期、雙盲、安慰劑對照、隨機、多劑量上升研究 (n=108) ➢ 研究治療了 24 名健康志願者 28 天,84 名受試者患有 T2DM 持續 56 天 Safety/ PK ▪ 1a 期,DA-1241 在健康志願者的劑量高達 400 mg 時耐受性良好 ▪ 1b 期,DA-1241 在劑量高達 200 mg/d 時耐受性良好,持續 28 天健康的男性和 T2DM 受試者持續 56 天的 100 mg/d ▪ 每天口服一次 DA-1241 片劑顯示出足夠的臨牀暴露,在 T2DM 受試者中以 劑量依賴性的方式增加。 PD 結果 ▪ DA-1241 在餐後血糖降低方面與西格列汀(JANUVIATM)相當,這表明 的臨牀療效高於 ds-8500a(第一三共的 GPR119 激動劑;在 2b 期失敗) ▪ 所有 DA-1241 治療組中 GIP、GLP-1 和 PYY 的分泌量在第 56 天均增加,與機制一致 DA-1241 的作用注意:T2DM(2 型糖尿病);PK(藥代動力學);PD(藥效學);AE(不良事件);iAUE(測量與時間曲線下的增量區域);GLP-1(類胰高血糖素肽 1);GIP(葡萄糖依賴性胰島素肽);PYY(多肽 YY)。 1。Dong-A 研究報告 da1241_dm_ia。 2。Dong-A 研究報告 da1241_dm_ib。 3。Kim MK 等人。美國糖尿病協會第 81 次會議。2021 年;摘要 765-P。 4。Kim MK 等人。美國糖尿病協會第 81 次會議。2021 年;摘要 766-P。 5. 在 2 型糖尿病受試者中使用二甲雙胍進行 ds-8500a 的 12 周研究 (NCT02647320) 34 18.5 -5.1 -38.6 -23.9 -25 -5 15 35 55 安慰劑 DA-1241 25 mg DA-1241 50 mg DA-1241 100 mg 西他列汀 美國血糖變化 t2DM 第 56 天(第 8 周)的受試者證實 DA-1241 療效得到增強:從非臨牀轉化為臨牀 -24.16 -18.77 13.81 -5.51 -60 -53.4 -50 -30 -20 -10 0 10 20 安慰劑 ds-8500a 25 mg ds-8500a 50 mg ds-8500a 75 75 mg 西他列汀 美國血糖變化 iaue0-3h第 12 周 (5) 2DM 受試者 DA-1241 臨牀概念驗證 第 1 階段 (1-4) |
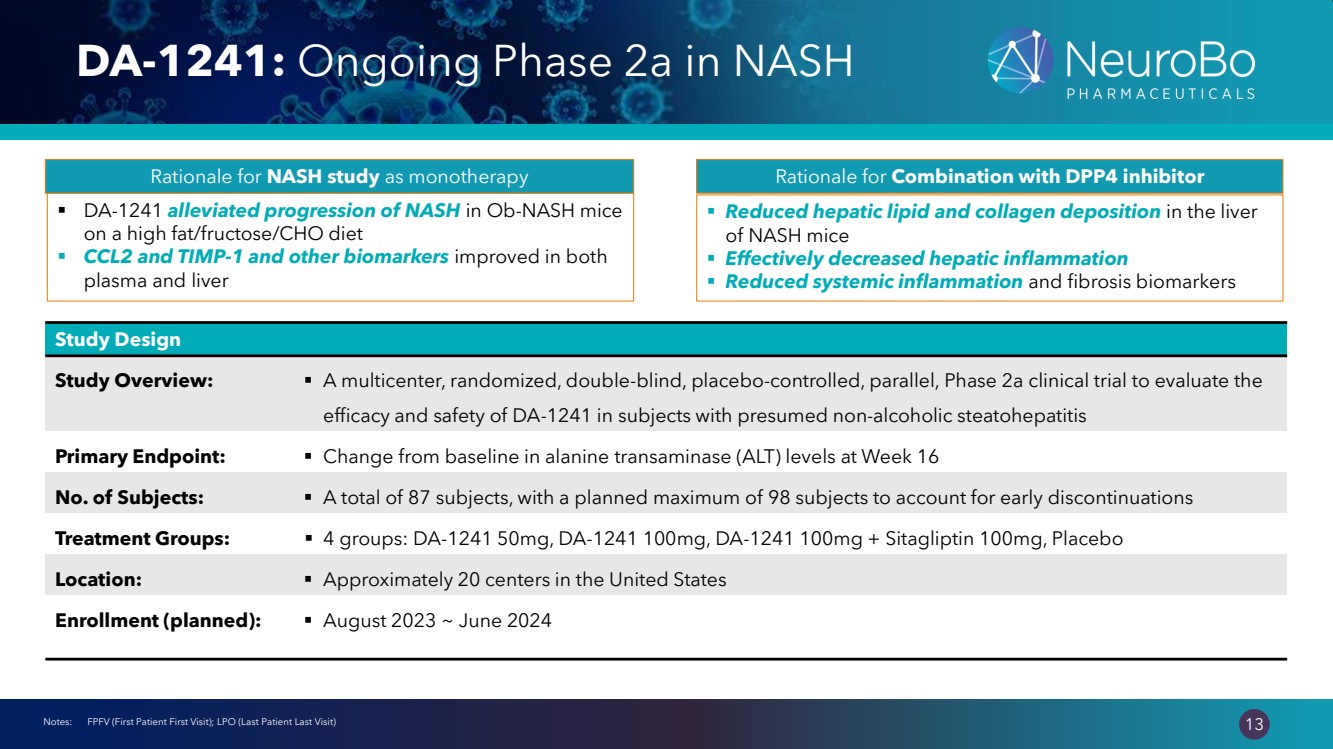
| 0.66” 0.66” 13 DA-1241:NASH 正在進行的 2a 期 注意:FPFV(首次患者首次就診);LPO(最後一次患者最後一次就診) 研究設計 研究概述:▪ 一項多中心、隨機、雙盲、安慰劑對照、平行、2a 期臨牀試驗,旨在評估 DA-1241 對假定為非酒精性飲料的受試者的療效和安全性 atopythenia 主要終點:▪ 第 16 周丙氨酸轉氨酶 (ALT) 水平與基線相比的變化受試者人數:▪ 共有 87 名受試者,計劃最多有 98 名受試者考慮早期受試者停藥 治療組:▪ 4 組:DA-1241 50mg、DA-1241 100mg、DA-1241 100mg + 西他列汀 100mg、安慰劑 地點:▪ 美國大約 20 箇中心 報名(計劃中):▪ 2023 年 8 月至 2024 年 6 月 ▪ DA-1241 緩解了服用高脂肪/果糖/CHO 飲食的 Ob-nash 小鼠 的 NASH 進展 CCL2 和 TIMP-1 以及其他生物標誌物在 血漿和肝臟中均有所改善 ▪ 減少了 NASH 小鼠肝臟中脂質和膠原蛋白的沉積 ▪ 有效減少肝臟炎症 ▪ 減少全身性炎症 ▪還有纖維化生物標誌物 NASH研究的理由作為與DPP4抑制劑聯合使用單一療法的理由 |
| 0.66” 0.66” 14 DA-1241:具有同類最佳療效的潛力 ▪ 用於 NASH 的新型、同類首創 GPR119 激動劑 ▪ 小分子口服,每天一次 ▪ 多模態機制 ▪ 經證實的臨牀前抗 Nash 作用 ▪ 動物對肝脂肪變性、 纖維化/纖維化、肝臟有積極作用和全身性炎症以及 NASH 進展 ▪ 多種併發症的前景:NASH、T2DM、血脂異常 ▪ 降低低血糖風險 } NASH 有望獲得臨牀前療效 ▪ 關鍵肽 GLP-1、GIP 和PYY,在葡萄糖和脂質代謝以及減肥中起作用 ▪ 減少脂質、膠原蛋白沉積和星狀細胞激活 ▪ 對血糖水平以及促炎細胞因子和趨化因子的有益影響 ▪ 肝轉錄組恢復正常控制 GPR119 Agonism 有積極影響 |
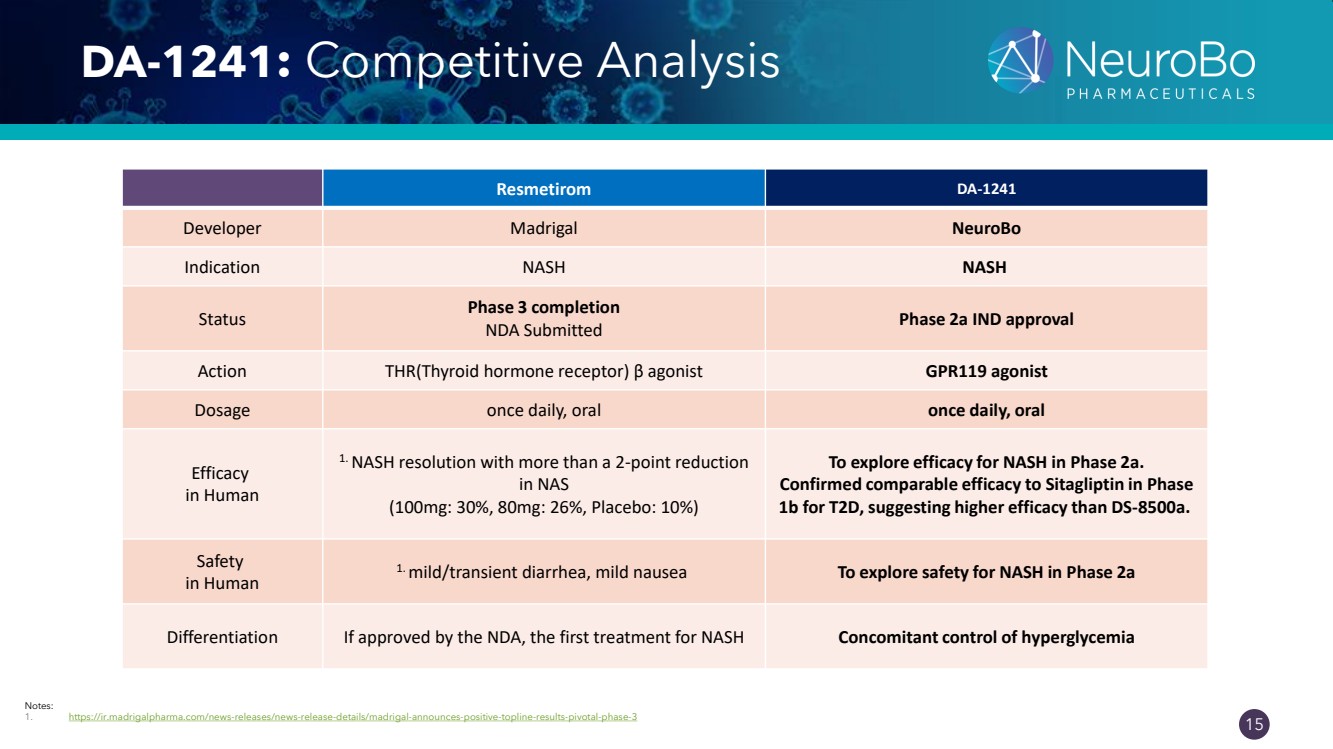
| 0.66” 0.66” 15 DA-1241:競爭分析 注意: 1. https://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-announces-positive-topline-results-pivotal-phase-3 Resmetirom DA-1241 開發者 Madrigal NeuroBo 適應症 NASH NASH 狀態第 3 階段完成 NDA 已提交 2a 階段 IND 批准 Action THR(甲狀腺激素受體)β 激動劑 GPR119 激動劑 劑量每日一次,口服一次,口服 功效 在 Human 1 中。NASH 分辨率降低 2 個百分點以上 (100mg:30%,80mg:26%,安慰劑:10%) 探索 2a 期 NASH 的功效。 證實T2D的療效與西格列汀相當 1b 期,這表明療效高於 ds-8500a。 人類 中的安全 1. 輕度/短暫性腹瀉,輕度噁心探索 NASH 在 2a 期的安全性 分化如果獲得 NDA 的批准,這是第一種 NASH 伴隨控制高血糖的治療方法 |
| DA-1726 一種用於治療肥胖症的新型 GLP1R/GCGR 雙重激動劑 |
| 0.66” 0.66” 17 DA-1726:作用機制 DA-1726 是一種新型的 oxyntomodulin 類似物,可作為治療肥胖的 GLP1R/GCGR 雙 激動劑 ➢ Oxyntomodulin 是一種進食後從腸道 L 細胞釋放的腸道激素,代表 GLP-1 受體和胰高血糖素受體的雙重激動 {} ➢ DA-1726 可減少食物攝入量 (GLP-1 R) 並增加人類的 能量消耗 (GCGR),這有可能導致 顯著降低體重 ➢ DA-1726 平衡良好,患高血糖的風險較低 • 激活時在 GCGR 增加葡萄糖產生 構成高血糖風險的 中,同時激活 GLP-1 受體可以抵消這種影響 注:GLP1R/GCGR(胰高血糖素樣肽 1 受體/胰高血糖素受體);NASH(非酒精性脂肪性肝炎);T2DM (2 型糖尿病);OXM(Oxyndotomodynodynodynodynodynodynodet 受體)尿素);GLP-1(類胰高血糖素 Peptide 1)。 1。Pocai A.Mol Metab.2014;3:241-51。 oxyntomodulin 的生理作用 (1) |
| 0.66” 0.66” 18 5 7 9 11 13 15 17 19 21 6 12 18 24 30 36 42 48 54 60 66 72 能量消耗(kcal/kg/hr) 時間(小時) HF Control Pair-Fed DA-1726*# DA-1726:身體的作用機制 減肥 (1,2) ▪ DA-1726 優於體內的配對餵養組減肥, 表示通過激活 GLP-1 受體減少食物攝入量和 增加能量消耗,這僅次於肥胖小鼠的胰高血糖素 BWL 累積食物攝入能量消耗 4 周 HFD feeding s.c. 注射,每 3 天 14-周 c57BL/6-DIO 小鼠 20 天 ▪ 動物:雄性 HF-DIO 肥胖小鼠 ▪ 治療方案:每三天 S.C. 注射 ▪ DA-1726 劑量:125 nmol/kg 58.1 41.6* 40.4* (20) 0 20 40 60 80 HF Control DA-1726 Pair-Fed (40) (30) (20) (10) 0 10 0 3 6 9 12 15 18 治療日 HF-Control Pair-Fed DA-1726% 體重與基線相比的變化(更正為高頻控制)72 小時(kcal/kg/hr) 平均能量消耗: DA-1726*# 16.6 kcal/kg/hr Pair-Fed 12.4 kcal/kg/hr Pair-Fed 12.4 kcal/kg/hr HF Control 12.4 kcal/kg/hr HF Control 12.4 k6 kcal/kg/hr (35.7%) (15.9%) # * * 注意:HF-DIO(高脂飲食誘發的肥胖);GLP-1(胰高血糖素樣肽 1);S.C.(皮下);HFD(高脂飲食)。 1。東亞研究報告 104372。 2。Kim TH 等人。美國糖尿病協會第 82 次會議。2022 年;摘要 1403-P。 * 與對照組相比具有統計學意義 # 與任何一種治療相比具有統計學顯著性 |
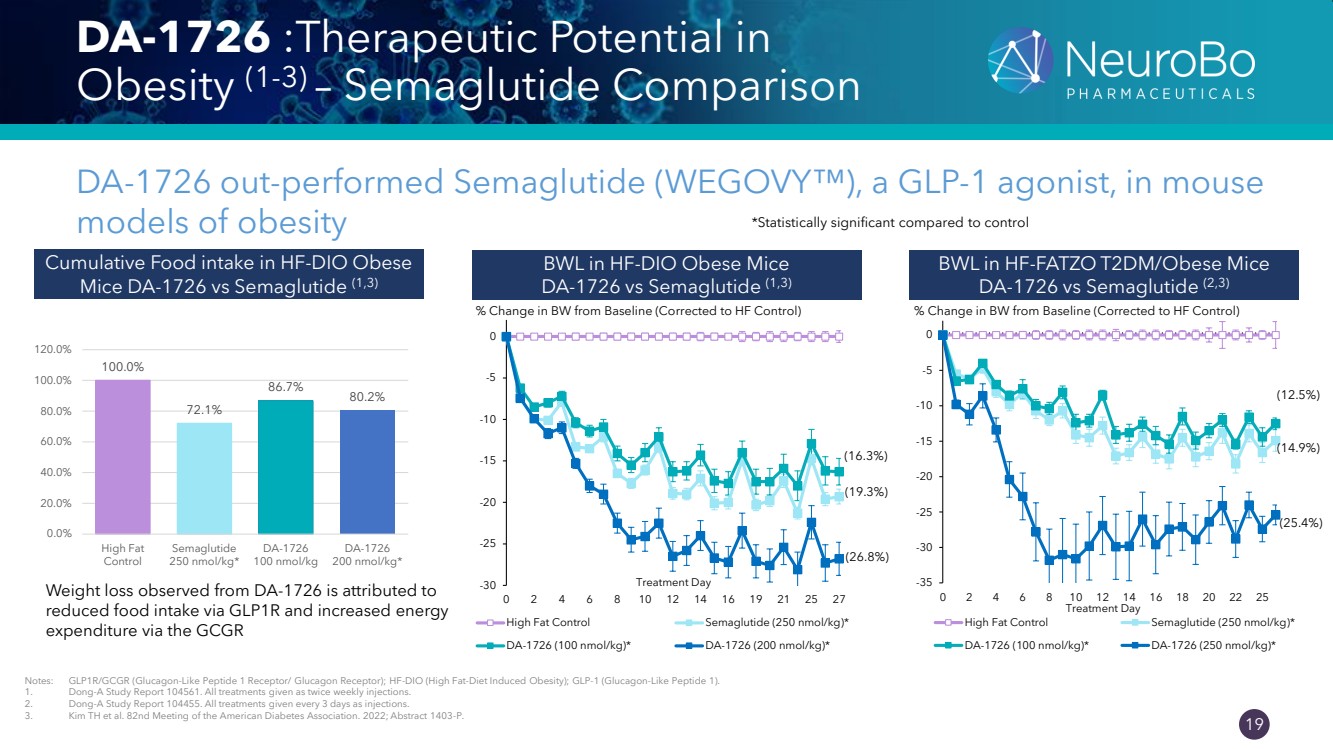
| 0.66” 0.66” 19 da-1726: 肥胖的治療潛力 (1-3) — Semaglutide 對比 DA-1726 在肥胖小鼠 vs Semaglutide (1,3) 中的表現優於 GLP-1 激動劑 Semaglutide (WEGOVY™) BWL BWL BWL vs Semaglutide (1,3) 注意:GLP1R/GCGR(類胰高血糖素肽 1 受體/胰高血糖素受體);HF-DIO(高脂飲食誘導的肥胖);GLP-1(胰高血糖素樣肽 1)。DA-1726 1。東亞研究報告 104561。所有治療均為每週注射兩次。 2。東亞研究報告 104455。所有治療均以注射方式每3天給予一次。 3。Kim TH 等人。美國糖尿病協會第 82 次會議。2022 年;摘要 1403-P。 *與對照組相比 % 體重與基線相比的變化具有統計學意義(更正為 HF 對照組) -30 -25 -20 -10 -10 -10 -10 0 0 2 4 6 8 10 12 16 19 21 25 27 治療日 高脂控制西瑪魯肽(250 nmol/kg)* { DA-1726 (100 nmol/kg) * DA-1726 (200 nmol/kg) * (16.3%) (19.3%) (26.8%) BWL 在 HF-FATZO t2dm/Obese Mices DA-1726 vs Semaglutide (2,3) % 與基線相比的變化(更正為 HF 控制) -35 -30 -25 -20 -15 -10 -10 -10 -0 0 2 6 8 10 14 16 18 20 22 25 治療日 High Fat Control Semaglutide (250 nmol/kg) * DA-1726 (100 nmol/kg) * DA-1726 (250 nmol/kg) * (12.5%) (14.9%) (25.4%) HF-DIO 肥胖 Mise DA-1726 vs Semaglutide (1,3) 100.0% 72.1% 86.7% 80.2% 0.0% 80.0% 0.0% br} 20.0% 40.0% 60.0% 80.0% 100.0% 120.0% High Fat Control Semaglutide 250 nmol/kg* 從 DA-1726 觀察到的減肥歸因於 通過 GLP1R 攝入食物並通過 GCGR 增加能量 消耗 DA-1726 DA-1726 |
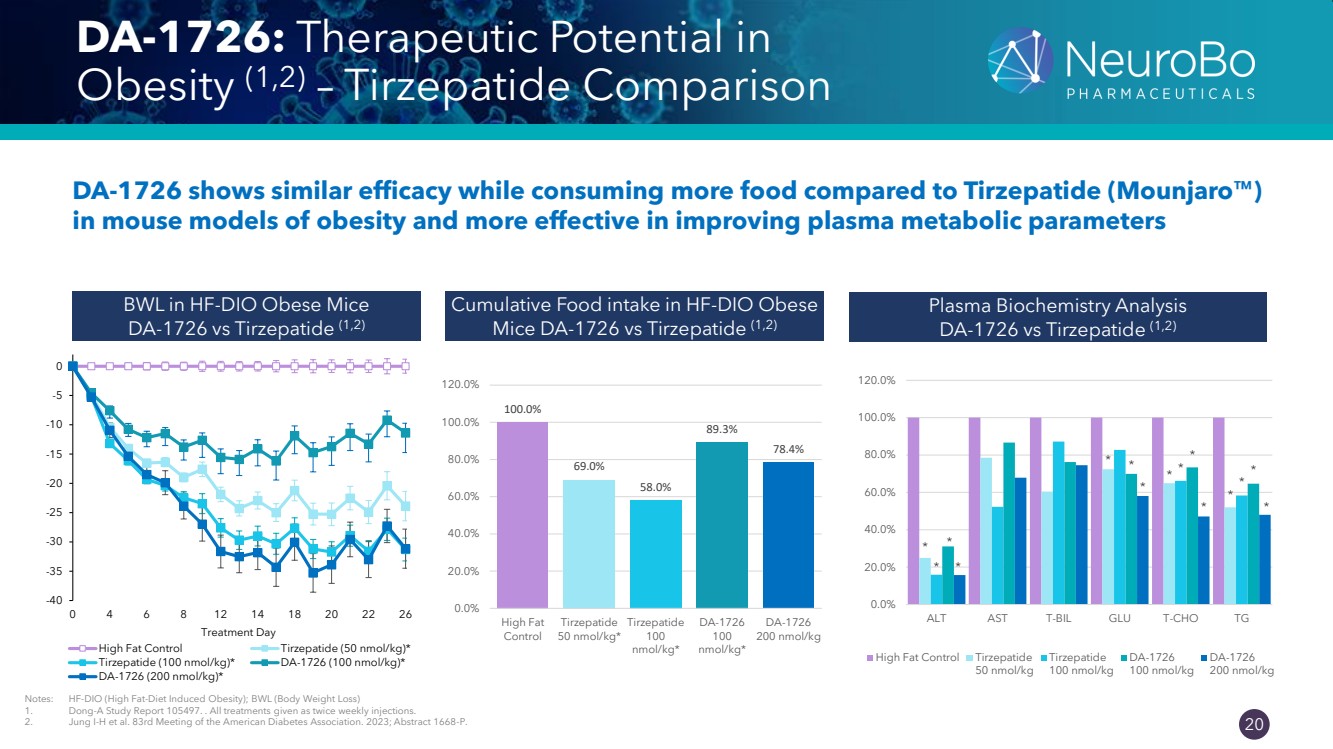
| 0.66” 0.66” 20 DA-1726: 肥胖症的治療潛力 (1,2) — 在肥胖小鼠模型中,替澤帕替比較 DA-1726 在食用更多食物時顯示出相似的功效 ,在改善血漿代謝參數方面更有效 HF-DIO 肥胖 小鼠 DA-1726 vs 替澤帕替的累積食物攝入量 (1,2)) HF-DIO 肥胖小鼠 DA-1726 vs 替澤帕肽 (1,2) 血漿生物化學分析 DA-1726 vs 替澤帕肽 (1,2) 注意:HF-DIO(高脂飲食誘發的肥胖);BWL(減肥) 1。™東亞研究報告 105497。所有治療均為每週注射兩次。 2。Jung I-H 等人。美國糖尿病協會第 83 次會議。2023 年;摘要 1668-P。 -40 -35 -30 -25 -20 -15 -10 -10 0 0 4 6 8 12 14 18 20 22 26 治療日 高脂控制替澤帕肽(50 nmol/kg)* 替澤帕肽(100 nmol/kg)* DA-1726(100 nmol/kg)* DA-1726 (200 nmol/kg) * 100.0% {} 69.0% 58.0% 89.3% 78.4% 0.0% 20.0% 40.0% 60.0% 100.0% 120.0% High Fat Control Tirzepatide 50 nmol/kg* Tirzepatide atide 100 nmol/kg* DA-1726 100 nmol/kg* DA-1726 200 nmol/kg * * * * * * * * * * * * * * * * * * * * * br} 20.0% 40.0% 60.0% 80.0% 100.0% 120.0% ALT AST T-BIL GLU T-CHO TG High Fat Control tirzepatide 50 nmol/kg 100 nmol/kg DA-1726 100 nmol/kg DA-1726 200 nmol/kg |
| 0.66” 0.66” 21 GLP1R/GCGR 雙重激動劑用於治療肥胖 一種新型的 oxyntomodulin 類似物,每週皮下給藥一次 DA-1726:臨牀前亮點 • DA-1726 誘導 GLP-1 和胰高血糖素受體之間的平衡激活 • DA-1726 顯示通過激活 GLP-1 受體減少食物攝入量,並通過葡萄糖激活能量消耗 agon 激活 • 在肥胖小鼠中,DA-1726 的體重減輕幅度比 Semaglutide • 肥胖的小鼠體重減輕得差不多,同時消耗的食物比替西帕替多 • DA 的組織病理學-DA-17261726 顯示與 Semaglutide 相比,肝臟脂肪變性、炎症和 纖維化有進一步改善。• 平衡激活 GLP-1 和胰高血糖素受體有可能降低低血糖 和高血糖症的風險 |
| 0.66” 0.66” 22 DA-1726 計劃在 1a 階段評估 PK/PD 和肥胖症的安全性 注意:MAD(多重上升劑量);SAD(單次上升劑量);PK(藥代動力學);PD(藥效學);FPFV(首次就診);LPLV(最後一次患者上次就診)。 I 期 研究概述:▪ 12 周 SAD/MAD、PK/PD、安全性和耐受性;在肥胖患者的 i1b 期研究中,延長給藥(12 周)可以為肥胖症提供額外的臨牀信號 人羣:▪ 1a 期:健康志願者;1b 期健康志願者和其他健康肥胖者組合 受試者人數:▪ 兩項研究的大約 100 名受試者 {} 地點:▪ 美國(可以考慮澳大利亞) 研究時間:▪ FPFV 到頂線結果大約 18 個月(SAD 和 MAD 合計) ▪ 在動物模型中 DA-1726與配對餵養組相比,體重減輕效果更好, 這表明減肥在很大程度上歸因於激活 GLP-1 導致食物攝入量減少 ▪ DA-1726 在能量消耗方面也優於配對餵養組和對照組 (繼發於胰高血糖素激活) ▪ 與西瑪魯肽 相比,減肥效果可能更好 ▪ 比替塞帕替特多食物消耗量更大 的理由肥胖研究 |
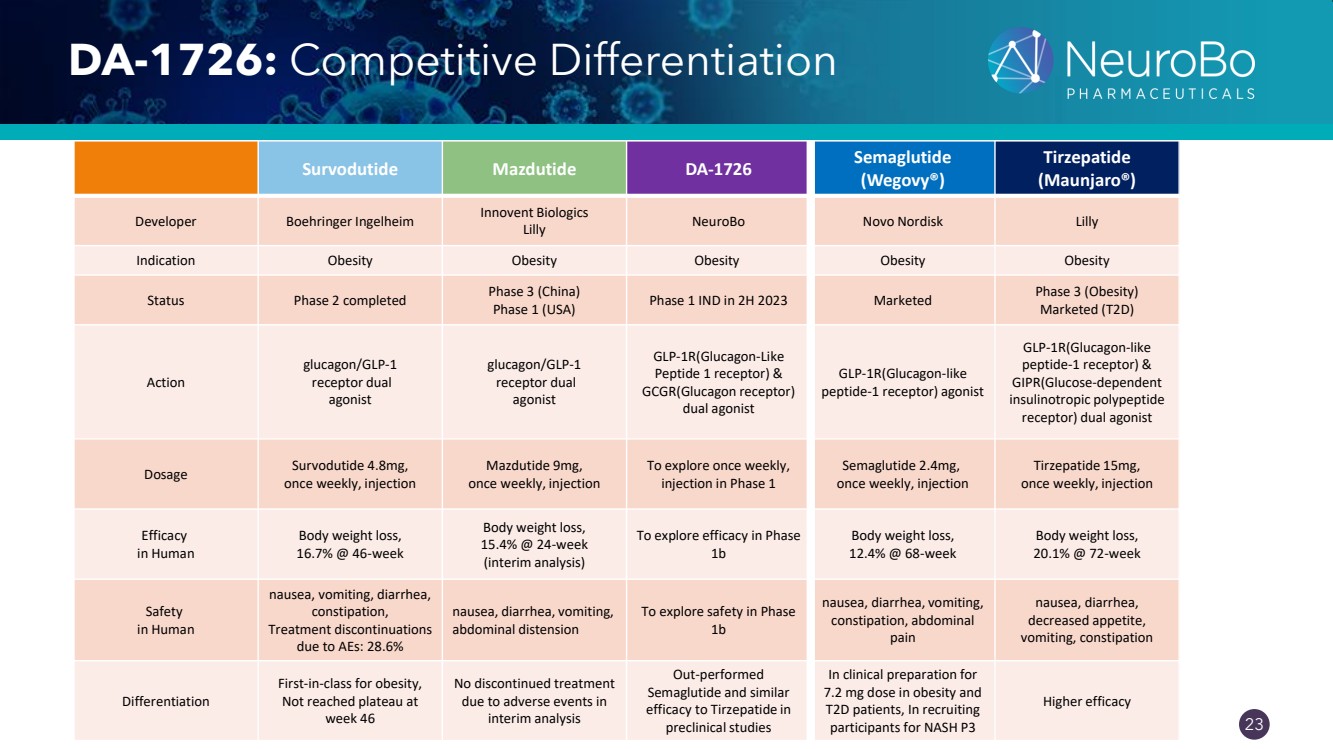
| 0.66” 0.66” 23 DA-1726:競爭差異化 Survodutide Mazdutide DA-1726 Semaglutide (Wegovy®) tirzepatide (Maunjaro®) 開發者 Boehringer Ingelheim Innovent Biologics Lilly NeuroBo Novo Nordisk Lilly 適應症肥胖肥胖 } Status 2 階段已於 2023 年下半年完成第 3 階段(中國)第 1 階段(美國)第 1 期 IND 已上市 3 期(肥胖) 已上市(T2D) Action Glucagon/GLP-1 受體雙 激動劑 tide 1 受體) & GCGR (GLP-1R胰高血糖素受體) 雙激動劑 GLP-1R(類胰高血糖素 肽-1 受體)激動劑 GLP-1R(類胰高血糖素 肽-1 受體)和 GIPR(葡萄糖依賴性 胰島素促多肽 受體)雙激動劑 劑量 Survodutide 4.8mg, 每週一次,注射 Mazdutide 9mg, 每週一次,注射 要探索一次, 在第一階段注射 Semaglutide 2.4mg, 每週注射 15mg, 注射 對人體的功效 體重減輕, 16.7% @ 6 周 減肥, 15.4% @ 24 周 (中期分析) 探索 1b 期體重減輕, 12.4% @ 68 周 體重減輕, 20.1% @ 72 周 Safety 人類 噁心、嘔吐、腹瀉、 便祕、 因不良而停止治療 :28.6% 噁心、腹瀉,嘔吐, 腹脹 探討階段 1b 噁心、腹瀉、嘔吐、 便祕、腹部 疼痛 噁心、腹瀉、 食慾下降、 嘔吐、便祕 分化 肥胖症同類第一, 周未達到平穩46 中期分析中沒有因不良事件而停止治療 Semaglutide 在 臨牀前研究中表現優於 Semaglutide,其療效與替西帕替類似 7.2 mg 劑量的肥胖患者和 T2D 患者,在招募 受試者時,NASH P3 的療效更高 |
| 企業概述 |
| 0.66” 0.66” 25 廣泛的知識產權組合 DA-1241 DA-1726 U.S. ▪ 一項專利:既是物質的構成 又是成分的過程 ——預計將於 2035 年到期* ▪ 一項美國非臨時專利 申請:既是物質的構成 又是成分的使用 ▪ 一項美國專利:既是物質的構成 成分的使用 -預計將於 2038 年到期* ▪ 一項美國非臨時專利申請: 物質成分和 成分的使用 ▪ PCT 申請已進入全國 2022 年 10 月的階段 OUS ▪ 17 項專利: -預計將在 2035 年至 2039之間到期* ▪ 14 項專利申請: 物質的組成和/或成分的使用 ▪ 5 個物質組成專利: -預計將在 2038 年至 2040之間到期* ▪ 8 份專利申請:物質成分 和/或使用 |
| 0.66” 0.66” 26 強大的領導團隊 管理團隊 Hyung Heon Kim,首席執行官 ▪ 在製藥和生物技術開發領域工作超過 35 年 ▪ Adiso therapeutics 臨牀運營高級總監 ▪ Shire/Takeda Pharmicals 臨牀運營總監 ▪ 阿斯利康實驗試驗管理總監 Robert Homolka,臨牀運營高級副總裁 ▪ 牛津大學肝病學客座教授 ▪ NASH/NAFLD 臨牀試驗專家,大約 300 篇同行評審的出版物 ▪ MD 密西西比大學 ▪ Col(退休。)美國,MC Stephen Harrison,醫學博士,諮詢醫學總監 ▪ 在東亞東亞的製藥行業工作了18年以上 ▪ 企業規劃團隊負責人 ▪ 糖尿病專業臨牀試驗研究經理 ▪ 業務發展經理 Sung-Jin Kim,藥劑師,企業戰略總監 ▪ 35 年以上的投資銀行和高管經驗 ▪ Pinetree Therapeutics 首席財務官、美國醫療創新、Rotor Clip ▪ 瑞士信貸、保誠證券、 Chase、花旗 的投資銀行職位 ▪ 哈佛大學文學學士、工商管理碩士哥倫比亞大學 Bennett Goldstein,財務顧問 ▪ 在東亞 ST 從事藥物發現研究超過 25 年 ▪ 專門研究糖尿病、肥胖、NASH、免疫介導疾病 ▪ 梨花女子大學藥學院博士、rpH、RpH、首席科學官 ▪ 喬治華盛頓大學會計學學士學位 University 是一名持牌註冊會計師 Adam Perlish,註冊會計師,財務總監 ▪ 在併購、融資和公司治理領域擁有 20 多年的經驗 ▪ 在東亞集團執照、併購和合規方面擁有 10 年以上的經驗 ▪ Dong-A ST 和 Dong-A Socio Group 的前總法律顧問/高級副總裁 ▪ BA Soonghsil University、JD 華盛頓大學法學院 |
| 0.66” 0.66” 27 經驗豐富的董事會 ▪ 在不同級別的執行管理工作超過20年 ▪ Medifast Inc. 的執行副總裁兼總法律顧問 ▪ 美國退伍軍人;美國陸軍(JAG) 軍團直接任命的軍法辯護律師 ▪ BS 白求恩-庫克曼大學,法學博士北卡羅來納中央大學 Jason Groves ▪ 在製藥和醫療器械行業擁有 30 多年的經驗 ▪ TherapeicsMD 前聯席首席執行官 ▪ 紐約州立大學斯特恩商學院工商管理碩士 Mark A. Glickman ▪ 擔任高管超過 35 年的經驗和上市公司 和私營公司的董事會成員 ▪ Ampex Corporation 前董事長 ▪ 耶魯大學文學學士、沃頓商學院工商管理碩士 D. Gordon Strickland——審計委員會主席 ▪ 20+在併購、融資和公司治理領域擁有多年的經驗 ▪ 在東亞集團執照、併購和合規方面擁有 10 年以上 ▪ 曾任東亞科技大學和東亞社會集團總法律顧問/高級副總裁 ▪ BA 鬆實大學、法學博士華盛頓大學法學院 Hyung Heon Kim-Neurobo 總裁兼首席執行官 ▪ 30 多年在上市和私營公司擔任高級管理人員的經驗 br} 和私法實踐 ▪ 奧林匹斯衞星顧問委員會,Current Health Inc. 和 Triage Technologies, Inc. 的法律顧問 ▪ BA 達特茅斯學院、法學博士和工商管理碩士弗吉尼亞大學 Michael Salsbury — 薪酬委員會主席 Andrew Koven——董事會主席、提名和 公司治理委員會主席 ▪ 在公共和私營製藥公司擔任高管、董事會成員和總法律顧問 ▪ 卡拉制藥公司首席獨立董事 ▪ 達爾豪西大學文學士和法學學士學位,哥倫比亞大學法學碩士 |
| 0.66” 0.66” 28 由科學顧問委員會支持 科學顧問委員會 ▪ 哈佛醫學院神經病學教授 ▪ 自主神經和周圍神經疾病中心主任 ▪ 馬薩諸塞州波士頓 Roy Freeman,mbchB ▪ 科羅拉多大學醫學院醫學副教授 ▪ 內分泌系生物學、代謝和糖尿病 ▪ 科羅拉多州博爾德 Leigh Perreault,醫學博士,FACE,FACE,FACE,FACE ▪ 哈佛醫學院醫學副教授 ▪ 體重管理與 Wellness Brigham and Women's 聯合主任醫院 ▪ 馬薩諸塞州波士頓 Caroline Apovian,醫學博士,FACP,FTOS,DABOM ▪ 加州大學聖地亞哥分校 ▪ NAFLD 研究中心主任、肝病學主任、 醫學教授、 胃腸病學系副主任 ▪ 加利福尼亞州聖地亞哥 Rohit Loomba,醫學博士 HSC |
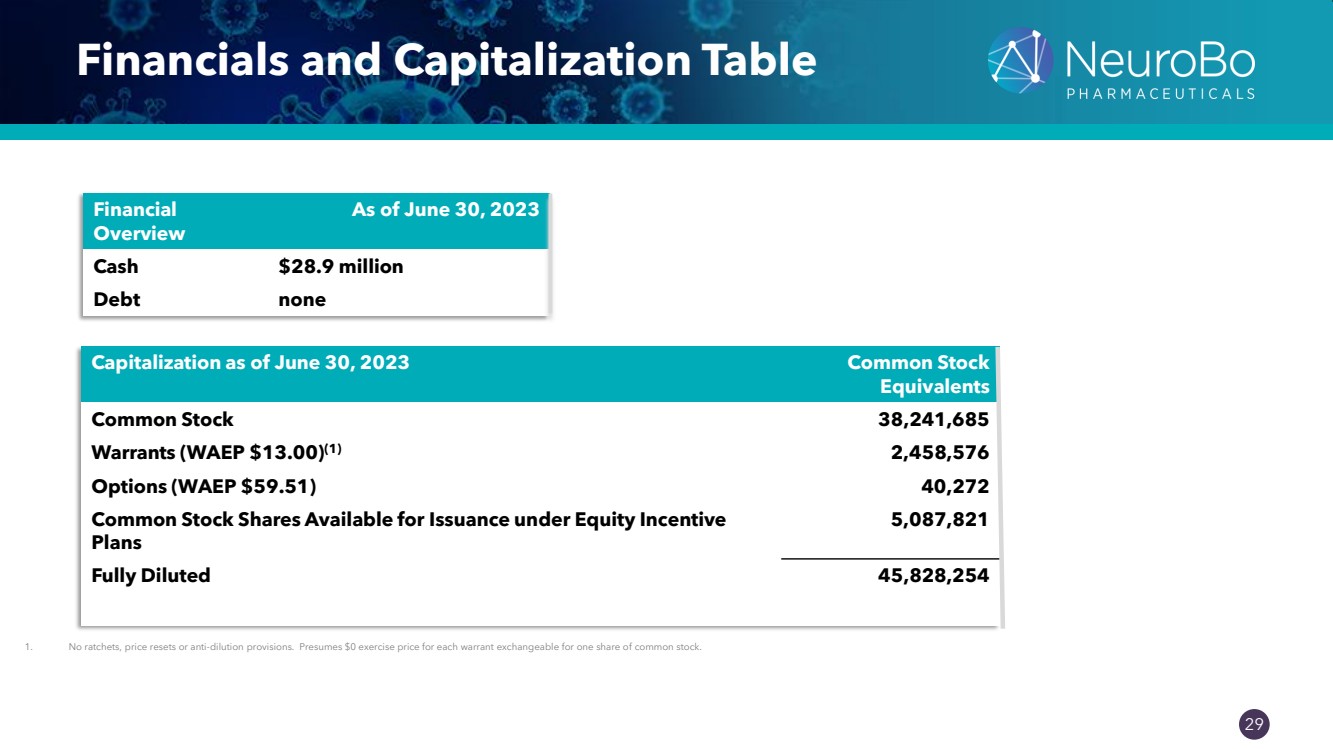
| 0.66” 0.66” 29 財務和資本化表 1.沒有棘輪、價格重置或反稀釋條款。假設每份可兑換成一股普通股的認股權證的行使價為0美元。 Financial 概述 截至2023年6月30日現金2890萬美元 債務無 截至2023年6月30日的市值普通股 等價物 普通股 38,241,685 份認股權證(WAEP 13.00 美元)(1) 2,458,576 份期權(WAEP 59.51 美元)40,272 股普通股可供根據股權激勵發行} 計劃 5,087,821 全面攤薄 45,828,254 |
| 0.66” 0.66” 30 引人注目的投資摘要 通過下一代治療產品線瞄準 NASH 和肥胖 Therapeutics • 通過多個短期創造價值的里程碑推動股東價值 ✓ 已提交用於治療 NASH 的 DA-1241 第 2a 期試驗 ✓ 在 {肥胖} 中提交 DA-1726 的 IND • 在財務和臨牀合夥人Dong-A ST 的支持下 • 2023年第二季度資本充足,現金為2,890萬美元 • 探索超越傳統資產許可的戰略機會 DA-1241 |
| 謝謝! 投資者聯繫人: RX COMMUNICATIONS GROUP MICHAEL MILLER +1-917-633-6086 MMILLER@RXIR.COM |
| 附錄 |
| 0.66” 0.66” 33 NASH 中的機遇與挑戰 在第 2 階段 (3) 中選擇 NASH Comparables Company Drug Target Dev第 Akero Efruxifermin FGF-21 第 2 階段正在進行中 Altimmune Pemvidutide GLP-1 第 2b 期 2023 年中期 cytoDyn Leronlimab CCR5 第 2b 期計劃中 半乳糖凝集素半乳糖凝集素-3 第 2b 期計劃中 NGM PharmMK-3655 β-klotho/fgfr1C 第 2b 階段已結束 Terns Pharm。TERN-501 thrβ Phase 2b/3 2024 Viking Therap。VK2809 thrβ 第 2 階段 ▪ 美國食品藥品管理局沒有批准的 NASH 治療方法 ▪ 預計到 2030 年將增長到 1600 億美元 (1) ▪ 患病率從 1700 萬增加到 2700 萬(2015-2030 年)(2) [基本要求和需求 ] 高安全性和久經考驗的有效性 (1) https://www.globenewswire.com/news-release/2023/04/14/2647029/0/en/Global-Non-alcoholic-Steatohepatitis-NASH-Market-to-Reach-160-7-Billion-by-2030.html (2) Hepatology,Loomba,Sanyal,2018 年 1 月;67 (1): 123-133。doi:10.1002/hep.29466。Epub 2017 年 12 月 1 日 (3) 納斯達克、公司網站和投資者簡報 2022-2030年全球納什銷售額 (1) 2015-2030年納什流行率(估計值)(2)(估計值)(2)(估計值)選擇 NASH COMPANIES COMPARABLES 市值 (3) 0 5 10 15 20 25 30 35 40 2016 2017 2019 2019 2021 2022 2026 2026 2027 2028 2028 2029 2030 美國 NASH 流行率(百萬) 0 25 75 100 125 150 175 203 2026 2028 2029 2030 NRBO GALT ALT CYDY NGM TERN TERN AKRO VKTX 0 200 400 600 800 1,400 1,400 1,400 1,600 1,800 2,000 市值(百萬美元) |
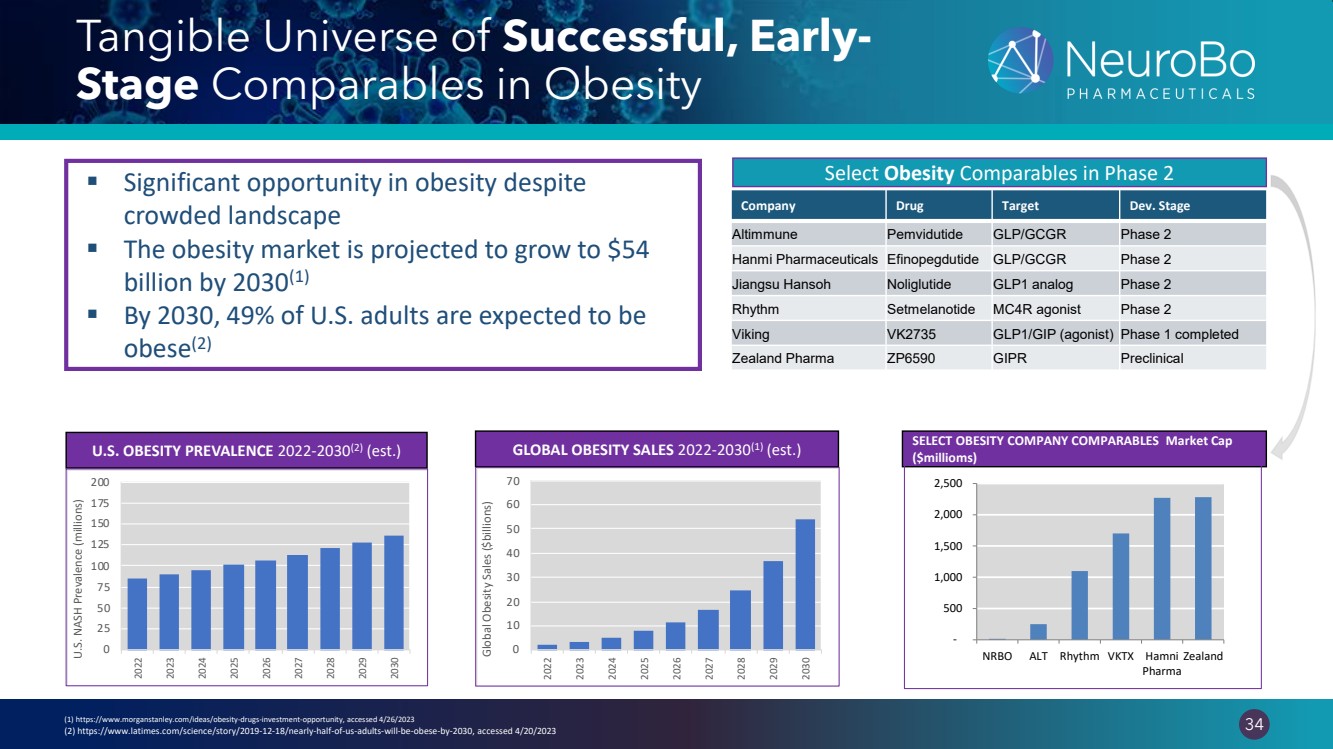
| 0.66” 0.66” 34 Tangible Universe of Successful, Early-Stage Comparables in Obesity Select Obesity Comparables in Phase 2 Company Drug Target Dev. Stage Altimmune Pemvidutide GLP/GCGR Phase 2 Hanmi Pharmaceuticals Efinopegdutide GLP/GCGR Phase 2 Jiangsu Hansoh Noliglutide GLP1 analog Phase 2 Rhythm Setmelanotide MC4R agonist Phase 2 Viking VK2735 GLP1/GIP (agonist) Phase 1 completed Zealand Pharma ZP6590 GIPR Preclinical ▪ Significant opportunity in obesity despite crowded landscape ▪ The obesity market is projected to grow to $54 billion by 2030(1) ▪ By 2030, 49% of U.S. adults are expected to be obese(2) GLOBAL OBESITY SALES 2022-2030(1) (est.) (1) https://www.morganstanley.com/ideas/obesity-drugs-investment-opportunity, accessed 4/26/2023 (2) https://www.latimes.com/science/story/2019-12-18/nearly-half-of-us-adults-will-be-obese-by-2030, accessed 4/20/2023 SELECT OBESITY COMPANY COMPARABLES Market Cap ($millioms) U.S. OBESITY PREVALENCE 2022-2030(2) (est.) 0 25 50 75 100 125 150 175 200 2022 2023 2024 2025 2026 2027 2028 2029 2030 U.S. NASH Prevalence (millions) 0 10 20 30 40 50 60 70 2022 2023 2024 2025 2026 2027 2028 2029 2030 Global Obesity Sales ($billions) - 500 1,000 1,500 2,000 2,500 NRBO ALT Rhythm VKTX Hamni Pharma Zealand |