
由Magenta Therapeutics, Inc.根據經修訂的1933年 證券法第425條提交,並視為根據經修訂的1934年《證券交易法》第14a-12條提交,標的公司:Magenta Therapeutics, Inc.(委員會文件編號333-271917)2023 年 8 月公司簡報

免責聲明前瞻性陳述本 演示文稿(“演示文稿”)中的某些陳述,除了純粹的歷史信息外,可能構成聯邦證券法所指的 “-florw ookard ing 聲明”,包括就1995年《美國私人證券訴訟改革法》下關於Magenta Therapeutics, Inc.(“Magenta”)、Dianthus Therapeutics, Inc.(“Dianthus Therapeutics, Inc.” Dianthus Therapeutics, Inc.(“Dianthus Therapeutics, Inc.””),擬議的並行融資以及Magenta和Dianthus之間的擬議業務 合併(”擬議的交易和補充行動(兩者兼而有之)就事情而定。這些前瞻性陳述包括但不限於關於Magenta或Dianthus 對未來的期望、希望、信念、意圖或規則日期的明示或暗示陳述,包括但不限於以下方面的陳述:擬議交易和預期效果、感知的收益或機會以及相關時機、對發現的期望或計劃、臨牀前研究、臨牀試驗和研發計劃,特別是關於 DNTH103,以及任何與之相關的發展或業績,包括 DNTH103 的 目標產品概況;這些研究和試驗結果的預期時間;對收益用途的預期以及合併後的公司的資本資源將足以為其預期運營提供資金的時間段;對補充療法市場和潛在機會的預期,特別是與 DNTH103 有關的預期;以及合併後的公司普通股在 股票代碼“DNTH。”此外,任何提及 zfati utuon re sev ents 或情況的預測、預測或其他特徵的陳述,包括石竹臨牀試驗的預計啟動時間以及上述任何一項的任何 基本假設,均為前瞻性陳述。“機會”、“潛力”、“里程碑”、“跑道”、“將”、“預期”、 “實現”、“新術語ar”、“催化劑”、“追求”、“管道”、“相信”、“繼續”、“可以”、“可能”、“估計”、“期望”、 “打算”、“可能”、“plos ans,”” i “ble”、p “預測”、“項目”、“應該”、“戰略”、“努力”、“將”、 “目標”、“目標”、“承諾” 和類似的表達(包括這些術語的否定詞或它們的變體)通常表示前瞻性陳述,但缺少這些詞並不意味着 陳述不具有前瞻性。前瞻性陳述受風險、不確定性和其他因素的影響,這些因素可能導致實際結果與此類前瞻性陳述所表達或暗示的結果存在重大差異。這些 前瞻性陳述基於當前的預期和假設,儘管Magenta及其管理層或Dianthus及其管理層(視情況而定)認為這些預期和假設是合理的,但本質上是不確定的。新的風險和不確定性 可能會不時出現,因此不可能預測或識別所有風險和不確定性。可能導致實際業績與當前預期存在重大差異的因素包括但不限於:擬議交易完成或完成的 條件未得到滿足的風險,包括擬議交易未能獲得股東的批准;並行融資無法及時完成的風險或 ;擬議交易完成的時間和每項交易能力的不確定性 Magenta 和 Dianthus 將完成所考慮的交易;與Magenta在擬議交易完成之前繼續在納斯達克上市 以及合併後的公司在擬議的Tranisskac大放異彩之後能夠繼續上市相關的風險;rd Magenta和Dianthus能夠正確估計與擬議交易相關的各自運營 費用和支出(如適用),以及任何延遲收盤將對預期現金資源產生的影響的不確定性收盤時由此產生的合併公司以及 其他事件可能減少合併後公司現金資源的意想不到的支出和成本;任何可能導致Magenta和Dianthus之間業務合併終止的事件、變更或其他情況或條件的發生;宣佈或暫停業務合併對Magenta或Dianthus的業務關係、經營業績和總體業務的影響;與擬議的 ctiT 有關的成本。可能對 Magenta、Dianthus 或其中任何一項提起的任何法律訴訟的結果他們各自的董事或高級管理人員與合併協議或其所設想的交易有關;Magenta 或 Dianthus 保護各自知識產權的能力;對擬議交易的競爭性迴應;擬議交易產生的意外成本、費用或費用;因宣佈或完成擬議交易而對 業務關係可能產生的不良反應或變化;立法、監管、政治和經濟發展;以及這些不確定性以及Magenta於2023年3月23日向美國證券交易委員會(“SEC”)提交的-K f10表年度報告中標題為 “風險 因素”、“風險因素摘要” 和 “前瞻性陳述” 的章節、Magenta 不時向美國證券交易委員會提交的其他文件 中列出的因素,以及與洋紅色或石竹有關的任何風險因素與擬議交易的關係,以及與在 生物製藥行業運營的公司(例如Dianthus)相關的風險因素。如果其中一個或多個風險或不確定性成為現實,或者如果Magenta或Dianthus的任何假設被證明不正確,則實際結果可能在重大方面與這些 前瞻性陳述中預測的結果有所不同。本演示文稿中的任何內容均不應被視為任何人表示將實現此處提出的前瞻性陳述或此類前瞻性 陳述的任何預期結果將實現。您不應過分依賴本演示文稿中的前瞻性陳述,這些陳述僅代表其發表之日,並且參照此處的警示性陳述進行了全面限定。 Magenta 和 Dianthus 均不承擔或接受任何公開發布任何前瞻性陳述的任何更新或修訂的責任。本演示文稿無意總結 投資洋紅色或石竹的所有條件、風險和其他屬性。2

免責聲明(續)沒有要約或招攬本演示文稿和此處包含的 信息無意也不得構成 (i) 就任何證券或擬議交易徵求代理人、同意或批准,或 (ii) 要約買入或賣出任何證券,或招標 任何證券的要約,也不得在任何司法管轄區出售任何證券在根據任何證券法進行註冊或獲得資格之前,此類要約、招攬或出售都是非法的這種 管轄權。除非通過符合經修訂的1933年《證券法》第10條要求的招股説明書或該法的豁免,否則不得發行證券。美國證券交易委員會和任何州證券委員會 均未批准或不批准這些證券,也未確定本陳述是真實還是完整。有關擬議交易的重要其他信息及其在哪裏可以找到本演示文稿不能取代經修訂的S-4表格上的註冊 聲明,也不能取代Magenta就擬議交易向美國證券交易委員會提交或可能提交的任何其他文件。關於擬議交易,Magenta向美國證券交易委員會提交了經修訂的 S-4表格的註冊聲明,其中包含Magenta的最終委託書/招股説明書。美國證券交易委員會於2023年8月1日宣佈S-4表格上的註冊生效,洋紅色股東特別會議定於2023年9月8日舉行 。Magenta還可能向美國證券交易委員會提交有關擬議交易的其他相關文件。MAGENTA敦促投資者和股東仔細閲讀S-4表格上的註冊聲明、最終委託書/招股説明書和 已經或可能向美國證券交易委員會提交的任何其他相關文件,以及對這些文件的任何修正或補充,因為它們包含或將包含有關洋紅色、DIANTHUS、 擬議交易和相關事項的重要信息。投資者和股東可以通過美國證券交易委員會維護的網站 www.sec.gov 免費獲得Magenta向美國證券交易委員會提交的最終委託書/招股説明書和其他文件的副本。此外,投資者和股東應注意,Magenta使用其網站(www.magentatx.com)與投資者和公眾溝通,任何人都可以免費獲得Magenta向美國證券交易委員會提交的最終委託書/招股説明書 和其他文件的副本,並敦促股東在就以下內容做出任何投票或投資決定之前閲讀向美國證券交易委員會提交的最終委託書/招股説明書和其他相關材料 提議的交易。招標的參與者Magenta、Dianthus及其各自的董事和執行官可能被視為與擬議的 交易相關的股東招標代理人的參與者。有關Magenta董事和執行官的信息包含在Magenta向美國證券交易委員會提交的關於-F Korm, inc. lud 10的年度報告中,以及其中以引用方式納入的任何信息。向美國證券交易委員會提交的與擬議交易有關的最終委託書/招股説明書中有關Magenta和Dianthus各自的董事和執行官以及他們在擬議的Transiac ncti lud oned中的權益的信息 載於此 SEC。這些文件可以從上述來源免費獲得。行業和市場數據本演示文稿中包含的某些信息與研究、出版物、調查和 Dian thu internal 的 ow es n 估算和研究有關或基於這些信息。在本演示文稿中,Magenta和Dianthus依賴並參考了有關石竹競爭行業市場參與者的公開信息和統計數據以及其他行業數據。將 Dianthus 與任何其他實體進行任何 比較都假設 Dianthus 可用信息的可靠性。Dianthus從第三方來源獲得了這些信息和統計數據,包括市場研究公司的報告和公司文件。 此外,本演示文稿中包含的所有市場數據都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。最後,儘管Dianthus認為其內部 研究是可靠的,但此類研究尚未得到任何獨立來源的證實,Magenta和Dianthus都沒有獨立驗證這些信息。商標 Magenta 和 Dianthus 擁有或擁有其在各自業務運營中使用的各種商標、服務標誌 和商品名稱的權利。本演示文稿還可能包含其他公司的商標、服務標記、商品名稱和版權,這些都是其各自所有者的財產。在本演示文稿中使用或展示第三方的商標、服務標誌、商品名稱或產品,並不意圖也不暗示與洋紅色或石竹有關係,也不暗示由 Magenta 或 Dianthus 認可或贊助。僅為方便起見,本演示文稿中提及的 3 個商標、服務商標、商品名稱和版權中的一些可能不帶 TM、SM、© 或® 符號,但此類提法無意 以任何方式表明 Magenta 和 Dianthus 不會在適用法律的最大範圍內主張適用所有者對這些商標、服務商標、商品名稱和版權的權利(如果有)。

推進下一代補體療法以改善 自身免疫性疾病患者的生活成立於 2019 年,旨在開發治療嚴重自身免疫性疾病的下一代補體療法 Lead 項目 DNTH103 是一種有效的研究性單克隆抗體,其靶向經典補體途徑, 選擇性抑制活性 C1s 蛋白 DNTH103 旨在成為第一種皮下自我給藥注射劑,治療全身肌肉瘤的頻率不高,每兩週一次 Asthenia Gravis Top-Line Ph.1 數據證實了大約 60 天 半衰期、有效的經典途徑抑制以及可能存在差異化的安全性特徵 Ph.2 試驗,從24年第一季度全身重症肌無力開始,目標是25年下半年的頂線結果 Cash Runway 預計將為2026年第二季度的運營提供資金 4

由生物技術行業資深人士和科學家組成的出色團隊致力於為市場帶來創新高級管理董事會董事會主席朗尼·莫爾德董事會主席 Dianthus Tomas Kiselak Marino Garcia Ryan Savitz Adam Veness,EsqSimrat Randhawa,醫學博士、Fairmount 總裁兼首席執行官 法律顧問首席財務官艾莉森·勞頓首席醫學官 ProQR 和 X4 董事會成員、前董事會主席、Magenta Anne McGeorge 董事會成員、Be the Match Jude Jud Taylor Kristina Maximenko Debra Segal Rivka Gluck,R.N. 監管技術主管臨牀主管 Lei Meng 首席人事官運營事務開發運營高級治療分析師 Avidity Partners Paula Soteropoulos 風險投資合夥人 5AM VenturesJonathan Violin,博士 Robert McGarr,博士 Angela Norton,博士 Douangsone Sankalp “Sam” 項目負責人兼聯盟副總裁、Discovery Vadysirisack 博士風險投資合夥人、Dianthus 聯合創始人、Gokhale 董事會成員、醫學博士副總裁、 轉化生物學管理研究副總裁、Astria Therapeutics 臨牀開發副總裁、前總裁 Viridian Therapeutics 首席執行官精選體驗包括:Marino Garcia 總裁兼首席執行官 Dianthus Select 自身免疫藥物 Zilucoplan 5 由 Dianthus 團隊開發

DNTH103 提供產品管線,在多個 神經肌肉適應症計劃中具有同類最佳潛力(目標)2024 年目標人羣 2025 年全身肌無力啟動 Ph.2 試驗 Q1'24 Top-Line Ph.2 數據 2H'25 Gravis (gmG) 約 60,000 名美國患者 DNTH103 多焦點運動 (S.C. Active c1s Neuropathy (MMN) 啟動 Ph.2 試驗 1H'24 抗體) 約 5,000-10,000 名美國患者慢性炎症性脱髓鞘啟動第 2 期臨牀試驗 2H'24 Polyneuropathy (CIDP) 約 15,000 名美國患者 DNTH103 有可能擴展到多種經典的 路徑驅動型具有同類最佳特徵的疾病 6 https://www.mgregistry.org/,https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7033452/ #,https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3983019/, https://jnnp.bmj.com/content/90/9/981.long

DNTH103 重症肌無力的機會

GmG 代表着數十億美元的機會,只有兩個獲得批准的 類別,每個類別都有改進補體類 fcRn Class Soliris 和 Ultomiris U.S. GmG 估計 Vyvgart 的銷售額超過 50 億美元,GmG 的患者羣體增長約 60,000 人,GmG 的銷售額估計超過 30 億美元 NMOSD,PNH 269.3 Ultomiris 的銷售額:增長約 60,000 名 gmG、aHU、gmG 峯值 銷售額大於 30 億美元 NMOSD,PNH 269.3 Ultomiris Soliris 5,727 美元 5,362 美元 5,141 美元 218.0 1,965 1,389 美元 1,077 美元 173.4 美元 133.4 美元 4,064 美元 3,973 美元 74.8 美元 3,762 美元 21.2 22年第二季度2022年第四季度2022年第二季度2022年第二季度2021年第二季度2022年第二季度百萬美元。Soliris & Ultomiris 2021 年的銷售額 分別為 1/1 — 6/30 和 7/21 — 12/31。評估 Pharma 8 https://www.mgregistry.org/,https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7033452/ #

DNTH103 靶向產品概況與當前 批准的 gmG 生物製劑差異很大。需要增加便利性和減少體積、減少頻率、自行給藥 S.C. 減輕患者負擔 DNTH103 更頻繁和/或更高容量 S.C.;必須由醫療保健專業人員給藥頻率更高, 體積更大,臨牀內靜脈注射 9
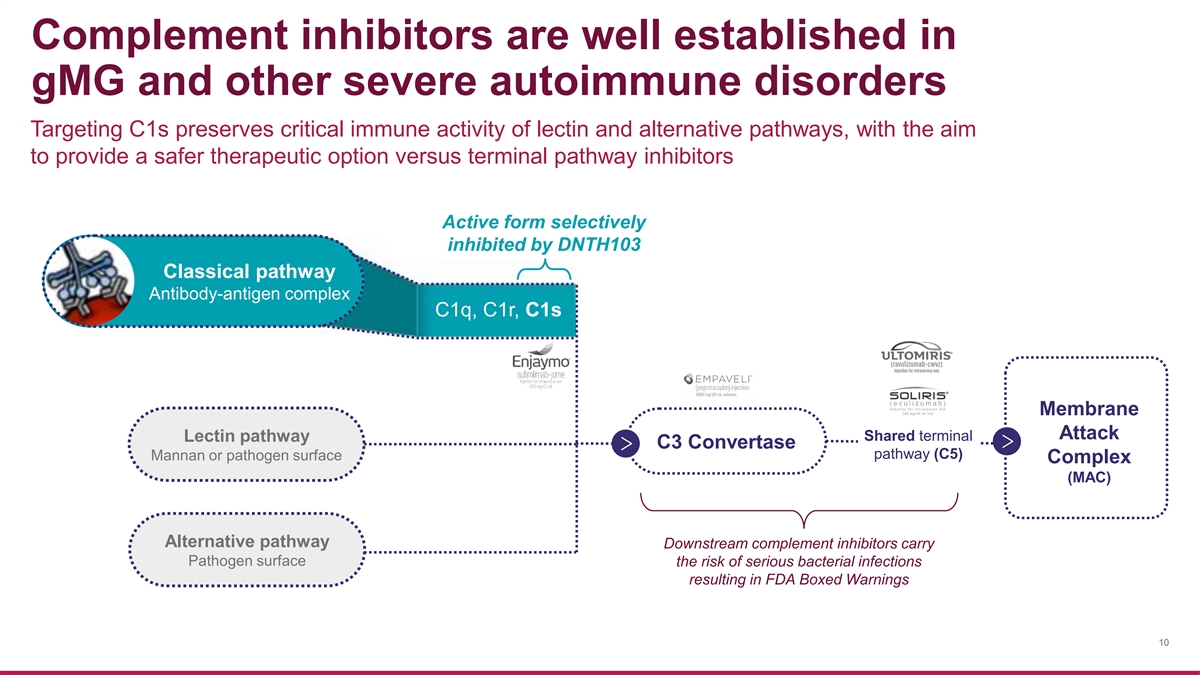
補體抑制劑在 gmG 和其他嚴重 自身免疫性疾病中已得到充分證實,靶向 C1 可以保留凝集素和替代途徑的關鍵免疫活性,目的是提供比終末途徑抑制劑更安全的治療選擇活性形式被 DNTH103 Classical 途徑選擇性抑制抗體-抗原複合物 c1q、c1r、c1s 膜攻擊共享末端凝集素途徑 C3 轉化酶途徑 (C5)) 甘露聚糖或病原體表面複合物 (MAC) 替代途徑下游補體抑制劑攜帶病原體表面 {的風險br} 嚴重細菌感染導致美國食品藥品管理局盒裝警告 10
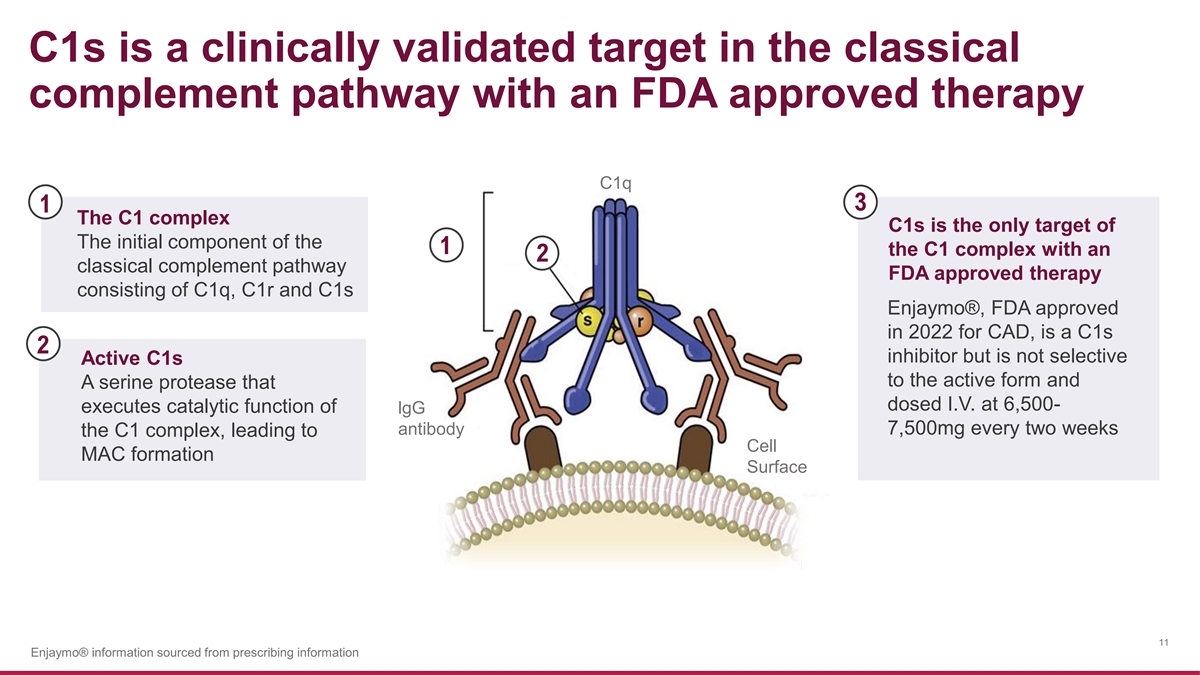
C1s 是經典補體途徑 中經過臨牀驗證的靶點,採用美國食品藥品管理局批准的療法 c1q 3 1 C1 複合物 c1s 是唯一的靶標 1 的初始成分 C1 複合物,具有 2 種經典補體途徑 FDA 批准的由 c1q、c1r 和 c1s 組成的療法 Enjaymo®,美國食品藥品管理局於 2022 批准用於冠心病,是 C1s 2 抑制劑,但是活性C1對活性形式沒有選擇性,在6,500時給靜脈注射的絲氨酸蛋白酶每兩週執行一次7,500mg LgG抗體的催化功能,C1複合物會導致細胞 MAC 的形成 Surface 11 Enjaymo® 信息來自處方信息
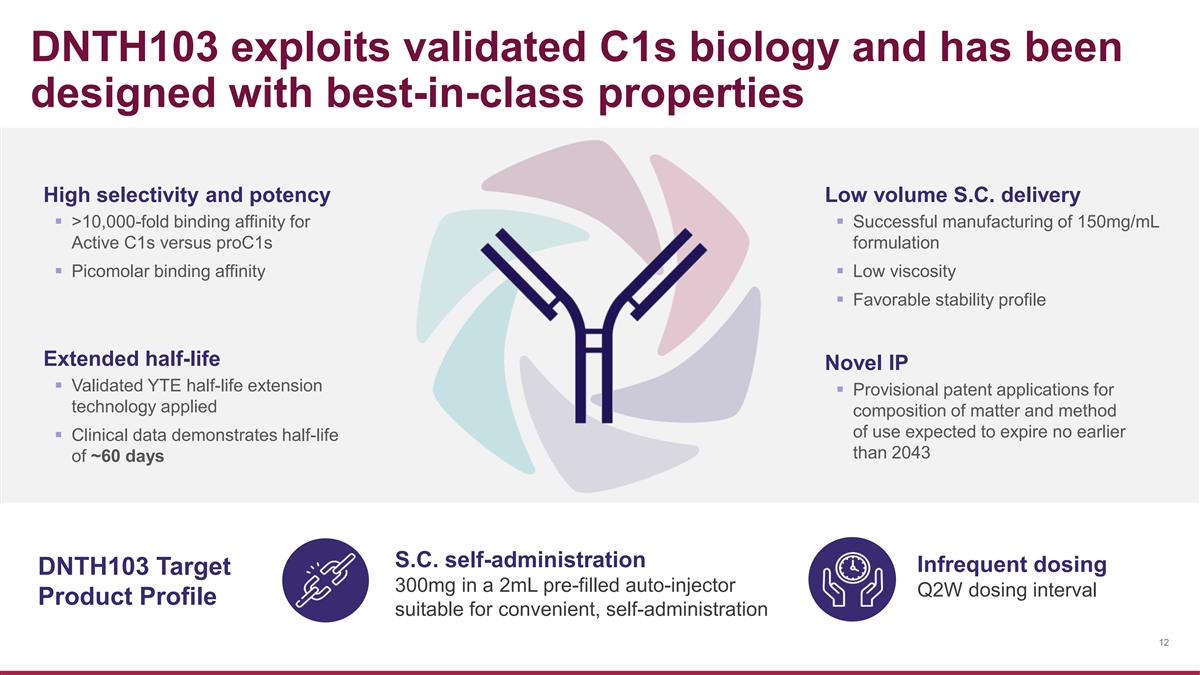
DNTH103 利用了經過驗證的 C1s 生物學特性,其設計具有 一流的特性高選擇性和效力低容量 S.C. 交付 ▪ >10,000 倍的結合親和力 ▪ 成功製造 150mg/mL 活性 C1 與 proc1 配方 ▪ 皮摩爾結合親和力 ▪ 低粘度 ▪ 良好的穩定性延長半衰期新型 IP ▪ 經驗證的 YTE 半衰期延長 ▪ 物質應用成分的臨時專利申請和使用方法預計不早於 過期 ▪ 臨牀數據顯示半衰期大於 2043 天左右 60 天 S.C. 自我給藥不頻繁給藥 DNTH103 Target 300mg 在 2mL 預先填充的自動注射器 Q2W 給藥間隔 Q2W 給藥間隔產品簡介適合方便、 自我給藥 12

DNTH103 臨牀開發
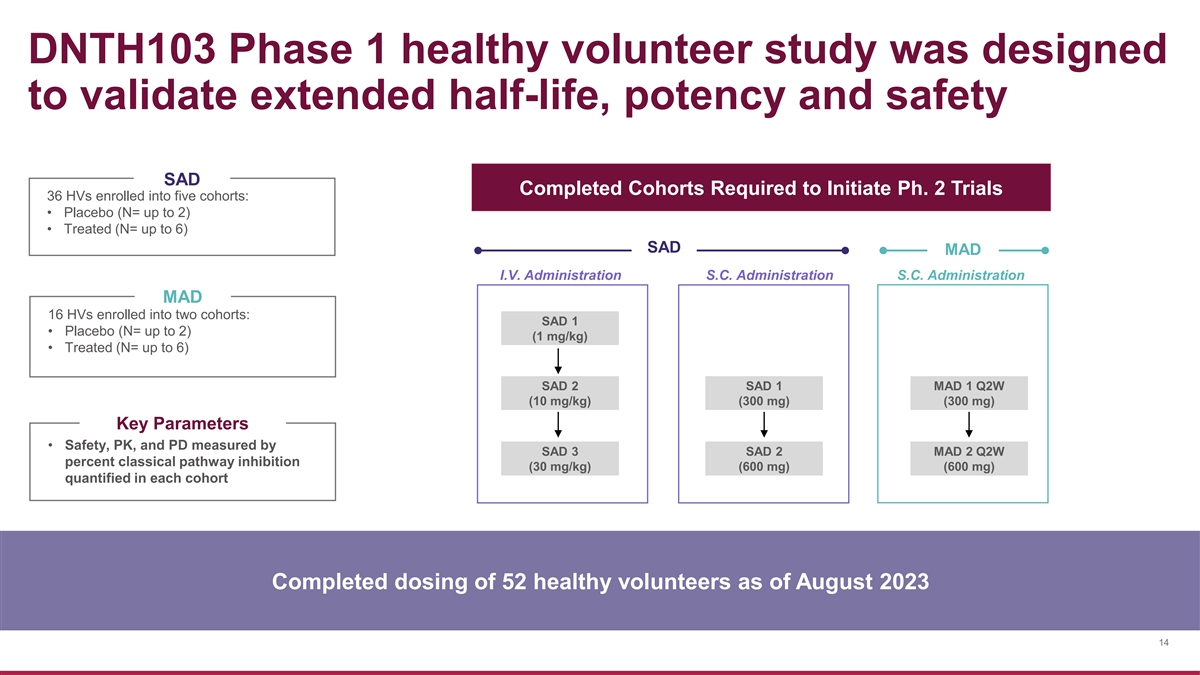
DNTH103 第 1 期健康志願者研究旨在驗證延長 的半衰期、效力和安全性 SAD 已完成的隊列啟動 Ph. 2 試驗所需的羣組 36 名 HV 加入了五個隊列:• 安慰劑(N = 最多 2)• 已治療(N = 最多 6)SAD MAD IV。SAD MAD 16 HV 加入兩個隊列:SAD 1 • 安慰劑(N = 最多 2)(1 mg/kg)• 已治療(N= 最多 6)SAD 2 SAD 1 MAD 1 Q2W(10 mg/kg)(300 mg)(300 mg)(300 mg)關鍵參數 • 安全性、PK 和 PD 由 SAD 3 SAD 2 MAD 2 Q2W 百分比測量 經典途徑抑制作用(30 mg/kg)(600 mg)(600 mg)(600 mg)在每個隊列中進行了量化,截至 2023 年 8 月,已完成 52 名健康志願者的給藥 14

DNTH103 已在 健康志願者中表現出深層持續的補體抑制作用 I.V. SAD:S.C. MAD:PK/PD:半衰期延長 PK(大約 60 天)第二季度給藥分析顯示了 IC90 為 83 µg/mL 150 600 100 500 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 0 0 0 0(天)時間(天)DNTH103 濃度(µg/mL)1 mg/kg IV SAD 10 mg/kg IV SAD 30 mg/kg IV SAD 300 mg SAD 1 mg/kg IV SAD 10 mg/kg IV SAD 30 mg/kg IV SAD 300 mg SC MAD 數據由來自 7 的 52 個 HV 組成羣組 600 mg SC SAD 300 mg SC MAD 600 mg SC MAD DNTH103 總體耐受性良好 SAE,健康志願者中未見到與補體相關的感染 15 DNTH103 濃度 (µg/mL) (平均值 SE) DNTH103 濃度 (µg/mL) (mean SE) CH50 抑制 (%)
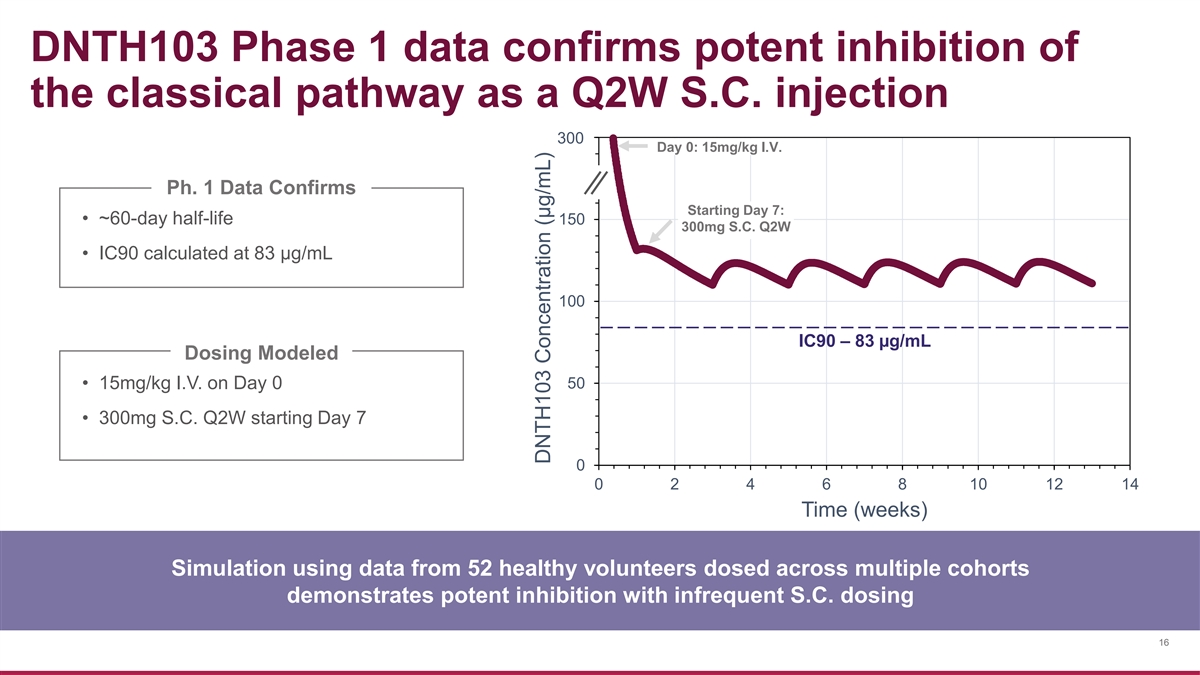
DNTH103 第 1 階段數據證實了經典途徑 作為 Q2W S.C. 注射 200 300 第 0 天:15mg/kg 靜脈注射。Ph.1 數據確認了第 7 天開始的半衰期:• 大約 60 天半衰期 150 300mg S.C. Q2W • IC90 計算為 83 µg/mL 100 IC90 — 83 µg/mL 劑量建模 • 第 0 天 15mg/kg 靜脈注射 50 • 300mg S.C. Q2W 從第 7 天開始 0 0 2 4 6 8 10 12 14 時間(周)使用來自多個隊列的 52 名健康志願者的數據進行的模擬表明,很少給藥 S.C. 具有強大的抑制作用 16 DNTH103 濃度 (µg/mL)

DNTH103 改善 achr+ MG 模型中的神經傳遞和肌肉收縮 Ravulizumab* (1 μM) DNTH103 (0.1 μM) DNTH103 (1 μM) n=3 n=3 n=3 0 • 經驗證的體外 1,2,3 MG 模型中使用的 MG 患者的血清 -10 -14.8% • 評估了 ravulizumab* 和 DNTH103 在神經傳遞和肌肉收縮方面的改善,-20 以肌肉收縮疲勞的減少來衡量 -24.8% -27.8% • 結果證實 DNTH03 改善了 -30 神經傳遞和肌肉收縮 achr+ MG 患者血清-40 結果為 GmG 中的 DNTH103 提供了進一步的科學依據 17 1 https://pubmed.ncbi.nlm.nih.gov/34881241/,2-https://pubmed.ncbi.nlm.nih.gov/31846349/,3-https://pubmed.ncbi.nlm.nih.gov/30867827/ * 使用專利序列肌肉收縮疲勞指數進行設計( 到基線的變化百分比,平均值 ± SEM)
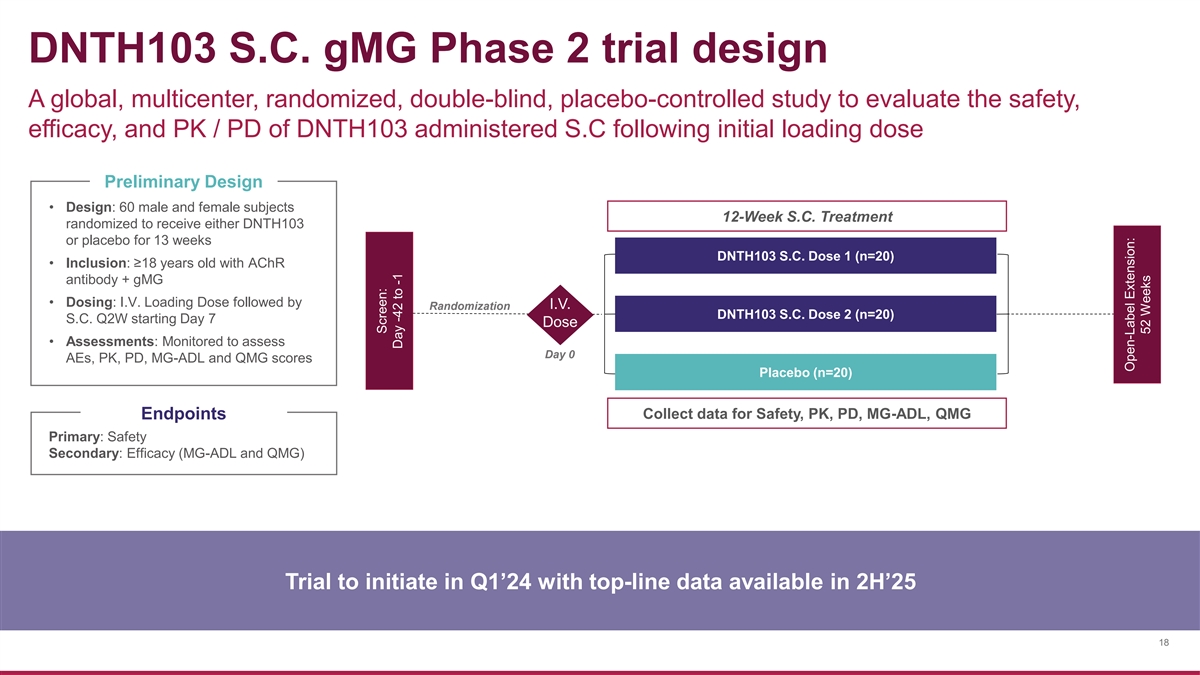
DNTH103 S.C. gmG 2 期試驗設計一項全球、多中心、隨機、 雙盲、安慰劑對照研究,旨在評估初始負荷劑量後服用 S.C. S.C. S.C. S.C. 隨機分配給 的 60 名男性和女性受試者接受 DNTH103 或安慰劑,持續 13 周 DNTH103。劑量 1(n=20)• 包含:≥ 18 歲 witah chR 抗體 + gmG • 劑量:靜脈注射。加載劑量然後靜脈注射。隨機化 DNTH103 S.C. 劑量 2 (n=20) S.C. Q2W 開始服用 第 7 天劑量 • DNTH103評估:監測以評估第 0 天 AE、PK、PD、MG-ADL 和 QMG 分數安慰劑(n=20)收集安全、PK、PD、MG-ADL、QMG 終點的數據主要:安全次要:療效(MG-ADL 和 QMG)試驗將於 24 年第 1 季度啟動,頂線數據可在 25 年 2 小時內獲得 18 屏幕:第 -42 天至 -1 天開放標籤延期:52 周

MMN 和 CIDP 為下一個 DNTH103 適應症提供了明確的生物學和商業依據慢性炎症性多灶性運動神經病 (MMN) 脱髓鞘性多發性神經病 (CIDP) 神經肌肉適應症未獲批准的靶向約5,000-10,000 ~15,000 未獲批准的針對性高未得到滿足的生物療法美國患者有醫療需求證據約50%的患者有補體沉積 CIDP 患者血清支持經典 MMN 已觀察到患者血清有抗 GM1 IgM 活化會激活補體 在計劃分別於24年1H'24和 2H'24啟動的MMN和CIDP的疾病2期試驗中,補體在臨牀前模型中相關激活補體通路神經上的CIDP特徵已得到證實,並模仿了CIDP在相關激活補體通路神經上的CIDP特徵 19

企業
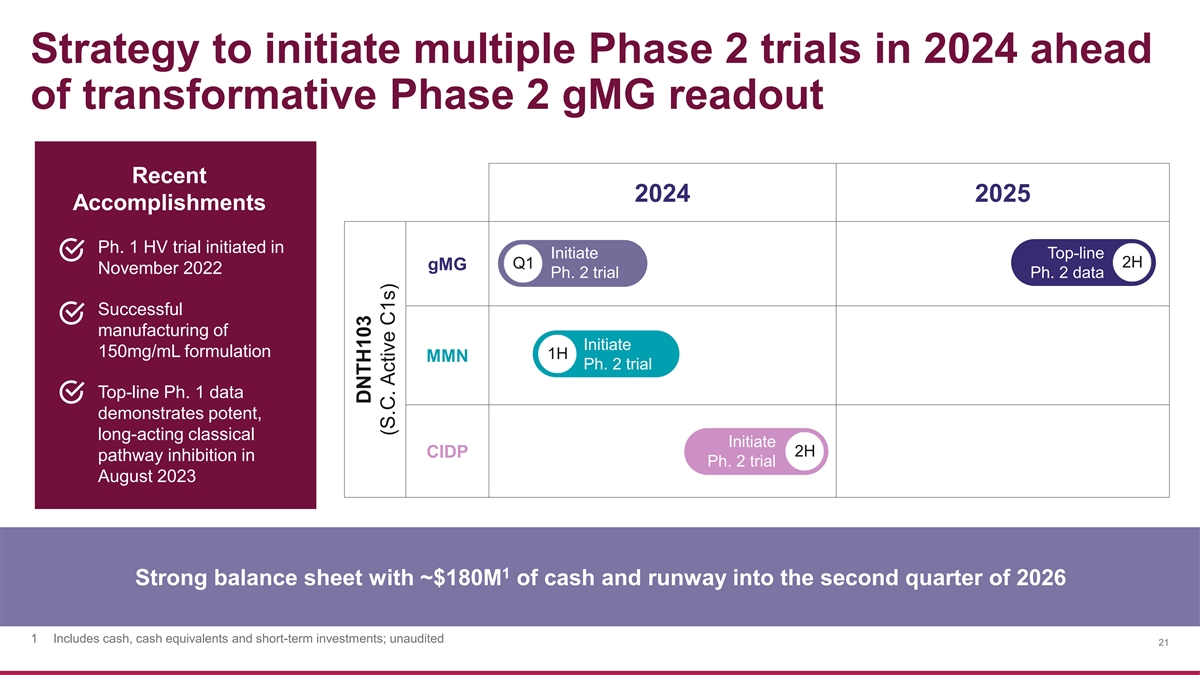
策略在 變革性的 2 期 gmG 讀數之前,在 2024 年啟動多項 2 期試驗 2024 年最新成就 2025 年成就 Ph. 1 HV 試驗於 2022 年 11 月啟動 Top-Line 2H 第 2 季度試驗 Ph.2 數據成功製造 Initiate 150mg/mL 配方 1H MMN Ph.2 試驗 top-line Ph.1 數據顯示出強大、長效的經典 Initiate 2H CIDP 抑制途徑在 2023 年 8 月的 Ph.2 試驗中 1 強勁的資產負債表,現金約為 1.8 億美元,將持續到 2026 年第二季度 1 包括現金、現金等價物和 短期投資;未經審計 21 DNTH103(S.C. Active C1s)

26年第二季度資本充足,並得到領先的生命科學 投資者的支持 1 ▪ 收盤後現金餘額約為1.8億美元;沒有債務 ▪ 預計到26年第二季度現金流 ▪ 股票構成 — 單股類別:2 ▪ 收盤後約2.43億股已發行基本股(反向股票拆分前) ▪ 收盤後約2.72億股已發行股票(反向股票拆分前)Premier ▪ 投資者集團 1 包括現金、現金等價物和短期投資;未經審計 22 2 視收盤時調整情況而定 3 不包括國庫股票法