

2023 年 9 月公司簡報附錄 99.1

免責聲明以下演示文稿, ,包括這些幻燈片的任何印刷版或電子版、演講者的演講、在任何演示和問答環節中傳達的信息以及在 上分發的與演示文稿相關的任何文件或材料(統稱為 “演示文稿”)均由 Cabaletta Bio, Inc.(“我們”、“我們”、“我們的”、“Cabaletta” 或 “公司”),僅供參考 。本演示文稿並不聲稱是招股説明書、完整性或包含您可能想要的所有信息。除非另有説明,否則此處包含的聲明均自本演示文稿發佈之日起作出, 和本演示文稿在任何情況下均不得暗示此處包含的信息在該日期之後的任何時候都是正確的,也不得暗示將更新或修訂信息以反映隨後 可用的信息或在本演示日期之後發生的變化。本演示文稿可能包含1995年《私人證券訴訟改革法》所指的與我們的業務、運營和 財務狀況有關的 “前瞻性陳述”,包括但不限於關於我們當前的信念、期望和假設的明示或暗示陳述:我們的業務、CAAR T 和 CARTA 技術以及 CABA™ 平臺的未來計劃和戰略;我們發展以自身免疫為重點的產品線的能力;能力利用由此產生的潛在好處與 Georg Schett 教授的轉化研究合作以及與 IASO Bio 的獨家許可協議;我們對 CABA-201 的潛在成功和治療益處的期望,包括我們相信 CABA-201 可以實現 “免疫系統重置” 併為自身免疫 疾病患者提供深刻而持久的反應;我們 (i) 在系統性紅斑狼瘡患者中進行 CABA-201 的 1/2 期臨牀試驗,包括我們的預期進展、臨牀試驗設計、利用能力我們在自身免疫細胞療法和狼瘡產品方面的經驗開發和 (ii) 在肌炎患者中進行 CABA-201 的 1/2 期臨牀試驗,包括我們的預期進展、臨牀試驗設計以及利用我們在自身免疫細胞治療方面的經驗的能力;我們計劃在 2024 年上半年讀出接受 CABA-201 治療的患者的初步臨牀數據;我們有能力招募必要數量的患者,按預期方式給每個給藥隊列服藥,並按計劃推進本階段的試驗 CABA-201 的 1/2 臨牀試驗; 保留和識別預期激勵措施的能力由 CABA-201 的任何 Fast Track 指定授予;我們為開發計劃提交任何計劃監管文件的時機;我們的 Descaartes™ 1 期試驗的進展和結果,包括 圍繞我們的 Descaartes™ 試驗中報告的隊列的安全性、臨牀和轉化數據的重要性和影響,以及我們推進劑量遞增和啟動聯合隊列以及優化靶向細胞 療法的能力;我們實施預治療方案、這種預處理方案的結果以及潛在的能力增強 DSG3-CAART 在體內的暴露;我們的候選產品的治療潛力和臨牀益處; 期望 Cabaletta 可以改善患有系統性紅斑狼瘡、肌炎、尋常型粘膜天皰瘡、重症肌無力或其他自身免疫性疾病的患者的預後;我們有能力在隊列 a6m 中將劑量提升至 150 億 個細胞,開始給藥在組合隊列或其他隊列中;我們評估 DSG3-CAART 持久性與潛力之間關係的能力及其潛在意義mPV 患者的臨牀反應;我們 安全撤退更多患者的能力,以及我們在對患者進行再治療和重複給藥後是否會繼續觀察到免疫介導的 DSG3-CAART 細胞清除率不足;我們成功完成候選產品的臨牀前和臨牀 研究的能力,包括我們招收必要數量的患者、按預期方式給每個給藥隊列劑量以及推進試驗的能力;能力 musk-caart 靶向分化成 抗體的 B 細胞分泌細胞,產生針對肌肉特異性激酶的自身抗體;我們獲得和維持候選產品的監管部門批准的能力,包括我們對候選產品提供的預期激勵措施的期望以及 保留候選產品孤兒藥稱號和快速通道稱號的能力(如適用);進一步擴展和發展我們的模塊化CABA™ 平臺涵蓋一系列自身免疫性疾病;我們與第三方供應商和製造商簽訂合同的能力 ,實施增強型製造處理並進一步發展我們的內部製造戰略、能力和設施;我們潛在的商業機會,包括候選產品的價值和可開發的 市場;我們對資本使用和其他財務業績的預期;以及我們為2025年第四季度的運營提供資金的能力。諸如但不限於 “期待”、 、“相信”、“期望”、“預期”、“估計”、“打算”、“計劃”、“將”、“應該” 和 “可以” 之類的詞語以及類似的表達方式或詞語可以識別 前瞻性陳述。各種風險、不確定性和假設可能導致實際結果與我們前瞻性陳述中的預期或暗示存在重大差異。此類風險和不確定性包括但不限於 與我們的候選產品開發活動以及臨牀前研究和臨牀試驗的成功、成本和時機相關的風險,以及與我們能夠在 的 CABA-201、DSG3-CAART 和 musk-caart 的臨牀前研究和臨牀試驗中證明足夠的安全性、有效性和耐受性證據相關的風險,以及使用類似設計的結構觀察到的結果的風險,包括但不限於由於給藥方案,這並不能代表我們 尋求的結果為了實現 CABA-201 的目標,我們計劃在 Descaartes™ 試驗中評估其他隊列,包括實施預治療方案的隊列、生物活性或持續性跡象可能無法為長期 結果提供依據的風險、通過有效的 CART-19 腫瘤學研究觀察到的持續性與淋巴枯竭相結合的風險並不能表明或不適用於 mPV 患者的臨牀反應,與臨牀試驗站點激活相關的風險 {} 或者入學率低於預期,我們的保護能力和維護我們的知識產權地位、與第三方關係相關的風險、與監管機構評估 監管文件相關的不確定性以及與我們的候選產品相關的其他信息、我們保留和認可任何孤兒藥指定和快速通道指定所賦予的預期激勵措施的能力、與監管申報和 潛在許可相關的風險、我們的任何一個或多個候選產品無法成功開發和商業化的風險,結果的風險的臨牀前研究或臨牀研究無法預測 與未來研究相關的未來結果,以及與動盪的市場和經濟狀況以及公共衞生危機相關的風險。新的風險和不確定性可能會不時出現,因此不可能預測所有的風險和不確定性。除非適用法律要求 ,否則我們不打算公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化還是其他原因。儘管我們認為此類前瞻性陳述中反映的 預期是合理的,但我們無法保證這種預期會被證明是正確的。因此,提醒您不要過分依賴這些前瞻性陳述。對於任何此類前瞻性陳述的準確性,不作出 陳述或擔保(明示或暗示)。有關這些風險和不確定性以及其他重要因素的討論,其中任何一個因素都可能導致我們的實際 業績與前瞻性陳述中包含的業績存在重大差異,請參閲我們最新的10-K表年度報告中標題為 “風險因素” 的部分,以及我們隨後向美國證券交易委員會提交的其他文件中關於潛在風險、不確定性和其他重要 因素的討論。本演示文稿中包含的某些信息涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及 公司自己的內部估算和研究。儘管公司認為截至本演示文稿發佈之日,這些第三方來源是可靠的,但它沒有獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性作出任何陳述。該公司是各種商標、商品名稱和服務標誌的所有者。本 演示文稿中出現的某些其他商標、商品名稱和服務標誌是第三方的財產。僅為方便起見,本演示文稿中提及的商標和商品名稱不帶® 和 TM 符號,但此類提法不應被解釋為表示其 各自所有者不會在適用法律的最大範圍內主張其權利。
為自身免疫性疾病患者開發並推出首款治療性 靶向細胞療法

利用多年來在自身免疫領域的 細胞療法經驗,啟動 CABA-201 臨牀試驗 Cabaletta®:尋求各種自身免疫性疾病的治療方法 CARTA — 用於自身免疫的嵌合抗原受體 T 細胞;CAART — 嵌合自身抗體 受體 T 細胞;IND — 在研新藥;SLE — 系統性紅斑狼瘡;DM — 皮膚肌炎;ASYs — 抗體合成酶綜合徵;IMNM — 免疫介導的壞死性肌病;流感 — 氟達拉濱;Cy — 環磷酰胺 Mackensen、Andreas 等“抗CD19 CAR T細胞療法治療難治性系統性紅斑狼瘡。”《自然醫學》(2022):1-9。Müller、Fabian 等“難治性抗合成酶 綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。戴振宇等“用於T細胞治療的新型全人源抗CD19 CAR的開發和功能表徵。”《細胞生理學雜誌》236.8 (2021):5832-5847。假設隊列中未觀察到劑量限制 毒性,並且試驗中出現不間斷的入組。截至2023年第二季度10季度報告。通過有效的設計推進肌炎和系統性紅斑狼瘡試驗,包括起始劑量和平行隊列 1.0 x 106 個細胞/kg CABA-201 的初始劑量與學術性肌炎和系統性紅斑狼瘡研究中使用的劑量相同 1,2 各有 6 名患者的平行隊列 — 1) DM、2) ASYs 和 3) IMNM 的系統性紅斑狼瘡研究;1) LN 和 2) 非腎臟系統性紅斑狼瘡 CABA-201 的肌炎研究 專為自身免疫性疾病患者設計的全人類 CD19 粘合劑,包含大約 20 名腫瘤患者的數據 — 支持進一步評估自身免疫的臨牀安全性 Same 4-1BB共刺激域和類似的 CD19 粘合劑 affinity3 用於學術性肌炎和系統性紅斑狼瘡研究1,2 有可能治癒各種自身免疫性疾病,其中 B 細胞起着引發或維持疾病的作用。學術機構提供的其他臨牀數據強化了 CD19-CAR T 在自身免疫中的潛力,早期的行業研究正在進行中。有機會解決風濕病學以及其他治療領域(包括神經病學、腎病)未得到滿足的需求病學和皮膚病學 Descaartes™ 在尋常型粘膜天皰瘡中試驗 DSG3-CAART —iViG/Flu/Cy 隊列報名參加 MusCaartes™ 重症肌無力試驗 — 利用 DSG3-CAART CARTA 策略經驗的見解 | CABA-201(4-1BB CD19-CAR T)將在肌炎和系統性紅斑狼瘡 1/2 期研究中同時進行評估 CAART 策略 | DSG3-CAART 和 musk-Caart 臨牀研究評估聯合療法初始 CABA-201 3 個月臨牀療效和耐受性數據 1H244 | 1766美元 M cash5 將進入二零二五年第四季度
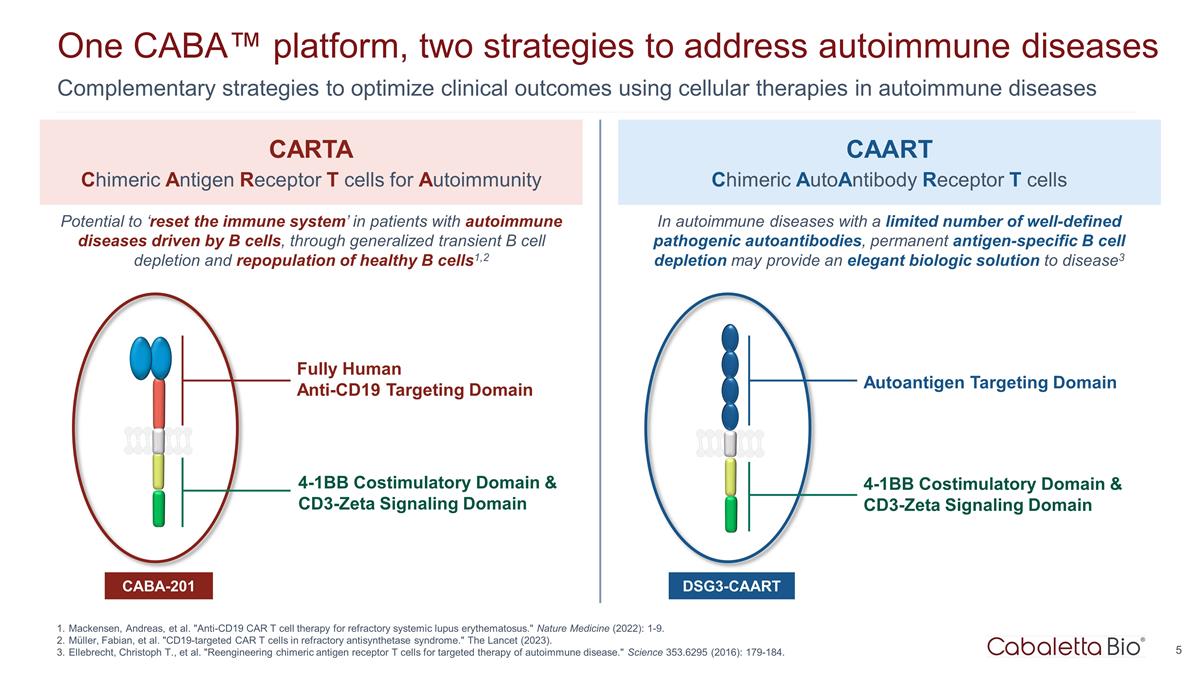
一個 CABA™ 平臺,兩個 應對自身免疫性疾病的策略使用細胞療法來優化自身免疫性疾病的臨牀結果的互補策略 Mackensen、Andreas 等“抗CD19 CAR T細胞療法治療難治性系統性紅斑狼瘡。” 自然醫學 (2022):1-9。穆勒、法比安等“難治性抗合成酶綜合徵中的CD19靶向CAR T細胞。”《柳葉刀》(2023)。Ellebrecht、Christoph T. 等。“重新設計嵌合抗原受體 T 細胞,用於 自身免疫性疾病的靶向治療。”Science 353.6295 (2016):179-184。用於自身免疫的全人抗 CD19 靶向域 CARTA 嵌合抗原受體 T 細胞 CAART 嵌合抗體受體 T 細胞 CABA-201 4-1BB 共刺激結構域和 cd3-zeta 信號域 DSG3-CAART 有可能 “重置免疫系統”,通過普遍短暫的 B 細胞消耗和健康 B 細胞的再種羣,1,2 在自身免疫性 疾病中明確的致病性自身抗體,永久性抗原特異性 B 細胞耗盡可能提供優雅的生物製劑disease3 自身抗原靶向域 4-1BB 共刺激域和 cd3-zeta 信號域
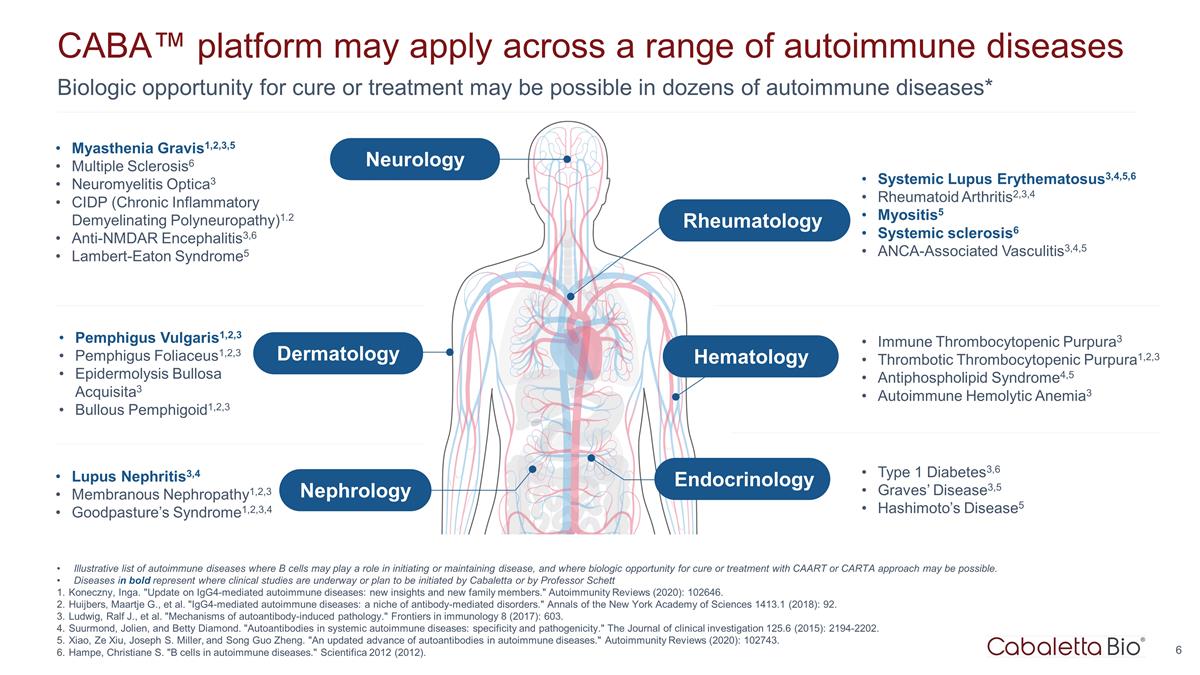
數十種自身免疫性疾病可能有機會治癒或 治療* CABA™ 平臺可能適用於一系列自身免疫性疾病 pemphigus vulgaris1,2,3 Pemphigus Foliaceus1,2,3 表皮鬆解大皰性天皰瘡1,2,3 狼瘡 腎炎3,4 膜性腎病 1,2,3 Goodpasture 綜合徵1,2,3,4 重症肌無力1,2,3,5 多發性硬化症6 神經脊髓炎 optica3 CIDP(慢性炎症性脱髓鞘性多發性神經病)1.2 抗 nmdar 腦炎3,6 Lambert-Eaton Syndrome5 系統性紅斑狼瘡3,4,5,6類風濕性關節炎2,3,4 肌炎5 系統性硬化症6 ANCA 相關性血管炎3,4,5 免疫性血小板減少性紫癜3 血栓性血小板減少性紫斑1,2,3 抗磷脂綜合徵4,5 自身免疫 溶血性貧血3 1 型糖尿病3,6 Graves病3,5 橋本氏病5 説明性清單自身免疫性疾病,其中 B 細胞可能在引發或維持疾病方面發揮作用,並且可能有機會使用 CAART 或 CARTA 方法進行治癒或 治療。粗體顯示的疾病表示正在進行或計劃由卡巴萊塔或英加的謝特·科內奇尼教授發起的臨牀研究。“IgG4介導的自身免疫性疾病的最新情況:新的 見解和新的家庭成員。”自身免疫評論 (2020):102646。Huijbers、Maartje G. 等“IgG4介導的自身免疫性疾病:抗體介導的疾病的利基市場。”《紐約科學院年鑑》1413.1 (2018):92。Ludwig, Ralf J.,等“自身抗體誘發的病理機制。”《免疫學前沿》8 (2017):603。Suurmond、Jolien 和 Betty Diamond。“系統性自身免疫性疾病中的自身抗體:特異性和致病性。”《臨牀 調查雜誌》125.6 (2015):2194-2202。Xiao、Ze Xiu、Joseph S. Miller 和宋國正。“自身免疫性疾病中自身抗體的最新進展。”自身免疫評論 (2020):102743。Hampe,Christiane S. “自身免疫性疾病中的 B 細胞。” Scientifica 2012 (2012)。皮膚科腎臟病學神經病學風濕病學血液學內分泌學
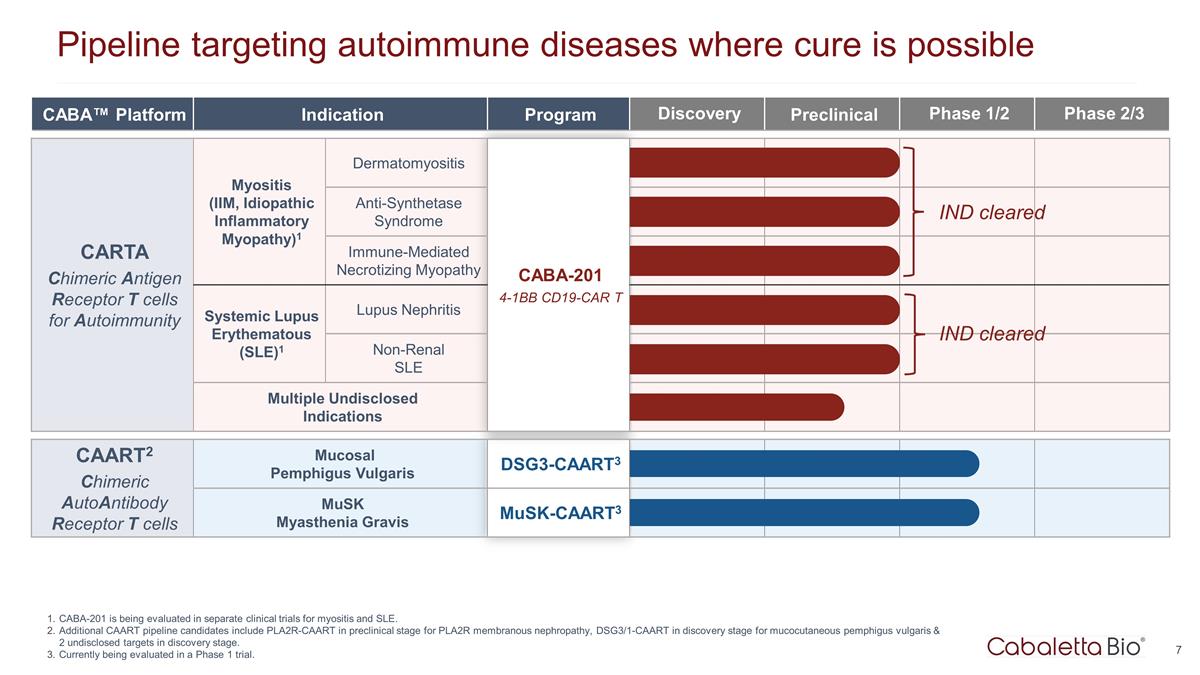
CABA™ 平臺適應症 項目發現臨牀前 1/2 期 2/3 期 CARTA 嵌合抗原受體 T 細胞用於自身免疫性肌炎(IIM,特發性炎性肌病)1 皮肌炎 CABA-201 4-1BB CD19-CAR T 抗合成酶綜合徵免疫介導 壞死性肌病 CARTA 嵌合抗原受體 T 細胞用於自身免疫系統性紅斑狼瘡 Matous (SLE) 1 狼瘡性腎炎 CABA-201 4-1BB CD19-CAR T 非腎臟系統性紅斑狼瘡多種未公開適應症 CAART2 嵌合自身抗體受體 T 細胞 尋常型粘膜天皰瘡 DSG3-CAART3 musk重症肌無力 Musk-caart3 Pipeline 靶向可能治癒的自身免疫性疾病 CABA-201 正在單獨的肌炎和系統性紅斑狼瘡臨牀試驗中進行評估。其他 CAART 管線 候選藥物包括 PLA2R 膜性腎病處於臨牀前階段的 PLA2R-CAART、尋常型皮膚粘膜天皰瘡處於發現階段的 DSG3/1-CAART 以及 2 個處於發現階段的未公開靶標。目前正在1期試驗中進行評估。 IND 已通過 IND 已獲批准

用於 自身免疫的嵌合抗原受體 T 細胞 CABA-201
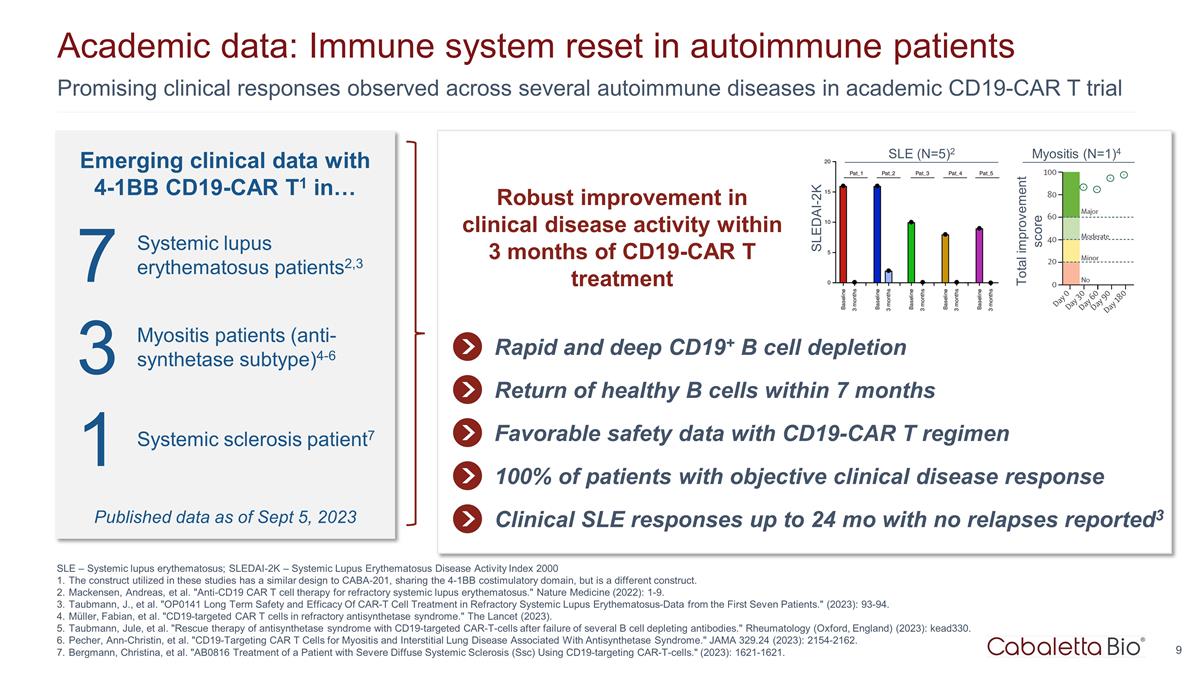
新出現的 4-1BB CD19-CAR T1 在... SLE — 系統性紅斑狼瘡;SLEDAI-2K — 系統性紅斑狼瘡疾病活動指數 2000 這些研究中使用的結構與 CABA-201 相似,共享 4-1BB 共刺激 結構域,但結構不同。麥肯森、安德烈亞斯等“抗CD19 CAR T細胞療法治療難治性系統性紅斑狼瘡。”《自然醫學》(2022):1-9。Taubmann,J. 等“OP0141 CAR-T 細胞 治療難治性系統性紅斑狼瘡的長期安全性和有效性——來自前七名患者的數據。”(2023):93-94。Müller、Fabian 等“難治性抗合成酶綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。Taubmann、Jule 等“在幾種B細胞消耗抗體失效後,使用CD19靶向的Car-T細胞拯救 抗合成酶綜合徵的治療。”風濕病學(英格蘭牛津)(2023):kead330。Pecher、Ann-Christin 等“靶向 CD19 的 CAR T 細胞治療與抗合成酶綜合徵相關的肌炎和 間質性肺病。”JAMA 329.24 (2023):2154-2162。伯格曼、克里斯蒂娜等“AB0816 使用靶向 CD19 的 car-T 細胞治療嚴重瀰漫性系統性硬化症 (Ssc) 患者。” (2023): 1621-1621。9 在學術性 CD19-CAR T 試驗中觀察到的幾種自身免疫性疾病的臨牀反應令人鼓舞學術數據:自身免疫性患者的免疫系統重置 CD19-CAR T 治療後 3 個月內臨牀疾病活動得到顯著改善 CD19+ B 細胞快速而深度消耗健康 B 細胞的恢復 7 個月內 CD19-CAR T 方案的良好安全性數據臨牀系統性紅斑狼瘡反應長達 24 個月,無復發已報告3 7 系統性紅斑狼瘡患者2,3 3 肌炎患者(抗合成酶亞型)4-6 1 系統性硬化症患者7 系統性紅斑狼瘡(N=5)2 SLEDAI-2K 截至2023年9月5日公佈的數據截至2023年9月5日 100% 有客觀臨牀疾病反應的患者總改善評分肌炎(N=1)4
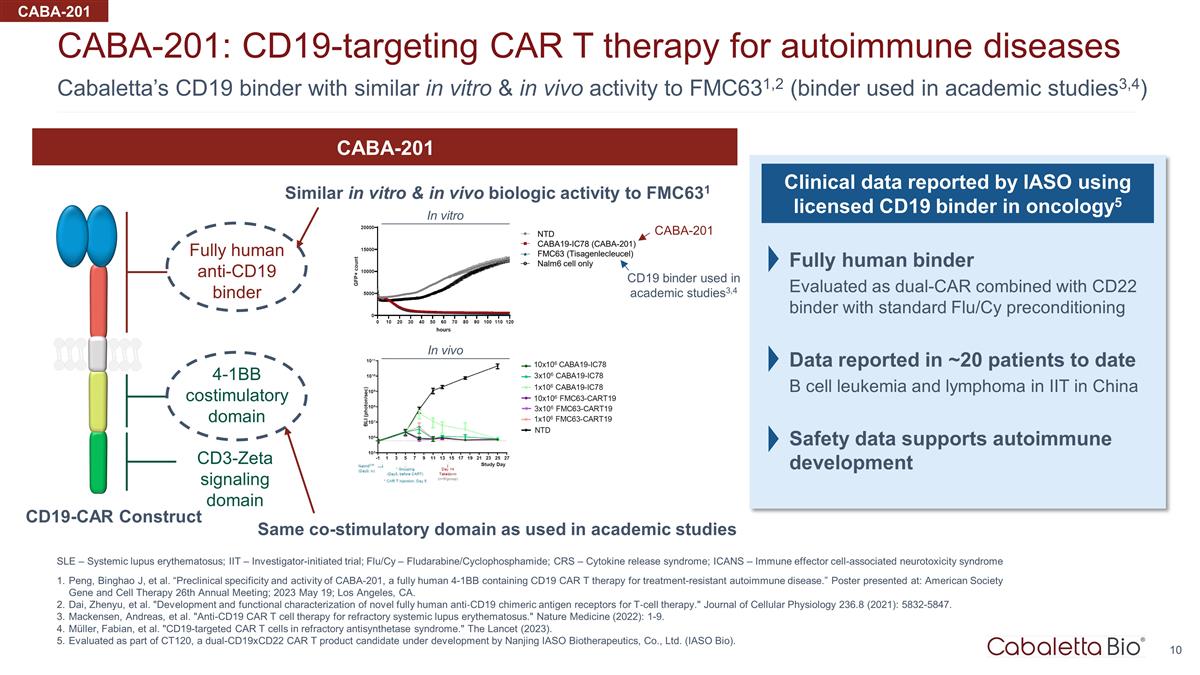
Cabaletta 的 CD19 粘合劑 在體外和體內活性與 FMC631,2 相似(學術研究中使用的粘合劑3,4)CABA-201:靶向 CD19 的 CAR T 療法治療自身免疫性疾病 SLE — 系統性紅斑狼瘡;IT — 研究者發起的試驗;Flu/Cy — 氟達拉賓/環磷酰胺;CRS — 細胞因子釋放綜合徵;ICS — 細胞因子釋放綜合徵;ICS ANS — 免疫效應細胞相關神經毒性綜合徵 Peng、Binghao J 等“CABA-201 的臨牀前特異性和活性,這是一種全人類 4-1BB ,含有 CD19 CAR T 療法,用於治療耐藥性自身免疫性疾病。”海報發表於:美國學會基因與細胞療法第26屆年會;2023年5月19日;加利福尼亞州洛杉磯。戴振宇等“用於T細胞療法的新型全人類抗CD19嵌合抗原受體的開發和功能表徵。”《細胞生理學雜誌》236.8 (2021):5832-5847。麥肯森、安德烈亞斯等“用於難治性系統性 紅斑狼瘡的抗 CD19 CAR T 細胞療法。”《自然醫學》(2022):1-9。Müller、Fabian 等“難治性抗合成酶綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。作為 CT120 的一部分,南京 IASO Biotherapeutics, Ltd. (IASO Bio) 正在開發 的雙 CD19xCD22 CAR T 候選產品。全人類抗 CD19 粘合劑 4-1BB 共刺激域 CD3-zeta 信號域 CABA-201 體外和體內生物活性與 FMC631 相似學術研究中使用的 相同的共刺激域 CD19-CAR 在腫瘤學中使用獲得許可的 CD19 粘合劑構建 IASO 報告的臨牀數據 5 全人類粘合劑評估為雙CAR 與 CD22 粘合劑結合使用標準 Flu/Cy 預處理數據 中國理工學院的日期 B 細胞白血病和淋巴瘤安全數據支持自身免疫發育 CABA-201 體外 CABA-201 CD19學術研究中使用的活頁夾3,4

大約 66K 美國患有 IIM 亞型並有 B 細胞受累的患者;通常很嚴重,治療選擇有限 Myositis:有充分的科學依據和沉重的疾病負擔 Lundberg、Ingrid E. 等“特發性炎症性肌病。”《自然評論》疾病 Primers 7.1 (2021):86。Kronzer、Vanessa L. 等“皮肌炎的發病率、患病率和死亡率:一項基於人羣的隊列研究。”關節炎護理與研究 75.2 (2023):348-355。Badshah、Aliena 等“表現為間質性肺病的抗合成酶 綜合徵:病例報告。”《醫學案例報告雜誌》13.1(2019):1-6。Coffey、Caitryn 等“以人羣為基礎的隊列中抗合成酶綜合徵的發病率和惡性腫瘤風險 (1998-2019)” [抽象]。風濕性關節炎。2021;73(補編 9)。Shelly、Shahar 等。“明尼蘇達州奧爾姆斯特德縣成人中免疫介導的壞死性肌病的發病率和患病率。”肌肉與神經 65.5 (2022):541-546。 ~6K 美國 pts5 免疫介導的壞死性肌病 (IMNM) ~17K 美國 pts3,4 抗合成酶綜合徵 (ASYs) ~43K 美國 pts2 皮膚肌炎 (DM) 基於潛在免疫機制和臨牀特徵的關鍵肌炎亞型1 潛在的 表現和亞型患病率 1 伴有 B 細胞的自身免疫性疾病參與 2 功能和生活質量負擔沉重1 特發性炎性肌病(IIM 或肌炎)是一組以 炎症和肌肉無力為特徵的自身免疫性疾病。通常,發病於中年,更常見於女性的症狀可能包括虛弱、疲勞、疼痛、呼吸急促和吞嚥困難治療的主要方法是使用不含類固醇的 藥物(即甲氨蝶呤、硫唑嘌呤、黴酚酸鹽、利妥昔單抗)的糖皮質激素只有經美國食品藥品管理局批准的治療是皮肌炎亞型的 iViG(靜脈注射免疫球蛋白)許多患者患有仍然難治的疾病療法具有潛在的長期副作用 間質性肺病 (ILD)、心血管疾病和/或惡性腫瘤導致的高死亡率 CABA-201

12 CABA-201 將在 活動性肌炎患者中進行評估,包括 DM、ASYS 和 IMNM 針對肌炎患者 CABA-201 的 1/2 期研究設計 DM — 皮肌炎;ASYS — 抗合成酶綜合徵;IMNM — 免疫介導的壞死性肌病受試者 將使用由氟達拉濱和環磷酰胺組成的標準預處理方案進行治療單劑量 CABA-201。麥肯森、安德烈亞斯等“抗CD19 CAR T細胞療法治療難治性系統性紅斑狼瘡。”Nature Medicine (2022):1-9。Müller、Fabian 等“難治性抗合成酶綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。CABA-201 開放標籤試驗的1/2期研究評估活動性特發性炎性炎症 肌病(IIM 或肌炎)受試者的 CABA-201 CABA-201 關鍵納入標準年齡 ≥ 18 至 65 歲儘管以前或目前接受過標準護理治療但仍有活動性疾病的證據關鍵排除標準癌症相關的 肌炎嚴重的肺部或心臟損傷在大約 6 個月內使用 B 細胞消耗劑治療使用生物製劑治療大約 3 個月內平行隊列篩查 CABA-201 輸液監測下一頁患者研究終點和 目標主要目標:輸液後 28 天內活動性肌炎受試者中 CABA-201 的安全性和耐受性關鍵次要目標包括 CABA-201 對以下疾病的影響:肌炎臨牀疾病活動;功能和射線照相 疾病證據;肌炎血清學;以及藥代動力學/藥效學 1x106 細胞/kg1 的劑量相當於最近使用的含有 4-1BB 的 CD19-CAR T 劑量學術研究 2,3 ASYs (N = 6) IMNM (N = 6) DM (N = 6) DM (N = 6) 多個臨牀團隊執行記錄一致 評估自身免疫性疾病患者新候選細胞療法的研究
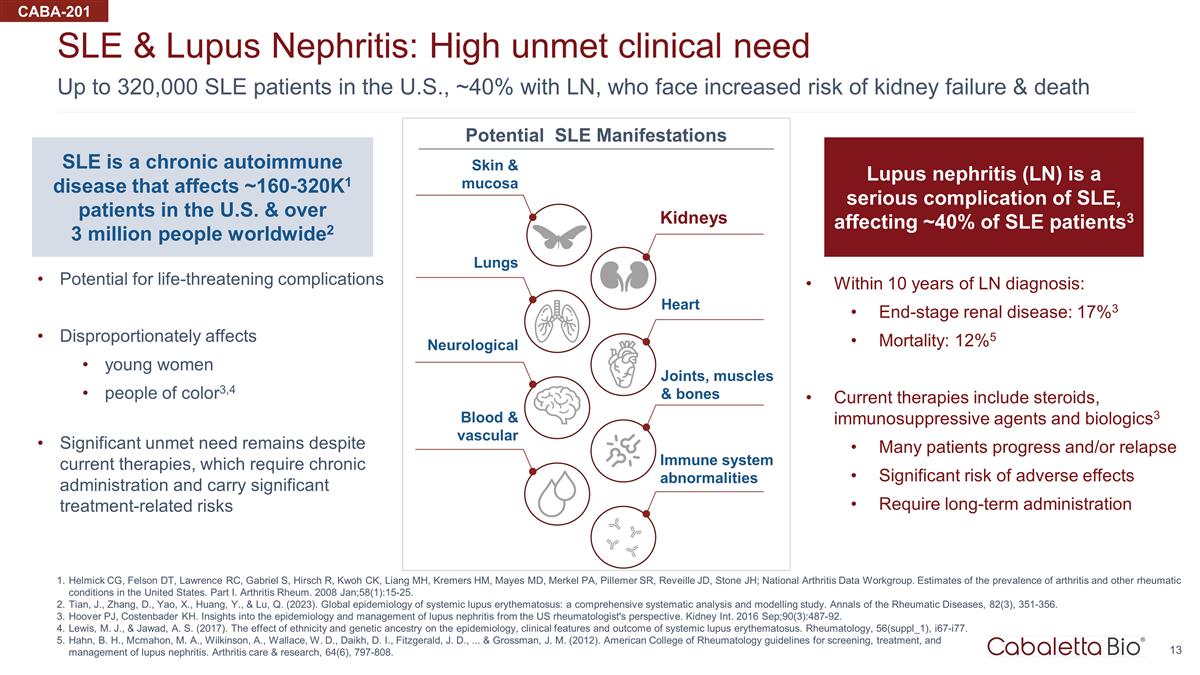
美國有多達 32 萬名系統性紅斑狼瘡患者,約 40% 患有 LN,他們面臨着更高的腎衰竭和死亡風險系統性紅斑狼瘡和狼瘡腎炎:高度未得到滿足的臨牀需求 Helmick CG、Felson DT、Lawrence RC、Gabriel S、Hirsch R、Kwoh CK、Liang MH、Kremers HM、Mayes MD、Merkel PA、Pillemer SR、 Reveille JD、Stone JH; 全國關節炎數據工作組。美國關節炎和其他風濕性疾病患病率的估計。第一部分關節炎類風濕病。2008 年 1 月;58 (1): 15-25。Tian、J.、Zhang、D.、Yao、X.、Huang、Y. 和 Lu, Q. (2023)。系統性紅斑狼瘡的全球流行病學:一項全面的系統分析和建模研究。《風濕病年鑑》,82(3),351-356。Hoover PJ,Costenbader KH從美國風濕病學家的角度對 狼瘡腎炎的流行病學和管理的見解。Kidney Int. 2016 年 9 月;90 (3): 487-92。M.J. Lewis 和 A.S. Jawad(2017)。種族和遺傳血統對系統性紅斑狼瘡 的流行病學、臨牀特徵和預後的影響。風濕病學,56(suppl_1),i67-i77。Hahn,B.H.、M.A. Mcmahon、A.、Wilkinson、W. Wallace、W.D.、D.I. Daikh、J.D. Fitzgerald、... 以及 J.M. Grossman(2012)。美國風濕病學會狼瘡腎炎篩查、治療、 和管理指南。關節炎護理與研究,64 (6),797-808。CABA-201 脊髓灰質炎診斷後 10 年內:終末期腎臟疾病:17% 3 死亡率:12% 5 目前的療法包括類固醇、免疫抑制劑和生物製劑3 許多患者進展和/或復發嚴重的不良反應風險需要長期服用 SLE 是一種慢性自身免疫性疾病,影響美國約 160-320K1 患者和全球超過 300 萬人2 可能出現危及生命的併發症對年輕女性的影響尤其嚴重 of color3,4 儘管目前的療法要求,但仍有大量需求未得到滿足長期服藥並帶來顯著的治療相關風險狼瘡腎炎 (LN) 是系統性紅斑狼瘡的嚴重併發症,影響了大約 40% 的系統性紅斑狼瘡患者3 皮膚和粘膜腎臟心臟關節、肌肉和骨骼免疫系統異常血液和血管神經系統肺部潛在的系統性紅斑狼瘡表現
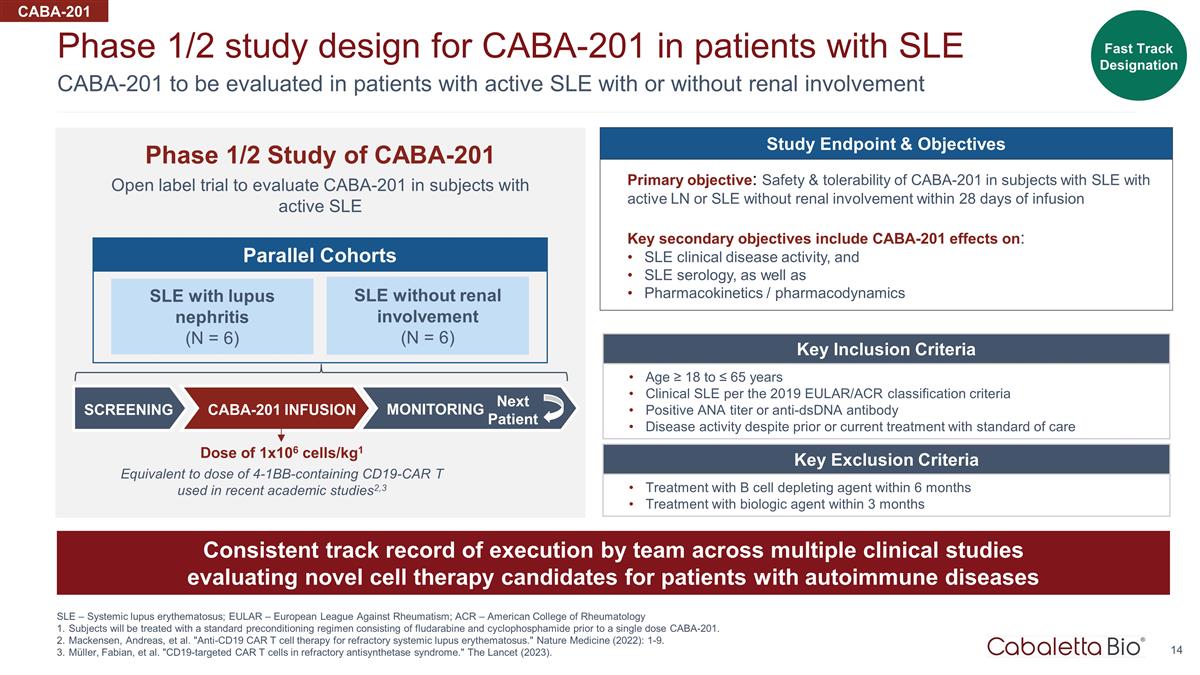
14 CABA-201 待評估 伴有或沒有腎臟受累的活動性系統性紅斑狼瘡患者 CABA-201 的 1/2 期研究設計系統性紅斑狼瘡 — 系統性紅斑狼瘡;EULAR — 歐洲抗風濕病聯盟;ACR — 美國 風濕病學學會受試者將在單劑量 CABA-201 之前接受由氟達拉濱和環磷酰胺組成的標準預處理方案。麥肯森、安德烈亞斯等“抗CD19 CAR T細胞療法治療難治性系統性紅斑狼瘡 。”《自然醫學》(2022):1-9。Müller、Fabian 等“難治性抗合成酶綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。CABA-201 開放標籤試驗的1/2期研究旨在評估活性 SLE 的受試者的 CABA-201 CABA-201 關鍵納入標準年齡 ≥ 18 至 ≤ 65 歲根據 2019 年 EULAR/ACR 分類標準臨牀系統性紅斑狼瘡陽性 ANA 滴度或抗 dsDNA 抗體儘管以前或目前接受過標準護理治療,但仍存在疾病活性 關鍵排除標準 6 個月內使用 B 細胞消耗劑治療 3 個月內使用生物製劑治療各團隊一致的執行記錄評估新型細胞療法的多項臨牀研究 自身免疫性疾病患者的候選人快速通道指定伴狼瘡腎炎(N = 6)無腎臟受累的系統性紅斑狼瘡(N = 6)平行隊列篩查 CABA-201 輸液監測下一個患者研究終點和目標主要目標: 在輸液後 28 天內具有活動性 LN 或無腎臟受累的系統性紅斑狼瘡受試者中 CABA-201 的安全性和耐受性關鍵次要目標包括 CABA-201 對以下系統性紅斑狼瘡臨牀疾病活動的影響,以及系統性紅斑狼瘡血清學以及 藥代動力學/藥效學 1x106 細胞/kg 的劑量1 相當於最近學術研究中使用的含有 4-1BB 的 CD19-CAR T 的劑量2,3

我們的候選產品和 具有獨特經驗的人為我們的開發道路提供了信息。加速開發治療自身免疫性疾病 SLE 的 CABA-201 — 系統性紅斑狼瘡 Peng、Binghao J 等。“CABA-201 的臨牀前特異性和活性,這是一種完全 人類 4-1BB,含有 CD19 CAR T 療法,用於治療耐藥性自身免疫性疾病。”海報發表於:美國基因與細胞療法學會第26屆年會;2023年5月19日;加利福尼亞州洛杉磯。戴振宇等“用於T細胞治療的新型全人源抗CD19嵌合抗原受體的開發和 功能表徵。”《細胞生理學雜誌》236.8 (2021):5832-5847。麥肯森、安德烈亞斯等“用於難治性 系統性紅斑狼瘡的抗 CD19 CAR T 細胞療法。”《自然醫學》(2022):1-9。Müller、Fabian 等“難治性抗合成酶綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。CABA-201 CABA-201 的高效臨牀試驗設計促進了快速 和廣泛的開發計劃加速開發獨家轉化合作夥伴關係提供了對時間表有影響的早期見解針對多種自身免疫性疾病的高效臨牀試驗設計具有潛在的治療起始劑量 劑量並行隊列對自身免疫患者的複雜細胞治療計劃有深刻的理解和經驗 CABA-201 全人類粘合劑降低了免疫原性的風險基於在大約 20 名腫瘤患者中使用的臨牀耐受性特徵 4-1BB costim 結構域與學術 CD19-CAR T 研究中使用的結構域相同1,2 具有 4-1BB costim 結構域且結合活性與學術界 CD19-CAR T1-4 相似的候選產品 4 份自身免疫細胞療法 IND 申請,每份申請均在常規 30 天窗口中獲得批准的經驗為 CABA-201 多種適應症的高效臨牀策略提供信息 CMO 領導團隊成員在過去 65 年中僅有的兩款獲得 FDA 批准的系統性紅斑狼瘡產品的開發領導團隊成員廣泛的 建立細胞療法供應的經驗人物 Singular 專注於潛在的治癒細胞自 2018 年以來的自身免疫性疾病療法

嵌合自身抗體受體 T 細胞 DSG3-CAART 和 musk-caart

目前的治療需要廣泛的 免疫抑制與安全風險和短暫療效相關的尋常型天皰瘡概述和當前治療格局圖片來源:D @nderm。http://www.vgrd.org/archive/cases/2004/pv/DSCN4996%20copy.JPG Joly、Pascal 等。 “一線利妥昔單抗聯合短期潑尼鬆對比單獨使用潑尼鬆治療天皰瘡(Ritux 3):一項前瞻性、多中心、平行組、開放標籤的隨機試驗。”《柳葉刀》389.10083 (2017):2031-2040。 Werth、Victoria P. 等。“尋常型天皰瘡患者的利妥昔單抗與嗎替麥考酚酯。”新英格蘭醫學雜誌(2021)。利妥昔單抗標籤,2020 年 8 月修訂版。庫什納、Carolyn J. 等。“與利妥昔單抗治療天皰瘡後完全緩解相關的因素。”JAMA 皮膚科(2019)。託尼、漢斯-彼得等。“利妥昔單抗治療對不同自身免疫性疾病患者的安全性和臨牀結果:來自國家註冊機構 (GRAID)的經驗。”關節炎研究與治療 13.3 (2011):1-14。CROT = 非全身治療時無病變8周以上 mucosal PV1 (25%) 相關抗體 Anti-dsg3 + Anti-dsg1 臨牀症狀粘膜疼痛水泡 (口、鼻、喉、食道、眼睛、生殖器、直腸)鼻孔和皮膚上有水泡美國疾病患病率 3,250 至 4,750 9,750 至 14,250 皮膚 PV2 (75%) DSG3-CAART 暫時緩解廣泛免疫抑制3,6 利妥昔單抗加類固醇 (~3,500 mg/年) 4 有效性適中且耐受性差 8 周以上 6 16 周以上 4,5% 的患者未能達到任何 8 周或 16 周以上沒有病變或藥物未實現在 1 年內復發約 30%,2 年內復發 > 50% 6 Safety 風險 22% 年度嚴重不良事件 (SAE) 發生率4 4-9% 3,4,5 每年 PV 嚴重感染風險 ~ 1.9% 終身發生致命感染的風險7
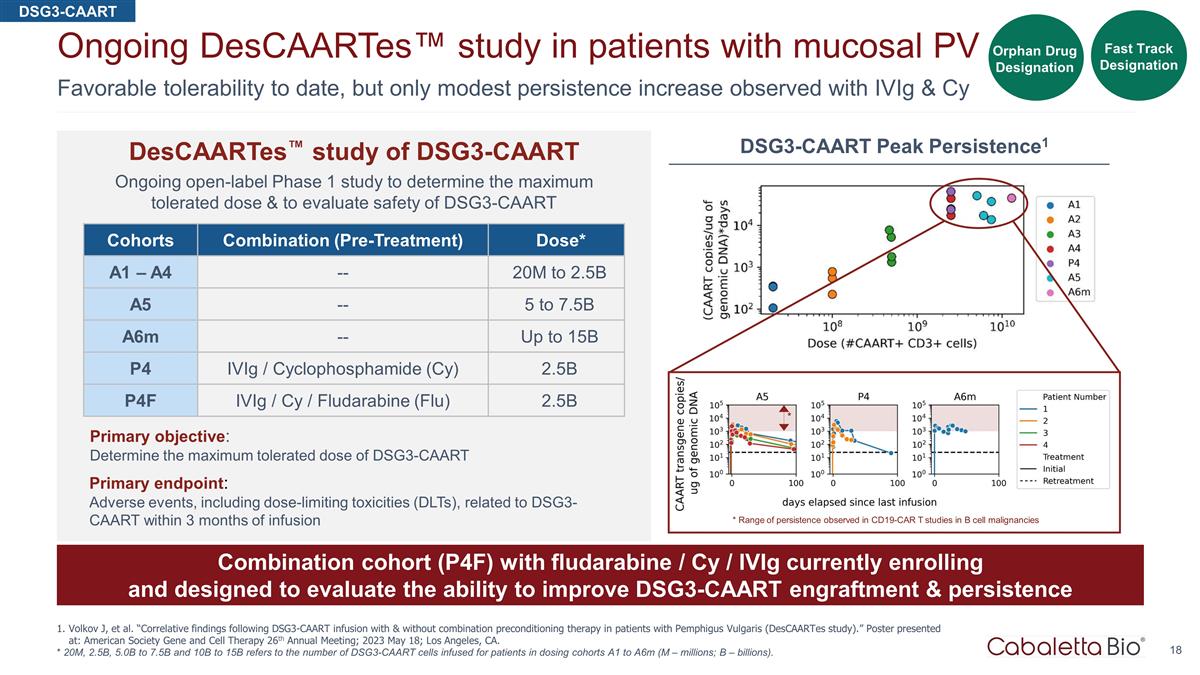
迄今為止,耐受性良好,但是 通過對粘膜 PV 患者 Volkov J 等人的 iViG & Cy 正在進行的 Descaartes™ 研究,觀察到的持續性僅略有增加。“尋常型天皰瘡患者輸注 DSG3-CAART 和不使用聯合預處理 治療後的相關發現(DescaArtes 研究)。”海報發表於:美國基因與細胞療法學會第26屆年會;2023年5月18日;加利福尼亞州洛杉磯。* 2000萬、25B、50B至75B和10B至15B是指在給藥隊列A1至A6m中為患者注入的 DSG3-CAART 細胞數量(M — 數百萬;B — 十億)。隊列組合(預治療)劑量* A1 — A4 — 20M 到 2.5B A5 — 5 到 7.5B a6m — 最高 15B P4 iViG /環磷酰胺 (Cy) 2.5B P4F iVIg/Cy /氟達拉濱(流感)2.5B 主要目標:確定 DSG3-CAART 的最大耐受劑量主要終點:不良事件,包括輸液 3 個月內與 DSG3-CAART 相關的劑量限制毒性 (DLT) DSG3-CAART descaartes™ 研究 DSG3-CAART 正在進行的開放標籤 1 期研究,以確定最大耐受劑量並評估 DSG3-CAART Fast Track 指定孤兒藥的安全性名稱 * 在 CD19-CAR T B 細胞惡性腫瘤研究中觀察到的持續性範圍 * DSG3-CAART Peak Persistence1 目前正在註冊的氟達拉濱/Cy/iViG 的組合隊列 (P4F),旨在評估改善 DSG3-CAART 植入和持久性的能力

正在根據來自 Descaartes™ 研究的新興數據評估研究時間表 musk 重症肌無力 (MG) MuscaArtes™ Musk-caart 的研究正在進行開放標籤研究,以確定最大耐受劑量並評估 musk-caart Part 羣組受試者的安全性 A — 單一療法劑量升級7 劑量從 5 億增加使用 2 (+4) 設計 A1-A3 2 (+4) 每個隊列 A — 自適應組合隊列 7 組合隊列 8,從 A2 劑量開始 A2 劑量 A4+ 2 (+4) 每個隊列 B — Expansion 在最終選定劑量下擴大受試者註冊人數 B ~12 musk-caart以IgG4為主的疾病利妥昔單抗1,2 利妥昔單抗未完全消滅後自身抗體滴度下降並在復發期間持續存在3 循環抗麝香抗體 滴度可能比PV4,5,6 中的抗 dsg3 抗體低約 90% 1 2 研究終點和目標主要終點:不良事件,包括 DLT 次要和三級目標:CAART 擴展/持久性,對血清抗麝香抗體的影響 滴度、同時使用全身性藥物、對臨牀症狀的影響、製造成功率令人信服的生物學理由,類似於PV 差異化市場機會美國 MG 總患病率 50,000 至 80,000 名患者 musk+ MG 佔總數 MG 的 6-7.5% 與 achr+ MG 相比,musk+ 病通常更為嚴重,治療選擇有限 musk+ 疾病發病早,7:1 女性 MG — 重症肌無力 * 500M 是指給藥隊列 A1 (M —) 中為患者注入的 musk-caart 細胞數量百萬)。Hain、Berit 等“用利妥昔單抗成功治療Musk抗體陽性MG。”肌肉與神經。33.4 (2006):575-580。Illa、Isabel 等。“抗 ACHR 和抗馬斯克陽性的重症肌無力患者對 利妥昔單抗的持續反應。”《神經免疫學雜誌》201 (2008):90-94。Jiang、Ruoyi 等“單細胞庫追蹤可識別重症肌無力復發期間耐利妥昔單抗的B細胞。” JCI Insight 5.14 (2020)。Matthews、Ian 等。“肌肉特異性受體酪氨酸激酶自身抗體——一種新的免疫沉澱測定法。”Clinica chimica acta 348.1-2 (2004):95-99。McConville、John 等“血清陰性重症肌無力中 musK 抗體的檢測和表徵。”《神經病學年鑑》55.4(2004):580-584。Marino、Mariapaola 等“長期利妥昔單抗誘導的重症肌無力 重症肌無力 的特異性(但不是總量)IgG4降低。”《免疫學前沿》11 (2020):613。在研究的A部分中,共有6名受試者需要接受最終選擇的劑量。在隊列 A2 耐受性良好、 傾向於 A4 入學 A4 之後,A3 和 A4 隊列將同時入學。快速通道認定孤兒藥認定

公司摘要
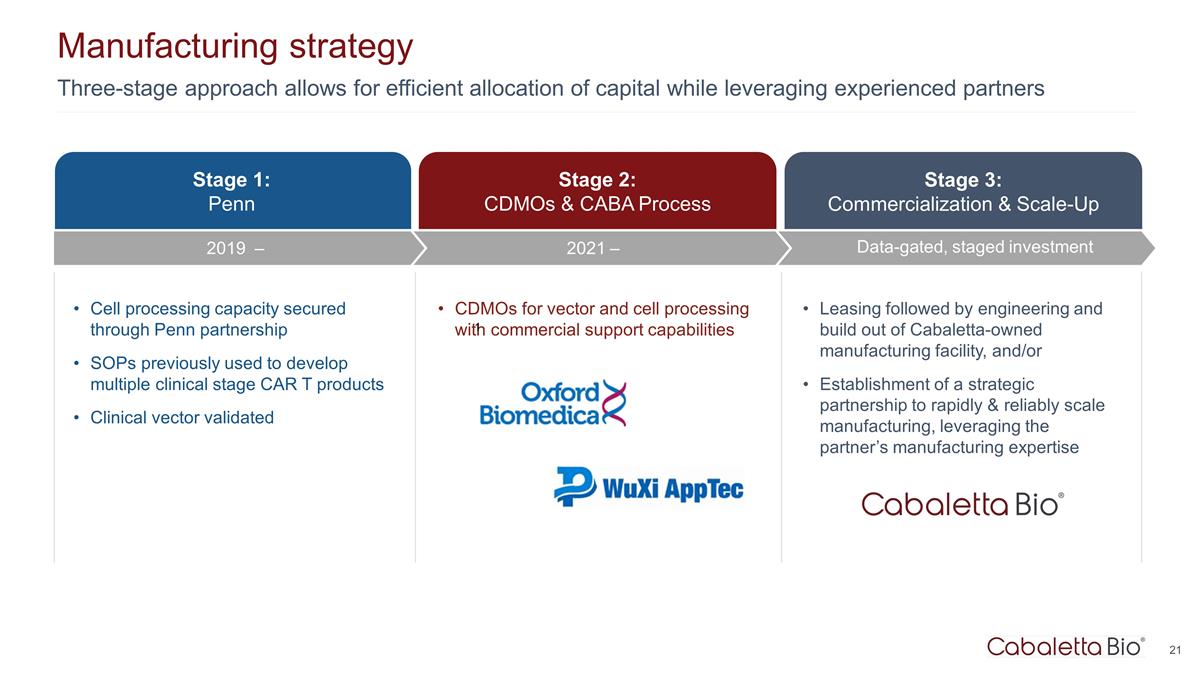
三階段方法允許 高效分配資本,同時利用經驗豐富的合作伙伴製造戰略第 3 階段:商業化和擴大規模數據門控、分階段投資第 1 階段:賓夕法尼亞大學第 2 階段:通過賓夕法尼亞大學的合作伙伴關係 SOP 確保細胞處理能力 以前用於開發多個臨牀階段 CAR T 產品經過臨牀載體驗證的用於載體和細胞處理的 CDMO 具有商業支持能力租賃然後是 cabaTaleTaLeta 的工程和構建 TA 擁有的製造工廠,和/或建立戰略合作伙伴關係,利用合作伙伴的製造專業知識,快速可靠地擴大製造規模 2021 — 2019 — 1

董事會 Cabaletta Bio 領導團隊 Anup Marda 首席財務官阿倫·達斯,醫學博士,首席商務官 David J. Chang,醫學博士,M.P.,FACR 首席醫學官瑪莎·奧康納首席人力資源官邁克爾·傑拉德總法律顧問史蒂芬·尼希特伯格, 醫學博士總裁、首席合規官兼董事長 Heather Harte-Hall 首席合規官薩米克·巴蘇,醫學博士警官 Gwendolyn Binder,科學與技術科學顧問委員會主席 Gwendolyn Binder 博士在評估新型細胞療法候選藥物方面的運營成功記錄 臨牀前、臨牀、製造和監管領域的自身免疫艾米·佩恩,醫學博士,博士聯合創始人兼聯席主席 Michael C. Milone,醫學博士,聯合創始人兼聯席主席 Carl June,醫學博士 Jay Siegel,醫學博士 Steven Nichtberger,醫學博士 Richard Henriques,M.B.A. Scott Brun,醫學博士 Mark Simon,M.B.. Catherine Bollard,醫學博士 Drew Weissman,醫學博士,伊恩·麥金尼斯博士,FRCP,FRSE,FMedSci Georg Schett,醫學博士 Shawn Tomasello, M.B.A.

利用多年來在自身免疫領域的 細胞療法經驗,啟動 CABA-201 臨牀試驗 Cabaletta®:尋求各種自身免疫性疾病的治療方法 CARTA — 用於自身免疫的嵌合抗原受體 T 細胞;CAART — 嵌合自身抗體 受體 T 細胞;IND — 在研新藥;SLE — 系統性紅斑狼瘡;DM — 皮膚肌炎;ASYs — 抗體合成酶綜合徵;IMNM — 免疫介導的壞死性肌病;流感 — 氟達拉濱;Cy — 環磷酰胺 Mackensen、Andreas 等“抗CD19 CAR T細胞療法治療難治性系統性紅斑狼瘡。”《自然醫學》(2022):1-9。Müller、Fabian 等“難治性抗合成酶 綜合徵中靶向CD19的CAR T細胞。”《柳葉刀》(2023)。戴振宇等“用於T細胞治療的新型全人源抗CD19 CAR的開發和功能表徵。”《細胞生理學雜誌》236.8 (2021):5832-5847。假設隊列中未觀察到劑量限制 毒性,並且試驗中出現不間斷的入組。截至2023年第二季度10季度報告。通過有效的設計推進肌炎和系統性紅斑狼瘡試驗,包括起始劑量和平行隊列 1.0 x 106 個細胞/kg CABA-201 的初始劑量與學術性肌炎和系統性紅斑狼瘡研究中使用的劑量相同 1,2 各有 6 名患者的平行隊列 — 1) DM、2) ASYs 和 3) IMNM 的系統性紅斑狼瘡研究;1) LN 和 2) 非腎臟系統性紅斑狼瘡 CABA-201 的肌炎研究 專為自身免疫性疾病患者設計的全人類 CD19 粘合劑,包含大約 20 名腫瘤患者的數據 — 支持進一步評估自身免疫的臨牀安全性 Same 4-1BB共刺激域和類似的 CD19 粘合劑 affinity3 用於學術性肌炎和系統性紅斑狼瘡研究1,2 有可能治癒各種自身免疫性疾病,其中 B 細胞起着引發或維持疾病的作用。學術機構提供的其他臨牀數據強化了 CD19-CAR T 在自身免疫中的潛力,早期的行業研究正在進行中。有機會解決風濕病學以及其他治療領域(包括神經病學、腎病)未得到滿足的需求病學和皮膚病學 Descaartes™ 在尋常型粘膜天皰瘡中試驗 DSG3-CAART —iViG/Flu/Cy 隊列報名參加 MusCaartes™ 重症肌無力試驗 — 利用 DSG3-CAART CARTA 策略經驗的見解 | CABA-201(4-1BB CD19-CAR T)將在肌炎和系統性紅斑狼瘡 1/2 期研究中同時進行評估 CAART 策略 | DSG3-CAART 和 musk-Caart 臨牀研究評估聯合療法初始 CABA-201 3 個月臨牀療效和耐受性數據 1H244 | 1766美元 M cash5 將進入二零二五年第四季度

2023 年 9 月公司簡報