

附錄 99.1 FTX-6058 f o r S i c k l e c e l l d i s e a s e program 更新

F U L C R U M T H E R A P E U T I C S 免責聲明和通知本 演示文稿包含1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”,涉及重大風險和不確定性。除歷史事實陳述外,本演示文稿中包含的所有陳述 均為前瞻性陳述,包括關於恢復 FTX-6058 臨牀開發的明示或暗示陳述;1b 期臨牀試驗設計和每個隊列中的受試者數量以及 羣組數量;以及修訂後的納入和排除標準的影響;以及此類試驗的註冊等。“預期”、“相信”、“繼續”、“可以”、 “估計”、“預期”、“打算”、“可能”、“計劃”、“潛在”、“預測”、“項目”、“應該”、“目標”、“將”、 “將” 等詞語旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別詞。任何前瞻性陳述均基於管理層當前 對未來事件的預期,並且存在許多風險和不確定性,這些風險和不確定性可能導致實際業績與此類前瞻性陳述中或暗示的結果存在重大和不利差異。這些風險和 不確定性包括但不限於與進行臨牀試驗相關的風險;Fulcrum 在臨牀試驗中繼續推進其候選產品的能力;按預期或完全按時啟動和註冊臨牀試驗;獲得並維持美國食品藥品管理局和其他監管機構的必要批准;在臨牀試驗中複製臨牀前研究和/或早期臨牀試驗中發現的積極結果;獲得、 維護或保護與之相關的知識產權其候選產品;管理開支;管理高管和員工流失,包括整合新的首席執行官和首席財務官;以及籌集 實現其業務目標所需的大量額外資金等。有關其他風險和不確定性以及其他重要因素的討論,其中任何一個因素都可能導致Fulcrum的實際業績與前瞻性陳述中包含的結果不同, 請參閲Fulcrum最近向美國證券交易委員會提交的文件中的 “風險因素” 部分,以及對潛在風險、不確定性和其他重要因素的討論。此外,本演示文稿中包含的前瞻性 陳述代表了Fulcrum截至本文發佈之日的觀點,不應將其視為Fulcrum在本文發佈之日之後的任何日期的觀點。Fulcrum預計,隨後的 事件和事態發展將導致Fulcrum的觀點發生變化。但是,儘管Fulcrum可能會選擇在未來的某個時候更新這些前瞻性陳述,但Fulcrum明確表示不承擔任何這樣做的義務。2
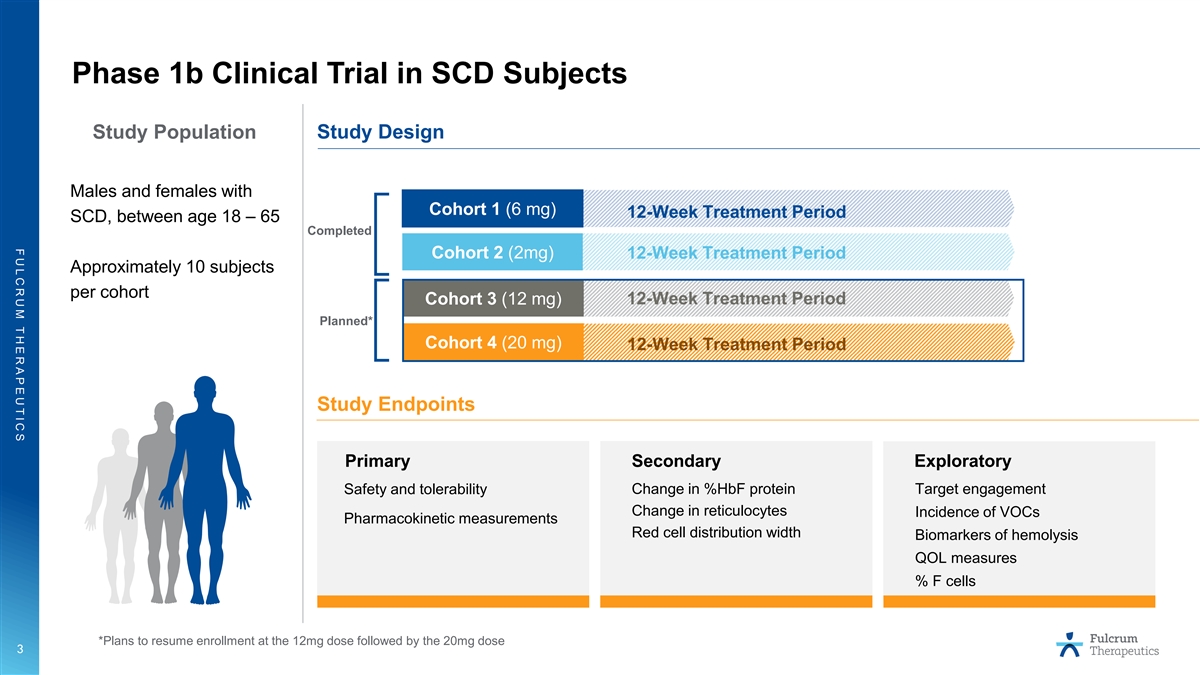
F U L C R U M T H E R A P E U T I C S 1b 期 SCD 臨牀試驗 受試者研究人羣研究設計第 1 組 (6 mg) 12 周治療期 SCD 的男性和女性,年齡在 18 至 65 歲之間,已完成第 2 組 (2mg) 12 周治療期每組大約 10 名受試者隊列 3 (12 mg) 12 周 計劃治療期* 隊列 4 (20 mg) 12 周治療期研究終點 %hbF 蛋白的主要次要探索性變化靶點參與度安全性和耐受性網織紅細胞變化揮發性有機化合物發生率藥代動力學測量 紅細胞分佈寬度溶血生物標誌物 QOL 可測量 F 細胞百分比 *計劃在 12 毫克劑量後恢復入組 20 毫克劑量 3

F U L C R U M T H E R A P E U T I C S 初始 FTX-6058 數據表明 HbF 絕對百分比變化與基線安全隨訪相比的劑量依賴性增加 12 2mg FTX-6058 10 6mg FTX-6058 8 12mg FTX-6058 6 4 2 0 0 14 28 42 56 70 84 98 112 Day 美國食品藥品管理局於 2023 年 2 月 23 日發佈了 FTX-6058 的全面臨牀擱置。Safety 數據收集仍在繼續,數據截止日期為2023年3月3日。4 注意:彙總數據包括羥基脲開啟和關閉的受試者;受試者 15 在第 22 天停止給藥,因此僅包含在第 14 天之前的分析中。與基線平均值 (+/-SE) 相比,絕對的 %hbF 變化

F U L C R U M T H E R A P E U T I C S 關鍵收錄內容和 排除標準概述關鍵納入標準關鍵排除標準患者嚴重程度排除目前在開始 FTX-6058 前 60 天內曾接受過以下羥基脲療法的受試者:以及以前 使用過穩定的羥基脲和 voxelotor 或劑量 voxelotor 或 crizanlizumab 或 L-glugludar 的經歷 tamine crizanlizumab 或 L-glustamine 或者無法獲得這些先進療法我們估計 {中大約有 7,500 到 10,000 名患者br} 符合修訂後議定書納入和排除標準的美國 5

F U L C R U M T H E R A P E U T I C S 關鍵收錄內容概述 標準:患者嚴重程度其他嚴重程度衡量標準 12 個月內揮發性有機化合物 ≥ 2 慢性腎臟 ≥ 2 其他 ≥ 4 12 種疾病或至少一種月份或 ≥ 2 種其他衡量標準 6 個月以上肺動脈嚴重程度月份 6

F U L C R U M T H E R A P E U T I C S 關鍵收錄內容概述 標準:以前使用過羥基脲和其他一種批准的療法 • 持續使用揮發性有機化合物或急性胸部綜合徵發作 • 藥物相互作用在最大耐受劑量下至少 6 個月難以控制 • 患者拒絕 • 無法耐受治療的不良反應以及 • 持續的疼痛危機和其他揮發性有機化合物處於穩定狀態時 • 無法耐受 Voxelotor 或 crizanlizumab 劑量至少 6 個月或左旋谷氨醯胺的不良反應或 l-谷氨醯胺 •難以控制的藥物相互作用 • 未能將 Hb 提高 1 g/dL(vox.)或持續 • 患者拒絕 VOC 發作(criz. 或 L-glutamine)或 • 缺乏可用性 無法獲得 • 缺乏保險覆蓋高級療法 7

FTX-6058 f o r S i c k l e c e c e l l d i s e a s e 補充詳情

F U L C R U M T H E R A P E U T I C S 關鍵收錄內容的修改 標準:患者嚴重程度 ▪ 篩查前 12 個月內超過 4 次 SCD 疼痛危機發作或在篩查前 6 個月內發生 ≥2 次 SCD 疼痛危機發作,再加上過去 12 個月中至少一次發作:• 急性胸部綜合徵 (ACS) • 肝臟或脾臟封存 • 陰莖異常勃起 ▪ 在過去 12 個月中發生的以下事件中超過 2 個:• ACS • 肝臟或脾臟封存 • 陰莖異常勃起 ▪ Tricuspid regurgitant 噴射速度 (TRV) ≥ 3.0 m/s 或 TRV ≥ 2.5 m/s + N 末端 pro b 型 ▪利鈉肽 (nt-proBNP) 血漿水平 ≥ 160 pg/mL 或者記錄了通過先前的超聲心動圖或 右側心臟導管插入術診斷出持續的肺動脈高壓,平均肺動脈壓 > 25 mm Hg ▪ SCD 相關慢性腎臟病 (CKD) 由以下至少一個標準定義,分別連續測量:2 • 估計腎小球濾過率 (eGFR):2 • 估計腎小球濾過率 (eGFR) ≥ 30 和 300 mg/g 或蛋白質與肌酐的比例 >30 mg/mmol ▪ 符合接受的醫療標準(例如 腦血管事故後)但是禁用於慢性輸血(例如異體免疫、輸血反應)9

F U L C R U M T H E R A P E U T I C S 對關鍵內含物的修改 標準:以前使用過羥基脲和另一種批准的療法以前使用過羥基尿素(HU)至少 6 個月的經歷之前使用過穩定劑量的 voxelotor crizanlizumab(最大耐受劑量)但已證明 無反應或左旋谷氨醯胺在至少 6 個月但根據以下標準之一,至少基於以下一項無迴應和/或不容忍或不符合資格:標準:▪ 對於 voxelotor,未能將血紅蛋白 (Hb) 增加至少 1 ▪ 與基線相比,在HU服用穩定劑量至少6種和/或其他揮發性有機化合物後,疼痛危機次數 g/dL 與基線相比相同或更高,▪ ACS 發作至少 6 個月 ,與基線相比,crizanlizumab 或 L-Glutamine 與基線相比,ACS 發作在疼痛危象和/或其他揮發性有機化合物數量相同或更高的情況下服用 HU 至少 6 個月,而在穩定劑量的治療下,最大耐受 劑量至少 6 個月 ▪ 無法耐受 HU 為 ▪定義為 ▪ 無法耐受以下治療的不良反應中的至少一個:▪ 藥物相互作用難以控制 • 嚴重的過敏反應 ▪ 無法獲得治療 • 血液學毒性定義為紅細胞、白細胞或血小板的臨牀顯著減少 ▪ 患者拒絕 • 無法耐受 胃腸道副作用,例如噁心、嘔吐、腹瀉或腹痛 • 無法耐受副作用包括疲勞、頭暈、頭痛、發燒、腿部潰瘍和/或皮膚變化 ▪難以控制的藥物相互作用 ▪ 患者拒絕 10

F U L C R U M T H E R A P E U T I C S 排除標準摘要 ▪ 在開始研究藥物前 14 天內進行重大手術、嚴重疾病、感染、發燒、嚴重出血、腦血管意外或癲癇發作;計劃在試驗期間進行選擇性手術 ▪ 鐮狀細胞 併發症在開始研究藥物前 14 天內需要醫療提供者護理 ▪ 抗藥的使用誘導或抑制細胞色素 P450 (CYP) 3A4、抑制 P 糖蛋白、乳腺癌耐藥蛋白、 或多種藥物和毒素的凝固劑或藥物擠壓蛋白 2-K,或者在第一劑研究藥物或研究期間預計需要任何這些藥物之前 14 天內成為 CYP2B6 的底物。▪ 在入組後的過去 60 天內使用 研究人員參與任何其他研究 ▪ 骨髓移植、人類幹細胞移植或基因療法史 ▪ 在開始研究藥物前的 7 天內接種過丙氨酸 氨基轉移酶 ≥ 3× 正常 (ULN)、白蛋白 1.5mg/dL 或凝血酶原時間上限 >1.5 ULN ▪ 有以下病史的受試者 ▪定義為 eGFR 的嚴重腎臟疾病

F U L C R U M T H E R A P E U T I C S 排除標準摘要 (續)▪ 定期接受輸血的受試者或任何在開始研究藥物前 60 天內輸血的受試者 ▪ 經臨牀診斷的酒精或其他非法藥物濫用藥物的藥物濫用障礙 ▪ 尿液藥物篩查呈陽性,非法濫用藥物(阿片類藥物和大麻除外/四氫大麻除外)氫化大麻酚 [四氫大麻酚]/大麻二酚 [CBD]) 是排他性的 ▪ 孕婦或哺乳期女性;或者育齡女性無法或 不願在研究期間遵守節育措施或禁慾,受試者是調查現場工作人員或其直系親屬(配偶、父母、子女或兄弟姐妹,無論是親生還是合法收養)▪ 心率校正 QT interval-Fridericia 的方法 (qtCF) >450 msec(男性)或 >470 msec(女性)▪ 受試者有活動性惡性腫瘤或癌症史(鱗狀細胞皮膚癌、基底細胞皮膚癌或 {0 期宮頸癌除外)br} situ,過去 5 年內沒有復發)或直系親屬患有已知或疑似家族癌症綜合徵。已知存在染色體異常或基因突變,可能使受試者患上 骨髓增生異常綜合徵 (MDS) 或急性髓系白血病 (AML) 的風險增加 ▪ 受試者目前正在接受HU、voxelotor、crizanlizumab 和/或 Lglutamine 或者已經接受了 HU、voxelotor、crizanlizumab 和/或 Lgrutamine 或者已經接受了 HU、voxelotor、crizanlizumab 和/或 L-谷氨醯胺在開始研究前 60 天內 藥物 12