

2023 年 8 月公司推介會

本演示文稿中包含的某些信息可能包括1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”。在某些情況下,我們可能會使用 “預測”、“相信”、“潛力”、“繼續”、“估計”、“預期”、“預期”、“計劃”、“打算”、“可能”、“可能”、“將”、“應該” 或其他表達未來事件或結果不確定性的詞語來識別這些前瞻性陳述。特別是,公司關於趨勢和潛在未來業績的陳述就是此類前瞻性陳述的例子。前瞻性陳述包括風險和不確定性,包括但不限於我們的 Sunosi® 和 Auvelity® 產品的持續商業成功,以及我們成功獲得與 solriamfetol 和/或 AXS-05 有關的任何其他適應症;我們正在進行的臨牀試驗和當前候選產品的預期臨牀試驗的成功、時機和成本,包括關於啟動時間、註冊速度和完成試驗的聲明(包括我們有能力為我們披露的全額資金臨牀試驗,假設我們目前的預計收入或支出沒有重大變化)、徒勞性分析和中期結果的收到(不一定表明我們正在進行的臨牀試驗的最終結果),以及支持為我們當前任何候選產品提交新藥申請(“NDA”)所必需的研究數量或類型或結果性質;我們為其他臨牀試驗提供資金以繼續推進候選產品的能力;時機以及我們獲得和維持美國食品的能力以及藥物管理局(“FDA”)或其他監管機構對我們的候選產品的批准或其他行動;根據我們對 MOMENTUM 臨牀試驗的特殊方案評估,美國食品藥品管理局在完整回覆信中發現的問題是否會影響公司對有或沒有先兆的成年人偏頭痛急性治療的 AXS-07 保密協議的潛在批准性;公司成功捍衞其知識產權或付費獲得必要許可證的能力公司可以接受(如果有的話);成功實施公司的研發計劃和合作;公司許可協議的成功;市場對公司產品和候選產品(如果獲得批准)的接受;公司的預期資本需求,包括Sunosi和Auvelity持續商業化以及公司商業推出其他候選產品所需的資本金額,以及對公司預期現金流的潛在影響;不可預見的情況或其他情況由於 COVID-19 引起或與之相關的正常業務運營中斷;以及其他不受公司控制的因素,包括總體經濟狀況和監管發展。本文討論的因素可能導致實際結果和發展與此類陳述中表達或暗示的結果和發展存在重大差異。前瞻性陳述僅在本新聞稿發佈之日作出,公司沒有義務公開更新此類前瞻性陳述以反映後續事件或情況。本演示文稿包含有關公司根據報告的臨牀數據得出的觀察的陳述。本演示文稿還包含獨立方和我們提供的與市場規模相關的估計值和其他統計數據,以及有關公司行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。我們和任何其他人均未就此類數據的準確性或完整性作出任何陳述,也不承擔在本演示之日之後更新此類數據的義務。此外,這些預測、假設和估計必然存在高度的不確定性和風險。Axsome、Auvelity、Sunosi 和 Moseic 是 Axsome Therapeutics, Inc. 或其關聯公司的商標或註冊商標。除了Auvelity和Sunosi的批准適應症外,此處提及的開發產品尚未獲得美國食品藥品管理局的批准。前瞻性聲明和安全港
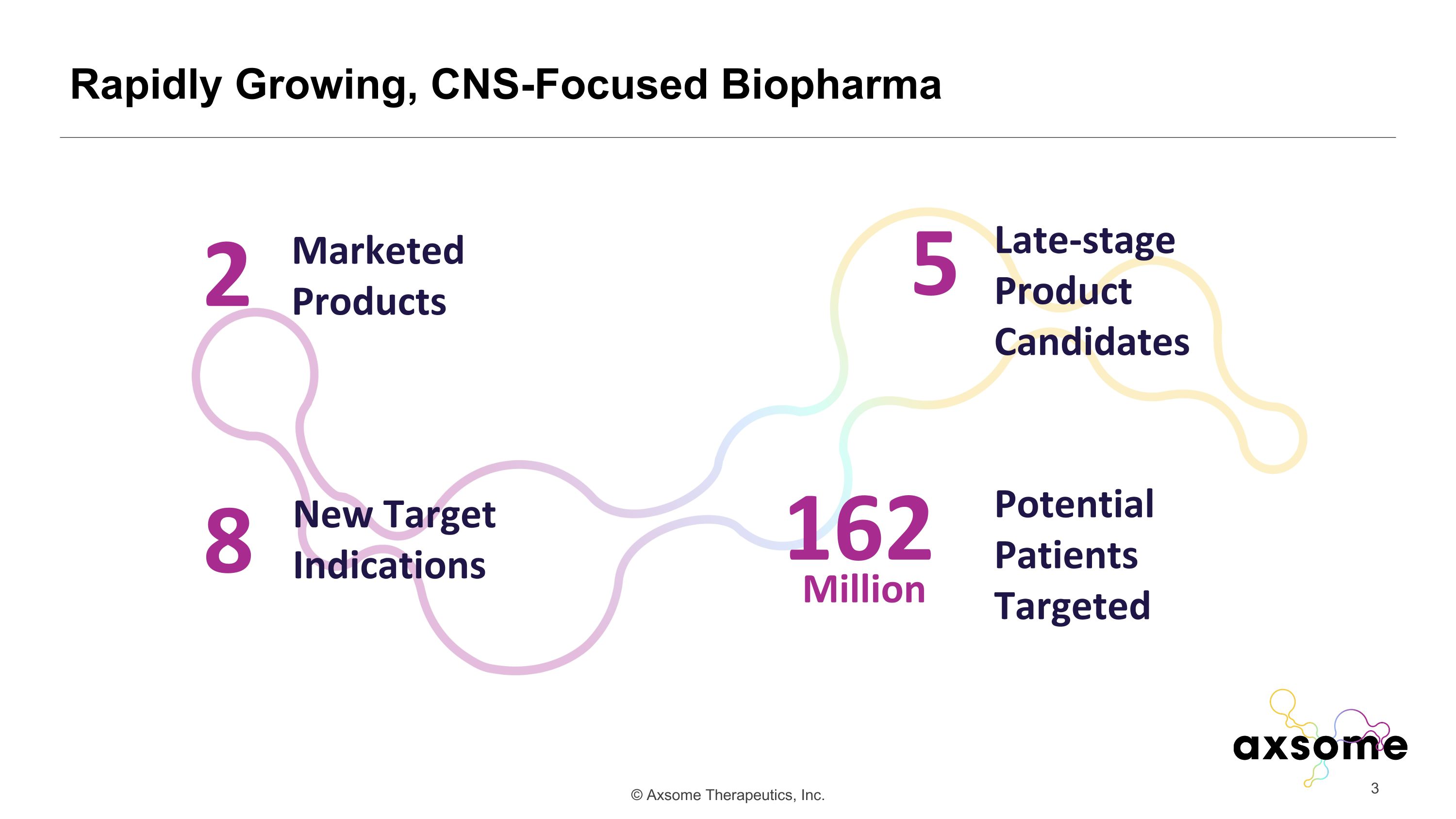
快速增長、專注於 CNS 的 Biopharma 2 上市產品 8 種新靶向適應症 5 種後期候選產品 162 名潛在患者瞄準百萬人

領先的中樞神經系統組合第一階段第二階段第三階段保密協議上市縮寫:CNS = 中樞神經系統;MOA = 作用機制;NMDA = N-甲基-d-天冬氨酸;COX-2 = 環氧合酶-2;5-HT = 5-羥色胺;NE = 去甲腎上腺素。CYP2D6 = Cytochrome P450 Family 2 亞家族 D 成員 6;moseic = 分子溶解度增強包涵複合物請在 www.auvelity.com 上查看 Auvelity 的完整處方信息。請在 www.sunosi.com 上查看 Sunosi 的完整處方信息。阿爾茨海默氏病激動 (ADA) 戒煙注意力缺陷多動障礙 (ADHD) 偏頭痛發作性睡病纖維肌痛 AXS-05、AXS-07、AXS-12、AXS-14 和 solriamfetol 治療注意力缺陷多動障礙未獲美國食品藥品管理局批准,其安全性和有效性尚未確定重度抑鬱症 (MDD) 與發作性睡病或阻塞性睡眠呼吸暫停 (OSA) 暴飲暴食相關的白天過度嗜睡 (EDS) 障礙 (BED) 輪班工作障礙 (SWD) 產品 MOA NMDA 受體拮抗劑和 sigma-1 受體激動劑,氨基酮 CYP2D6 抑制劑 Dual-作用多巴胺和去甲腎上腺素再攝取抑制劑 (DNRI) 和 TAAR1 激動劑 NMDA 受體拮抗劑和 sigma-1 受體激動劑、氨基酮 CYP2D6 抑制劑 moseic COX-2 prefior. 抑制劑 + 5-HT1B/1D 激動劑高選擇性 NE 再攝取抑制劑對映體純化高選擇性 NE 再攝取抑制劑雙效多巴胺和去甲腎上腺素再攝取抑制劑服用抑制劑 (DNRI) 和 TAAR1 激動劑 FDA 突破性療法稱號 FDA 孤兒藥稱號 AXS-05 AXS-07 solriamfetol AXS-12 AXS-14

已上市和後期中樞神經系統產品組合有可能影響超過1.62萬美國患者的生活 17 M 34 M 185 K 4 M 37 M 5 M ADHD 偏頭痛 22 M 21 M 纖維肌痛發作性睡病 OSA MDD 戒煙 AD 激動縮寫:MDD = 重度抑鬱症;OSA = 阻塞性睡眠呼吸暫停;AD = 阿爾茨海默病;注意力缺陷多動障礙;BED = 暴飲暴食障礙;SWSD = 輪班工作障礙 7 M BED 15 M SWD
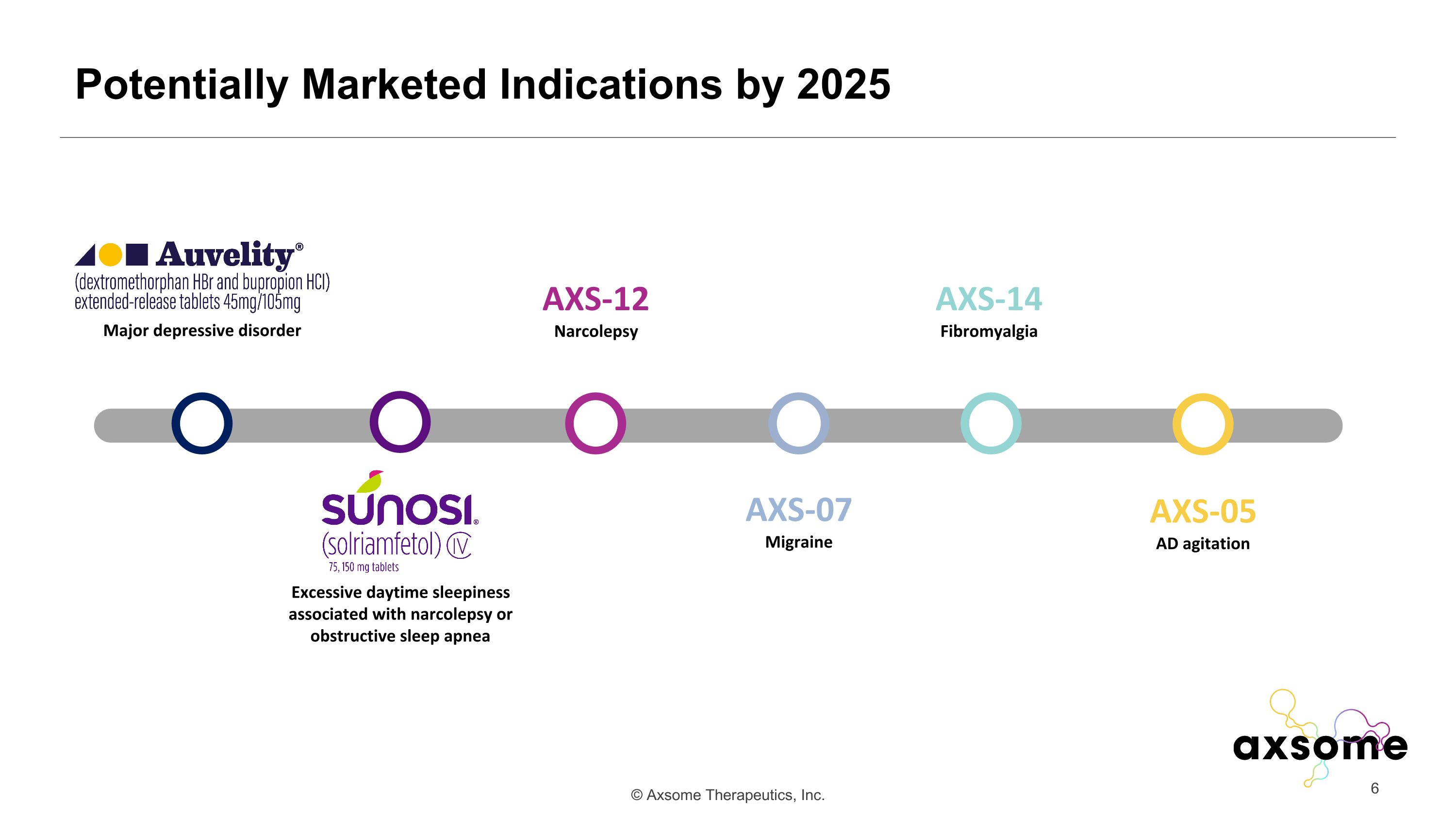
到 2025 年可能上市的適應症 AXS-14 纖維肌痛 AXS-07 偏頭痛 AXS-05 AD 激動 AXS-12 Narcolepsy 重度抑鬱症與發作性睡病或阻塞性睡眠呼吸暫停相關的白天過度睡眠

已上市的產品
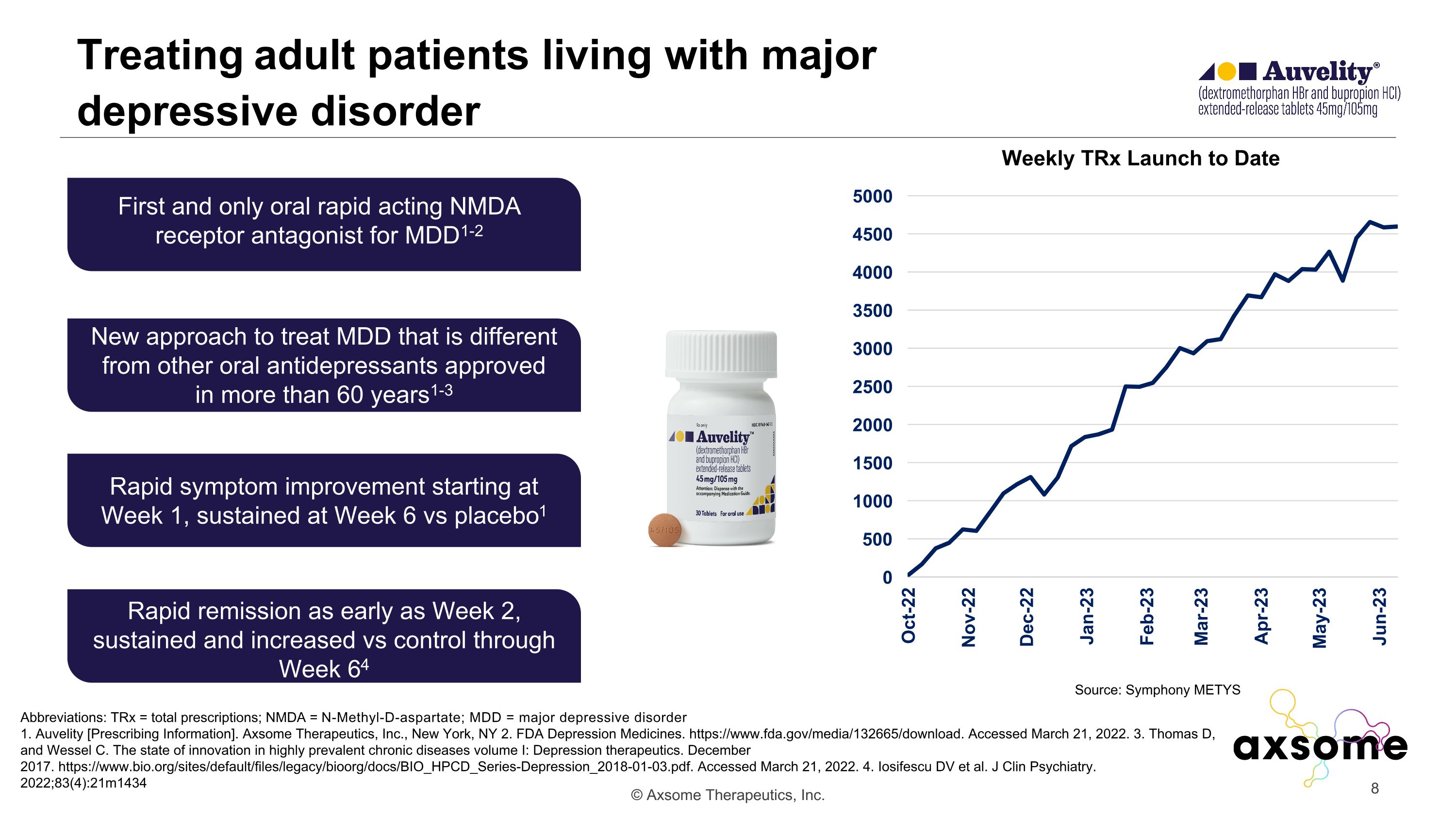
治療患有重度抑鬱症的成年患者縮寫:tRx = 處方總數; NMDA = n-甲基-d-天冬氨酸; MDD = 重度抑鬱症 1.Auvelity [處方信息]。Axsome Therapeutics, Inc.,紐約州紐約 2.美國食品藥品管理局抑鬱藥物。https://www.fda.gov/media/132665/download。已於 2022 年 3 月 21 日訪問。3.Thomas D 和 Wessel C. 高度流行的慢性病的創新狀況第一卷:抑鬱症療法。2017 年 12 月。https://www.bio.org/sites/default/files/legacy/bioorg/docs/BIO_HPCD_Series-Depression_2018-01-03.pdf。已於 2022 年 3 月 21 日訪問。4.Iosifescu DV 等人J Clin Psychiatry。2022;83 (4): 21m1434 第一種也是唯一一種用於 MDD1-2 的口服速效 NMDA 受體拮抗劑 MDD 的新治療方法不同於 60 多年來批准的其他口服抗抑鬱藥1-3 從第 1 周開始症狀迅速改善,在第 6 周持續緩解 vs 安慰劑 1 最早在第 64 周持續緩解,與控制相比持續並增加來源:Symphony METYS 迄今為止每週發佈一次 TRx
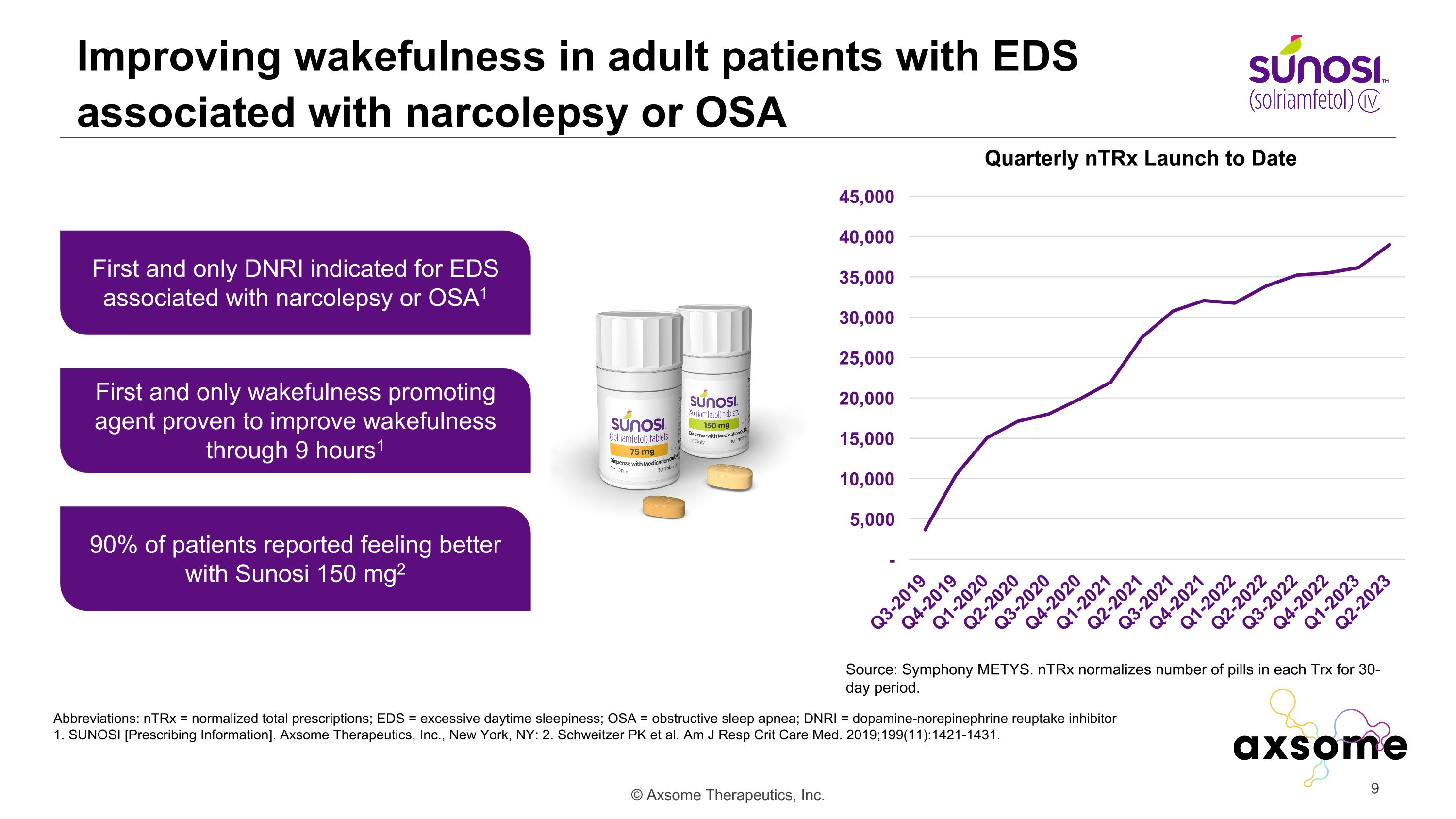
改善與發作性睡病或 OSA 相關的 EDS 成年患者的清醒度縮寫:ntRx = 標準化處方總數;EDS = 白天睡眠過度;OSA = 阻塞性睡眠呼吸暫停;DNRI = 多巴胺-去甲腎上腺素再攝取抑制劑 1。SUNOSI [處方信息]。Axsome Therapeutics, Inc.,紐約州紐約:2.Schweitzer PK 等人Am J Resp Crit Care Med. 2019;199 (11): 1421-1431。第一個,也是唯一一個 DNRI 適用於與發作性睡病相關的 EDS 或 OSA1 90% 的患者報告説,使用 Sunosi 150 mg2 感覺好多了第一種也是唯一一種被證明可以在 9 小時內改善清醒狀態的清醒促進劑1 迄今為止每個 Trx 的藥丸數量:Symphony METYS。ntrX 在 30 天內使每個 Trx 中的藥丸數量正常化。

開發管道

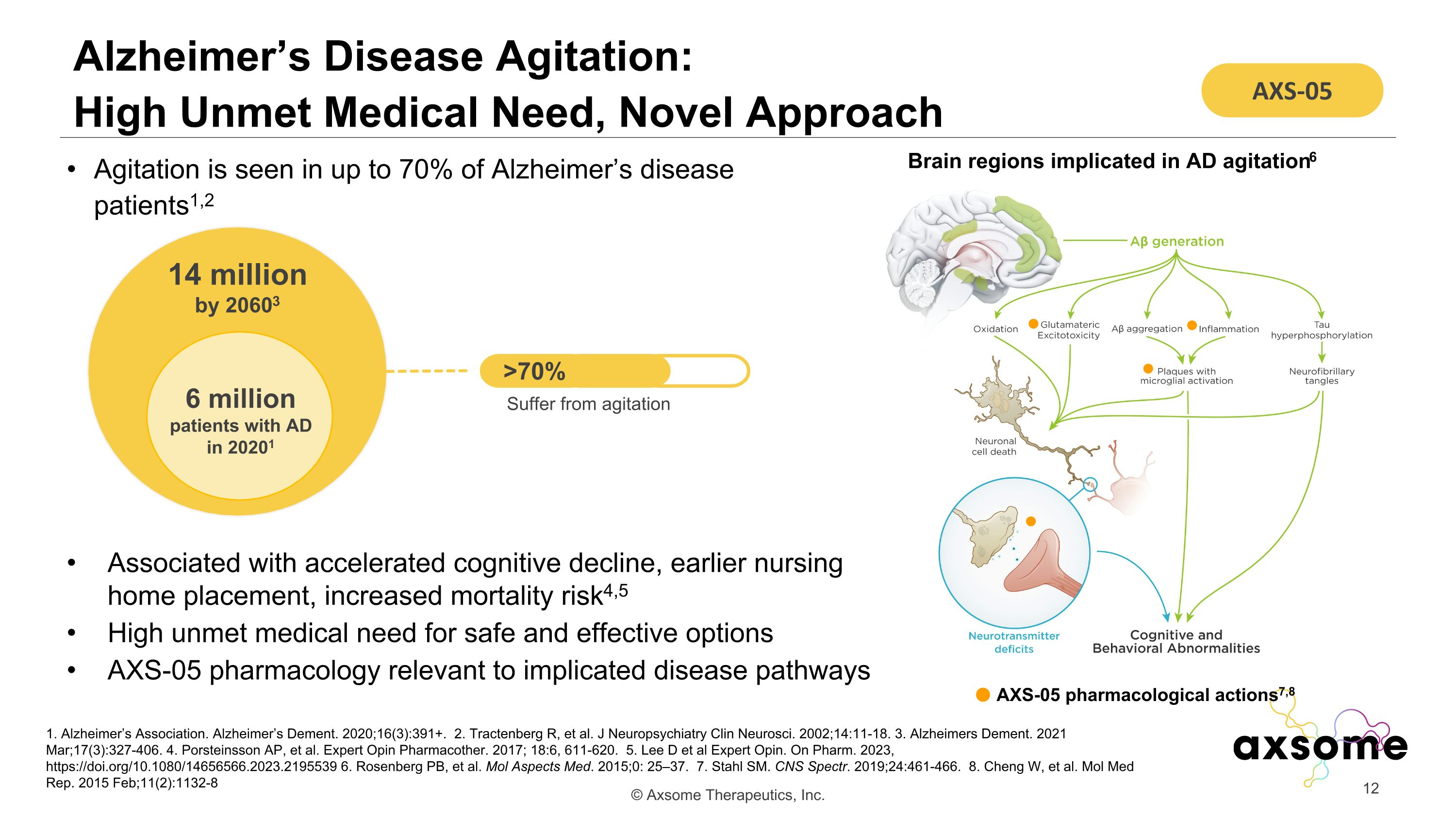
阿爾茨海默氏病激動:醫療需求未得到滿足,新方法 1.阿爾茨海默氏症協會。阿爾茨海默氏痴呆症。2020;16 (3): 391+。2.Tractenberg R 等人J. 神經精神病學 Clin Neurosci。2002;14:11-18。3.Alzheimers Dement。2021 年 3 月;17 (3): 327-406。4.Porsteinsson AP 等人Expert Opin Pharmacther。2017;18:6,611-620。5.Lee D 等人 Expert Opin。在 Pharm. 2023 上,https://doi.org/10.1080/14656566.2023.2195539 6.Rosenberg PB 等Mol Aspects Med. 2015;0:25—37。7.Stahl SM.CNS Spectr. 2019;24:461-466。8.Cheng W 等Mol Med Rep. 2015 年 2 月;11 (2): 1132-8 高達 70% 的阿爾茨海默氏病患者出現焦慮1,2 與認知能力加速下降、提早安置療養院、死亡風險增加有關 4,5 對安全有效選擇的醫療需求很高 AXS-05 藥理學與相關疾病途徑有關 AXS-05 藥理作用 7,8 與 AD 激動有關的大腦區域 2021 年 6 000 萬 AD 患者 14 到 20603 年,百萬人 > 70% 飽受激動之苦 AXS-05
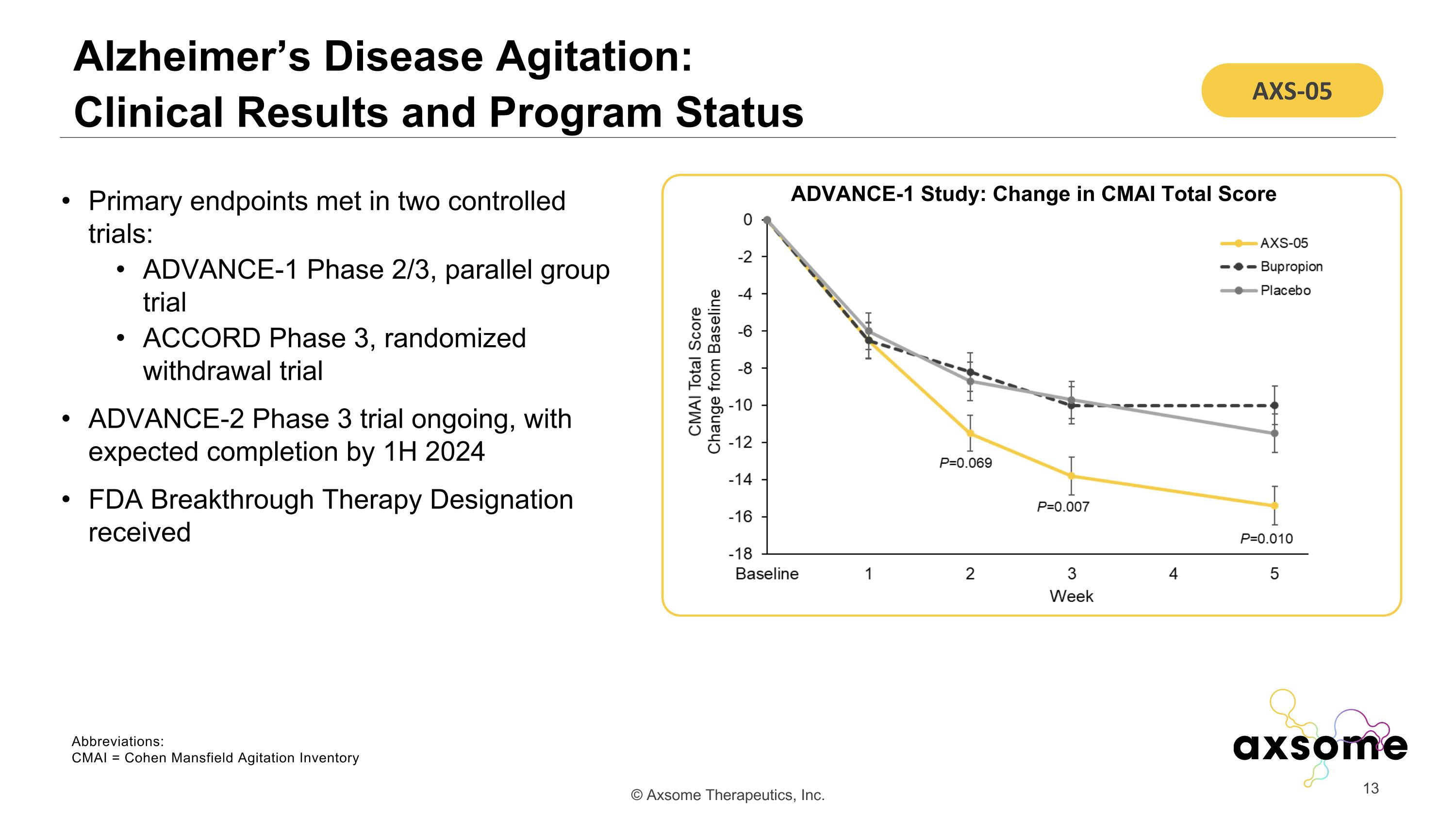
阿爾茨海默氏病激動:臨牀結果和項目狀態在兩項對照試驗中達到主要終點:ADVANCE-1 2/3 期、平行小組試驗 ACCORD 3 期、隨機戒斷試驗 ADVANCE-2 3 期試驗正在進行中,預計於 2024 年上半年完成 FDA 突破性療法稱號 ADVANCE-1 研究:CMAI 總分變化 AXS-05 縮寫:CMAI = Cohen Mansfield 激動清單
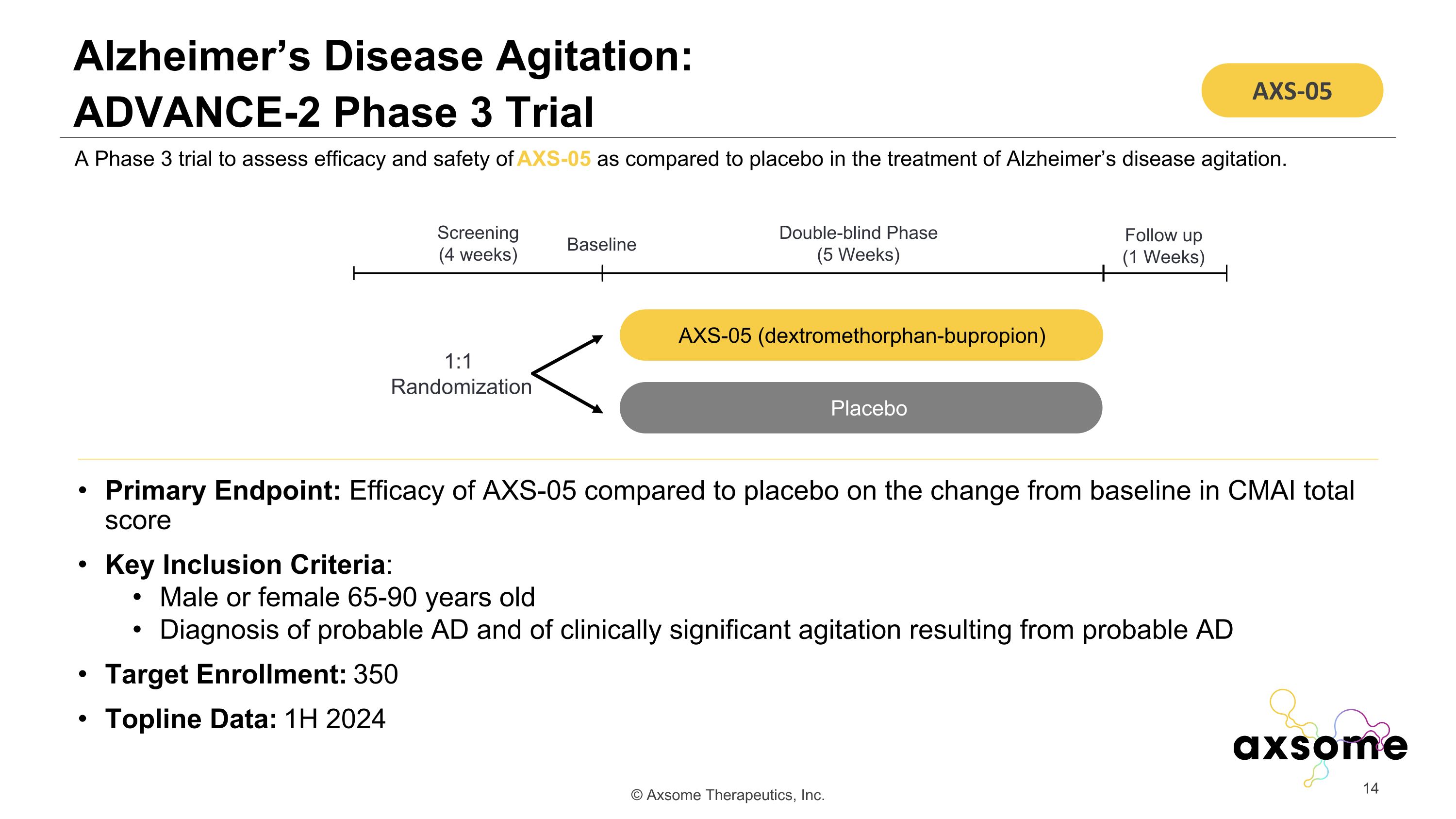
阿爾茨海默病激動:ADVANCE-2 3 期試驗主要終點:AXS-05 與安慰劑相比對 CMAI 總分與基線相比的療效關鍵納入標準:65-90 歲的男性或女性診斷可能的 AD 和可能的 AD 目標入組引起的臨牀顯著性躁動:350 Topline 數據:1H 2024 AXS-05 每天兩次 AXS-05(右美沙芬-安非他酮)安慰劑 A 3 期試驗,旨在評估 AXS-05 的療效和安全性與治療阿爾茨海默病焦慮的安慰劑相比。雙盲階段(5 周)篩查(4 周)1:1 隨機隨訪(1 周)基線 AXS-05

在美國,吸煙是可預防死亡的最大原因1 70%的吸煙者希望戒煙2 只有3-5%的吸煙者在沒有幫助的情況下成功戒煙6至12個月2 戒煙縮寫:NMDA = N-甲基d-天冬氨酸美國衞生與公共服務部。吸煙對健康的影響:50年的進步。《外科醫生報告》,2014年。Hughes JR 等人成癮。2004;99 (1): 29-38 AXS-05 代表了一種潛在的新戒煙作用機制 FDA 從美國食品藥品管理局收到的 inD 前會議指導方針 — 可以繼續進行關鍵的 2/3 期試驗計劃於 2023 年第四季度或 2024 年第一季度啟動試驗 Fast Facts AXS-05 關鍵更新 AXS-05

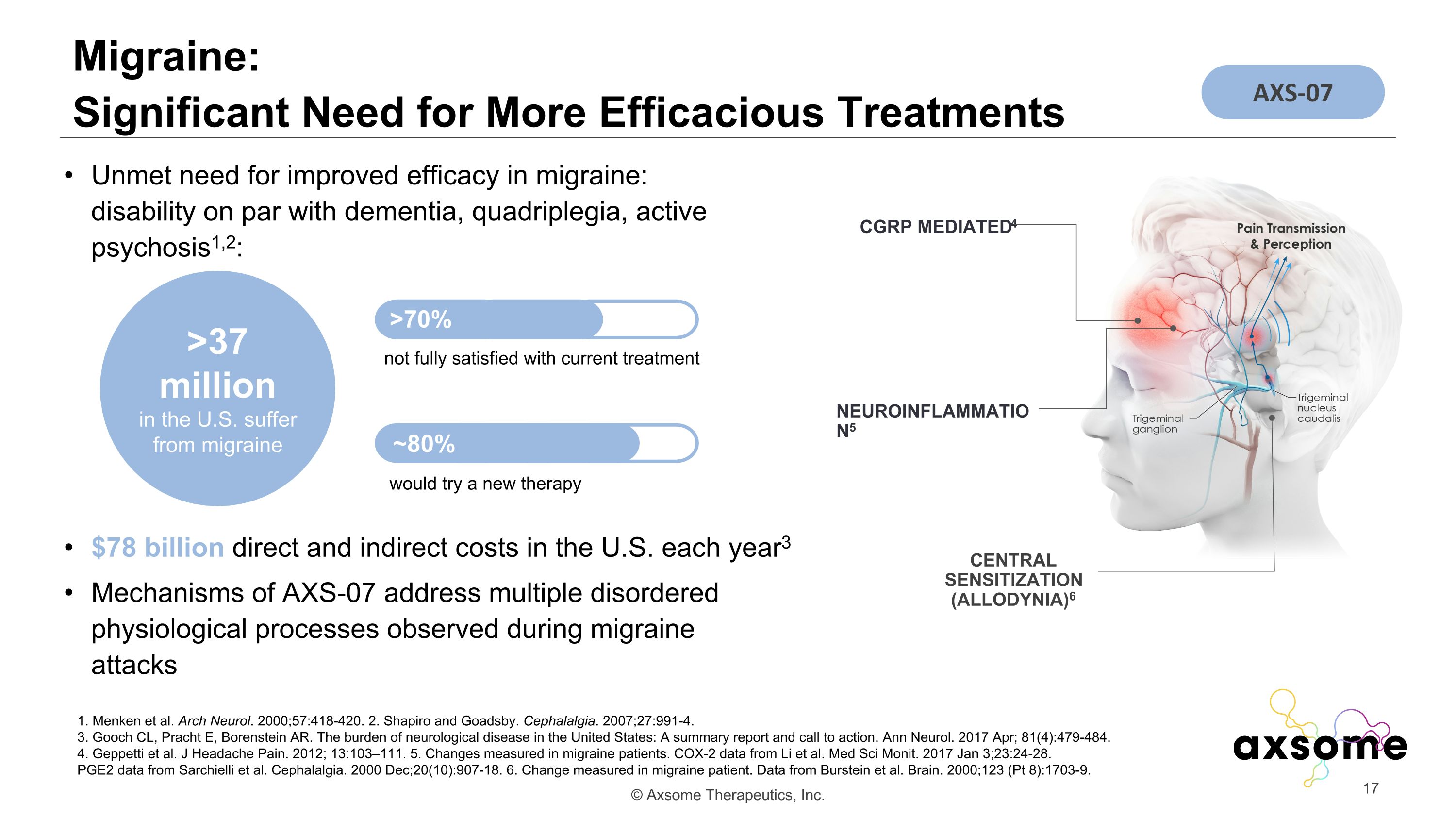
偏頭痛:迫切需要更有效的治療方法 1.Menken 等。Arch Neurol。2000;57:418-420。2.Shapiro 和 Goadsby。Cephalgia。2007;27:991-4。3.Gooch CL、Pracht E、Borenstein AR。美國神經系統疾病的負擔:摘要報告和行動呼籲。Ann Neurol。2017 年 4 月;81 (4): 479-484。4.Geppetti 等人。J Hearking Pain。2012;13:103 —111。5.在偏頭痛患者中測得的變化。來自 Li 等人的 COX-2 數據Med Sci Monit。2017 年 1 月 3 日;23:24-28。來自 Sarchielli 等人的 PGE2 數據Cephalgia。2000 年 12 月;20 (10): 907-18。6.在偏頭痛患者中測得的變化。數據來自 Burstein 等人Brain。2000;123(Pt 8): 1703-9。美國每年有 780 億美元的直接和間接成本 3 提高偏頭痛療效的需求未得到滿足:殘疾與痴呆、四肢癱瘓、活動性精神病相提並論1,2:超過3700萬美國人患有偏頭痛 > 70% ~ 80% 對當前治療不完全滿意會嘗試新療法 CGRP Mediated4 Central Aldigent4 Allodynia(Allodynia)6 機制 of AXS-07 解決了偏頭痛發作期間觀察到的多種失調/生理過程 NEUROINFLAMMATION5 AXS-07
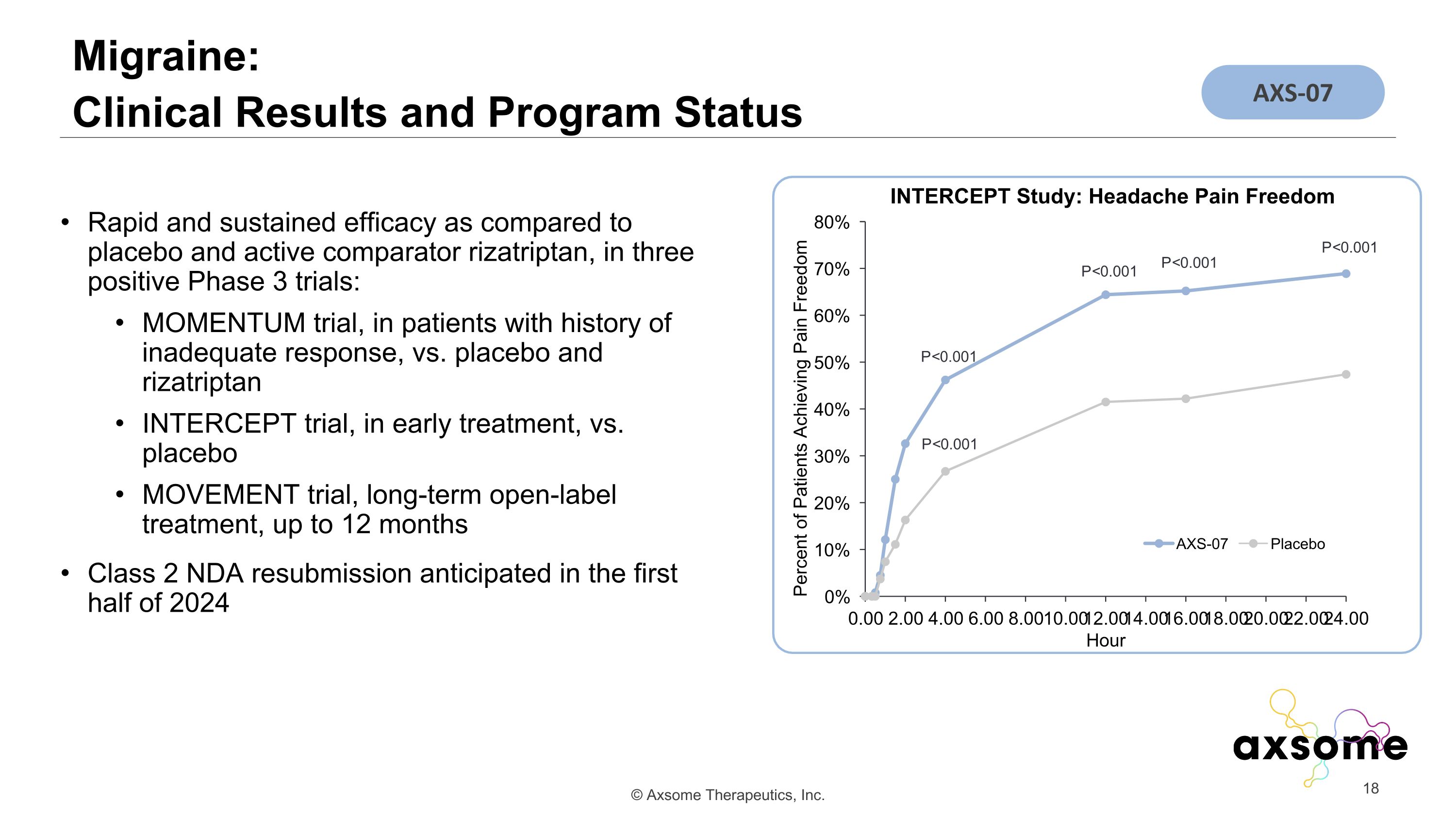
偏頭痛:臨牀結果和項目狀態 P

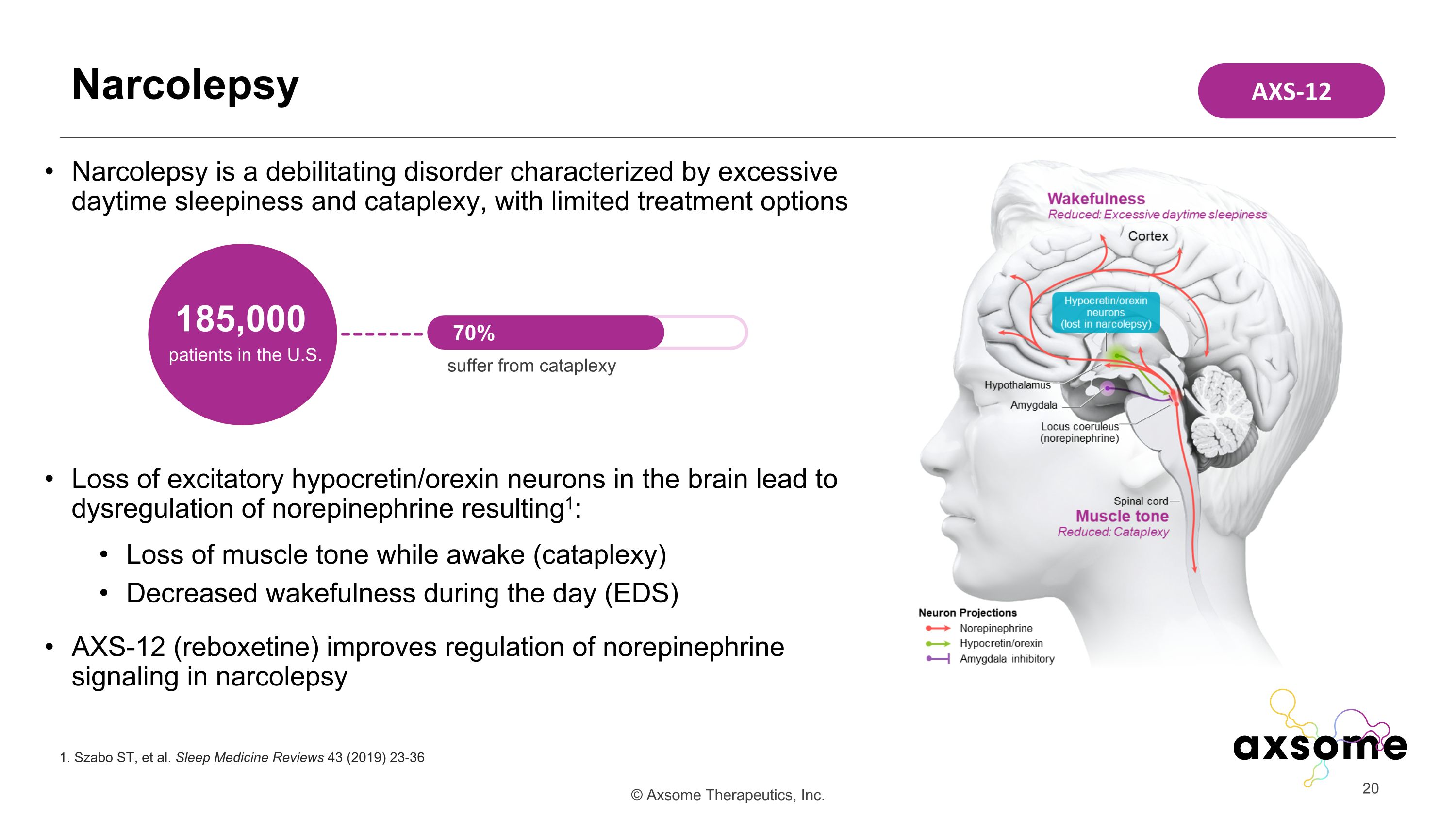
發作性睡病是一種以白天過度睡眠和過度癱瘓為特徵的虛弱性疾病,治療選擇有限,大腦中興奮性下胰腺素/食慾素神經元的喪失會導致去甲腎上腺素失調導致 1:醒着時肌肉張力下降(cataplexy)白天覺醒降低(EDS)AXS-12(瑞波西汀)可改善去甲腎上腺素的調節發作性睡病中的信號傳導發作性睡病 1.Szabo ST 等人睡眠醫學評論 43 (2019) 23-36 美國 18.5 萬名患者 70% 患有 cataplexy AXS-12
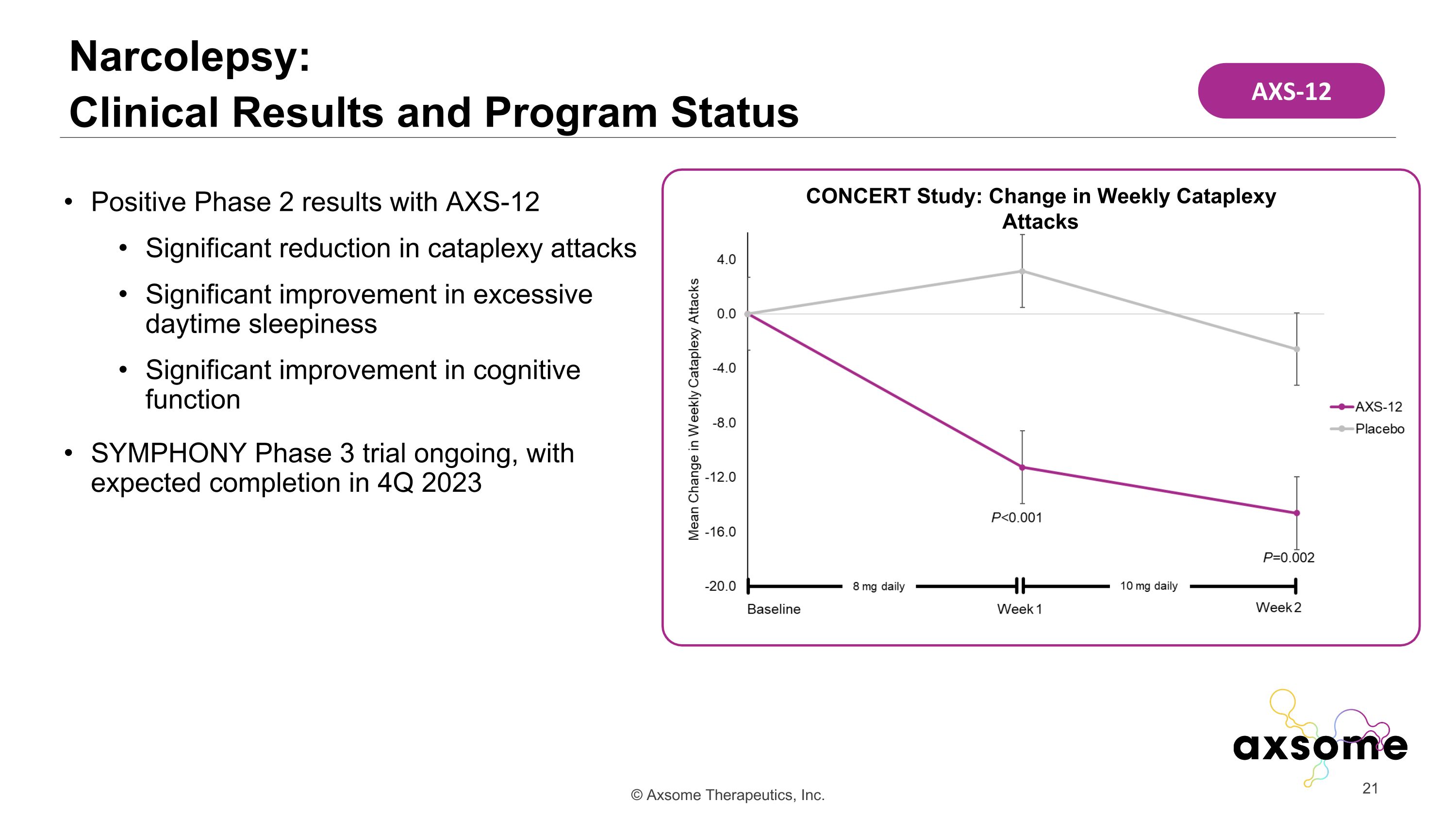
AXS-12 的 2 期結果呈陽性 cataplexy 發作顯著減少 cataplexy 發作顯著改善 SYMPHONY 3 期試驗正在進行中,預計將於 2023 年第四季度完成 Narcolepsy: 臨牀結果和項目狀態音樂會研究:每週的 Cataplexy 攻擊變化 AXS-12
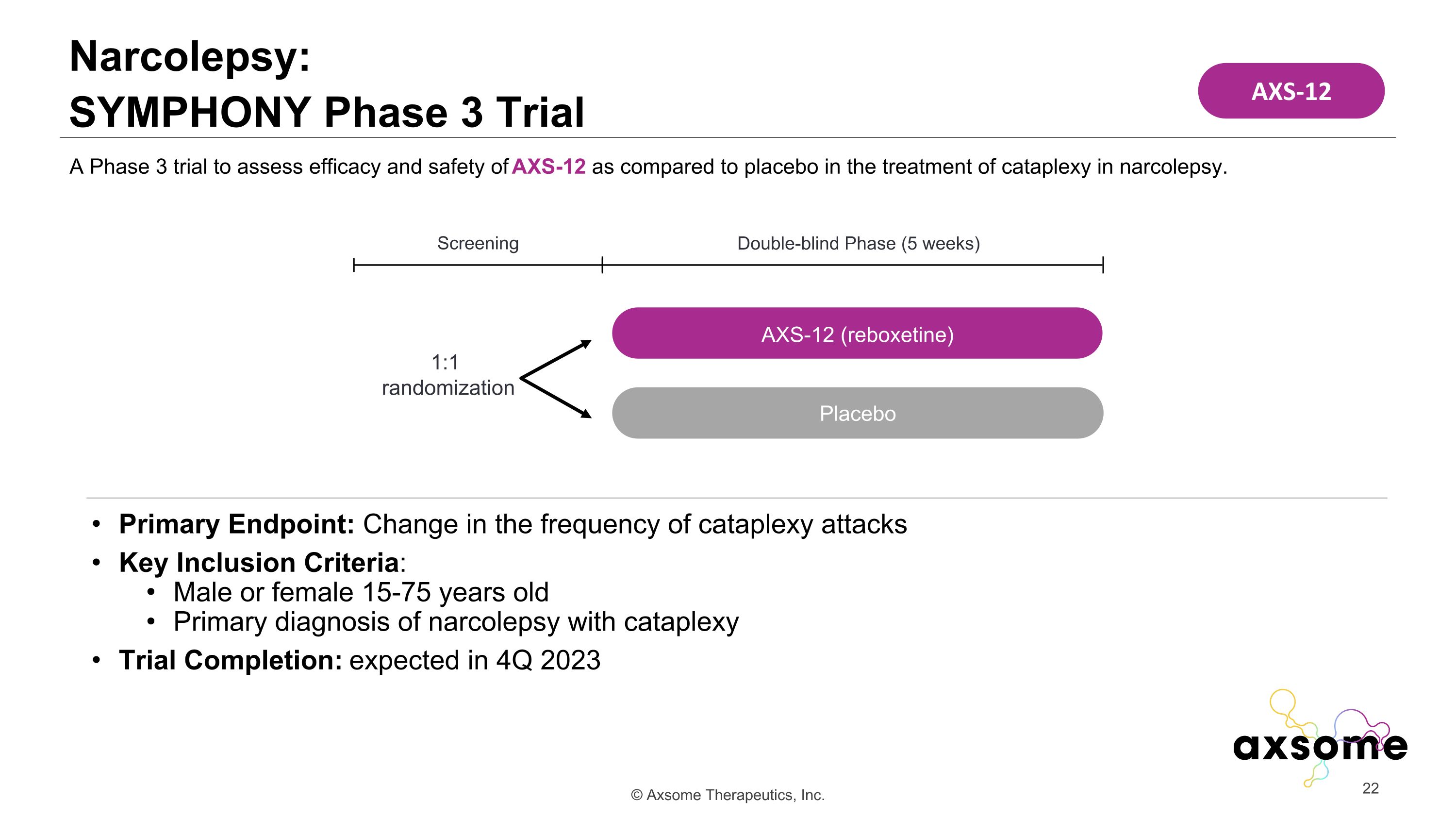
主要終點:突發性發作頻率的變化關鍵納入標準:男性或女性 15-75 歲 15-75 歲發作性睡病的主要診斷為突發性睡病試驗完成:預計在 2023 年第 4 季度進行一項第 3 期試驗,旨在評估 AXS-12 在治療發作性睡病中與安慰劑相比的療效和安全性。雙盲階段(5 周)篩查 1:1 隨機分組 AXS-12(reboxetine)安慰劑 AXS-12 narcolepsy: Symphony 第 3 階段試驗

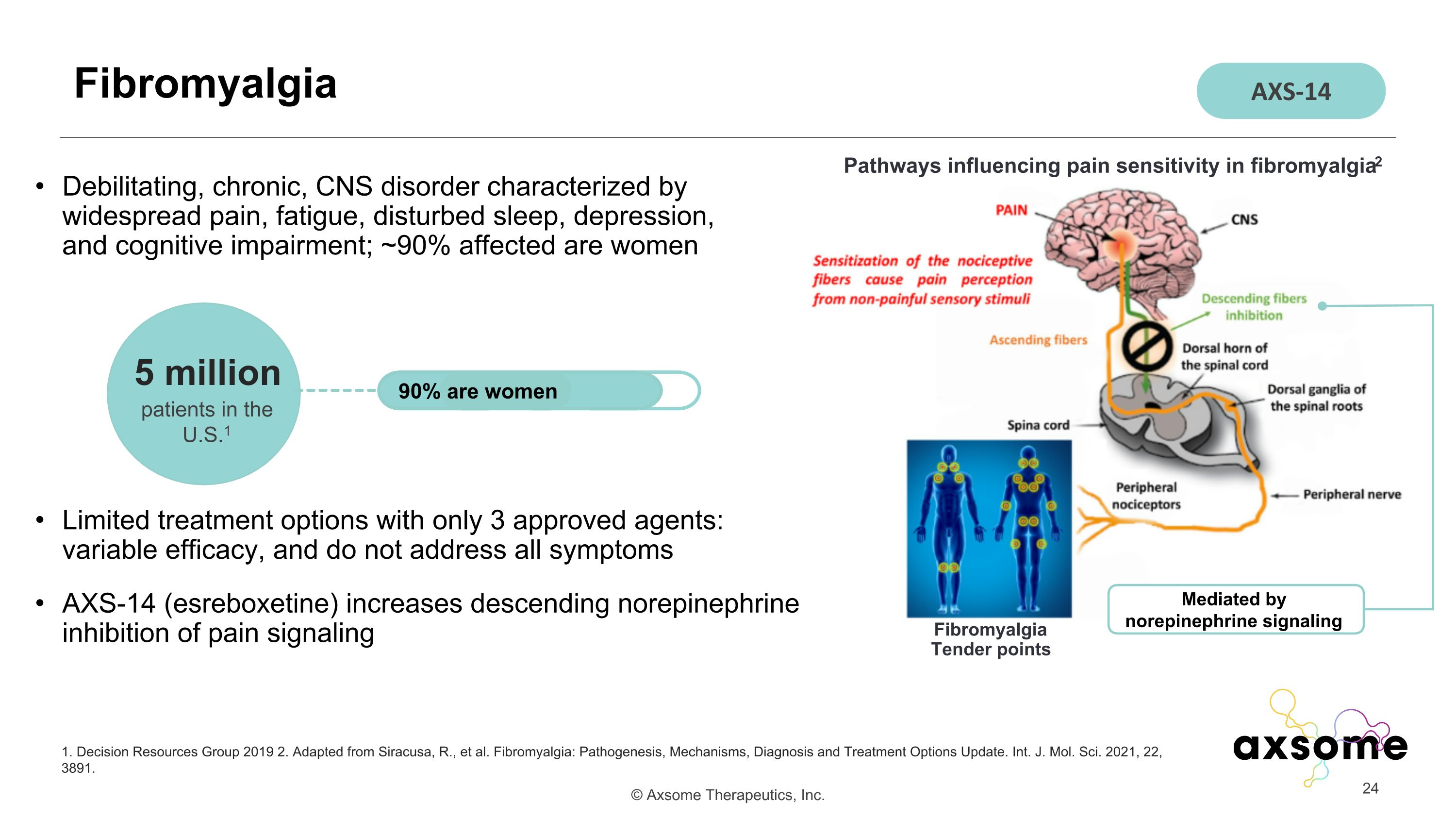
使人衰弱的慢性中樞神經系統疾病,其特徵是廣泛的疼痛、疲勞、睡眠障礙、抑鬱和認知障礙;大約 90% 的受影響是女性,只有 3 種經批准的藥物的治療選擇有限:療效各不相同,無法解決所有症狀 AXS-14(esreboxetine)增加去甲腎上腺素對疼痛信號的抑制下降纖維肌痛 1.2019 年決策資源小組 2.改編自 Siracusa、R. 等人。纖維肌痛:發病機制、機制、診斷和治療方案更新。整數。J.MolSci. 2021、22、3891。美國 500 萬患者1 90% 是女性影響纖維肌痛疼痛敏感性的途徑2 由去甲腎上腺素信號介導纖維肌痛 Tender points AXS-14
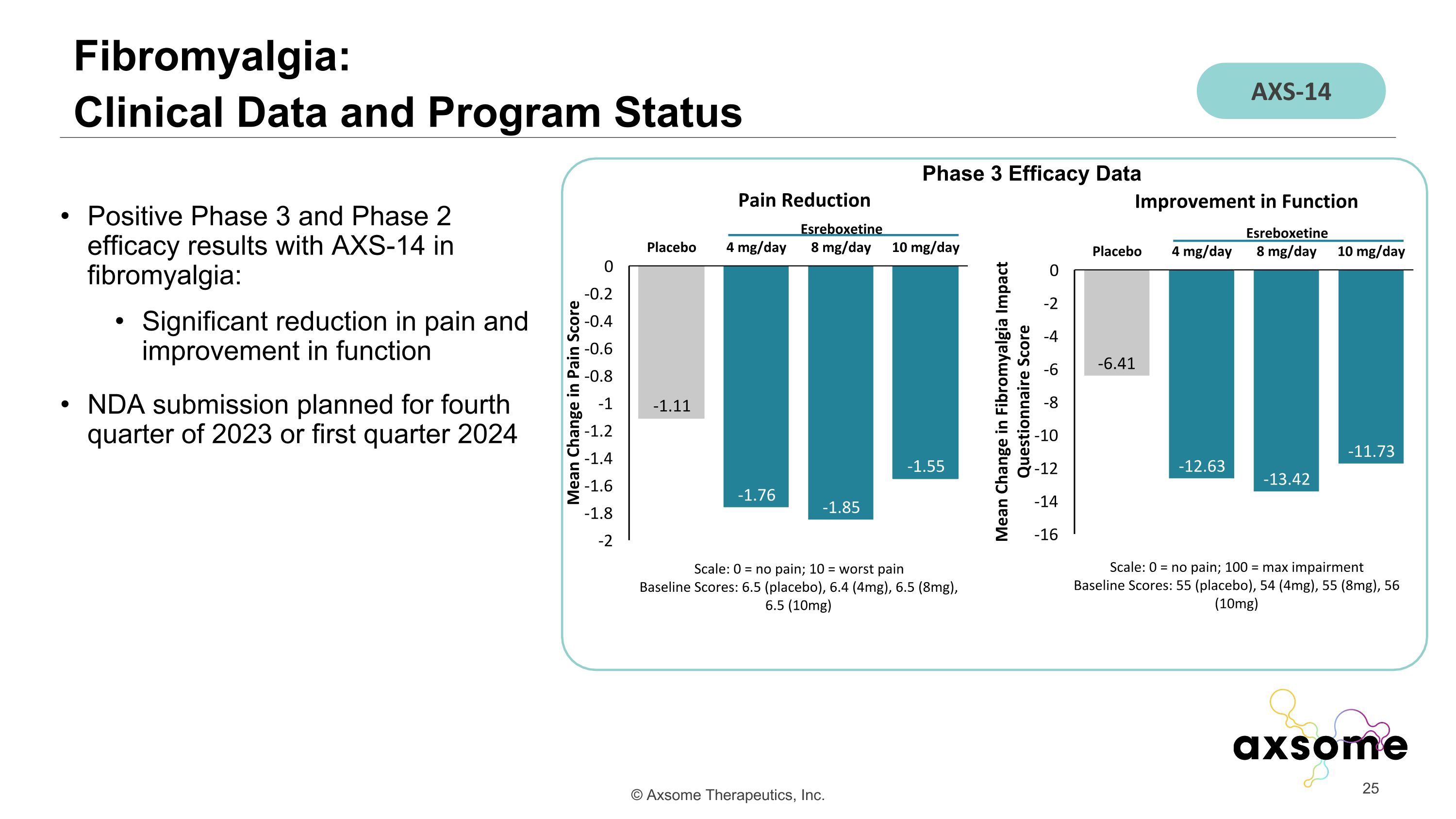
AXS-14 治療纖維肌痛的 3 期和 2 期療效結果呈陽性:計劃於 2023 年第四季度或 2024 年第一季度提交的 NDA 顯著減輕疼痛並改善功能 Fibromyalgia:臨牀數據和項目狀態 AXS-14 第 3 期療效數據

Solriamfetol 是治療中樞神經系統疾病的潛在差異化選擇

注意力缺陷多動障礙是一種以注意力不集中、多動或衝動為特徵的嚴重疾病,與社交、學術和職業功能或發育嚴重受損有關 Solriamfetol 靶向與 ADHD3 注意力缺陷多動障礙 1 有關的大腦神經遞質通路。Kessler RC 等人美國成人注意力缺陷多動障礙的患病率和相關性:全國合併症調查複製的結果。Am J Psychiatry。2006 年 4 月;163 (4): 716-23。2.Bitsko RH 等人兒童心理健康監測——美國,2013—2019 年。MMWR 補編 2022;71 (2): 1-48。3.Faraone、S.V. 等人注意力缺陷/多動障礙。納特。Dis. Rev.Primers。2015 美國有 1740 萬人患有注意力缺陷多動障礙 600 萬 youth2 1140 萬成年人 1 神經遞質途徑與 ADHD1 solriamfetol 有關

注意力缺陷多動障礙:FOCUS 3期試驗主要終點:成人注意力缺陷多動障礙研究者症狀報告量表(AISRS)的變化主要納入標準:成人,年齡在18至55歲之間。使用 DSM-5 標準對注意力缺陷多動障礙(注意力不集中、過度活躍或合併亞型)進行初步診斷,並通過臨牀醫生給藥 ACDS 目標招生人數:450 Topline 數據:2H 2024 AXS-05 每天兩次 Solriamfetol(150 mg)安慰劑雙盲期(6 周)篩查(5 周)1:1:1 隨機化隨訪(1 周)基線 A 期試驗,以評估 solriamfetol 的療效和安全性與治療注意力缺陷多動障礙的安慰劑相比。Solriamfetol (300 mg) solriamfetol

CNS投資組合有可能在美國東部時間實現高達115億美元的總銷售額峯值。美國銷售峯值關鍵亮點與OSA和發作性睡病相關的EDS 10-30億美元 0.5-10億美元 0.5-10億美元 0.5-10億美元 15億美元至30億美元 2025年美國東部時間2025年美國東部時間2025年美國東部時間2025年美國東部時間2025年快速而顯著的療效,早在第11周,60年來首款口服抗抑鬱藥具有新的MOA1-4 第一個也是唯一一個改善清醒的藥物在 9 小時內保持清醒狀態5 美國食品藥品管理局首次批准使用雙效 DNRI 來治療 OSA 或發作性睡病 EDS 快速且效果顯著,早在第 2 周,沒有相關的認知障礙或鎮靜劑快速而穩定緩解症狀復發減少 cataplexy、EDS 和認知功能改善緩解疼痛,改善功能並對疲勞有影響待定 10億美元 3 期試驗正在進行中;預計在 2024 年 2 月 AXS-05 AXS-07 AXS-12 Solriamfetol AXS-14 阿爾茨海默氏病激動偏頭痛發作性睡病 Fibromylagia MDD ADHD AXS-05 戒煙代表一種潛在的新戒煙作用機制計劃於 2023 年第四季度啟動 2/3 期試驗或者 2024 年第一季度待定 0.5-10 億美元 Auvelity 和 Sunosi 裁判分別出現在幻燈片 8 和 9 上。請在 www.auvelity.com 上查看 Auvelity 的完整處方信息。請在 www.sunosi.com 上查看 Sunosi 的完整處方信息。

強大的知識產權和進入壁壘 >120 項已頒發的美國專利和 >70 項已頒發的 O-U.S.PatentsClaiments 的申請延期至少 2034-43 年;多項待處理的專有藥物配方 >85 項已頒發的美國專利,>103 項已頒發的美國專利PatentsClaims 有效期至少 2038 年;多項待審專有 MoseicTM 配方和藥品配方 Orphan drug 指定 6 項已頒發專利;申請有效期至少 2040 年;多項待處理的專有藥物和藥品配方受強大專利財產的保護,至少延伸至 2040 年/允許提出索賠 2042;多種待處理的專有藥物和藥品配方 AXS-05 AXS-07 AXS-12 AXS-14

財務快照現金餘額:(截至2023年6月30日)債務(面值):(截至2023年6月30日)市值:(截至2023年8月4日)已發行股票:(截至2023年6月30日)期權、限制性股票單位和未償還認股權證1:1 包括793萬份期權、78萬個限制性股權單位和0.08億美元認股權證 4.371 億美元 340 萬美元 46.7 萬美元根據當前的運營計劃,Runway的現金流將達到正值預測現金餘額——4.688億美元
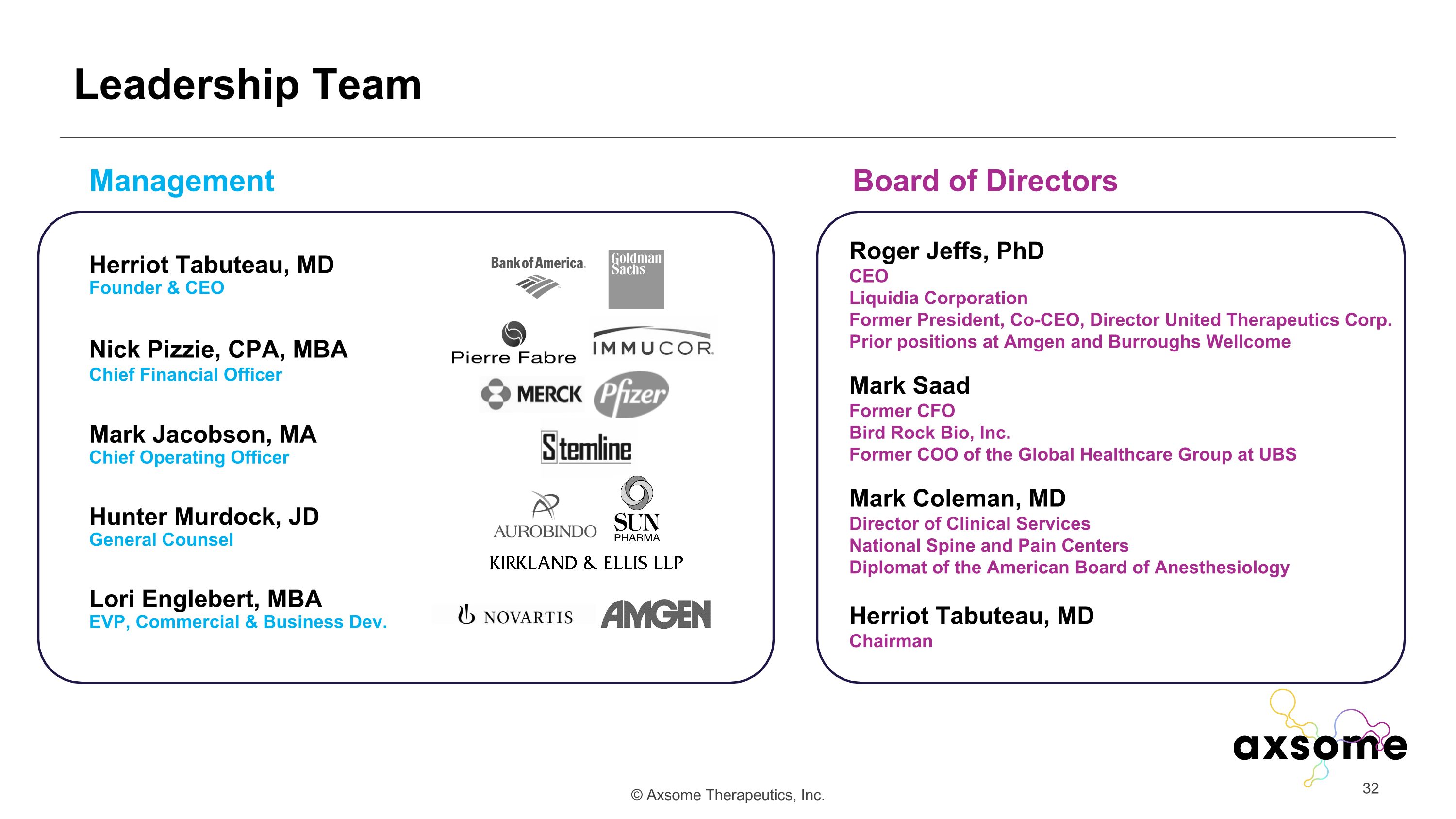
領導團隊 Roger Jeffs,phdCeoliquidia Corporations前總裁、聯席首席執行官、董事曾在安進和巴勒斯惠康任職馬克·薩德前首席財務官 Bird Rock Bio, Inc. 瑞銀全球醫療集團前首席運營官馬克·科爾曼、醫學博士國家脊柱和疼痛中心主任美國麻醉學委員會外交官 Herriot Tabuteau、醫學博士赫裏奧特·塔布託、醫學博士赫裏奧特·塔布託 teau,md創始人兼首席執行官 Nick Pizzie、註冊會計師、mbachief 財務官馬克·雅各布森、machiEF 運營官 Hunter Murdock、京東總法律顧問 LoriEnglebert,MBAEVP,商業與商業開發部管理董事會

預計即將到來的臨牀和監管里程碑監管和商業臨牀試驗讀數臨牀試驗啟動 AXS-05 戒煙的 2/3 期試驗,啟動 — 2023 年第 4 季度或 2024 年第 1 季度 AXS-12 SYMPHONY 3 期發作性睡病試驗,完成 — 2023 年 4 季度 AXS-05 ADVANCE-2 阿爾茨海默氏病激動的 3 期試驗,完成 — 2024 年 1 月 AXS-07 偏頭痛 NDA,計劃重新提交 — 2024 年 1 月 AXS-14 Fibromyalgia NDA,計劃提交 — 4Q 2023 年或 2024 年 1 季度 solriamfetol FOCUS 成人注意力缺陷多動障礙第 3 期試驗,已完成 — 2H 2024 solriamfetol 第 3 階段暴飲暴食症試驗 — 2023 年第 4 季度 solriamfetol 輪班工作障礙第 3 期試驗 — 2024 年第 1 季度

快速增長、專注於 CNS 的 Biopharma 2 上市產品 8 種新靶向適應症 5 種後期候選產品 162 名潛在患者瞄準百萬人

欲瞭解更多信息,請聯繫:mark jacobson首席運營官 212-332-3243 mjacobson@axsome.com www.axsome.com 謝謝