附錄 99.1
Belite Bio 公佈了 2023 年第二季度運營亮點和財務業績
| · | 完成了針對Tinlarebant治療青少年斯塔加特病(“STGD1”)的關鍵3期 “DRAGON” 試驗的註冊,在全球11個國家註冊了100名受試者 |
| · | 在《地理萎縮》(“GA”)的關鍵全球 第三階段 “PHOENIX” 試驗中,第一位受試者服用了 Tinlarebant |
| · | 在第 2 期 STGD1 試驗(“LBS-008-CT02”)中,口服,每天一次的 Tinlarebant 仍然安全且耐受性良好,減緩了自發熒光的擴張,降低了入射萎縮性視網膜病變的生長速度,並將 視力穩定到 18 個月 |
| · | 承銷公開發行總收益為3000萬美元 ,資產負債表得到加強 |
| · | STGD1 中 LBS-008-CT02 的最終 2 年數據預計將於 2023 年第四季度公佈,關鍵的 “DRAGON” 試驗的 3 期臨時安全性和有效性數據預計將於 2024 年中期公佈 |
| · | 電話會議和網絡直播,美國東部時間 2023 年 8 月 9 日星期三下午 4:30 |
聖地亞哥,2023年8月8日——Belite Bio, Inc.(納斯達克股票代碼: BLTE)(“Belite” 或 “公司”)是一家臨牀階段的生物製藥藥物開發公司,專注於推進 針對有大量未滿足醫療需求的視網膜退行性眼病的新療法,今天公佈了截至2023年6月30日的三個月財務 業績,並提供了總體業務最新情況。
Belite董事長兼首席執行官湯姆·林博士説:“我們將繼續執行關鍵的里程碑,並在Tinlarebant的後期項目中取得重大進展,Tinlarebant是一種每天一次的視網膜退行性疾病的口服治療方法,包括 STGD1 和 GA。”“除了完成青少年 STGD1 關鍵的 DRAGON 試驗的註冊外,我們很高興在我們的 GA 關鍵的 PHOENIX 試驗中給了第一個受試者。在接下來的12-18個月中,我們有幾個潛在的 轉折點,預計 LBS-008-CT02 的最終 2 年數據將在今年第四季度 公佈,而我們關鍵的 DRAGON 試驗的第三階段臨時安全性和有效性數據將於 2024 年中公佈。”
Belite Bio 首席科學官Nathan L. Mata博士補充説:“在Tinlarebant 的 2 期 STGD1 試驗中,病變生長放緩和視力穩定長達 18 個月,這令人鼓舞,也增強了治療其他視網膜退行性疾病(例如 GA)的潛力。像 fenretinide 這樣的口服維生素 A 方法此前已證明有望治療 GA,但由於芬雷替尼的 生物利用度和效力差,僅限於一部分患者。我們相信,Tinlarebant的化學設計克服了與芬雷替尼相關的有限效力和生物利用度 ,有可能在更廣泛的患者羣體中提高療效結果,更具選擇性的 靶向以提高安全性。”
2023 年第二季度業務亮點和即將到來的里程碑:
臨牀亮點
Tinlarebant (LBS-008) 被設計為一種口服、強效的 每日一次視黃醇結合蛋白 4 (RBP4) 拮抗劑,可降低血液中的 RBP4 水平,選擇性地降低維生素 A (視黃醇) 向眼睛的輸送,而不會干擾視黃醇向其他組織的全身輸送。維生素 A 對正常視力至關重要,但可以積累 作為毒性副產物,導致視網膜細胞死亡和視力喪失疾病,例如 STGD1 和 GA,這是乾性年齡相關的 黃斑變性(幹 AMD)的高級形式。
| · | Stargardt 病 (STGD1):細胞毒性雙維甲酸的積累 與 STGD1 的發作和進展有關。Tinlarebant 已獲得美國食品藥品監督管理局 (FDA) 的快速通道和罕見 兒科疾病 (RPD) 稱號,並在美國和 歐洲獲得 STGD1 孤兒藥稱號 (ODD)。目前尚無美國食品藥品管理局批准的 STGD1 治療方法。 |
| o | LBS-008-CT02 試驗:正在進行的、針對青少年 STGD1 受試者的開放標籤的 2 年期 2 期試驗 |
| § | 2023年視覺與眼科研究協會 (ARVO)發佈的為期18個月的療效和安全性更新(n = 12)表明: |
| • | Tinlarebant 仍然安全且耐受性良好 |
| • | 根據眼底自發熒光 (FAF) 成像的評估,將近 60% 的受試者(12人中有7人)沒有發生萎縮性視網膜病變 |
| • | Tinlarebant 穩定了視力,視力沒有明顯下降,視網膜厚度在臨牀上也沒有 的顯著變化 |
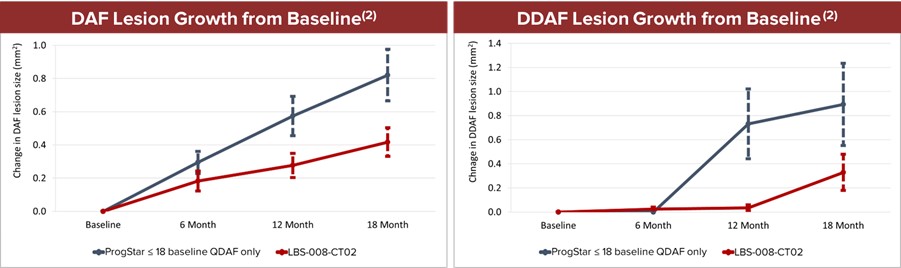
| • | 與 Georgiou 等人的 Childhood-Onset STGD1 前瞻性隊列研究(2020 年)的參與者相比,LBS-008-CT02 的受試者顯示自發熒光 (DAF) 病變減少從 基線擴展到 18 個月(0.69 ± 0.72 mm)有所減少2/年比 0.28 ± 0.28 mm2/年,分別為)(1)。 DAF 區域代表自發熒光可疑減少 (QDAF) + 自體熒光 (DDAF) 病變的組合面積 |
| • | 與基線時只有 QDAF 病變的 progStar 研究參與者相比,接受長達 18 個月的 LBS-008-CT02 受試者顯示(1): |
| - | DAF 病變大小與基線相比的擴張幅度減小; |
| - | 與基線相比,DDAF 病變大小縮小了 |

| o | Pivotal DRAGON 試驗:針對 12-20 歲的 STGD1 受試者進行為期 2 年、隨機、雙掩膜、安慰劑對照、全球、多中心、關鍵的 3 期試驗: |
| § | 註冊完成,100 個科目遍佈全球 11 個國家,包括美國、英國、德國、比利時、法國、瑞士、中國、香港、臺灣、澳大利亞和荷蘭的 個地點 |
| § | 主要療效終點是病變生長速度減慢;還將評估安全性和耐受性 |
| § | 2024 年中期:預計會有中期療效和安全性數據 |
| · | Geography Atrophy (GA):GA 是乾性 AMD 的晚期形式,是一種慢性視網膜退行性疾病,會導致老年人失明。 毒性維生素 A 副產物(雙維甲酸)的積累與 GA 的進展有關。目前尚無美國食品藥品管理局批准的 口服GA療法。 |
| o | Pivotal PHOENIX 試驗:2 年前瞻性、隨機(2:1、active: placebo,n ~430)、雙掩膜、安慰劑對照、全球、多中心、 GA 受試者的 3 期試驗。 |
| § | 主要療效終點是病變生長速度減慢;還將評估安全性和耐受性 |
| § | 第一位受試者已服藥 |
| § | 預計將在審判中期進行中期分析 |
企業要聞
| · | 完成美國 存托股份(“ADS”)和認股權證的承銷公開發行,總收益為3000萬美元 |
| · | 在 5 月舉辦了兩場重要意見領袖 (KOL) 活動,重點是 STGD1 疾病概述和青少年受試者的 Tinlarebant 數據的討論: |
| o | Hendrik Scholl 教授,醫學博士(巴塞爾大學眼科系主任),他討論了 STGD1 概述以及 評估 Tinlarebant 的 STGD1 試驗的 18 個月數據 LBS-008-CT02 |
| o | Michel Michaelides 教授,醫學博士(倫敦大學學院眼科研究所眼科教授),他討論了兒童時期發作的 STGD1 的進展 以及廷拉雷班特 18 個月的 LBS-008-CT02 試驗數據的相關性 |
2023 年第二季度財務業績:
現金及現金等價物:截至2023年6月30日,該公司 擁有5,740萬美元的現金。
研發費用:
在截至2023年6月30日的三個月中,研發費用 為550萬美元,而2022年同期為160萬美元。增長的主要原因是進行PHOENIX試驗的 (x) 費用增加,以及 (y) 我們的研發團隊擴張導致的工資和薪水增加。在截至2023年6月30日的六個月中,研發費用為1,120萬美元,而2022年同期為250萬美元。研究 和開發費用的增加主要歸因於 (i) 與進行 DRAGON 和 PHOENIX 試驗相關的費用增加,以及 (ii) 由於我們的研發團隊擴張而導致的工資和薪水增加。
G&A 費用:
在截至2023年6月30日的三個月中,一般和行政開支 為140萬美元,而2022年同期為90萬美元。增加的主要原因是 (i) 專業服務費和 (ii) 工資和薪金的增加。在截至2023年6月30日的六個月中,一般和管理費用為250萬美元,而2022年同期為110萬美元。增長的主要原因是 (i) 專業人員 服務費和 (ii) 工資和薪金的增加。
淨虧損:
在截至2023年6月30日的三個月中,該公司報告稱 淨虧損為680萬美元或每股虧損0.26美元,而2022年同期為240萬美元,合每股虧損0.12美元。在截至2023年6月30日的六個月 個月中,該公司報告淨虧損1,370萬美元或每股虧損0.54美元,而2022年同期的每股淨虧損為350萬美元 或(0.23 美元)。
網絡直播信息
Belite Bio將主持網絡直播,討論公司的 財務業績並提供業務最新情況。電話會議定於美國東部時間2023年8月9日星期三下午 4:30。要加入 網絡直播,請點擊 https://lifescievents.com/event/belitebio/。 活動結束大約兩小時後,將提供為期 90 天的重播。
關於 Belite Bio
Belite Bio是一家臨牀階段的生物製藥藥物開發公司 ,專注於開發針對視網膜退行性眼病的新療法,這些疾病的醫療需求明顯未得到滿足,例如晚期乾性 AMD 中的 STGD1 和 GA,以及特定的代謝性疾病。欲瞭解更多信息,請在 Twitter、Instagram、 LinkedIn、Facebook 上關注我們或訪問我們 www.belitebio.com。
關於前瞻性陳述的重要注意事項
本新聞稿包含有關未來 預期、計劃和前景的前瞻性陳述,以及任何其他關於非歷史事實的陳述。這些陳述包括 但不限於關於臨牀數據對患者的潛在影響、臨牀開發、其候選產品的監管 里程碑的陳述,以及任何其他包含 “期望”、“將”、“相信”、 “目標”、“預期” 和其他類似表達方式的陳述。由於各種重要因素,實際結果可能與前瞻性陳述 中指出的結果存在重大差異,包括但不限於 Belite Bio 證明其候選藥物的安全性和有效性的能力;其候選藥物的臨牀結果,可能不支持進一步的開發或監管批准;對啟動、註冊和完成時間的預期以及與其 臨牀試驗相關的數據;內容以及有關監管機構作出決定的時間關於監管部門對Belite Bio候選藥物的批准;根據各自的 數據,DRAGON或PHOENIX研究是否需要進行額外的臨牀試驗;Tinlarebant的潛在療效,以及 Belite Bio向美國證券交易委員會提交的文件中 “風險因素” 部分更全面地討論的風險。所有前瞻性陳述均基於Belite Bio當前 可獲得的信息,除非法律要求,否則Belite Bio沒有義務公開更新或修改任何前瞻性陳述,無論是 是由於新信息、未來事件還是其他原因。
BELITE BIO, INC
未經審計的運營和綜合虧損簡明合併報表
(金額以千美元計, 份額和每股金額除外)
| 在這三個月裏 | 在這六個月裏 | |||||||||||||||
| 已於6月30日結束 | 已於6月30日結束 | |||||||||||||||
| 2022 | 2023 | 2022 | 2023 | |||||||||||||
| 開支 | ||||||||||||||||
| 研究和開發 | 1,579 | 5,516 | 2,457 | 11,239 | ||||||||||||
| 一般和行政 | 927 | 1,355 | 1,102 | 2,513 | ||||||||||||
| 運營費用總額 | 2,506 | 6,871 | 3,559 | 13,752 | ||||||||||||
| 運營損失 | (2,506 | ) | (6,871 | ) | (3,559 | ) | (13,752 | ) | ||||||||
| 其他收入(支出): | ||||||||||||||||
| 其他收入總額,淨額 | 115 | 62 | 98 | 54 | ||||||||||||
| 所得税前虧損 | (2,391 | ) | (6,809 | ) | (3,461 | ) | (13,698 | ) | ||||||||
| 所得税支出 | - | 3 | - | 9 | ||||||||||||
| 淨虧損 | (2,391 | ) | (6,812 | ) | (3,461 | ) | (13,707 | ) | ||||||||
| 其他綜合收益(虧損) | ||||||||||||||||
| 扣除零税後的外幣折算調整 | (182 | ) | 76 | (157 | ) | (60 | ) | |||||||||
| 綜合損失總額 | (2,573 | ) | (6,888 | ) | (3,618 | ) | (13,767 | ) | ||||||||
| 每股計算中使用的加權平均普通股數量: | ||||||||||||||||
| -基礎版和稀釋版 | 19,659,441 | 25,785,147 | 14,992,848 | 25,350,949 | ||||||||||||
| 每股普通股淨虧損 | ||||||||||||||||
| -基礎版和稀釋版 | $ | (0.12 | ) | $ | (0.26 | ) | $ | (0.23 | ) | $ | (0.54 | ) | ||||
BELITE BIO, INC
未經審計的簡明合併資產負債表
(金額以千美元計, 份額除外)
| 十二月三十一日 | 6月30日 | |||||||
| 2022 | 2023 | |||||||
| 流動資產 | $ | 42,807 | $ | 59,137 | ||||
| 其他資產 | 1,466 | 1,558 | ||||||
| 總資產 | $ | 44,273 | $ | 60,695 | ||||
| 負債總額 | $ | 2,772 | $ | 4,978 | ||||
| 股東權益總額 | 41,501 | 55,717 | ||||||
| 負債總額和股東權益 | $ | 44,273 | $ | 60,695 | ||||
| 授權的普通股 | 492,179,086 | 400,000,000 | ||||||
| 已發行和流通的普通股 | 24,898,908 | 27,229,255 | ||||||
媒體和投資者關係聯繫人:
詹妮弗·吳/ir@belitebio.com
蒂姆·麥卡錫/tim@lifesciadvisors.com
注意:(1) 儘管我們將上述研究的已公佈數據與 LBS-008-CT02 試驗的中期數據進行了比較,但這種比較的價值是有限的,因為 它們來自在不同方案、不同地點、針對不同患者羣體進行的研究,並且結果 是使用非標準化方法分析的。我們注意到,我們未來的試驗可能無法證實我們迄今為止所做的比較或分析。
(2) 對於每個受試者,確定了眼睛之間的平均病變大小 ,並計算了每個研究組內病變大小的平均值。數據顯示 每組 內的平均病變大小 ± 每個時間點均值的標準誤差。