
Chimerix 企業演示文稿 2023 年 8 月 3 日

2 前瞻性陳述本演示文稿包含1995年《私人證券訴訟改革法》所指的前瞻性陳述,這些陳述存在風險和不確定性,可能導致實際結果與預期結果存在重大差異。前瞻性陳述包括與 3 期 ACTION 研究成功的可能性、ONC201 保密協議的潛在申請和批准以及隨後的商業機會、ONC206 劑量增加期間觀察到的單一療法射線照相部分反應的影響、重現臨牀和臨牀前發現的能力,以及對未來數據讀取資金和時間的預測有關的陳述。可能導致實際結果與前瞻性陳述中顯示的結果存在重大差異的因素和風險包括與 ONC201 第 3 期行動研究的時機、完成和結果相關的風險;與在未來的研究中重複先前臨牀前或臨牀研究中獲得的積極結果相關的風險;與 ONC206 臨牀開發相關的風險;以及公司向美國證券交易委員會提交的文件中列出的其他風險。這些前瞻性陳述代表了公司截至本新聞稿發佈之日的判斷。但是,公司不打算或有義務更新這些前瞻性陳述。

3 投資亮點 • 沒有有效治療選擇的絕症疾病 • 神經腫瘤學界對項目的知名度很高 • 至少在 2037 年之前的美國專利獨家經營權 • 僅首次適應症的全球收入潛力就約為 7.5 億美元 • 旨在隔離困難治療環境中單一藥物活性的第 2 期研究 • 與操作系統和其他形式的臨牀益處相關的持久反應 • 大量獨立的自然疾病史研究支持潛在的生存優勢 • 基因選擇的患者羣體限制了患者的潛在生存優勢異質性 • 領導團隊成功執行了大規模的研究和監管部門的批准 • 強勁的資產負債表為行動研究和潛在的 ONC206 催化劑提供了充足的資金 • 持續的非稀釋性 TEMBEXA 里程碑和特許權使用費的機會增加了靈活性 • 在創造價值獲取途徑方面的客觀記錄對於 ONC201 的商業潛力很高 ONC201 的商業潛力壁壘企業能力和財務靈活性
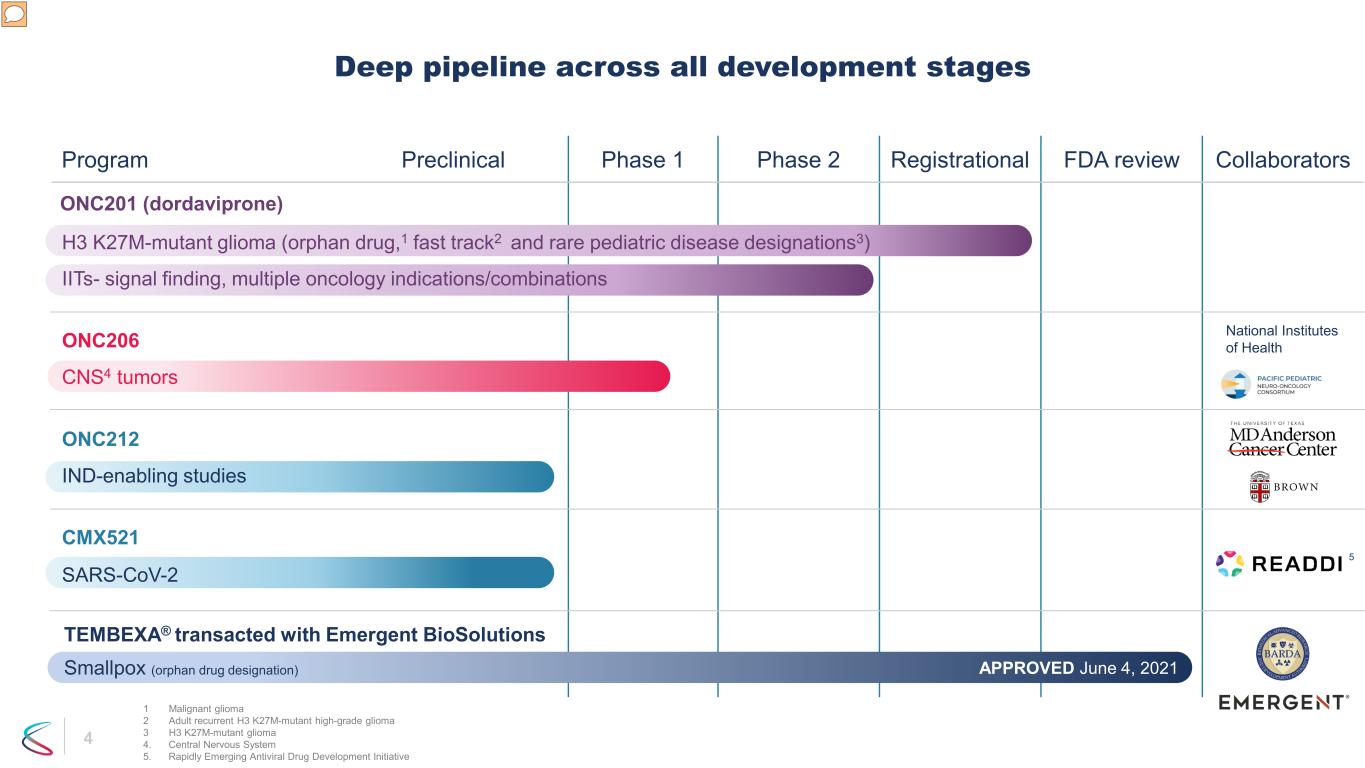
4 項目臨牀前階段 1 階段 2 註冊美國食品藥品管理局審查合作者所有開發階段的深度管道 ONC201 (dordavipron) H3 k27m-突變神經膠質瘤(孤兒藥、1 快速通道2 和罕見兒科疾病名稱 3)IIT-信號發現、多種腫瘤適應症/組合 CMX521 SARS-CoV-2 CNS4 腫瘤 ONC206 IND 支持研究 ONC212 TEMBEXA® 與 Emergent BioSolutions Smallpox 交易(孤兒藥名稱)2021 年 6 月 4 日批准 5 美國國立衞生研究院 1 惡性神經膠質瘤 2 成人復發 H3 k27m-突變高度膠質瘤3 H3 k27m-mutant 神經膠質瘤 4.中樞神經系統 5.快速崛起的抗病毒藥物開發計劃

ONC201(dordavipron)2 期療效分析
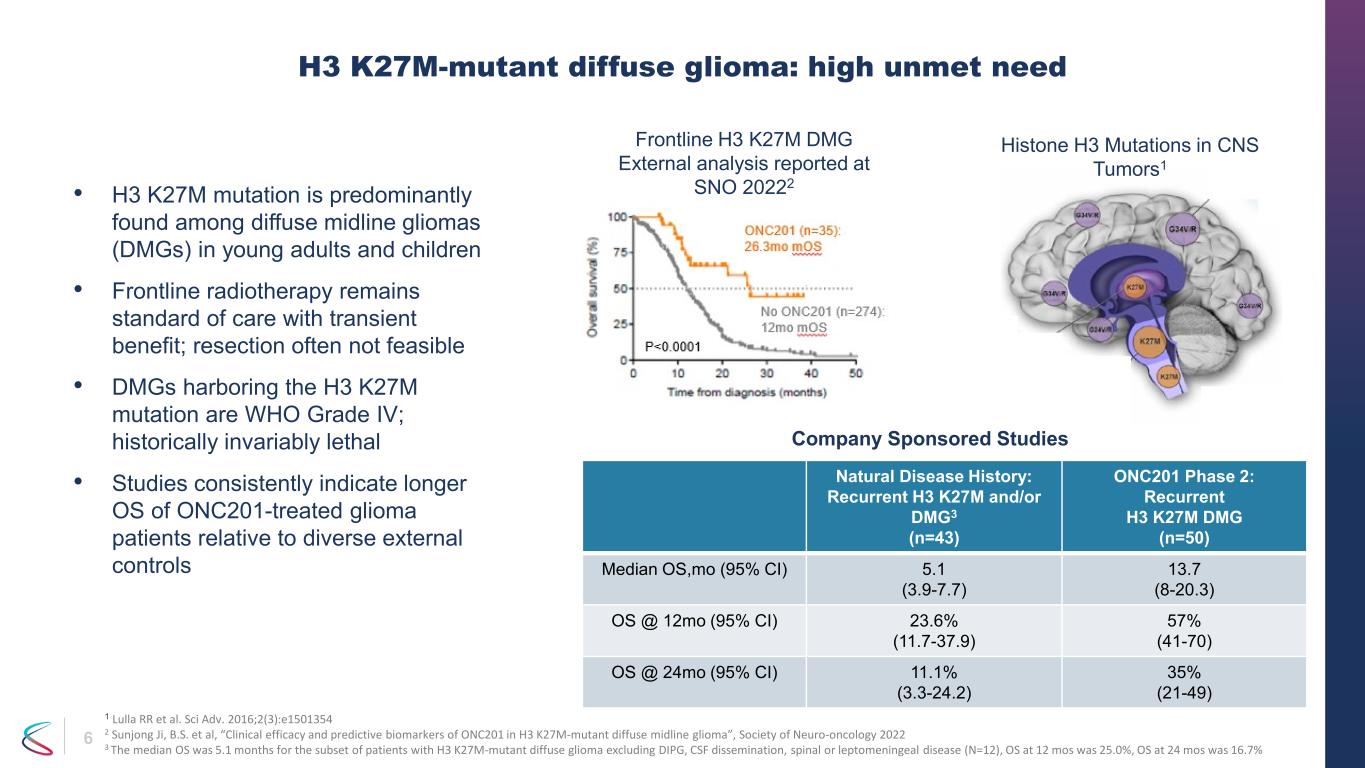
6 • H3 K27M 突變主要存在於年輕人和兒童的瀰漫性中線神經膠質瘤 (DMG) 中 • 前線放射治療仍然是標準治療,具有短暫的益處;切除通常不可行 • H3 K27M 突變的 dmg 屬於世衞組織 IV 級;歷史上總是致命 • 研究一致表明,與不同的外部對照組相比,經過 onc201 治療的神經膠質瘤患者的操作系統更長 H3 k27m-mutant difft 使用神經膠質瘤:高未滿足需求自然病史:復發 H3 K27M 和/或 DMG3 (n=43) ONC201 第 2 階段:復發 H3 K27M DMG (n=50)密蘇裏州操作系統中位數 (95% 置信區間) 5.1 (3.9-7.7) 13.7 (8-20.3) OS @ 12mo (95% 置信區間) 23.6% (11.7-37.9) 57% (41-70) OS @ 24mo (95% 置信區間) 11.1% (3.3-24.2) 35% (21-49) 中樞神經系統腫瘤中的組蛋白 H3 突變1 Lulla RR 等Sci Adv. 2016;2 (3): e1501354 2 Sunjong Ji,B.S. 等人,“ONC201 在 H3 k27m-突變體瀰漫性中線膠質瘤中的臨牀療效和預測生物標誌物”,神經腫瘤學會 2022 3 H3 K27M 突變瀰漫性神經膠質瘤患者的中位操作系統為 5.1 個月,不包括 DIPG、腦脊液擴散、脊柱或 leptomeningingingings SNO 2022 報告了真實疾病 (N=12),12 個月時的 OS 為 25.0%,24 個月時的 OS 為 16.7% Frontline H3 K27M DMG

7 • ONC201 單一療法在復發 H3 K27M 突變體傷害中表現出持久、具有臨牀意義的療效——由 RANO HGG 和/或 LGG 雙讀者 BICR 評估的 RANO-HGG 標準的總體反應率 (ORR) 為 30%(95% 置信區間:18-45%)• ORR 20%(95% 置信區間:10 — 34%)• 中位反應持續時間 (DOR) 11.2 個月(95% 置信區間:3.8 — 未達到)• 平均反應時間 8.3 個月(範圍 1.9 — 15.9)• 疾病控制率 40%(95% 置信區間:26 — 55%)• 6 個月時的 PFS 35%(95% 置信區間:21 — 49%);12 個月時的 PFS 30%(95% 置信區間:17 — 44%)——RANO-LGG 標準評估者雙讀取器 BICR • ORR 26%(95% 置信區間:15 — 40%)-總存活率 • 12 個月:57%(95% 置信區間:41 — 70%)• 24 個月:35%(95% 置信區間:21 — 49%)• 觀察到性能狀況改善和皮質類固醇使用減少 • 贊助商認為所有 SAE 與 ONC201 無關 ONC201

8 目標 • 評估 ONC201 在復發 H3 k27m 突變體瀰漫性中線膠質瘤資格中的單一療法療效 • 年齡 ≥ 2 歲,正在研究中接受 ONC201 ONC006、ONC013、ONC014、ONC016 或 ONC018 • 具有已知 H3 K27M 突變且涉及大腦中線結構的瀰漫性神經膠質瘤 • 按照 rano-High 等級膠質瘤 (HGG) 標準對比度增強腦部核磁共振成像進行性可測量的疾病 • Prior 至少使用放射線治療 • 在第一次給藥前洗澡:-輻射:90 天-替莫唑胺:23 天/抗體(例如 bevacizumab ONC201): 42 天/其他抗癌療法:28 天 • 基線表現狀態 ≥ 60 • 皮質類固醇在基線掃描前至少 3 天內穩定或下降 • 不包括:DIPG、原發性脊柱腫瘤、非典型和非星形膠質細胞病史、leptomeningeal 擴散、CSF 傳播與 FDA 一致的隔離 ONC201 單藥活性的第 2 階段療效分析標準
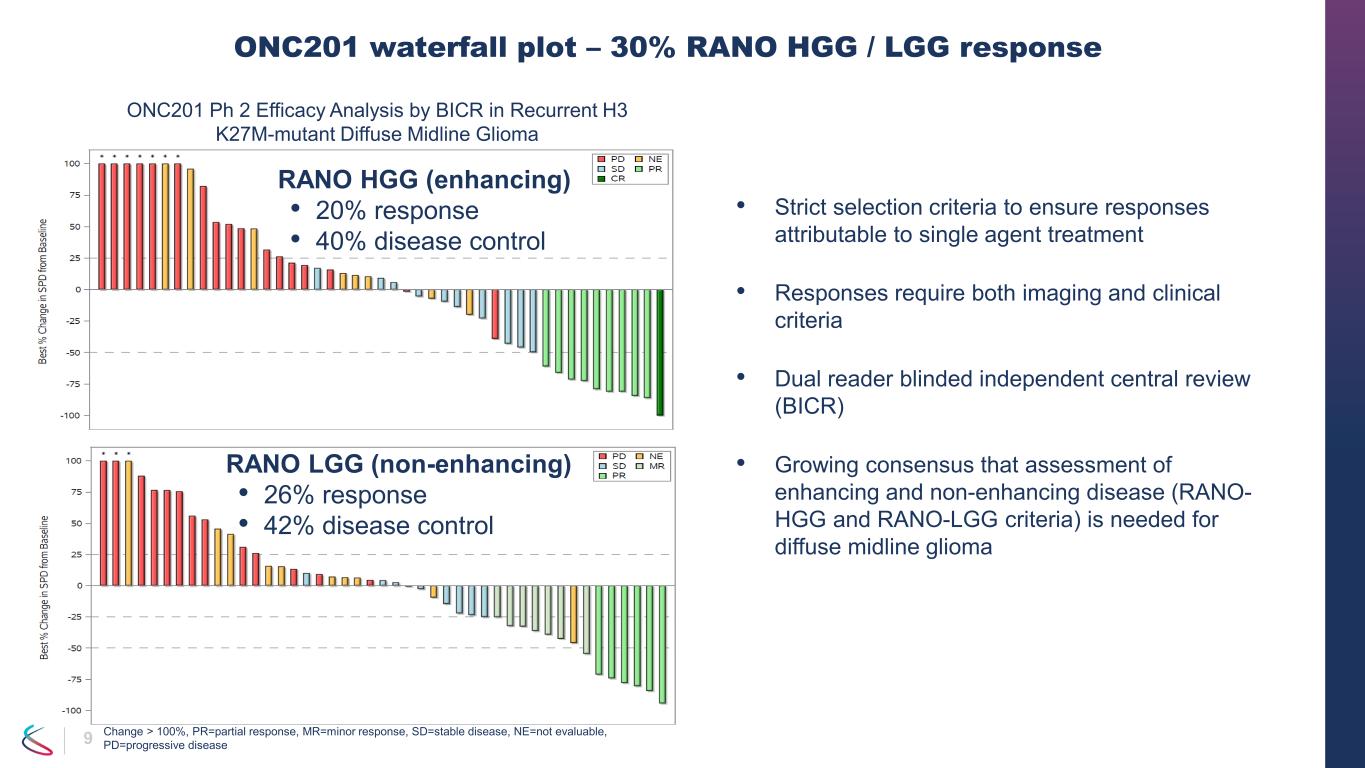
9 • 嚴格的選擇標準以確保單藥治療的反應 • 反應需要影像學和臨牀標準 • 雙讀者盲人獨立中央審查 (BICR) • 越來越多的人一致認為,瀰漫性中線神經膠質瘤 ONC201 瀑布圖需要評估增強型和非增強型疾病(RANO-HGG 和 RANO-LGG 標準)— 30% RANO HGG /LGG 反應 RANO HGG(增強)• 20% 疾病控制 LGG(非增強)• 26% 反應 • 42% 疾病控制 ONC201 Ph 2 療效分析 BICR 在復發 H 中的功效3 k27m-mutant 瀰漫性中線膠質瘤變化 > 100%,pr=部分反應,mr=次要反應,sd=穩定疾病,ne=不可評估,pd=進展性疾病
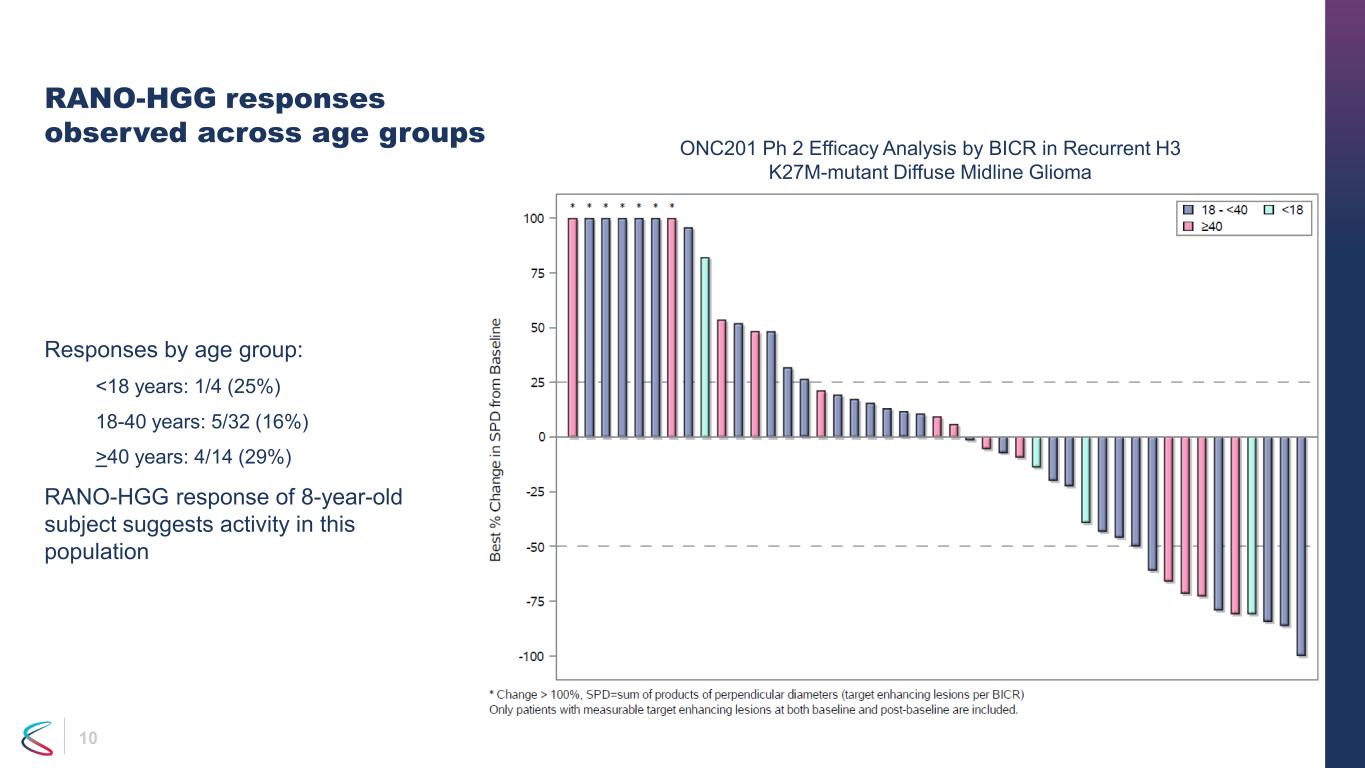
各年齡組觀察到 10 個 RANO-HGG 反應按年齡組劃分的反應:40 歲:4/14(29%)8 歲受試者的 RANO-HGG 反應表明該人羣活躍 ONC201 Ph 2 療效分析 BICR 對復發 H3 k27m-mutant 瀰漫性中線膠質瘤的療效分析
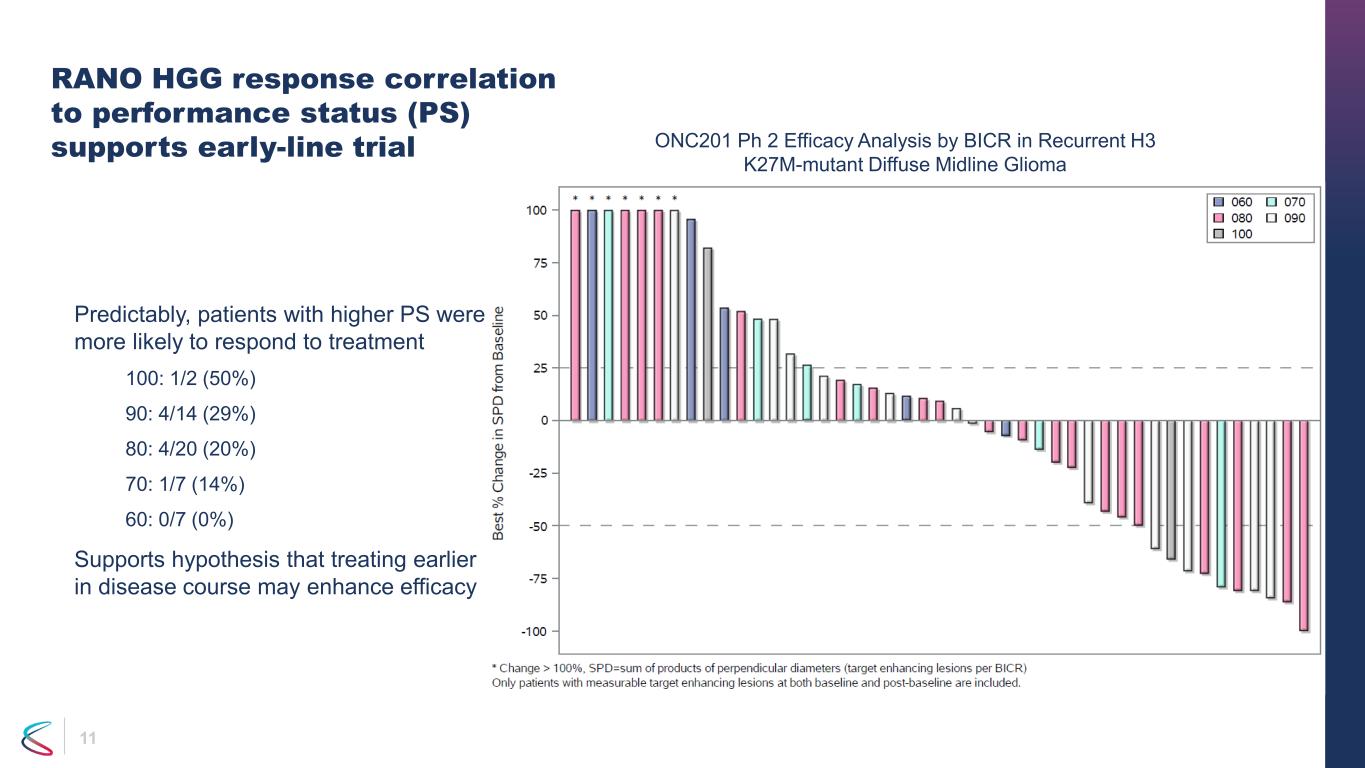
11 RANO HGG 反應與表現狀態的相關性 (PS) 支持早期試驗可以預見的是,PS 較高的患者對治療產生反應的可能性更大 100:1/2 (50%) 90:4/14 (29%) 80:4/20 (20%) 70:1/7 (14%) 60:0/7 (0%) BICR 在復發 H3 k27m-mutant 中進行的 ONC201 Ph 2 療效分析使用中線膠質瘤
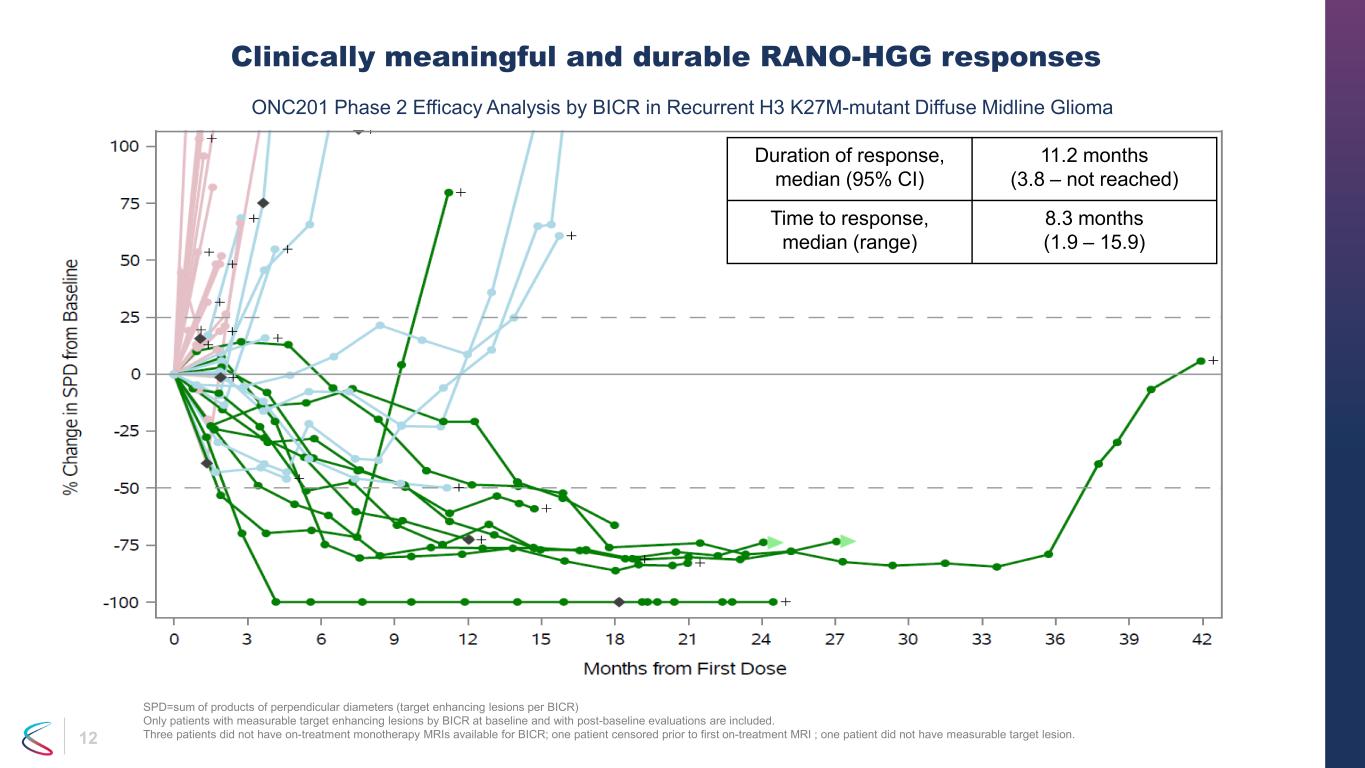
12 具有臨牀意義和持久性的 RANO-HGG 反應 spd=垂直直徑乘積的總和(每個 BICR 的靶向增強病變)僅包括基線時通過 BICR 可測量的靶向增強病變且經過基線後評估的患者。三名患者沒有可用於 BICR 的治療單一療法 MRI;一名患者在首次接受治療 MRI 之前接受了審查;一名患者沒有可測量的靶損傷。反應持續時間,中位數(95% 置信區間)11.2 個月(3.8 — 未達到)反應時間,中位數(範圍)8.3 個月(1.9 — 15.9)BICR 對復發 H3 K27M 突變瀰漫性中線膠質瘤的 ONC201 2 期療效分析
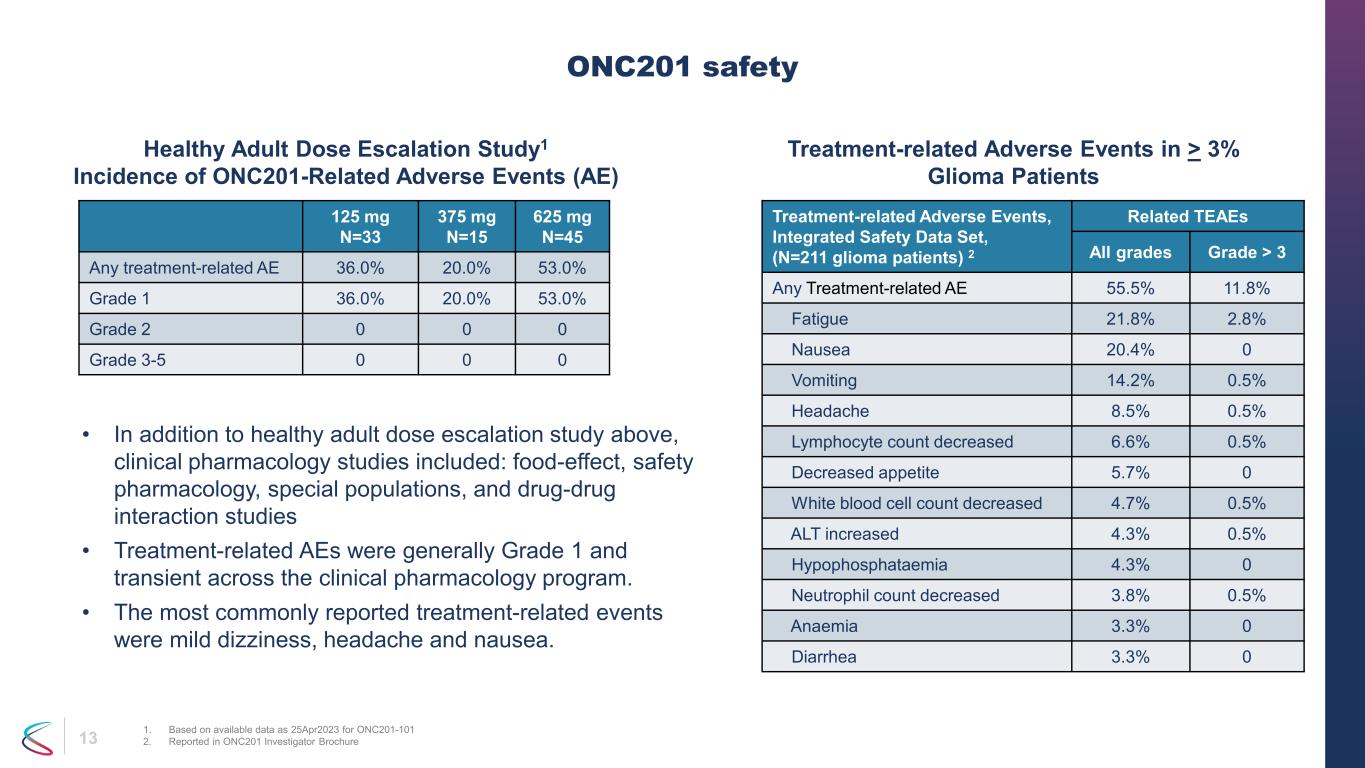
13 與治療相關的不良事件,綜合安全數據集,(N=211 神經膠質瘤患者)2 個相關 TEAE 所有等級 > 3 任何與治療相關的 AE 55.5% 11.8% 疲勞 21.8% 2.8% 噁心 20.4% 0 嘔吐 14.2% 0.5% 頭痛 8.5% 淋巴細胞計數下降 6.6% 0.5% 食慾下降 5.7% 0 白細胞計數下降 4.7% 0.5% ALT 增加 4.3% 0.5% 中性粒細胞 4.3% 0 中性粒細胞計數下降了 3.8% 0.5% 貧血 3.3% 0 腹瀉 3.3% 0 ONC201 安全 1.基於截至 2023 年 4 月 25 日 ONC201-101 2 的可用數據。ONC201 研究者手冊健康成人劑量遞增研究1 超過 3% 的神經膠質瘤患者中 onc201 相關不良事件 (AE) 治療相關不良事件的發生率 • 除了上述健康成人劑量遞增研究外,臨牀藥理學研究還包括:食物效應、安全藥理學、特殊人羣和藥物相互作用研究 • 治療相關的 AE 在臨牀藥理學項目中通常為 1 級,是短暫的。• 最常報告的治療相關事件是輕度頭暈,頭痛和噁心。125 mg N=33 375 mg N=15 625 mg N=45 任何與治療相關的 AE 36.0% 20.0% 53.0% 1 級 36.0% 20.0% 53.0% 2 級 0 0 0 年級 3-5 0 0
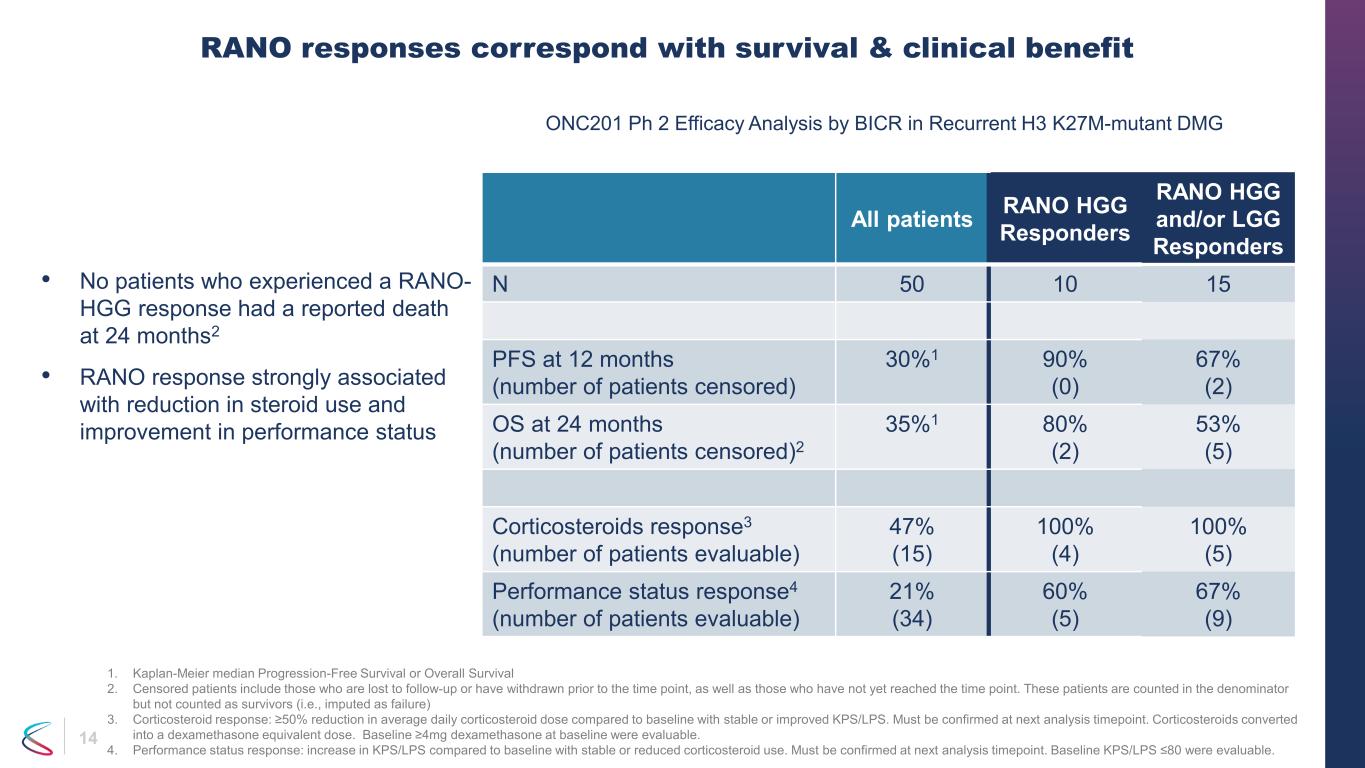
14 所有患者 RANO HGG RESPONDERS RANO HGG 和/或 LGG Responders N 50 10 15 PFS 12 個月時(接受審查的患者人數)30% 1 90% (0) 67% (2) 24 個月的操作系統(接受審查的患者人數)2 35% 1 80% (2) 53% (5) 皮質類固醇反應3(可評估的患者人數)47% (15) 100% (5) 表現反應狀態 se4(可評估的患者人數)21% (34) 60% (5) 67% (9) RANO 反應與存活率和臨牀益處相對應 1。Kaplan-Meier 中位數無進展存活率或總存活率 2.接受審查的患者包括那些因隨訪而迷失或在時間點之前退出的患者,以及尚未到達時間點的患者。這些患者按分母計算,但不算作倖存者(即歸因於失敗)3。皮質類固醇反應:與 KPS/LPS 穩定或改善的基線相比,皮質類固醇每日平均劑量減少≥ 50%。必須在下次分析時間點進行確認。皮質類固醇轉化為地塞米松等效劑量。基線時基線 ≥4mg 地塞米松是可以評估的。4.表現狀態反應:與基線相比,在皮質類固醇使用量穩定或減少的情況下,KPS/LPS 增加。必須在下次分析時間點進行確認。基線 KPS/LPS ≤80 是可以評估的。BICR 在復發 H3 k27m-mutant DMG 中進行的 ONC201 Ph 2 療效分析 • 沒有經歷過 RANO-HGG 反應的患者在 24 個月時報告死亡2 • RANO 反應與減少類固醇使用量和改善表現狀況密切相關
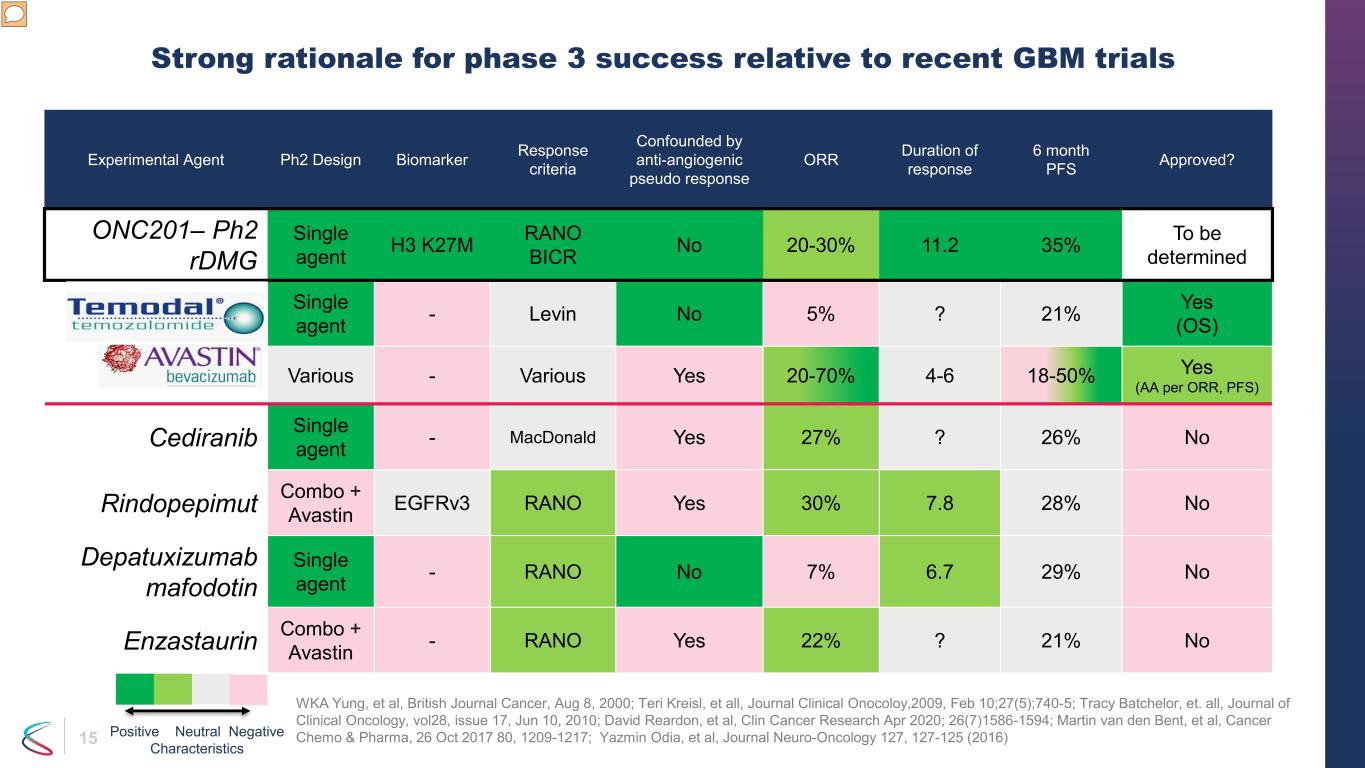
15 實驗劑 ph2 Design Biomarker 反應標準被抗血管生成假反應所困惑 ORR 反應持續時間 6 個月 PFS 已獲批准?ONC201— Ph2 rdmg 單劑 H3 K27M RANO BICR No 20-30% 11.2 35% 待定替莫唑胺單一藥劑——Levin No 5%?21% 是 (OS) Bevacizumab 各種各樣——各種各樣是的 20-70% 4-6 18-50% 是(AA per ORR,PFS)Cediranib 單一藥劑——MacDonald 是的 27%?26% 不是 Rindopepimut Combo + Avastin egfrv3 RANO 是 30% 7.8 28% 不是 depatuxizumab mafodotin 單一藥劑-RANO 沒有 7% 6.7 29% 沒有 Enzastaurin Combo + Avastin-RANO 是的 22%?21% 與最近的 GBM 試驗相比,第 3 階段成功沒有充分的理由 WKA Yung 等人,《英國癌症雜誌》,2000 年 8 月 8 日;Teri Kreisl 等人,《臨牀腫瘤學雜誌》,2009 年 2 月 10 日;27 (5);740-5;Tracy Batchelor 等人,《臨牀腫瘤學雜誌》,第 28 卷,第 17 期,2010 年 6 月 10 日;David Reardon,等人,《臨牀癌症研究》2020 年 4 月;26 (7) 1586-1594;Martin van den Bent 等人,《癌症化療與製藥》,2017 年 10 月 26 日 80、1209-1217;Yazmin Odia 等人,《神經腫瘤學》雜誌 127、127-125 (2016)

ONC201 第三階段行動研究摘要
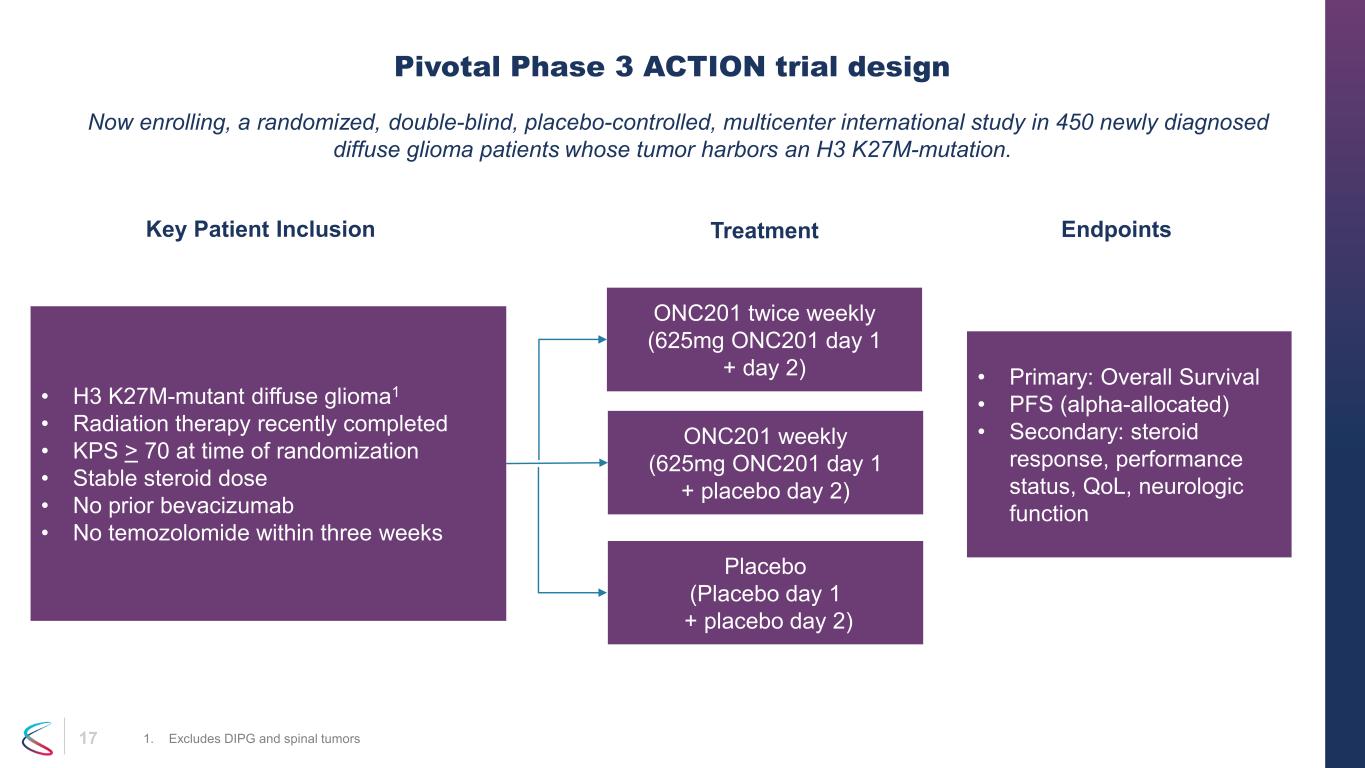
17 一項隨機、雙盲、安慰劑對照的多中心國際研究現已報名,對象為450名腫瘤攜帶H3 K27M突變的新診斷瀰漫性神經膠質瘤患者。Pivotal 3 期動作試驗設計 1.不包括 DIPG 和脊柱腫瘤 • H3 k27m-突變體瀰漫性膠質瘤1 • 最近完成放射治療 • 隨機分組時 KPS > 70 • 類固醇劑量穩定 • 之前沒有貝伐珠單抗 • 三週內沒有替莫唑胺 ONC201 每週兩次(625mg ONC201 第 1 天 + 第 2 天)ONC201 每週(625mg ONC201 第 1 天 + 安慰劑第 2 天)安慰劑(安慰劑第 1 天 + 安慰劑第 2 天) • 主要:總存活率 • PFS(α分配)• 次要:類固醇反應、表現狀態、生活質量、神經系統功能關鍵患者包容 endPoints治療
18 ONC201 數據的多個獨特方面支持轉化為第 3 階段的成功隔離、持久的單一藥物活性跨多個終點保持一致性不需要增強活性,但很可能 • 反應不會被聯合治療所困惑 • 反應是漸進的、持久的、多焦點的 • 在盲目評估中通過最嚴格的標準觀察到的反應 • 與更高的反應率(表現狀態、腫瘤體積)相關的早期設置 • 增加更高劑量的研究組 • 生物標誌物選擇支持患者的同質性 • 反應與其他形式的臨牀益處高度相關 • PFS 和 OS 有利於歷史基準 • 多項單獨的分析表明,接受 ONC201 的患者的存活時間更長

19 Design 為成功提供了多種途徑預計在 2025 年初公佈中期數據和 2026 年第二次操作系統中期的最終數據 • 大約 246 個活動 • 在 HR=0.64 最終操作系統上取得成功 • 大約 327 個活動 • 在 HR=0.73 PFS 時取得成功 by RANO HGG (2) • 大約 286 個事件 • 成功於 HR=0.68 1。總體生存率 (OS) 2.無進展生存 (PFS)。PFS 可能為監管討論提供有價值的數據。危險比將在每個時間點對每個 ONC201 臂與對照組進行獨立比較。支持假設 OS 的預期 HR 為 0.65,PFS First OS 的預期 HR 為 0.60 (1) 中期 • 大約 164 個事件 • HR 的成功 (3) =0.52
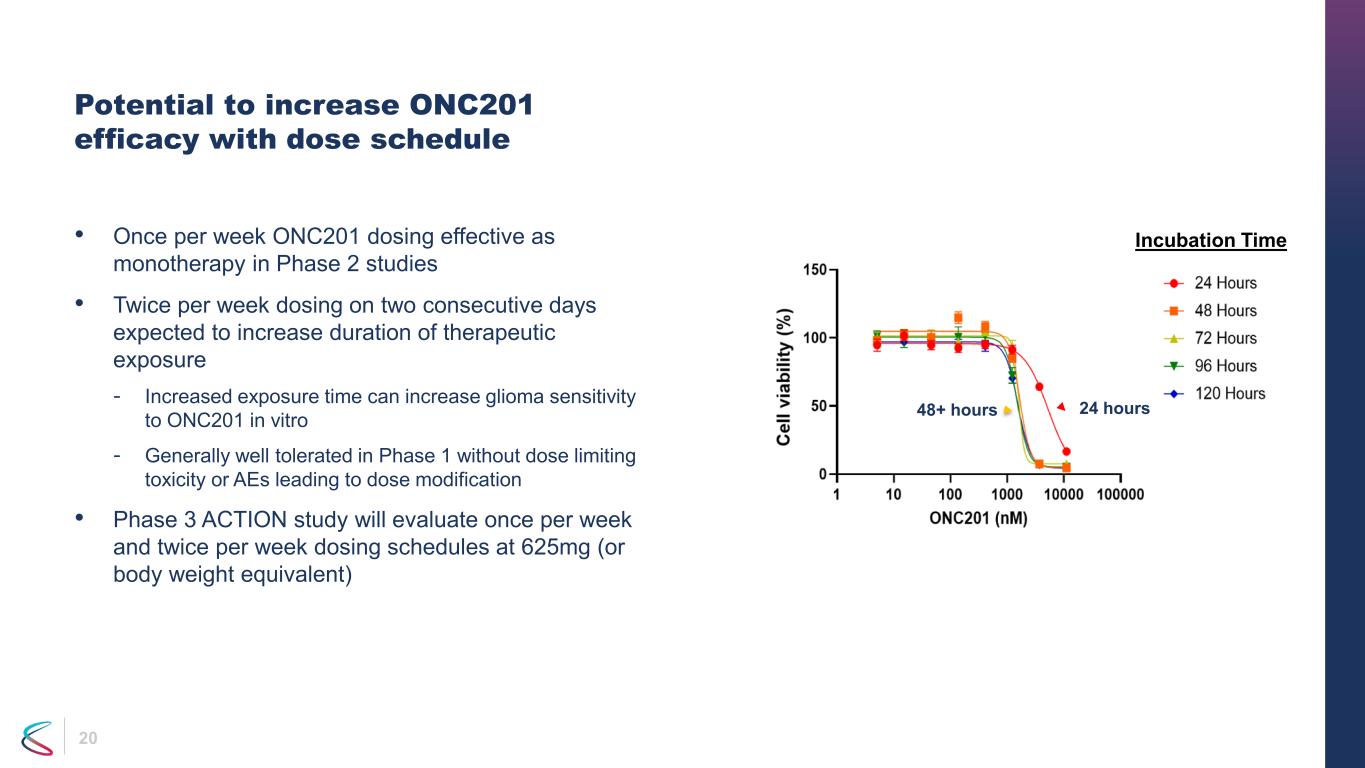
20 有可能通過劑量計劃提高 ONC201 療效 • 每週一次 ONC201 給藥在第 2 階段研究中作為單一療法有效 • 每週給藥兩次,連續兩天給藥預計會延長治療暴露持續時間-延長暴露時間可以增加膠質瘤在體外對 ONC201 的敏感性-第 1 階段總體耐受性良好,沒有劑量限制毒性或 AE 導致劑量修改 • 第 3 階段行動研究將評估每週一次,每週兩次給藥時間表,劑量為 625 毫克(或體重當量)24 小時 48 小時以上孵化時間

ONC201 市場機會評估

22 (1) Ostrom QT 等人Neuro Oncol. 2022;24(補編 5): v1-v95;(2) 患者人數和百分比是從(2012-2023 年)的文獻綜述得出的估計值(每個樣本量的加權平均值):(Aihara K 等人Neuro Oncol. 2014;16 (1): 140-6;Feng J 等人Hum Pathol。2015;46 (11): 1626-32;Solomon DA 等人Brain Pathol。2016;26 (5): 569-80;Ryall S 等人Acta Neuropathol Commun. 2016;4 (1): 93;Aboian MS 等AJNR Am J Neuroradiol。2017;38 (4): 795-800;Wang L 等人Hum Pathol。2018;78:89-96;Castel D 等人。Acta Neuropathol Commun. 2018;6 (1): 117;Karremann M 等人Neuro Oncol. 2018;20 (1): 123-131;Aboian MS 等AJNR Am J Neuroradiol。2019;40 (11): 1804-1810;Dorfer C 等人Acta Neurochir(維也納)。2021;163 (7): 2025-2035;Sievers P 等人Neuro Oncol。2021;23 (1): 34-43;Mackay A 等人Cancer Cell。2017;32 (4): 520-537 e5;Huang T 等人。Oncotarget。2018;9 (98): 37112-37124;Schreck KC 等J Neurooncol。2019;143 (1): 87-93;Chiba K 等人World Neurosurg。2020;134:e530-e539;Mukasa A 等人Neuro Oncol. 2014;16(補編 3): iii9-iii10;Castel D 等人Acta Neuropathol。2015;130 (6): 815-27;Khuong-Quang DA 等Acta Neuropathol。2012;124 (3): 439-47;Roux A 等人Neuro Oncol。2020;22 (8): 1190-1202;Giagnacovo M 等Childs Nerv Syst. 2020;36 (4): 697-704;Wu G 等人Nat Genet。2014;46 (5): 444-450;Wu G 等人Nat Genet。2012;44 (3): 251-3;Taylor KR 等人Nat Genet。2014;46 (5): 457-461;Saratsis AM 等人Acta Neuropathol。2014;127 (6): 881-95;Erker C 等人Neuro Oncol. 2022;24 (1): 141-152;Buczkowicz P 等人Acta Neuropathol。2014;128 (4): 573-81;Daoud EV 等J Neuropathol Exp Neurol. 2018;77 (4): 302-311;Chai RC 等人Acta Neuropathol Commun. 2020;8 (1): 40;Yi S 等人神經外科。2019;84 (5): 1072-1081;Gessi M 等人。Acta Neuropathol。2015;130 (3): 435-7;Alvi MA 等人Mod Pathol。2019;32 (9): 1236-1243;Crotty EE 等人。J Neurooncol。2020;148 (3): 607-617;Dono A 等人J Clin Neurosci。2020;82 (Pt A): 1-8;Akinduro OO 等J Neurosurg Spine。2021;35 (6): 834-843;Nakata S 等人Brain Tumo Pathol。2017;34 (3): 113-119;Nomura M 等人Acta Neuropathol。2017;134 (6): 941-956;Eschbacher KL 等Am J Surg Pathol。2021;45 (8): 1082-1090;D'Amico RS 等J Neurooncol. 2018;140 (1): 63-73;Korshunov A 等人Acta Neuropathol。2015;129 (5): 669-78;Aibaidula A 等Neuro Oncol. 2017;19 (10): 1327-1337。) • 預計 4,000 多箇中線神經膠質瘤中約有 40% 會含有 H3 K27M 突變2 • 在17,000多個非中線神經膠質瘤中,預計約有2%會攜帶H3 K27M突變膠質瘤2 • 據估計,美國每年約有2,000名患者受到H3 K27M突變膠質瘤的影響; 全球前七大市場中約有 5,000 名患者 Thalamic 220 患者 (52%) Pineal 40 患者 (20%) Cerebellum 240 患者 (22%) Brainstem(不包括 pons)270 名患者(50%)非中線患者(約 2%)心室 250 名患者(71%)Pons 290 名患者(75%)脊髓370 名患者(49%)美國每年報告約有 21,000 個神經膠質瘤,影響大腦的所有部位1 按腫瘤位置(陽性率)劃分的美國 H3 K27M+ 患者估計數量 2

23 • H3 K27M 突變神經膠質瘤沒有獲得批准的療法,ONC201 是全球針對這種突變的領先項目 • 潛在市場機會約為 7.5 億美元 • 排名前七的市場約有 5,000 名患者 • 超孤兒適應症藥物定價 • H3 K27M 突變最常見於兒童/年輕人(很少接觸醫療保險)• 收養門檻低——沒有有效的替代療法——神經腫瘤學家的獨立意識很高——突變通常被識別為現有診斷-長期診斷,可能與其他神經膠質瘤合併使用療法 • 鉛適應症的專利保護至2037年——美國專利期限可能延長(長達五年)H3 k27m-突變神經膠質瘤:預計收入將迅速攀升至峯值

24 監管機構名稱 1.視罕見兒科疾病代金券計劃的延續而定,代金券的收益將與Oncoceutics的傳統股東美國——孤兒藥認證(ODD)(治療膠質母細胞瘤和惡性膠質瘤治療)歐盟——ODD 用於治療成人復發 H3 K27M 突變型神經膠質瘤的快速通道指定 (FTD) 獲得稀有的兒科代金券1
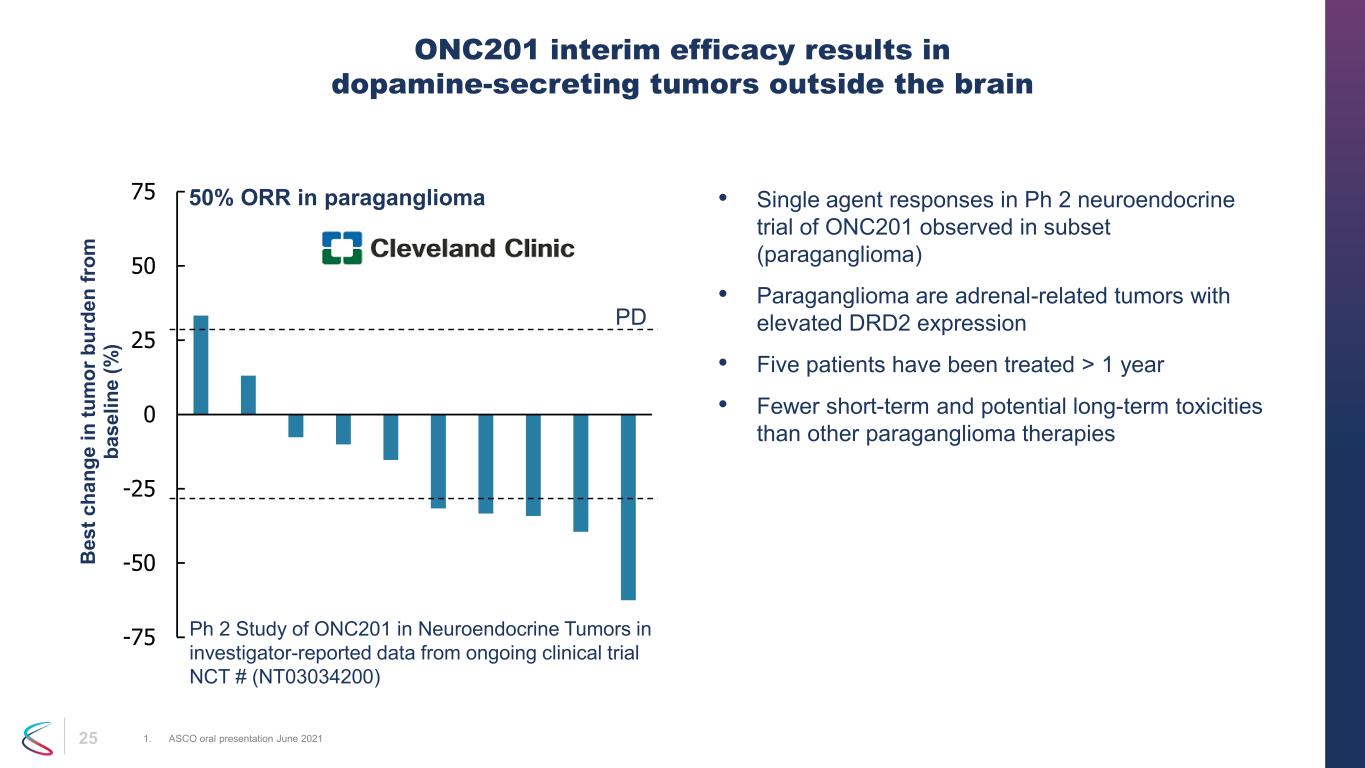
25 • 在子集(副神經節瘤)中觀察到的 ONC201 的 Ph 2 神經內分泌試驗中的單藥反應 • 副神經節瘤是腎上腺相關腫瘤,DRD2 表達升高 • 五名患者接受治療 > 1 年 • 與其他副神經節瘤療法相比,短期和潛在的長期毒性更少 ONC201 中期療效導致腦外分泌多巴胺的腫瘤 1.ASCO 口頭陳述 2021 年 6 月 -75 -50 -25 0 25 50 75 B es t c ha ng e in tu m or b ur de n fr om ba se lin e (%) 副神經節瘤中的 50% ORR ph 2 研究者報告的正在進行的臨牀試驗 NCT # (NT03034200) 中神經內分泌腫瘤中的 ONC201 研究

ONC201 作用機制
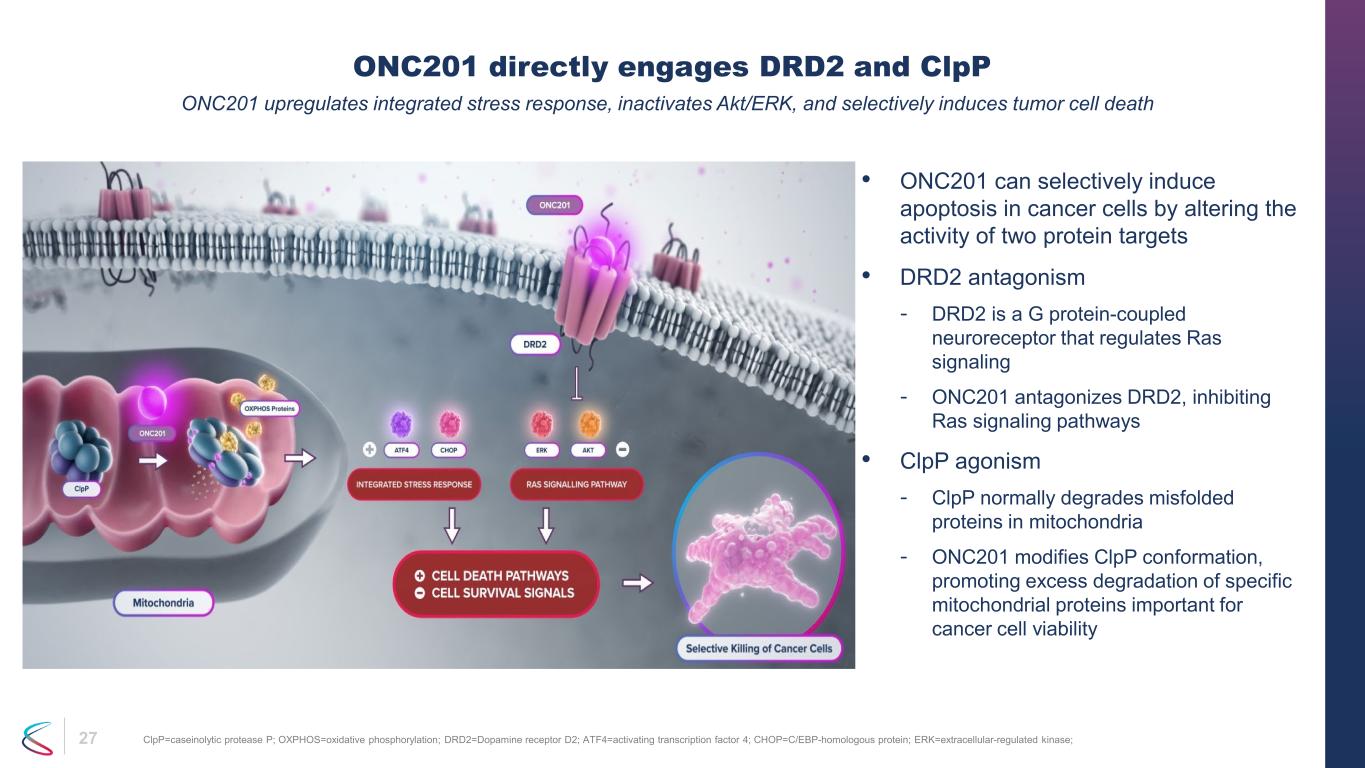
27 • ONC201 可以通過改變兩個蛋白質靶標的活性來選擇性地誘導癌細胞凋亡 • DRD2 拮抗作用——DRD2 是一種調節 Ras 信號傳導的 G 蛋白偶聯神經受體——ONC201 拮抗 DRD2,抑制 Ras 信號通路 • clpP 激動作用——clpP 通常會降解線粒體中錯誤摺疊的蛋白——ONC201 修改 clpP 構象,促進特定線粒體的過度降解對癌細胞活力很重要的蛋白質 ONC201 直接參與 DRD2 和 clpP ONC201 上調綜合應激反應,失活akt/erk,並選擇性地誘導腫瘤細胞死亡 clpp=caseinolytic 蛋白酶 P;oxphos=氧化磷酸化;drd2=多巴胺受體 D2;atf4=激活轉錄因子 4;chop=c/ebp-homologous 蛋白;erk=extracellar 調節激酶;
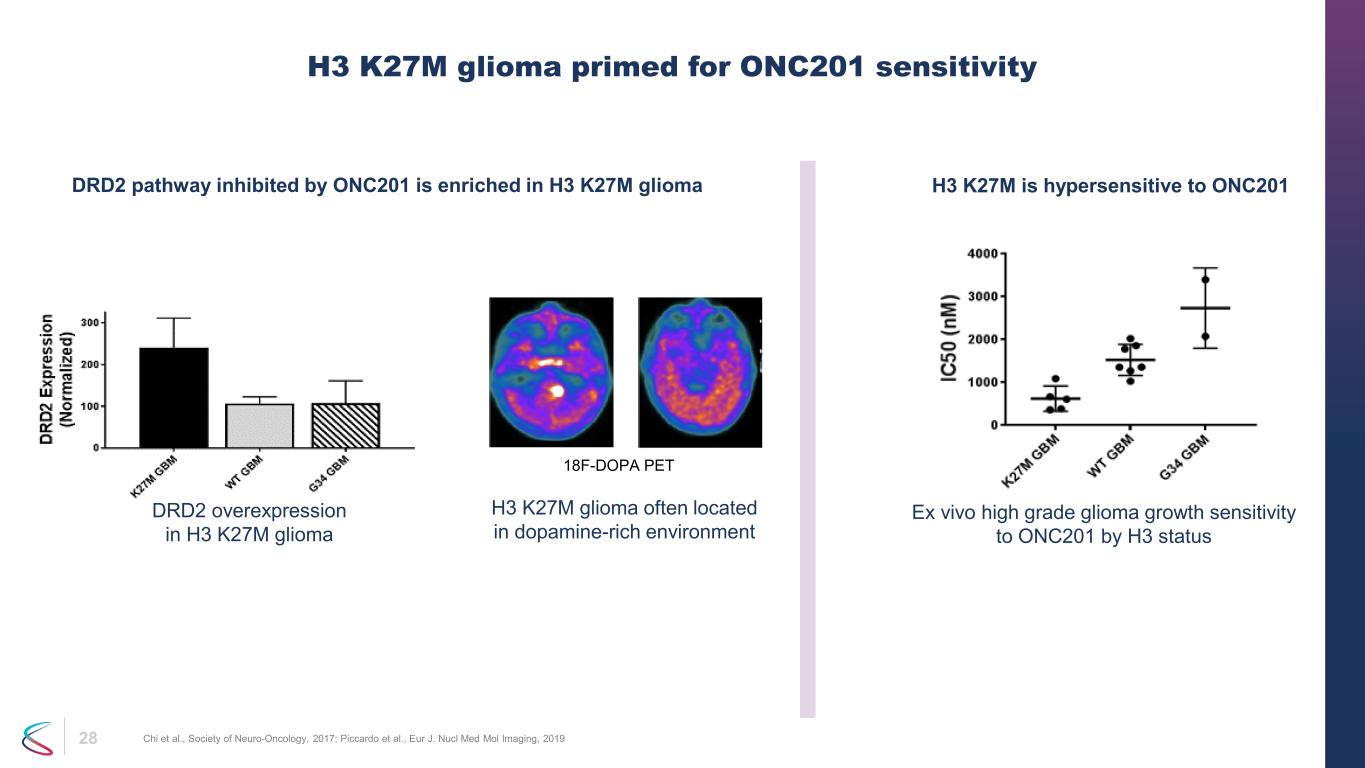
28 H3 K27M 膠質瘤為 ONC201 靈敏度做好準備 Chi 等人,神經腫瘤學會,2017 年;Piccardo 等人,Eur J. Nucl Med Mol Imaging,2019 年 ONC201 抑制的 H3 K27M 膠質瘤 H3 K27M 神經膠質瘤 18F-DOPA PET 富含 H3 K27M 神經膠質瘤 18F-DOPA PET H3 K27M 膠質瘤 H3 K27M 中的 DRD2 過度表達對 ONC201 過敏 ONC201
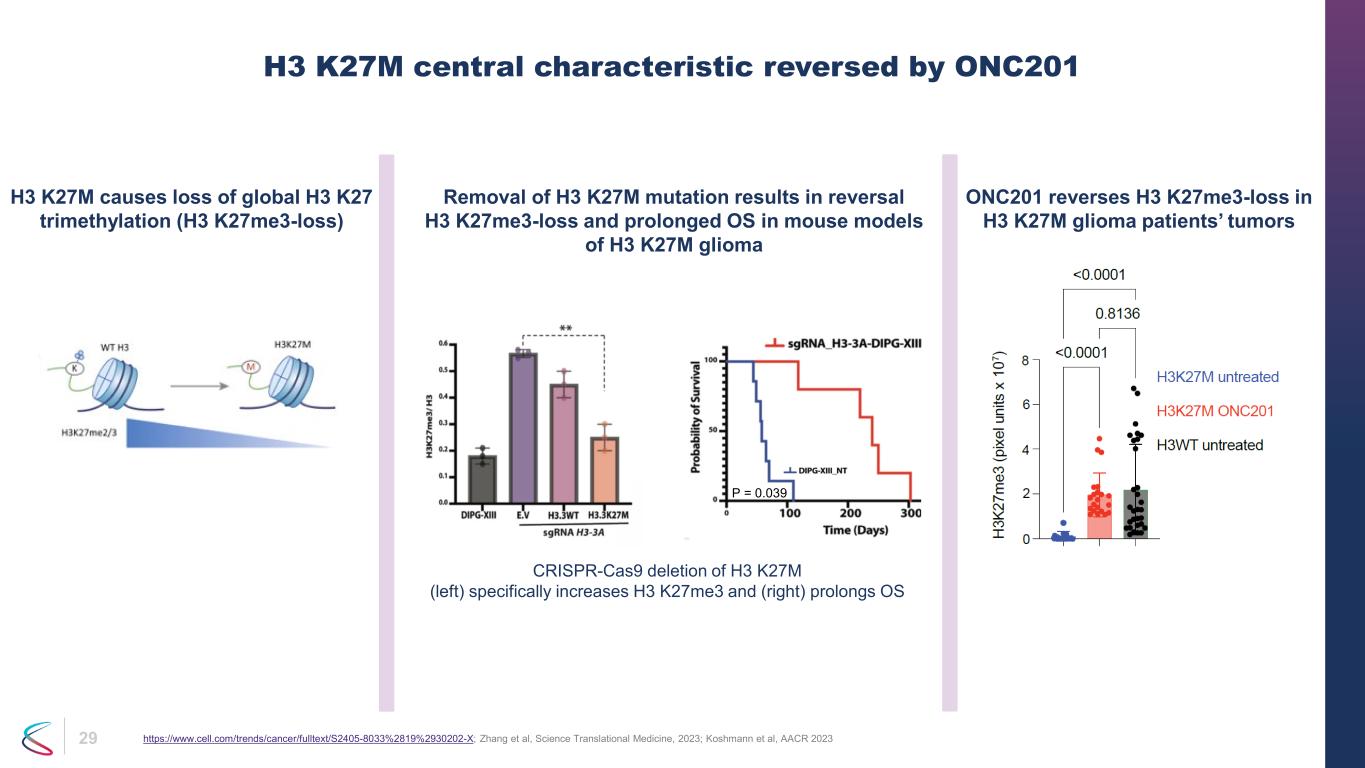
29 H3 K27M 中心特徵被 ONC201 逆轉 https://www.cell.com/trends/cancer/fulltext/S2405-8033%2819%2930202-X;Zhang 等人,《科學轉化醫學》,2023 年;Koshmann 等人,AACR 2023 H3 K27M 會導致全球 H3 K27 三甲基化(H3 k27me3-Loss)消失 H3 K27M 突變會逆轉 H3 K27M 神經膠質瘤 ONC201 小鼠模型中的操作系統延長 H3 K27M 神經膠質瘤患者腫瘤 k27me3-loss crispr-cas9 缺失 H3 K27M(左)會特別增加 H3 k27me3 而且(右)延長 OS P = 0.039

ONC206
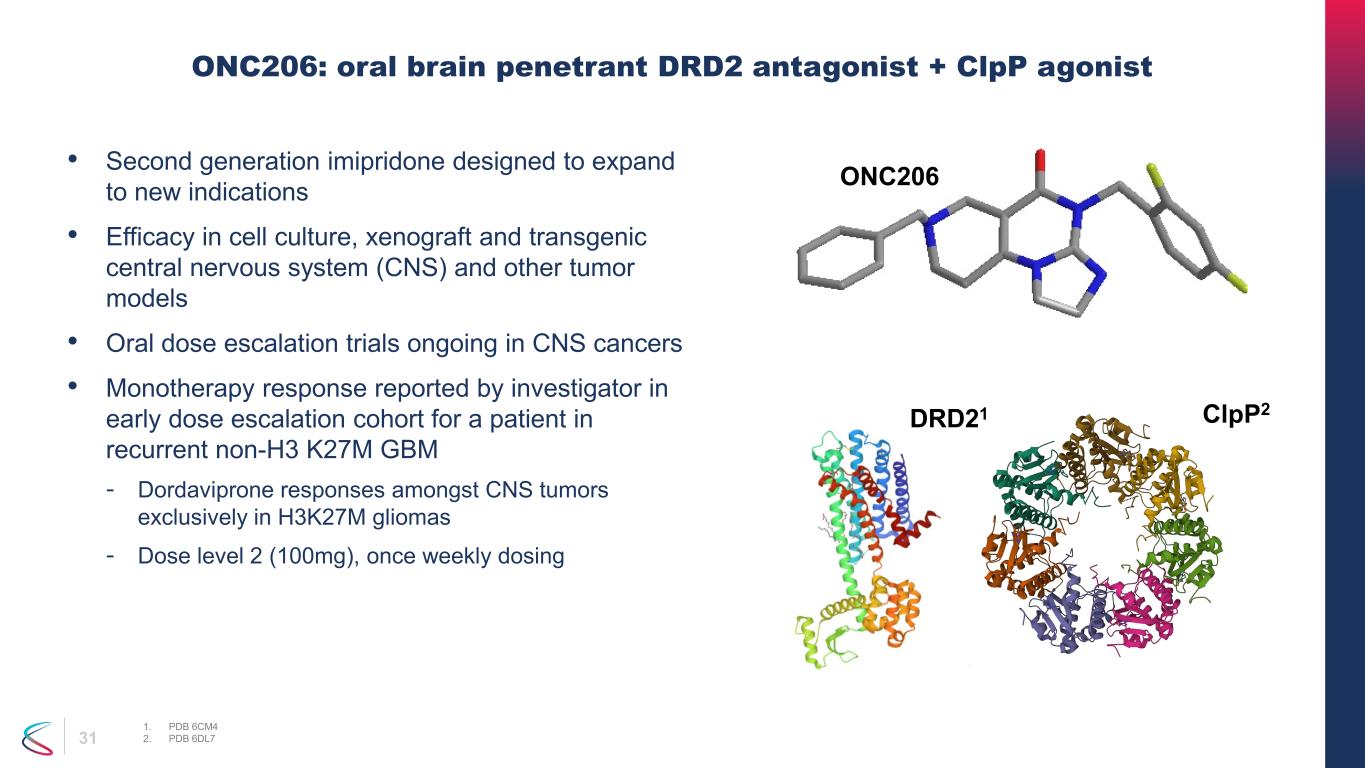
31 ONC206:口服大腦滲透劑 DRD2 拮抗劑 + clPP 激動劑 1。PDB 6CM4 2.PDB 6DL7 DRD21 clpp2 ONC206• 第二代丙吡啶酮旨在擴展到新的適應症 • 在細胞培養、異種移植和轉基因中樞神經系統 (CNS) 和其他腫瘤模型中的功效 • 中樞神經系統癌症的口服劑量遞增試驗正在進行中 • 研究人員在早期劑量遞增隊列中報告的單一療法反應,中樞神經系統中複發性非H3 K27M GBM-Dordavipron 反應腫瘤僅限於 H3K27M 神經膠質瘤——劑量等級 2(100 mg),每週給藥一次
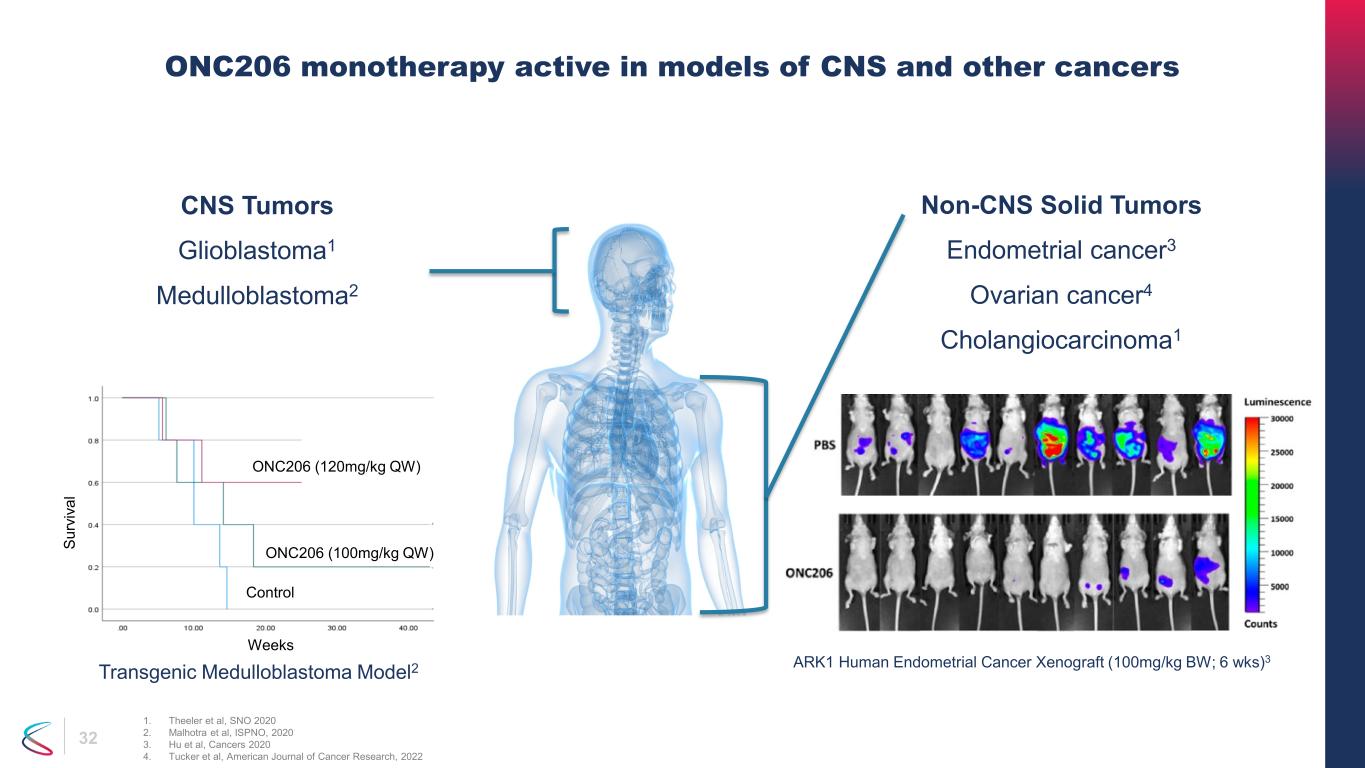
32 中樞神經系統腫瘤 glioblastoma1 Medulloblastoma2 ONC206 單一療法活躍在中樞神經系統和其他癌症模型中 1.Theeler 等人,SNO 2020 2.Malhotra 等人,ISPNO,2020 3.Hu 等人,《癌症 2020》4.Tucker 等人,《美國癌症研究雜誌》,2022 周 P
33 ONC206 劑量遞增:兒科和成人中樞神經系統腫瘤 • 成人和兒科中樞神經系統腫瘤並行註冊的單一療法劑量遞增試驗 • 研究人員報告的反應來自沒有 H3 K27M 突變的早期隊列(100mg QW)——18 歲的顳葉複發性膠質母細胞瘤患者——通過 PET 成像進行核磁共振成像和代謝降低的迴歸,持續治療 15 個月 • 每週一次的劑量增加預計將增加到每週連續三天 National 衞生研究所
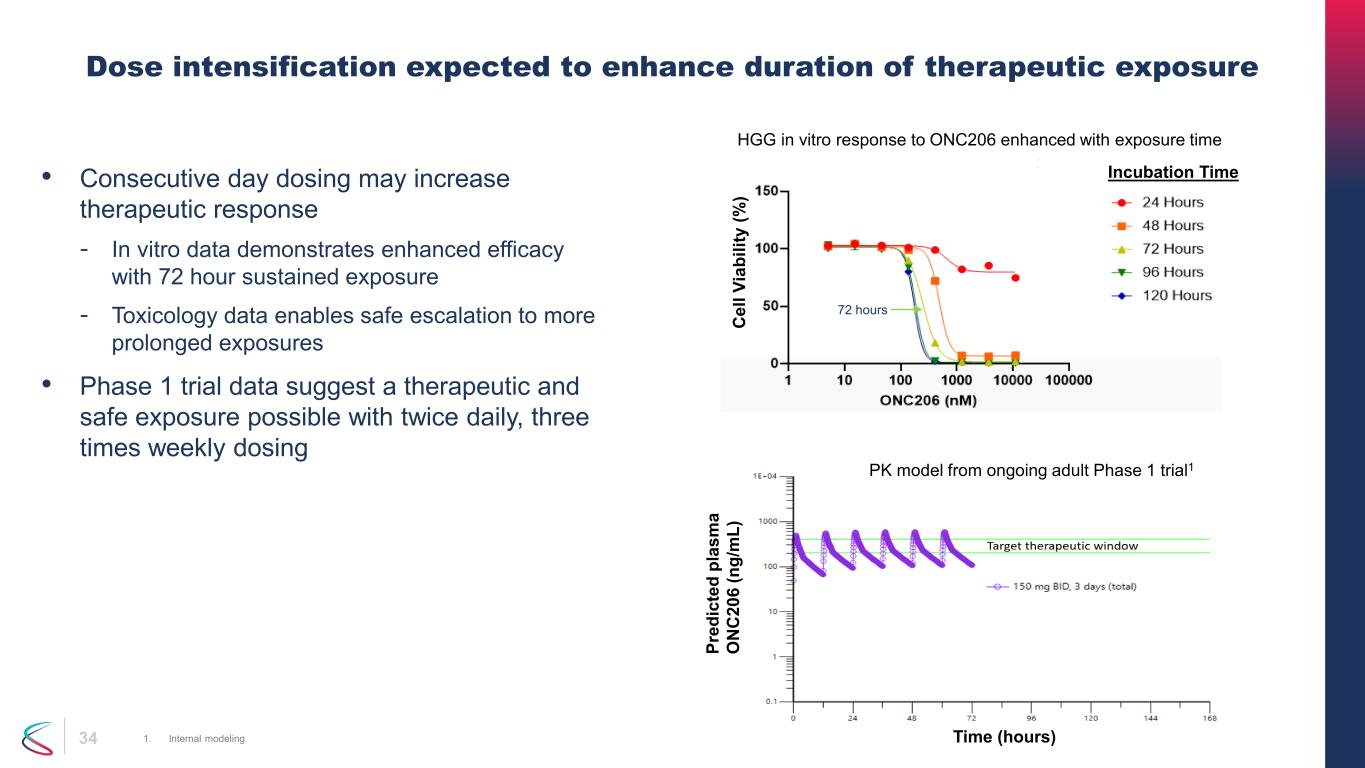
34 • 連續一天給藥可能會增加治療反應——體外數據表明,持續暴露72小時後療效會增強——毒理學數據可以安全地升級到更長的暴露時間 • 1期試驗數據表明,每天兩次,每週三次劑量加大劑量預計會延長治療暴露的持續時間 1.內部建模 72 小時孵化時間 C el l V ia bi lit y (%) pr ed ic te d pl as m a O N C 20 6 (n g/ m L) 時間 (小時) HGG 對 ONC206 的體外反應隨着正在進行的成人 1 期試驗的暴露時間 PK 模型而增強 1
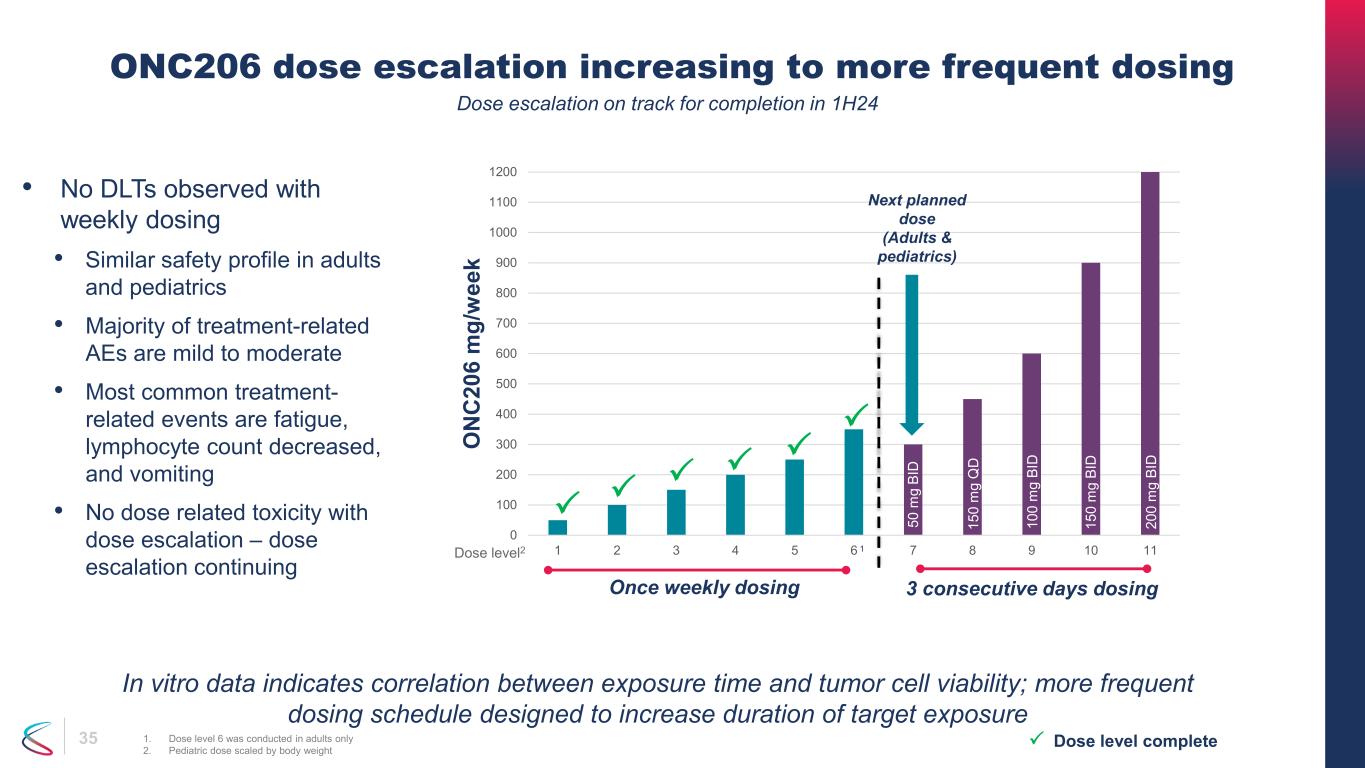
35 ONC206 劑量增加到更頻繁的給藥 1.劑量等級 6 僅在成人身上進行 2.兒科劑量按體重縮放 • 每週給藥時未觀察到 DLT • 成人和兒科的安全性相似 • 大多數與治療相關的 AE 均為輕度至中度 • 最常見的治療相關事件是疲勞、淋巴細胞數量減少和嘔吐 • 劑量增加時沒有與劑量相關的毒性 — 劑量持續增加劑量水平完成 0 100 200 300 500 600 800 1000 1200 1 2 3 5 6 7 8 10 O N C 20 6 m g/ w ee k 下一個計劃劑量(成人和兒科)劑量 level2 50 m g BI D 15 0 m g Q D 10 0 m g g BI D 10 0 m g BI D 15 0m g BI D 20 0 m g BI D 每週一次給藥 3 天給藥 1 劑量遞增有望在 1H24 完成。體外數據表明暴露時間與腫瘤細胞活力之間存在相關性;更頻繁的給藥時間表旨在延長目標暴露持續時間

36 • GBM 是一種進展迅速的疾病,存活率低,過去 25 年很少有藥物批准:-替莫唑胺(TMZ)於 1999 年獲得批准 — Bevacizumab 於 2009 年獲得批准 • 現有療法很少提供持久效果——診斷後存活率為 3 年 • Chimerix 保留 ONC2062 的全球運營權 • 全球市場機會超過 20 億美元——TMZ 收入在 2009 年達到峯值,約為 14 億美元,通貨膨脹調整後的峯值:> 2 美元 50億美元——新的GBM療法:按當代腫瘤藥物批准的平均價格計算,50%的滲透率超過20億美元排名前七的市場每年約有 30,000 例新增 GBM 病例;> 20 億美元的市場機會 1 wjso.biomedcentral.com/articles/10.1186/1477-7819-10-220 2 根據2021年的合併協議,特許權使用費和里程碑歸功於 Oncoceutics 的傳統股東

臨牀前開發 ONC212 和 CMX521
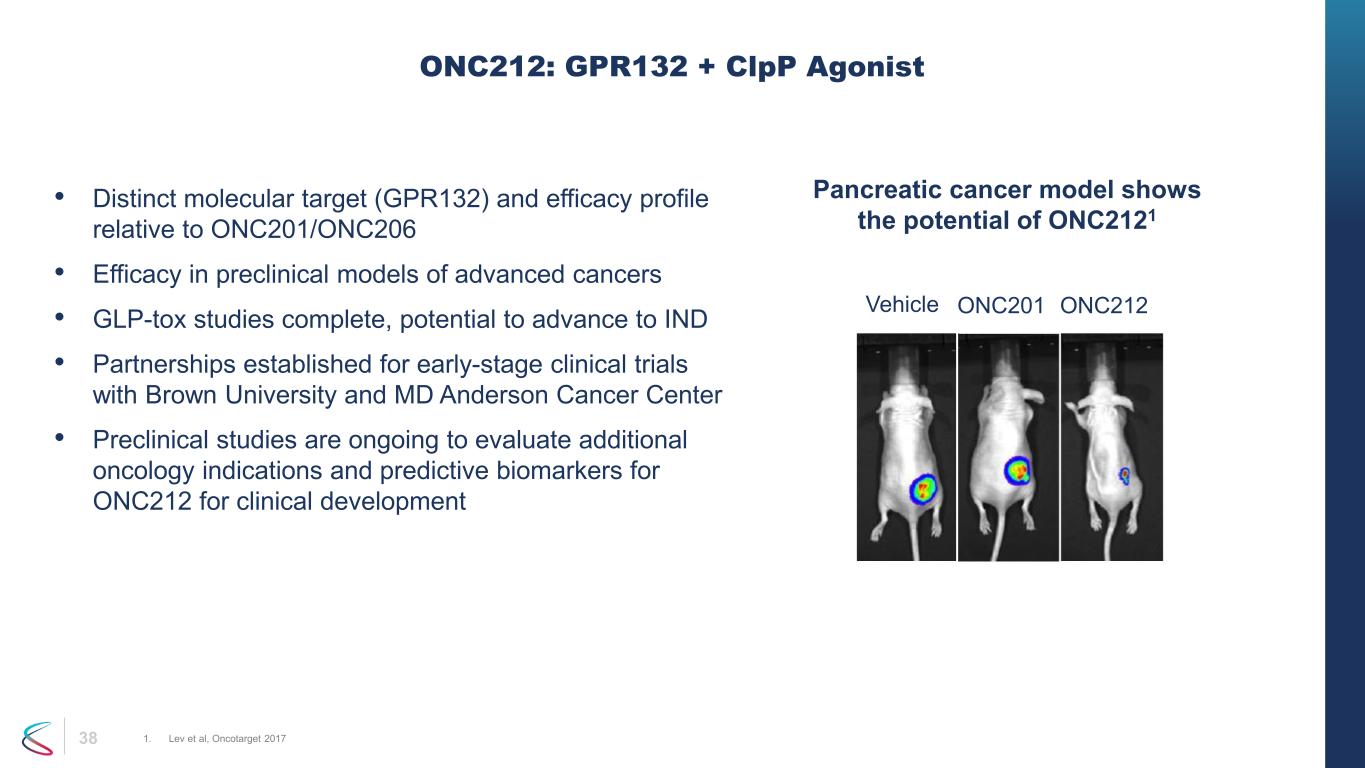
38 • 與 ONC201/ONC206 相關的不同分子靶標 (GPR132) 和療效特徵 • 晚期癌症臨牀前模型的療效 • GLP-toX 研究已完成,有可能進入 IND • 與布朗大學和醫學博士安德森癌症中心建立早期臨牀試驗合作伙伴關係 • 臨牀前研究正在進行中,以評估 ONC212 用於臨牀開發的其他腫瘤適應症和預測性生物標誌物 ONC212 GPR132: + clpP Agonist 1。Lev 等人,Oncotarget 2017 胰腺癌模型顯示了 ONC2121 載具 ONC201 ONC212 的潛力
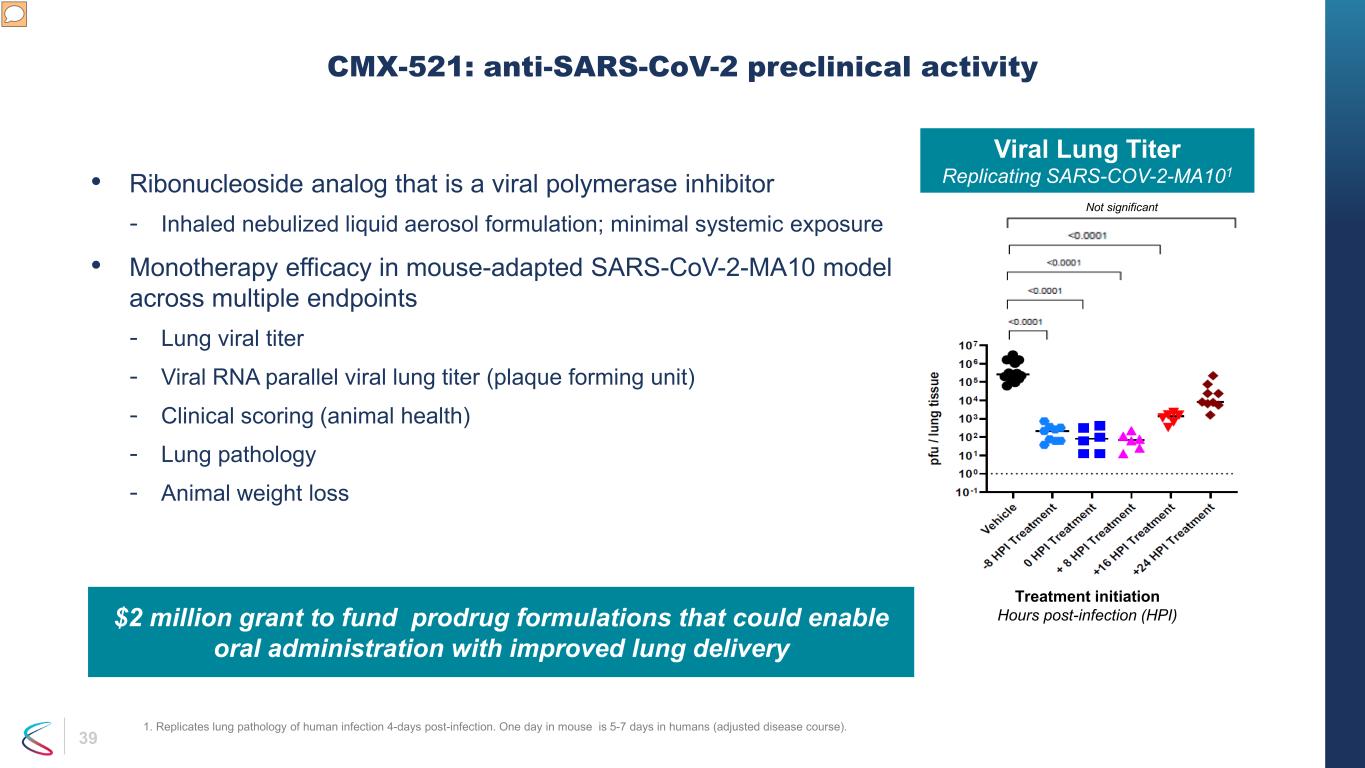
39 • 作為病毒聚合酶抑制劑的核糖核苷類似物——吸入霧化液體氣溶膠配方;最小全身暴露 • 小鼠適應性的 SARS-CoV-2-ma10 模型在多個終點上的單一療法療效——肺部病毒滴度——病毒 RNA 平行病毒肺滴度(斑塊形成單位)——臨牀評分(動物健康)——肺部病理學——動物減肥 CMX-521:抗SARS-CoV-2 臨牀前活性不是大量病毒肺滴度複製 SARS-COV-2-MA101 治療啟動時間 (HPI) 200萬美元撥款用於資助前藥能夠改善肺部遞送的口服給藥的配方 1.在感染 4 天后複製人類感染的肺部病理學。在人類中,小鼠一天是5-7天(調整後的病程)。

公司最新消息

41 Emergent BioSolutions 是一家經驗豐富的生物防禦公司,與政府機構合作保護公共健康條款摘要:• 2022年第三季度收盤時預付了2.38億美元 • BARDA潛在採購里程碑最高可額外獲得1.24億美元 • 未來美國毛利的 20% 特許權使用費,交易量超過170萬療程 • 開發里程碑TEMBEXA® 交易期限摘要

42 財務實力通過關鍵催化劑支持開發全額資助的 Ph 3 項目有多種潛在的批准途徑一線 H3 k27m-突變體瀰漫性神經膠質瘤 — ACTION 研究試驗預計於 2022 年 11 月初啟動中期操作系統數據,美國國立衞生研究院的早期劑量遞增研究中預計有 2026 年 ONC206 的完整操作系統數據,截至 2023 年 6 月 30 日,非 H3 K27M 複發性膠質母細胞瘤患者的反應為 2.33 億美元資金為運營提供資金,沒有債務早期階段的管道利用外部資本臨牀前項目晉升為診所或合作伙伴的潛力(ONC212、CMX521)穩健的業務發展搜索和評估流程成功的可能性很高 ONC201 第 3 階段 ACTION 研究成功的可能性很高 ONC201 的商業潛力壁壘企業能力和財務靈活性

Chimerix 企業推介會