目錄
RAS表達突變,包括KRAS突變和擴增。RAS基因突變的患者比沒有這種突變的患者預後更差,目前還沒有批准的藥物來治療RAS突變的患者。我們預計這項試驗將在美國的三個地點招募35到50名患者。預期的主要終點將是無進展生存。該試驗設計目前正在開發中,準備提交給FDA進行審查。這項試驗預計將於2017年開始招生,2018年開始提供初步數據。
我們的管道
下表總結了我們產品開發渠道的當前狀況。

我們和Nereus製藥公司(Nereus PharmPharmticals,Inc.)已向FDA提交了三份研究新藥或IND的申請,以供我們的產品候選。2006年1月,Nereus向FDA提交了S用於實體腫瘤患者的普利布林適應症的IND。這個Ind是在2013年7月轉讓給我們的。2015年6月,我們向美國食品和藥物管理局提交了IND,後來修改了Plinumulin的IND,在S的適應症下,用於二線和三線聯合紫杉醇治療晚期非小細胞肺癌患者,並有至少一個可測量的肺部病變。2016年12月,我們向FDA提交了另一份IND,用於普利布林和S適應症,用於預防接受多西紫杉醇單一免疫系統抑制治療的實體瘤患者嚴重的中性粒細胞減少症。
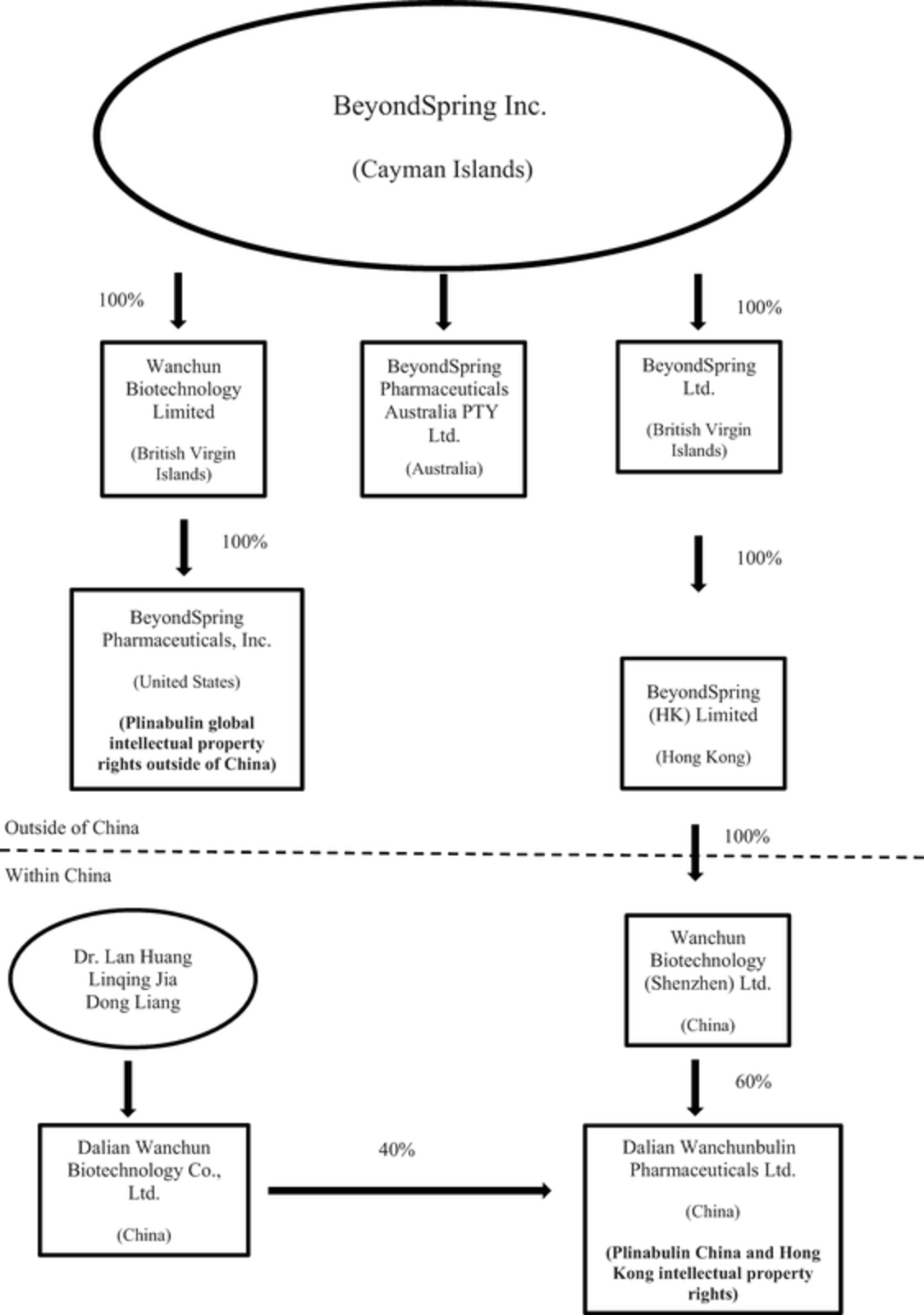
我們的主要執行辦公室設在紐約,我們在大連、中國也設有辦事處,大連是製藥公司的中心。我們在開曼羣島註冊成立。我們的管理團隊在生物、化學、藥物研發、臨牀開發和監管事務方面擁有豐富的經驗和能力。2013年,我們從Nereus手中獲得了普利布林的全部全球權利,包括其2期臨牀試驗數據。在獲得普利布林後,我們獲準在美國、中國和澳大利亞進行3期試驗,以研究普利布林與多西紫杉醇聯合應用於非小細胞肺癌的抗癌作用。我們預計將在美國、歐洲、以色列、澳大利亞和中國招募患者參加兩個2/3期試驗,研究普利布林在降低多西紫杉醇化療引起的嚴重中性粒細胞減少症、預防非多西紫杉醇化療引起的嚴重中性粒細胞減少症方面的作用,並預計在其他適應症方面繼續取得進展。
4