
附錄 99.1

樂團 BioMed 企業演講 2023 年第二季度

| 2023 年第 2 季度企業演示文稿 2 前瞻性陳述本演示文稿僅供參考,僅根據Orchestra BioMed Holdings, Inc.(此處簡稱 “我們”、“我們的”、“Orchestra BioMed” 和 “公司”)提供的信息以及本文所示的第三方來源。此類第三方信息尚未經過獨立核實。Orchestra BioMed 對此類信息的準確性或完整性不作任何明示或暗示的陳述或保證。就1995年《美國私人證券訴訟改革法》的安全港條款而言,本文件中包含的某些不是歷史事實的陳述是前瞻性陳述。前瞻性陳述通常附有 “相信”、“可能”、“將”、“估計”、“繼續”、“預期”、“打算”、“期望”、“應該”、“將”、“計劃”、“預測”、“潛力”、“看起來”、“尋找”、“未來”、“展望” 等詞語以及預測或表明未來事件或趨勢或不是陳述的類似表達歷史問題。這些前瞻性陳述包括但不限於與我們的候選產品的潛在安全性和有效性、我們計劃中的關鍵試驗的時機、候選產品的預期市場規模、我們的合作伙伴加速臨牀開發的能力以及我們估計的未來財務業績和財務狀況有關的聲明。這些陳述基於各種假設,無論是否在本文件中確定,也基於公司管理層的當前預期,而不是對實際業績的預測。這些前瞻性陳述僅用於説明目的,無意用作擔保、保證、預測或明確的事實或概率陳述,也不得用作擔保、保證、預測或明確的事實或概率陳述。實際事件和情況很難或無法預測,可能與假設有所不同。許多實際事件和情況都超出了公司的控制範圍。這些前瞻性陳述受許多風險和不確定性的影響,包括國內外業務、市場、財務、政治和法律狀況的變化;未能實現業務合併的預期收益;與監管部門批准公司候選產品相關的風險;公司實現預期監管和業務里程碑的時機以及公司實現預期監管和業務里程碑的能力;競爭產品和候選產品的影響;以及在 “項目1 A” 標題下討論的風險因素。風險因素” 出現在公司向美國提交的10-Q表季度報告中。S。美國證券交易委員會於2023年5月12日根據在 “項目1 A” 標題下披露的任何風險因素進行了更新。風險因素” 出現在公司隨後提交的10-Q表季度報告中。公司在競爭激烈且瞬息萬變的環境中運營。新的風險不時出現。鑑於這些風險和不確定性,公司告誡不要過分依賴這些前瞻性聲明,這些陳述僅在本新聞稿發佈之日才有效。除非法律要求,否則公司不計劃也沒有義務更新此處發表的任何前瞻性陳述。

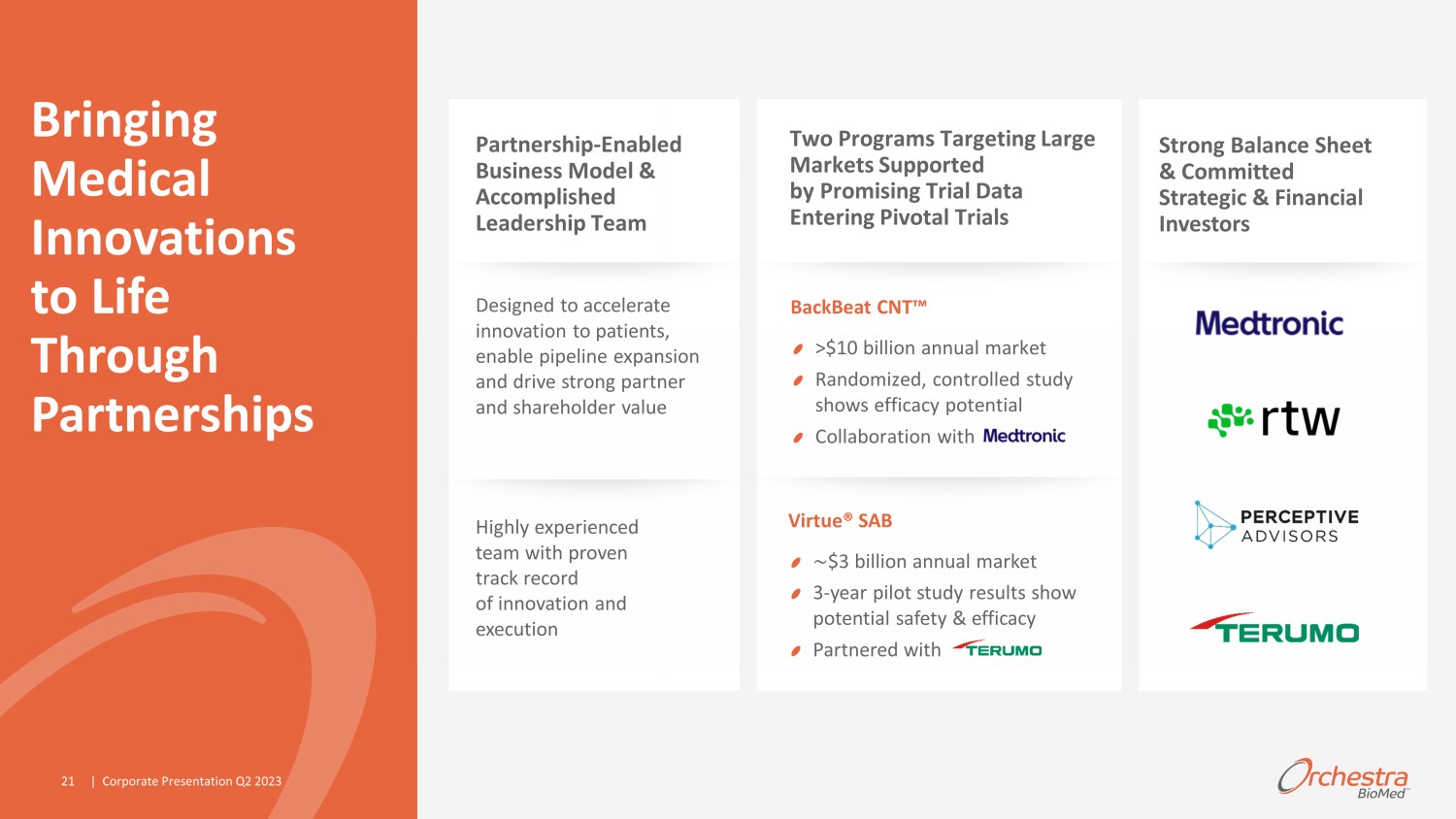
Orchestra BioMed 執行摘要強勁的資產負債表和傑出的投資者:強勁的 3 年多中心初步試驗安全性和有效性數據計劃啟動 p ivotal 試驗 2023 年下半年戰略合作雙位數收入份額 Virtue® SAB 的目標是:加速患者創新推動強大的合作伙伴和股東價值產生卓越的未來盈利能力具有統計學意義的雙盲,隨機初步試驗療效數據計劃啟動關鍵試驗 H2 2023 戰略合作雙位數收入份額 Ed 2023 年第二季度演講 3
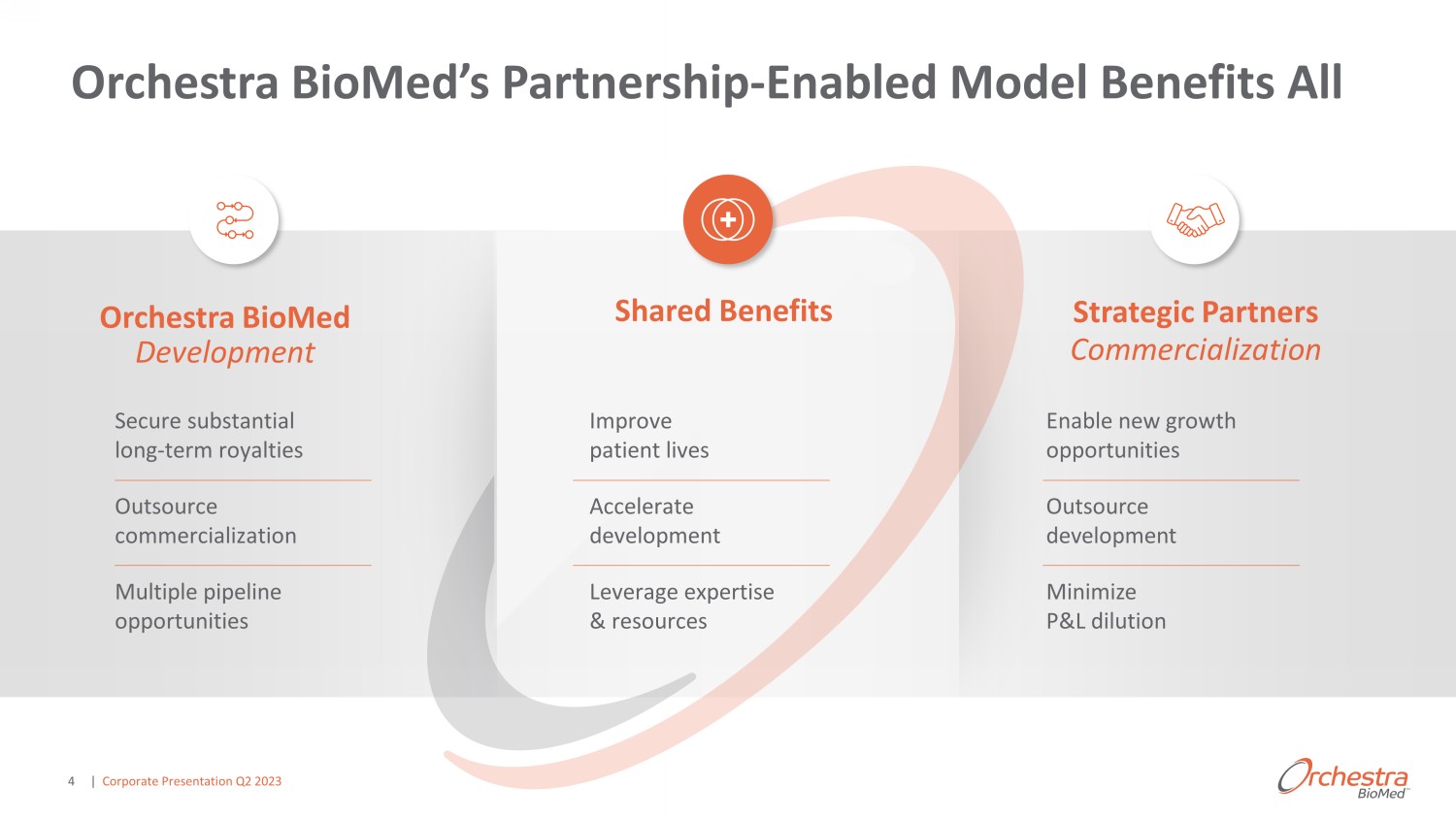
Orchestra BioMed Development 商業化戰略合作伙伴共享好處 ^gdgazai develop development 商業化戰略合作伙伴分享了好處 ^^^改善患者生活加速發展利用專業知識和資源實現新的增長機會外包開發最大限度地減少損益稀釋 Orchestra BioMed 的合作伙伴關係——啟用模式使所有人受益 | 2023 年第二季度企業演講 4

| 企業演示文稿 2023 年第 2 季度與 Virtue SAB 合作 > 15 億美元 5,000 萬美元股權投資 >25 億美元 3000 萬美元預付款 500-1600 美元 *根據公司估計,2025 年的總潛在市場;1 金額基於 (1) 每台設備的固定美元金額(金額因國家而異,因縣而異)或 (2) 百分比中的較高者銷售額。2 基於 Terumo 截至 2022 年 3 月 31 日的財年的合併財務業績。強有力的合作使我們能夠取得長期成功
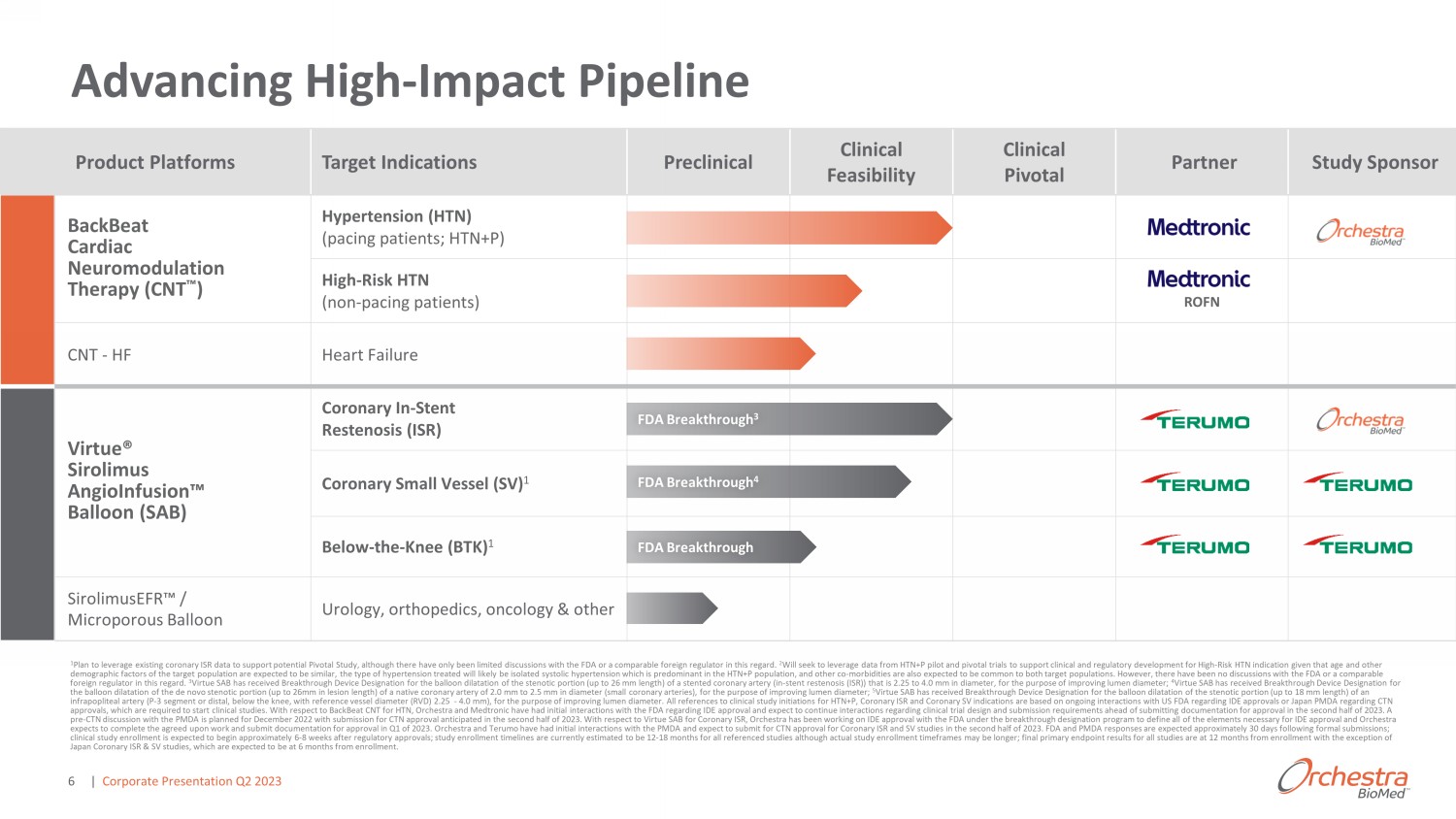
推進High-Impact Pipeline 1計劃利用現有的冠狀動脈ISR數據來支持潛在的Pivotal研究,儘管在這方面與美國食品藥品管理局或類似的外國監管機構的討論有限。2 鑑於目標人羣的年齡和其他人口統計學因素預計相似,將尋求利用HTN+P試點和關鍵試驗的數據來支持高危HTN適應症的臨牀和監管發展,治療的高血壓類型很可能是同義詞 d 佔主導地位的收縮期高血壓在HTN+P人羣中,預計其他合併發病率也將是兩個目標人羣的共同發病率。但是,在這方面沒有與美國食品藥品管理局或類似的外國監管機構進行過討論。3 Virtue SAB 已獲得突破性設備稱號,用於擴張直徑為 2.25 至 4.0 mm 的冠狀動脈(支架再狹窄 (ISR))的狹窄部分(長度不超過 26 mm),以改善管腔直徑;4 Virtue SAB 已獲得突破性設備稱號 2.0 mm 至 2.5 mm 的天然冠狀動脈的從頭狹窄部分(病變長度可達 26 毫米)的球囊擴張直徑(sm 所有冠狀動脈),目的是改善管腔直徑;5 Virtue SAB 已獲得突破性設備稱號,用於擴張髕下動脈(P-3 段或遠端,膝蓋以下,參考血管直徑 (RVD) 2.25-4.0 mm)的狹窄部分(長度不超過 18 mm),以實現管腔直徑。所有提及HTN+P、冠狀動脈ISR和冠狀動脈SV適應症的臨牀研究啟動均基於與美國食品藥品管理局就IDE批准或日本PMDA關於CTN批准的持續互動,這些都是開始臨牀研究所必需的。關於HTN的BackBeat CNT,Orchestra和Medtronic已經與美國食品藥品管理局就IDE批准進行了初步互動,預計在2023年下半年提交文件供批准之前,將繼續就臨牀試驗設計和提交要求進行互動。計劃於2022年12月與PMDA進行CTN前討論,預計將於2023年下半年提交CTN批准。關於冠狀動脈ISR的Virtue SAB,Orchestra一直在根據breakthr out gh指定計劃與美國食品藥品管理局合作獲得IDE批准,以定義IDE批准所需的所有要素,Orchestra預計將在2023年第一季度完成商定的工作並提交文件以供批准。Orchestra 和 Terumo 已經與 PMDA 進行了初步互動,預計將在 20 23 年下半年提交冠狀動脈ISR和SV研究的CTN批准。FDA和PMDA預計將在正式提交後約30天內做出迴應;臨牀研究入組預計將在監管部門批准後約6-8周開始;目前估計所有參考研究的研究入組時間為12-18個月,儘管實際的研究註冊時間可能更長;f所有研究的最終主要終點結果均為入組後的12個月,但日本冠狀動脈ISR和SV研究除外,這些研究預計為入組6個月。產品平臺目標適應症臨牀前臨牀可行性臨牀關鍵合作伙伴研究贊助商 backBeat 心臟神經調節療法 (CNT) 高血壓 (HTN)(起搏患者;HTN+P)高風險 HTN(非起搏患者)ROFN CNT-HF 心力衰竭 Virtue® Sirolimus AngioInfusion 氣球 (SAB) 冠狀動脈介入支架再狹窄 (ISR) low-the-Knee (BTK) 1 sirolimuseFR /微孔氣球泌尿外科、骨科、腫瘤學和其他 FDA 突破 3 FDA Breakthrough 4 FDA Breakthrough 4 FDA Breakthrough | 第二季度企業演講2023 6

高管團隊:| >350 年經驗 | 平均行業年限約 25 年 | >100 項產品批准 | >600 項著作專利大衞·霍赫曼董事長、首席執行官、創始人達倫·謝爾曼總裁、首席運營官、創始人安德魯·泰勒首席財務官尤瓦爾·米卡,生物電子療法董事經理兼首席技術官喬治·帕潘德里歐博士,Focal Therapies Hans-Peter Stoll 博士,醫學博士首席臨牀官 Bill Little 企業開發與戰略執行副總裁 Avi Fischer,醫學博士,醫學事務與創新高級副總裁 J.C. Simeon 高級副總裁,Quality Inessa R. Wheeler 營銷副總裁 Bob Laughner 副總裁,監管事務 Stephen A. Zielinski 生物電子療法產品開發副總裁 Ziv Belsky 生物電子療法研究副總裁 Juan Lorenzo 副總裁、焦點療法產品開發成就卓著的高管團隊兼董事會成員 Jason Aryeh Pamela Connealy Eric S. Fain,醫學博士 Eric A. Rose,醫學博士 Geoffrey W. Smith | 2023 年第二季度公司演講 7
BackBeat 心臟神經調節療法 (CNT) | 2023 年第二季度公司簡報 8
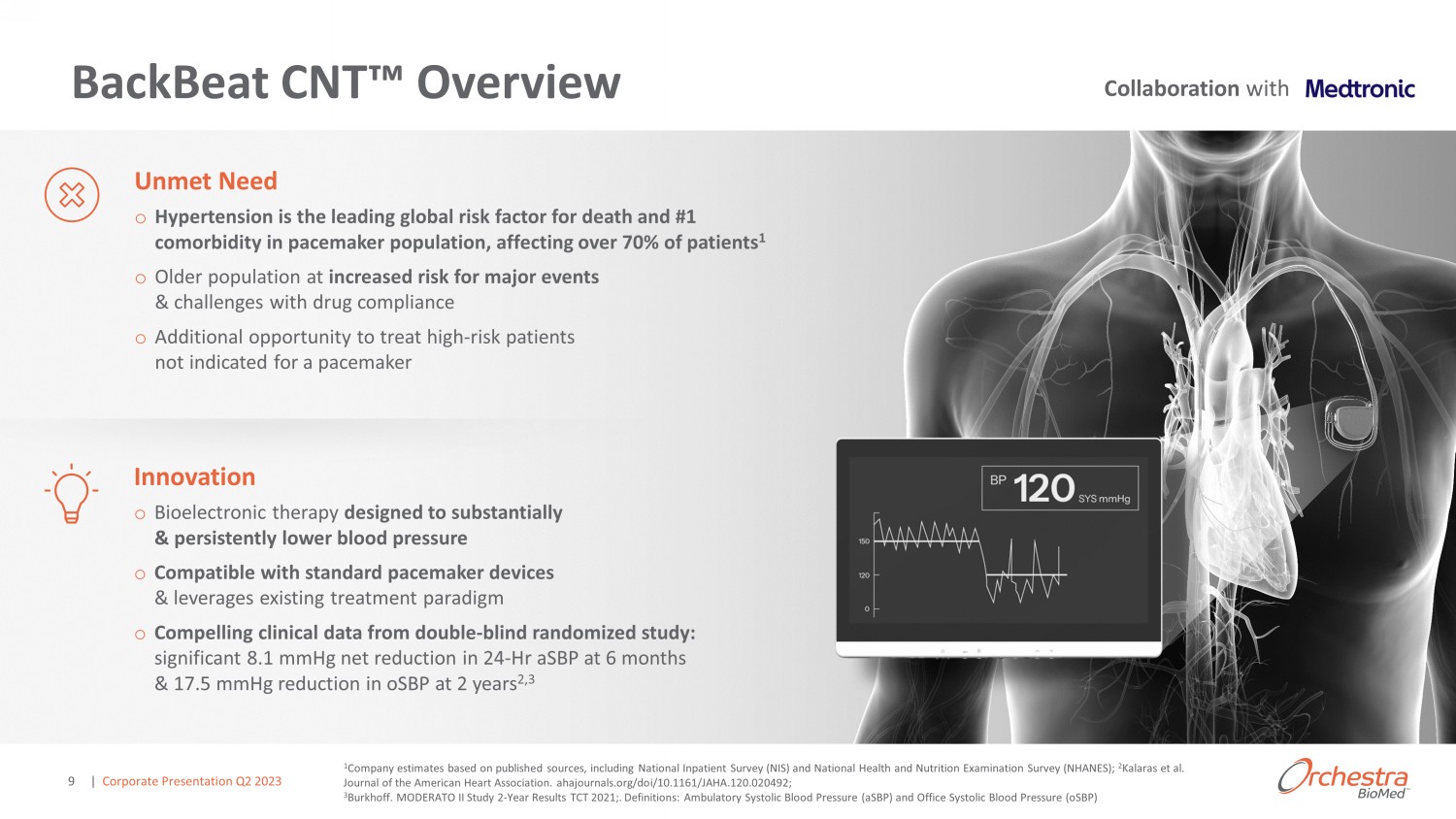
BackBeat CNT 概述 1 公司根據已公佈的資料估計,包括全國住院患者調查 (NIS) 和全國健康與營養考試調查 (NHANES);2 Kalaras 等人《美國心臟協會雜誌》。ahajournals.org/ doi /10.1161/JAHA.120492;3 Burkhoff。MODERATO II 研究 2-2021 年 TCT 年度成績;.定義:動態收縮壓 (asBP) 和辦公室收縮壓 (osBP) o 高血壓是起搏器人羣中死亡和 #1 合併症的主要全球危險因素,影響了超過 70% 的患者 1 o 老年人羣發生重大事件和藥物依從性挑戰的風險增加 o 治療未適宜使用起搏器的高危患者的額外機會未得到滿足 ned o 旨在大幅持續降低血壓的生物電子療法 o 與標準起搏器設備和槓桿兼容現有治療範式 o 來自雙盲隨機研究的令人信服的臨牀數據:24 小時的 asbP 在 6 個月時淨減少了 8.1 mmHg,2 年後 osbP 顯著減少 17.5 mmHg 2,3 與 | 企業演示文稿 2023 年第二季度 9

| 企業演示文稿 2023 年第 2 季度 10 治療目標人羣高血壓的巨大全球機會 *根據公司估計,2025 年的總潛在市場;1公司根據已公佈的資料進行估計,包括全國住院患者調查 (NIS) 和全國健康和營養檢查調查 (NHANES);2已知且特徵明確的人羣,有多個參考文獻;定義:高血壓 (HTN) 年度全球機會高危HTN 約 0.2% 的24萬名患者超過 80 億美元的患者 HTN + Pacemaker 約 70% 的心臟起搏器患者 750,000 名患者 >20 億美元 >100 億美元的潛在年度全球市場機會* >310 萬可尋址的 HTN 患者
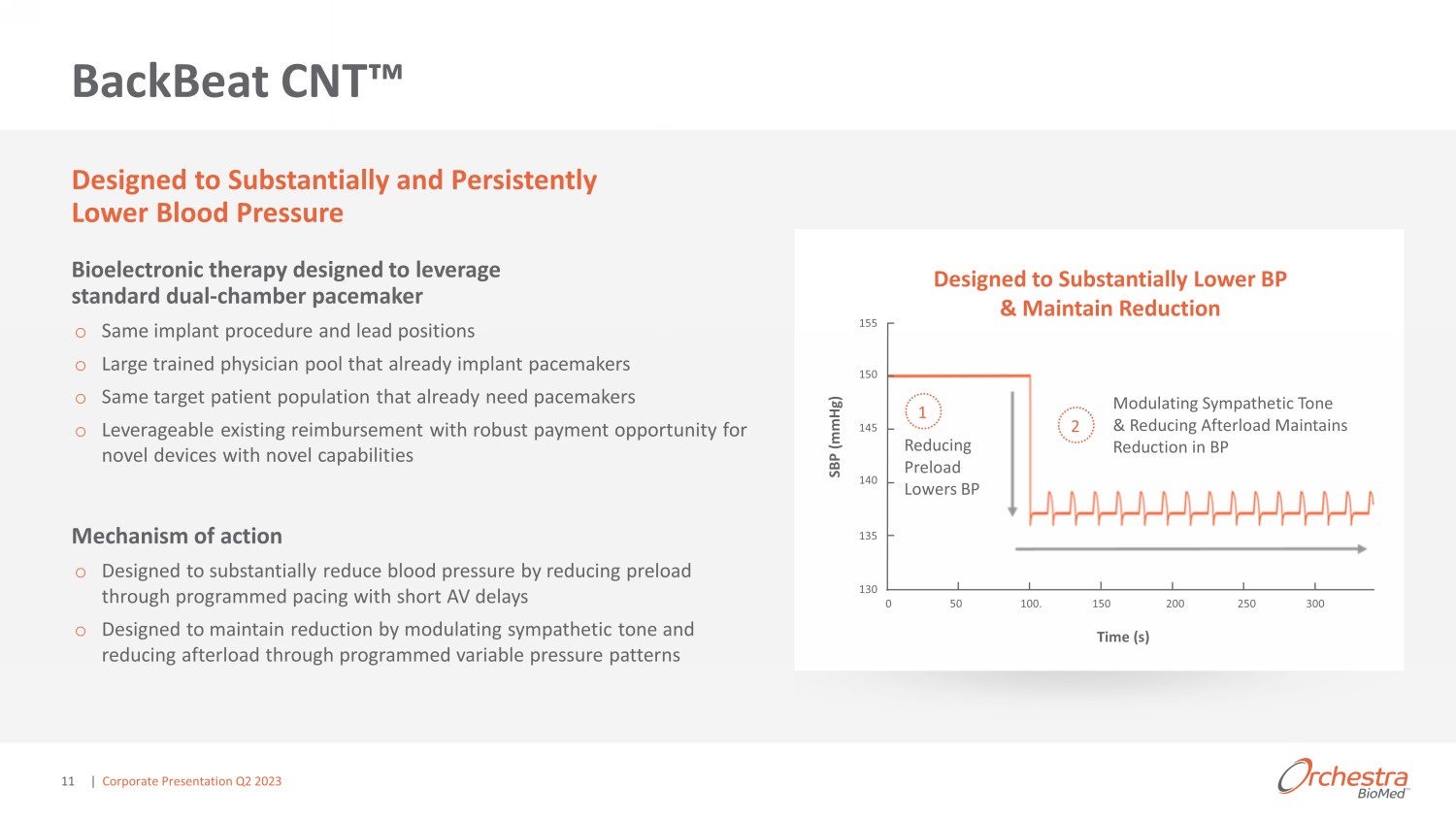
backBeat CNT ²旨在大幅持續降低血壓生物電子療法,旨在利用標準的雙腔起搏器 o 相同的植入手術和主導職位 o 訓練有素的大型醫生庫已經植入起搏器 o 已經需要起搏器的相同目標患者羣體 o 可利用現有報銷,為具有新功能的新型設備提供強勁的付款機會作用機制 o 旨在通過使用短音室編程來減少預負荷來大幅降低血壓延遲 o 旨在通過調節交感神經音調和通過編程的可變壓力模式減少後負荷來保持減速設計旨在大幅降低血壓並保持減壓減少預負荷降低血壓調節交感神經音調和減少後負荷保持縮短 BP SBP (mmHg) 時間 155 0 50 100。150 200 300 150 140 140 130 1 2 | 企業演示文稿 2023 年第二季度 11
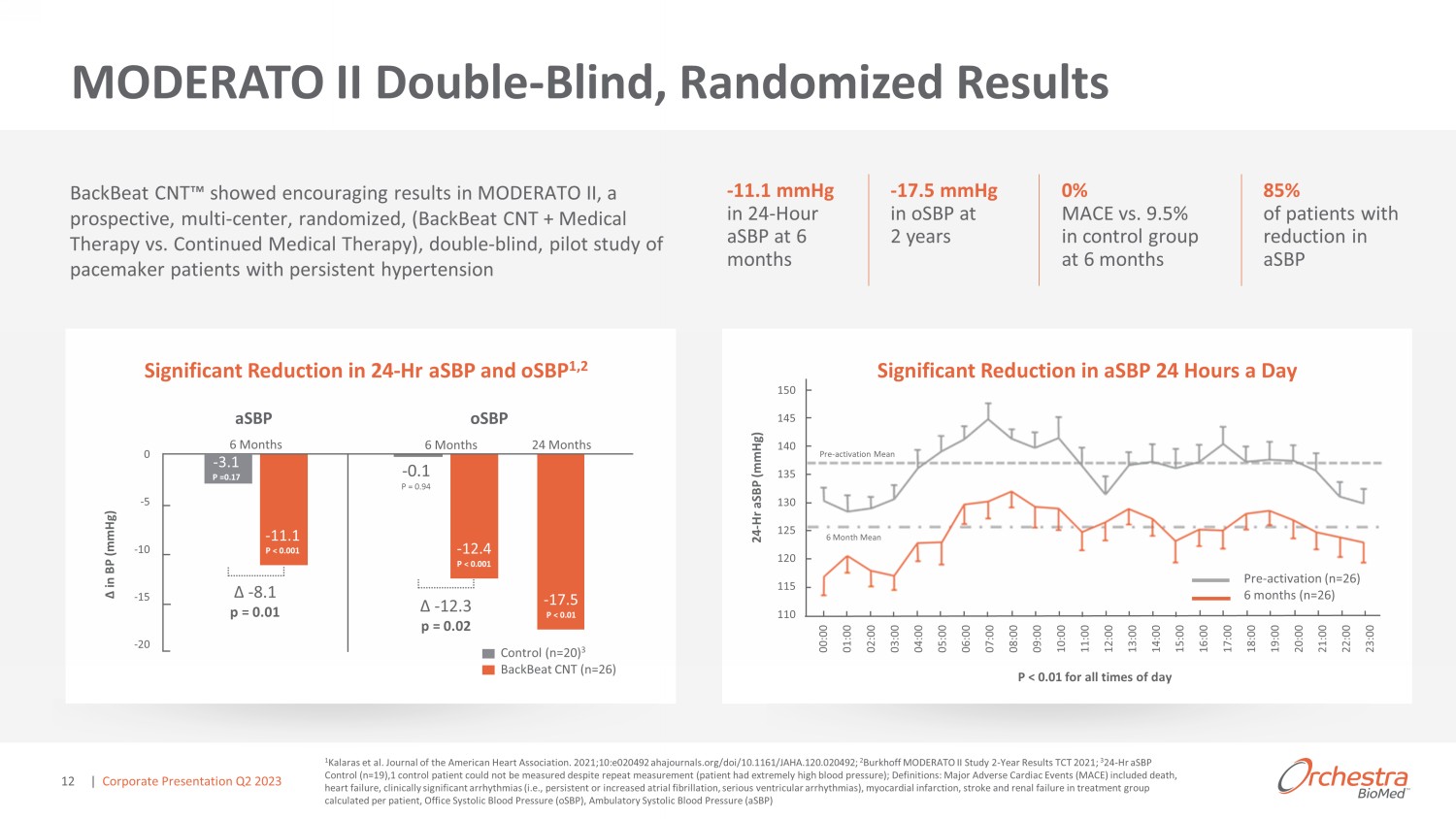
MODERATO II Double-Blind,隨機結果 1 Kalaras 等人《美國心臟協會雜誌》。2021;10:e020492 ahajournals.org/ doi /10.1161/JAHA.120492;2 Burkhoff MODERATO II 研究 2 年結果 TCT 2021;3 24-Hr asbp 控制 (n=19) 1 儘管重複測量(患者血壓極高),但仍無法測量對照患者;D 定義:嚴重心臟不良事件 (MACE) 包括死亡、心力衰竭、臨牀上顯著的心律失常(即持續或增加的心房顫動、嚴重的心室 arr hyt hmias)、心肌梗塞、中風和治療中的腎衰竭按患者計算的羣組,辦公室收縮壓 (osbP),動態收縮壓 (asbP) 150 145 140 135 135 125 125 125 115 110 110 000 01:00 02:00 03:00 07:00 08:00 08:00 10:00 12:00 13:00 15:00 17:00 19:00 21:00 23:00 24-Hr asbp (mmHg) P }

backBeat CNT Pivotal Trial Design Pivotal 試驗設計功效終點:安全終點:| 2023 年第二季度企業演示文稿 13

ssèg^^^

Virtue® SAB 概述 1 von Birgelen 等人JACC Vol. 59,第 15 期,2012 年 4 月 10 日:1350 — 61;Virtue SAB 已獲得突破性設備稱號:2 直徑為 2.25 至 4.0 mm 的冠狀動脈(支架再狹窄 (ISR))狹窄部分(長度不超過 26 mm)的球囊擴張,目的是改善管腔直徑;3 新生的球囊擴張 o 直徑為 2.0 mm 至 2.5 mm 的天然冠狀動脈(小冠狀動脈)的狹窄部分(病變長度不超過 26mm),目的是改善管腔直徑;4 球囊擴張腋下動脈(P-3 段或遠端,膝蓋以下,參考血管直徑 (RVD) 2.25-4.0 mm)的狹窄部分(長度不超過 18 mm),目的是改善管腔直徑。o 動脈疾病是美國乃至全球的主要死因 o 全球範式向藥物轉變 —— 將氣球從支架上脱出用於治療冠狀動脈的適應症 o Current 治療選擇不理想,與長期風險和併發症有關 Unmet Need o 高度差異化、非塗層藥物/設備組合候選產品旨在通過支持血管成形術來減少長期併發症,延長釋放西羅莫司 o 在多中心冠狀動脈 ISR 臨牀試驗中取得令人信服的臨牀結果,隨訪 3 年 —— 1 o 冠狀動脈 ISR 2、冠狀動脈 SV 3 和 BTK 4 的適應症獲得 FDA 突破性設備稱號 | 企業演示文稿 2023 年第二季度 15

*根據公司估計,2025年總潛在市場;定義:冠狀動脈疾病(CAD)、外周動脈Dise(PAD)、支架內再狹窄(ISR)、小血管(SV,≤2.5mm)、高出血風險 De Novo(>2.5mm)、膝蓋以下(BTK、Rutherford 3-6,沒有嚴重的合併症)。外圍 BTK 大約 1,250 萬名患者 cadio ISR,SV De Novo,高出血風險約 2,000,000 名患者 >18 億美元 >30 億美元的全球 CAD 和 PAD 年度市場機會 * 新型 Angio Infusion 氣球的巨大機會

Virtue® SAB 旨在通過受保護的西羅莫司輸送實現血管成形術,同時不留下任何金屬 /1ng/mg 肺和肝臟所需的治療濃度 > 1ng/mg 肺和肝臟所需的治療濃度 > 1ng/mg 肺、肝臟和肝臟腎臟低於 的測定量水平(0.1 ng/mg)
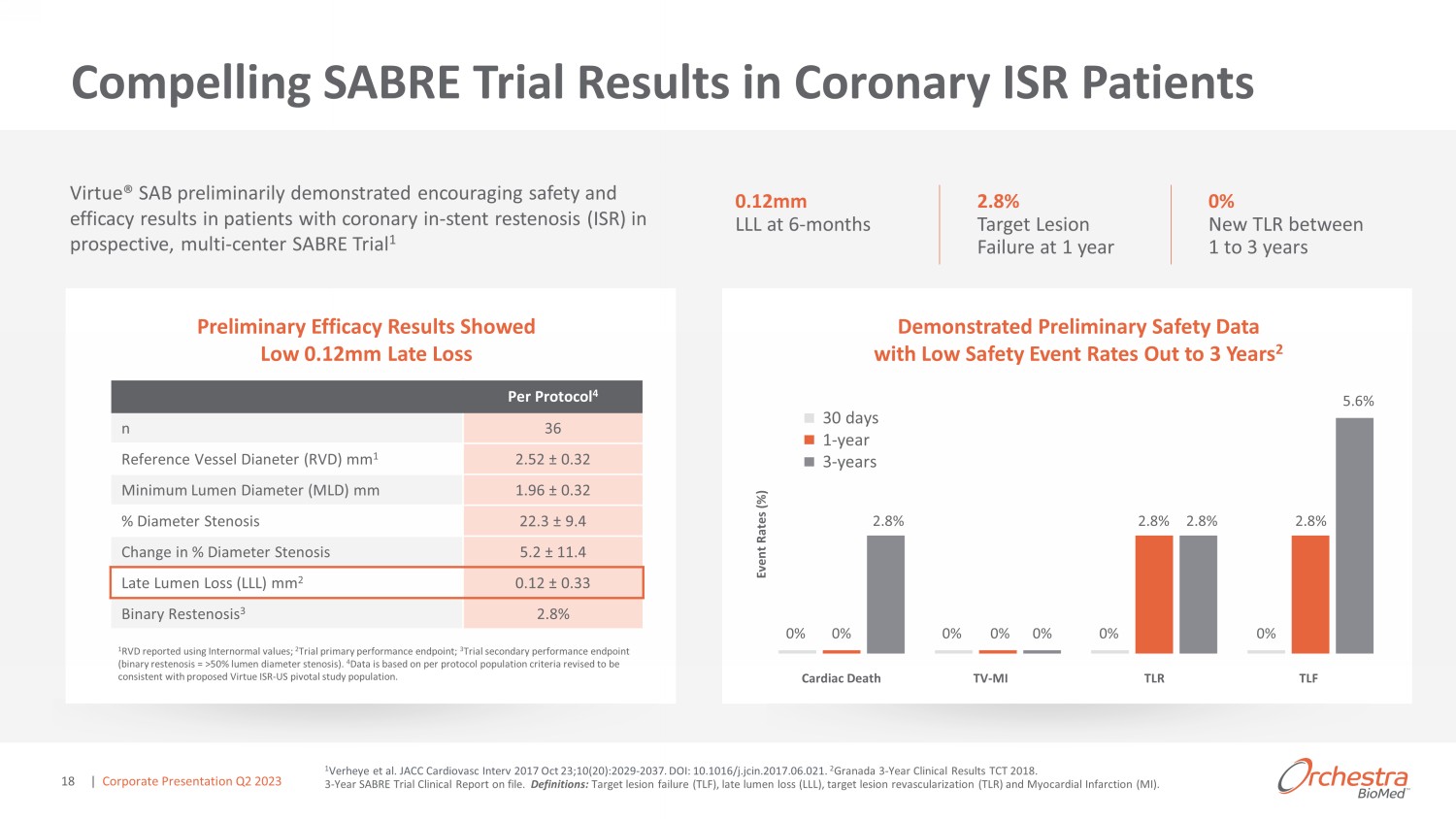
冠狀動脈 ISR 患者的令人信服的 SABRE 試驗結果 sagcree SAB: sgèza'zaaèád>&&//3年的比率 2 初步療效結果顯示較低 0.12mm Late Loss Virtue® SAB 初步顯示出令人鼓舞的安全性和有效性前瞻性多中心 SABRE 試驗 1 0.12mm LLL 在 6 個月時對冠狀動脈內支架再狹窄 (ISR) 患者的結果 2.8% 1 年目標病變失敗 egd>z 5.6% 2.8% 0% 0% 0% 0% 2.8% 心臟死亡電視-MI TLR d>& 事件速率 (%) 每個協議 4 n 36 參考血管 dianeter (RVD) mm 1 2.52 0.32 最小流明直徑 (MLD) mm 1.96 0.32 直徑狹窄 22.3 9.4 直徑變動 5.2 11.4 後期流明損失 (LLL) mm 2 0.12 0.33 二進制再狹窄 3 2.8% 1 RVD 使用正態間值報告;2 試驗主要性能終點;3 試驗次要性能終點(二元再狹窄 = > 50% 流明直徑狹窄)。4 數據基於每個協議羣體標準,修訂後與擬議的 Virtue ISR——美國關鍵研究人羣一致。| 企業演示文稿 2023 年第二季度 18
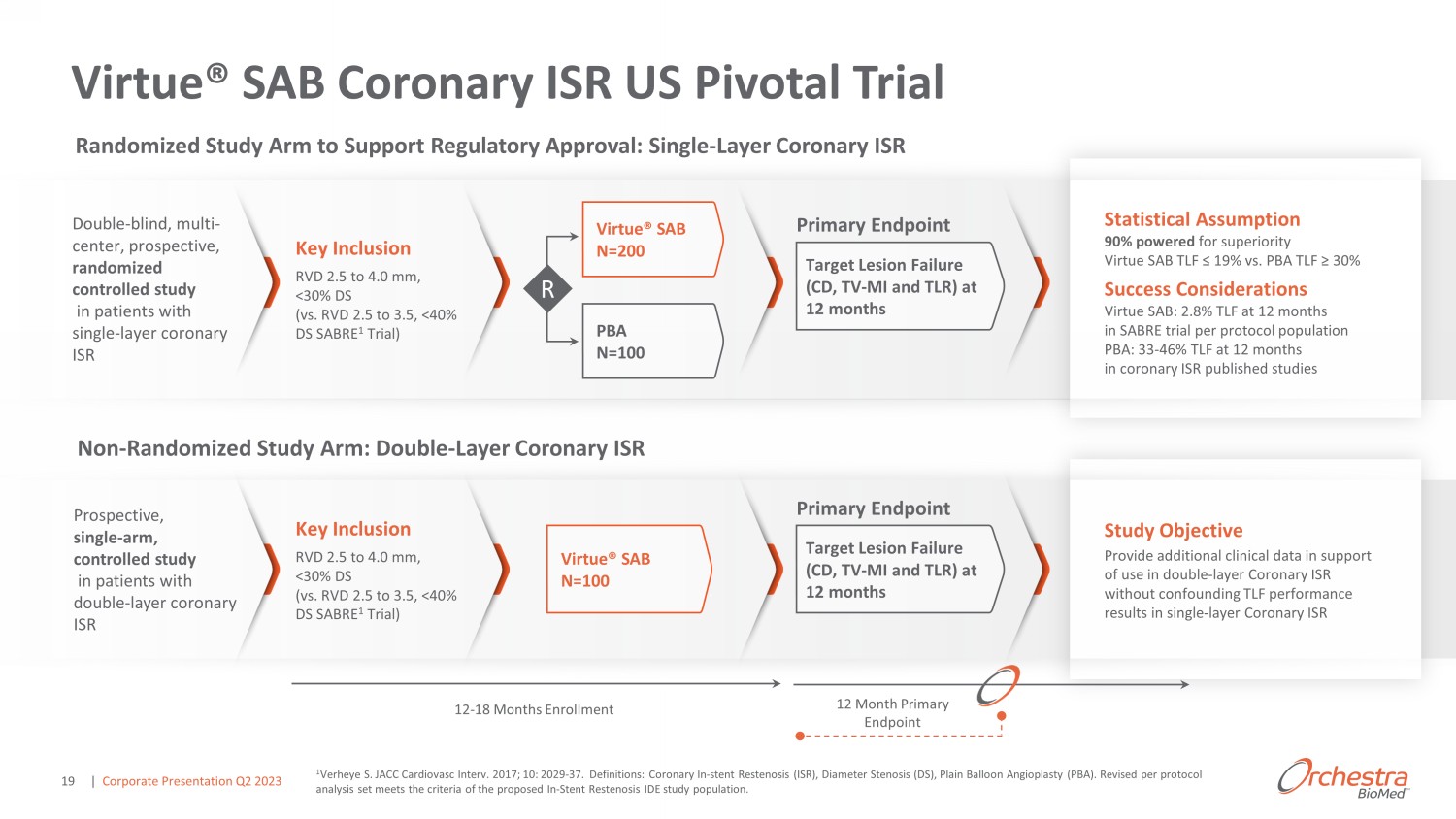
Virtue® SAB 冠狀動脈 ISR US Pivotal 試驗統計假設 90% 支持優越性 Virtue SAB TLF ≤ 19% vs PBA TLF ≥ 30% 成功考慮因素 Virtue SAB:在冠狀動脈 ISR 發表的研究中,12 個月時的 TLF 為 33-46% ^/^z R

2023 年——預期里程碑 backBeat CNT HTN + Pacemaker 1 st Pt招生計劃監管里程碑計劃中的臨牀里程碑 Ed,dewádga&/Virtue SAB Virtue — ISR 美國 FDA IDE 批准日本 PMDA CTN 冠狀動脈 ISR 批准 1 日本 PMDA CTN 冠狀動脈 SV 批准 1 dsèskèdgai ^^sèz^sèzèdgggzzzazz^sèz^sèz^sèz^sèz^sèèzz^sèèzz/^ Z: AVirtue SAB Virtue SAB Virtue-ISR US 1st Pt.招生 CNT-HF 和 SirolimuseFR 計劃更新 | 2023 年第二季度公司演講 20
通過合作伙伴關係將醫學創新變為現實 dzwzözzaau daagsau dai daugzai i dau dai daugzaai 強勁的資產負債表和堅定的戰略和財務狀況 Investors wa???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????? 每年30億美元的市場 3 年試點研究結果顯示出潛力安全性和有效性與 x?????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????? 2023 年第二季度
.