
公司介紹納斯達克:CRIS © 2023 Curis, Inc. 附錄 99.2

關於前瞻性聲明和免責聲明的警示説明本演示文稿包含經修訂的1995年《私人證券訴訟改革法》所指的關於Curis, Inc.(“我們” 或 “公司”)的某些前瞻性陳述。諸如 “期望”、“相信”、“將”、“可能”、“預期”、“重點”、“計劃”、“使命”、“戰略”、“潛力”、“估計”、“打算”、“項目”、“尋求”、“應該”、“將” 等詞語旨在識別前瞻性陳述。前瞻性陳述是指非歷史事實的陳述,反映了管理層截至本演示文稿之日的預期,涉及重要的風險和不確定性。此處的前瞻性陳述包括但不限於有關未來臨牀和臨牀前里程碑的時間和結果的陳述;未來臨牀前研究和臨牀試驗的時機以及這些研究和試驗的結果;我們的候選藥物的臨牀和治療潛力;我們的現金跑道;對emavusertib的擬議重點以及管理層成功實現其目標的能力。這些前瞻性陳述基於我們目前的預期,可能與實際結果存在重大差異,原因有多種重要因素,包括但不限於以下風險:美國食品藥品監督管理局是否以及何時會對我們的試驗採取進一步的監管行動,我們的候選藥物是否會在臨牀開發過程中取得進一步進展,以及它們是否以及何時獲得美國食品藥品管理局或同等外國監管機構的批准;臨牀前歷史結果將預測未來的臨牀試驗結果;歷史臨牀試驗結果是否可以預測未來的試驗結果;我們的任何候選藥物開發工作是否會成功;我們的任何候選藥物如果獲得批准,是否會成功上市;我們實現合作協議所設想的好處的能力;管理層成功實現其目標的能力;現金資源的充足性;我們以我們可接受的條件籌集額外資金為我們的運營提供資金的能力,或者我們的使用情況任何證券或其他融資發行的收益、總體經濟狀況、競爭以及我們向美國證券交易委員會提交的定期報告中包含的其他風險因素,包括公司截至2022年12月31日財年的10-K表年度報告和公司截至2023年3月31日的季度10-Q表季度報告,這些報告可在美國證券交易委員會網站www.sec.gov上查閲。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本文發佈之日,除非法律要求,否則我們沒有義務修改和傳播前瞻性陳述以反映本文發佈之日之後的事件或情況,或反映任何事件的發生或不發生。本演示文稿包括我們從行業出版物和第三方進行的研究、調查和研究中獲得的統計數據和其他行業和市場數據,以及我們自己的估計。本演示文稿中使用的所有市場數據都涉及許多假設和侷限性,請注意不要過分重視這些數據。行業出版物和第三方研究、調查和研究通常表明,他們的信息是從被認為可靠的來源獲得的,儘管它們不能保證此類信息的準確性或完整性。我們對候選產品潛在市場機會的估計包括基於我們的行業知識、行業出版物、第三方研究和其他調查的幾個關鍵假設,這些假設可能基於較小的樣本量,可能無法準確反映市場機會。雖然我們認為我們的內部假設是合理的,但沒有獨立的消息來源證實過這樣的假設。幻燈片 2

投資論文 Emavusertib 是一種三靶點抑制劑,有可能成為血液系統惡性腫瘤的基石藥物 Cash runway 到 2025 年 — 截至 2023 年 3 月 31 日,7180 萬美元主導項目 TakeAim 白血病 — IRAK4 和 FLT3 是 AML/MDS1,2 Takeaim 淋巴瘤中最常見的疾病驅動因素 — emavusertib/ibrutinib 可以阻斷 NHL 中驅動 NF-B 的兩種途徑市場機會 AML/MDS:31.7 萬名患者3(目前的護理標準是 HMA)NHL/CLL:180 萬名患者3(目前的護理標準是 btKi)2024 年裏程碑 • 澄清單一療法美國食品藥品管理局對白血病的註冊研究設計 • 復發/複發性白血病(單一療法和聯合療法)的最新數據 • R/R 淋巴瘤(組合)幻燈片 3 企業概述摘要 1)Smith 等人的最新數據Nat Cell Biol 2019;2) Saygin 等人J Hematol Oncol. 2017 年 4 月 18 日;3) 2022 年流行率數據 DRG Clarivate

最新進展在基因定義的復發/急性髓細胞白血病人羣中擴大單一療法的現狀(有可能快速獲得保密協議)下一步 o 向美國食品藥品管理局澄清白血病單一療法註冊研究設計 o 擴展到白血病一線聯合療法(潛在的廣泛商業機會)幻燈片 4 突發新聞:• 美國食品藥品管理局取消了對TakeAim白血病的部分臨牀保留 • RP2D 確定為 300 mg BID

Emavusertib:機制與設計
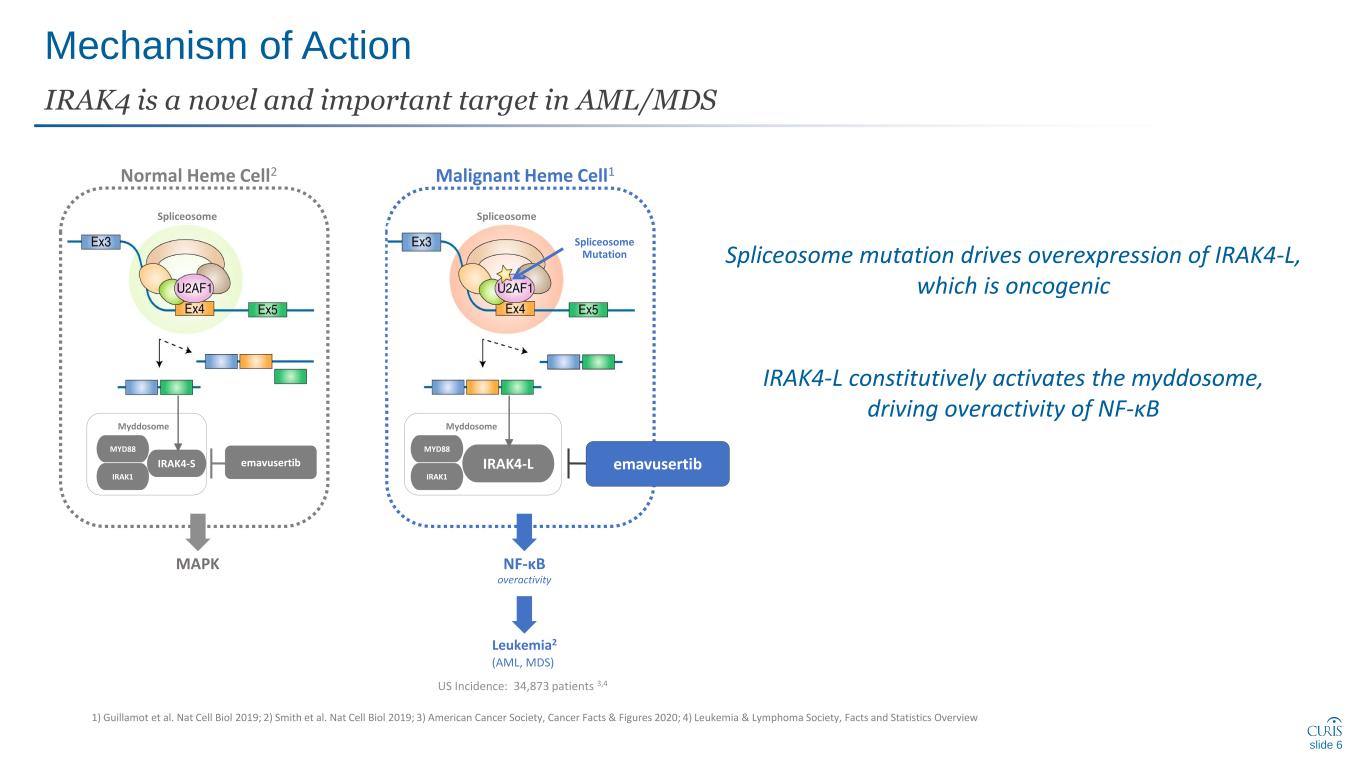
作用機制 IRAK4 是 AML/MDS 中的一個新穎而重要的目標 1) Guillamot 等人。Nat Cell Biol 2019;2) Smith 等人Nat Cell Biol 2019;3) 美國癌症協會,2020 年癌症事實與數據;4) 白血病和淋巴瘤協會,事實與統計概述 Myddosome IRAK1 IRAK4-S MYD88 Myddosome IRAK1 IRAK4-L MYD88 惡性血紅素細胞1 剪接體正常血紅素細胞2 剪接體突變美國發病率:34,873 名患者 3,4 emavusertib 白血病2(AML,MDS)nf-κB emauservimia tib 過度活躍 MAPK slide 6 slide 6 slide spliceosome 突變會導致 IRAK4-L 的過度表達,這是致癌的 IRAK4-L 會本構地激活 myddosome,推動 nf-B 的過度活躍
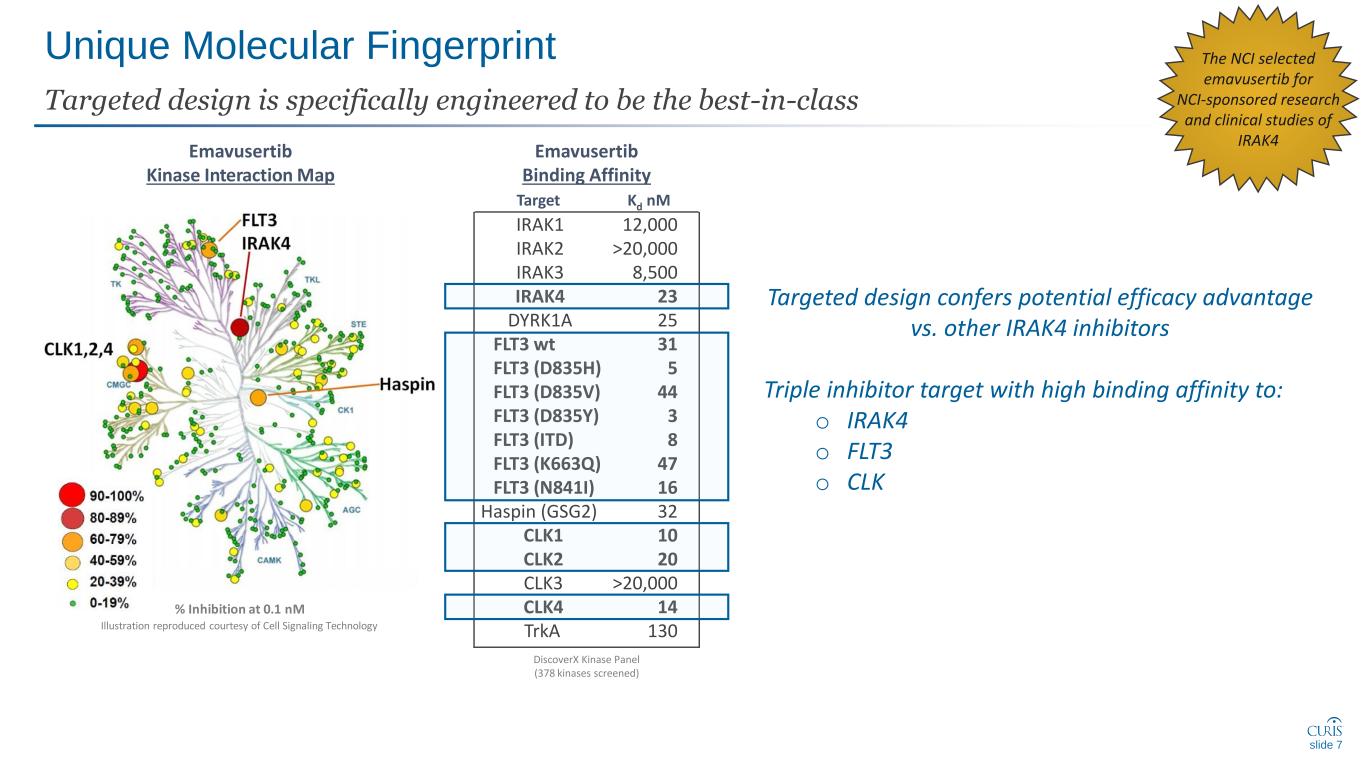
獨特的分子指紋靶向設計經過專門設計,成為同類最佳的 Emavusertib 激酶相互作用圖在 0.1 nM 時抑制百分比。插圖由細胞信號傳導技術轉載 Target kd nM IRAK1 12,000 IRAK2 >20,000 IRAK3 8,500 IRAK4 23 DYRK1A 25 FLT3 (D835H) 31 5 FLT3 (D835V) 4 FLT3 () 3 FLT3 (TD) 4 FLT3 (TD) 47 FLT3 (haspin (GSG2) 32 CLK1 10 CLK2 20 CLK3 >20,000 CLK4 14 trkA 130 Emavusertib Binding Affinity DiscoverX 激酶面板(篩選了 378 個激酶)NCI 選擇 emavusertib 作為 NCI-D835Y K663Q N841I贊助的 IRAK4 slide 7 三重抑制劑靶標的研究和臨牀研究:o IRAK4 o FLT3 o CLK 與其他 IRAK4 抑制劑相比,靶向設計具有潛在的療效優勢

Emavusertib 在白血病中的應用 (AML/MDS)
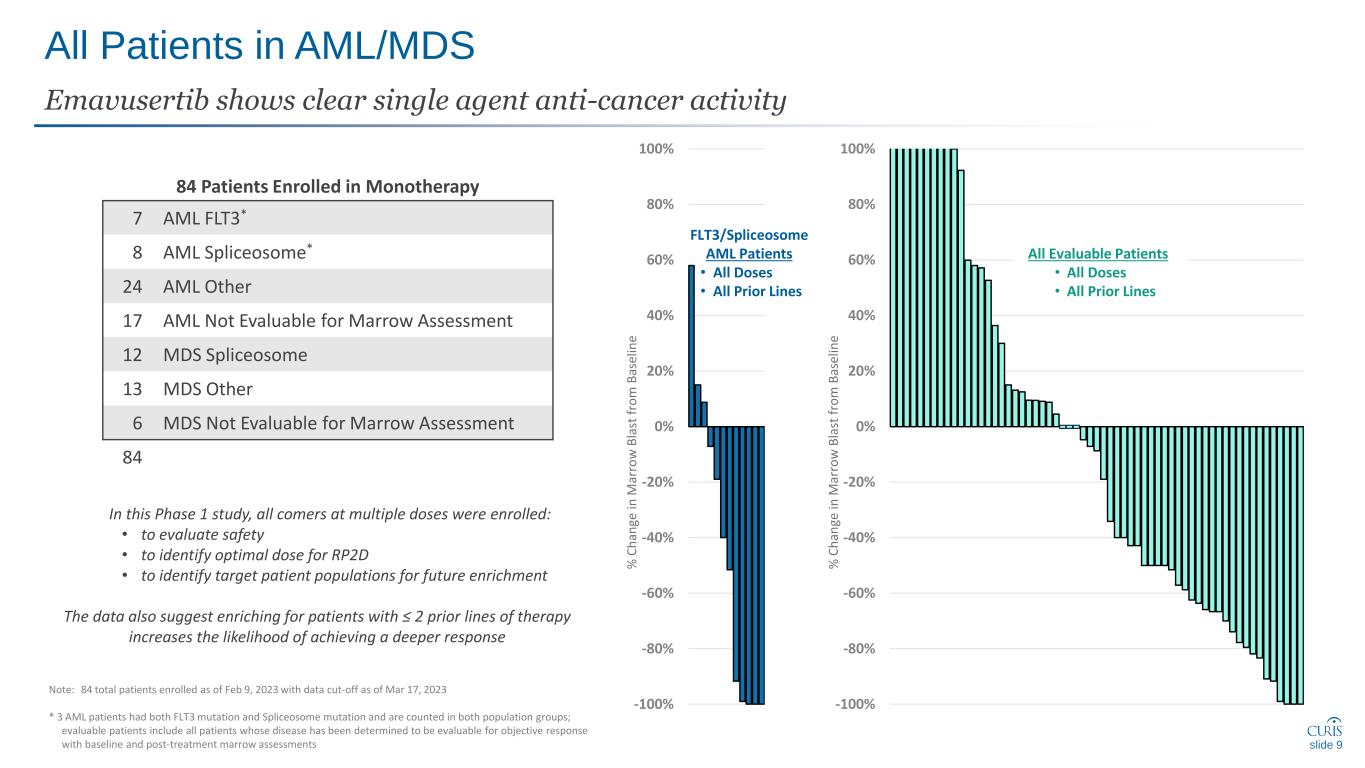
-100% -80% -60% -40% 0% 20% 40% 80% -100% -80% -40% -20% -20% 20% 40% 80% 100% AML/MDS Emavusertib 中的所有患者都顯示了清晰的單藥抗癌活性幻燈片 9 注意:截至 2023 年 3 月 17 日,共有 84 名患者入組,數據截止 * 3 名急性髓細胞白血病患者同時有 FLT3 突變和剪接體突變,同時計入兩個人羣羣體;可評估的患者包括所有通過基線和治療後骨髓評估確定其疾病可進行客觀反應評估的患者 84 患者加入了單一療法 7 AML FLT3* 8 急性髓細胞剪接體* 24 AML 其他 17 AML 無法評估骨髓評估 12 MDS spliceosome 13 MDS 其他 6 MDS 無法評估骨髓評估 84 在這項 1 期研究中,所有服用多劑量的患者都被招募了:• 評估安全性 • 確定 rp2D 的最佳劑量 • 確定目標患者羣體,以便將來富集。數據還建議對患有 2 的患者進行豐富先前的治療線路增加了獲得更深層反應的可能性 flt3/spliceosome 急性髓細胞白血病患者 • 所有劑量 • 所有先前系列所有可評估的患者 • 所有劑量 • 所有之前的線路% C h 和 ge in m ar r w b la st f ro m B as el in e% C h 和 ge in m ar r w b la st f ro m B as el in e

遺傳定義的目標人羣在目標患者羣體中觀察到單一療法顯著減少爆炸計數下滑 10 CR CR MLFS -100% -80% -40% -20% crH -100% -80% -60% -40% -20% 0% ** 7 名患者 AML 伴有 FLT3 剪接突變*** 所有劑量和 2-5 條先前線注——參加 emavusertib 單一療法研究的患者共有 84 人 2023 年 2 月 9 日,截止數據截止於 2023 年 3 月 17 日 * 3 名急性髓細胞白血病患者既有 FLT3 突變又有 sliceosome(U2AF1 或 SF3B1)突變,兩者都計入其中人羣;可評估的患者包括所有通過基線和治療後骨髓評估確定其疾病可以客觀反應評估的患者 ** 表示爆炸百分比增加 > 10% C h 和 ge in m ar ro w b la st f ro m b as e e e 中 e ar ro w b a s e e 中有 e ar ro w b la st f ro m B as el
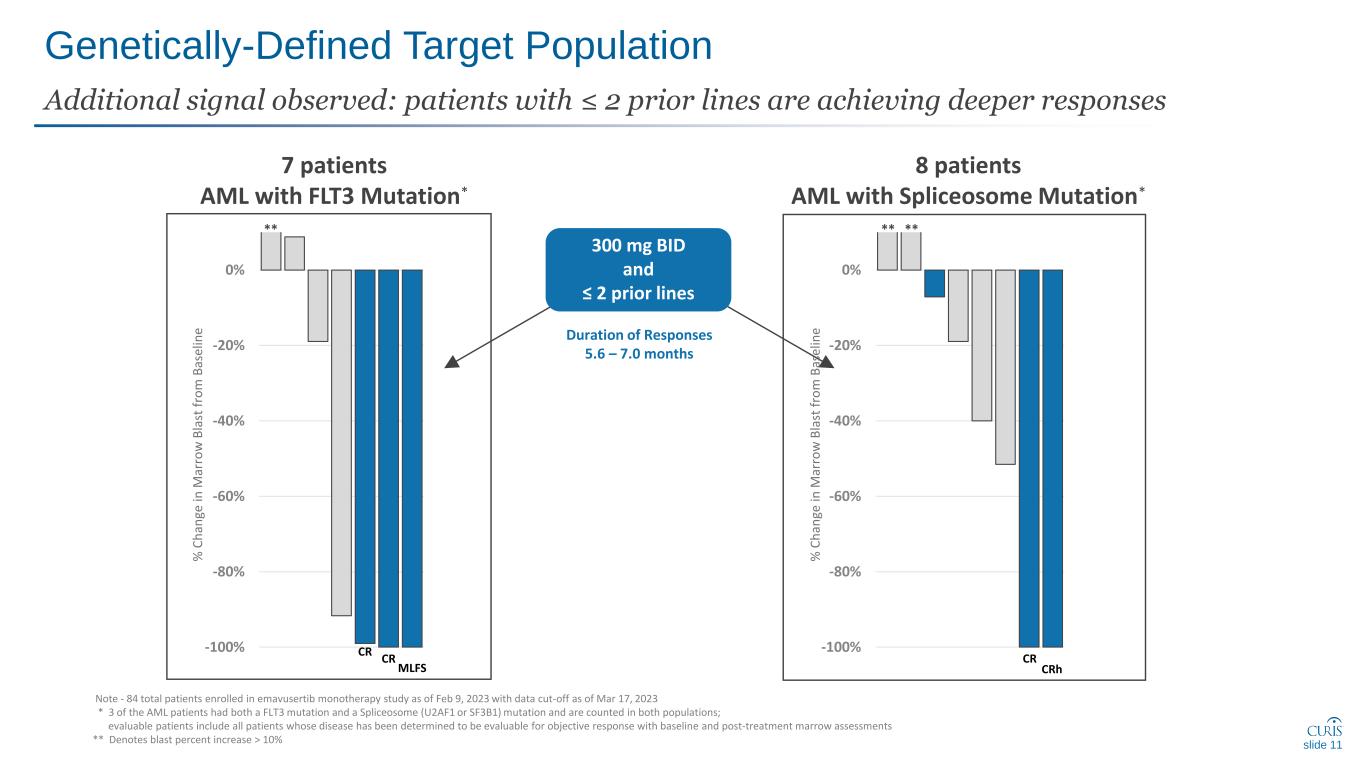
CR CR MLFS -100% -80% -60% -40% -20% crH -100% -80% -60% -40% -20% 0% 遺傳定義目標人羣觀察到其他信號:之前有 ≤ 2 條系的患者反應更深層次幻燈片 11 ** 7 患者 AML 伴有剪接體突變* ** 300 mg BID 和 ≤ 2 條之前的反應時間 5.6 — 7.0 個月% C h 和 ge in m ar ro w B la st f ro m B as el in e% C h 和 ge in m ar ro w B la st f ro m B as el in e 注意——截至 2023 年 2 月 9 日,參加 emavusertib 單一療法研究的患者總數為 84 人,有數據截止至 2023 年 3 月 17 日 * 3 名急性髓細胞白血病患者既有 FLT3 突變又有 sliceosome(U2AF1 或 SF3B1)突變,並計入兩個人羣;可評估的患者包括所有通過基線和治療後骨髓評估確定其疾病可以客觀反應評估的患者 ** 表示爆炸百分比增加 > 10%

0% p

白血病的臨牀策略 TakeAim 白血病單一療法策略和一線位置組合的聯合潛力招收 20 名患者(1L)所有來自 aza/ven o 一線 MDS 組合的患者(1L)對於每種適應症,收集大約 20 名患者的臨牀數據,以確定安全性和抗癌活性,以支持與監管機構進行討論 NDA 單一療法的快速途徑招收 20 名患者(2L/3L)進行遺傳學研究使用 FLT3 的 R/R AML 定義種羣 o R/R AML 和剪接體對於每種適應症,收集約20名患者的臨牀數據,以促進與監管機構的關鍵設計討論,包括加速開發的可能性

Emavusertib 治療淋巴瘤 (NHL/CLL)
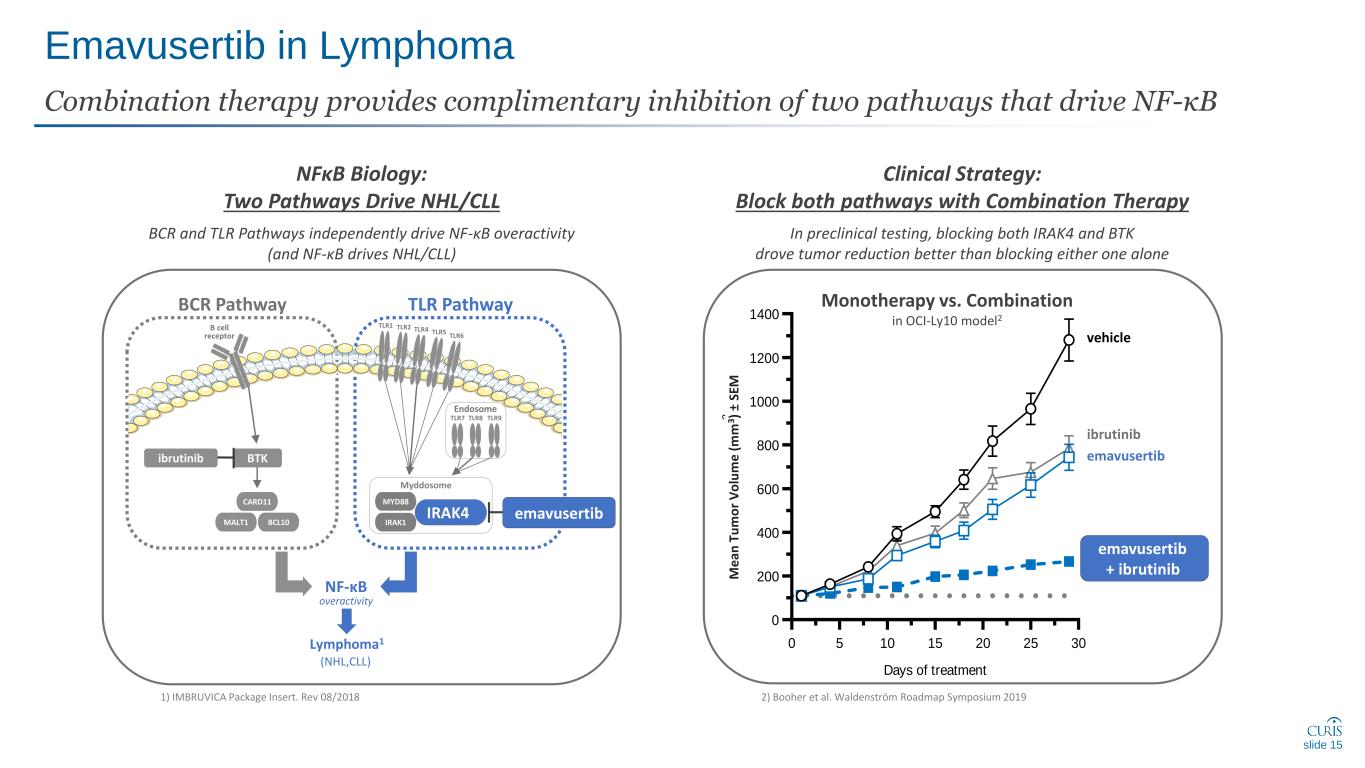
淋巴瘤中的 Emavusertib 聯合療法可互補抑驅動 NF-κB 的兩種途徑 NFκB 生物學:兩種途徑驅動 NHL/CLL BCR 和 TLR Pathways 獨立驅動 NF-κB 過度活動(而 NF-κB 驅動 NHL/CLL)臨牀策略:用聯合療法阻斷這兩種途徑在臨牀前測試中,阻斷 IRAK4 和 BTK 比單獨阻斷任何一種更能促進腫瘤減少 2) Booher 等人Waldenström 路線圖研討會 20191) IMBRUVICA 軟件包插頁。Rev 08/2018 TLR1B 細胞受體 BTK CARD11 MALT1 BCL10 ibrutinib TLR2 TLR4 TLR5 TLR6 TLR7 TLR8 TLR9 BCR Pathway TLR Pathway 內體淋巴瘤 1 (NHL, CLL) nf-κB Myddosome IRAK1 IRAK4 emavusertib 幻燈片 15 車輛 ibrutinib emavusertib + Ibrutinib Oci-ly10 中的腫瘤生長模型 0 5 10 15 20 30 0 200 400 600 800 1000 1200 1200 1400 治療天數 m e a n T u m o lu e (m m 3) + S E M 劑量:qdx28,PO Vehicle Ibrutinib,12.5 mg/kg + Ibrutinib,12.5 mg/kg + Ibrutinib,100 mg/kg 87% TGI M e can T u m o r V o lu m e (m m m m MYD88 CA-4948 CA-4948 CA-49483) ± SE M 單一療法與 oci-ly10 model2 中的組合療法 emavusertib + ibrutinib
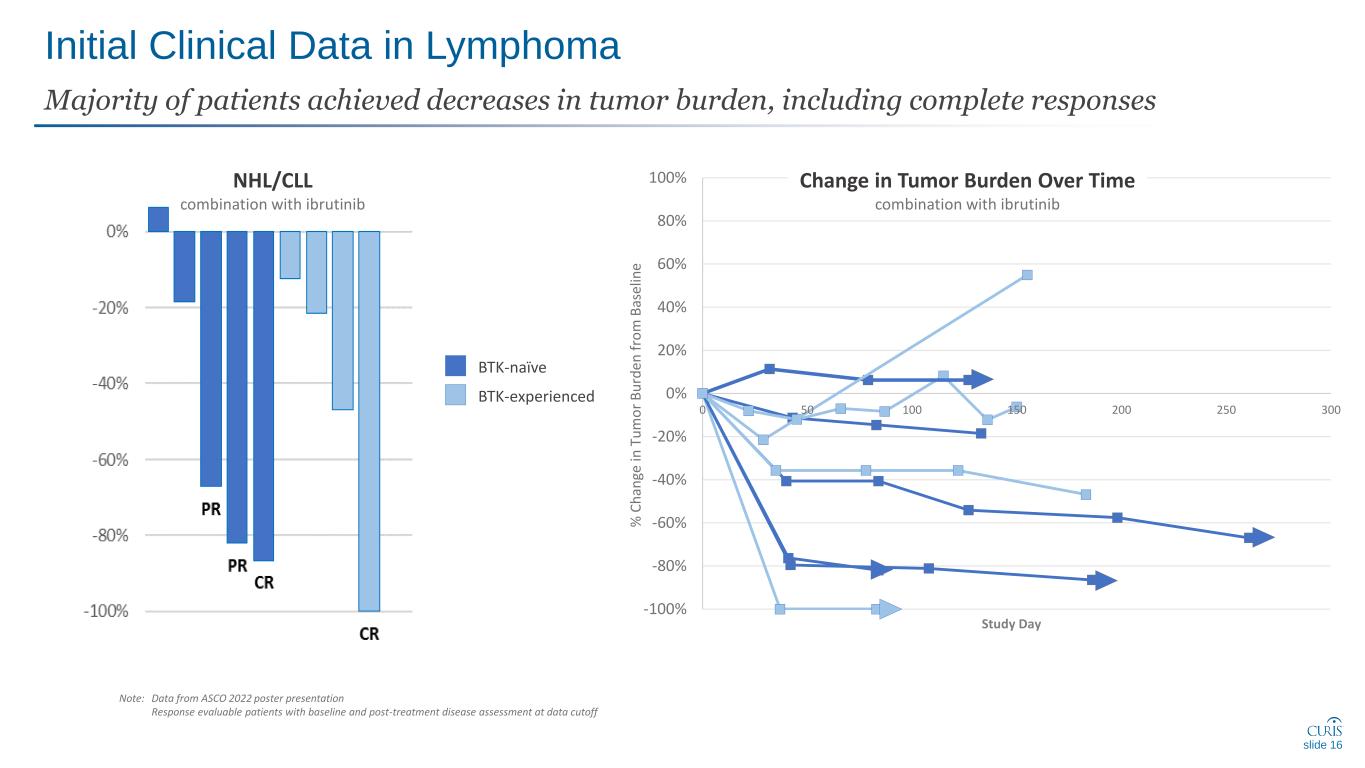
淋巴瘤的初步臨牀數據大多數患者的腫瘤負擔都有所減輕,包括完全緩解 -100% -80% -40% -20% 20% 40% 40% 80% 0 50 100 200 300% C h 和 ge in t u m o r b u rd en f ro m B as el in e 研究日幻燈片 16 btk-naive btk-aive NHL/CLL 與 ibrutinib 聯合使用注意:數據來自 ASCO 2022 海報演示在數據截止時間內,通過基線和治療後疾病評估的可評估患者與依魯替尼聯合使用時腫瘤負擔隨時間的變化

淋巴瘤的臨牀策略與BTKI聯合使用以最大限度地降低NF-κB的理想候選藥物 • 患者目前正在接受BTKI治療,因為它下調了NF-κB • 有兩種途徑驅動 NF-κB:1) BCR 途徑:通過阻斷 BTK 2) TLR 途徑:通過阻斷 IRAK4 來解決 • 初步臨牀數據表明,阻斷這兩種途徑可以克服對依魯替尼的耐藥性下一步 Takeaim 淋巴瘤研究 • 靶向患者:pcnSL 幻燈片 17

白血病 Emavusertib 與現有療法協同作用5 因為 IRAK4-L 在幾乎所有 AML/MDS 患者中都有表達,單一療法針對 AML/MDSA 中最大的兩個基因定義患者羣體,6-8 淋巴瘤血液惡性腫瘤的潛在基石治療 Emavusertib 同時抑制 IRAK4、FLT3 和 CLK ——白血病和淋巴瘤的關鍵疾病驅動因素 Emavusertib 已在兩個靶點上表現出臨牀活性還有非靶向人羣1,4,5 a FLT3 突變或 IRAK4-L 過度表達的患者。1) Joffe 等人Hemasphere。2022。6 月 6 日(補編 3): 1011-1012;2) Guidetti 等人AACR Mol Cancer Ther. 2021;20(補編 12): P073;3) 2022 年患病率數據 DRG Clarivate;4) Garcia-Manero 等人Hemasphere。2022。6 月 6 日(補編 3): 30-31;5) Curis 新聞稿。https://investors.curis.com/2022-12-12-Curis-Announces-Additional-Encouraging-Clinical-Data-from-TakeAim-Leukemia-Study-of-emavusertib-CA-4948-in-Monotherapy-R-R-AML-and-hrMDS,2023 年 5 月 19 日訪問;6) Smith 等人Nat Cell Biol。2019;7) Choudhary 等人。eLife。2022;11:378136;8) Saygin 等人J Hematol Oncol。2017 年 4 月 18 日。初步臨牀數據顯示,NHL/CLL1 NHL/CLL 機會患者有可能克服 btKi 耐藥性:180 萬患者3 AML/MDS 機會:31.7 萬名患者3 與 btKi 聯合使用可阻斷 BCR 和 TLR 信號傳導,最大限度地降低 nf-kb2 幻燈片 18

投資論文 Emavusertib 是一種三靶點抑制劑,有可能成為血液系統惡性腫瘤的基石藥物 Cash runway 到 2025 年 — 截至 2023 年 3 月 31 日,7180 萬美元主導項目 TakeAim 白血病 — IRAK4 和 FLT3 是 AML/MDS1,2 Takeaim 淋巴瘤中最常見的疾病驅動因素 — emavusertib/ibrutinib 可以阻斷 NHL 中驅動 NF-B 的兩種途徑市場機會 AML/MDS:31.7 萬名患者3(目前的護理標準是 HMA)NHL/CLL:180 萬名患者3(目前的護理標準是 btKi)2024 年裏程碑 • 澄清單一療法美國食品藥品管理局對白血病的註冊研究設計 • 復發/複發性白血病(單一療法和聯合療法)的最新數據 • R/R 淋巴瘤(組合)幻燈片 19 中的更新數據企業概述摘要 1)Smith 等人Nat Cell Biol 2019;2) Saygin 等人J Hematol Oncol. 2017 年 4 月 18 日;3) 2022 年流行率數據 DRG Clarivate

公司演講結束 NASDAQ: CRIS