
2023 年 6 月公司簡報納斯達克:ZNTL

2 前瞻性聲明和免責聲明 Zentalis Pharmicals, Inc.(“我們”,“我們的”,“Zentalis” 或 “公司”)警告説,本演講(包括本演示附帶的口頭評論)包含1995年《美國私人證券訴訟改革法》所指的前瞻性陳述。本演示文稿中包含的所有與歷史事實無關的陳述應被視為前瞻性陳述,包括但不限於關於我們的候選產品有可能成為同類首創和/或同類最佳產品的陳述;有可能加快批准途徑;我們的候選產品有可能作為單一療法和聯合療法開發;azenosertib(zn-c3)有可能解決一系列癌症未得到滿足的巨大需求;間歇給藥對我們的潛在好處候選產品;我們的我們的候選產品(包括azenosertib和zn-d5)的開發方法;劑量優化的計劃和潛在益處,以及劑量優化更新的預期時間,包括宣佈zn-d5單藥RP2D的時機;提供azenosertib項目時間表和潛在註冊途徑的最新時機;臨牀前和臨牀項目更新的時機;特定適應症和/或患者羣體的潛在未滿足需求;組合潛力,包括我們的候選產品和潛力其益處;我們的候選產品的目標特徵和潛在益處及其作用機制,包括作為單一療法和/或聯合療法;我們認為我們已經加強了臨牀開發計劃,包括azenosertib的臨牀和監管進展,包括支持IND的研究、註冊、啟動臨牀試驗和數據發佈的預計時間;候選產品的市場機會和市場潛力;啟動3期試驗的時機azenosertib 與化療聯合治療 Cyclin E1+ 鉑敏感性卵巢癌;我們的臨牀前項目,包括 bcl-xL 和蛋白降解項目進展的時機;我們的預期里程碑,以及包含 “繼續”、“設計”、“估計”、“預期”、“可能”、“里程碑”、“機會”、“計劃”、“潛力”、“預測”、“策略” 等詞語的陳述,” “意志” 以及具有未來或前瞻性質的類似陳述。這些陳述既不是承諾也不是擔保,而是涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致我們的實際業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異,包括但不限於以下內容:我們的運營歷史有限,這可能使我們難以評估當前業務和預測未來的成功和生存能力;我們已經並且預計將繼續承擔重大差異損失;我們需要額外的資金,但可能無法獲得;我們開發任何診斷工具的計劃,包括其成本;臨牀前測試和早期試驗的結果可能無法預測後期臨牀試驗的成功;未能確定其他候選產品並開發或商業化可銷售的產品;臨牀試驗期間潛在的不可預見事件可能導致延誤或其他不利後果;與監管批准程序或持續監管義務相關的風險;未能獲得美國或國際市場批准;我們的候選產品可能造成嚴重的不良副作用;無法維持我們的合作或合作失敗;我們對第三方的依賴;重大競爭的影響;系統故障或安全漏洞的可能性;與知識產權相關的風險;我們吸引、留住和激勵合格人員的能力以及與管理過渡相關的風險;以及作為上市公司運營所產生的鉅額成本。其他風險和不確定性包括我們最近提交的10-K和10-Q表定期報告中標題為 “風險因素” 的風險和不確定性以及未來向美國證券交易委員會提交的文件中列出的風險和不確定性。可能導致實際結果與本演示文稿中前瞻性陳述所顯示的結果存在重大差異。任何此類前瞻性陳述均代表管理層截至本演示之日的估計。新的風險和不確定性可能會不時出現,而且不可能預測所有的風險和不確定性。儘管我們可能會選擇在未來的某個時候更新這些前瞻性陳述,但除非適用法律要求,否則我們沒有義務更新或修改任何前瞻性陳述。儘管我們認為此類前瞻性陳述中反映的預期是合理的,但我們無法保證這種預期會被證明是正確的。因此,提醒讀者不要過分依賴這些前瞻性陳述。對任何此類前瞻性陳述的準確性不作任何陳述或保證(明示或暗示)。本演示文稿還包含獨立各方和我們做出的與市場規模有關的估計和其他統計數據以及有關我們行業的其他數據。這些數據涉及許多假設和限制,提醒您不要對此類數據和估計值給予過分的重視。此外,對我們未來業績以及我們運營所在市場的未來表現的預測、假設和估計必然受到高度的不確定性和風險的影響。我們和我們的關聯公司、顧問或代表均不對該數據的準確性或完整性作出任何陳述,也不承諾在本演示之日之後更新此類數據。ZENTALIS® 及其相關徽標是 Zentalis 和/或其關聯公司的商標。本演示文稿中出現的所有其他商標、商品名稱和服務標記均為其各自所有者的財產。本演示文稿中提供的所有網站地址僅供參考,無意用作活躍鏈接或將任何網站信息納入本文檔。Zentalis的候選產品是研究藥物,尚未獲得美國食品藥品監督管理局或任何其他監管機構的批准。
3 • 豐富的腫瘤學經驗 • 資深的科學和臨牀顧問 • 與輝瑞、葛蘭素史克的合作有望執行和交付我們是一家臨牀階段的腫瘤學公司,專注於難以治療的癌症 • 高水平的單一療法抗腫瘤活性 • 迄今為止一流的安全性和耐受性支持在早期研究和維持環境中使用 • 已證明與化療和分子靶向藥物具有協同活性 • 在包括Cyclin E1在內的基因組不穩定性高的腫瘤中具有豐富的活性 + 和 HRD+ 癌症 • 8 項試驗;大型試驗適應症;400 多名患者給藥 Ac ce le ra tin g De ve lo pm en t bl oc kb us te r c om m er ci al o pp 或 tu ni ty • 在單一療法和化療組合中可能覆蓋 88% 的卵巢癌 • 有可能通過單一療法或聯合療法擴展到多種腫瘤,每年處理約 14 萬件 • 全球商業版權(中國除外)• IP — 美國案件構成 2039 Azenosertib:同類首創 WEE1i 具有廣泛特許經營潛力的候選藥物 • 多種適應症;血紅素惡性腫瘤具有同類最佳潛力 • 在 3 項正在進行的研究中對 100 多名患者進行了給藥 • 有望在 AL 澱粉樣變性中表現出單一療法活性 • 作為潛在的第一種註冊藥物具有吸引力的商業機會高選擇性 BCL-2 抑制劑 • 利用獨特的化學專業知識發現資產前景光明的臨牀前項目

4 Pipeline 解決具有巨大商業機會的難以治療的癌症化合物適應症 + 開發方法臨牀前 1 期 1b 階段 2 期 3 期狀態/預期里程碑 azenosertib WEE1 抑制劑鉑敏感性卵巢癌 + 紫杉醇或卡鉑啟動 2024 年第一季度 Cyclin E1 陽性卵巢癌單一療法註冊子宮漿液性癌單一療法;FDA Fast track 認證 PARP 耐藥性卵巢癌 azenosertib 單一療法,與尼拉帕尼交替使用或同時使用尼拉帕尼註冊劑量優化實體瘤單一療法註冊骨肉瘤 + 吉西他濱註冊 BRAF 突變體結直腸癌 + encorafenib 和西妥昔單抗註冊胰腺癌 + 吉西他濱 Dana Farber 癌症研究所,由 su2c/LustGarten zn-d5 BCL-2 抑制劑輕鏈 (AL) 澱粉樣變性單一療法入組;提供中期臨牀數據並申報 RP2D 用於單一療法 2H23 非霍奇金淋巴瘤 (NHL) 單一療法註冊急性髓系白血病 (AML) + azenosertib 註冊;提供臨牀試驗的初步數據 2H23 bcl-xL 降解實體瘤和血紅素惡性腫瘤被宣佈為開發候選藥物;IND 賦能活動已啟動

Azenosertib WEE1 抑制劑有可能解決一系列癌症的大量未滿足需求

6 正在進行的三項2期單一療法試驗有可能為卵巢癌的快速註冊提供支持,南加州大學單一療法 RP2D 已確立:400 mg 5:2 與持續給藥相比,穩定狀態藥物暴露量翻了一番 37% 卵巢和南加州大學患者使用間歇給藥的客觀反應率沒有與治療相關的停藥與持續給藥 Azenosertib 單一療法相比保持安全性並提高耐受性劑量優化支持進步into 多種難以治療的腫瘤類型縮寫:RP2D:推薦的 2 期劑量;5:2 是指治療五天和休息兩天的給藥時間表;USC,子宮漿液性癌

7 • WEE1 磷酸化 CDK/細胞週期蛋白複合物與細胞週期檢查點接觸,允許進行 DNA 修復 • Azenosertib 抑制 WEE1:• 導致 CDK 1 和 2 失活 • 移除 2 個細胞週期檢查點:G1/S 和 G2/M • 細胞週期在沒有充分 DNA 修復的情況下發展 • 癌細胞積累 DNA 損傷,導致細胞凋亡和有絲分裂災難 cdk2/Cyclin E phophoriaLationp WEE1 P P S G2 M G1 細胞存活癌症進展 P Azenosertib WEE1 cdk2/Cyclin E 細胞死亡 S G2 M G1 WEE1 在未經治療的癌細胞中的活性 Azenosertib 阻斷 WEE1導致癌細胞死亡 Azenosertib Targets WEE1,這是癌細胞存活的關鍵蛋白 cdk1/Cyclin A cdk1/Cyclin A Luserna di Rora 等人,2020 年。J Hem Onc. 13:126。Elbaek 等人。2022。細胞報告。38:110261。縮寫:MOA,作用機制建立 RP2D 是藥物開發這一高潛力腫瘤靶點 Azenosertib 的 MOA 和早期的單一療法臨牀活性使劑量優化變得至關重要

8 Cyclin E1 0 0.1 0.3 1 µM Azenosertib p-chk1 Cleaved Caspase-3 γH2ax p-h3 Azenosertib 誘導 DNA 損傷、複製應激和細胞凋亡的標誌物* OVCAR3 Cyclin E1 陽性細胞,16 小時治療高度的基因組不穩定性可能由以下原因引起:細胞週期蛋白 E1+ 腫瘤 • 細胞週期蛋白 E1+ 推動加速進入 S-s 分階段完成與 CDK2 的合作 • 複製機制超負荷,導致基因組不穩定同源重組修復缺陷 (HRD+) 腫瘤 • 腫瘤無法修復雙鏈 DNA 導致基因組不穩定休息。基因組不穩定性高的腫瘤對 Azenosertib 單一療法劑量敏感,生物標誌物富集是我們臨牀策略的基礎
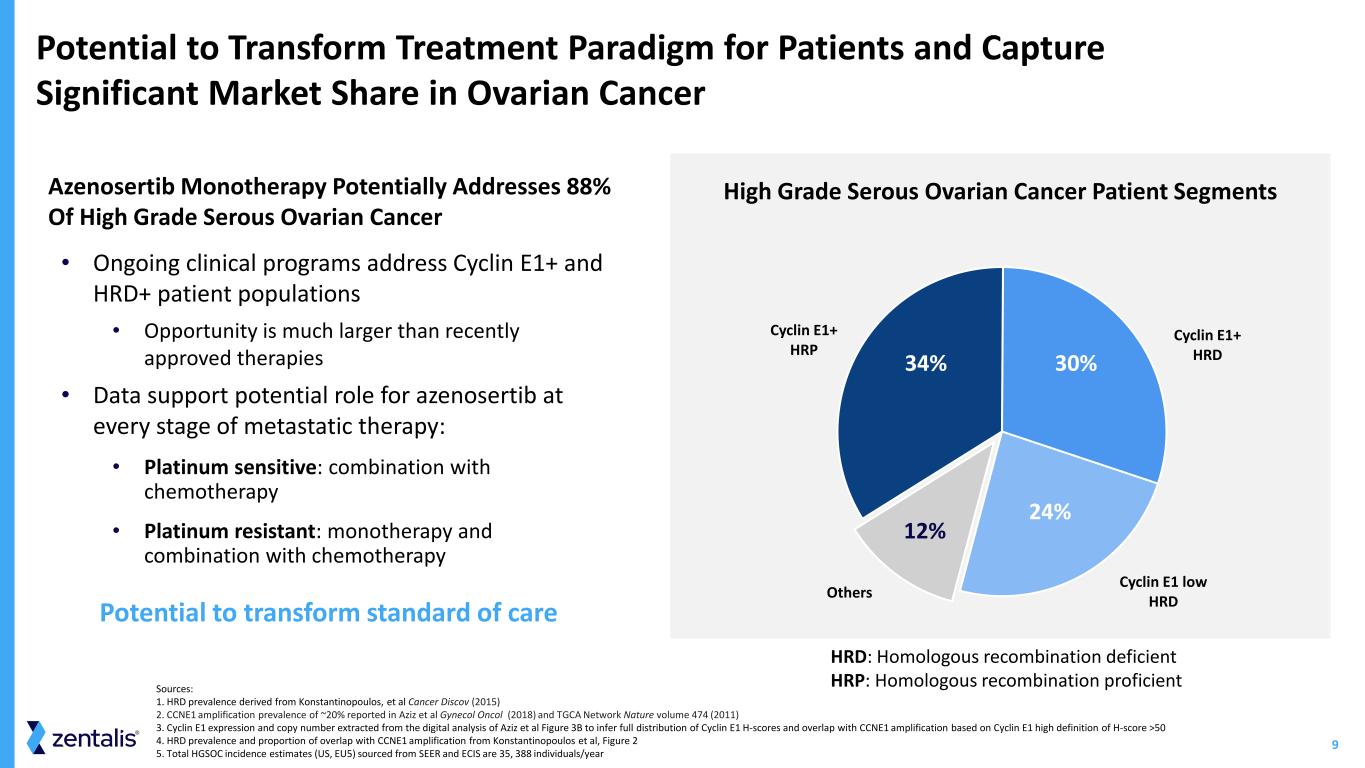
9 有可能改變患者治療模式,在卵巢癌 Cyclin E1+ HRP Cyclin E1+ HRD Cyclin E1 低 hrdoThers 30% 24% 12% 34% 高等級漿液性卵巢癌患者羣體中佔據重要市場份額 • 正在進行的臨牀項目涉及 Cyclin E1+ 和 HRD+ 患者羣體 • 機會比最近批准的療法大得多 • 數據支持 azenosertib 在轉移治療各個階段的潛在作用:• 鉑敏感:與化療聯合使用 • 鉑耐藥:單一療法和聯合化療化療有可能改變治療標準 Azenosertib 單一療法有可能解決 88% 的高度漿液性卵巢癌來源:1.HRD 患病率源自 Konstantinopoulos 等人 Cancer Discov(2015)2。Aziz 等人 Gynocol Oncol(2018)和 TGCA Network Nature 第 474 卷(2011)3 中報告的 CCNE1 擴增患病率約為 20%。從 Aziz 等人的數字分析中提取的 Cyclin E1 表達和拷貝數(圖 3B),用於推斷 Cyclin E1 H 分數的完整分佈,並與基於 Cyclin E1 的 H 分數 >50 4 的高清晰度的 CCNE1 擴增重疊。HRD 患病率和與 Konstantinopoulos 等人的 CCNE1 擴增重疊比例,圖 2 5。來自 SEER 和 ECIS 的 HGSOC 總髮病率估計值(美國、歐盟5)為 35 388 人/年 HRD:同源重組缺陷 HRP:同源重組缺乏 HRP:同源重組精通
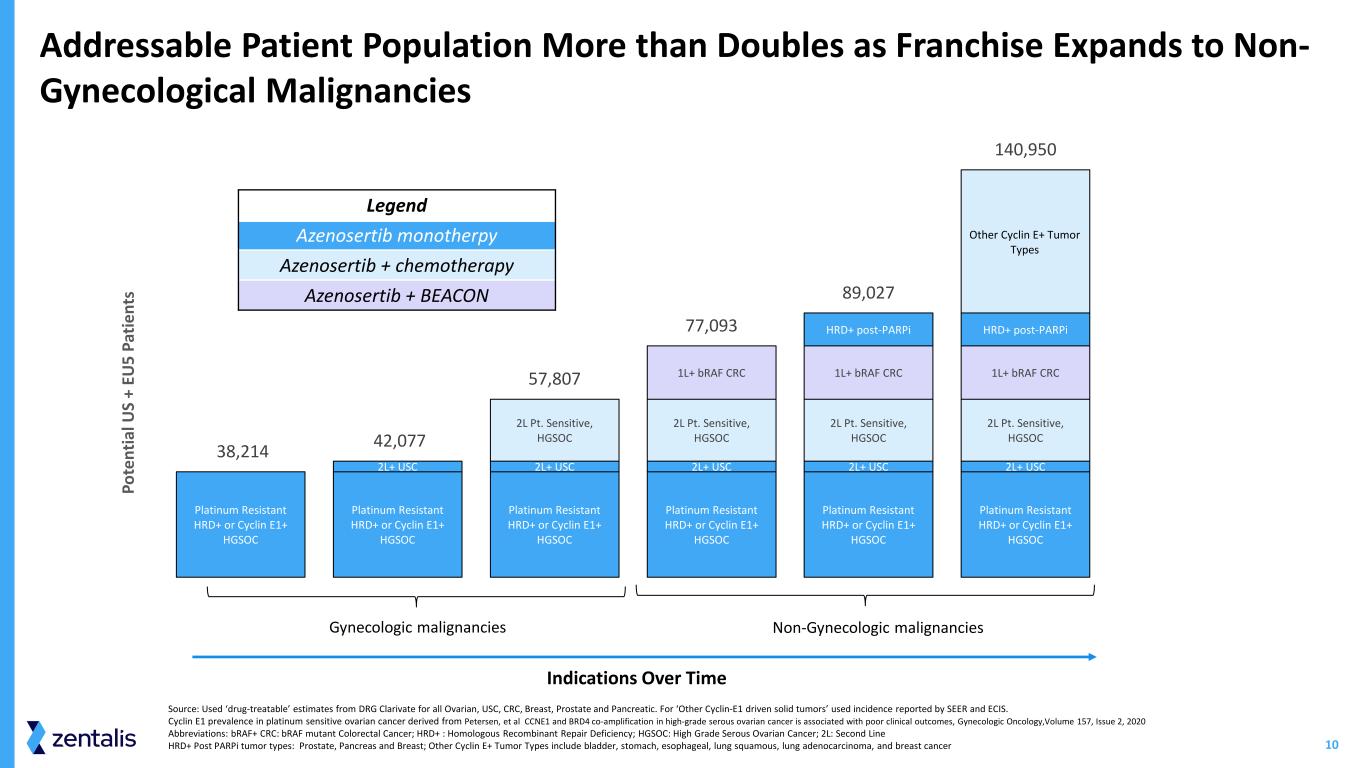
10 耐鉑金 HRD+ 或 Cyclin E1+ HGSOC 鉑金抗性 HRD+ 或 Cyclin E1+ HGSOC Platinum Dasistance HRD+ 或 Cyclin E1+ Platinum Dasisting HRD+ 或 Cyclin E1+ Platinum Dasisting HRD+ L+ USC 2L+ USC 2L Pt.敏感,HGSOC 2L Pt.敏感,HGSOC 2L Pt.敏感,HGSOC 2L Pt.敏感、HGSOC 1L+ braF CRC 1L+ braF CRC 1L+ braF CRC HRD+ postParpi HRD+ post-Parpi 其他細胞週期蛋白 E+ 腫瘤類型 38,214 42,807 7,077 7,027 140,950 Po te nt ia l U S + EU 5 Pa time nt s 婦科惡性腫瘤傳奇 Azenosertib 單一療法隨着特許經營範圍擴展到非婦科惡性腫瘤,Azenosertib + 化療 Azenosertib + BEACON 隨着時間的推移適應症可尋址的患者人數增加了一倍以上來源:使用了 DRG Clarivate 對所有卵巢、南加州大學、結直腸癌、乳腺癌、前列腺和前列腺的 “藥物可治療” 估計胰腺。對於 “其他Cyclin-E1驅動的實體腫瘤”,使用了SEER和ECIS報告的發病率。源自 Petersen 等人的鉑敏感性卵巢癌的 cyclin E1 患病率,CCNE1 和 BRD4 聯合擴增與臨牀療效不佳有關,《婦科腫瘤學》,第 157 卷,2020 年第 2 期縮寫:braF+ CRC:braF 突變體結直腸癌;HRD+:同源重組修復缺陷;HGSOC:高級別漿液性卵巢癌;2L:二線 HRDD + parPi 後腫瘤類型:前列腺、胰腺和乳腺;其他 Cyclin E+ 腫瘤類型包括膀胱、胃、食管、肺鱗癌、肺腺癌,和乳腺癌

Azenosertib azenosertib 間歇性單藥劑量顯著提高了抗腫瘤活性和耐受性
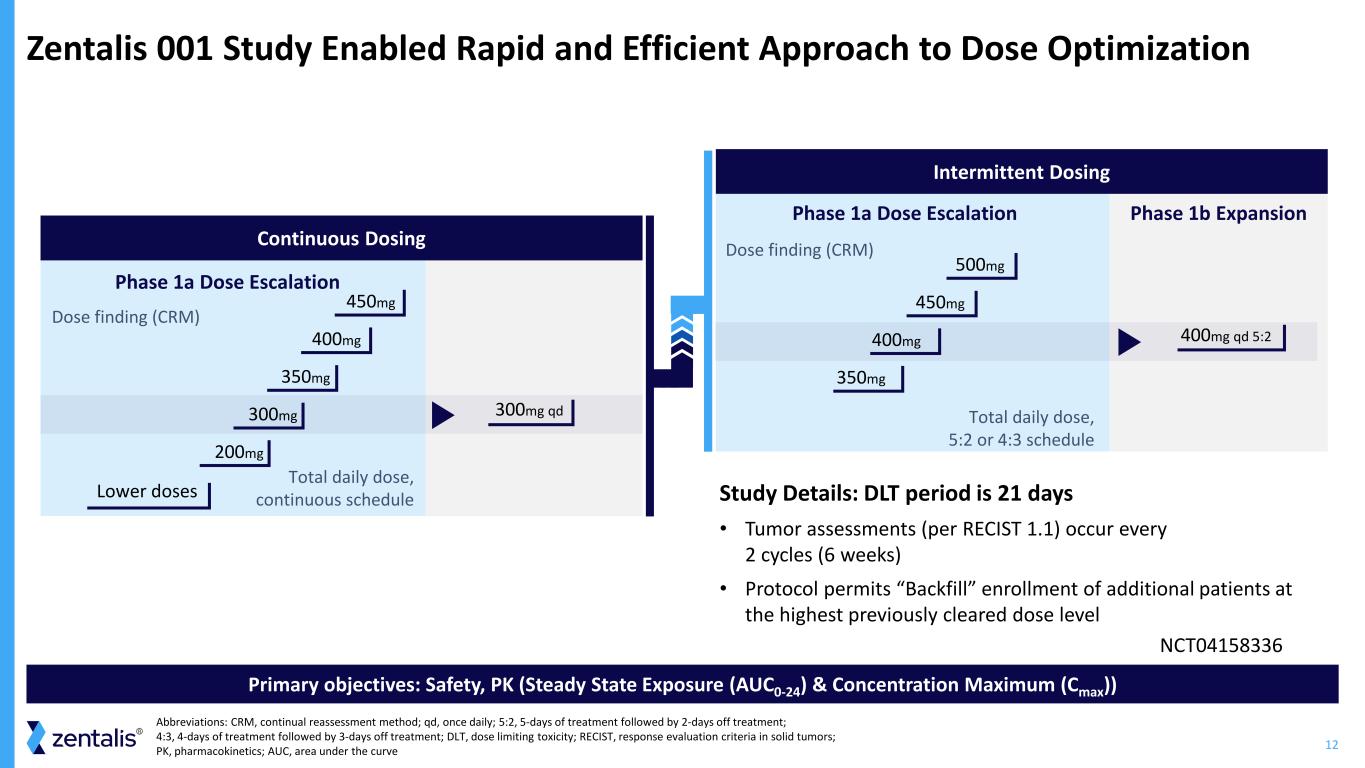
12 Zentalis 001 研究支持快速有效的劑量優化方法主要目標:安全性、PK(穩定狀態暴露(AUC0-24)和最大濃度(Cmax))1b 階段擴展間歇性給藥劑量發現 (CRM) 每日總劑量,5:2 或 4:3 時間表 1a 劑量升級階段 1a 劑量遞增 500mg 450mg 400mg qd 5:2 持續劑量升級 450mg 200mg CRM) 每日總劑量,連續時間表 400mg 350mg 300mg 300mg qd 較低劑量研究詳情:DLT 期為 21 天 • 腫瘤評估(每RECIST 1.1) 每 2 個週期(6 周)發生一次 • 協議允許以先前批准的最高劑量水平 “回填” 註冊更多患者縮寫:CRM,持續重新評估方法;qd,每天一次;5:2,5 天治療,然後休假 3 天治療;DLT,劑量限制毒性;RECIST,實體瘤的反應評估標準;PK,pharmaceokokad 動力學;AUC,曲線下方的區域 NCT04158336
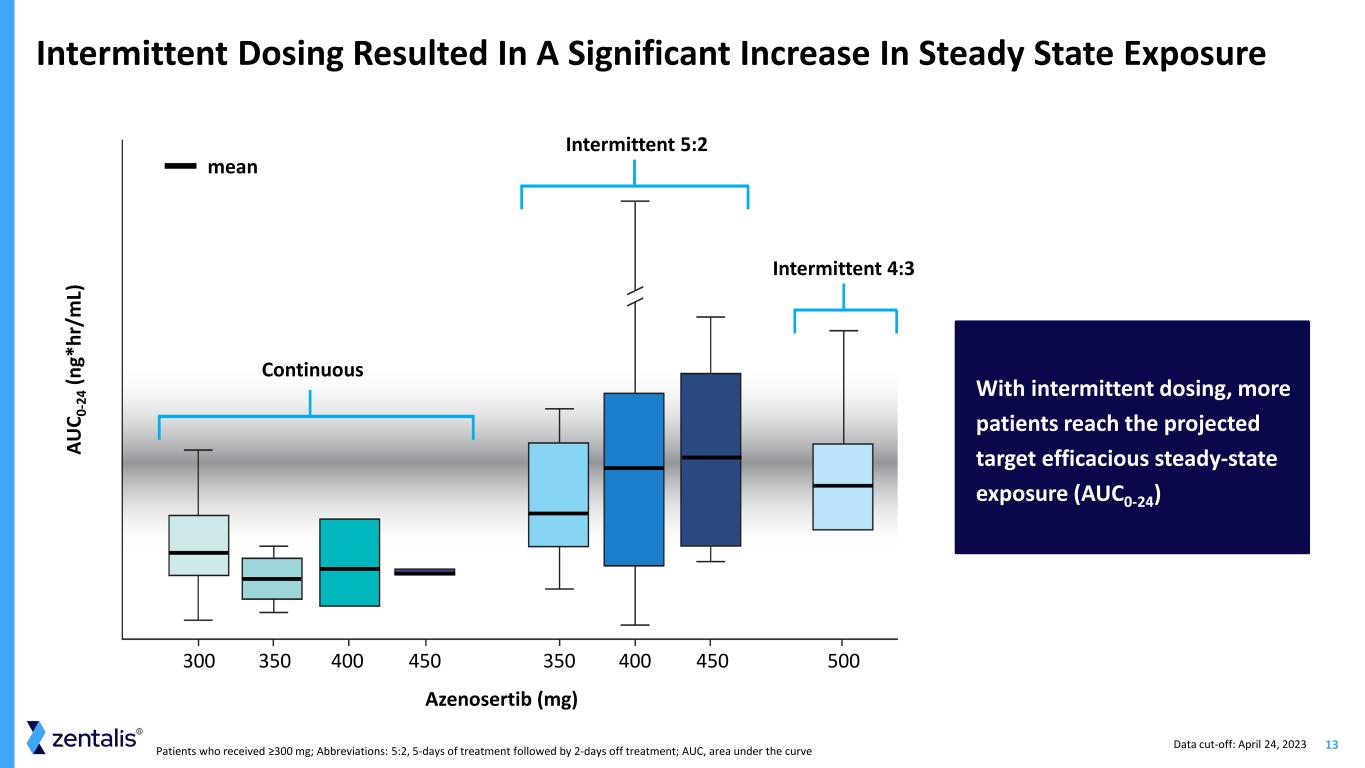
13接受 ≥300 mg 的患者;縮寫:5:2 治療 5 天后休息 2 天;AUC,曲線下方區域間歇給藥導致穩態暴露顯著增加通過間歇給藥,更多的患者達到預期的目標有效穩態暴露 (AUC0-24) Azenosertib (mg) 300 350 450 350 400 450 450 450 500 連續間歇性 5:2 AU C -2 4 (n g* hr /m) L) 平均間歇性 4:3 數據截止時間:2023 年 4 月 24 日

14 Azenosertib 間歇性給藥時間表使卵巢/南加州大學人羣的客觀反應率翻倍數據截止時間:2023 年 6 月 2 日 *反應可評估:使用 RECIST 1.1 進行基線可測量的疾病,至少進行一次基線後掃描,並接受至少一劑藥物治療 ≥300 mg 的患者。縮寫:USC,子宮漿液性癌;CR,完全緩解;PR,部分緩解;SD,穩定性疾病;PD,進展性疾病;ORR,客觀反應率;CI,置信區間;+:數據截止時患者仍在接受治療 0 20 40 60 80 -100 -80 -60 -20 20 40 80 80 100 300 450 300 300 300 300 300 300 300 300 300 300 300 300 350 300 + + + + +U + + + + + + 20 40 60 80 120 180 200 500 500 500 500 400 400 400 400 450 450 350 350 350 450 350 450st P er ce nt C ha ng e fr om B as el in e (%) PR PD 連續間歇性 CR/PR SD PD 最佳整體響應隊列 N* ORR% (95% 置信區間) 間歇性 19 36.8% (16.3, 61.6) 連續 26 19.2% (6.5, 39.3) 總體而言 45 26.7% (14.6, 41.9)
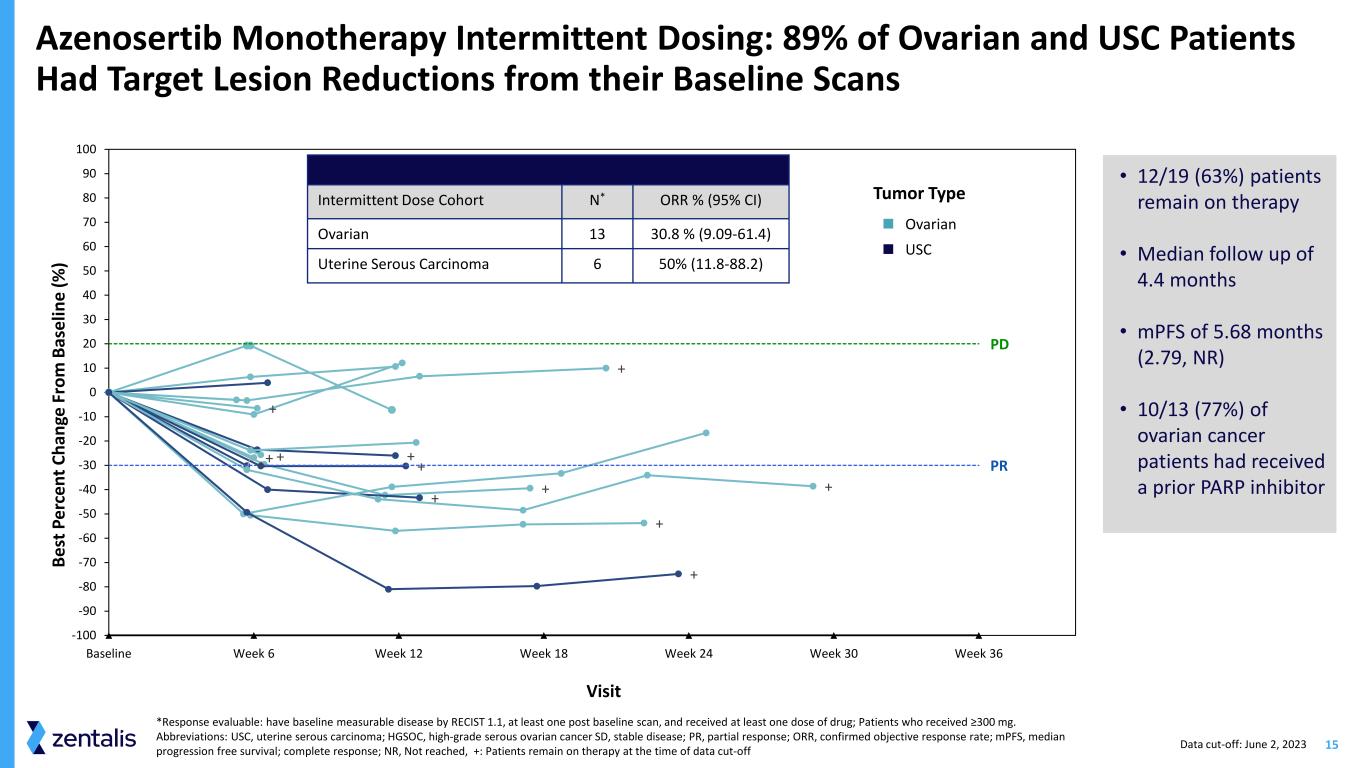
15 Azenosertib 單一療法間歇性給藥:89% 的卵巢和南加州大學患者在基線掃描中目標病變減少 + + + + + + + + + + 基線周 6 周 12 周 18 周 30 周 36 PD PR -100 -90 -80 -60 -50 -40 -20 -10 10 10 20 20 20 20 20 20 40 50 60 80 P per ce nt ce ce ann ge Fr om B as el in e (%) 訪問腫瘤類型卵巢南加州大學間歇劑量隊列 N* ORR% (95% 置信區間) 卵巢 13 30.8% (9.09-61.4) 子宮漿液性癌 6 50% (11.8-88.2) *反應可評估:有 RECIST 1.1 可測量的基線疾病,至少一個基線掃描後,接受了至少一劑藥物;接受了≥300 mg的患者。縮寫:USC,子宮漿液性癌;HGSOC,高級別漿液性卵巢癌 SD,疾病穩定;PR,部分緩解;ORR,已確認的客觀反應率;mPF,無進展存活率中位數;完全緩解;NR,未達到,+:數據截止時患者仍在接受治療 • 12/19(63%)患者仍在接受治療 • 隨訪中位數 4.4 個月 • MPF 為 5.68 個月(NR 2.79,) • 10/13(77%)的卵巢癌患者之前曾接受過 PARP 抑制劑數據截止日期:2023 年 6 月 2 日
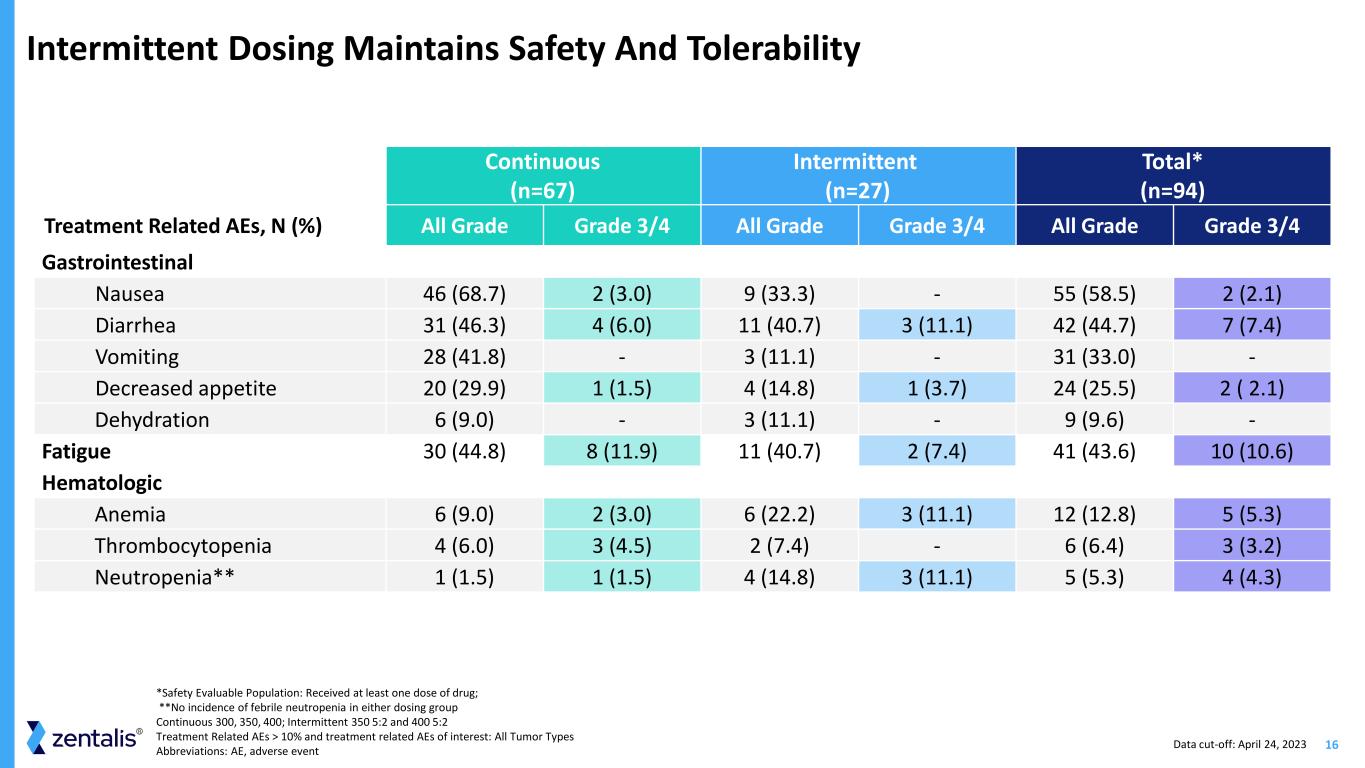
16 間歇性給藥持續保持安全性和耐受性 (n=67) 間歇性 (n=27) 總數* (n=94) 治療相關的 AE,N (%) 全級 3/4 所有等級 3/4 所有等級 3/4 胃腸道噁心 46 (68.7) 2 (33.3)-55 (58.5) 2 (2.1) 腹瀉 31 (66.3) 4 (6.0) 11 (40.7) 3 11.1) 42 (44.7) 7 (7.4) 嘔吐 28 (41.8)-3 (11.1)-31 (33.0)-食慾下降 20 (29.9) 1 (1.5) 4 (14.8) 1 (3.7) 24 (25.5) 2 (2.1) 脱水 6 (9.0)-3 (11.1)-9 (9.6)-疲勞 30 (44.8) 8 (11.9) 11 (40.7)) 2 (7.4) 41 (43.6) 10 (10.6) 血液學貧血 6 (9.0) 2 (3.0) 6 (22.2) 3 (11.1) 12 (12.8) 5 (5.3) 血小板減少症 4 (6.0) 3 (4.5) 2 (7.4)-6 (6.4) 3 (3.2) 中性粒細胞減少** 1 (1.5) 1 (1.5) 4 (14.8) 3 (11.1) 5 (5.3) 4 (4.3) *安全評估人羣:收到於至少一劑藥物;**任一給藥組均未出現發熱性中性粒細胞減少症連續 300、350、400;間歇性 350 5:2 和 400 5:2 治療相關的 AE > 10% 和治療相關的 AE:所有腫瘤類型縮寫:AE,不良事件數據截止日期:2023 年 4 月 24 日
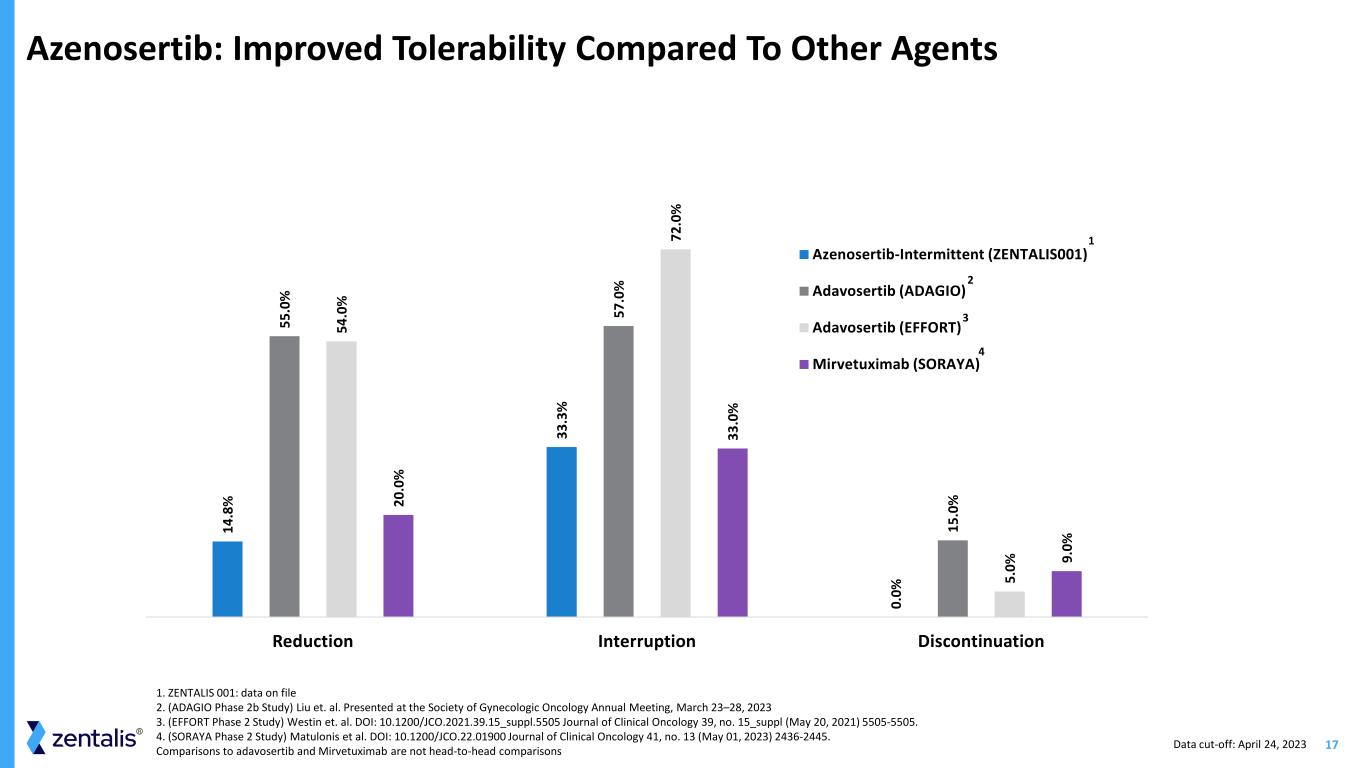
17 Azenosertib:與其他代理相比提高了耐受性 14 .8% 33 .3% 0. 0% 55 .0% 57 .0% 15 .0% 54 .0% 72 .0% 5. 0% 20 .0% 33 .0% 9. 0% 減少中斷 Azenosertib (ADAGIO) Adavosertib (ADAGIO) Adavosertib (EFFORT) AB (SORAYA) 1 2 4 3 數據截止日期:2023 年 4 月 24 日 1. ZENTALIS001ZENTALIS 001:文件 2 中的數據。(ADAGIO 2b 期研究)Liu 等人在 2023 年 3 月 23 日至 28 日婦科腫瘤學會年會上發表 3.(EFFORT 第 2 階段研究)Westin 等人DOI:10.1200/jco.2021.39.15_Suppl.5505《臨牀腫瘤學雜誌》39,第 15_suppl(2021 年 5 月 20 日)5505-5505。4.(SORAYA 第 2 階段研究)Matulonis 等人DOI:10.1200/JCO.22.01900《臨牀腫瘤學雜誌》41,第 13 期(2023 年 5 月 1 日)2436-2445。與 adavosertib 和 Mirvetuximab 的比較不是正面比較

Azenosertib 單一療法為註冊鋪平了道路,新的間歇劑量正在進行三項試驗
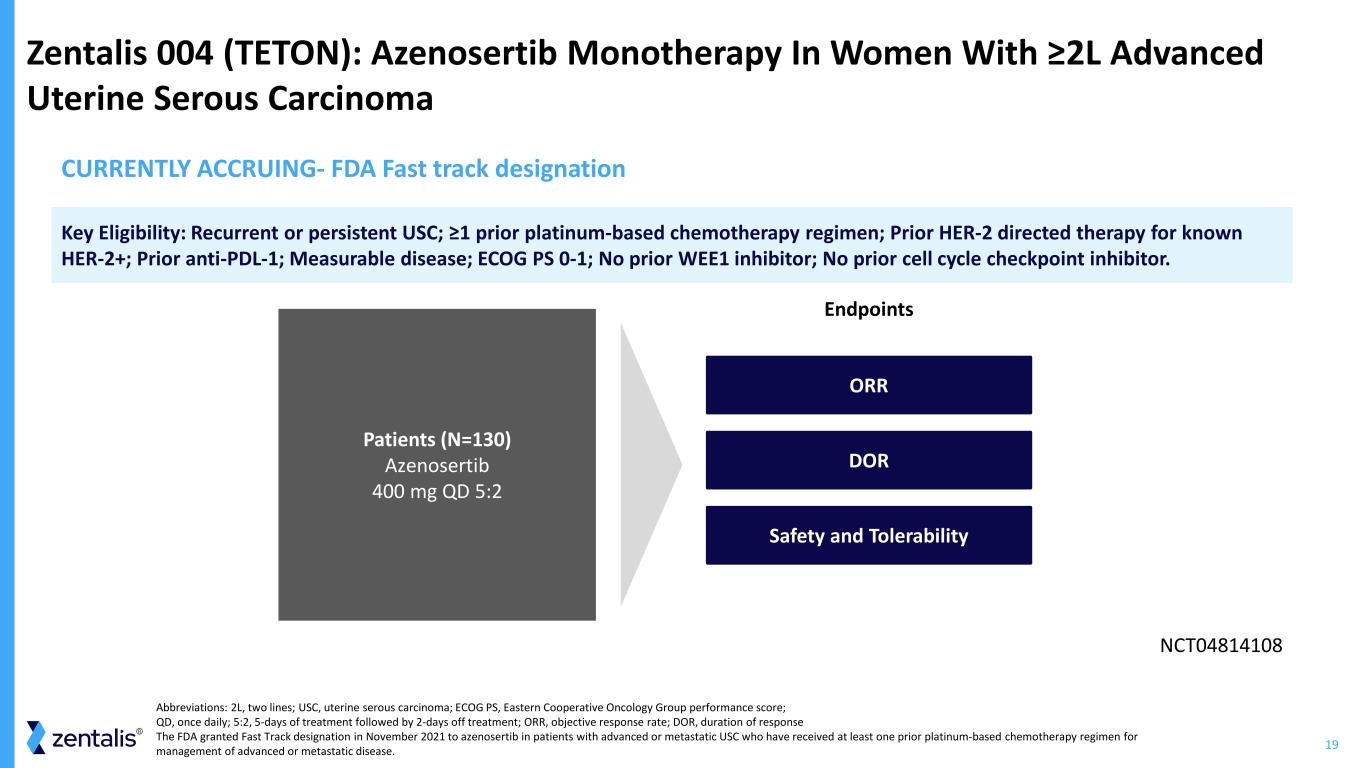
19 Zentalis 004(TETON):Azenosertib 單一療法對晚期子宮漿液性癌的女性進行終點 NCT04814108 患者(N=130)Azenosertib 400 mg QD 5:2 關鍵資格:複發性或持續性 USC;先前有 HER-2 針對已知 HER-2+ 的定向治療;先前的抗PDL-1;可測量的疾病;ECOG PS 0-1;先前沒有 WEE1 抑制劑;之前沒有細胞週期檢查點抑制劑。DOR 安全性和耐受性 ORR 目前正在累積——美國食品藥品管理局快速通道名稱縮寫:2L,兩行;USC,子宮漿液癌;ECOG PS,東部合作腫瘤學小組表現得分;QD,每天一次;5:2 治療 5 天后休息;ORR,反應持續時間 FDA 於 2021 年 11 月授予阿澤諾替布用於晚期或轉移性患者的快速通道資格南加州大學之前接受過至少一種治療晚期或轉移性疾病的鉑基化療方案。
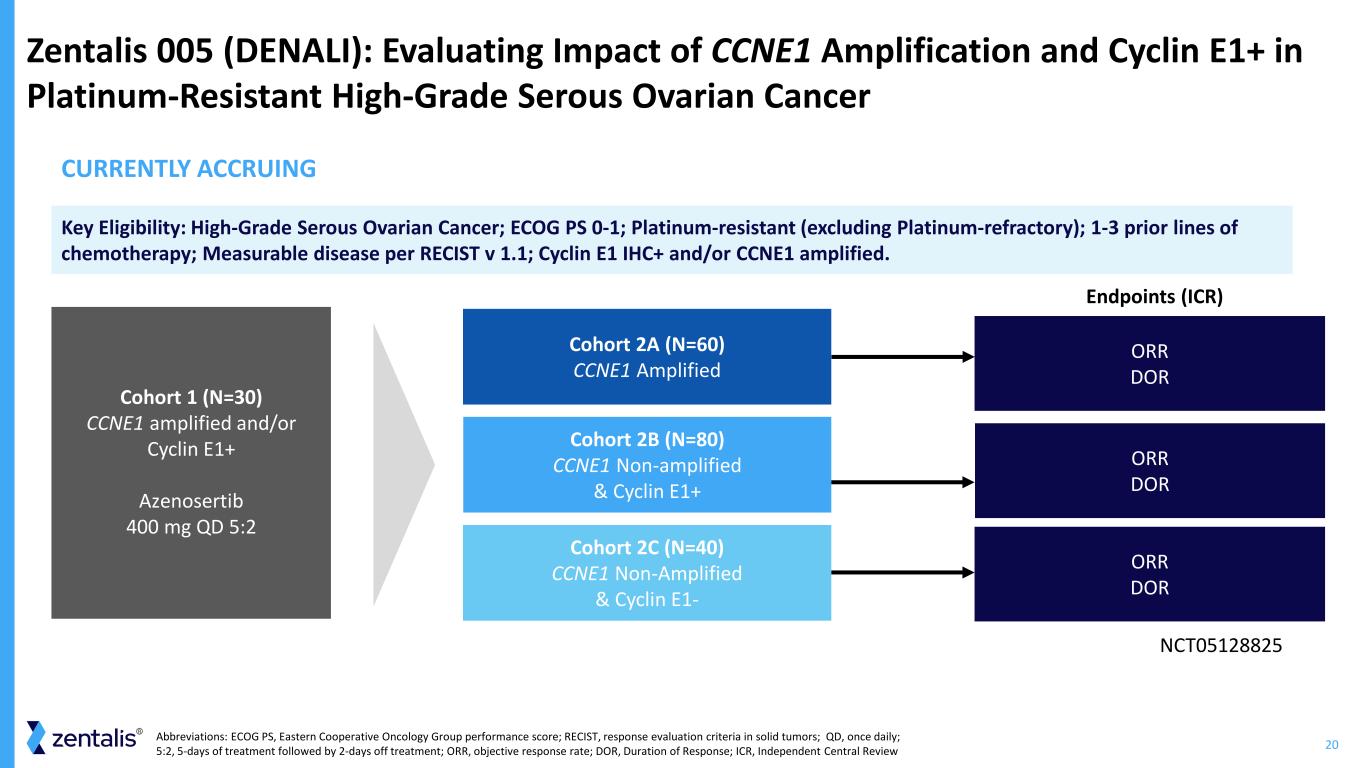
20 Zentalis 005 (DENALI):評估 CCNE1 擴增和細胞週期蛋白 E1+ 對耐鉑高級漿液性卵巢癌終點 (ICR) 隊列 2B (N=80) CCNE1 非擴增和細胞週期蛋白 E1+ 隊列 2C (N=40) CCNE1 非擴增和細胞週期蛋白 E1-隊列 2A (N=60) CCNE1 擴增和細胞週期蛋白 E1+ 隊列 1 (N=30) 擴增和/或 Cyclin E1+ Azenosertib 400 mg QD 5:2 關鍵資格:高級別漿液性卵巢癌;ECOG PS 0-1;鉑耐藥(不包括鉑難治性);先前有 1-3 條化療線路;RECIST v 1.1 中可測量的疾病;Cyclin E1 NCT05128825 CCNE1IHC+ 和/或 CCNE1 已放大。目前正在累積 ORR DOR DOR ORR DOR DOR DOR 縮寫:ECOG PS,東方合作腫瘤小組表現得分;RECIST,實體瘤反應評估標準;QD,每天一次;5:2,治療 5 天后休息 2 天;ORR,客觀反應率;DOR,反應持續時間;ICR,獨立中央評論
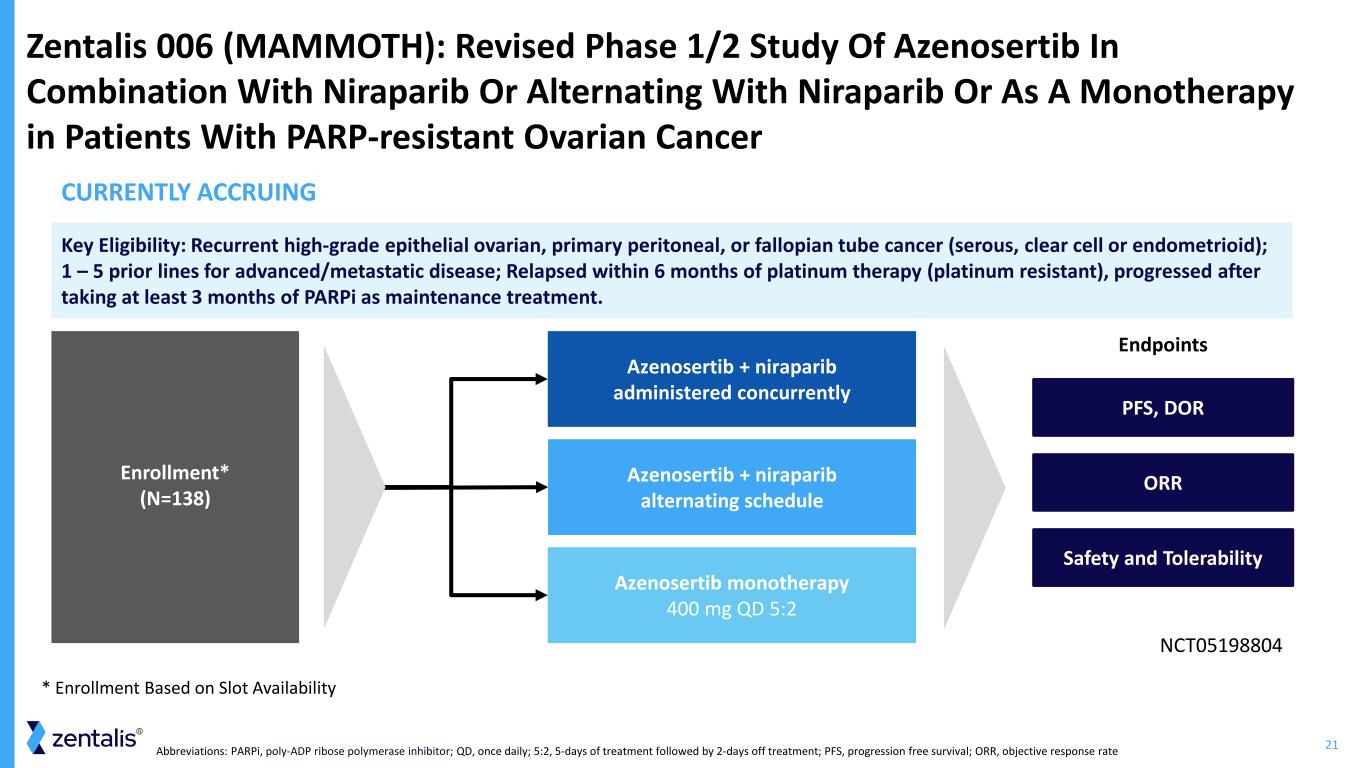
21縮寫:parPI,聚-ADP 核糖聚合酶抑制劑;QD,每天一次;5:2 治療 5 天,然後休息 2 天;PFS,無進展存活率;ORR,客觀反應率 Zentalis 006(MAMOTH):修訂了阿澤諾塞替布與尼拉帕利布聯合使用或作為單一療法治療PARP患者的1/2期研究耐藥性卵巢癌終點 Azenosertib + niraparib 交替方案 Azenosertib 單一療法 400 mg QD 5:2 Azenosertib + niraparib 同時給藥 NCT05198804 Rollant* (N=138) *根據空位可用性關鍵資格進行入組:複發性高度上皮性卵巢癌、原發性腹膜癌或輸卵管癌(漿液性、透明細胞癌或子宮內膜樣癌);1 — 5 條先前患有晚期/轉移性疾病;鉑療法(鉑耐藥)後 6 個月內復發,在服用至少 3 個月的 parPi 作為維持治療後進展。ORR 安全性和耐受性 PFS、DOR 目前正在累積

Azenosertib 與化療聯合使用強大而持久的療效信號和良好的化療骨幹安全性可使卵巢癌進入第 3 階段

23 與單獨化療相比,在化療中添加Azenosertib可提高卵巢癌的反應率和緩解持久性,在可評估反應的患者羣體中具有優異的客觀反應率和更長的無進展存活率在鉑敏感性卵巢癌中宣佈的註冊性3期試驗在鉑敏感性卵巢癌中宣佈的註冊性3期試驗的總體耐受性與SOC化療雙倍紫杉醇-卡鉑或PLD-Carboplatin Superior相比具有優勢卡鉑的耐久性聯合紫杉醇組合 10.4 個月無進展存活率和 36% 客觀反應率 50% 客觀反應率為 7.4 個月無進展存活率 50% SOC,標準治療;PLD,聚乙二醇化脂質體多柔比星

24 Zentalis 002:定義 RP2D 劑量 Azenosertib + Paclitaxel 200 mg QD 5:2 2 劑量水平 300 mg QD 5:2 Azenosertib + 吉西他濱 Azenosertib + PLD 200 mg QD 3 劑量水平按可用性和研究者偏好劃分隊列分配紫杉醇:D1、D8、D15 上的 80 mg/m2(28 天)週期) 目標 Azenosertib + Carboplatin 300 mg QD 吉西他濱:D1、D8(21 天週期)4 劑量水平 200 mg QD 5:2 卡鉑:AUC 5 mg/ml*min 在 D1(21 天週期)G:1000 mg/m2 A:600 mg QD 5:2 PLD:40mg/m2 D1(28 天週期)在 CRM 關鍵資格指導下發現劑量:高級別漿液性卵巢癌;ECOG 表現狀態 0-2;鉑耐藥/難治性;最多 3 條先前的化療線路;根據 RECIST v 1.1 可測量的疾病:安全性和耐受性 MTD 和/或 RP2D 關鍵次要:臨牀活動(終點:ORR、DOR、PFS、CA125)NCT04516447 縮寫:;ECOG,東方合作腫瘤小組;RECIST,實體瘤反應評估標準;5:2 治療 5 天,然後休息 2 天;CRM,持續重新評估模型;QD,每日一次;D,天;AUC,曲線下方區域;G,吉西他濱;A,azenosertib;PLD,聚乙二醇化脂質體多柔比星;MTD,最大耐受劑量;RP2D,推薦第 2 期劑量;ORR,反應持續時間;PFS,無進展存活率;Liu,J. 等“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於鉑耐藥或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”海報呈現 ASCO 2023 數據截止日期:2023 年 4 月 10 日

25 Azenosertib 化療 Doublets 的療效和耐久性令人鼓舞終點 Azenosertib + 紫杉醇 (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + Gemcitable (N=18) Azenosertib + PLD (N=35) Total (N=115) Responsertib + PLD (N=35) Response-Evaluable* (N) 22 28 13 31 94 ORR(已確認),N (%) 11 (50.0) 10 (35.7) 5 (38.5) 6 (19.4) 32 (34.0) 5.6 (3.8-NE) 11.4 (8.3-NE) 6.2 (NE) 7.3 (1.5-NE) 8.3 (5.6-12.4) 臨牀受益率 (CR + PR + SD ≥ 16 周),N (%) 18 (81.8) 16 (57.1)) 6 (46.2) 24 (77.4) 64 (68.1) 7.4 (5) 月 PFS 中位數 (95% 置信區間).5-NE) 10.4 (3.3-14.5) 8.3 (3.3-NE) 6.3 (3.7-11.0) 9.0 (5.8-13.7) *根據RECIST 版本 1.1 和至少一次基線後評估,可評估反應的受試者是基線可測量疾病的治療受試者。根據 RECIST v 1.1,所有客觀迴應均得到證實。縮寫:;PLD,聚乙二醇化脂質體多柔比星;ORR,客觀反應率;DOR,反應持續時間;CI,置信區間;NE,不可估計;CR,完全反應;SD,穩定性疾病;PFS,無進展存活率;RECIST,實體瘤的反應評估標準 Liu、J. 等“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於鉑耐藥或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”海報呈現 ASCO 2023 數據截止日期:2023 年 4 月 10 日

26 Azenosertib + Paclitaxel 的活性強勁且具有競爭優勢參考文獻:1.馬克曼等Gynol Oncol 2006;101:436-40。2.AURELIA:Avastin USPI 3。MITO11:Pignata 等人。Lancet Oncol 2015;16:561-68。4.章魚:Banerjee 等人。ESMO 2019。5.GYN49:Moore 等人。2022 年 Clin Cancer Ress;28:36-44。6.SORAYA:Matulonis 等人。J Clin Oncol 2023;41:2436-45. 7.MIRASOL:免疫原新聞稿 2023 年 5 月 3 日。縮寫:ORR,客觀反應率;mPF,無進展存活率中位數;m,月數與本幻燈片上歷史基準的比較不是正面比較 Liu、J. 等人“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於鉑耐藥或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”發佈的海報 ASCO 2023 數據截止日期:2023 年 4 月 10 日 21 30 29 29 32 42 50 0 10 20 30 40 50 O RR (%) 3.9 3.5 4.1 5.5 5.5 5.6 7.4 0 2 4 6 8 紫杉醇 (N=36) 紫杉醇 (N=68) Adavosertib + paclitaxel (N=38) Mirvetuximab (N=105)) mirvetuximab (N~225) Azenosertib + paclitaxel (N=26) mpF (m) 客觀反應率 (ORR) 中位無進展存活率 (mPF) 7 6 5 4 3 2

27 參考文獻:1.Leitao 等人。Gynol Oncol 2003;91:123-9。2.CARTAXHY:Lortholary 等人。Ann Oncol 2012;23:346-52。3.Pectasides 等人。Gynol Oncol 2010;118:52-7。4.布魯爾等Gynol Oncol 2006;103:446-50。5.MK-1775-009:Leijen 等人。J Clin Oncol 2016;34:4354-61。6.GYN-49:Moore 等人。2022 年 Clin Cancer Ress;28:36-44。7.SORAYA:Matulonis 等人。J Clin Oncol 2023;41:2436-2445。8.MIRASOL:免疫原新聞稿 2023 年 5 月 3 日。縮寫:ORR,客觀反應率;mPF,無進展存活率中位數;m,月數與本幻燈片上歷史基準的比較不是正面比較 Liu、J. 等人“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於鉑耐藥或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”海報呈現 ASCO 2023 Azenosertib + Carboplatin 活性強勁耐久性差異化數據截止日期:2023 年 4 月 10 日 23 37 39 16 43 30 32 42 36 0 20 30 40 50 ORR (%) 4.8 7.1 5.2 5.6 10.4 0 2 4 6 6 10 12 Carboplatin + 卡鉑 (N=21) Adavosertib (5 劑) + 卡鉑 (N=23) Mirvetuximab (N=105) mirvetuximab (N~225) Azenosertib + Carboplatin (N=36) mpF (m) 目標反應率 (ORR) 中位自由進展存活率 (mPF) 8 7 6 5 3 2
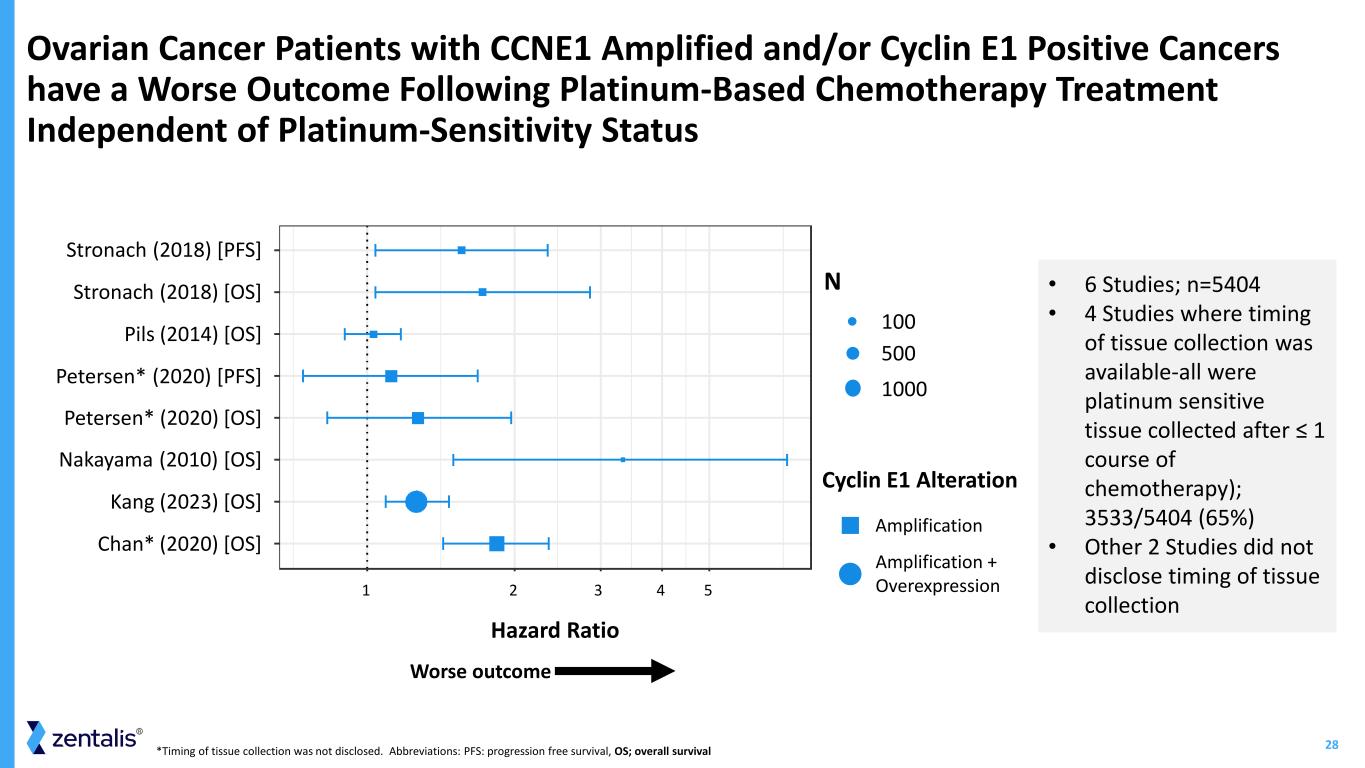
28*未透露組織採集時間。縮寫:PFS:無進展存活率,OS;總存活率 CCNE1 擴增和/或細胞週期蛋白 E1 陽性癌症患者接受鉑類化療後的預後較差(與鉑敏感狀態無關)細胞週期蛋白 E1 改變 • 6 項研究;n=5404 • 4 項有組織採集時機的研究(均為 ≤ 1 個療程化療後採集的鉑敏感組織);3533/5404 (65%) • 其他 2 項研究沒有透露組織採集的時間 1 2 4 53 Chan* (2020) [操作系統]中山 (2010) [操作系統]彼得森* (2020) [操作系統]彼得森* (2020) [PFS]Pils (2014) [操作系統]Stronach (2018) [操作系統]Stronach (2018) [PFS]N 500 100 1000 擴增擴增 + 過度表達 Kang (2023) [操作系統]
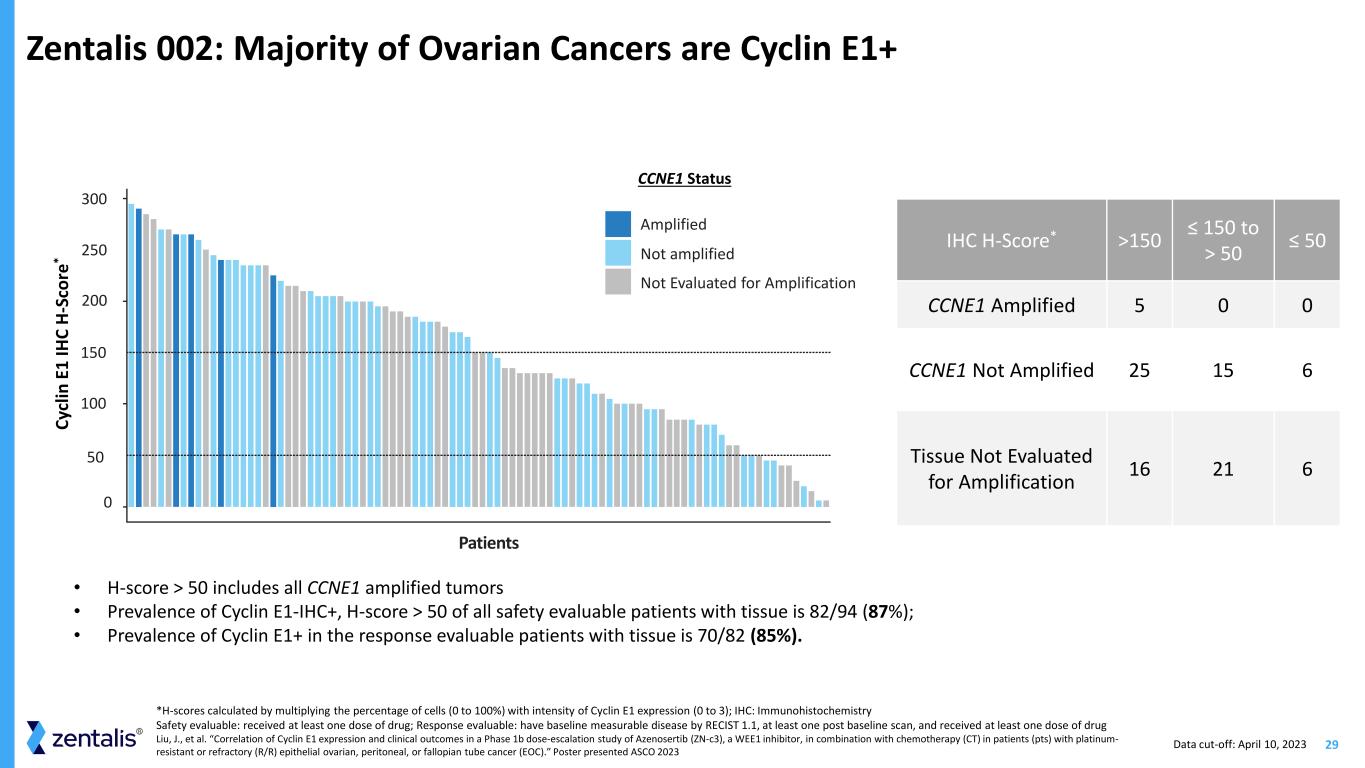
29 Zentalis 002:大多數卵巢癌是 Cyclin E1+ IHC H-Score* >150 ≤ 150 到 > 50 ≤ 50 CCNE1 擴增後 5 0 CCNE1 未擴增 25 15 6 組織未進行擴增評估 16 21 6 • H-score > 50 包括所有 CCNE1 擴增後的腫瘤 • 細胞週期蛋白 E1-IHC+ 的患病率在所有可進行安全評估的組織患者中有 50% 為 82/94 (87%); • 可評估反應的組織患者中 Cyclin E1+ 的患病率為 70/82 (85%)。Cy cl in E 1 IH C H-Sc 或 e* CCNE1 狀態放大未進行擴增評估 0 患者 100 200 300 50 150 *H 分數通過將細胞百分比(0 到 100%)乘以 Cyclin E1 表達強度(0 到 100%)計算得出;IHC:免疫組織化學安全性可評估:已接受至少一劑藥物;反應可評估:使用 RECIST 1.1 測出基線可測量的疾病,基線後至少進行過一次掃描,並接受了至少一劑藥物 Liu、J. 等人。“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於鉑耐藥或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”海報呈現 ASCO 2023 數據截止日期:2023 年 4 月 10 日 250

30 *可評估反應的患者(至少接受過一次掃描)縮寫:IHC,免疫組織化學;CI,置信區間 Liu,J. 等“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於耐鉑或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”海報展示了與化療無關的細胞週期蛋白 E1+ 腫瘤患者的耐久性增加三倍 H-分數 ≤ 50 (N=12) H-分數 > 50 (N=78) PFS(月)中位數 3.25 9.86 危險比(95% 置信區間)0.37 (0.18 — 0.79) log-rank p 值 0.0078 0 0.2 0.6 0.8 1.0 10 15 20 25 有風險的患者 78 12 36 2 12 1 1 1 0 Pro og re ss io n-Fr ee S ur va l Pro bab ili ty Time(月)H-Score > 50 H-Score ≤ 50 數據截止日期:2023 年 4 月 10 日
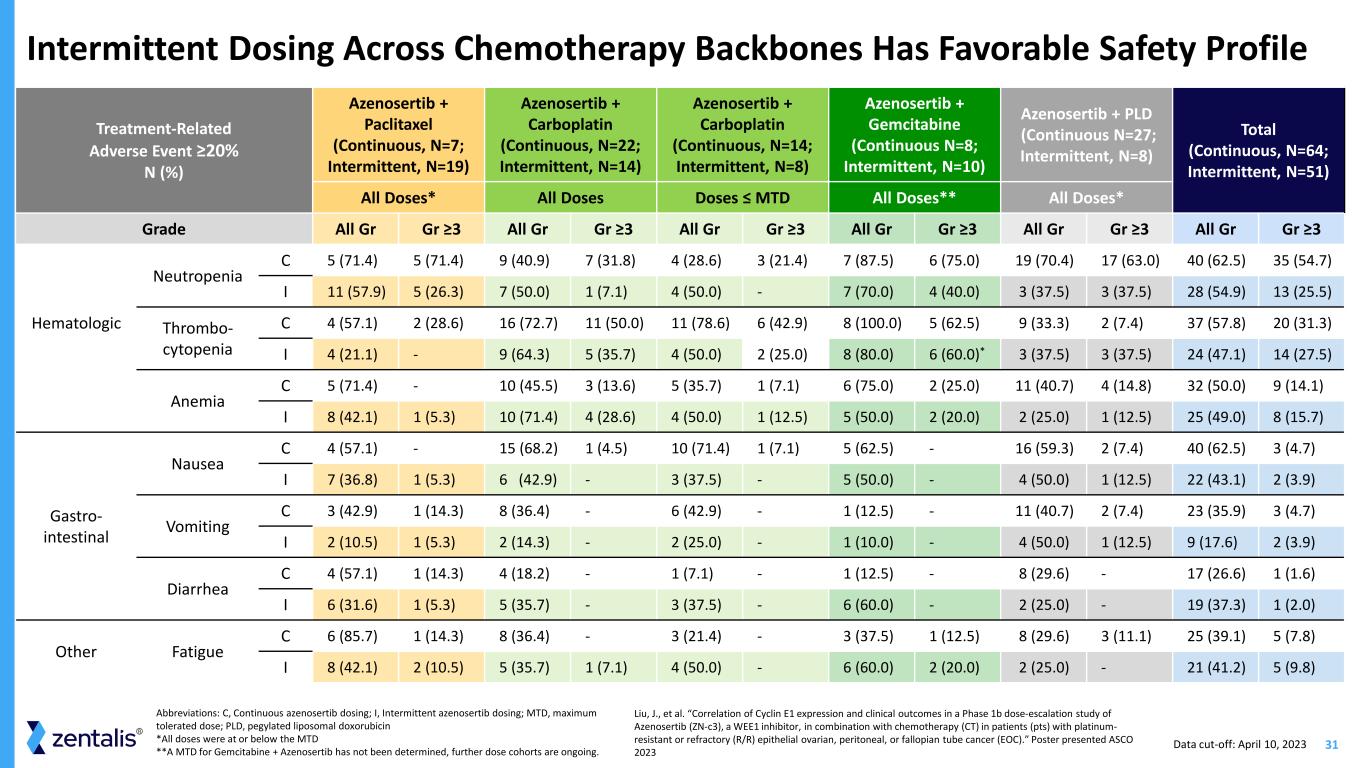
31 縮寫:C,持續阿澤諾塞替布給藥;I,間歇性阿澤諾塞替布給藥;MTD,最大耐受劑量;PLD,聚乙二醇化脂質體多柔比星*所有劑量均等於或低於 MTD **吉西他濱+ Azenosertib 的 A MTD 尚未確定,更多劑量隊列正在進行中。化療骨幹間歇給藥具有良好的安全性特徵治療相關不良事件 ≥ 20% N (%) Azenosertib + 紫杉醇(連續,N=7;間歇性,N=19)Azenosertib + Carboplatin(連續,N=22;間歇性,N=14)Azenosertib + 吉西他濱(連續 N=8;間歇性,N=10)Azenosertib + PLD(連續 N=27;間歇性,N=8)總計(連續,N=64;間歇性,N=51)所有劑量* 所有劑量 ≤ MTD 所有劑量** 所有劑量* 等級 All Gr ≥3 AllGr ≥3 All Gr Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 血液學中性粒細胞減少症 C 5 (71.4) 5 (71.4) 9 (40.9) 7 (28.6) 3 (21.4) 7 (87.5) 6 (75.0) 19 (70.4) 17 (63.0) 40 (62.5) 35 (57.9) I 11 (57.9) 5 (26.3) 7 (50.0) 1 (7.1) 4 (50.0)-7 (70.0) 4 (40.0) 3 (37.5) 3 (37.5) 28 (54.9) 13 (25.5) Thrombo-cytopenia C 4 (57.1) 2 (28.6) 16 (72.7) 11 (50.0) 11 (78.6) 6 (42.9) 8 (100.0) 5 (62.5)) 9 (33.3) 2 (7.4) 37 (57.8) 20 (31.3) I 4 (21.1)-9 (64.3) 5 (35.7) 4 (50.0) 2 (25.0) 8 (80.0) 6 (60.0) * 3 (37.5) 3 (37.5) 3 (37.5) 4 (27.5) 貧血 C 5 (71.4)-10 (45.5) 3 (13.6))5 (35.7) 1 (7.1) 6 (75.0) 2 (25.0) 11 (40.7) 4 (14.8) 32 (50.0) 9 (14.1) I 8 (42.1) 1 (5.3) 10 (71.4) 4 (28.0) 4 (50.0) 1 (12.5) 5 (50.0) 2 (25.0) 2 (25.0) 1 (25.0) 1 (25.0) 1 (12.0) 1 (12.0) 1 (25.0) 1 (12.0) 1 (25.0) 1 (12.0) 1 (25.0) 1 (12.0) 1 (25.0) 1 (12.0) 1 (25.0) 1 (12.0) 1 (25.0) 8 (15.7) Gastro-腸道噁心 C 4 (57.1)-15 (68.2) 1 (4.5) 10 (71.4) 1 (7.1) 5 (62.5)-16 (59.3) 2 (7.4) 40 (62.5) 3 (4.7) I 7 (36.8) 1 (5.3) 6 (42.9)-3 (37.5)-5 (50.0)-4 (50.0) 1 (11.0) 2.5) 22 (43.1) 2 (3.9) 嘔吐 C 3 (42.9) 1 (14.3) 8 (36.4)-6 (42.9)-1 (12.5)-11 (40.7) 2 (7.4) 23 (35.9) 3 (4.7) I 2 (10.5) 1 (5.3)-2 (25.0)-1 (10.0)-4 (50.0) 1 (11.0) 2.5) 9 (17.6)2 (3.9) 腹瀉 C 4 (57.1) 1 (14.3) 4 (18.2)-1 (7.1)-1 (12.5)-8 (29.6)-17 (26.6) 1 (1.6) I 6 (31.6) 1 (35.7)-3 (37.5)-6 (60.0)-2 (25.0)-19 (37.3) 1 (2.0)-19 (37.3) 1 (2.0) 其他 C 6 (85.7) 1 (14.3) 8 (36.4)-3 (21.4)-3 (37.5) 1 (12.5) 8 (29.6) 3 (11.1) 25 (39.1) 5 (7.8) I 8 (42.1) 2 (10.5) 5 (35.7) 1 (7.1) 4 (50.0)-6 (60.0) 2 (20.0) 2 (25.0)-21 (42.0) 1.2) 5 (9.8) Liu,J. 等人。“一項針對WEE1抑制劑Azenosertib(zn-c3)與化療(CT)聯合用於鉑耐藥或難治性卵巢、腹膜或輸卵管癌(EOC)患者(pts)的1b期劑量遞增研究中Cyclin E1表達與臨牀結果的相關性。”海報呈現 ASCO 2023 數據截止日期:2023 年 4 月 10 日

32 *吉西他濱 + Azenosertib 具有令人興奮和持久的活性——MTD 尚未確定,更多劑量隊列正在進行中。縮寫:RP2D,推薦第 2 期劑量;PLD 聚乙二醇化脂質體多柔比星;QD,每日一次;5:2 治療 5 天,然後休息 2 天;D,day;AUC,曲線下方區域;mg/ml*min 數據支持將 Azenosertib-Chermalisa 聯合療法推進到鉑敏感性卵巢癌和早期線療法的主要要點 • 整個化療期間信號強而持久 backbones • Cyclin E1 狀態預測了在化療之外加用 azenosertib 的益處 • 表明 azenosertib 可以恢復經過大量預先治療的化療敏感性鉑耐藥性卵巢癌 • 計劃啟動 azenosertib 與紫杉醇或卡鉑聯合使用 Cyclin E1+ 鉑金敏感性卵巢癌 RP2D Azenosertib 化療 Paclitaxel 300 mg QD 5:2 80 mg/m2 在 D1、D8、D15(28 天週期)D1(21 天週期)Carboplatin 200 mg QD 5:2 AUC=5 在 D1(21 天週期)) 吉西他濱待定* 待定* PLD 400 mg QD 5:2 40 mg/m2 D1(28 天週期)RP2D 是為紫杉醇、卡鉑和 PLD 組合建立的

在大量臨牀前數據的支持下,Azenosertib 推進研究 PARPI 後治療和信標後 BRAF mCRC 的項目

341。Chen X Cancers(巴塞爾)。2021 年 4 月 1 日;13 (7)。縮寫:PARP,聚(ADP-核糖)聚合酶;CDX,細胞系衍生異種移植物;TNBC,三陰性乳腺癌;PDX,患者衍生異種移植物;TGI,腫瘤生長抑制單一療法 Azenosertib +/-PARP 抑制劑組合在卵巢 CDX 和 TNBC PDX 模型中均具有活性 OVCAR3 • PARP 和 WEE1 抑制劑的組合在具有 BRCA 突變或高水平 Cyclin E1 1 的臨牀前模型中 TNBC modelCDX 卵巢癌模型 (OVCAR3; CCNE1 Amp) PDX TNBC 模型 (hbcx-10; brca2mt) Vehicle qdAzenosertib 60 mg/kg,5 on/2 off Azenosertib 60 mg/kg,7 off niraparib 35 mg/kg,5 on/2 off + Azenosertib 60 mg/kg,7 on/7 off + 60 mg/kg,7 on/7 off niraparib 35 mg/kg,7 on/7 off + 60 mg/kg,7 on/7 off(連續)Niraparib 35 mg/kg,7 on/7 off Body Weight TGI Body Weight Vehice Azenosertib 60 mg/kg,Niraparib 5 on/2 優惠 35 mg/kg,Azenosertib 5 on/2 off 60 mg/kg + Niraparib 35 mg/kg
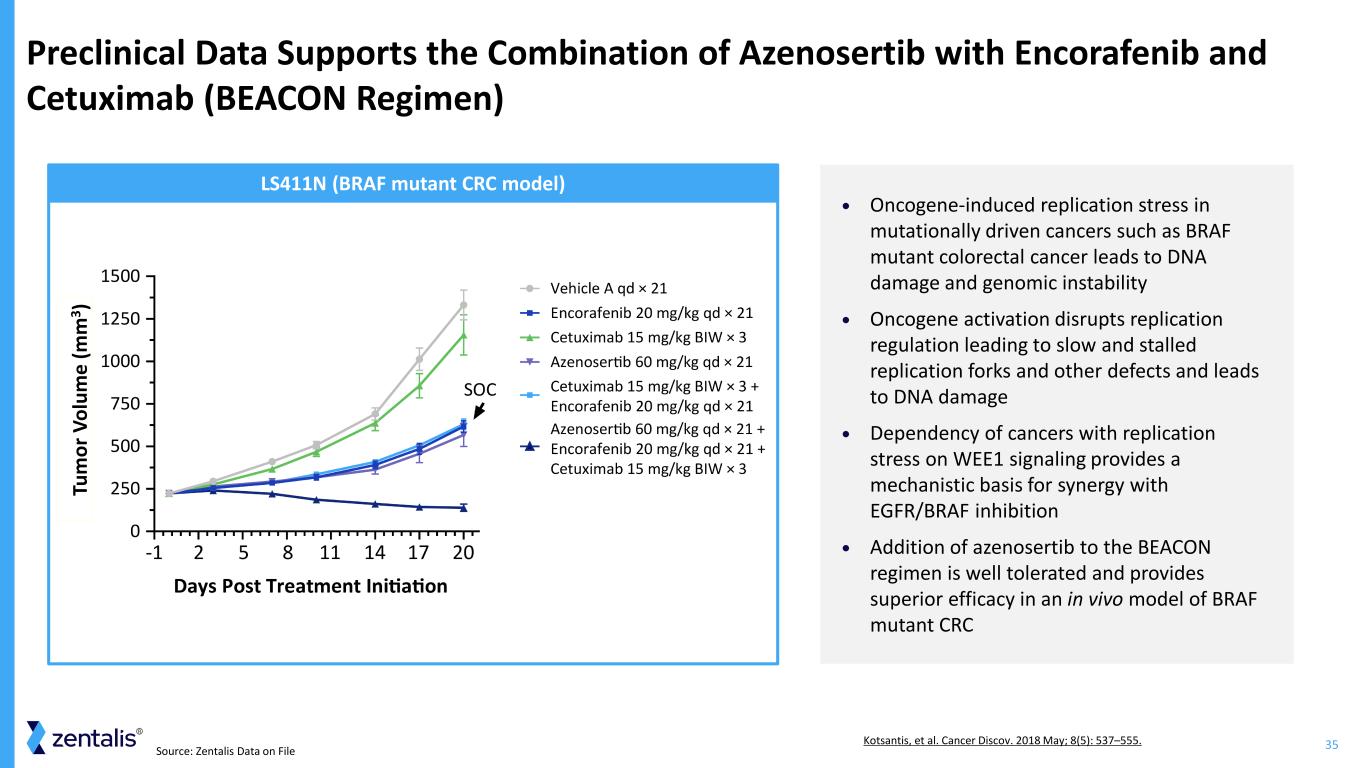
35來源:Zentalis 檔案數據臨牀前數據支持將 Azenosertib 與 Encorafenib 和西妥昔單抗聯合使用(BAEAN 方案)• 在 BRAF 突變體結直腸癌等突變驅動的癌症中,癌基因誘導的複製應激會導致 DNA 損傷和基因組不穩定 • 癌基因激活會破壞複製調節,導致複製分叉緩慢停滯和其他缺陷,導致 DNA 依賴損傷 • WEE1 信號傳導受複製應激的癌症為與 EGFR/BRAF 抑制協同作用提供了機制基礎 •在 BEACON 方案中添加 azenosertib 具有良好的耐受性,在 BRAF 突變體 CRC LS411N(BRAF 突變體 CRC 模型)Tu m 或 V ol um e (m m 3) Kotsantis 等人的體內模型中具有卓越的療效。Cancer Discov。2018 年 5 月;8 (5):537—555。

36 與輝瑞合作開展的 BRAF mCRC 研究主要資格:有 mCRC 且記錄在案 BRAFV600E 突變的患者;先前 1 或 2 次轉移性疾病治療後的疾病進展;先前的治療可能包括 BRAF 和/或 EGFR 定向療法(例如,在 BEACON 方案後可能已取得進展)三聯組合有待於需求未得到滿足的患者進行研究 • BRAF 突變體 CRC 患者的中位操作系統為 2 年2 • 同時有針對性的 BRAF 抑制(braf)例如,vemurafenib)在黑色素瘤中取得了成功,反應率大於 80%,但該策略失敗了由於先天耐藥性導致 CRC(OR ~ 5%)3 • 恩科拉非尼與西妥昔單抗(BEACON)聯合使用於 2020 年 4 月獲準用於 BRAF V600E mCRC,現已成為治療標準階段 1:安全性、耐受性、MTD、RP2D 第 2 階段:劑量擴大階段 1:劑量尋找主要目標第 2 階段:ORR、DOR、DCR、PFS、TTP 提高氮酮的劑量水平 sertib + encorafenib + cetuximab n=多達 80 名患者 Azenosertib 治療轉移性結直腸癌成年人的 1/2 期開放標籤、多中心研究 1 sorbye H、Dragomir A、Sundström M 等。在基於人羣的前瞻性轉移性結直腸癌隊列中,根據KRAS/BRAF突變狀態和腫瘤組織可用性,BRAF突變頻率高,亞組存活率明顯差異。PloS One. 2015;10 (6): e0131046。2 Corcoran 等人BRAF 和 MEK 抑制與達布拉非尼和曲美替尼聯合治療突變結直腸癌。J Clin Oncol (2015) 12 月 1 日;33 (34):4023-4031 3 Kopetz 等人BRAF V600E——突變結直腸癌中的 Encorafenib、Binimetinib 和西妥昔單抗。NEJM(2019)381:1632-1643 Zentalis保留了azenosertib的全部經濟所有權和控制權,但大中華區的權利(Zentara)除外。縮寫:mCRC,轉移性結直腸癌;MTD,最大耐受劑量;RP2D,推薦的第 2 期劑量;ORR,客觀反應率;DOR,反應持續時間;DCR,疾病控制率;PFS,無進展存活率;TTP,進展時間;OS,總存活率

zn-d5 BCL-2 抑制劑具有潛在的同類最佳特徵
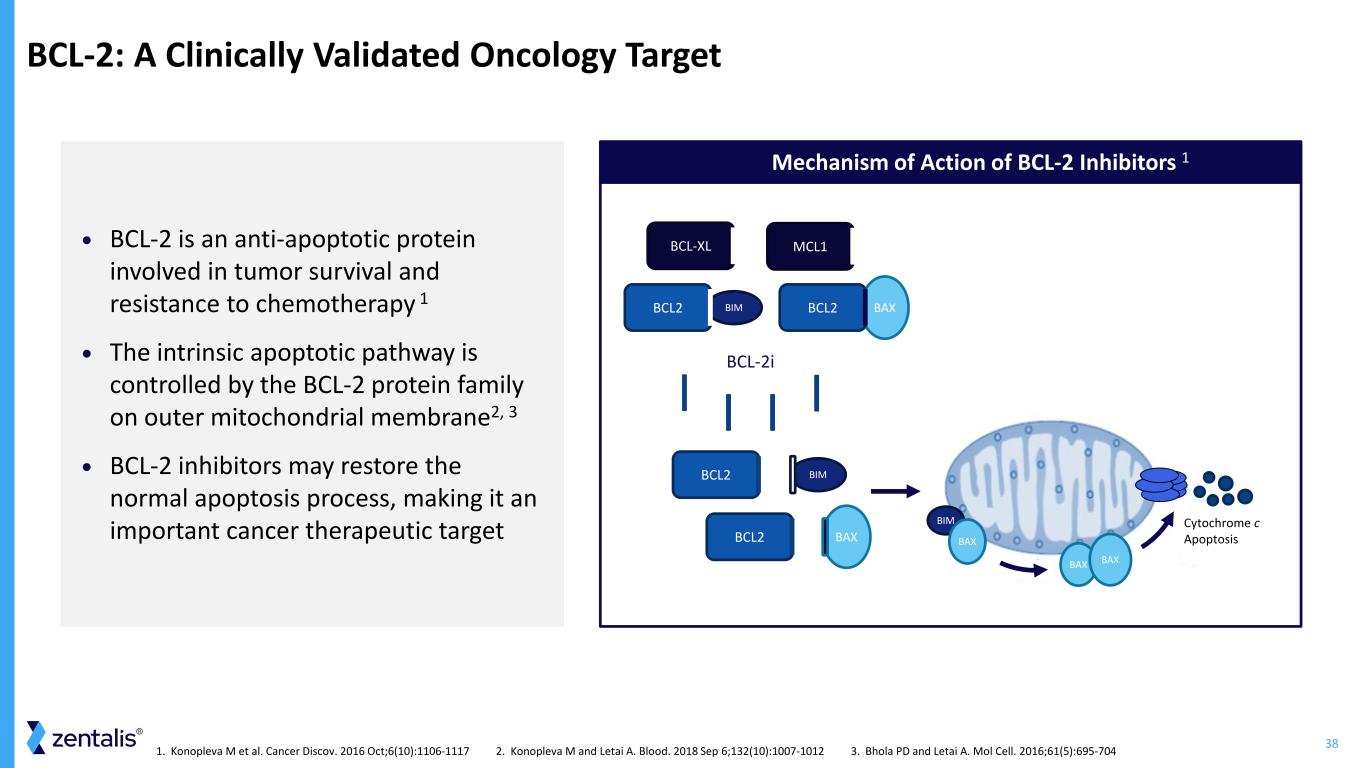
38 BCL-2:經臨牀驗證的腫瘤學靶點 • BCL-2 是一種參與腫瘤存活和化療耐藥性的抗凋亡蛋白 1 • 內在細胞凋亡途徑由線粒體外膜上的 BCL-2 蛋白家族控制2、3 • BCL-2 抑制劑可以恢復正常的細胞凋亡過程,使其成為重要的癌症治療靶點 BCL-2 抑制劑的作用機制 1 BAXBIM BCL2 BCL-2I BCL-2I BAX BCL-2I-XL MCL1 BIM BCL2 BCL2 BIM BAX BAX Cytolhroch c 細胞色素 c 細胞凋亡 1.Konopleva M 等人。Cancer Discov. 2016 年 10 月;6 (10): 1106-1117 2.Konopleva M 和 Letai A. Blood。2018 年 9 月 6 日;132 (10): 1007-1012 3.Bhola PD 和 Letai A. Mol Cell。2016;61 (5): 695-704
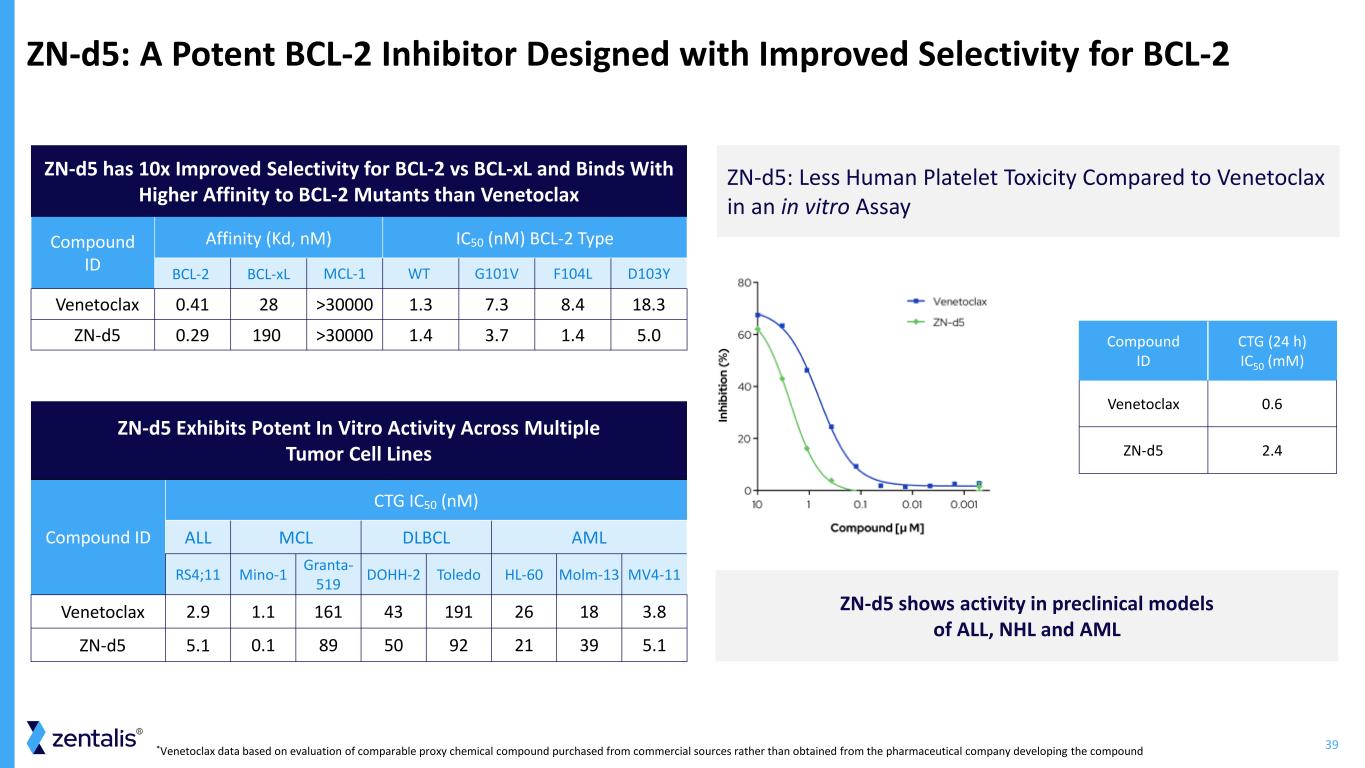
39 zn-d5:與 venetoclax 化合物 ID 親和力 (Kd, nM) IC50 (nM) BCL-2 型 BCL-2 bcl-xL 選擇性相比於 venetoclax 化合物 ID 親和力 (Kd, nM) IC50 (nM) 類型 bcl-xL MCL-1 WT G101V F104L venetoclax 0.41 28 >30000 1.3 7.3 8.4 zn-d5 0.3 29 190 >30000 1.4 3.7 1.4 5.0 zn-d5 在多個腫瘤細胞系中表現出強大的體外活性化合物 ID CTG IC50 (nM) ALL MCL DLBCL AML RS4;11 mino-1 Granta-519,託萊多 bold-13 Venetoclax 2.9 1.1 BCL-2 BCL-2 BCL-2 BCL-2 D103Y DOHH-2 HL-60 MV4-11161 43 191 26 18 3.8 zn-d5 5.1 89 50 92 21 39 5.1 zn-d5:在體外測定中,與 Venetoclax 相比人類血小板毒性更低 zn-d5 在急性淋巴細胞白血病、NHL 和 AML 化合物 ID CTG (24 h) IC50 (mM) Venetoclax 0.6 zn-d5 2.4 的臨牀前模型中顯示出活性從商業來源購買,而不是從開發該化合物的製藥公司獲得
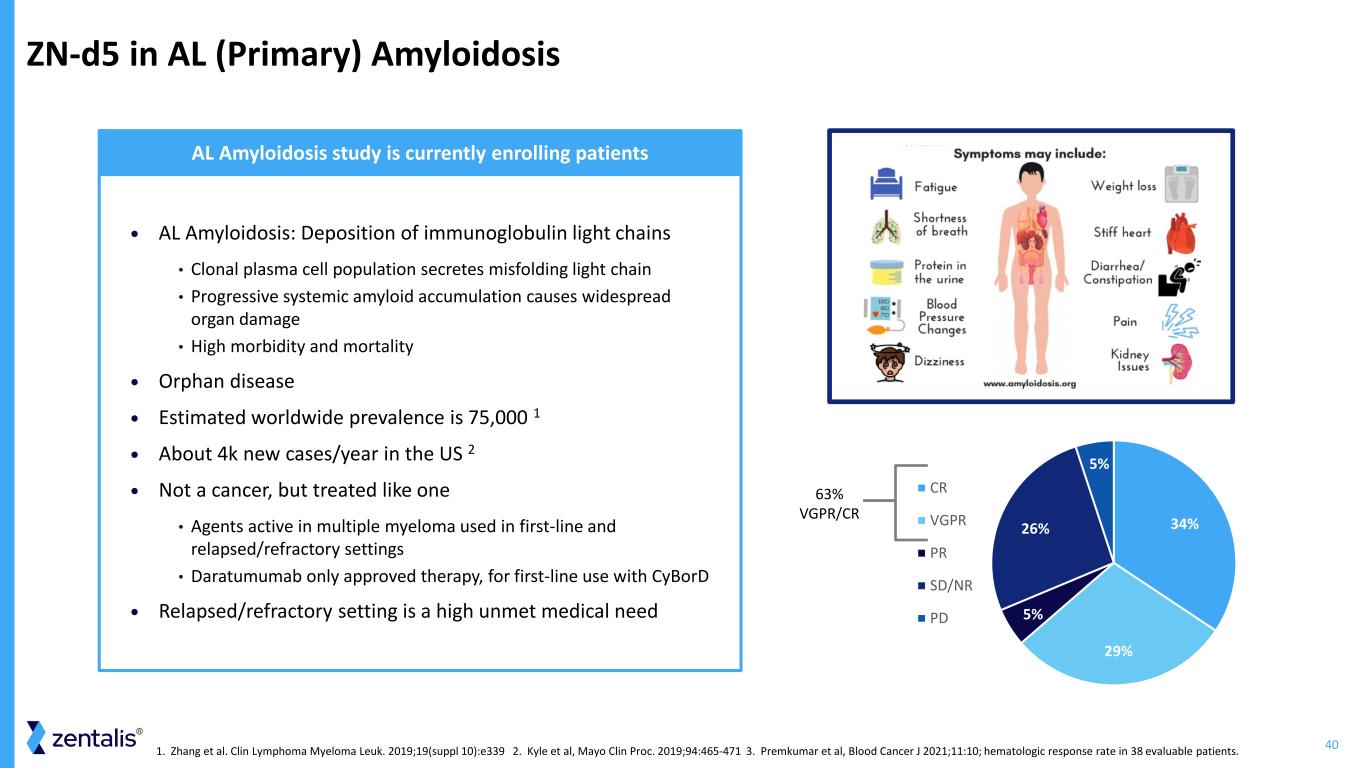
40 Zn-d5 在 AL(原發性)澱粉樣變性 • AL 澱粉樣變性:免疫球蛋白輕鏈沉積 • 克隆漿細胞羣分泌錯誤摺疊的輕鏈 • 進行性系統性澱粉樣蛋白積累會導致廣泛的器官損傷 • 高發病率和死亡率 • 孤兒病 • 估計全球患病率為 75,000 1 • 美國每年約有 4K 例新發病例 2 • 不是癌症,但治療得像癌症 • 活性藥物用於一線和復發/難治性環境中的多發性骨髓瘤 • Daratumumab 僅獲批准的療法,適用於一線與 cybord 一起使用 • Relapsed/難治性環境是一種高度未得到滿足的醫療需求 AL 澱粉樣變性研究目前正在招收患者 34% 29% 5% 26% CR VGPR PR SD/NR PD 63% VGPR/CR 1。張等臨牀淋巴瘤骨髓瘤 Leuk。2019;19(補編 10): e339 2.Kyle 等人,Mayo Clin Proc. 2019;94:465-471 3.Premkumar 等人,Blood Cancer J 2021;11:10;38 名可評估患者的血液學反應率。

41 BCL-2 抑制在 AL 澱粉樣變中顯示出強勁的臨牀活性在可評估的患者中表現出最佳反應 5% 20% 26% 40% 19% 10% 29% 10% 37% 34% 20% ALL PAT I ENTS (N =3 8) NON-T (11; 14) PAT IENT S (N=27) PAT IENT S (N=27) PAT IENT S (N=27) PART SD/NR VGPR CR 30% VGPR PR/CR 63% GPR/CR 78% VGPR/CR 1.Premkumar 等人,Blood Cancer J 2021;11:10;38 名可評估患者的血液學反應率。適用於所有患者 OS • t (11; 14) 易位患者的預後比普通的 AL 澱粉樣變性人羣差1 • BCL-2 抑制顯示 t (11; 14) 隊列的反應率有所提高,存活率有提高的趨勢
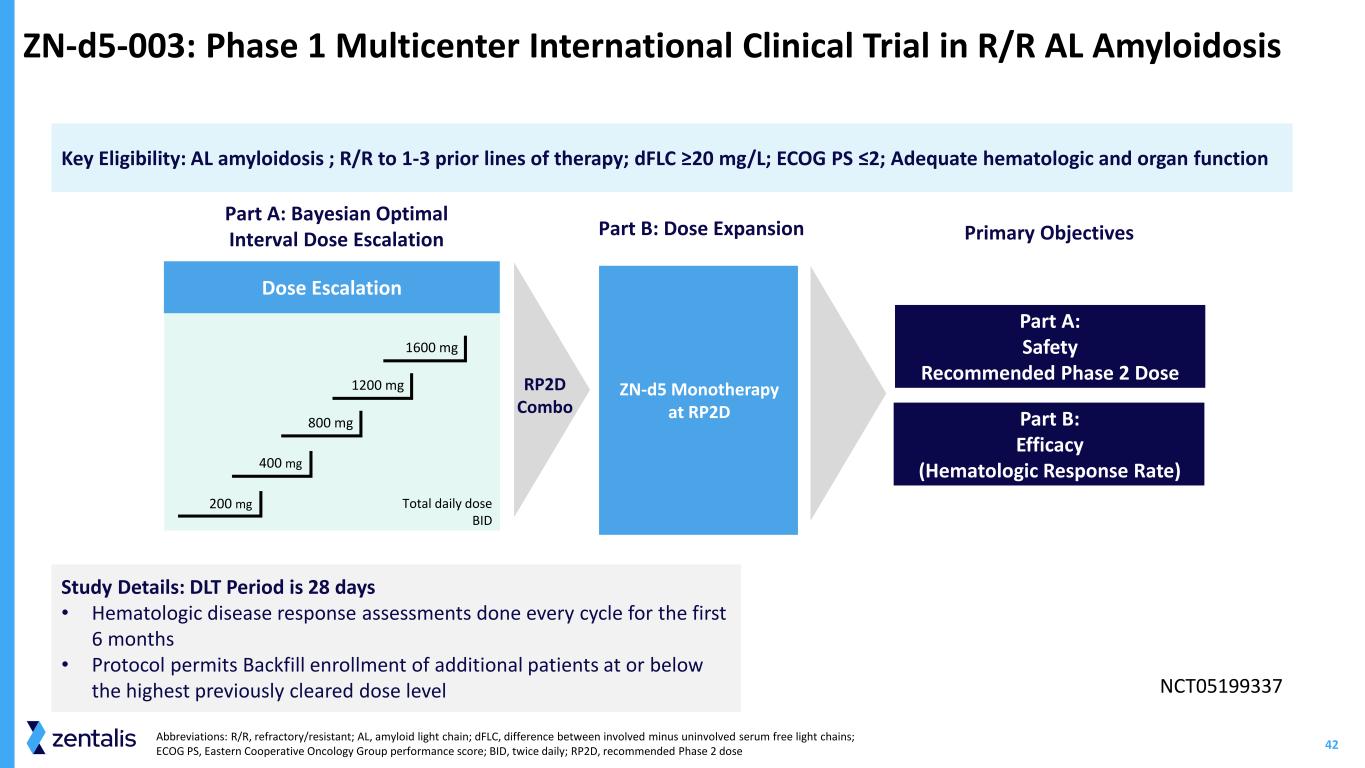
42 zn-d5-003:R/R AL澱粉樣變性的 1 期多中心國際臨牀試驗 A 部分:安全推薦的 2 期劑量密鑰資格:AL 澱粉樣變性;R/R 至 1-3 條先前的治療線路;dfLC ≥20 mg/L;ECOG PS ≤2;充足的血液學和器官功能 A 部分:貝葉斯最佳劑量遞增間隔劑量遞增主要目標 B 部分:療效(血液學反應)Rate) 每日總劑量 BID 研究詳情:DLT 期為 28 天 • 前 6 個月每個週期進行血液學疾病反應評估 • 協議允許回填註冊其他處於或低於先前批准的最高劑量水平的患者 NCT05199337 400 mg 1600 mg 1200 mg 800 mg 200 mg 200 mg zn-d5 單一療法在 RP2D 部分:劑量擴展 RP2D 組合縮寫:R/R,澱粉樣蛋白輕鏈;AL,澱粉樣蛋白輕鏈;dfLC,累及的差異減去未受累的血清遊離輕鏈;ECOG PS,東方合作腫瘤小組表現得分;BID,每日兩次;RP2D,第 2 階段的推薦劑量

bcl-xL 蛋白降解器引人入勝的發現計劃
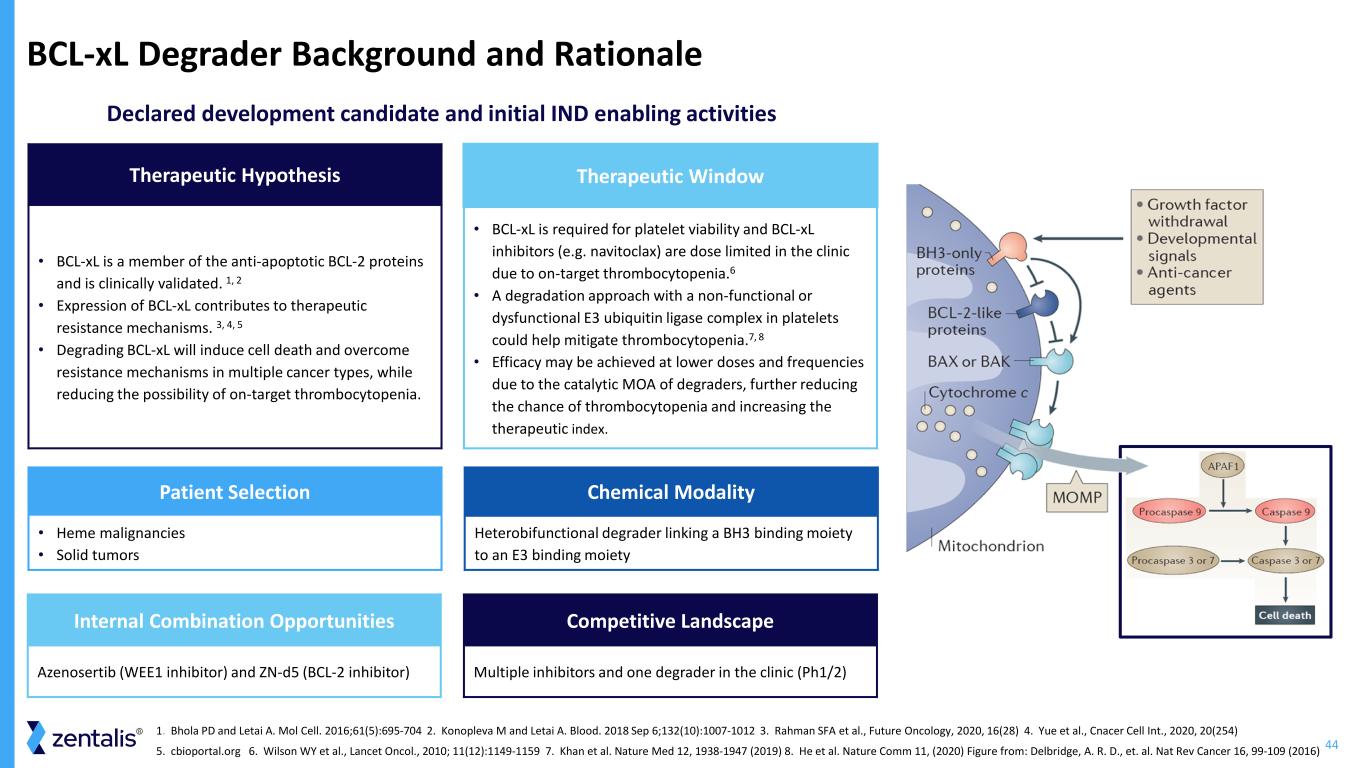
44 bcl-xL 降解背景和原理已申報的候選發育和初始 IND 支持活動治療假設 • bcl-xL 是抗細胞凋亡 BCL-2 蛋白的成員,已得到臨牀驗證。1、2 • bcl-xL 的表達有助於治療耐藥機制。3、4、5 • 降解 bcl-xL 將誘發細胞死亡並克服多種癌症類型的耐藥機制,同時降低靶向血小板減少的可能性。患者選擇 • 血紅素惡性腫瘤 • 實體瘤內部聯合機會 Azenosertib(WEE1 抑制劑)和 zn-d5(BCL-2 抑制劑)治療窗口 • 血小板活力需要 bcl-xL,而由於靶向血小板減少症,bcl-xL 抑制劑(例如 navitoclax)在臨牀上受到劑量限制。6 • 採用無功能或功能失調 E3 泛素的降解方法血小板中的酶複合物可能有助於緩解血小板減少症。7、8 • 此外,由於降解劑的催化 MOA,可以在較低的劑量和頻率下達到療效減少血小板減少的機會並提高治療指數。化學模態異雙功能降解劑將 BH3 結合部分連接到 E3 結合部分競爭格局多重抑制劑和臨牀中的一種降解劑 (Ph1/2) 1.Bhola PD 和 Letai A. Mol Cell。2016;61 (5): 695-704 2.Konopleva M 和 Letai A. Blood。2018 年 9 月 6 日;132 (10): 1007-1012 3.Rahman SFA 等人,《未來腫瘤學》,2020,16 (28) 4。Yue 等人,Cancer Cell Int.,2020,20 (254) 5。cbioportal.org 6.Wilson WY 等人,《Lancet Oncol.》,2010 年;11 (12): 1149-1159 7。Khan 等人。Nature Med 12,1938-1947 (2019) 8.他等。Nature Comm 11,(2020)圖來自:Delbridge、A.R.D. 等人。Nat Rev Cancer 16、99-109 (2016)
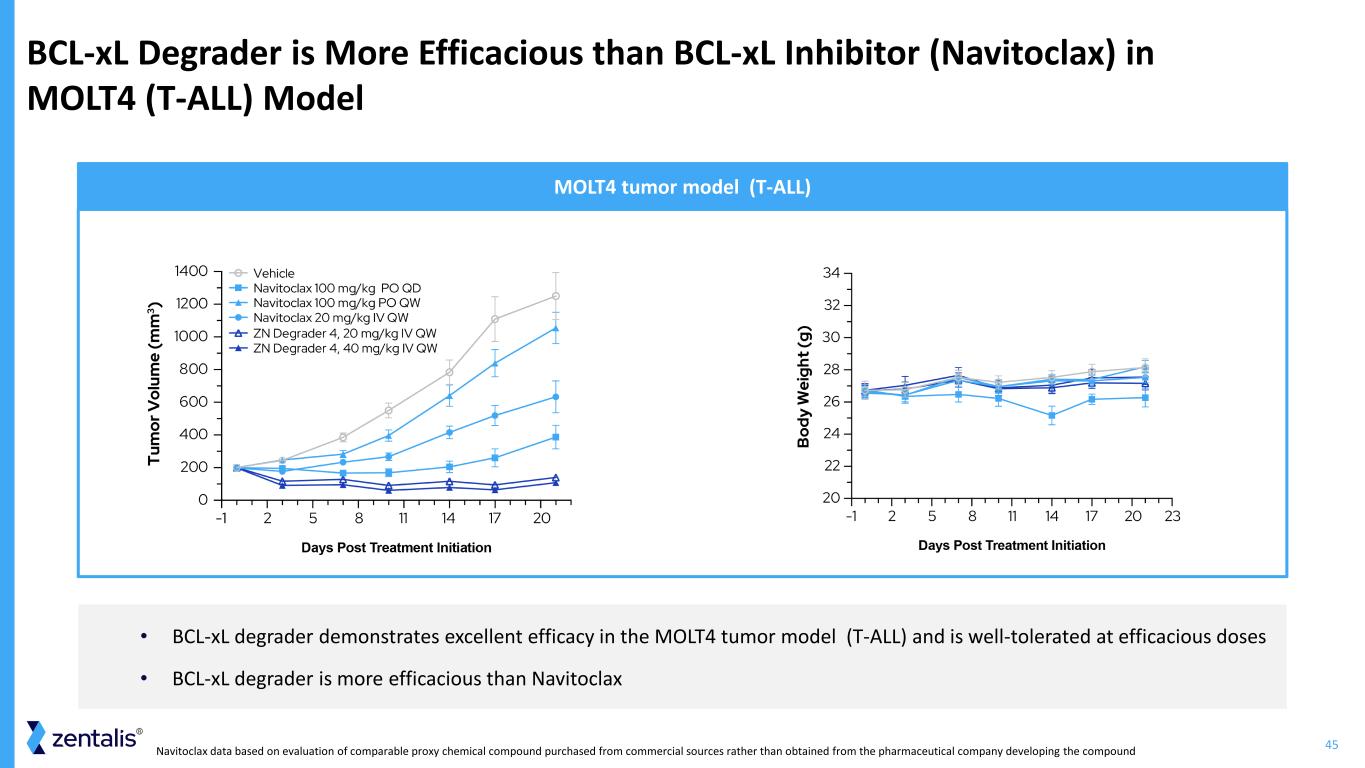
45 bcl-xL 降解劑在 MOLT4 (T-ALL) 模型 MOLT4 腫瘤模型 (T-ALL) 中比 bcl-xL 抑制劑 (Navitoclax) 更有效 • bcl-xL 降解劑在 MOLT4 腫瘤模型 (T-ALL) 中表現出優異的功效,在有效劑量下耐受性良好 • bcl-xL 降解劑比 Navitoclax Navitoclax 數據更有效來自商業來源,而不是從開發該化合物的製藥公司獲得

46 2023 年是催化劑豐富的一年 — 關鍵里程碑 Azenosertib WEE1 抑制劑 zn-d5 BCL-2 抑制劑發現 2023 年第 1 季度啟動 BRAF 突變體結直腸癌 BEACON 療法聯合臨牀試驗與輝瑞合作 2023 年上半年在科學會議上提供 Cyclin E1 富集策略的臨牀前依據 2023 年上半年在科學會議上宣佈單一療法 RP2D 並提供劑量優化活動、項目時間表和潛在註冊途徑的最新結果來自 1b 期卵巢化療聯合試驗,包括臨牀Cyclin E1 擴增/過度表達的轉化數據 2H 2023 更新實體瘤單一療法劑量優化的中期療效臨牀數據 2023 年下半年更新單一療法項目時間表和潛在註冊途徑 2024 年第一季度啟動 azenosertib + 化療的隨機 3 期試驗 2H 2023 提供中期臨牀數據並申報 RP2D 提供 2023 azenosertib + zn-d5 在復發/難治性急性患者臨牀試驗中的初步數據髓系白血病 2023 繼續通過 IND 賦能研究推進 bcl-xL 蛋白降解器計劃 2023 推進正在進行的未公開靶標蛋白降解計劃研究

zentalis.com 金伯利·布萊克威爾,醫學博士首席執行官 kblackwell@zentalis.com (212) 433-3787 梅利莎·埃珀利首席財務官 mepperly@zentalis.com (212) 290-7271 公司辦公室 1359 百老匯套房 801 紐約州紐約 10018 科學中心 10275 科學中心大道套房 200 加利福尼亞州聖地亞哥 92121