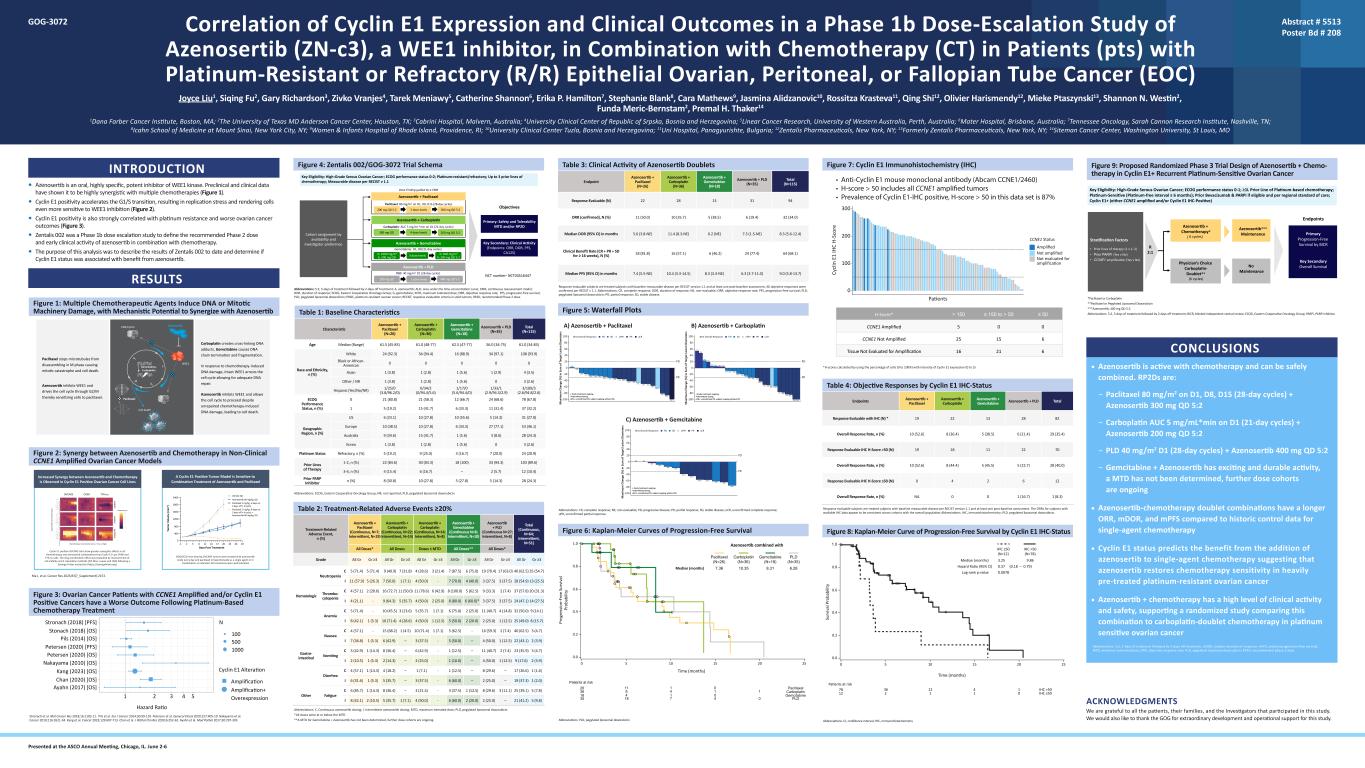
WEE1 抑制劑 Azenosertib (zn-c3) 聯合化療 (CT) 治療鉑耐藥或難治性卵巢癌、腹膜癌或輸卵管癌 (EOC) 患者 (pts) 的 1b 期劑量遞增研究中 Cyclin E1 表達與臨牀結局的相關性 Joyce Liu1、Siqing Fu2、Gary Richardson2 3、Zivko Vranjes4、Tarek Meniawy5、Catherine Shannon6、Erika P. Hamilton7、Stephanie Blank8、Cara Mathews9、Jasmina Alidzanovic10、Rossitza Krasteva11、Qing Shi12、Olivier Harismendy12、Mieke Ptaszynski13、Shannon N. Westin2、FundaMeric-Bernstam2,Premal H. Thaker14 1Dana Farber 癌症研究所,馬薩諸塞州波士頓;2德克薩斯州休斯敦德克薩斯大學安德森癌症中心;3澳大利亞馬爾文卡布里尼醫院;4波斯尼亞和黑塞哥維那塞族共和國大學臨牀中心;5線性癌症研究,澳大利亞珀斯西大學;6Mater 醫院,澳大利亞布里斯班;7田納西腫瘤學,莎拉·坎農研究所,田納西州納什維爾;8紐約州紐約市西奈山伊坎醫學院;9羅德島州普羅維登斯市羅德島婦幼醫院;10波斯尼亞和黑塞哥維那圖茲拉大學臨牀中心;保加利亞帕納久裏什特 11Uni 醫院;12Zentalis Pharmicals,紐約州紐約;13前身為紐約州紐約市 Zentalis Pharmicals;密蘇裏州聖路易斯華盛頓大學 14Siteman 癌症中心簡介 • Azenosertib 是一種口服、高特異性、強效的 WEE1 激酶抑制劑。臨牀前和臨牀數據表明,它與多種化療具有高度的協同作用(圖 1)。• 細胞週期蛋白 E1 陽性可加速 G1/S 過渡,導致複製應激,使細胞對 WEE1 抑制更加敏感(圖 2)。• Cyclin E1 陽性還與鉑耐藥和更差的卵巢癌預後密切相關(圖 3)。• Zentalis 002 是 1b 期遞增劑量旨在定義 azenosertib 與化療聯合使用的 2 期推薦劑量和早期臨牀活性的研究。•該分析的目的是描述Zentalis 002迄今為止的結果,並確定Cyclin E1狀態是否與azenosertib的益處有關。結果圖 1:多種化療藥物誘發 DNA 或有絲分裂機制損傷,具有與 Azenosertib 協同作用的機制潛力圖 2:在非臨牀 CCNE1 擴增的卵巢癌模型中 Azenosertib 與化療之間的協同作用 Ma J 等人Cancer Res 2023;83(7_Supplement): 2153。圖 3:患有 CCNE1 擴增和/或細胞週期蛋白 E1 陽性癌症的卵巢癌患者在接受鉑類化療後的預後較差 Stronach 等人。2018 年 Mol Cancer Res;16:1103-11。皮爾斯等人2014 年 Eur J Cancer;50:99-110。彼得森等。Gynol Oncol 2020;157:405-10。中山等2010 年癌症;116:2621-34。Kang 等人。癌症 2023;129:697-713。陳等2020 年 J Pathol Clin Ress;6:252-62。Ayahn 等Mod Pathol 2017;30:297-303 Carboplatin 會產生交聯 DNA 加合物,吉西他濱導致 DNA 鏈終止和片段。為了應對化療引起的 DNA 損傷,完整的 WEE1 會阻斷細胞週期,從而進行充分的 DNA 修復。Azenosertib 抑制 WEE1 並允許細胞週期繼續進行,儘管化療未修復引起的 DNA 損傷,但會導致細胞死亡。紫杉醇阻止微管在 M 期分解,導致有絲分裂災難和細胞死亡。Azenosertib 抑制 WEE1 並推動細胞週期通過 G2/M,從而使細胞對紫杉醇過敏。吉西他濱、卡鉑紫杉醇 WE1 CDK/Cyclin 細胞死亡 S G2 M G1 西他濱、arboplatin clitaxel E1 K/Cyclin el death Azenosertib Cyclin E1 陽性 OVCAR3 細胞在所有化療和 azenosertib 組合中的協同作用比 Cyclin E1 Low OV90 和 tyk-NU 細胞更大。根據Synergy Finder的指令(https://synergyfinder.org),通過測量細胞活力和4種計算方法(ZIP、Bliss、Loewe和HSA)對藥物組合效果進行了評估。患有 OVCAR3 腫瘤的 NOD/SCID 小鼠每天口服 azenosertib 治療,腹腔注射紫杉醇作為單一藥物或聯合治療,如指示所示。所有治療的耐受性良好。68% TGI 74% TGI 迴歸 OVCAR3 OV90 TYK-NU A Cyclin E1 陽性腫瘤模型對 azenosertib 和紫杉醇的聯合治療敏感在 cyclin E1 陽性卵巢癌細胞系中觀察到 Azenosertib 與化療之間的協同作用增強 1 2 4 53 Ayahn (2017) [操作系統]Cyclin E1 Alvated Chan (2020) [操作系統]Kang (2023) [操作系統]中山 (2010) [操作系統]彼得森 (2020) [操作系統]彼得森 (2020) [PFS]Pils (2014) [操作系統]Stonach (2018) [操作系統]Stronach (2018) [PFS]N Hazard Ratio 500 100 1000 擴增+ 過度表達在伊利諾伊州芝加哥的 ASCO 年會上發表。6 月 2 日至 6 日摘要 # 5513 Poster Bd # 208 GOG-3072 結論 • Azenosertib 對化療具有活性,可以安全地聯合使用。rp2D 是:— D1、D8、D15 上的紫杉醇 80 mg/m2(28 天週期)+ Azenosertib 300 mg QD 5:2 — Carbolatin AUC 5 mg/ml*Min 在 D1(21 天週期)+ Azenosertib 200 mg QD 5:2 — 吉西他濱 + Azenosertib 具有令人興奮和持久的活性,MTD 尚未確定,更多劑量隊列正在進行中 • 與單藥化療的歷史對照數據相比,azenoSertib-Chermarib複方聯合療法的 ORR、mdoR 和 mpF 更長 • Cyclin E1 狀態預測了添加的益處azenosertib 轉單藥化療表明 azenosertib 可恢復經過大量預先治療的耐鉑卵巢癌的化療敏感性 • Azenosertib + 化療具有很高的臨牀活性和安全性,支持一項隨機研究將該組合與鉑雙聯化療在鉑敏感性卵巢癌中進行比較縮寫:5:2 治療 5 天后休假;mdoR,中位反應持續時間;MPF,無進展存活率;MTD,最大耐受劑量;ORR,客觀反應比率;PLD,聚乙二醇化脂質體多柔比星;RP2D,推薦的 2 期劑量。圖 4:Zentalis 002/GOG-3072 試驗架構縮寫:5:2,治療 5 天,休息 2 天;A,azenosertib;AUC,時間集中曲線下的區域;CRM,持續重新評估模型;DOR,反應持續時間;ECOG,東方合作腫瘤小組;G,吉西他濱;MTD,最大耐受劑量;ORR,目標反應率;PFS,無進展存活;PLD,聚乙二醇化脂質體多柔比星;PROC,耐鉑卵巢癌;RECIST,實體瘤反應評估標準;RP2D,推薦的第二階段劑量。 表 1:基線特徵 Azenosertib + Paclitaxel (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + Gemcitabine (N=18) Azenosertib + PLD (N=35) 總計 (N=115) 年齡中位數(範圍)61.5 (45-83) 61.0 (48-77) 62.5 (47-77) 56。0 (34-75) 61.0 (34-83) 種族和民族,n (%) 白人 24 (92.3) 34 (94.4) 16 (88.9) 34 (97.1) 108 (93.9) 黑人或非裔美國人 0 0 0 0 0 0 亞洲人 1 (3.8) 1 (2.8) 1 (5.6) 1 (2.9) 4 (3.5) 其他/NR 1 (3.8) 1 (2.8) 1 (5.6) 0 3 (2.6) 西班牙裔 (是/no/nR) 1/25/0 (3.8/96.2/0) 0/34/2 (0/94.4/5.6) 1/17/0 (5.6/94.4/0) 1/33/1 (2.9/94.3/2。9) 3/109/3 (2.6/94.8/2.6) ECOG 績效狀態,n (%) 0 21 (80.8) 21 (58.3) 12 (66.7) 24 (68.6) 78 (67.8) 1 5 (19.2) 15 (41.7) 6 (33.3) 11 (31.4) 37 (32.2) 地理區域,n (%) 美國 6 (23.1) 10 (27.8) 10 (55.6) 5 (14.3) 31 (27.0) 歐洲 10 (38.5) 10 (27.8) 6 (33.3) 27 (77.1) 53 (46.1) 澳大利亞 9 (34.6) 15 (41.7) 1 (5.6) 3 (8.6) 28 (24.3) 韓國 1 (3.8) 1 (2.8) 1 (5.6) 0 3 (2.6) Platinum Status 耐火材料,n (%) 5 (19.2) 9 (25.0) 3 (16.7) 7 (20.0) 24 (20.9) 先前的治療線路 1-2,n (%) 22 (84.6) 30 (83.3) 18 (100) 33 (94.3) 103 (89.6) 3-4,n (%) 4 (15.4) 6 (16.7) — 2 (5.7) 12 (10.4) PARP 抑制劑 n (%) 8 (30.8) 10 (27.8) 5 (14.8) 5 (14.8) 5 (14.8) 3) 28 (24.3) 縮寫:ECOG,東方合作腫瘤學小組;NR,未報告;PLD,聚乙二醇化脂質體多柔比星。表 2:治療相關不良事件 ≥ 20% 治療相關不良事件,n (%) Azenosertib + 紫杉醇(持續,N=7;間歇性,N=19)Azenosertib + Carboplatin(連續,N=22;間歇性,N=14)azenosertib + Carboplatin(連續,N=14)abine(連續 N=8;間歇性,N=10)Azenosertib + PLD(連續 N=27;間歇性,N=8)總計(連續,N=64;間歇性,N=51)所有劑量* 所有劑量 ≤ MTD 所有劑量** 所有劑量* 等級 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3All Gr ≥3 血液學中性粒細胞減少症 C 5 (71.4) 5 (71.4) 9 (40.9) 7 (31.8) 4 (28.6) 3 (21.4) 7 (87.5) 6 (75.0) 19 (70.4) 17 (63.0) 40 (62.5) 35 (54.7) I 11 (57.9) 5 (26.3) 7 (50.0) 1 (7.1) 4 (50.0)-7 (70.0) 4 (40.0) 3 (37.5) 3 (37.5) 28 (54.9) 13 (25.5) Thrombo-cytopenia C 4 (57.1) 2 (28.6) 16 (72.7) 11 (78.6) 6 (42.9) 8 (100.0) 5 (62.5) 9 (33.3) 2 (7.4) 37 (57.8)) 20 (31.3) I 4 (21.1)-9 (64.3) 5 (35.7) 4 (50.0) 2 (25.0) 8 (80.0) 6 (60.0) * 3 (37.5) 24 (47.1) 14 (27.5) 貧血 C 5 (71.4)-10 (45.5) 3 (13.6) 5 (35.7) 1 (7.1) 6 (75.0)) 2 (25.0)11 (40.7) 4 (14.8) 32 (50.0) 9 (14.1) I 8 (42.1) 1 (5.3) 10 (71.4) 4 (28.6) 4 (50.0) 1 (12.5) 5 (50.0) 2 (25.0) 1 (12.5) 25 (49.0) 8 (15.7) 胃腸噁心 C 4 (57.1)-15 (57.1) 68.2) 1 (4.5) 10 (71.4) 1 (7.1) 5 (62.5)-16 (59.3) 2 (7.4) 40 (62.5) 3 (4.7) I 7 (36.8) 1 (5.3) 6 (42.9) — 3 (37.5) — 4 (50.0) 1 (12.5) 22 (43.1) 2 (3.9) 嘔吐 C 3 (42.9) 1 (14.3) 8 (36.4) — 6 (42.9)-1 (12.5) — 11 (40.7) 2 (7.4) 23 (35.9) 3 (4.7) I 2 (10.5) 1 (5.3) — 2 (25.0) — 1 (10.0) — 4 (50.0) 1 (12.5) 9 (17.6) 2 (3.9) 腹瀉 C 4 (57.1) 1 (14)。3) 4 (18.2) — 1 (7.1)-1 (12.5) — 8 (29.6) — 17 (26.6) 1 (1.6) I 6 (31.6) 1 (5.3) 5 (35.7) — 3 (37.5)-6 (60.0) — 2 (25.0) — 19 (37.3) 1 (2.0) 其他疲勞 C 6 (85.7) 1 (14.3) 8 (36.4) — 3 (21.4)-3 (37.5) 1 (12.5) 8 (29.6) 3 (11.1) 25 (39.1) 5 (7.8) I 8 (42.1) 2 (10.5) 5 (35.7) 1 (7.1) 4 (50.0)-6 (60.0) 2 (25.0) — 21 (41.2) 5 (9.8) 縮寫:C,連續 aza enosertib 劑量;I,間歇性 azenosertib 給藥;MTD,最大耐受劑量;PLD,聚乙二醇化脂質體多柔比星。*所有劑量均等於或低於最大劑量**吉西他濱+ Azenosertib的MTD尚未確定,進一步的劑量隊列正在進行中。表 3:Azenosertib Doublets 的臨牀活性終點 Azenosertib + paclitaxel (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + Gemcitabine (N=18) Azenosertib + PLD (N=35) Total (N=115) Responsertib + PLD (N =35) Responsertib (N) 22 28 13 31 94 ORR(已確認),N (%) 11 (50.0) 10 (35.7) 5 (38.5) 6 (19.4) 32 (34.0) 5.6 (3.8-NE) 11.4 (8.3-NE) 6.2 (NE) 7.3 (1.5-NE) 8.3 (5.6-12.4) 臨牀受益率 (CR + PR + SD ≥ 16 周),N (%) 18 (81.8) 16 (57.1) 6 (46.2) 24 (77.4) 64 (68.1) 7.4 (5.5-NE) 第 7.4 個月 PFS 中位數(95% 置信區間)10.4 (3.3-14.5) 8.3(3.3-NE) 6.3 (3.7-11.0) 9.0 (5.8-13.7) 根據RECIST版本1.1和至少一次基線後評估,可評估反應的受試者是接受過基線可測量疾病的受試者。根據 RECIST v 1.1,所有客觀迴應均得到證實。縮寫:CR,完全反應;DOR,反應持續時間;NE,不可評估;ORR,客觀反應率;PFS,無進展存活率;PLD,聚乙二醇化脂質體多柔比星;PR,部分緩解;SD,穩定性疾病。圖 5:瀑布圖縮寫:CR,完全反應;NE,不可評估;PD,進行性疾病;PR,部分緩解;SD,穩定性疾病;uCR,未經證實的完全反應;uPR,未經證實的部分反應。圖 6:無進展存活率的 Kaplan-Meier 曲線縮寫:PLD,聚乙二醇化脂質體多柔比星 0 0.0 0.2 0.4 0.6 0.8 1.0 10 15 20 25 時間(月)處境危險的患者 Pr og re ss io n-Fr ee S ur vi l pr ob ilt 35 36 26 18 8 11 4 4 1 1 4 1 4 4 1 4 0 0 1 中位數(月)tib 與紫杉醇聯合使用 PLD 卡博拉汀吉西他濱 6.28 PLD (N=35) 紫杉醇 (N=26) 7.36 吉西他濱 (N=18) 8.31 Carboplatin (N=36) 10.35 圖 7:Cyclin E1 免疫組織化學 (IHC) *H 分數通過使用細胞百分比(0 至 100%)計算得出細胞週期蛋白 E1 表達強度(0 至 3)表 4:細胞週期蛋白 E1 IHC 狀態終點的客觀反應 Azenosertib + paclitaxel Azenosertib + Carboplatin Azenosertib + Gemcitabine azenosertib + PLD 可用 IHC 進行評估的總反應* 19 22 13 28 82 總體反應率,n (%) 10 (52.6) 8 (33) 6.4) 5 (38.5) 6 (21.4) 29 (35.4) 響應可評估 IHC H-Score >50 (N) 19 18 11 22 70 總體回覆率,n (%) 10 (52.6) 8 (44.4) 5 (45.5) 5 (22.7) 28 (40.0) 響應可評估 IHC H-Score ≤50 (N) 0 4 2 6 12 總體響應率,n (%) NA 0 1 (16.7) 1 (8.3)根據RECIST版本1.1和至少一次基線後評估,可評估反應的受試者是接受過治療的受試者,其患有基線可測量的疾病。擁有可用 IHC 數據的受試者的 ORR 似乎在各隊列中與整個人羣一致。縮寫:IHC,免疫組織化學;PLD,聚乙二醇化脂質體多柔比星。圖 8:Cyclin E1 無進展存活率 Kaplan-Meier 曲線 IHC 狀態縮寫:CI,置信區間;IHC,免疫組織化學 0 0.2 0.4 0.6 0.8 5 10 15 25 25 1.0 時間(月)有風險的患者 Su rv iv al P ro bi lit y 78 12 36 12 1 4 1 0 中位數(月)3.25 IHC ≤50(N=12)IHC >C >50 IHC ≤50 IHC >50 (N=78) 9.86 危險比 (95% 置信區間) 0.37 (0.18 — 0.79) log-rank p 值 0.0078 圖 9:Azenosertib + 化療在週期蛋白 E1+ 複發性鉑敏感性卵巢癌中的擬議隨機化 3 期試驗設計 *紫杉醇或卡鉑**紫杉醇或聚乙二醇化脂質體多柔比星***Azenosertib,400 mg QD 5:2 縮寫:5:2 治療 5 天,然後休息 2 天;BICR,盲人獨立中心審查;ECOG,東方合作腫瘤小組;parPi,PARP 抑制劑。Azenosertib + Paclitaxel 200 mg QD 5:2 2 劑量水平 300 mg QD 5:2 Azenosertib + 吉西他濱 Azenosertib + PLD 200 mg QD 3 劑量水平按可用性和研究者偏好劃分紫杉醇:D1、D8、D15 上的 80 mg/m2(28 天週期)目標 Azenosertib + Carboplatin 300 mg QD Gemcitaxel D1、D8(21 天週期)4 劑量等級 200 mg QD 5:2 卡鉑:AUC 5 mg/mlin 在 D1(21 天週期)G:1000 mg/m2 A:200 mg QD 3 劑量水平 G:600 mg/m2 A:200 mg QD 5:2 pld:40 mg/m2 D1(28 天週期)在 CRM Key 的指導下進行劑量查找資格:高級別漿液性卵巢癌;ECOG 表現狀態 0-2;鉑耐藥/難治性;最多 3 條之前的化療線路;RECIST v 1.1 中可測量的疾病:安全性和耐受性 MTD 和/或 RP2D 關鍵次要性:臨牀活動(終點:ORR、DOR、PFS、CA125)NCT 編號——NCT04516447 致謝我們感謝參與這項研究的所有患者、他們的家屬和研究人員。我們還要感謝GOG為這項研究提供的非凡發展和運營支持。-100 -80 -60 -40 -20 0 200^ 200 200 250^ + 研究治療正在進行中。^間歇性給藥。upR+:未經證實的 PR,受試者正在進行沒有 PD。+ 研究治療正在進行中。^間歇性給藥。upr+:未經證實的 PR,受試者正在沒有 PD。200^ 300^,+ 300^,+ 200 200 200 300^,+ 300^,+ 250^ 200 200 200 200 200 200 250^,+300 300 200 200 200 200 200 200 250,+ 250^,+ 250 250,+ 250^,+ 200250,+ 250^,+ 300^ PR PD PR PD 200 40 60 m ax im um c ha ng e (%) i n Su m m o f t t l es io n di am et s m m c ha e (%) i n su m o f t ar ge t t l es io n di am et s a n di am et s ar s ar s s s s s s s s paclitaxel B (Azenosertib + paclitaxel B) enosertib + Carboplatin -100 -80 -60 -40 -20 20 20 40 60 8080100 -100 -80 -60 -40 -20 0 + 研究治療正在進行中。^間歇性給藥。upR+:未經證實的 PR,受試者正在進行沒有 PD。PR PD20 40 60 M ax im um C ha ng e (%) i n su m o f t t t t t l es io n di am et er s 100 80 C) azenosertib + Gemcitabine 200 200 200 200,+ 200,+ 200^,+ 200 200 ^ pd upr+ PR ucrBest 整體響應 PD upr+ PR ucrBest 整體響應 SD upr+ PR ucrBest 總體反應 ≤ 50≤ 150 至 > 50> 150H-Score* 005 61525CCNE1 未擴增 62116組織未進行擴增評估 • 抗細胞週期蛋白 E1 小鼠單克隆抗體 (Abcam cCNE1/2460) • H 分數 > 50 包括所有 CCNE1 擴增腫瘤 • 細胞週期蛋白 E1-IHC 陽性、H-該數據集中的分數 ≥ 50 為 94% CCNE1 擴增 0 名患者擴增 CCNE1 狀態未進行擴增評估 100 200 Cy cl in E 1 IH C H-Sc 或 e 300 • 抗細胞週期蛋白 E1 小鼠單克隆抗體 (Abcam cCNE1/2460) • H 分數 > 50 包括所有 CCNE1 擴增腫瘤 • 該數據集中 cyclin E1-IHC 陽性、H 分數 > 50 的患病率為 87% 關鍵資格:高級別漿液性卵巢癌;ECOG 表現狀態 0-1;≥1L 先驗鉑類化療;鉑敏感型(無鉑間隔 ≥ 6 個月);先行貝伐珠單抗和 parPi 如果符合條件且符合地區護理標準;Cyclin E1+(CCNE1 擴增和/或 Cyclin E1 IHC 陽性)醫師精選卡博鉑-雙重**(6 個週期)通過 BICR 終止初級無進展存活率 • 先前的治療線路(1 v 2-3)• 先前 parPi(是 v 否)• CCNE1 擴增(是 v 否)Azenosertib + y*(6 個週期)Azenosertib*** 維護密鑰次要總體生存 R 2:1