附錄 99.1

UniQure公佈2023年第一季度財務 業績
並重點介紹公司最近的進展
~ 美國亨廷頓舞蹈病I/II期試驗 的臨牀更新預計將於2023年第二季度公佈 ~
~ 在啟動兩項針對難治性顳葉癲癇的 AMT-260 和 SOD1-ALS 中的 AMT-162 的 新的 I/II 期臨牀研究方面繼續取得進展 ~
馬薩諸塞州列剋星敦和荷蘭阿姆斯特丹, 2023 年 5 月 9 日 — 為有嚴重醫療需求的 患者推進變革性療法的領先基因療法公司 Uniqure N.V.(納斯達克股票代碼:QURE)今天公佈了其 2023 年第一季度的財務業績,並重點介紹了其業務的最新進展 。
uniQure首席執行官馬特·卡普斯塔表示:“隨着我們在所有企業目標方面取得進展,從歷史性的 2022年到2023年第一季度,UniQure繼續保持其勢頭。”“我們在2023年的優先事項包括供應CSL推出的HEMGENIX®, 推進 AMT-130 在亨廷頓舞蹈病中的發展,為啟動兩項關於 SOD1-ALS 和難治性顳葉癲癇的新臨牀研究做準備。我們期待在 2023 年第二季度晚些時候提供我們正在進行的 AMT-130 美國 I/II 期研究的臨牀最新情況,這是亨廷頓舞蹈病臨牀開發中的第一個 AAV 基因療法。 本次更新將有助於進一步指導我們 AMT-130 的臨牀開發,因為我們正在努力為這種毀滅性神經退行性疾病的患者提供一種改善疾病的治療方法 選項。”
最近更新
| ● | HEMGENIX 商業上線® (etranacogene dezaparvovec-drbl)用於治療美國和歐盟的乙型血友病 |
| ● | 2023 年 2 月,歐盟委員會 批准了 HEMGENIX 的有條件上市許可®,這是第一種也是唯一一種用於治療 18 歲及以上患有重度和中度重度血友病 B 的成人 的一次性基因療法。這是在 HEMGENIX 於 2022 年 11 月獲得美國上市批准 之後發佈的®在患有B型血友病的成年人中 |
| ● | CSL Behring 向 HEMGENIX 授予了全球獨家版權 ®2021 年 5 月來自 UniQure,並全權負責其商業化。繼 HEMGENIX 首次商業銷售 之後®在美國,UniQure有權從CSL Behring獲得1億美元的付款。 如果在2023年7月2日之前在五個主要的 歐洲國家之一首次銷售產品,公司還有資格從CSL Behring獲得7500萬美元的付款。 |
| ● | 推進 AMT-130 用於治療亨廷頓氏病 |
| ● | 該公司計劃在2023年第二季度 公佈來自其26名患者、隨機、對照和雙盲的美國I/II期臨牀研究的一到兩年 的隨訪數據。 預計數據更新將包括高劑量和低劑量隊列的安全性和耐受性、生物標誌物、成像和功能 數據。 |
| ● | 高劑量隊列 中的六名對照患者中有三名現已交叉接受治療。這三名患者中有兩人接受了更高劑量的 AMT-130。如果高劑量 隊列中的對照患者在解盲後符合研究的資格標準,則可以選擇交叉治療。該公司預計 將在2023年第二季度末之前完成任何額外的交叉程序。 |
| ● | 所有六名患者均已加入低劑量 隊列的 AMT-130 開放標籤 I/II 期臨牀試驗。該公司繼續招收九名患者中的第二個高劑量隊列 。高劑量隊列的患者註冊預計將於2023年中期完成,預計將在2023年下半年來自低劑量隊列 的為期一年的臨牀數據。 |
| ● | 第三組患者 is 預計將於2023年下半年開始在美國註冊,以探索旨在提高手術效率的某些手術適應措施的可行性。 |
| ● | 擴大 在研新藥 (IND) 應用渠道並取得進展 |
| ● | 美國基因與細胞療法學會 (ASGCT) 2023— 該公司將在2023年5月16日至20日在加利福尼亞州洛杉磯舉行的ASGCT年度會議上大放異彩。 十二份摘要已獲準發表,包括兩份口頭報告,這些摘要將重點介紹公司在擴大 研究渠道方面的創新以及在 AAV 基因療法制造方面的進展。 |
| ● | AMT-162 用於治療 SOD1 肌萎縮性 側索硬化症 (ALS)-2023 年 1 月,公司與 Apic Bio 簽訂了 ABP-102(現為 AMT-162)的全球許可協議,用於治療超氧化物歧化酶 1 (SOD1) 肌萎縮性側索硬化症 (ALS),這是一種罕見的 ALS 遺傳形式。該公司 預計將在2023年下半年啟動 AMT-162 的 I/II 期臨牀研究。 |
| ● | AMT-260 用於治療難治性顳葉 葉癲癇 (rtLE)— 在 2022 年第三季度,該公司啟動了一項針對非人類靈長類動物體內的 AMT-260 的 GLP 毒理學研究。 該公司預計將於 2023 年下半年提交在研新藥 (IND) 申請並啟動 AMT-260 的 I/II 期臨牀研究。 |
| ● | AMT-191 用於治療 Fabry 病 — 2022 年第三季度,該公司啟動了一項針對非人類靈長類動物體內的 AMT-191 的 GLP 毒理學研究,預計 將支持 2023 年提交的臨牀試驗報告。 |
| ● | 強勁的現金狀況可推進公司的 計劃 |
| ● | 截至2023年3月31日, 公司的現金和現金等價物以及投資證券為3.153億美元。該公司預計,假設美國 美國實現了1億美元的首次商業銷售里程碑,則現金和現金等價物以及投資 證券將為運營提供資金;如果HEMGENIX實現7,500萬美元的首次商業銷售里程碑,則將進入2025年上半年® 五個合同規定的歐洲國家中的任何一個都是在2023年7月2日之前實現的。 |
財務要聞
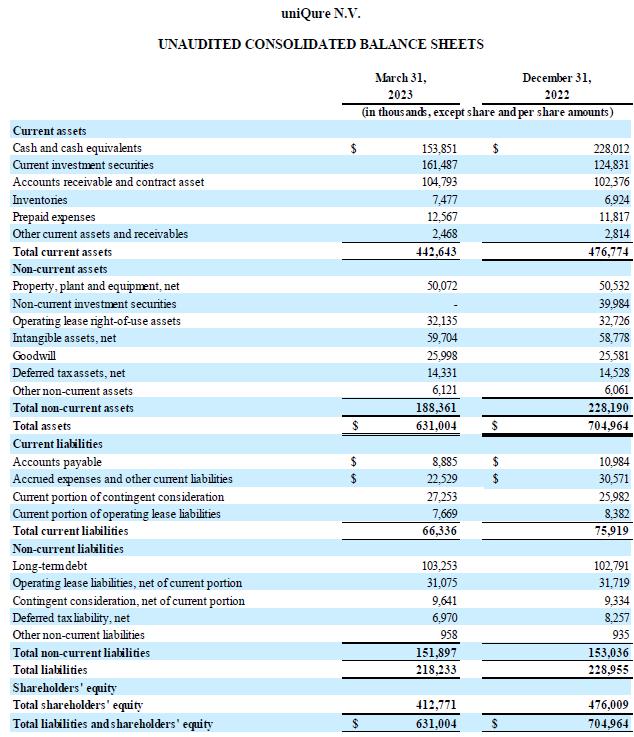
現金狀況:截至2023年3月31日, 公司持有的現金及現金等價物和投資證券為3.153億美元,而截至2022年12月31日為3.928億美元。
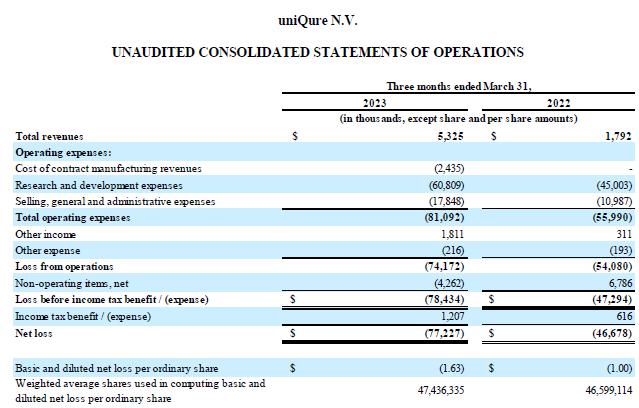
收入:截至2023年3月31日的三個月 的收入為530萬美元,而2022年同期為180萬美元。增長的主要原因是 本期確認的與合同製造相關的合同製造收入為490萬美元 HEMGENIX® CSL Behring的合作收入減少了140萬美元,部分抵消了這一點。
研發費用:截至2023年3月31日的三個月,研發費用 為6,080萬美元,而2022年同期為4500萬美元。 的增長主要與向Apic Bio支付的1,000萬美元款項有關,用於收購 ABP-102(現為 AMT-162),顳葉癲癇計劃(AMT-260)的臨牀前開發 ,支持 公司增長的人事和承包商相關開支的增加,以及EMA批准 HEMGENIX 後應向許可方支付的合同款項®.
銷售和收購費用:截至2023年3月31日的三個月,銷售、一般和 管理費用為1,780萬美元,而2022年同期 為1,100萬美元。增長主要與支持公司增長的人事和承包商相關費用增加有關 ,以及本期產生的專業費用的增加,這主要是由與 Apic Bio交易相關的專業費用增加所推動的。
其他非營業項目,淨額:
截至2023年3月31日的三個月,其他非營業項目淨支出為430萬美元,而2022年同期的淨收入為680萬美元。其他非營業項目淨額減少 主要與確認的外幣虧損有關,本期淨額為240萬美元 ,而確認的外匯收益為前一時期淨額860萬美元。
淨虧損:
截至2023年3月31日的三個月中, 的淨虧損為7,720萬美元,合每股普通股基本和攤薄虧損1.63美元,而 2022 年同期的淨虧損為4,670萬美元,相當於每股普通股基本和攤薄虧損1.00美元。
關於 HEMGENIX®
HEMGENIX® 是一種基因療法, 使人體能夠持續產生因子 IX,即 B 型血友病 缺陷蛋白,從而降低符合條件的 B 型血友病患者的異常出血率。它使用 AAV5,一種非傳染性病毒載體,稱為腺相關病毒 (AAV)。AAV5 載體 將因子 IX(fix-padua)的 Padua 基因變異攜帶到肝臟中的靶細胞,生成 IX 因子蛋白,其活性比正常細胞高 5x-8x 。這些遺傳指令保留在靶細胞中,但通常不會成為一個人 自身DNA的一部分。一旦發出,新的遺傳指令將允許細胞機制產生穩定水平的因子IX。
HEMGENIX® 是 CSL Behring 的註冊商標 。
關於 Uniqure
UniQure正在兑現基因 療法的承諾——具有潛在治癒效果的單一療法。我們的乙型血友病基因療法最近獲得批准——這是一項基於十多年的研究和臨牀開發的歷史性成就——代表着 基因組醫學領域的一個重要里程碑,為血友病患者開闢了一種新的治療方法。我們現在正在利用我們的模塊化 和經過驗證的技術平臺來推進一系列專有基因療法,用於治療亨廷頓氏病 病、難治性顳葉癲癇、ALS、Fabry 病和其他嚴重疾病的患者。www.uniqure.com
UniQure 前瞻性陳述
本新聞稿包含前瞻性 聲明。除歷史事實陳述以外的所有陳述都是前瞻性陳述,通常由術語 表示,例如 “預期”、“相信”、“可以”、“建立”、“估計”、“期望”、“目標”、“打算”、“展望”、“可能”、“預測”、“項目”、“尋求”、“應該”,“將”、“將” 和類似的表達方式。前瞻性 陳述基於管理層的信念和假設,以及管理層僅在本新聞稿 發佈之日可用的信息。這些前瞻性陳述包括但不限於 HEMGENIX 的商業化 是否會持續取得進展®,關於我們針對亨廷頓氏病 病的 AMT-130 臨牀試驗中的第三組患者是否將於 2023 年下半年開始在美國入組、公司是否會在 2023 年第二季度公佈美國 AMT-130 I/II 期臨牀研究的一到兩年的隨訪 數據、這些數據是否有助於進一步指導我們 正在進行的 AMT-130 臨牀開發、臨牀數據是否來自低收入國家的聲明 AMT-130 的劑量隊列預計將於 2023 年下半年公佈,該公司是否會在 2023 年提交法布里病的研究性新藥申請,公司 是否會在 2023 年下半年啟動用於治療 ALS 的 AMT-162 的 I/II 期臨牀研究,以及公司是否會在 2023 年下半年 提交研究性新藥申請或啟動 rtLE 的 AMT-260 的 I/II 期臨牀研究。 公司的實際業績可能與這些前瞻性陳述中的預期存在重大差異,原因有很多, 包括但不限於與監管部門批准和HEMGENIX商業啟動相關的風險®,我們的亨廷頓舞蹈病臨牀 試驗,金融和地緣政治事件對我們公司以及整個經濟和健康 護理系統的影響,我們與CSL Behring的商業化和許可協議,我們的臨牀開發活動,臨牀結果,合作 安排,監管監督,產品商業化和知識產權索賠,以及公司 “風險因素” 標題下描述的風險、不確定性和 其他因素的定期證券申報,包括其年度 報告在2023年2月27日提交的10-K表格和2023年5月9日提交的10-Q表季度報告上。鑑於這些風險、 的不確定性和其他因素,您不應過分依賴這些前瞻性陳述,即使將來有新的信息,公司也沒有義務 更新這些前瞻性陳述。
| Uniqure 聯繫人: | ||
| 對於投資者: | 對於媒體: | |
| 瑪麗亞·E·坎託 | 基婭拉·魯索 | 湯姆·馬龍 |
| 直接:339-970-7536 | 直播:617-306-9137 | 直播:339-970-7558 |
| 手機:617-680-9452 | 手機:617-306-9137 | 手機:339-223-8541 |
| m.cantor@uniQure.com | c.russo@uniQure.com | t.malone@uniQure.com |