目錄表
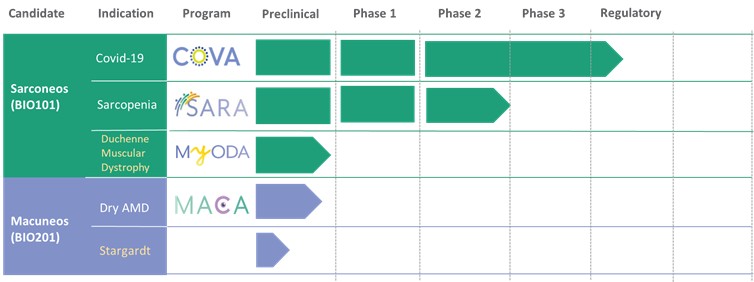
我們的臨牀渠道
我們正在開發一系列計劃,目標是生物彈性途徑,以減緩與衰老相關的退化過程,並改善與年齡相關疾病患者的功能結果。我們目前正在開發的候選藥物如下所示。
我們的戰略
我們專注於開發治療方法,以改善患有年齡相關疾病的患者的功能結局,包括新冠肺炎患者的嚴重呼吸衰竭。我們的目標是將BiPhytis打造成一家領先的生物技術公司,專注於以生物彈性途徑為目標,減緩與年齡相關的疾病進展相關的退化過程,以改善數百萬治療選擇有限或沒有治療選擇的患者的生活。我們目前計劃開發我們的候選藥物,然後通過監管批准和商業化為進一步的臨牀開發尋求許可和/或合作機會。為了實現我們的目標,我們正在實施以下戰略:
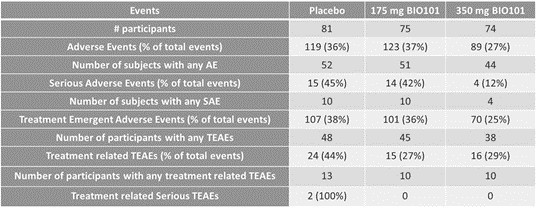
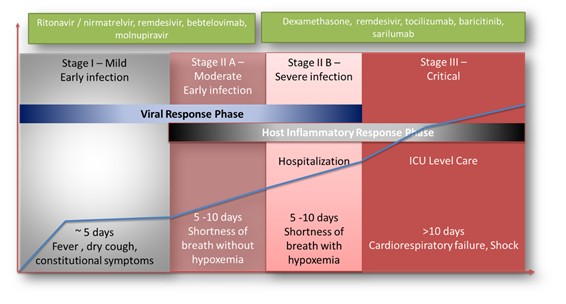
| ● | 在法國、巴西和其他選定國家獲得EAP,以及針對有呼吸衰竭風險的新冠肺炎患者獲得歐盟(US)和Sarconeos有條件批准(EU)(BIO101)。我們於2022年4月在住院的新冠肺炎嚴重呼吸道症狀患者中完成了CoVA 2/3期研究的招募,並於2023年2月報告了最終分析。這項研究達到了其預先定義的主要終點,表明Sarconeos(BIO101)和安慰劑在第28天出現呼吸衰竭或過早死亡的患者比例在統計學上存在顯著差異,代表着風險相對降低44%(p=0.043,Cochran-Mantel-Haenszel檢驗)。基於這些結果,我們於2023年3月在法國啟動了EAP審查程序。我們還計劃在巴西和其他選定的國家申請EAP,以及在美國申請EUA,並在歐盟有條件地批准。 |
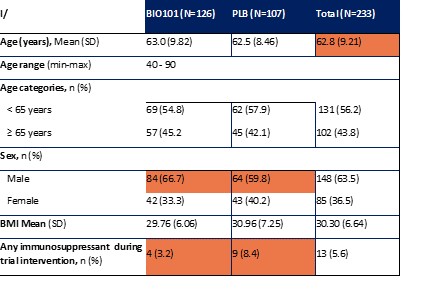
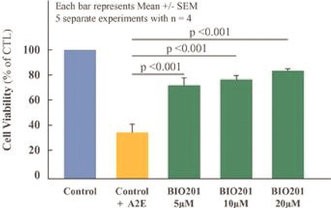
| ● | 展示Sarconeos(BIO101)對石棺減少症的療效。我們的資源和業務努力主要集中在推動Sarconeos(BIO101)的臨牀開發,從治療神經肌肉疾病入手,最初的重點是石棺減少症。我們的Sara-INT 2b期臨牀試驗的背線數據於2021年10月公佈。由於大流行對患者羣體的影響,只有45%的研究對象能夠完成具有治療結束療效評估的研究,研究沒有足夠的能力來觀察假設的效果大小,並且沒有滿足主要和次要終點。在整個2022年,我們與歐洲(EMA)和美國(FDA)的監管機構進行了廣泛的互動,以確定該適應症的3期臨牀試驗的設計,同時與潛在的合作伙伴進行討論,作為這一開發過程的一部分。 |
| ● | 啟動DMD中Sarconeos(BIO101)的臨牀開發。我們的努力還集中在利用我們的知識和Sarconeos(BIO101)在石棺減少症和新冠肺炎中的開發,以開始和推進Sarconeos(BIO101)的臨牀開發,用於治療具有呼吸惡化跡象的非動態DMD患者,獨立於基因突變和跨病譜。我們已經收到了來自美國FDA的IND“可以繼續”的信件和比利時FAMHP的CTA批准。在fda的“可能會繼續”的信中,fda指出,它對這項研究的設計有很大的擔憂,而且這項研究的結果,最初的設計是為了招募門診和非門診患者,並通過 |
56