

2023 年 3 月的炎症和癌症治療變革企業演示文稿附錄 99.2

本演示文稿中非歷史事實陳述的法律免責聲明是前瞻性陳述。此類前瞻性陳述包括但不限於有關RAPT Therapeutics, Inc.(“公司”、“我們” 或 “我們”)的研究和臨牀開發計劃、當前和未來的候選藥物、業務戰略和計劃、監管途徑以及我們完成某些里程碑的能力的陳述。諸如 “相信”、“預期”、“計劃”、“期望”、“將”、“可能”、“即將到來”、“里程碑”、“潛力”、“目標” 之類的詞語或這些術語或類似表達方式的否定詞旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都一定包含這些識別詞。這些前瞻性陳述基於公司管理層目前對未來事件和趨勢的信念,受已知和未知的風險和不確定性的影響,包括我們向美國證券交易委員會提交的最新10-K表格的 “風險因素” 部分所述的風險因素以及隨後提交的任何當前和定期報告,這些報告可能導致我們的實際業績或成就與前瞻性陳述所表達或暗示的任何未來表現或成就存在重大差異這個演示文稿。這些前瞻性陳述不應被視為預測或承諾,也不應將其視為暗示、保證或保證此類前瞻性陳述所依據的任何假設是正確或詳盡的,或者就此類假設而言,應在演示文稿中得到充分陳述。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本演示文稿發表之日。儘管我們認為前瞻性陳述中反映的信念和假設是合理的,但我們無法保證未來的表現或成就。除非法律要求,否則在本演示文稿發佈之日之後,我們沒有義務以任何原因公開更新任何前瞻性陳述。本演示文稿討論了正在進行臨牀研究且尚未獲得美國食品藥品監督管理局批准上市的候選藥物。對於正在研究此類候選藥物的任何用途,任何候選藥物的安全性或有效性均未作任何陳述。

DISCOVERY 靶向疾病 RPT193(炎症)關鍵免疫驅動因素的口服藥物:靶向 AD 中炎症 Th2 細胞 1b 期的口服藥物:所有關鍵探索終點的療效 AD 第 2b 階段正在進行中,數據預計於 2024 年中期在哮喘 2023 年第一季度啟動 2a 階段 FLX475(腫瘤學):在第 2 階段選擇性靶向免疫抑制性腫瘤 Treg PoC,單體和活性組合 2 期數據預計更新 2023 年 2H HPK1(腫瘤學)其他炎症和腫瘤學靶點臨牀專有發現引擎多元化渠道大型市場機會臨牀降低風險資產戰略合作
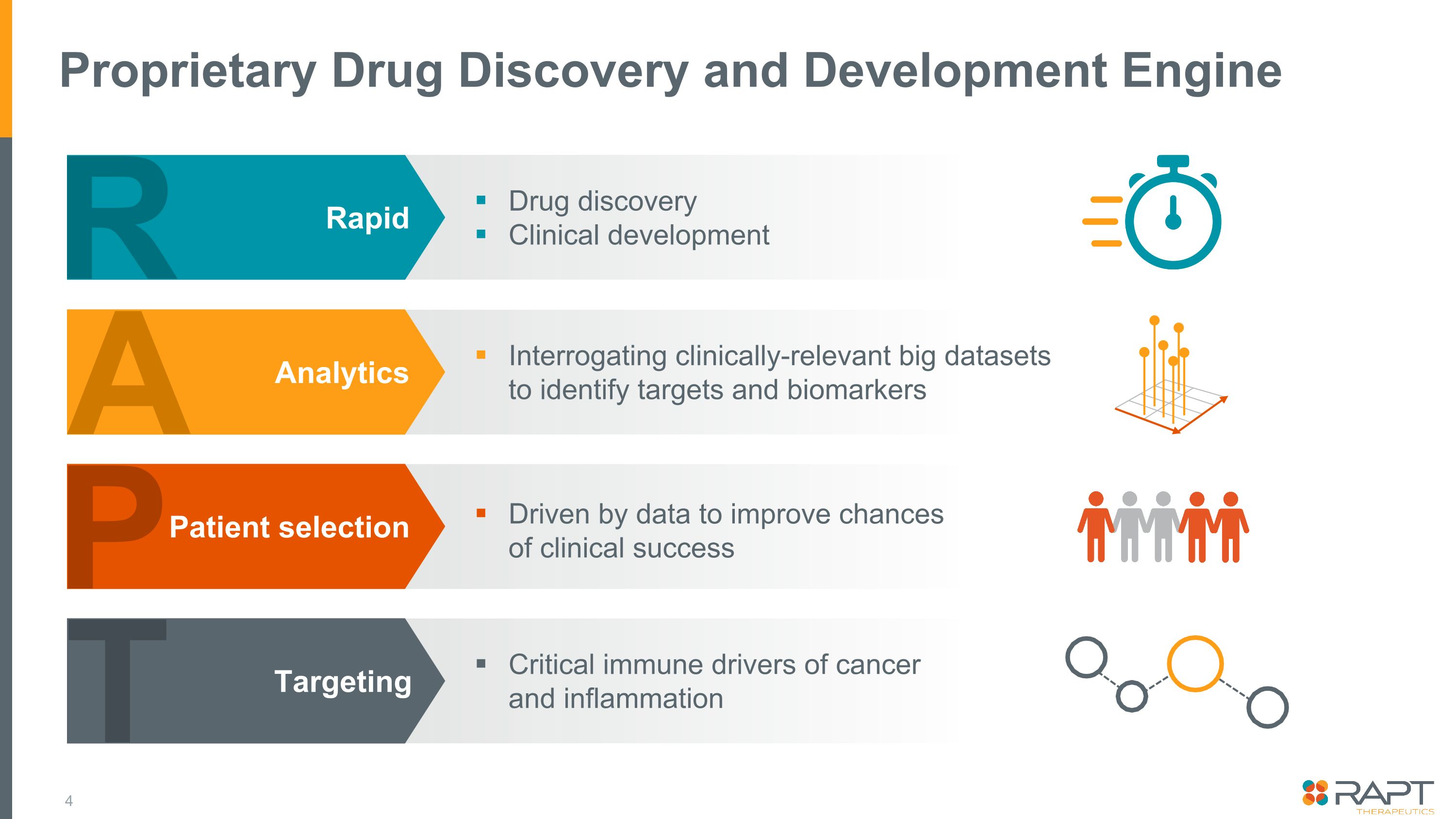
專有藥物發現和開發引擎 R 藥物發現臨牀開發快速查詢與臨牀相關的大數據集以確定靶點和生物標誌物由數據驅動以提高臨牀成功機率癌症和炎症的關鍵免疫驅動因素 A Analytics P 患者選擇 T 靶向
RPT193:用於炎症性疾病的 CCR4 拮抗劑
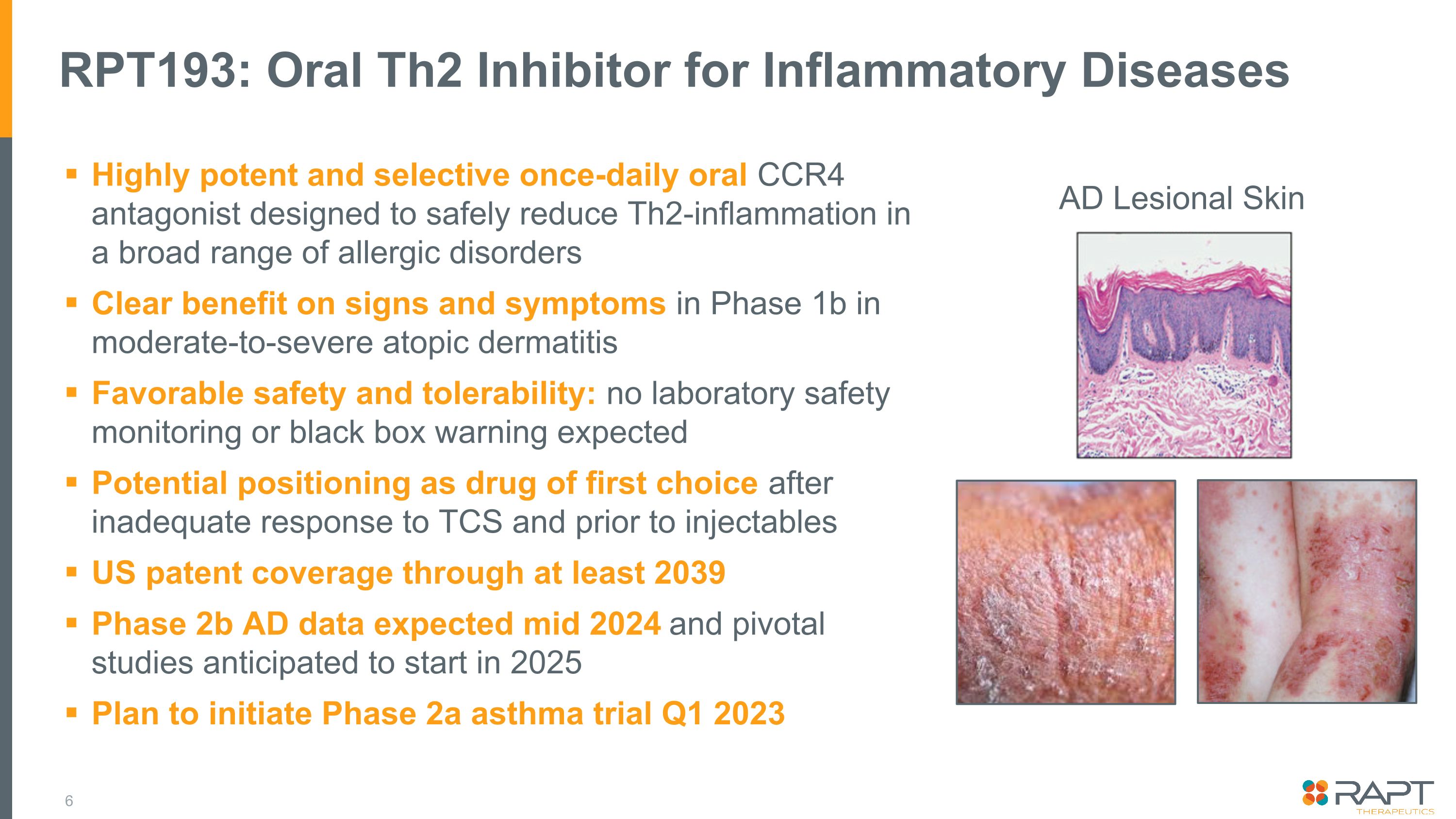
RPT193:治療炎症性疾病的口服 TH2 抑制劑高效、選擇性每天一次的口服 CCR4 拮抗劑,旨在安全地減少各種過敏性疾病的 TH2 炎症。對中度至重度特應性皮炎 1b 階段的體徵和症狀有明顯的益處有利安全性和耐受性:預計無需實驗室安全監測或黑匣子警告。在對三氯甲烷反應不足和注射劑之前,可能被定位為首選藥物至少 2039 年 2b 階段 AD 數據預計在 2024 年中期以及關鍵研究預計於 2025 年開始計劃啟動 2023 年第一季度的 2a 期哮喘試驗 AD 病變皮膚
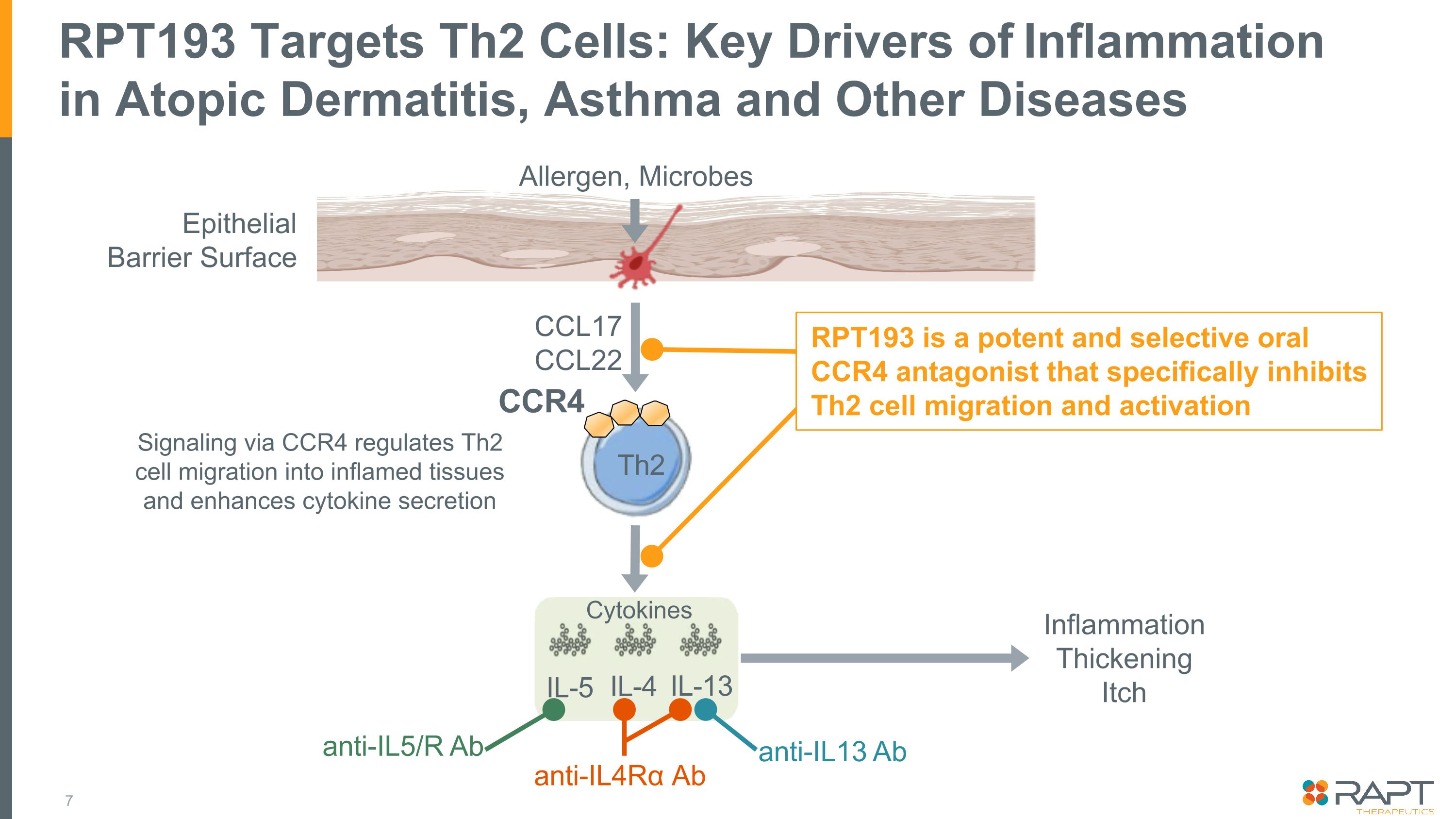
RPT193 靶向 Th2 細胞:過敏性皮炎、哮喘和其他疾病炎症的關鍵驅動因素上皮屏障表面 CCR4 Th2 IL-5 IL-4 IL-13 通過 CCR4 發炎增厚瘙癢信號傳導調節 Th2 細胞向發炎組織遷移並增強細胞因子分泌細胞因子過敏原,微生物 RPT193 是一種強效而選擇性的口服 CCR4 拮抗劑,可特異性抑制 Th2 細胞遷移和激活 CCL17 抗體 IL4Rα Ab Anti-IL5/R Ab Anti-il13 Ab CCL22
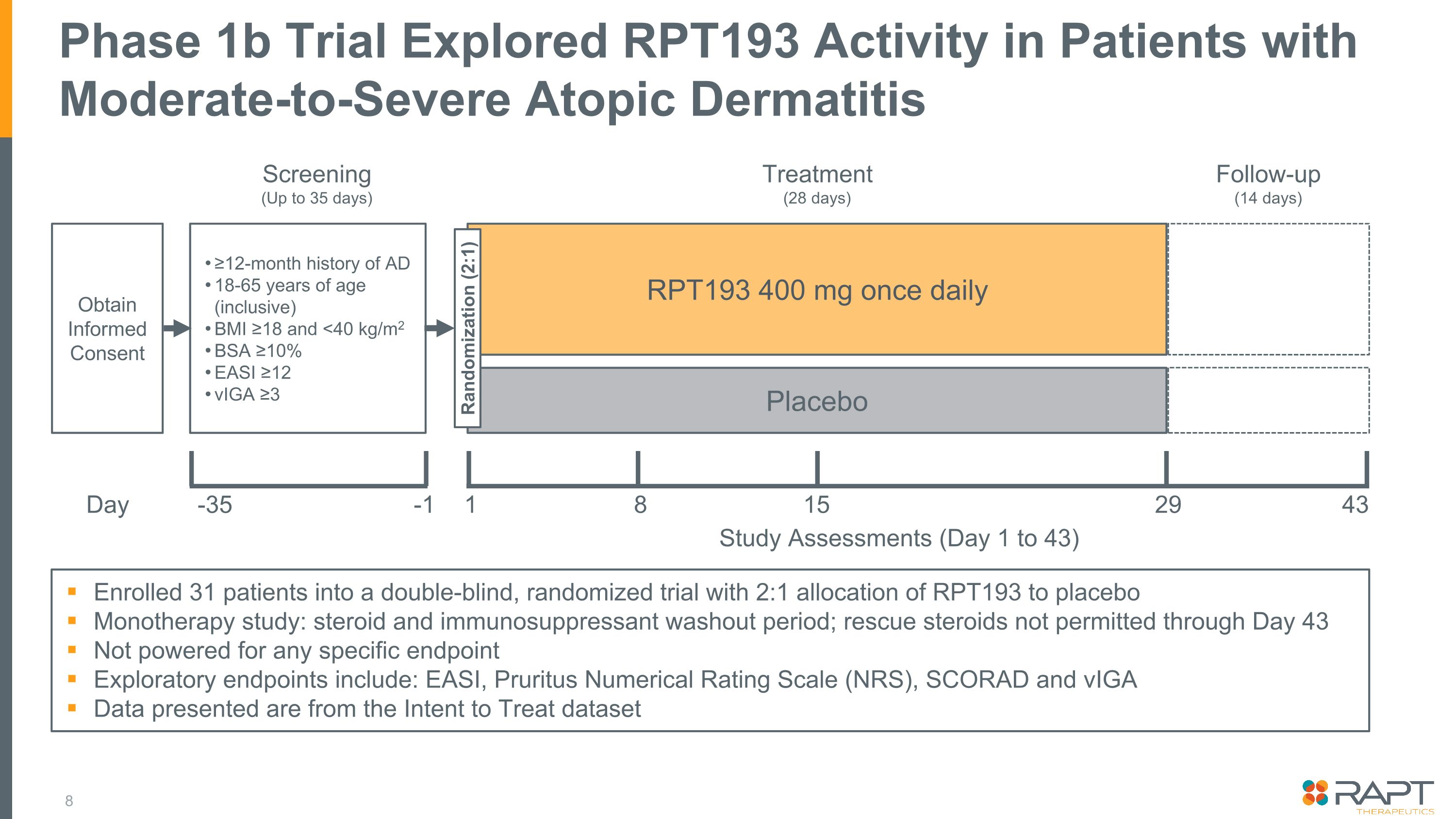
招收了 31 名患者參加了一項雙盲隨機試驗,將 RPT193 分配給 2:1 的安慰劑單一療法研究:類固醇和免疫抑制劑沖洗期;不允許在第 43 天之前使用救援類固醇不適用於任何特定終點探索性終點包括:EASI、Puritus 數值評級量表 (NRS)、SCORAD 和 VIGA 提供的數據來自意圖治療數據集 1b 期試驗探索了中度至重度患者的RPT193 活性特應性皮炎獲得知情同意 AD 病史 ≥ 12 個月 18-65 歲(含)BMI ≥18 和
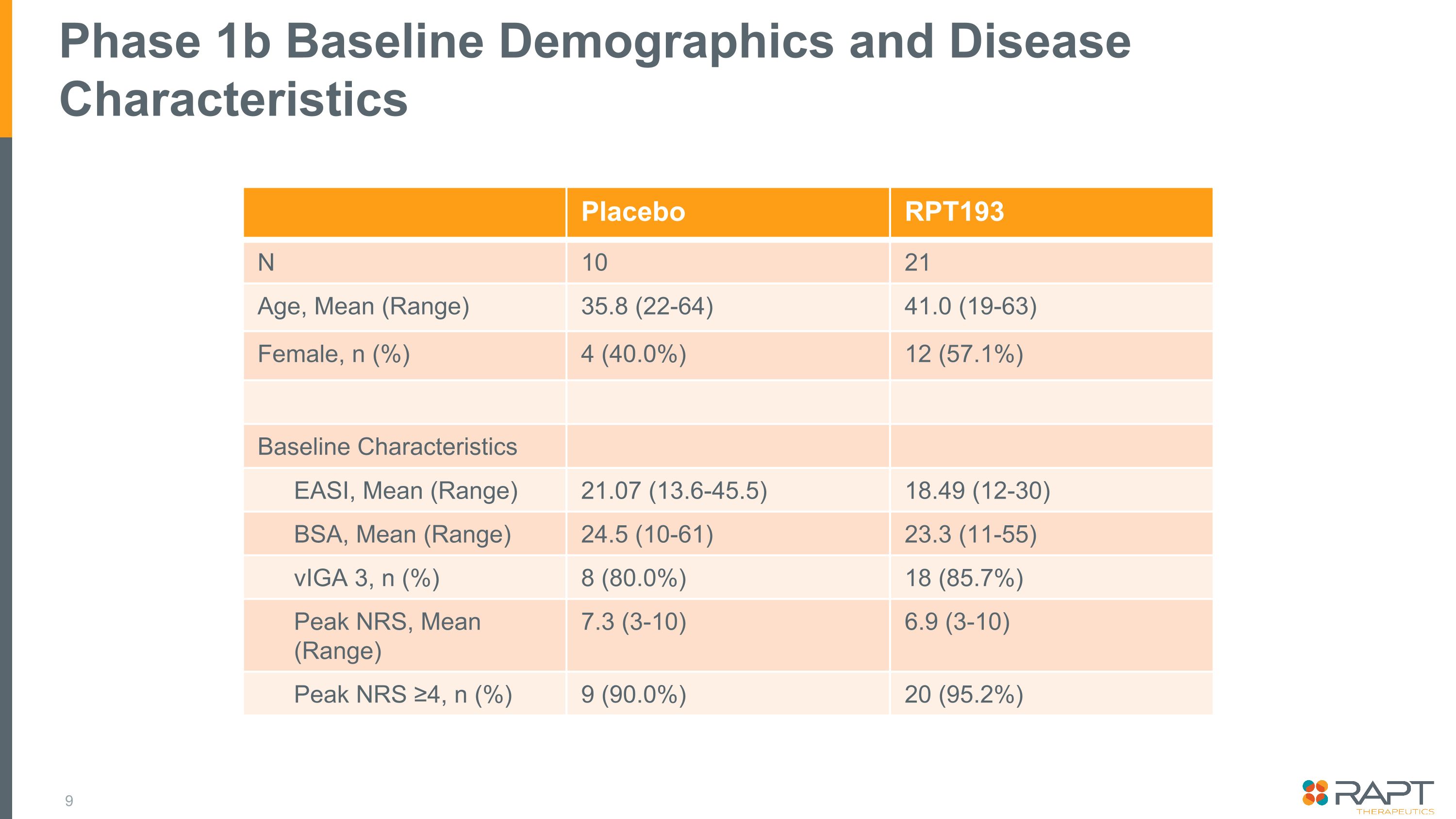
1b 期基線人口統計和疾病特徵安慰劑 RPT193 N 10 21 年齡,平均值(範圍)35.8 (22-64) 41.0 (19-63) 女性,n (%) 4 (40.0%) 12 (57.1%) 基線特徵 EASI,平均值(範圍)21.07 (13.6-45.5) 18.49 (12-30) BSA,平均值(範圍)24.5 (10-61) 23.3 (11-55) VigA 3,n (%) 8 (80.0%) 18 (85.7%) 峯值 NRS,平均值(範圍)7.3 (3-10) 6.9 (3-10) Peak NRS ≥4,n (%) 9 (90.0%) 20 (95.2%)
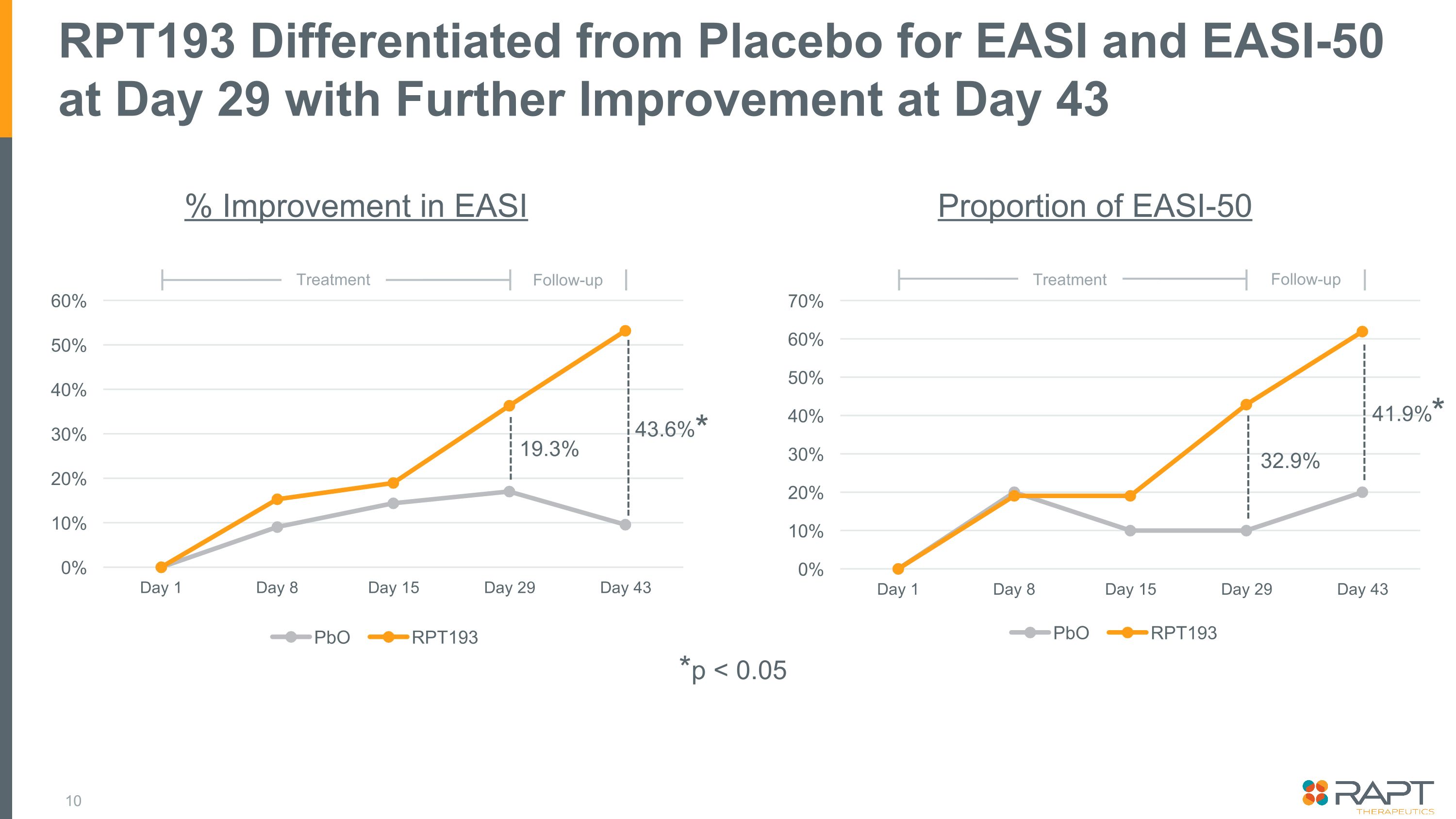
RPT193 在第 29 天與 EASI 和 EASI-50 的安慰劑有所區別,第 43 天的 EASI 比例進一步改善 EASI-50 19.3% 43.6% 32.9% 41.9% 後續治療後續治療 *p
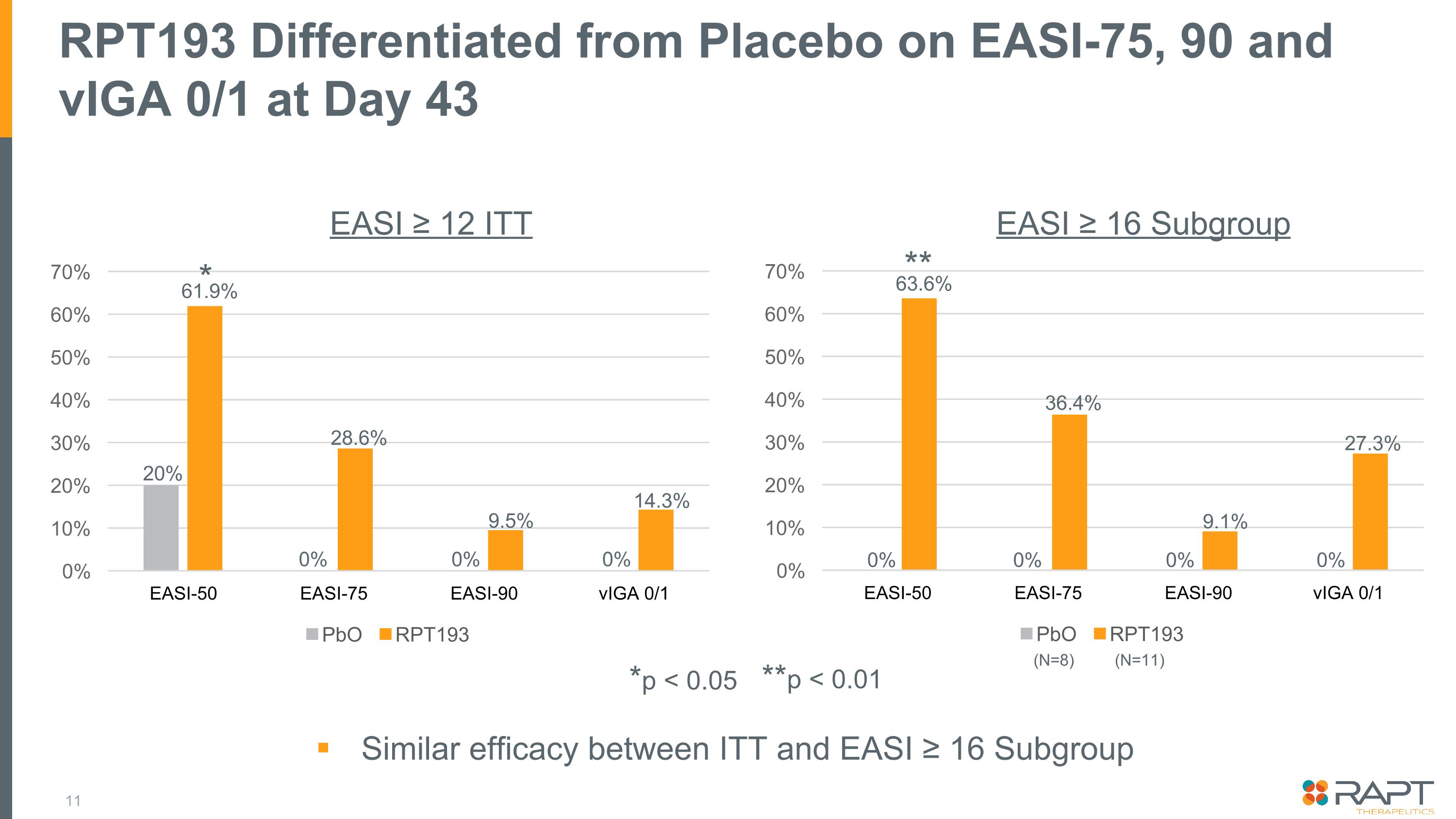
RPT193 在第 43 天與 EASI-75、90 和 viGA 0/1 的安慰劑有所區別 *p

RPT193 顯示皮膚中 AD 相關基因特徵顯著改善 MADAD:薈萃分析得出的特應性皮炎評分 *** (p
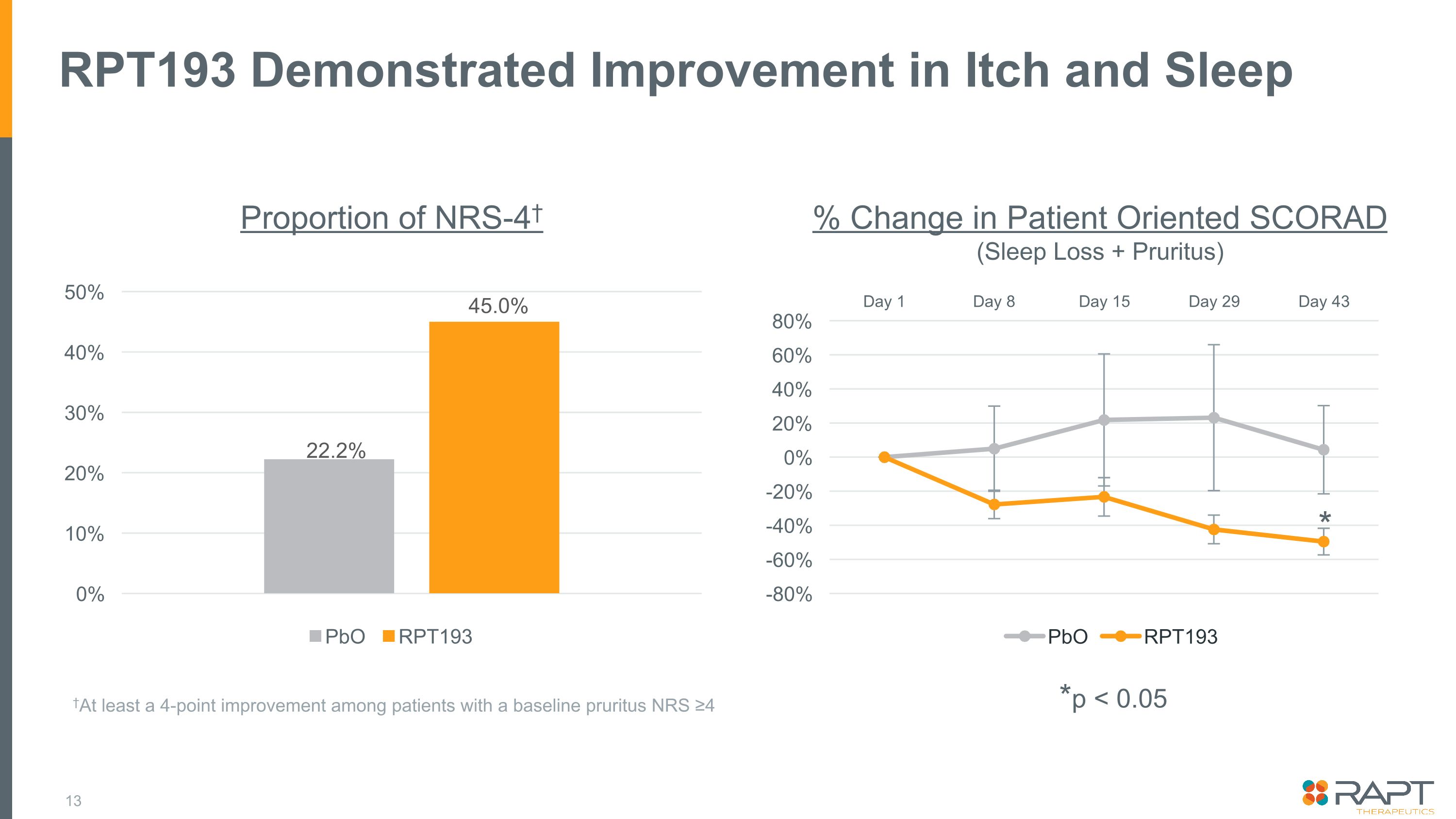
RPT193 顯示 NRS-4 的瘙癢和睡眠比例有所改善 22.2% 45.0% 基線瘙癢症患者至少改善 4 個百分點 NRS ≥4*% 以患者為導向的 SCORAD(睡眠減退 + 瘙癢)*p
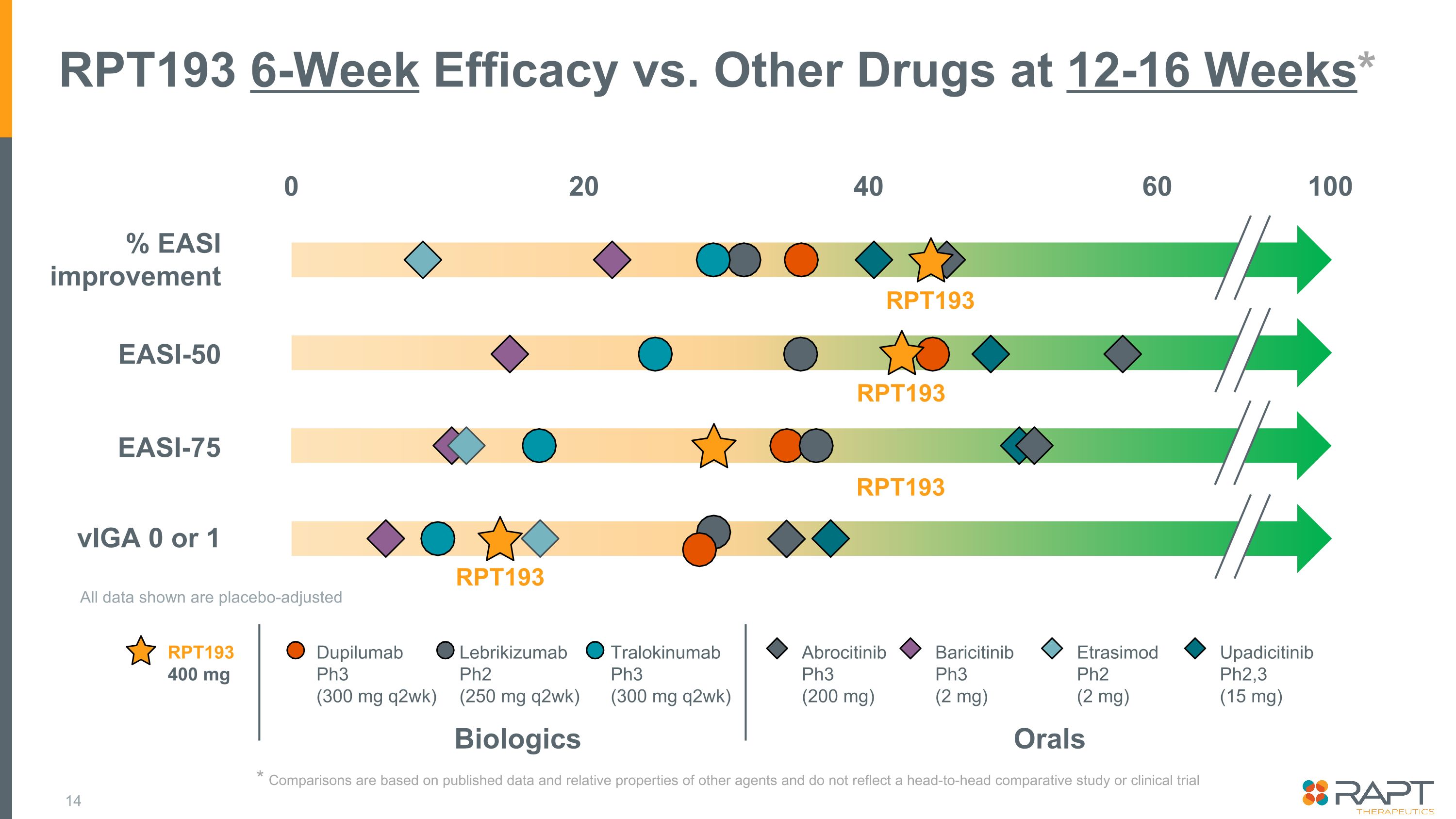
RPT193 對比 12-16 周的其他藥物 6 周療效* RPT193 RPT193 400 mg Biologics Orals dupilumab Ph3 (300 mg q2wk) lebrikizumab Ph2 (250 mg q2wk) tralokinumab Ph3 (200 mg) Baricitinib Ph3 (200 mg) Baricitinib Ph3 (2 mg) Etrasimod Ph2 (2 mg) Upadicitinib Ph2,3 (15 mg)% EASI 改進 EASI-50 viGA 0 或 1 100 RPT193 RPT193 0 40 20 60 顯示的所有數據均經過安慰劑調整 * 比較基於已公佈的數據和其他藥物的相對特性,並不反映正面對頭比較研究或臨牀試驗 EASI-75 RPT193

RPT193 Phase 1b Safety 未報告 SAE 報告的所有不良反應強度均為輕度或中度未觀察到具有臨牀意義的安全性實驗室異常總體安全概況表明口服藥物耐受性良好,無需實驗室安全監測

正在對中度至重度特應性皮炎患者進行劑量查找 2b 期單一療法試驗 169 獲得知情同意 ≥ 12 個月 AD 病史 18-75 歲 BMI ≥18 BSA ≥ 10% EASI ≥16 vigA ≥3 篩查(最多 5 周)第 -35 天 -1 RPT193 400 mg 每日一次 RPT193 200 mg 每日一次 RPT193 50 mg 安慰劑每日一次 (1:1:1:1) 治療 (16 周) 隨訪(最多 8 周)1 113 29 57 85 127 研究評估(第 1 天至 169 天)14 141 目標入組:268 名患者,每手臂約 67 名單一療法研究:消滅類固醇的標準方案/免疫抑制劑和限制性救援藥物主要終點:EASI 次要終點:EASI-50/75/90、ViGA、Pruritus NRS
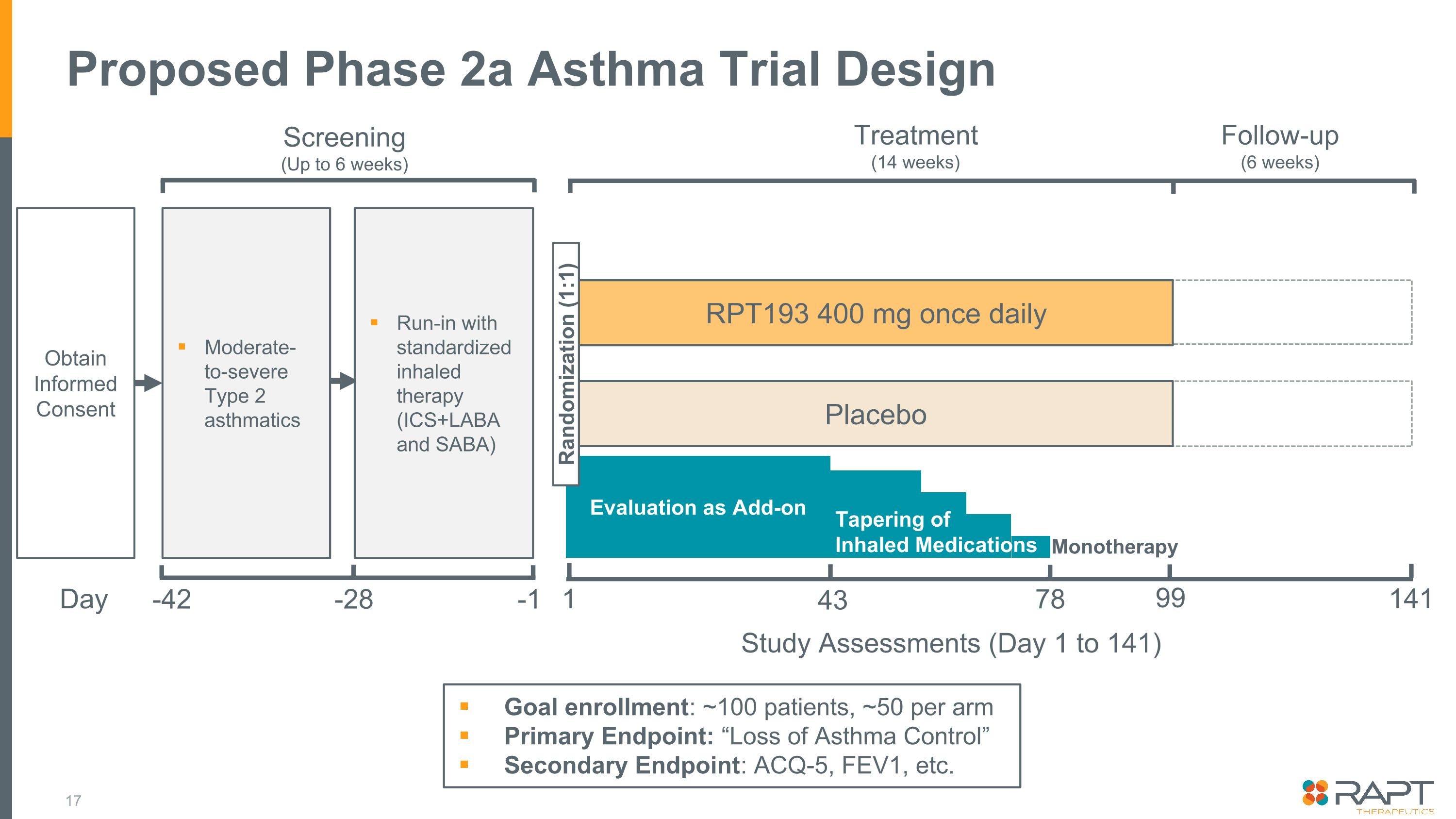
擬議的 2a 期哮喘試驗設計機密目標入組:約 100 名患者,每隻手臂大約 50 名主要終點:“哮喘失控” 次要終點:ACQ-5、FEV1 等。獲得知情同意中度至重度 2 型哮喘篩查(最多 6 周)第 -42 天 -1 RPT193 400 mg 每日一次安慰劑治療(14 周)隨訪(6 周)1 141 研究評估(第 1 天至 141 天)作為補充減少吸入量藥物單一療法 43 78 99 隨機分配 (1:1) 標準化吸入療法(ICS+LABA 和 SABA)-28
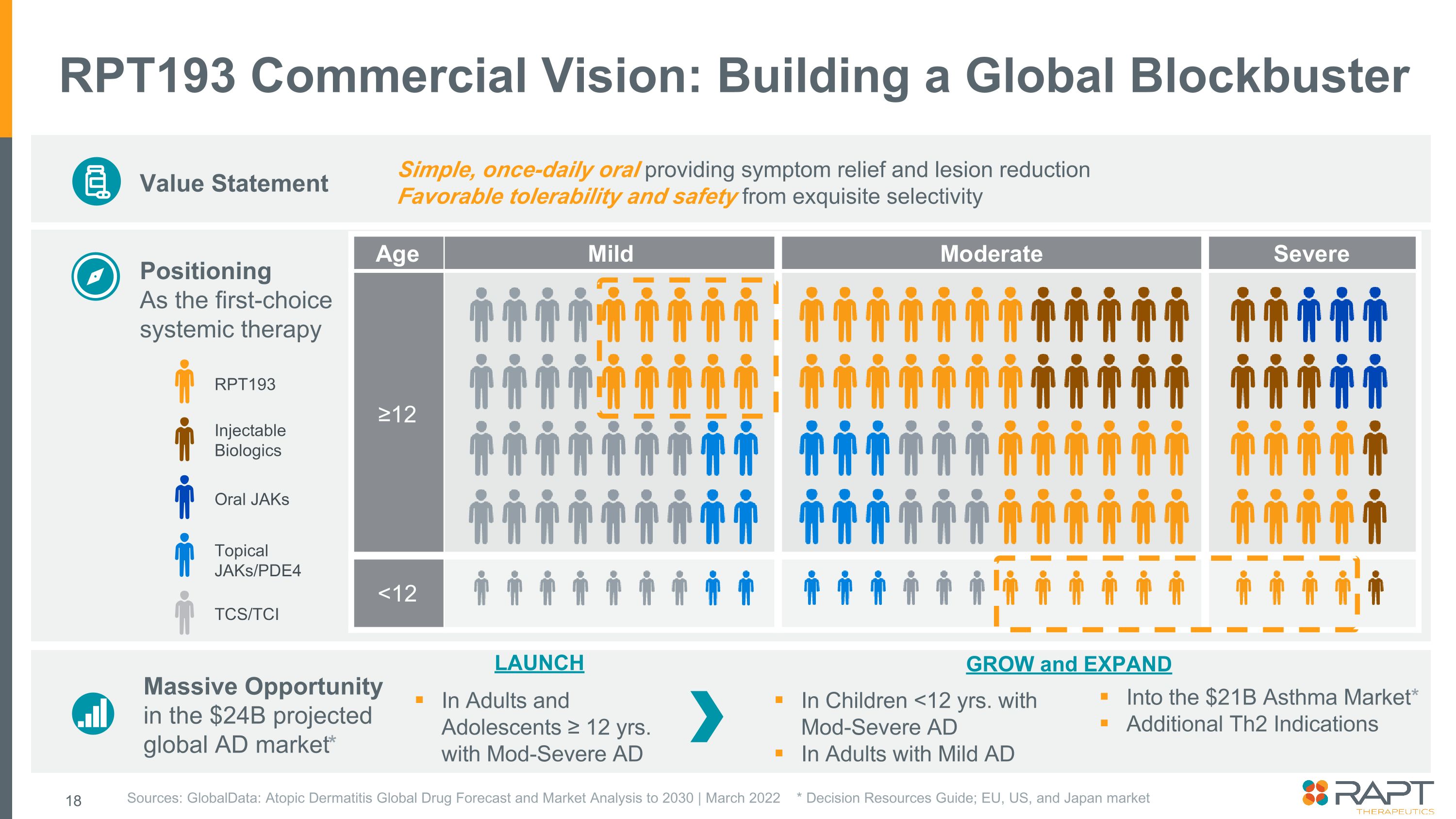
RPT193 商業願景:打造全球重磅價值陳述定位為首選全身療法來源:GlobalData:到2030年的特應性皮炎全球藥物預測和市場分析 | 2022 年 3 月 * 決策資源指南;歐盟、美國和日本市場簡單、每天一次的口服可緩解症狀和減少病變來自精緻選擇性帶來良好的耐受性和安全性 RPT193 可注射生物製劑口服 JAKS 局部外用 JAKs/PDE4 TCS/TCI 大量機會預計全球廣告市場為240億美元*成人和青少年 ≥ 12 歲。Mod-Severe AD 進入價值 210 億美元的哮喘市場* 其他 Th2 適應症 LAUNCH GROW AND EXPAND IN Children {b
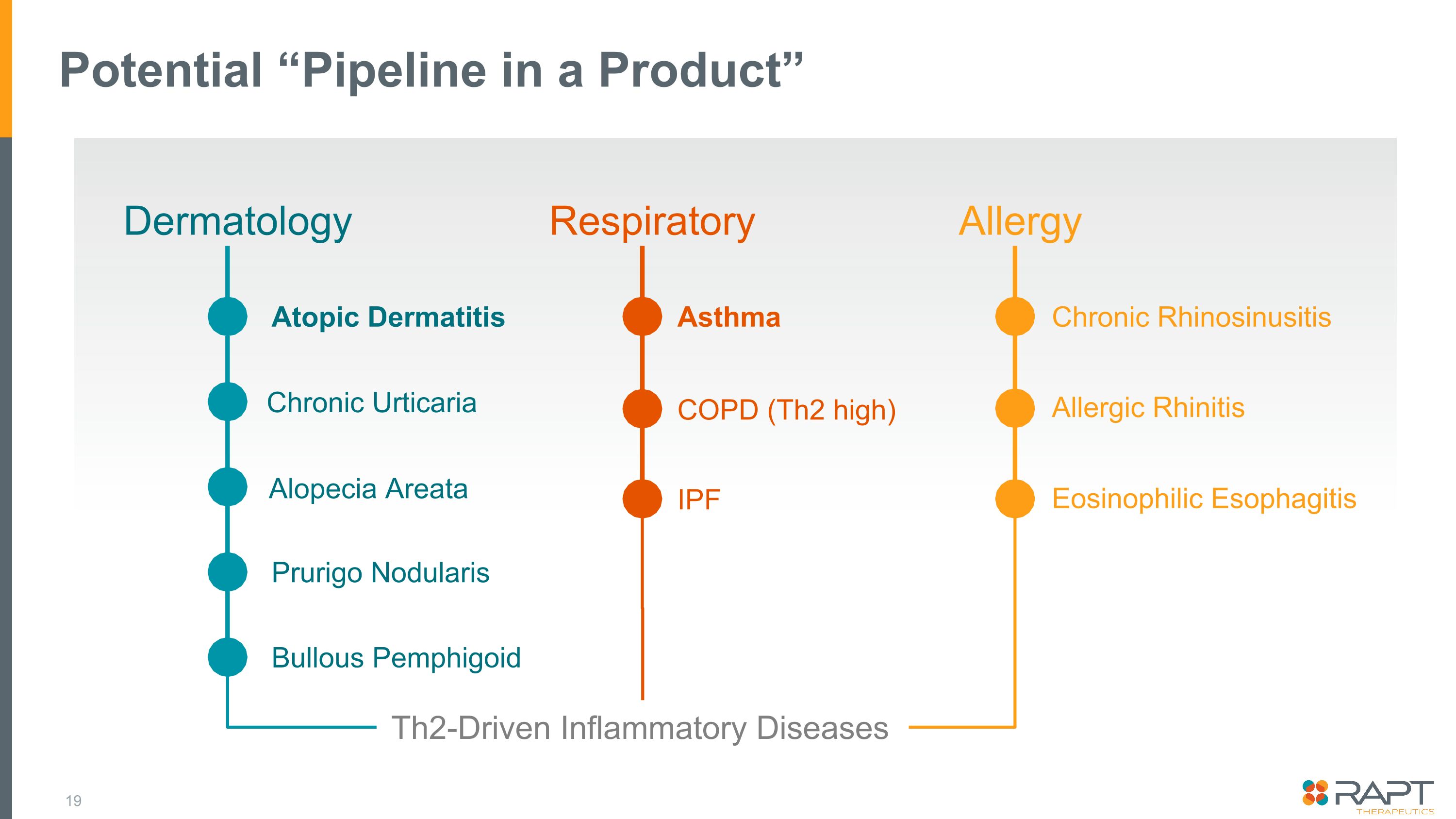
潛在的 “產品管道” 皮膚科呼吸道慢性鼻竇炎過敏嗜酸性食管炎瘙癢結節炎大皰性天皰瘡類脱髮哮喘 COPD(Th2 high)IPF 過敏性鼻炎 th2 驅動的炎症性疾病慢性蕁麻疹

RPT193 項目摘要口服選擇性 Th2 抑制劑對 AD 的體徵和症狀具有明顯的益處,耐受性良好,安全性良好。概況支持在注射劑和口服 JAK 之前佔據競爭地位 AD、哮喘和其他 Th2 適應症的巨大商業機會正在進行為期 16 周 AD 的 2b 期研究預計在 2024 年中期取得商業成功不需要生物學樣療效計劃在 2023 年第一季度啟動哮喘的 2a 期研究

FLX475:用於腫瘤學的 CCR4 拮抗劑
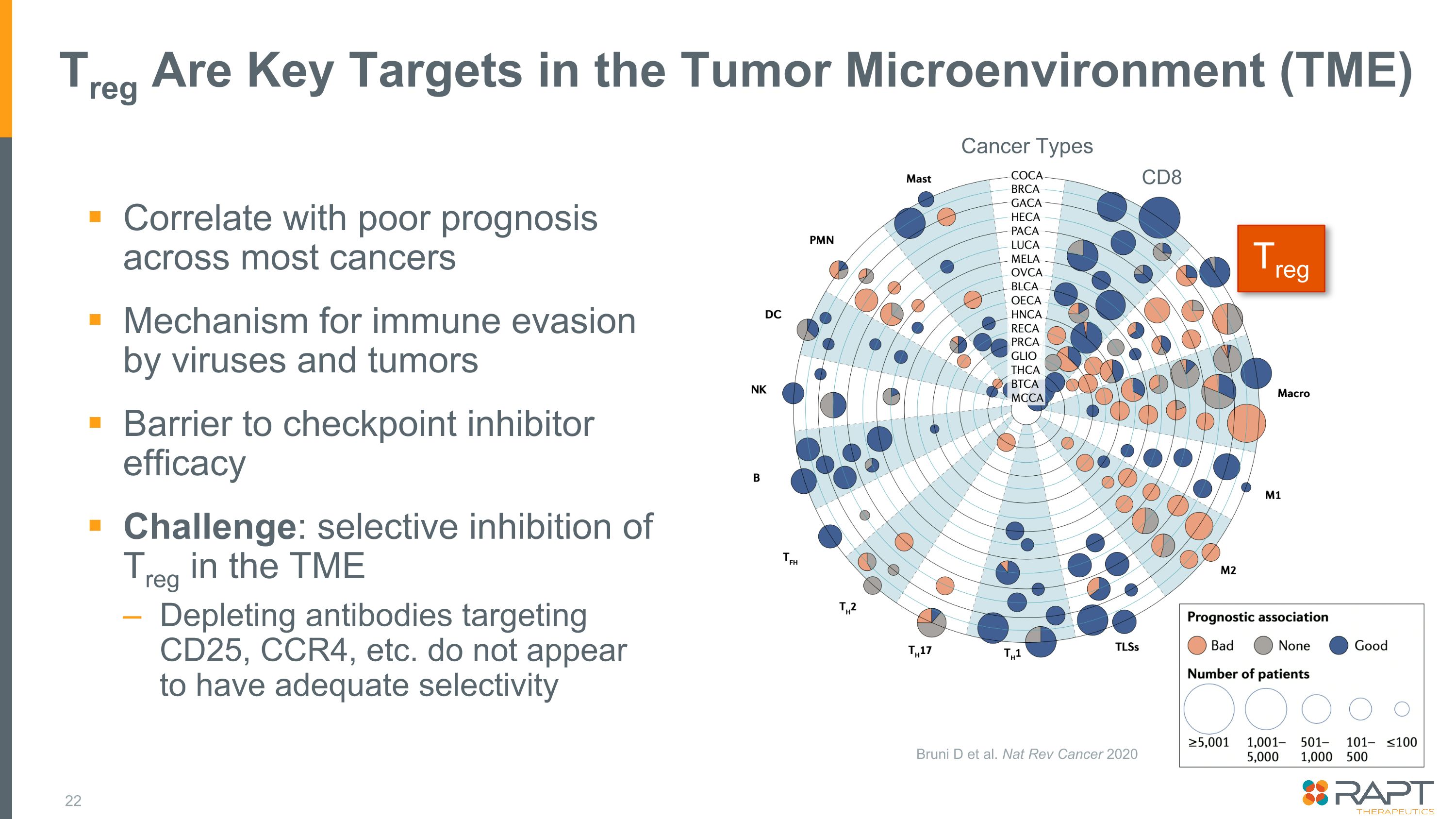
Treg 是腫瘤微環境 (TME) 中的關鍵靶標與大多數癌症的預後不佳相關聯病毒和腫瘤逃避免疫機制阻礙檢查點抑制劑功效挑戰:TME 中選擇性抑制 Treg 靶向 CD25、CCR4 等的消耗抗體似乎沒有足夠的選擇性 Treg CD8 癌症類型 Bruni D 等。Nat Rev Cancer 2020
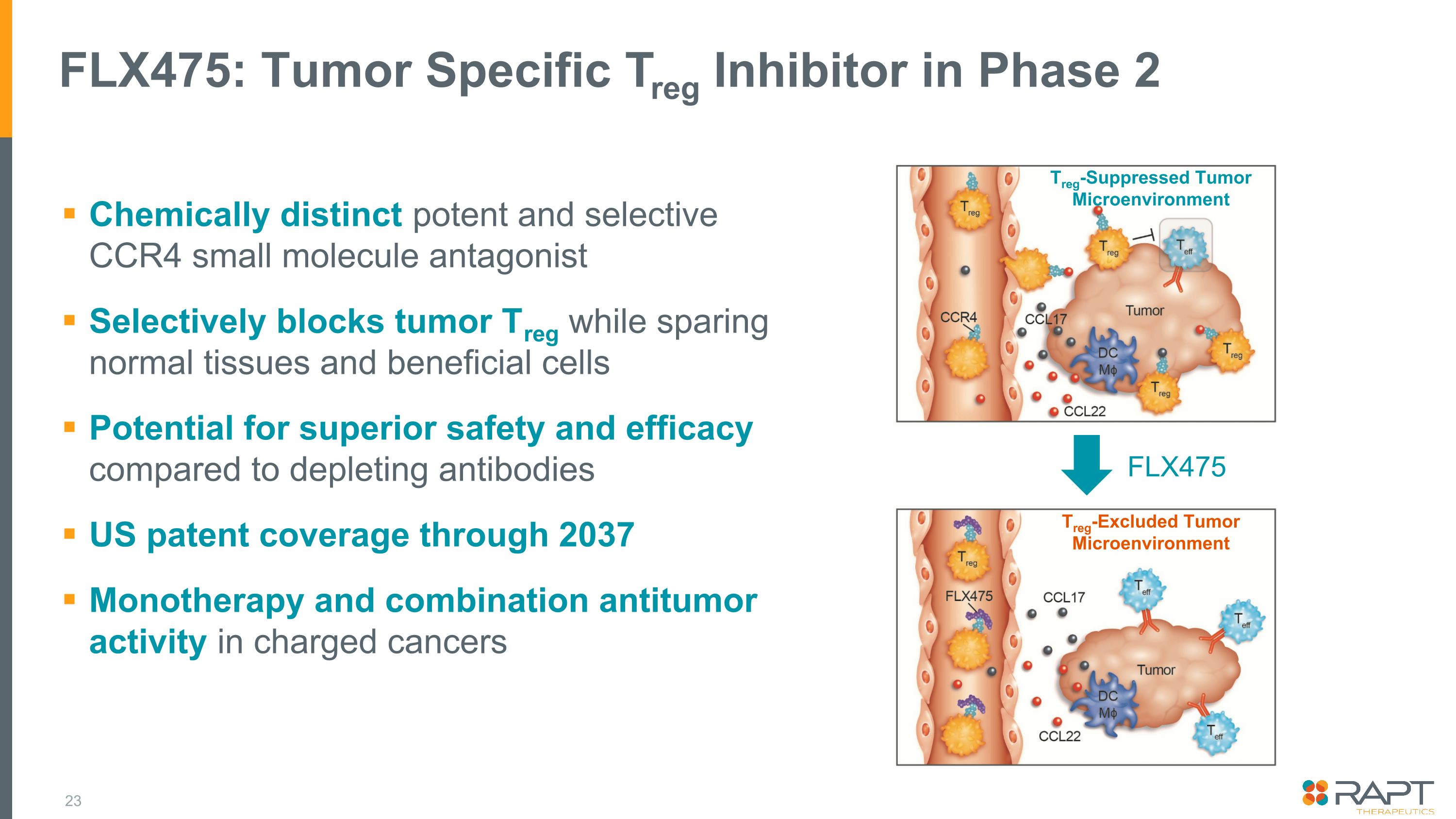
FLX475:腫瘤特異性 Treg 抑制劑處於 2 期化學特異性強效和選擇性 CCR4 小分子拮抗劑選擇性阻斷腫瘤 Treg,同時保護正常組織和有益細胞。與消耗抗體相比,有可能在 2037 年之前獲得優異的安全性和療效美國專利覆蓋範圍單一療法和帶電癌中的聯合抗腫瘤活性 Treg 排除的腫瘤微環境 Treg 抑制的腫瘤微環境 FLX475
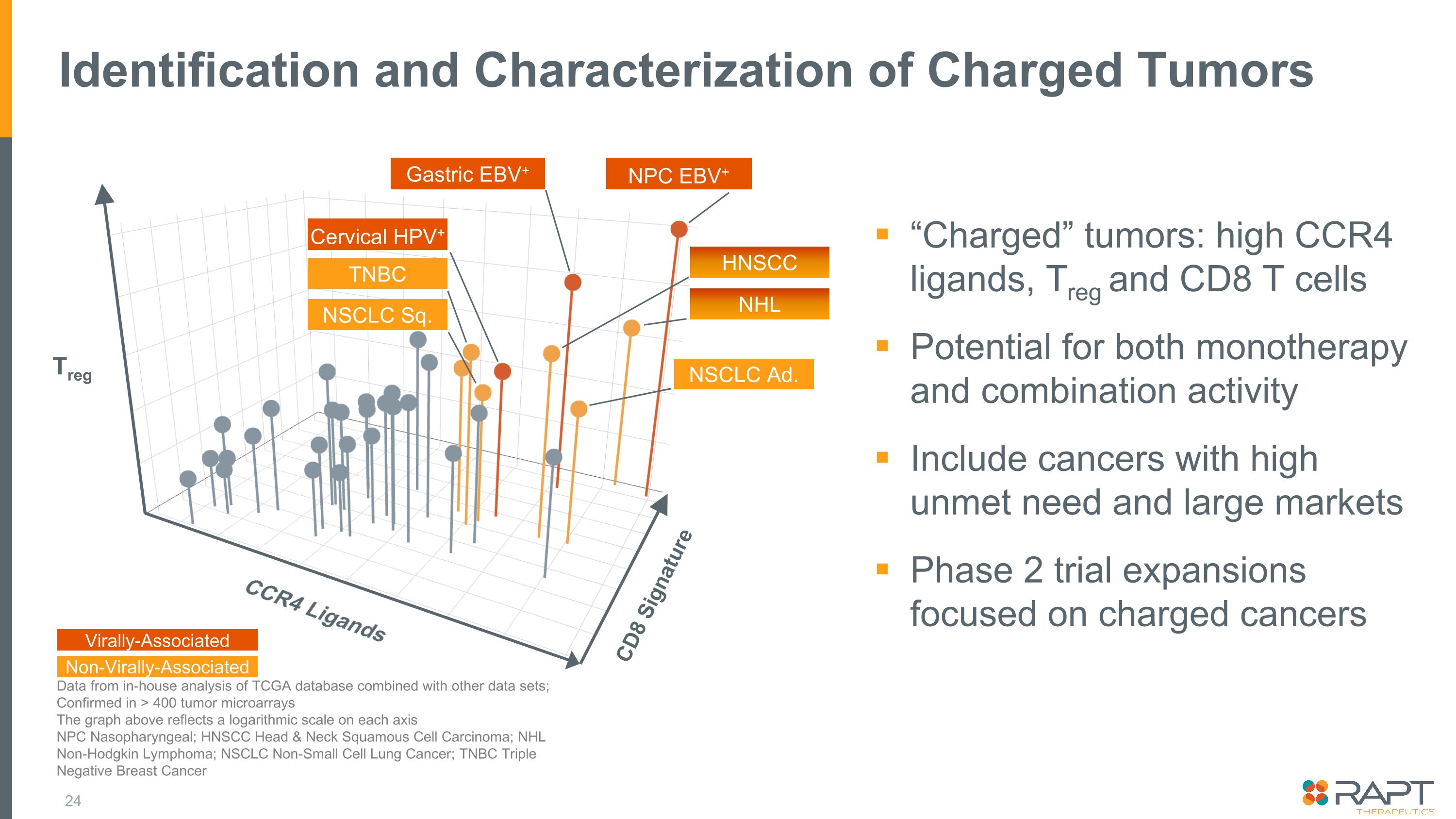
帶電腫瘤 “帶電” 腫瘤的鑑定和表徵:高 CCR4 配體、Treg 和 CD8 T 細胞同時具有單一療法和聯合療法活性的潛力包括需求高且市場龐大的癌症 2 期試驗擴展側重於帶電癌的數據來自對 TCGA 數據庫和其他數據集的內部分析;在 > 400 個腫瘤微陣列中得到證實上圖反映了每個 NPC 軸的對數標度 Nasopharyngeal; HNAL NSCC 頭頸部鱗狀細胞癌;NHL 非霍奇金淋巴瘤;NSCLC 非小細胞肺癌;TNBC 三陰性乳腺癌 Treg CCR4 配體 CD8 Signature 胃部 EBV+ NPC EBV+ NSCLC Sq.TNBC 子宮頸人乳頭瘤病毒+ HNSCC NSCLC 廣告與病毒相關的非病毒相關的 NHL
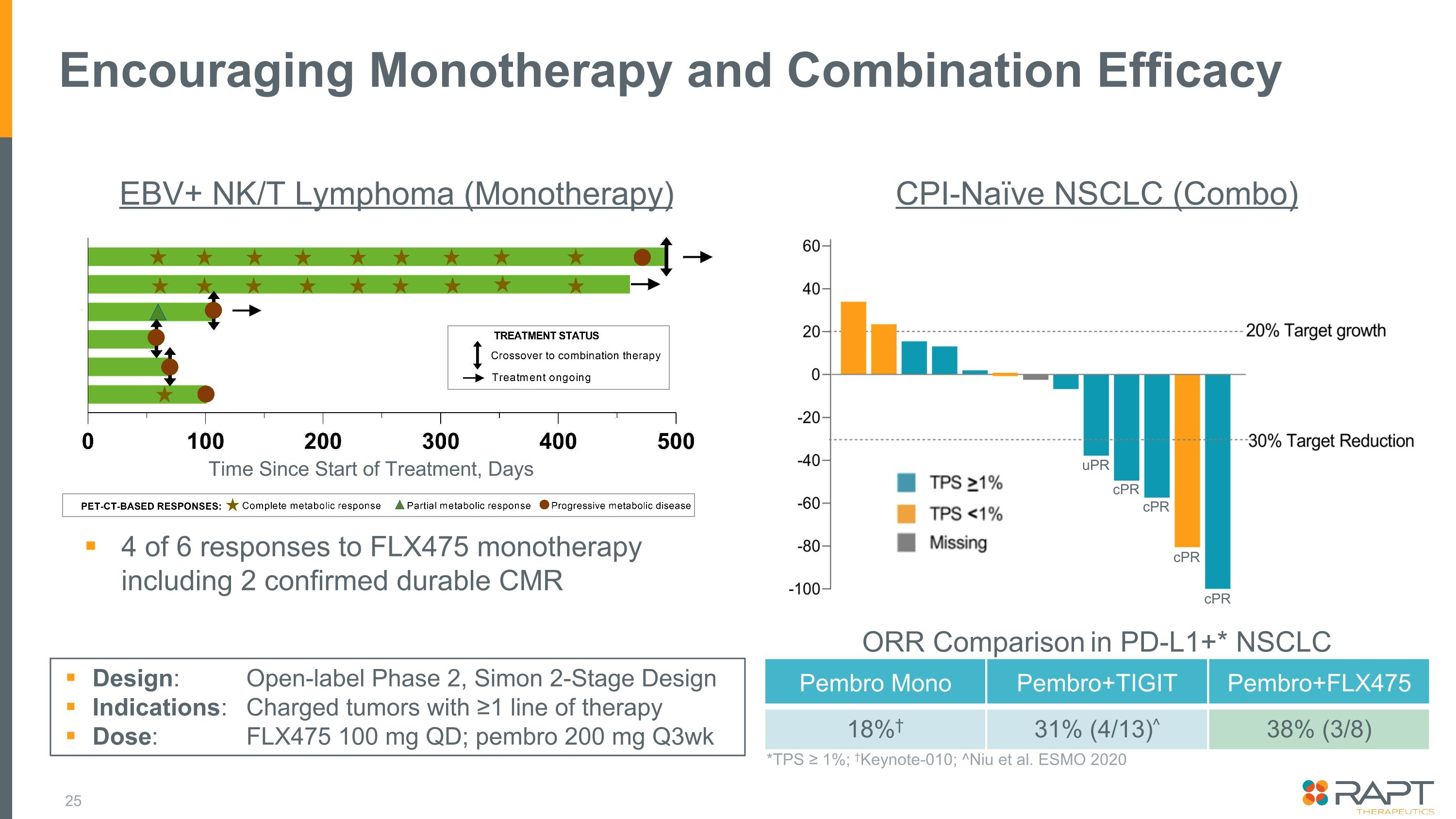
鼓勵單一療法和聯合療效 pembro mono pembro+tigit pembro+flx475 18% 31% (4/13) ^ 38% (3/8) PD-L1+* NSCLC *TPS ≥ 1%;Keynote-010;^Niue 等人。ESMO 2020 CPI-naíve NSCLC(組合)EBV+ NK/T 淋巴瘤(單一療法)FLX475 單一療法 6 個反應中的 4 個,包括 2 個已確認的耐用 CMR 設計:開放標籤 2 期,Simon 2 階段設計適應症:≥1 個療法的帶電腫瘤劑量:FLX475 100 mg QD;pembro 200 mg q3wk 自治療開始以來的時間,CPR CPR

FLX475 計劃摘要與生物製劑區分開來的高選擇性腫瘤 Treg 抑制劑鼓勵以單一療法和與 pembrolizumab 聯合使用早期療效良好的安全性和便捷的口服給藥支持廣泛組合在包括 CPI-naíve NSCLC 合作伙伴 Hanmi Pharmicals 在 EBV+ 胃癌中使用 FLX475 + pembro 的數據令人鼓舞。數據更新預計將於 2023 年下半年更新

關鍵要點和即將到來的里程碑 RPT193:專為各種炎症性疾病設計的安全口服藥物,在 AD FLX475 的一項明確的 2b 期研究中:高選擇性腫瘤 Treg 抑制劑作為單一療法和與 pembrolizumab 聯合使用的多個 2 期擴張計劃關鍵里程碑:RPT193 2023 年下半年開始 2 期哮喘試驗:FLX475 2024 年中期 2 期數據更新:RPT193 2b 期哮喘試驗在2023年下半年開始

謝謝