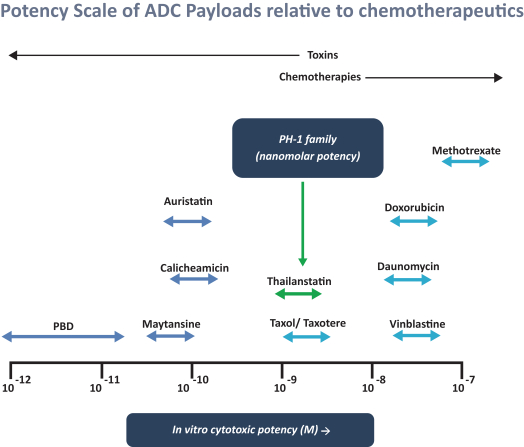
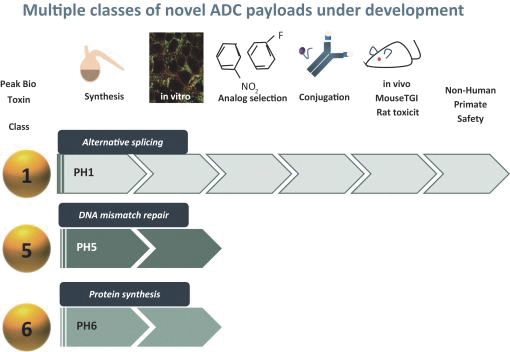
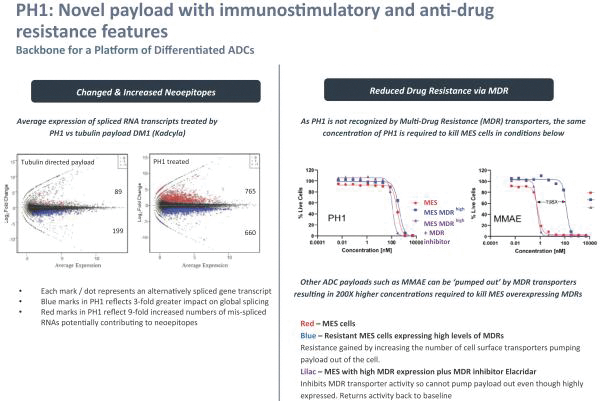
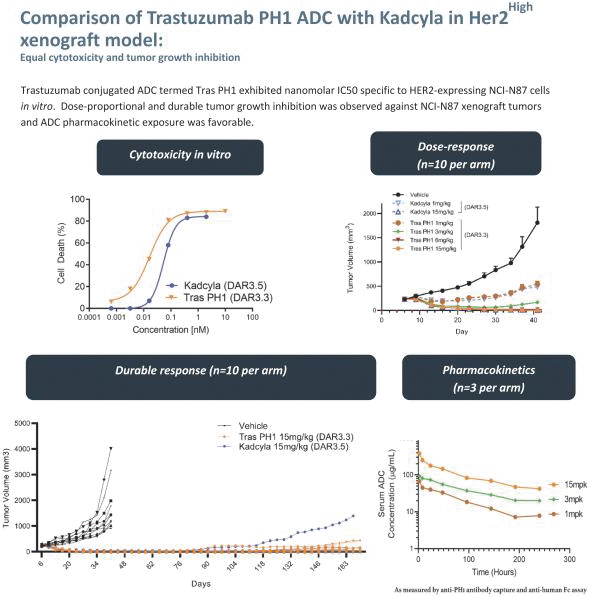
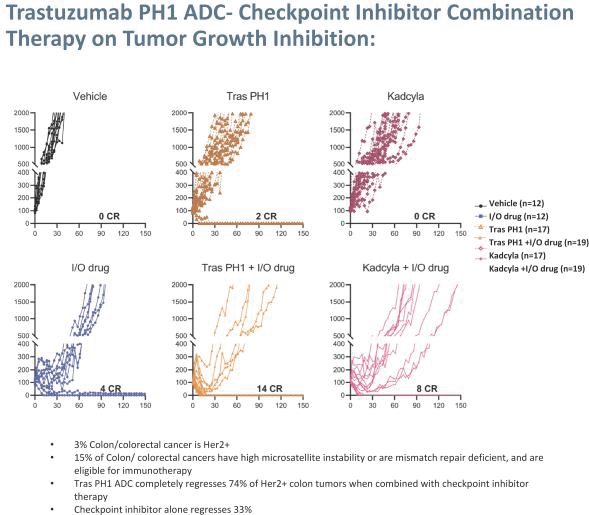
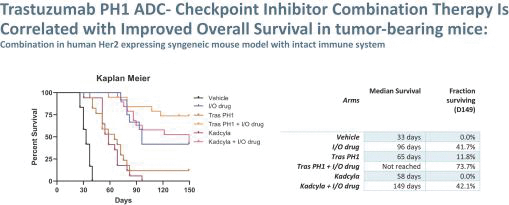
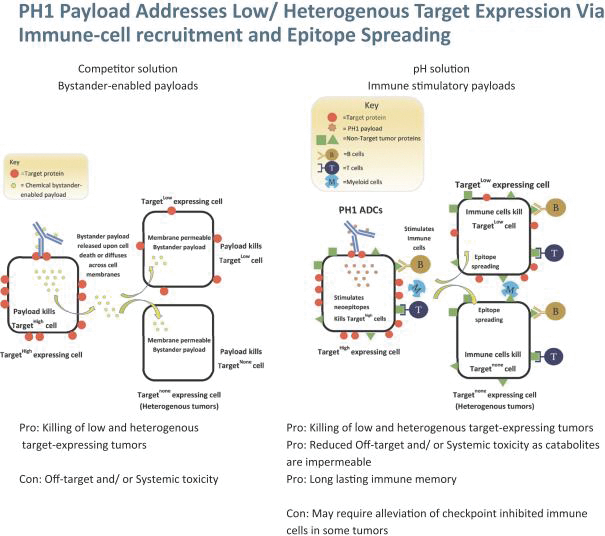
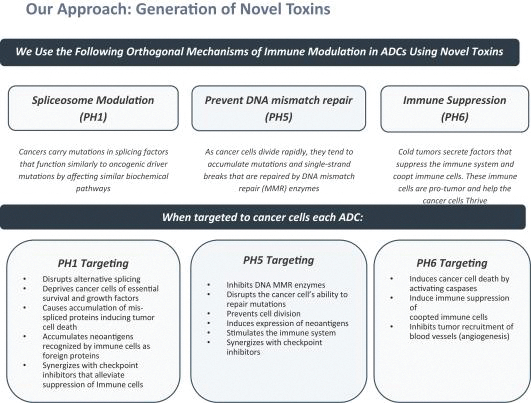
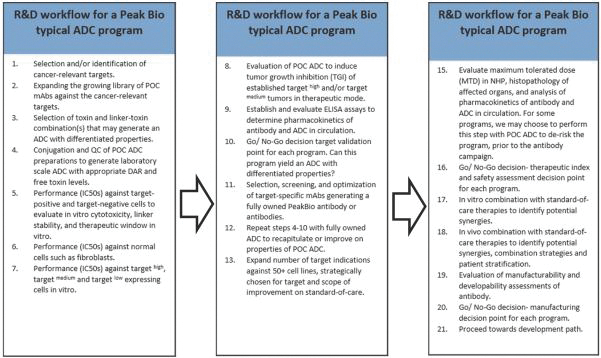
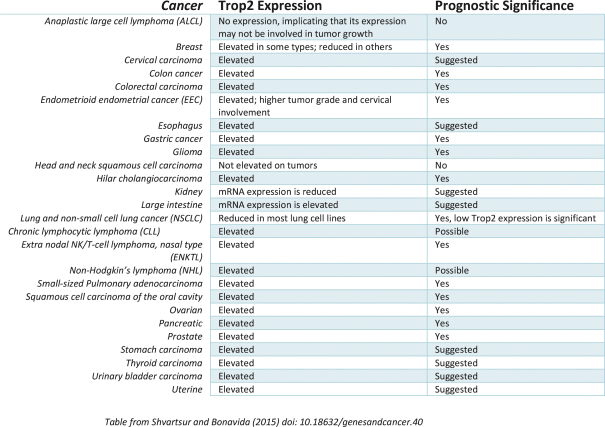
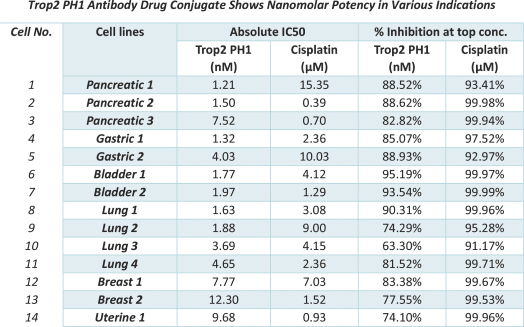
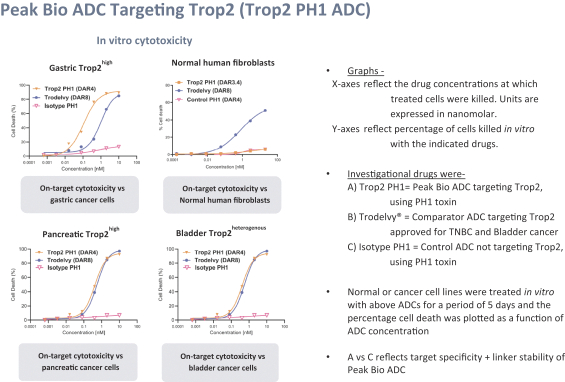
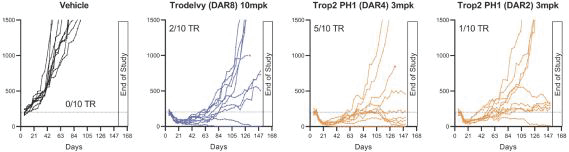
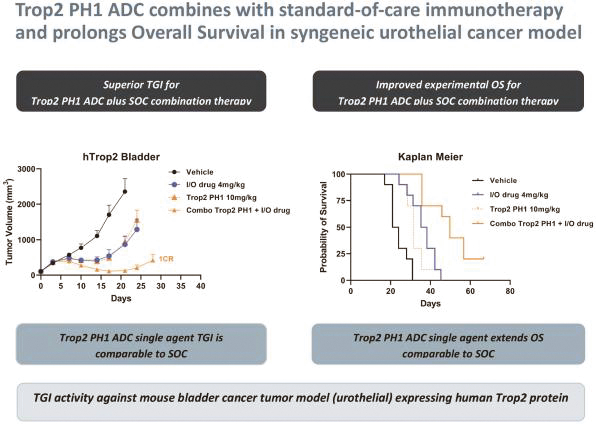
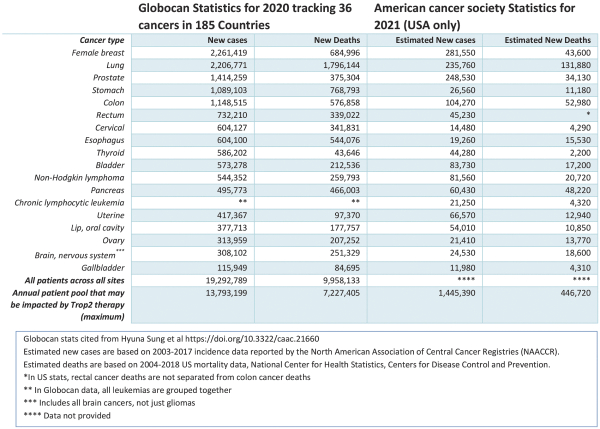
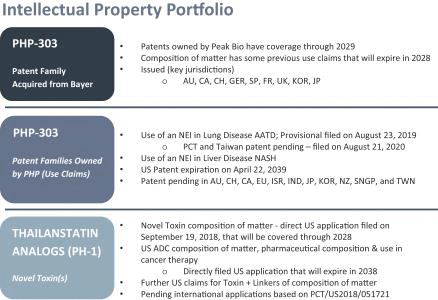
依據第424(B)(3)條提交
註冊號碼333-268801
| 招股説明書 | ||||

23,517,773股普通股
認股權證行使時最多可發行2,992,045股普通股
多達2,992,045份認股權證
本招股説明書 涉及本招股説明書中點名的銷售證券持有人(銷售證券持有人)不時提出並出售(I)最多23,517,773股我們的普通股,每股票面價值0.0001美元(普通股),包括,在我們根據日期為2022年11月3日的普通股購買 協議(白獅購買協議)向白獅發行後,白獅資本有限責任公司可能轉售的多達4,000,000股普通股,和(Ii)最多2,992,045份認股權證,其中包括最初以私人配售方式發行的2,500,000份私募認股權證(私募認股權證) 與Ignyte的首次公開發行(IPO)(定義如下)和與管道融資(定義如下)相關發行的492,045份認股權證(包括私募認股權證和私募認股權證) 。
本招股説明書所包括的23,517,773股本公司普通股 包括(I)最多4,000,000股可由White Lion轉售的股份,其中50,200股按每股4.98美元的價格向White Lion發行,以及3,949,800股可由本公司根據白獅收購協議以較本公司普通股公開交易價格折讓2%-5.5%的價格出售給White Lion,(Ii)向Peak Bio Co.股東發行17,295,044股。LTD與業務合併(定義見下文)有關,並在下文中被描述為目標對價股份《招股説明書摘要》在實施業務合併中的交換比例後,最初以每股約0.17美元至每股8.05美元的價格購買,(Iii)Ignyte保薦人有限責任公司(保薦人)最初以每股約0.02美元的價格購買的1,437,500股(創辦人股份),(Iv)下文 項下描述的579,079股《招股説明書摘要》(V)206,150股作為服務補償發行的股份,每股價格約5.18美元。
關於PIPE股份,(I)50,000股股份按每股10.00美元購買,且不包括認股權證覆蓋範圍及(Ii)529,079股股份 包括認股權證覆蓋範圍,以向購買者提供更具吸引力的價格如下。對於以10.00美元購買的529,079股管道股票(包括認股權證覆蓋範圍),購買者收到0.93份認股權證,行使價為每份認股權證0.01美元。因此,529,079股管道股票以每股10.00美元的價格購買,加上492,045股管道認股權證,行使價格為每股0.01美元,行使後的等值價格約為每股5.18美元(10.01美元除以1.93股)。我們預計所有492,045份管道認股權證都將被行使。
關於受本招股説明書約束的額外2,992,045股普通股,該等股份包括(I)2,500,000股可於行使私募認股權證時發行的普通股,其最初發行價為每股認股權證1.00美元,且 行使價為11.50美元,以及(Ii)492,045股可於行使認股權證時發行的普通股。關於管道搜查證,我們將獲得每次行使搜查證所得的收益1美元。關於2500,000份私募認股權證,我們將獲得每份認股權證11.50美元的收益。有關更多詳情,請參閲?產品?下面。
關於業務合併,持有Ignyte Acquisition Corp.(在業務合併結束後更名為Peak Bio,Inc.)的5,085,226股普通股(Ignyte普通股)的持有人行使了以約10.07美元的贖回價格贖回其股票以換取現金的權利,總贖回金額約為51,232,684美元。於2022年12月29日,根據先前披露的於2022年10月25日訂立的遠期股份購買協議(遠期購買協議),投資者行使出售最多450,000股普通股的權利後,公司以每股10.115美元的價格購買了375,939股普通股。這375,939股普通股已經註銷。作為這項工作的結果,以託管方式持有的與遠期購買協議有關的資金4,551,750美元分配如下:749,127美元分配給我們,3,802,623美元分配給投資者。
於實施上述贖回及購回後,根據本招股説明書可供回售的目標代價股份約佔截至2022年12月29日已發行股份的88%。
登記轉售的大部分股份是由出售證券持有人以遠低於本公司普通股當前市場價格的價格購買的。出售本招股説明書中提供的所有證券,或認為可能會出售這些證券,可能會導致我們證券的公開交易價格大幅下降。 例如,本公司創始人兼董事創始人胡志浩博士將控制本公司40%以上的股份。