我們的Iovance細胞治療中心,或ICTC,用於大規模集中製造
我們的iCTC是第一個集中式和可擴展的cGMP製造設施,致力於生產TIL作為實體瘤患者的潛在治療方法。佔地13.6萬平方英尺,iCTC是現有的最大的細胞治療製造設施之一。該公司目前為Iovance臨牀試驗提供研究性TIL療法,預計在初步產品批准後開始商業生產。距離最近的地方i多個機場的CTC促進了TIL療法向治療中心的交付,iCTC預計將涵蓋TIL療法在北美和歐洲的物流和交付。這個位置還可以在賓夕法尼亞州的Keystone機會改善區(KOIZ)下提供未來的税收節省。
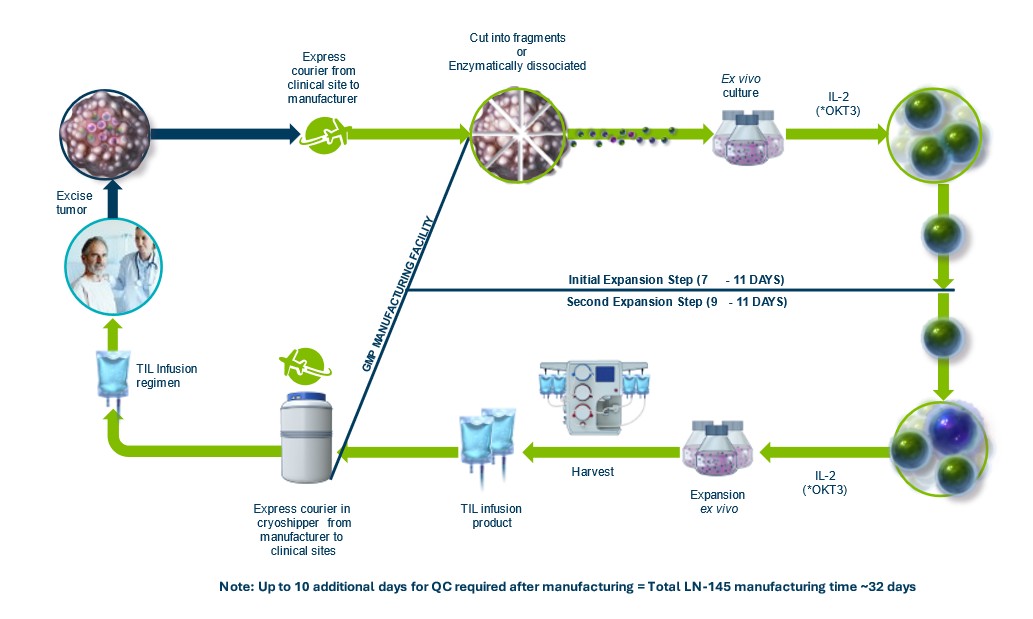
臨牀製造
在2021年,我們完成了投產活動i併成功啟動了Lifileucel和LN-145臨牀批次的生產。此外,我們還與無錫先進療法有限公司和莫菲特簽訂了MSA協議,根據協議,他們同意與我們的員工密切合作,為我們的TIL產品製造、包裝、運輸和處理某些臨牀試驗的質量保證和質量控制。未來,我們可能會依賴他們或其他第三方,或我們自己的製造能力,為我們的臨牀試驗製造和加工基於TIL的候選產品。
商業製造準備
為了滿足預計的商業數量需求,我們繼續為發射做好準備,並擴大活動規模,以在潛在的BLA批准後供應商業TIL。我們希望主要依靠我們自己i商業供應的CTC設施,可以靈活地使用CMO來滿足預期的臨牀試驗和商業需求(如果獲得批准)。例如,如果根據需求需要,我們預計能夠在費城無錫使用兩套臨牀或商業製造套件。如果我們自己的商業製造設施無法滿足製造能力和需求,我們可能需要依賴CMO,包括當前和替代供應商,以確保有足夠的產能用於商業目的。我們的CMO關係在本年度報告的Form 10-K中的研究、開發、製造和許可協議部分有更詳細的描述。
細胞加工活動在cGMP規定的所有設施中進行,使用合格的設備和材料。我們相信,在最終TIL產品的生產中使用的所有材料和組件都可以從合格的供應商處隨時獲得。
知識產權
我們的目標是通過建立和擴大我們專有的TIL技術平臺的專利權,在基於T細胞的免疫療法領域處於領先地位。TIL技術平臺是我們內部開發的,並從第三方獲得許可。知識產權在我們的領域和整個生物技術領域都很重要。我們通過尋求、維護和捍衞專利權,尋求保護和加強對我們的業務發展具有重要商業意義的專有技術、發明和改進。我們還計劃依靠通過孤兒藥物指定或奇怪的、可用的監管排他性和專利期延長提供的監管保護。為了達到這一目標,我們的戰略重點一直是發展自己的知識產權,同時也從提供保護的第三方識別和授權專利,並作為一個最佳平臺來加強我們的知識產權和技術基礎。我們預計將進一步發展我們的專利組合,作為2023年的戰略重點。
我們目前擁有60多項與TIL療法有關的美國專利,其中包括針對多種癌症的組合物和治療方法的專利,例如美國專利號10,130,659;10,166,257;10,272,113;10,363,273;10,398,734;10,420,799;10,463,697;10,517,894;10,537,595;10,639,330;10,646,517;10,656,517;10,653,723;10,695,372;10,894,063;10,905,718;11,918,666;10,925,900;10,933,094;10,946,044;10,946,045;10,933,046;10,953,047;11,007,894;11,007,226;11,013,770;11,026,974;11,040,0372;11,925,900;10,933,094,045;10,953,046;10,953,047;11,007,926,226;11,013,770;11,026,974;11,040,0672;10,894,718;11,918,666;10,925,900;10,933,094;10,943,046,044;10,946,045;10,933,046;10,953,047;11,007,226;11,013,770;11,026,974;11,401,0372;10,894,063,718;11,918,666;10,925,900;10,933,094;10,946,045;10,953,046;10,953,047;11,007,794;11,007,226 6;11,013,770;11,026,97411,311,578;11,337,998;11,344,579;11,344,580;11,344,581;11,351,197;11,351,198;11,351,199;11,364,266;11,369,637;11,384,637;1,433,097;11,529,372;和11,541,077。其中超過35項專利與我們的第二代TIL製造工藝有關,我們預計這些專利的期限將延長至2038年1月,這還不包括任何可能的專利期限延長或調整。我們擁有和授權的知識產權組合還包括與TIL、MIL和PBL療法有關的專利和專利申請;基於腫瘤的冷凍TIL技術;殘留TIL和消化TIL的成分、方法和過程;TIL、MIL和PBL療法的製造方法;共刺激分子和T細胞調節分子在TIL療法和製造中的使用;穩定和瞬時的轉基因TIL療法,包括免疫的基因敲除