
附件99.1

J.P.Morgan Healthcare Conference 2023年1月9日這一非宣傳演示文稿包含調查數據以及前瞻性陳述;實際結果可能會因情況而異。

J.P.Morgan Healthcare Conference 2023年戰略與商業更新2倫納德·S·施萊弗,醫學博士,博士聯合創始人,總裁兼首席執行官

3關於前瞻性陳述和非GAAP財務措施的説明本陳述包括前瞻性陳述,涉及與Regeneron製藥公司未來事件和未來業績有關的風險和不確定因素。(“Regeneron”或“公司”),實際事件或結果可能與這些前瞻性陳述大不相同。“預期”、“預期”、“打算”、“計劃”、“相信”、“尋求”、“估計”等詞語以及類似的表述旨在識別此類前瞻性陳述,儘管並非所有前瞻性陳述都包含這些可識別的詞語。這些聲明涉及但不限於以下風險和不確定性:SARS-CoV-2(導致新冠肺炎大流行的病毒)對Regeneron的業務及其員工、合作者和供應商以及Regeneron所依賴的其他第三方的影響;Regeneron及其合作者繼續進行研究和臨牀計劃的能力;Regeneron管理其供應鏈的能力;Regeneron和/或其合作者或被許可人(統稱為“Regeneron產品”)營銷或商業化的產品淨銷售額;以及全球經濟;Regeneron和/或其合作者或被許可方(統稱為“Regeneron的候選產品”)正在開發的產品和候選產品的性質、時機、可能的成功和治療應用,以及正在進行或計劃的研究和臨牀計劃,包括但不限於EYLEA®(阿弗利賽普)注射、杜匹克森®(杜匹單抗)注射、Libtayo®(賽米普利單抗)注射、Praluent®(阿利羅單抗)注射、kavzara®(沙利單抗)注射、Evkeeza®(依維阿單抗)、Inmazeb®(阿託替維單抗、maftivimab和odesivib-ebgn)、freafcept 8 mg、zpoab、odronextab、odronextab、odronextabItepekimab,fianlimab, Garetosmab,LinvoselTamab,REGN5713-5714-5715,Regeneron的其他腫瘤學計劃(包括其共刺激雙特異性組合),Regeneron及其合作者的早期計劃(包括REGN 14287,Regeneron的“下一代”新冠肺炎抗體在本演示中討論),以及在Regeneron的研究計劃中使用人類遺傳學;Regeneron的產品和Regeneron的候選產品的使用、市場接受度和商業成功的不確定性,以及研究(無論是由Regeneron或其他人進行的,無論是強制的還是自願的)的影響,包括本演示中討論或引用的研究對Regeneron的產品和Regeneron的候選產品的任何上述研究或任何潛在的監管批准的影響;Regeneron的候選產品和Regeneron的產品的新適應症(包括但不限於上面列出的那些)可能獲得監管批准和商業推出的可能性、時機和範圍;實現本演示中描述的任何預期里程碑的可能性和時間;在患者中管理Regeneron的產品和Regeneron的候選產品所產生的安全問題,包括在臨牀試驗中使用Regeneron的產品和Regeneron的候選產品所產生的嚴重併發症或副作用;監管和行政政府當局做出的可能推遲或限制Regeneron的產品和Regeneron的候選產品繼續開發或商業化的能力的決定;影響Regeneron的產品、研究和臨牀計劃以及業務的持續監管義務和監督,包括與患者隱私相關的義務;Regeneron產品從第三方付款人那裏獲得補償的可用性和程度, 包括私人付款人保健和保險計劃、健康維護組織、藥房福利管理公司和政府計劃,如Medicare和Medicaid;此類付款人的承保範圍和補償決定以及此類付款人採用的新政策和程序;可能優於或高於Regeneron的產品和Regeneron的候選產品的競爭藥品和候選產品;Regeneron和/或其合作者或被許可人(包括本演示文稿中討論或引用的研究和開發計劃)進行的研究和開發計劃的結果在多大程度上可以在其他研究中複製和/或導致候選產品進入臨牀試驗或治療應用;Regeneron為多種產品和候選產品製造和管理供應鏈的能力;Regeneron的合作者、被許可方、供應商或其他第三方(視情況而定)執行與Regeneron的產品和Regeneron的候選產品相關的製造、灌裝、整理、包裝、貼標籤、分銷和其他步驟的能力;意外費用;開發、生產和銷售產品的成本;Regeneron滿足其任何財務預測或指導的能力,以及對這些預測或指導所依據的假設的更改;任何許可或合作協議,包括Regeneron與賽諾菲和拜耳(或其各自的關聯公司,視情況而定)的協議被取消或終止的可能性;與其他各方的知識產權相關的風險以及與之相關的未決或未來訴訟、與公司和/或其運營有關的其他訴訟和其他訴訟以及政府調查;任何此類訴訟和調查的最終結果, 以及上述任何一項可能對Regeneron的業務、前景、經營業績和財務狀況產生的影響。在Regeneron提交給美國的文件中可以找到對這些和其他重大風險的更完整的描述。S.美國證券交易委員會。任何前瞻性陳述都是基於管理層目前的信念和判斷做出的,提醒讀者不要依賴Regeneron所作的任何前瞻性陳述。Regeneron不承擔任何更新(公開或其他)任何前瞻性陳述的義務,包括但不限於任何財務預測或指導,無論是由於新信息、未來事件或其他原因。本報告包括非公認會計準則稀釋後每股淨收入,這是一個不按照U計算的財務衡量標準。S.公認會計原則(“公認會計原則”)。這一非公認會計準則財務計量是通過從相關的公認會計準則財務計量中剔除某些非現金和/或其他項目來計算的。該公司還包括對對賬項目的估計所得税影響的非公認會計準則調整。本公司對本公司認為對評估其經營業績沒有幫助的項目進行此類調整。管理層使用這一和其他非公認會計準則衡量標準進行計劃、預算、預測、評估歷史業績以及作出財務和經營決策,並在此基礎上向投資者提供預測。此外,這些非公認會計準則使投資者能夠更好地瞭解公司核心業務的財務表現。然而,這種非公認會計準則財務措施的使用有侷限性,因為它們排除了某些性質上的經常性費用。更有甚者, 該公司的非GAAP財務指標可能無法與其他公司提供的非GAAP信息相比較。Regeneron提出的任何非GAAP財務指標都應被視為根據GAAP編制的財務業績指標的補充,而不是替代。

2022年跨關鍵戰略優先位置Regeneron的進展提供長期的股東價值4潛在即將提交的監管文件、批准和數據讀數在自由cept 8 mg數據位置視網膜特許經營權獲得長期領導特殊的Dupixent臨牀資料和商業執行,現在被批准用於治療五種類型的2型過敏性疾病和年輕的AD患者6個月的增強免疫腫瘤學平臺通過收購Libtayo,CD3雙特異性的進展,有希望的共刺激雙特異性數據,以及強大的LAG-3計劃潛在的突破性進展,新冠肺炎的治療和預防使用一種新型的單抗。注:本演示文稿中所有縮略語和縮略語的定義見第37頁。

保持美國領先地位,2022年收入增長繼續超過抗血管內皮生長因子類別的增長5$0.0$0.8$1.4$1.7$2.7$3.3$3.7$4.1$4.6$4.9$5.8$6.3 2011 2012 2013 2015 2016 2017 2018 2019 2020 2021 2022美國淨產品銷售額,2022年第四季度美國淨產品銷售額為62.6億美元(同比增長8%)*·2022年第四季度美國淨產品銷售額為15.億美元(同比下降3%)*·受短期轉向標籤外使用阿瓦斯丁的負面影響·2022年第四季度暫時關閉了提供患者自付援助的基金·最新的2022年第四季度市場數據顯示,2022年12月,轉向標籤外品牌類別的市場份額已經開始逆轉~75%,與之前2022個季度的†人口趨勢一致,預計將推動未來類別增長*基於截至2022年12月23日的初步、未經審計的結果†交響樂健康。*2022年年增長率+8%*基於11年以上的安全和療效經驗、適應症範圍和靈活的給藥方案的護理標準

減輕wAMD和DME患者的治療負擔仍然是一個高度未得到滿足的需求如果獲得批准,符合afLibercept 8 mg資格的患者可以從釋放後延長給藥間隔中受益cept 8 mg有可能改變治療範式;Positions Regeneron的視網膜特許經營權在釋放後6釋放cept 8 mg是一種研究產品,尚未被任何監管機構批准使用。BLA提交於2022年12月完成,使用優先審查憑證加快FDA審查的啟動前計劃正在進行中,可能在2023年8月底獲得FDA的批准。在Regeneron和拜耳股份公司聯合開發8 mg後,8 mg有可能成為下一代護理標準抗血管內皮生長因子治療。試驗的主要贊助商是Pho ton的Regeneron和脈衝星的拜耳。

Q8W*7%共用阿普利康8 mg(N=456^)Q8W*4%Q12W*7%Q16W 89%阿普利康8 mg Q16W(N=156^)93%的阿弗萊塞8 mg二甲基甲醚患者維持劑量間隔≥12周至48周7 Q8W*9%Q12W 91%阿普利諾8 mg Q12W(N=300^)在劑量方案修改評估的基礎上,在至48周的某個時間點縮短了阿普萊塞8 mg與阿普萊塞2 mg的安全性。†2 mg Q8W n=16 7,AFLibercept 8 mg Q12 W n=32 8,AFLibercept 8 mg Q16 W n=163。完成第48周的患者平均注射次數在第48周†後2毫克(Q8W)7.7AfLibercept 8 mg(Q12W)5.7 AfLibercept 8 mg(Q16W)4.9 AfLibercept 8 mg是一種研究產品,尚未獲得任何監管機構的批准使用。≥Q12W 93%的8 mg 12周和16周給藥方案與2 mg 8周給藥Regimen相比,視力改善不明顯

Q8W*13%Q12W*11%Q16W 77%釋放後8 mg Q16W(N=312^)Q8W*17%混合釋放8 mg(N=628^)83%的AFLibercept 8 mg(N=628^)83%的患者在12周至48週期間保持給藥間隔≥8 mg Q8W*21%Q12W 79%AFLibercept 8 mg Q12W(N=316^)≥Q12W 83%前48周內注射的平均次數†釋放後2 mg(Q8W)6.9釋放後8 mg(Q12W)5.2*患者在某個時間點通過48周的DRM評估縮短了注射次數。†患者完成48周治療:Q8周2 mg,Q12周8 mg,Q16周8 mg。^完成48周的患者。注:由於四捨五入,百分比之和可能不等於100%。拜耳股份公司是脈衝星研究的主要贊助商。與afLibercept 2 mg相當的安全性afLibercept 8 mg 12周和16周劑量方案與afLibercept 2 mg 8周劑量regimen 8 mg相比獲得了非劣性視力改善,是一種研究產品,尚未被任何監管機構批准使用。

在DME患者中,7%的患者在第一年接受Q4W給藥的交叉試驗比較AFLibercept 8 mg和Faricimab在DME患者中的9次給藥間隔在PHOTON研究中被隨機分為8 mg Q16W ARM(N=156),在Yosemite研究中DME患者被隨機分配到Faricimab 6 mg PTI ARM(N=286),一直到52周*afLibercept 8 mg是一種研究產品,尚未得到任何監管機構的批准使用。在比較不同臨牀研究的結果時,建議謹慎。用於描述目的,請參閲ly。0 4 8 12 16 20 24 28 32 36 40 44 48 0 4 8 12 16 20 24 28 32 36 40 44 48 52 52每10人中只有2人在第一年末完成了一個完整的Q16W劑量週期·間隔被允許延長,儘管Cst增加或減少了10%,視力損失高達10個字母~10人中有4人無法達到或維持劑量延長(Q8W,Q12W,Q16W)89%維持Q16W劑量持續48周患者3個初始月劑量*Wycoff C等人。玻璃體內注射Faricimab的有效性、耐受性和安全性:兩項隨機、雙盲、3期試驗,最長可達每16週一次。《柳葉刀》2022;399:741-55。為保持一致性而修改的顏色。Q8W Q12W Q16W Q4W初始劑量周患者決定4個月初始劑量

1077%在48周內維持Q16W劑量11%在48周內實現Q12W劑量4845%在第24周Q12W劑量分配在第24周22%分配在第20周Q8W劑量間隔在Tenaya和Lucerne研究(n=665)*(根據研究方案在第1年不允許縮短劑量間隔)在Pulsar研究Q8W Q12W Q16W後初始劑量*AAO 2022中,wAMD患者被隨機分配到8 mg Q16W ARM(N=312)的劑量間隔。為保持一致性而修改的顏色。4個月的初始劑量3個月的初始劑量8毫克是一種試驗性產品,沒有任何監管機構批准使用。在比較不同臨牀研究的結果時,建議謹慎。用於描述目的,請參閲ly。非洛昔洛普8 mg與法利昔單抗治療wAMD的交叉試驗比較

在2022年的前9個月,Dupixent全球淨產品銷售額增長了41%,超過62億美元的市場滲透率,新的適應症和年輕人口代表着持續增長的重要機會。2022年,5種疾病的監管進展:特應性皮炎被FDA批准為6個月至5歲AD患者的第一種生物藥物;歐盟提交的審查中的哮喘被EC批准為6至11歲的嗜酸性食管炎的第一種也是唯一的治療方法;建議歐盟批准FDA和EC批准的CHMP furigo Noularis作為第一種也是唯一一種治療生物幼稚患者的慢性自發性蕁麻疹x sBLA提交給FDA的批准2022年批准預計將從2023年開始做出有意義的收入增長貢獻2021年前9個月$3.4$4.7$1.1$1.5 2022年前9個月美國ROW+41%賽諾菲記錄的Dupixent的全球淨產品銷售額,數十億美元本幻燈片包含尚未獲得任何監管機構批准的Dupilumab的研究適應症。
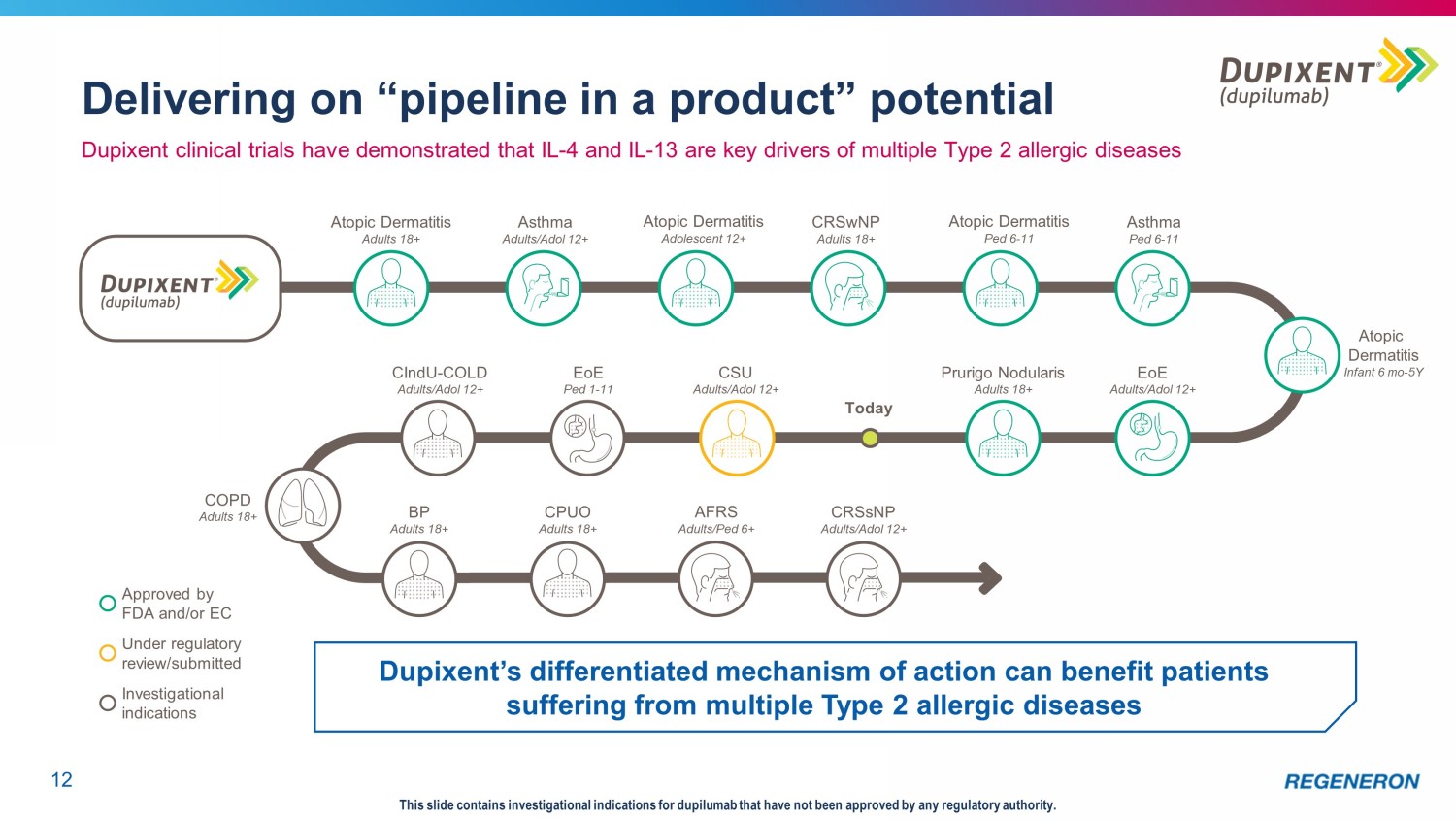
實現“產品中的流水線”潛力12本幻燈片包含了尚未得到任何監管機構批准的dupilumab的研究適應症。在FDA和/或EC批准的監管審查/提交的研究適應症下,Dupixent的差異化作用機制可以使患有多種2型變態反應性疾病的患者受益。Dupixent臨牀試驗表明,IL-4和IL-13是多種2型變態反應性疾病特應性皮炎的關鍵驅動因素成人18+哮喘成人/ADOl 12+特應性皮炎青少年12+CRSwNP成人18+特應性皮炎Ped 6-11成人/ADOl 12+CSU成人/ADOl 12+EoE Ped 1-11瘙癢結節性皮炎成人/ADOL 12+特應性皮炎成人18+今天BP 18+ADOL 12+EoE Ped 1-11結節性皮炎/ADOL 12+EoE Ped 1-11結節性皮炎成人/ADOL 12+特應性皮炎成人18+今天BP+18+特應性皮炎成人CPUO成人18+CRSsNP成人/ADO1 12+AFRS成人/Ped 6+

Dupixent和itepekimab:兩個解決慢性阻塞性肺病高度未滿足需求的機會13·在現任和以前吸煙者中解決2型COPD的潛力·正在進行的兩項第三階段研究:x BOREAS完全納入x NOTUS招募·BOREAS達到預先指定的臨時療效閾值,觸發NOTUS研究的啟動·關鍵納入標準:嗜酸性粒細胞≥300/μl·BOREAS關鍵數據預計在2023年上半年,Notus在2024年上半年·有可能解決前吸煙者中的COPD·正在進行的兩項第三階段研究:XAERIFY-1登記x AERIFY-2登記·在前吸煙者的第二階段研究中,與安慰劑相比,惡化程度降低了42%·嗜酸性粒細胞計數沒有納入標準·兩項AERIFY研究的關鍵數據預計在2024年,Itepekimab(抗IL-33)Itepekimab僅有約60萬名患者Dupixent或itepekimab>35萬名患者Dupixent或itepekimab>35萬名患者Dupixent僅~15萬名2型非吸煙者(70%的COPD患者)當前吸煙者(30%的COPD患者)-本幻燈片包含候選研究藥物和尚未得到任何監管機構批准的適應症。美國、歐盟和日本的可尋址患者數量估計

腫瘤類型初步適應症數據披露2022年下半年血液學淋巴瘤多發性骨髓瘤皮膚腫瘤學新輔助CSCC一線晚期黑色素瘤其他實體腫瘤符合改變的晚期NSCLC晚期NSCLC卵巢癌(2L+)轉移性去勢抵抗前列腺癌2022年腫瘤學有意義的進展14表明關鍵或潛在的關鍵研究這張幻燈片包含尚未獲得任何監管機構批准的研究候選藥物和適應症。Odronextamab LinvoselTamab Cymplimab PSMAxCD28 Ubamatamab METxMET Cymplimab Fianlimab顯示數據讀出Cymplimab Fianlimab FDA於2022年11月批准與鉑類化療一線聯合使用FDA批准的兩種PD-1/L1抗體之一,可與化療結合使用,無論組織學或PD-L1表達水平如何

J.P.Morgan Healthcare Conference 2023研究與流水線更新15 George D.Yancopoulos,醫學博士,博士聯合創始人,總裁&首席科學官

Regeneron公司交鑰匙技術的發展為我們的科學和生物製劑提供動力:交鑰匙治療平臺遺傳藥物:交鑰匙治療平臺遺傳藥物:交鑰匙治療平臺抗體捕獲基因治療siRNA基因組編輯(插入/敲除)CRISPR/Cas9技術|RNAi|下一基因編輯|病毒載體技術|AAV人類遺傳學CD3雙特異性共刺激雙特異性Regeneron成立致力於小鼠遺傳學小鼠遺傳學人性化免疫小鼠VelocImmune小鼠人性化免疫系統基因中心»已批准的多個臨牀階段抗體和雙特異性基因再生»超過200萬人的人類測序靶點和遺傳管道

2022年在治療領域取得有意義的進展17眼科免疫學腫瘤學更廣泛的流水線EYLEA(血管內皮生長因子陷阱)·接受了六個月的兒科排他性治療·sBLA接受了8 MG早產兒視網膜病變的優先審查·8 MG(血管內皮生長因子陷阱)·提交了濕性老年性黃斑變性和糖尿病黃斑水腫的積極關鍵數據,並提交了優先審查憑單DUPIXENT(抗IL-4/IL-13)·FDA和EC批准為第一個也是唯一表明治療嗜酸性食管炎的治療方案;建議歐盟批准CHMP·FDA批准作為治療兒童(6-5年)特應性皮炎的首個生物藥物·EC批准用於兒童(6-11歲)哮喘·sBLA提交慢性自發性蕁麻疹LIBTAYO(抗PD-1)·FDA批准聯合化療治療1L晚期NSCLC·EC和日本批准用於2L宮頸癌其他腫瘤學·fianlimab+Libtayo用於晚期黑色素瘤和晚期NSCLC·針對實體腫瘤(METxMET,METxMET,Ubamatamab)·PSMAxCD28+Libtayo的首個數據顯示在mCRPC中具有令人鼓舞的抗腫瘤活性·提供了用於B-NHL的odronextamab和用於骨髓瘤的linvoselTamab的潛在關鍵二期數據·sBLA被接受為兒童HoFH中Evkeeza的優先審查·BLA在Chaple中提交用於pozlimab的BLA·報告快速、深入, 單劑NTLA-2001後TTR持續減少·NASH中HSD17B13的siRNA報告的初步數據顯示具有強大的靶向擊倒作用·發現CIDEB基因的罕見突變,可預防肝病;發表在《新英格蘭醫學雜誌》上的Inmazeb因治療埃博拉贏得了享有盛譽的“最佳生物技術產品”Prix Glen獎這張幻燈片包含尚未獲得任何監管機構批准的候選研究藥物和適應症。

腫瘤靶向雙特異性藥物旨在幹擾細胞信號和/或向腫瘤細胞輸送細胞毒藥物內部開發的管道的獨特靈活性為新型和差異化的組合提供了可能性18 CD3雙特異性:“信號1”旨在將癌細胞上的腫瘤相關抗原與表達CD3的T細胞連接起來,導致潛在的局部T細胞激活和細胞毒性PD-1抑制劑CD28雙特異性:“信號2”旨在通過增強共刺激信號調節免疫反應來提高識別腫瘤抗原的T細胞的活性,旨在克服腫瘤抑制微環境(例如,通過抑制檢查點或靶向輸送免疫調節劑)

內部開發的管道的獨特靈活性推動了新型和差異化組合的潛力19 Odronextamab(CD20xCD3)LinvoselTamab(BCMAxCD3)MUC16xCD3(REGN4018)PSMAxCD3(REGN4336)R/R B-NHL,CLL R/R多發性骨髓瘤轉移性前列腺癌復發卵巢癌Cymplimab(PD-1)PSMAxCD3(REGN4336)轉移性前列腺癌Cymplimab(PD-1)Ubamatamab(MUC16xCD3)復發卵巢癌Cymplimab(PD-1)EGFRxCD28(REGN7075)Cymplimab(PD-1)MUC16xCD28(REGN5668)Cymplimab(PD-1)PSMAxCD28(REGN5678)實體瘤復發卵巢癌Ubamatamab(MUC16xCD3)MUC16xCD28(REGN56)復發卵巢癌PSMAxCD3(RE4336)PSMAxCD28(REGN5678)惡性修復(LAG3)Cymplimab(PD-1)PSMAxCD28(REGN5678)實體瘤復發卵巢癌Ubamatamab(MUC16xCD3)MUC16xCD28(REGN4336)PSMAxCD28(REGN5678)惡性修復BCC vidutolimod(TLR9)Cymplimab(PD-1)METxMET(REGN5093)METxMET ADC(REGN5093-M114)Met改變的晚期NSCLC Meet過表達先進的NSCLC腫瘤靶向Biparatopics CD3雙特異性:“Signal 1”CD28雙特異性:“Signal 2”調製免疫反應Odronextamab(CD20xCD3)CD22xCD28(REGN5837)R/R B-NHL PD-1抑制劑本幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。

內部開發的管道的獨特靈活性推動了新型差異化組合Odronextamab(CD20xCD3)LinvoselTamab(BCMAxCD3)MUC16xCD3(REGN4018)PSMAxCD3(REGN4336)R/R B-NHL的潛力CLL R/R多發性骨髓瘤轉移性前列腺癌復發卵巢癌Cymplimab(PD-1)PSMAxCD3(REGN4336)轉移性前列腺癌Cymplimab(PD-1)Ubamatamab(MUC16xCD3)復發卵巢癌Cymplimab(PD-1)EGFRxCD28(REGN7075)Cymplimab(PD-1)MUC16xCD28(REGN5668)Cymplimab(PD-1)PSMAxCD28(REGN5678)實體瘤復發卵巢癌Ubamatamab(MUC16xCD3)MUC16xCD28(REGN56)復發卵巢癌PSMAxCD3(RE4336)PSMAxCD28(REGN5678)惡性修復(LAG3)Cymplimab(PD-1)PSMAxCD28(REGN5678)實體瘤復發卵巢癌Ubamatamab(MUC16xCD3)MUC16xCD28(REGN4336)PSMAxCD28(REGN5678)惡性修復BCC vidutolimod(TLR9)Cymplimab(PD-1)METxMET(REGN5093)METxMET ADC(REGN5093-M114)Met改變的晚期NSCLC Met過表達晚期NSCLC腫瘤靶向雙功能CD3雙特異性:“Signal 1”CD28雙特異性:“Signal 2”調製免疫反應Odronextamab(CD20xCD3)CD22xCD28(REGN5837)R/R B-NHL PD-1抑制物20

08006 01003 05007‘09001 05012 09002 02001 05006 08001 05002 05003 055001 05008 08005 05009-100-80-60-40-20 0 20 40 60 80 100 01008 17001 07001 01007 07002 09003 05014 09004 01009 05016 07003 02004 02003-100-80-60-40 80 100 CoStim雙特異性抗體可能允許“冷”腫瘤對免疫治療21信號1信號2 REGN5678(PSMAxCD28)+Libtayo(PD-1抗體)的作用機制·PSMA在前列腺癌上高度表達·REGN5678和Libtayo(Cymplimab)的組合旨在進一步增強抗腫瘤作用通過增強共刺激“信號2”和阻斷癌細胞利用PD-1途徑抑制T細胞激活的T細胞的活性REGN5678+Libtayo:最初的1/2期數據顯示,當與REGN5678劑量水平的Libtayo患者聯合使用時,PSMAxCD28的抗腫瘤活性具有劑量依賴關係1-5名患者REGN5678劑量水平6-8·REGN5678:克服mCRPC對PD-1抑制的耐藥性的潛力·DL1-5(n=17):最低的抗腫瘤活性和沒有≥Gr3irAEs·DL6-8(n=16):觀察到劑量依賴的反應IrAEs·≥3級免疫相關不良事件僅發生在某些具有抗腫瘤活性的患者中*8月3日,2022年9月新聞稿,ESMO REGN投資者活動。初步數據。DL3 DL4 DL5 DL2 DL1 DL8 DL7 DL6較基線的最佳PSA變化(%)較基線的最佳PSA變化(%)初始PSMAxCD28+Libtayo臨牀數據顯示對抗PD-1單一療法耐藥的腫瘤的反應

PSMAxCD28+Libtayo在歷來對PD-1單藥耐藥的腫瘤類型中顯示了深刻的抗腫瘤活性22從最初的PSMAxCD28數據中得出的關鍵結論·在較低劑量下PSMAxCD28的最低抗腫瘤活性,正如臨牀前模型預測的那樣·通過Libtayo啟動增強了抗腫瘤活性·PSAGr 3免疫相關不良事件僅發生在某些抗腫瘤活動“指數患者”(DL6)在初始劑量後~1.5年持續反應的患者*·將≥水平維持在檢測下限以下^·軟組織疾病消失·骨掃描正常化,PSMA PET掃描陰性^*患者在7周後因皮膚Gr3感染而停止治療?每名醫生在DL8報告,在開始聯合治療0 500 1000 W0 W3…時,4名患者中有3名顯示出深刻的PSAR反應W6 W9 HLHPSA(ng/ml)0 20 40 60 W0 W3…W6 W9 W12患者1009治療在W9患者2004患者逝世W13啟動PSMAxCD28啟動Libtayo PSA(ng/ml)0 100 200 300 W0 W3…W6 W9 W12 W15 PSA(ng/ml)按方案給藥方案AIDPGr 3 PR SD肝炎Gr 2患者7003在W9至W10期間進行為期一週的治療

共刺激雙特異性平臺:現狀和下一步23*斯科科斯,D.,魏,J.等人。(2022)。科學轉化醫學。Https://doi.org/10.1126/scitranslmed.abn1082前列腺癌卵巢癌EGFR+實體瘤血液學PSMAxCD28(REGN5678)+Libtayo x共享第一階段初始數據·在2013年第一季度的醫學會議上提交第一階段數據·選擇2023年繼續進行的劑量PSMaxCD28(REGN5678)+PSMAxCD3(REGN4336)·第一階段研究計劃·2024年初始數據+MUC16xCD28(REGN5668)+Ubamatamab(MUC16xCD3)·啟動第一階段(劑量升級)·2024年初始數據MUC16xCD28(REGN5668)+Libtayo·2023年的初始數據EGFRxCD28(REGN7075)+Libtayo x 1期早期劑量遞增數據在SITC 2022上提交·2023年CD22xCD28(REGN5837)+Odronextamab(CD20xCD3)x的更新數據提交給SITC 2022*·DLBCL啟動1H 2023 TAAxCD28+LinvoselTamab(BCMAxCD3)的1/2期研究·將於2023年啟動的3L+多發性骨髓瘤的1期研究將與Libtayo和不斷增加的CD3雙特異性藥物列表相結合本幻燈片包含尚未獲得任何監管機構批准的研究用候選藥物。

與單獨使用抗PD-1藥物相比,雙重阻斷LAG-3和PD-1可以增強免疫活性。這張幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。Fianlimab(抗LAG-3)+Libtayo(抗PD-1)黑色素瘤·兩個轉移性黑色素瘤隊列顯示出一致而強大的療效信號·1L晚期黑色素瘤和輔助黑色素瘤的3期研究正在進行·圍術期黑色素瘤的3期研究於2023年上半年開始·FIH研究的擴展隊列提供了有希望的早期數據·1L晚期NSCLC(2023年1月)和圍術期NSCLC(2023年2月)開始進行2/3期研究,探索其他適應症·新輔助乳腺癌:Fianlimab+Libtayo+紫杉醇的I-標普500ETF研究2022年下半年公佈的數據·科學引導的潛在附加適應症的開發·淋巴細胞激活基因3(LAG-3)是一種免疫檢查點受體,向激活的T細胞傳遞抑制信號·LAG-3在黑色素瘤活檢組織中的表達已被證明與抗PD-1的治療耐藥性有關,這表明在PD-1的基礎上抑制LAG-3可能會增強正在進行的強大的臨牀開發計劃中的抗腫瘤效果

Fianlimab+Libtayo:在1L轉移性黑色素瘤中的競爭性療效來自第二個抗PD-(L)1-樸素轉移性黑色素瘤隊列數據證實了通過研究人員評估(黑色素瘤抗PD-(L)1-樸素患者,6和15)PD SD PR CR 100較基線80 60 40 20-100 0-20-40-60-80 1 2 3 4 5 6 7 8 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 27 28 29 30 31 32 34 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 68 69 70 71 72 73 74 76 75名患者(N=76)*抗PD-1/PD-L1天真隊列,Fianlimab 1600 mg+西普利單抗350 mg靜脈注射,每3週一次,最多51周,之前的系統治療,包括先前的輔助治療,不包括在隊列15。數據截止日期:2022年7月1日†Long,G.(2022年3月)。摘要360385:在未經治療的轉移性或無法切除的黑色素瘤中,Relatlimab和nivolumab與nivolumab的對比:來自Relative-047的總存活率和反應率[介紹]。ASCO全體會議系列2022。本幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。沒有直接的面對面數據可用-在比較不同臨牀研究的結果時建議謹慎。†ORR,%(95%CI)62.5(45.8,77.3)65.0(48.3,79.4)63.8(52.2,74.2)43(38,48)完全緩解15.0(6)2.5(1)8.8(7)16(58)部分緩解47.5(19)62.5(25)55.0(44)27(95)穩定疾病17.5(7)15.0(6)16.3(13)17(61)進展性疾病15.0(6)15.0(6)15.0(12)30(105)東北/未知5.0(2)5.0(2)5.0(4)8(27)DCR 80.0(32)80.0(32)80.0(64)62.8(223)公里-估計PFS,中位數(95%CI),MOS 24(4.2,NE)NR(7.5,NE)24(9.9,NE)10.2(6.5,14.8)DOR,中位數(95%CI),MOS NR(11.9,NE)NR(6.3,NE)NR(22.6,NE)NR(29.6,NR)OS,HR(95%CI)---0.80(0.64,1.01)類似於抗PD-1單一療法的Fianlimab+Libtayo聯合治療的安全性

腫瘤類型初步指徵即將公佈預期數據2023 2024+血液學淋巴瘤多發性骨髓瘤皮膚腫瘤新輔助CSCC佐劑CSCC高級CSCC(2L)圍手術期和佐劑性黑色素瘤一線晚期黑色素瘤其他實體腫瘤符合改變的晚期NSCLC圍術期和晚期NSCLC卵巢癌(2L+)轉移性去勢耐去勢前列腺癌SCCHN EGFR+實體瘤有望在2023年及26年後推進腫瘤學管道Cymplimab PSMAxCD28 Fianlimab Cymplimab Fianlimab Cymplimab

下一代冠狀病毒抗體與可變型RBD外部結合,並對所有已知的變異體和譜系顯示出高中和活性27變異型譜系REGEN-COV*Xevudy†Evushold^BebtelovimabäREGN14287 D614G xxx xxx奧密克戎BA.2 x-xxx xxx BA.4/5 x xxxxxxBA.4.6 xxx BA.2.75 x-xxx BQ.1 x xxx BQ.1.1 xxx XBB x xxx與以前的抗體途徑·免疫顯性、高度可變的RBD和NTD區域外的結合部位降低對未來變種失去活性的風險·靶向表位高度保守,自疫情開始以來保存率超過99.9%·對所有已知的SARS-CoV-2變種和譜系顯示出高中和能力·目前為止的靶向治療和預防設置·僅在美國,數百萬免疫受損的人將無法對疫苗做出充分反應·可以預防性地注射抗體以防止感染和嚴重的新冠肺炎疾病預計將在2023年啟動REGN14287臨牀試驗,尚待監管討論xxx高中和活性(IC5010-8 M)未對中和活性進行評估*REGEN-COV(casirivimab(REGN10933)和Imdemab(REGN10987))由Regeneron製藥公司開發。Regen-COV目前未獲授權使用。†Xevudy(Sotrovimab,又稱VIR-7831和GSK4182136)是由葛蘭素史克和Vir生物技術公司開發的, Tixagevimab(AZD8895)和cilgavimab(AZD1061)的組合是由Vanderbilt大學醫學中心發現的,並授權給阿斯利康。?Bebtelovimab(LY-CoV1404;LY3853113)是由AbCellera和國家過敏和傳染病研究所(NIAID)疫苗研究中心發現的,並被許可給禮來公司。注:中和活性來自已發表的研究或由Regeneron使用公開可用的序列測量。本幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。-

基因藥物:交鑰匙治療平臺基因治療siRNA基因組編輯(插入/敲除)CRISPR/Cas9技術|RNAi|下一代編輯|病毒載體技術|AAV生物製品:交鑰匙治療平臺抗體捕獲CD3雙特異性共刺激雙特異性Regeneron的交鑰匙技術的發展為我們的科學和管道解鎖人類遺傳學的力量Regeneron成立遺傳中心再生基因中心成立超過200萬人測序基因目標和遺傳醫學管道致力於小鼠遺傳學小鼠遺傳學人源化免疫小鼠遺傳學»以基因藥物為靶點的臨牀階段抗體和雙特異性生物製品|||28

用抗體靶向遞送優化遺傳藥物改進遞送技術以創造下一代基因藥物29全身遞送主要針對肝臟局部遞送遺傳學藥物遞送的當前選擇我們的願景是通過全身遞送專門針對任何類型的細胞或利用Regeneron公司在生物學方面的專業知識通過部署抗體技術更有效地遞送有效載荷來潛在地解決具有挑戰性的遺傳病當嘗試靶向其他器官時肝臟“超載”在非人類靈長類動物中獲得概念驗證

Regeneron-發現,多種疾病的批准和研究藥物30 odronextamab(CD20xCD3)linvoselTamab(BCMaxCD3)REGN5459(BCMaxCD3)REGN7257(IL-2Rg)REGN9933(因子XI)REGN7999(TMPRS6)NTLA-2001#(Ttr)REGN5381/REGN9035(NPR1)ALN-APP‡(APP)ALN-PNP‡(PNPLA3)“下一代”冠狀病毒抗體(SARS-CoV-2)REGN43LAG(PSMAxCD3)REGN5093)REGN5093-M114(METxMET ADC)REGN5668(MUC16xCD28)REGN5678(PSMAxCD28)REGN6569(GITR)REGN7075(EGFRxCD28)cymplimab(PD1)vidutolimod(TLR9)ubamatamab(MUC16xCD3)odronextamab(CD20xCD3)pozlimab(C5)linvoselTamab(BCMAxCD3)sarilumab*(IL-6R)dupilumab*(IL-4R)mibpladavemab(LEPR)REGN5381/REGN9035(N1)Free cept(VEGF8)dupilumab*(IL-4R)RE5733-14-15V1)30多個候選產品cymplimab(PD1)fianlimab(LAG-3)與:*賽諾菲;截至2023年1月批准的羅氏;‡Alnylam;#Intellia;?Ultragenyx;Cavity Bayer pozlimab+cemdisiran‡(C5xC5)第一階段第二階段第三階段Regeneron於2022年12月收到了REGEN-COV BLA的CRL。本幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。阿利洛庫單抗(PCSK9)加洛舒單抗(激活素A)實體器官腫瘤學血液學I&I眼科

早產兒的Eylea視網膜病變DUPIXENT*Cindu-冷(2H)LIBTAYO佐劑CSCC Itepekimab*COPD DUPIXENT*嗜酸性食管炎DUPIXENT*兒科EoE(MID)DUPIXENT*2型COPD Fianlimab+LIBTAYO晚期黑色素瘤DUPIXENT*瘙癢結節性結節PRALUENT兒科HeFH(MID)DUPIXENT*CRSNP Pozab±cemdilimsiran+C5-介導性疾病DPIXENT*自發性尿道炎Oronextamb-NHL(2H)DUPXENT*CPO Garetosb EVKZA*PUPIXENT*PUPIXENT*CRSNP Poznp Pozab±cemdisiran+C5-介導性疾病DPIXENT*自發性慢性尿道炎Oronamb-NHL(2H)DUPXENT*CPO Garetosb+與Alnylam合作。2023年1月,FDA從FDA的審查中撤回了糖尿病視網膜病變患者每16周給藥一次的EYLEA方案的sBLA(AfLibercept 2 Mg)。2024+2022年2023年BLA sBLA本幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。提交完成,等待驗收接受提交2022年使用優先審查憑證接受和批准的提交

2023即將到來的關鍵里程碑32眼科·FDA在ROP中對EYLEA的決定(第一季度)·BLA接受DME和WAMD中的8 mg·FDA的決定和可能在美國推出的afLibercept 8 mg(第三季度)·光子(DME)和脈衝星(WAMD)的兩年數據(第三季度)·CSU接受Dupixent·sBLA(第一季度)·EC關於兒科AD(6mo-5年)和EoE(1H)的決定·Cindu-冷和2型COPD第三階段研究的報告數據(1H)·提交兒科EoE(MID)和Cindu-冷(2H)的sBLA·FDA關於CSU(Q4)Pozlimab(抗C5抗體)的決定·BLA接受(1H)和FDA關於Chaple實體器官腫瘤學的決定(2H)·啟動fianlimab+Libtayo用於圍手術期黑色素瘤的3期研究(1H)以及1L晚期NSCLC(1H)和圍手術期NSCLC(2H)的2/3期研究·報告PSMAxCD28+Libtayo的更多數據·報告實體器官腫瘤學的初始數據,包括CD3雙特異性和CD28共刺激雙特異性·1L晚期NSCLC(1H)Odronextamab(CD20xCD3)化療聯合使用Libtayo的EC決定·啟動FL和DLBCL的驗證性研究,包括早期系列(1H)·啟動與REGN5837(CD22xCD28)聯合治療侵襲性B-NHL(1H)的第一階段研究·提交B-NHL(2H)LinvoselTamab(BCMAxCD3)的BLA·啟動MM的驗證性研究,包括在前面的行(1H)·在MM(2H)中結合TAAxCD28啟動第一階段研究·在3L+MM中提交BLA(2H)本幻燈片包含尚未獲得任何監管機構批准的研究候選藥物。

三個責任重點領域都體現了我們“通過做好事做得更好”的精神33我們的使命:利用科學的力量不斷為嚴重疾病患者帶來新藥改善嚴重疾病患者的生活促進誠信和卓越的文化建立可持續的社區1 2 3·產品質量和安全·多樣化、健康和參與的勞動力·道德和誠信·STEM教育-贊助頂級科學比賽:·Regeneron科學人才搜索·Regeneron國際科學與工程博覽會·環境可持續性·管道創新·獲得藥物和公平定價·患者倡導

問與答34喬治·D·揚科普洛斯,醫學博士,博士聯合創始人,總裁&首席科學官馬裏恩·麥考特執行副總裁,商業主管倫納德·S·施萊弗,醫學博士,博士聯合創始人,總裁&首席執行官

在2022年撥出約34億美元*用於業務發展和股票回購35·2021年7月宣佈對Tarrytown研發設施投資18億美元·繼續投資研發和製造產能·部署多餘現金用於機會性回購股票·自2019年11月以來在股票回購中約98億美元*,包括2022年的約21億美元*·收購Libtayo為現有和未來的腫瘤學合作提供了靈活性,涉及Libtayo組合·收購Checkmate製藥公司並與CytomX合作擴大免疫腫瘤學流水線內部投資我們世界級的研發能力和資本支出,以支持可持續增長業務發展,以擴大流水線並最大限度地擴大商業機會*根據初步的未經審計的結果回購股票。

重寫2021年第四季度包括公共研發在內的公認會計準則損益表36 2022年第四季度,Regeneron預計將記錄與公司與CytomX Treateutics,Inc.合作的預付款相關的收購的正在進行的研究和開發費用約3,000萬‡,這預計將對每個公認會計準則和非公認會計準則稀釋後每股收益產生負面影響從2022年第一季度開始,公司在其簡明綜合經營報表中增加了一個新的項目,即收購的正在進行的研究和開發。此項目包括與資產收購相關的正在進行的研發,以及與許可和協作協議相關的預付/選擇加入付款。記錄到收購的正在進行的研究和開發的金額在歷史上本應記錄到研究和開發費用。*知識產權研發費用主要與我們與Nykode治療公司的合作協議有關的3400萬美元的預付款總額有關。^知識產權研發費用主要與根據我們與Adicet Bio,Inc.的合作協議與一種候選產品相關的2000萬美元選擇加入付款有關。†知識產權研發費用主要與與公司收購CheckMate有關的1.95億美元費用有關。‡基於未經審計的初步結果。

縮寫和定義37縮寫定義1L一線2L+二線及以上3L+三線及以上AD特應性皮炎AFRS變應性真菌性鼻-鼻竇炎BCC基底細胞癌BCMA B細胞成熟抗原BLA生物製劑許可證申請B-NHL B細胞非霍奇金淋巴瘤BP大皰性類天皰瘡CD55缺陷性蛋白缺失性腸病CHMP人用產品委員會CI可信區間Cindu慢性誘發性蕁麻疹冷CLL慢性阻塞性肺疾病慢性阻塞性肺疾病慢性CPO慢性皮膚瘙癢CR完全應答信CRSNP慢性鼻竇炎無鼻息肉CRNP慢性鼻竇炎伴鼻息肉CSCC皮膚DCR完全反應持續時間劑量水平DLBCL瀰漫性大B細胞淋巴瘤DME糖尿病黃斑水腫DOR反應持續時間歐盟委員會EGRF表皮生長因子受體EoE嗜酸性食管炎FIH在人類FL濾泡性淋巴瘤FOP纖維增生性骨化症進行性GAAP中首發FIH公認的會計原則GITR糖皮質激素誘導的TNFR相關蛋白HeFH雜合子家族性高膽固醇血癥HNSCC頭頸部鱗狀細胞癌HoFH純合子家族性高膽固醇血癥危險比ICFH 50半數抑制事件免疫不良相關事件滯後3淋巴細胞激活基因3 M MolmPC去勢耐受前列腺癌MCC Merkel細胞癌MM多發性骨髓瘤UC16誘導的TNFR相關蛋白HeFH雜合性家族性高膽固醇血癥HNSCC頭頸部鱗狀細胞癌HoFH純合子家族性高膽固醇血癥危險比50免疫相關事件最大抑制濃度ILAG-3淋巴細胞激活基因3 M MolmPC去勢耐受前列腺癌MCC Merkel細胞癌MM多發性骨髓瘤UC16誘導的TNFR相關蛋白HeFH雜合子家族性高膽固醇血癥HNSCC頭頸部鱗狀細胞癌危險比50免疫相關半數抑制事件IRAG-3淋巴細胞激活基因3 M MolmPC去勢耐受前列腺癌MCC Merkel細胞癌MM多發性骨髓瘤UC16誘導的TNFR相關蛋白HeFH雜合子家族性高膽固醇血癥HNSCC頭頸部鱗癌危險比50免疫相關事件最大抑制濃度IRAIL-3淋巴細胞激活基因3 M MolmPC去勢耐受前列腺癌MCC Merkel細胞癌MM多發性骨髓瘤UC16誘導的TNFR相關蛋白HeFH雜合子家族性高膽固醇血癥粘蛋白16 NASH非酒精性脂肪性肝炎NE不可估量新英格蘭醫學雜誌未達NSCLC非小細胞肺癌NTD N端域, OS總體存活PD-1/PD-(L)1程序性細胞死亡蛋白/(配體)1PET掃描正電子發射斷層掃描PFS無進展存活pMHC肽主要組織相容性複合體I類PMR多發性肌痛風濕性PN結節性癢疹PR部分反應縮寫定義PSA前列腺特異性抗原PSMA前列腺特異性膜抗原PTI個性化治療間隔RBD受體結合域ROP早產兒視網膜病變視網膜病變RVO視網膜靜脈阻塞世界其他地區BLA補充生物製劑許可證申請SCCHN頭頸部鱗狀細胞癌TAA腫瘤相關抗原T細胞受體VEGFTM跨胸腺視黃素血管內皮細胞生長因子AMD WET濕性黃斑變性